БИОФИЗИКА, 2023, том 68, № 3, с. 442-450
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.3
КИНЕТИКА И МЕХАНИЗМ ИНГИБИРОВАНИЯ АКТИВНОСТИ
ПЕРОКСИДАЗЫ ХРЕНА N-ФОСФОНОМЕТИЛ-ГЛИЦИНОМ
© 2023 г. Л.В. Авдеева*, Я.В. Вахтерова**, Е.А. Саратовских*, #
*Федеральный исследовательский центр проблем химической физики и медицинской химии РАН,
просп. Н.Н. Семёнова, 1, Черноголовка Московской области, 142432, Россия
**Московский государственный университет имени М.В. Ломоносова, Ленинские горы, 1/51, Москва, 119912, Россия
#E-mail: easar@icp.ac.ru
Поступила в редакцию 30.12.2022 г.
После доработки 06.03.2023 г.
Принята к публикации 15.03.2023 г.
Исследовано ингибирование активности пероксидазы хрена N-фосфонометил-глицином,
действующим веществом самого распространенного в сельскохозяйственной практике в мире
гербицида раундапа (глифосата). Показано, что N-фосфонометил-глицин ингибирует активность
пероксидазы из корней хрена по конкурентному типу, Ki = 0.1004·мМ. Определена константа
Михаэлиса Km = 1.776 мМ и величина концентрации I50 = 0.302 мM. Полученные данные
показывают, что N-фосфонометил-глицин способен блокировать работу антиоксидантной
системы и в теплокровных организмах может стать причиной накопления свободных радикалов,
что является дополнением к имеющимся литературным данным о биологических мишенях, на
которые направлено действие раундапа.
Ключевые cлова: раундап (глифосат), пероксидаза хрена, ингибирование активности фермента.
DOI: 10.31857/S0006302923030031, EDN: FPODNK
лeнные последствия применения препаратов,
Экологическая опасность химического загряз-
предотвращать возникновение вредных продук-
нения окружающей среды проявляется в прямом
тов трансформации исходных соединений, разра-
и опосредованном токсическом действии на жи-
батывать эффективные и экологически безопас-
вые организмы веществ, не предназначенных
ные способы переработки обходов промышлен-
природой к естественному метаболизму. Техно-
ных и сельскохозяйственных производств, стоков
генные выбросы в окружающей среде приводят к
коммунально-бытового хозяйства.
изменению нормального протекания биохимиче-
ских реакций. В результате этого, экосистемы
До 80% пестицидов адсорбируется почвенным
теряют способность к самоочищению. Накопле-
гумусом, в таком состоянии они практически не
ние токсикантов в природных объектах обуслов-
подвергаются биоразложению, вследствие чего
ливает прогрессирующие темпы сокращения ре-
их время жизни в почвенном покрове значитель-
сурсов - запасов питьевой воды, промысловых
но возрастает [1]. Накапливаясь в почвах, расте-
организмов, плодородия почв.
ниях и животных, они вызывают глубокие и необ-
ратимые нарушения нормальных циклов биоло-
Раскрытие молекулярных механизмов биоло-
гического круговорота веществ [2], отрицательно
гического действия экотоксикантов на структур-
влияют на живые организмы почв [3]. Подавляе-
но-функциональные системы клетки - фермент-
мые виды насекомых вырабатывают резистент-
ные системы, биомембраны, генетический аппа-
ность, заставляя применять более токсичные пре-
рат - необходимы для успешной борьбы за
параты [2, 4]. Появляются в качестве сорных ви-
чистоту окружающей среды и безопасность суще-
ды растений, более устойчивые к действию
ствования человека. Без понимания химической
гербицидов [4, 5], увеличивается эрозия почв. В
причины возникновения токсичности невозмож-
частности, с ростом применения гербицида раун-
но создавать методы контроля состояния окружа-
дапа происходит образование водородных связей
ющей среды, прогнозировать токсичность и отда-
между его фосфорными группами и гуминовыми
полимерами, приводящее к дезагрегации моле-
Сокращения: N-ФМГ - N-фосфонометил-глицин, ВПСП-
синтаза
-
5-энолпирувилшикимат-3-фосфат-синтаза,
кул гуминовых кислот [6, 7]. Уменьшается содер-
ПХ - пероксидаза хрена.
жание микроэлементов и других веществ в расте-
442
КИНЕТИКА И МЕХАНИЗМ ИНГИБИРОВАНИЯ
443
ниях, способность сельскохозяйственной про-
не имеют ферментной системы шикиматного пу-
дукции к хранению, вкусовые качества и
ти, в том числе они не имеют ВПСП-синтазы.
пищевую ценность растений [8].
Однако в литературе имеется очень большое
Вещество с тривиальным названием глифосат
количество работ, доказывающих высокую опас-
используется более чем в 20 коммерческих препа-
ность раундапа для живых организмов. Установ-
ратах, в частности, в раундапе (далее по тексту мы
лено, что раундап оказывает токсическое дей-
приводим те названия, которые использовали ав-
ствие на живые организмы всех трофических
торы в конкретной цитируемой статье). Раундап
уровней, в частности, у людей вызывает множе-
является самым распространенным по объему
ство патологий - нарушения в работе печени, по-
производства и применения в практике сельского
чек, онкологические заболевания. В марте 2015 г.
хозяйства в мире [9]. Это неселективный систем-
Международное агентство по изучению рака ВОЗ
ный гербицид, использующийся для борьбы с
обнародовало заключение, о том, что глифосат
сорняками, особенно многолетними. Действую-
является «возможным канцерогеном для челове-
щее вещество имеет систематическое название
ка» (категория опасности «2А»). В заключении
N-фосфонометил-глицин (N-ФМГ).
приводятся данные о повышенном уровне разви-
Всякое вещество, которое в следовых количе-
тия неходжкинской лимфомы у работающих с
ствах оказывает биологическое действие, влияет на
глифосатом [19]; о развитии рака у лабораторных
какую-то ферментативную реакцию. Считается,
крыс и мышей [20, 21]; о способности глифосата
что действие раундапа, как и других фосфорорга-
повреждать ДНК и вызывать аберрации хромо-
нических пестицидов, на растение обусловлено
сом в клетках человека и животных, культивируе-
тем, что он ингибирует фермент растений 5-энол-
мых in vitro; а также приводить к повышению ча-
пирувилшикимат-3-фосфат-синтазу (ВПСП-син-
стоты хромосомных повреждений (микроядер) в
таза, КФ 2.5.1.19) [10, 11]. ВПСП-синтаза является
клетках крови [21]. Показано [22] образование
компонентом ферментной системы шикиматного
комплексов раундапа с ДНК и РНК, приводящее
пути биосинтеза бензоидных ароматических со-
к потере комплементарности спирали.
единений (содержащих бензольные кольца) и осу-
ществляет одну из стадий превращения шикимата
Ранее было показано, что раундап ингибирует
в хоризмат - предшественник трех ароматических
активность фермента НАДН-оксидоредуктазы,
протеиногенных аминокислот (фенилаланина, ти-
катализирующего многие окислительно-восста-
розина и триптофана), пара-аминобензоата, тер-
новительные реакции в клетках [23]. Естествен-
пеноидных хинонов (убихинона, пластохинона,
но, вставал вопрос о способности окислительно-
филлохинона), ряда других важных метаболитов
восстановительной системы организма растения
(фенолов, ароматических кислот, токоферолов,
или животного окислять и обезвреживать данное
алкалоидов, фитогормонов), лигнинов и др. [12,
химическое токсичное соединение. Способность
13].
объектов окружающей среды к самоочищению,
На ферменте ВПСП-синтазе, выделенном из
т.е. разложению загрязняющих веществ, во мно-
Escherichia coli, определено обратимое ингибиро-
гом определяется протеканием ферментативных
вание его раундапом c псевдопервым порядком,
окислительно-восстановительных процессов в
клетках растений и микроорганизмов. Поэтому
при Ki = 45 мM и Vmax = 1.1 мМ·мин-1 [14]. В пря-
мы исследовали действие раундапа именно на
мой реакции ингибирование конкурентное по
окислительный фермент.
фосфоенолпирувату [15], но неконкурентное по
шикимат-3-фосфату. Продукт реакции конку-
В качестве объекта исследования взята перок-
рентно ингибирует и то, и другое. В обратной ре-
сидаза хрена (ПХ). Выбор фермента обусловлен
акции - неконкурентно ингибируется фермент
тем, что пероксидазы (КФ 1.11.1.Х) относятся к
из Streptococcus pneumoniae, но бесконкурентно -
классу оксидоредуктаз, ферментов основной ан-
неорганический фосфат. Это указывает на обра-
тиоксидантной системы. ПХ окисляет широкий
зование непродуктивного четырехчленного ком-
спектр субстратов, однако функционирует ис-
плекса между ферментом, раундапом и фосфатом
ключительно в присутствии пероксида водорода.
[16]. Октаэдрическая координация осуществля-
Например, при исследовании ингибирования ак-
ется ионом кобальта: ВПСП-синтаза-Co-раун-
тивности пероксидазы хрена хлорсодержащим
дап [17].
гербицидом пиклорамом, было показано, что до
Поэтому при попадании раундапа на растение
концентрации 2·10-4 М он не влиял на окисление
он проникает в клетки, блокирует синтез ряда не-
содержащей протогем ПХ [24].
обходимых соединений, и в результате растение
погибает. Кроме растений, шикиматный путь
Цель настоящего исследования состоит в
имеют микроорганизмы, что подвергает опасно-
определении кинетических параметров ингиби-
сти их жизненный цикл при наличии раундапа в
рования пероксидазы хрена гербицидом раун-
окружающей среде [18]. Считается, что животные
дапом.
БИОФИЗИКА том 68
№ 3
2023
444
АВДЕЕВА и др.
МАТЕPИАЛЫ И МЕТОДЫ
концентрации растворов: гидрохинон - 0.336 мМ,
N-ФМГ - 0.331 мМ и H2O2 - 0.318 мМ. Для каж-
Реактивы. В работе были использованы: вода
дой реакции регистрировали изменение электрон-
дистиллированная; раундап («Август», Россия) в
ных спектров гидрохинона во времени.
форме действующего вещества N-ФМГ
(C3H8NO5P), очищенного двойной перекристал-
Определение активности фермента и величины
лизацией из воды
[25]; тиосульфат натрия
константы ингибирования. Концентрацию перок-
(Na2S2O3, Merck, Германия) в виде 0.1 N водного
сидазы определяли спектрофотометрически по по-
раствора; серная кислота (neoFroxx, Германия), в
глощению при 403 нм (ϵ = 102 мМ-1 · см-1) [29]. За
виде 1 N раствора; йодид натрия (NaI, Biochem,
единицу активности ПХ принимали его количе-
Франция) в виде 1 N раствора; бихромат калия
ство, окисляющее 1 мкМ гидрохинона за 1 мин.
(K2Cr2O7 («ЛенРеактив», Россия) в форме по-
Удельная активность составляла 110 ед/мг (мкМ
рошка; крахмал растворимый
(«ЛенРеактив»,
окисленного субстрата в 1 мин на 1 мг белка). Зна-
Россия) в виде 1%-го раствора; молибдат натрия
чение RZ определяли как отношение поглощения
(Na2MoO4, «ЛенРеактив», Россия) в виде 0.1%-го
при λ = 403 нм к поглощению при λ = 275 нм.
раствора; гидрохинон, (C6H6O2, Sigma-Aldrich,
Спектральный показатель чистоты RZ = 2. Катали-
США), очищенный экстракцией из диэтилового
тическую активность фермента ПХ определяли на
эфира согласно работе [26]; перекись водорода
основании контроля концентрации гидрохинона.
(H2O2, Merck, Германия) в виде 35%-го раствора;
Реакцию окисления гидрохинона на ферменте в
уксусная кислота (CH3COOH,
«ЛенРеактив»,
присутствии H2O2 проводили при 23°С в 0.05 М
Россия) в виде 0.2 М раствора; ацетат натрия
натрий-ацетатном буфере, рН 5.4. Концентрации
(CH3COONa, «ЛенРеактив», Россия) в виде 0.2 М
используемых веществ: гидрохинон - 0.05÷0.4 мМ;
раствора; натрий-ацетатный буфер (рН 5.4) в
H2O2 - 0.64 мМ; ПХ - 15 нМ. Ингибирование пе-
концентрации 0.05 М. Пероксидаза хрена была
роксидазного окисления гидрохинона изучали пу-
выделена из корней хрена экстракцией водой с
тем добавления ингибитора N-ФМГ (в концентра-
последующей фильтрацией с помощью ионооб-
ции 0÷0.5 мМ) в кювету вместе со всеми компо-
менной хроматографии и диализа согласно рабо-
нентами системы.
те [27].
Приборы. Текущую концентрацию водных
В работе использовали методику Михаэлиса-
растворов регистрировали на UV-VIS-спектро-
Ментен. На первом этапе получали зависимость
фотометре BUOLAMBDA-45 (Perkin Elmer,
скорости ферментативной реакции от концен-
США) при температуре 23°C. Использовали квар-
трации гидрохинона и определяли I50 - концен-
цевые кюветы объемом 3.0 мл и длиной оптиче-
трацию ингибитора, при которой скорость фер-
ского пути 1 см.
ментативной реакции составляет 50% от скорости
Определение концентрации перекиси водоро-
в отсутствие ингибитора. На втором этапе прово-
да. Определение концентрации H2O2 в растворе
дили эксперименты при постоянной концентра-
выполняли йодометрическим методом [28].
ции H2O2 и изменяющейся концентрации гидро-
Определение концентрации гидрохинона. Кон-
хинона.
центрацию гидрохинона в растворах определяли
Значения константы ингибирования активно-
спектрофотометрически по калибровочной пря-
сти фермента Ki рассчитывали по формуле [30]:
мой, построенной по поглощению при λ = 289 нм
и определенному в ходе исследования коэффици-
I
50
⋅
K
M
енту экстинкции ϵ = 2691 ± 43 М-1 · см-1.
K
=
,
i
Проведение предварительных реакций между
sV KM
v
компонентами системы. Возможность протекания
реакции между гидрохиноном и N-ФМГ проверя-
где Ki - константа ингибирования, I50 - концен-
ли при молярных соотношениях гидро-
трация пестицида ингибитора, Km - полученные
хинон : N-ФМГ = 1 : 1; 1 : 3 и 3 : 1; исходные кон-
значения константы Михаэлиса для гидрохино-
центрации: гидрохинон - 0.15 мМ и N-ФМГ -
0.167 мМ. Возможность протекания реакции меж-
на, v - скорость в конкретный момент времени,
ду гидрохиноном и H2O2 проверяли при молярных
S - концентрация гидрохинона, V - максималь-
ная скорость, взята из графика Лайнуивера-
соотношениях гидрохинон: H2O2 = 1 : 1; 1 : 2 и 2 : 1;
Бэрка.
исходные концентрации: гидрохинон - 0.336 мМ и
H2O2 - 0.318 мМ. Реакцию в тройной системе
Все эксперименты выполнены в трех повтор-
гидрохинон : N-ФМГ : H2O2 проводили при моль-
ностях. Статистический разброс данных не пре-
ном соотношении реагентов 1 : 1 : 1. Исходные
вышал 3%.
БИОФИЗИКА том 68
№ 3
2023
КИНЕТИКА И МЕХАНИЗМ ИНГИБИРОВАНИЯ
445
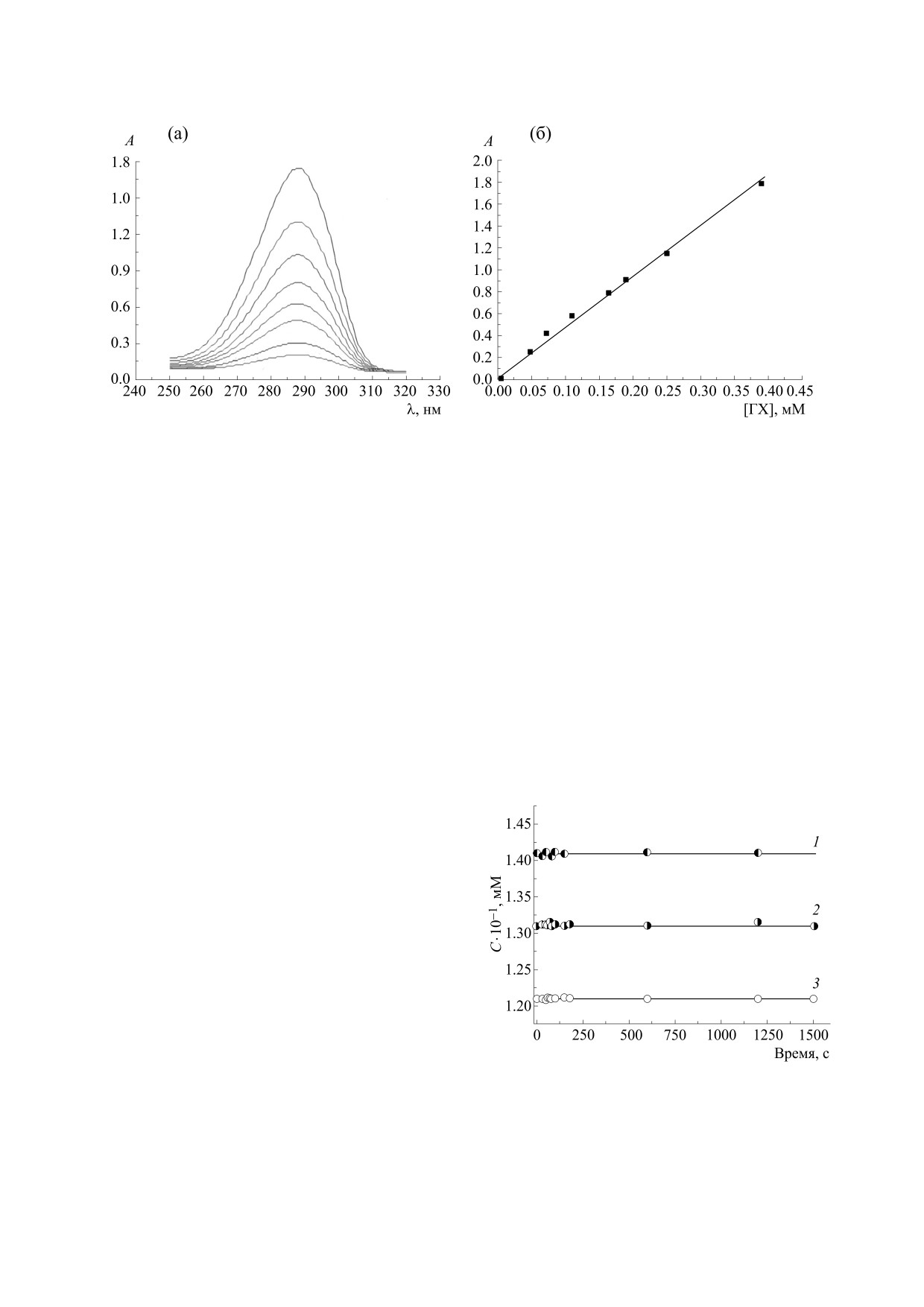
Рис. 1. (а) - Электронные спектры водных растворов гидрохинона в различных концентрациях (0.39 ÷ 0.048 мМ), (б) -
график зависимости оптической плотности растворов гидрохинона от концентрации.
PЕЗУЛЬТАТЫ
N-ФМГ, а также между гидрохиноном и H2O2 в
диапазоне исследованных нами концентраций
Проведено исследование кинетики и механиз-
отсутствуют, т.е. не наблюдается параллельная
ма ингибирования активности ПХ действующим
реакция окисления гидрохинона, обусловленная
веществом раундапа - N-ФМГ. За ходом реакции
наличием в системе H2O2 и/или растворенного
окисления гидрохинона пероксидом водорода
кислорода. Это позволяет не учитывать спонтан-
наблюдали по уменьшению оптической плотно-
сти гидрохинона (рис. 1а).
ное окисление гидрохинона в дальнейших экспе-
риментах.
По линейной зависимости оптической плотно-
сти раствора гидрохинона от концентрации свеже-
В тройной системе гидрохинон : N-ФМГ : H2O2
приготовленного раствора (рис. 1б) определен ко-
концентрация гидрохинона остается неизменной
эффициент экстинкции ε = 2691 ± 43 М-1 · см-1.
в течение 25 мин (рис. 2, кривая 2). Таким обра-
Это значение использовано в дальнейшем для
зом, компоненты исследуемой реакционной си-
расчета кинетических параметров реакции окис-
стемы (гидрохинон, N-ФМГ и H2O2) являются
ления гидрохинона.
инертными по отношению друг к другу.
Изучали кинетику реакций «гидрохинон + ра-
ундап», «гидрохинон + перекись водорода», «гид-
рохинон + раундап + перекись водорода». Иссле-
дуемая система является многокомпонентной,
содержащей ПХ, N-ФМГ, H2O2 и гидрохинон. В
ней гидрохинон - активнейший восстановитель,
а H2O2 - сильнейший окислитель. Поэтому необ-
ходимо установить, являются ли компоненты си-
стемы инертными друг к другу, в частности, не
происходит ли фонового окисления гидрохинона
без участия ПХ. Полученные результаты пред-
ставлены на рис. 2 (кривые 1-3).
Как видно из рис. 2 (кривая 3), концентрация
гидрохинона в смесях остается неизменной от
40 мин до полутора часов для всех проверенных
соотношений гидрохинон : N-ФМГ. Концентра-
ция гидрохинона в смесях гидрохинон : H2O2
Рис. 2. Динамика изменения концентрации гидрохи-
(рис. 2, кривая 1) остается неизменной от 25 мин
нона в присутствии компонентов реакционной си-
наблюдения, также при трех исследованных соот-
стемы: 1 - H2O2 (гидрохинон : H2O2 = 1 : 1); 2 - H2O2
ношении компонентов. Это означает, что реак-
и N-ФМГ (гидрохинон : H2O2 : N-ФМГ = 1 : 1 : 1); 3 -
ционные взаимодействия между гидрохиноном и
N-ФМГ (гидрохинон : N-ФМГ = 1 : 3).
БИОФИЗИКА том 68
№ 3
2023
446
АВДЕЕВА и др.
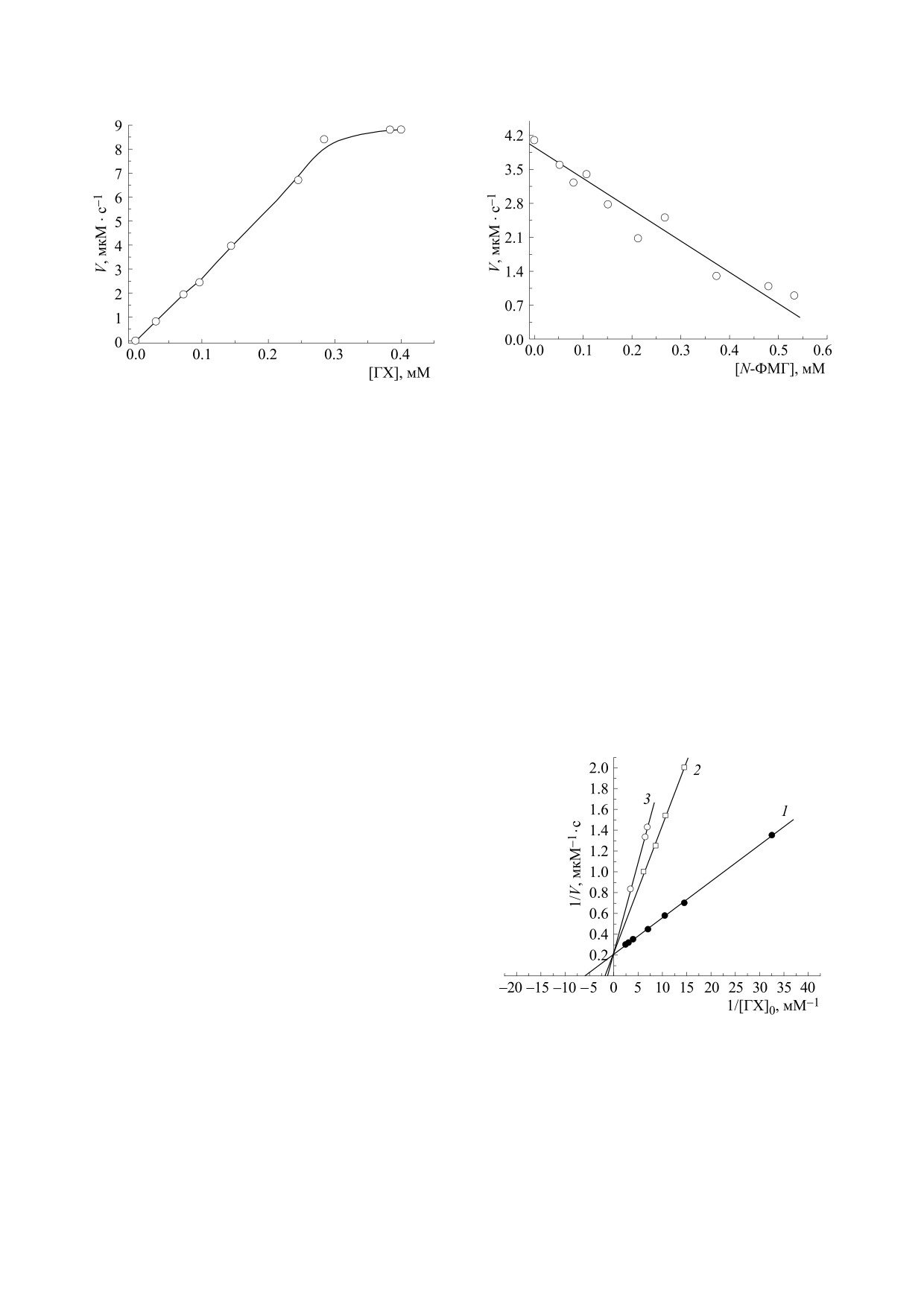
Рис. 3. Скорость окисления гидрохинона (0.05 ÷ 0.4 мМ)
Рис. 4. Зависимость скорости окисления гидрохино-
на ферменте ПХ (15 нМ) в присутствии 0.64 мМ H2O2.
на (0.05÷0.4 мМ) на ферменте ПХ (15 нМ) в присут-
Среда - 0.05 М Na-ацетатный буфер, рН 5.4.
ствии 0.64 мМ H2O2 от концентрации ингибитора
N-ФМГ (0.05 ÷ 0.53 мМ). Среда - 0.05 М Na-ацетат-
ный буфер, рН 5.4.
Кинетика окисления гидрохинона на пероксида-
зе хрена. Известно, что гидрохинон относится к
SH, NO-, COO-, находящимися внутри активно-
группе быстро окисляемых субстратов ПХ [31].
Кинетика пероксидазного окисления гидрохино-
го центра фермента.
на подчиняется уравнению Михаэлиса-Ментен.
Экспериментальные кинетические параметры
На рис. 3 приведена экспериментальная кинети-
ферментативного процесса приведены в табл. 1.
ческая кривая скорости реакции фермента ПХ от
Из табл. 1 видно, что с увеличением концен-
концентрации субстрата - гидрохинона - при
трации гидрохинона происходит возрастание ве-
постоянной концентрации H2O2. Из нее следует,
личины K'm. Значения Ki рассчитывали по урав-
что константа Михаэлиса Km = 0.1776 мМ.
нению [30]. Полученное значение константы ин-
гибирования Ki = 0.1004 мМ.
Влияние N-ФМГ на активность ПХ иллюстри-
Механизм ингибирования активности перокси-
рует рис. 4. Зависимости начальной скорости пе-
дазы хрена N-фосфонометил-глицином. Известно,
роксидазного окисления гидрохинона в присут-
ствии различных концентраций N-ФМГ спрям-
ляются в координатах Лайнуивера-Берка.
Полученные результаты показывают прямую за-
висимость снижения скорости ферментативной
реакции от концентрации N-ФМГ. Величина
концентрации N-ФМГ, приводящая к падению
скорости ферментативной реакции в два раза
(I50), составляет 0.302 мM.
Как видно из рис. 5, зависимость изменения
скорости реакции от концентрации гидрохинона
в двойных обратных координатах (координаты
Лайнуивера-Берка) носит линейный характер и
демонстрирует конкурентный тип ингибирова-
ния по донору электронов - гидрохинону. Значе-
ния кажущихся констант Михаэлиса составляют
K'm = 0.883 мМ и K'm = 0.552 мМ при концентра-
циях субстрата 0.398 мМ и 0.31 мМ соответствен-
Рис. 5. Зависимость обратной скорости фермен-
но. Максимальная скорость ферментативной ре-
тативной реакции от обратной концентрации
ингибитора N-ФМГ (координаты Лайнуивера-
акции составила V = 0.5 мкМ·с-1.
Берка): 1 - без ингибитора, 2 - в присутствии 0.31
мМ N-ФМГ, 3 - в присутствии 0.398 мМ N-ФМГ.
Следовательно, N-ФМГ блокирует фермент,
Концентрации реагентов: ПХ - 20 нМ, H2O2 -
связываясь с некими активными группами моле-
0.62 мМ, гидрохинон - 0.07 ÷ 0.285 мМ, среда -
кул или аминокислотными остатками, вероятно:
0.05 М Na-ацетатный буфер, рН 5.4.
БИОФИЗИКА том 68
№ 3
2023
КИНЕТИКА И МЕХАНИЗМ ИНГИБИРОВАНИЯ
447
Таблица 1. Кинетические параметры пероксидазной реакции
Кинетический параметр
Система
I50, мМ
Km, мМ
K'm, мМ
V, мкМ · с-1
Гидрохинон + H2O2 + ПХ
-
0.1776
5.00
Гидрохинон + H2O2 + ПХ +
0.302
0.883
5.00
+ N-ФМГ (S = 0.398 мМ)
Гидрохинон + H2O2 + ПХ +
0.302
0.552
5.00
+ N-ФМГ (S = 0.31 мМ)
что N-ФМГ представляет собой аналог амино-
радикально-цепному механизму, при этом роль
кислоты глицина. В растениях N-ФМГ блокирует
катализатора заключается в инициировании сво-
работу ВПСП-синтазы, тем самым угнетается
бодных радикалов [34, 35]. Если кроме водного
синтез ароматических аминокислот, белка, хло-
раствора Н2О2 присутствует Fe2+, тогда в системе
рофилла, в результате чего растения погибают
идет реакция переноса электрона с иона Fe2+ на
[32].
молекулу H2O2 с образованием иона Fe3+ и очень
Кроме того, было показано [23], что N-ФМГ
ингибирует активность НАДН-оксидоредуктазы.
неустойчивого анион-радикала [H2O2]•, кото-
Это приводит к угнетению окислительно-восста-
рый сразу же распадается на анион HО- и свобод-
новительных процессов как в растениях, так и в
живых организмах. При этом N-ФМГ достаточно
ный гидроксильный радикал HО•. Радикал НО•
легко образует комплексы с металлами вида
очень активен, реализуя разнообразные реакции
М(N-ФМГ)2 [33]. В результате повышается ток-
с органическими соединениями, в том числе
окисления ароматических соединений. В отсут-
сичность гербицида и меняется место связывания
в активном центре. Ингибитор связывается в не-
ствие же подходящих реагентов НО• реагирует с
посредственной близости к [2Fe-2S]-кластеру
Н2О2 с образованием менее активного радикала
активного центра НАДН-оксидоредуктазы [23].
НО2•, который способен восстанавливать ионы
Можно предположить, что и в ПХ ингибитор
ориентируется на ион железа в составе гема ак-
Fe3+, что замыкает каталитический цикл:
тивного центра.
H2O2+ Fe2+→Fe3+ + НО• + HO-;
Полученные результаты показали, что N-ФМГ
инактивирует ПХ. Механизм ингибирования ПХ
НО• + Н2О2→H2O + НО2•;
является весьма сложным и может включать не-
сколько стадий. Конкурентное ингибирование
НО2•+ Fe3+→Fe2+ + O2 + H+;
N-ФМГ пероксидазного окисления гидрохинона,
H+ + HO-→H2O.
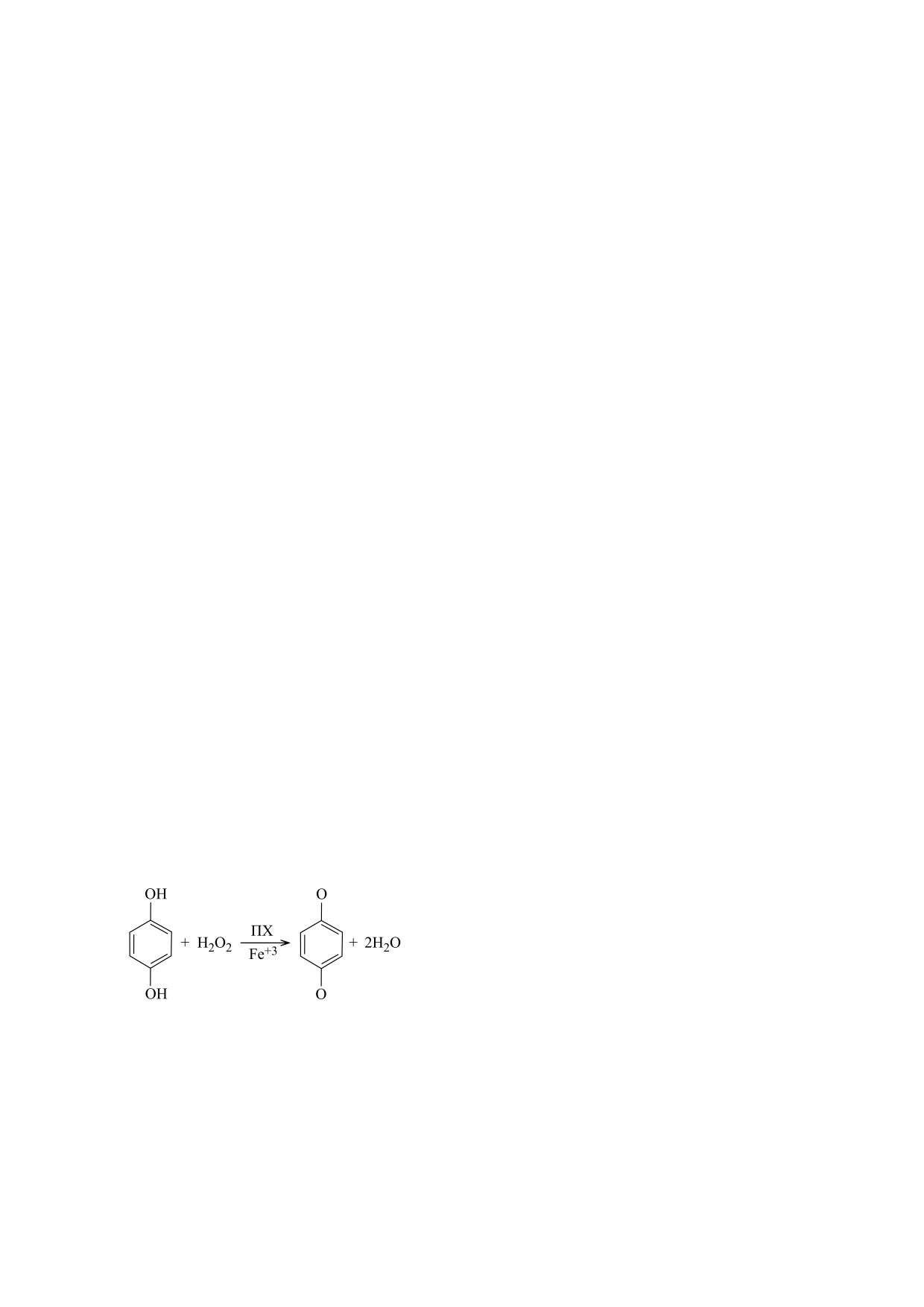
по-видимому, протекает по классической схеме 1.
ПХ относится к двухкомпонентным фермен-
там, в ее состав входят гемин, представленный
протопорфирином IX в комплексе с Fe3+, и поли-
пептидая цепь [35, 36]. Пропионовокислые остат-
ки протопорфирина направлены к поверхности, а
винильные группы - во внутреннюю часть белка
[37, 38]. Планарная структура гемина фиксирует-
ся внутри белка за счет π-электронных взаимо-
действий пропионовокислых остатков пирроль-
ных колец протопорфирина с аминокислотными
Работа ПХ происходит исключительно в при-
остатками: тирозина (Tyr,), фенилаланина (Phe),
сутствии Н2О2, приводящей фермент в активиро-
триптофана (Trp), гистидина (His) и метионина
ванное состояние (Е1). В молекуле пероксида во-
(Met) [39]. Известно, что Phe-41 локализован
дорода электронная плотность смещена в сторо-
между остатками дистальных His-40 и His-42. По-
ну атомов кислорода [34]:
следний координирует атом железа гемина в ак-
тивном центре ПХ. При этом остаток Phe-143
Н2О2 = Нδ+ → Оδ- ― Оδ- ← Нδ+.
расположен в проксимальной области гемина
Реакция разложения пероксида водорода в
вблизи входа в полость, связывающую гем и сов-
присутствии катализаторов часто протекает по
местно с Phe-142, формирует протяженный гид-
БИОФИЗИКА том 68
№ 3
2023
448
АВДЕЕВА и др.
рофобный участок активного центра ПХ, связы-
зи -Р=О и смещенной в сторону кислорода элек-
вающий субстрат [40].
тронной плотности двух гидроксильных групп.
Он атакует железо гема. Это кажется весьма веро-
Активный центр ПХ представлен Arg-38, Phe-
41 и His-42; а Phe-142 и Phe-143 формируют канал
ятным, так как высокая комплексообразующая
способность пестицидов с металлами, в частно-
доступа ароматических субстратов к активному
сти с железом, была показана ранее [33]. В этом
центру [41,42]. Активную роль в каталитическом
процессе пероксидазного окисления субстратов
случае две группы НО- в сочетании с двойной
связью на кислороде при фосфорном конце мо-
принимает участие ион Fe3+, находящийся в ко-
ординации с четырьмя атомами азотов пирролов
лекулы N-ФМГ, имеют столь же значительную
избыточную электронную плотность, что и Н2О2.
протопорфирина, проксимальным лигандом ко-
торого является остаток имидазола гистидина
Фосфорный остаток N-ФМГ способен к дониро-
белка His-170. В процессе восстановления пере-
ванию двух Н+. Аминокислотные группы, кото-
киси водорода участвуют His-42 и Arg-38, распо-
рые входят в активный центр ПХ (His-42, Phe-41,
ложенные в спирали В [41, 43, 44].
Arg-38), своими карбоксильными остатками мо-
Причины широкой субстратной специфично-
гут достаточно легко вступить в реакцию с
сти пероксидазы объясняются тем, что на поверх-
карбоксильным остатком N-ФМГ. Такое взаимо-
ности белка реализуются несколько различных
действие приведет к образованию прочной кова-
каналов электронного транспорта с субстратов,
лентной связи между ферментом и ингибитором.
контактирующих с поверхностью белковой гло-
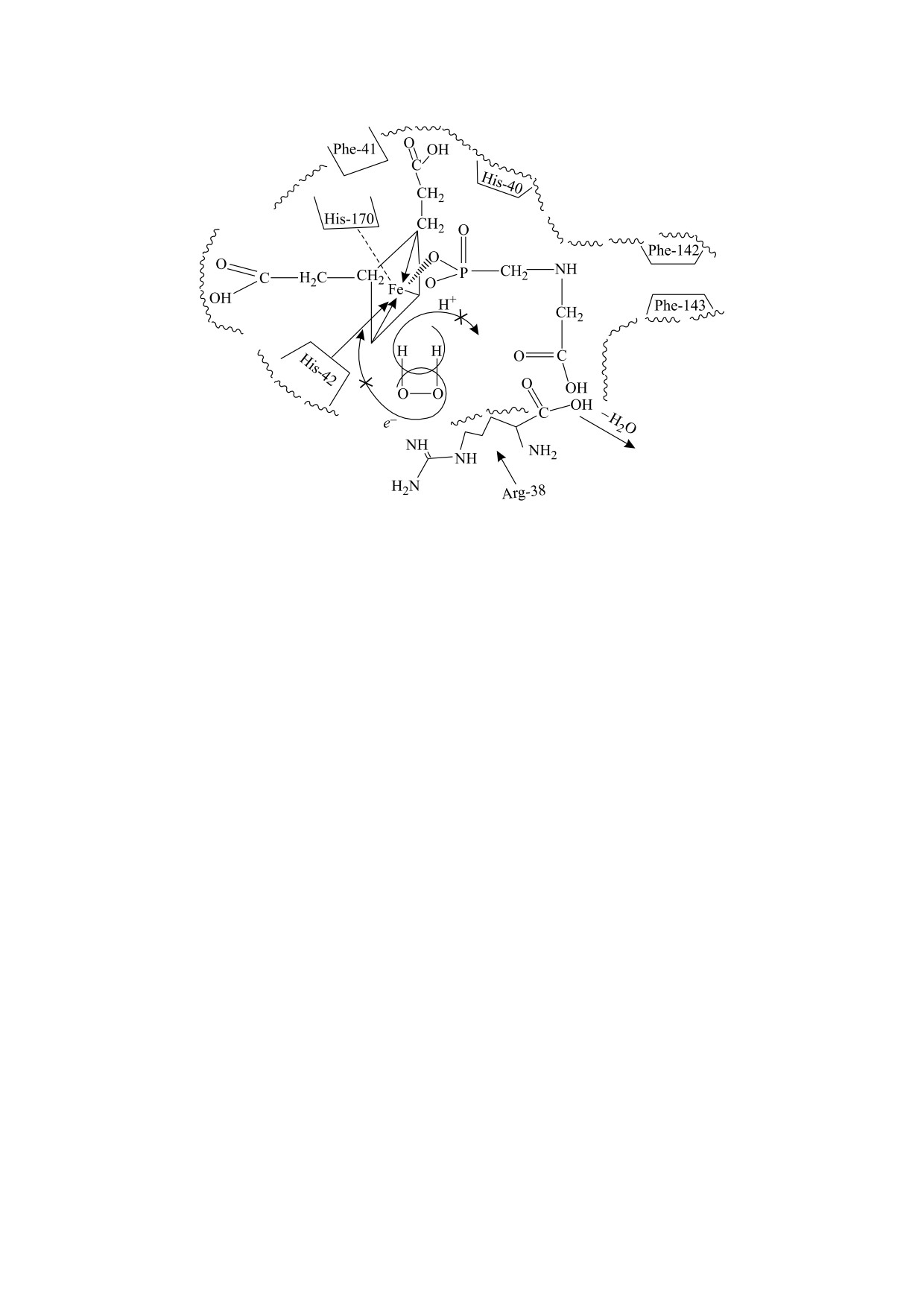
Гипотетическая схема такого варианта ингибиро-
булы, на железо гема [45]. Ингибиторы перокси-
вания активности фермента представлена на
даз - ионы, образующие прочные комплексы с
рис. 6.
катионом железа [35]. В восстановлении фермен-
Прерываются цепь переноса электронов и
та участвуют соединения, являющиеся донорами
цепь переноса протона. Фермент полностью дез-
водорода и донорами электронов.
активирован: N-ФМГ препятствует вхождению
В исследуемой реакции в активном центре в
гидрохинона в активном центре, связыванию,
превращению и образованию продуктов реакции.
отсутствие ингибитора Fe3+ гем смещает в свою
сторону электронную плотность донора
Снижение активности ПХ под действием
электронов - перекиси водорода, возможно, че-
N-ФМГ свидетельствует о снижении регулирова-
рез посредство аминокислотных остатков His-42
ния окислительно-восстановительных процессов
и(или) Arg-38. Н2О2 претерпевает ряд превраще-
и может приводить к накоплению перекиси водо-
рода и усилению свободнорадикальных процес-
ний с образованием ионов и радикалов. Фермент
сов в клетках. Полученные нами в настоящей ра-
переходит в окисленную форму (Е1). Гидрохи-
боте данные расширяют круг знаний о тех фер-
нон, как сильнейший восстановитель, также вхо-
ментах, деятельность которых в растении или
дит в координацию с Fe+3, который оттягивает на
живом организме ингибирует гербицид раундап.
себя электронную плотность кислорода, что при-
водит к дегидрированию гидрохинона. При этом
ВЫВОДЫ
гидрохинон отдает два Н+, а Н2О2 принимает их
на себя. Возникают две параллельные цепи: пере-
1. Показано, что гидрохинон в условиях прове-
дения исследования (23°C; 1.5 ч наблюдения; при
носа е- и переноса Н+. Отдав е- и Н+ реагенты,
соотношениях реагентов гидрохинон : N-ФМГ =
системы «расходятся» с образованием продуктов
= 1 : 1; 1 : 3; 3 : 1; гидрохинон : H2O2 = 1 : 1; 1 : 2;
реакции: 1,4-бензохинона и воды:
2 : 1; гидрохинон : N-ФМГ : H2O2 = 1 : 1 : 1) не
вступает во взаимодействие ни с H2O2, ни с N-
фосфонометил-глицином (глифосатом) - дей-
ствующим веществом гербицида раундапа.
2. Впервые показано, что N-фосфонометил-
глицин ингибирует пероксидазу из корней хрена.
Данный результат является серьезным дополне-
нием к имеющимся литературным данным о ми-
Однако этого не происходит в присутствии ин-
шенях, на которые направлено действие гербици-
гибитора. В данном исследовании показано, что
да раундапа.
ингибитор N-ФМГ не взаимодействует ни с гид-
рохиноном, ни с Н2О2. Кроме того, он конкури-
3. Определена константа Михаэлиса (Km =
рует с гидрохиноном за место связывания в ак-
= 0.1776 мМ) и величина концентрации N-ФМГ,
тивном центре. Очевидно, что N-ФМГ обладает
приводящая к падению скорости ферментатив-
значительной электронной плотностью за счет
ной реакции в два раза (I50 = 0.302 мM). Установ-
неподеленной электронной пары на двойной свя-
лено, что N-ФМГ ингибирует пероксидазу по
БИОФИЗИКА том 68
№ 3
2023
КИНЕТИКА И МЕХАНИЗМ ИНГИБИРОВАНИЯ
449
Рис. 6. Гипотетическая схема ингибирования активности ПХ N-ФМГ.
конкурентному типу. Значение Ki составляет
2. С. А. Остроумов, Введение в биохимическую эколо-
гию (Изд-во МГУ, М., 1986).
0.1004·мМ.
3. Г. В. Меренюк, А. С. Усатая, Е. Е. Емнова и др.,
4. Полученные результаты доказывают, что
Гигиена и санитария, № 5, 20 (1987).
гербицид раундап блокирует работу антиокси-
4. В. В. Курдюков, Последействие пестицидов на рас-
дантной системы, что в теплокровных организ-
тительные и животные организмы (Колос, М.,
мах может стать причиной накопления свобод-
1982).
ных радикалов и онкологических перерождений
5. А. В. Яблоков, Ядовитая приправа. Проблемы при-
тканей и органов.
менения ядохимикатов и пути экологизации сельско-
го хозяйства (Мысль, М., 1990).
ФИНАНCИPОВАНИЕ РАБОТЫ
6. И. В. Перминова, в сб. Биотехнология: состояние и
перспективы развития, под ред. П. Д. Саркисова и
Работа выполнена в соответствии с темами Госу-
М. П. Кирпичникова (ПИК Максима, М., 2003),
дарственного задания № 0089-2019-0014 (№ го-
с. 11.
сударственной
регистрации
АААА-А19-
7. В. Н. Давидчик, О. В. Королёва, Е. В. Степанова и
119071890015-6) и № 0089-2019-0004 (№ государ-
др., в сб. Биотехнология: состояние и перспективы
ственной регистрации АААА-А19-119071190045-0).
развития, под ред. П. Д. Саркисова и М. П. Кир-
пичникова (Максима, М., 2003), с. 59.
8. Л. А. Юданова, Пестициды в окружающей среде
КОНФЛИКТ ИНТЕРЕСОВ
(ГПНТБ СО АН СССР, Новосибирск, 1989).
Авторы заявляют об отсутствии конфликта
9. Ch. M. Benbrook, Environ. Sci. Eur., 28 (1), 3 (2016).
интересов.
10. Е. М. Кузнецова и В. Д. Чмиль, Современные про-
блемы токсикологии, № 1, 87 (2010).
11. Д. Грин и Р. Гольдбергер, Молекулярные аспекты
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
жизни (Мир, М., 1968).
Настоящая работа не содержит описания ка-
12. V. Tzin, G. Galili, and A. Aharoni, In eLS (John Wiley
ких-либо исследований с использованием людей
& Sons Ltd, Chichester,
2012).
DOI:
и животных в качестве объектов.
10.1002/9780470015902.a0001315.pub2
13. Saccharomyces Genome Database - S. cerevisiae Path-
СПИСОК ЛИТЕРАТУРЫ
nome.org/YEAST/NEW-IMAGE?type=PATH-
1. Л. А. Головлёва и З. И. Филькенштейн, Агрохи-
WAY&object=ALL-CHORISMATE-PWY-1. Дата
мия, № 3, 105 (1984).
обращения: 30.12.2022.
БИОФИЗИКА том 68
№ 3
2023
450
АВДЕЕВА и др.
14. Q. K. Huynh, G. M. Kishore, and G. S. Bild, J. Biol.
29. S. Ogawa, Y. Shira, and I. Morishima, Biochem. Bio-
Chem., 263 (2), 735 (1988).
phys. Res. Commun., 90 (2), 674 (1979).
15. E. Schönbrunn, S. Eschenburg, W. A. Shuttleworth,
30. М. Диксон и Э. Уэбб, Ферменты (Мир, М., 1982).
et al., Proc. Natl. Acad. Sci. USA, 98, 1376 (2001).
31. Г. С. Захарова, И. В. Упоров и В. И. Тишков, Усп.
16. W. Du, N. G. Wallis, and D. J. Payne, J. Enzyme
биол. химии, 51, 37 (2011)
Inhib., 15 (6), 571 (2000).
32. О. С. Медведев, Комбикорма, 4, 61 (2017).
17. R. J. Ganson, R. A. Jensen., Arch. Biochem. Biophys.,
33. Е. А. Саратовских, Изв. АН СССР. Сер. хим.,
260 (1), 85 (1988).
№ 10, 2327 (1989).
18. N. E. De Long and A. C. Holloway, Diabetes Metab.
34. Л. И. Мухортова, Ю. Т. Ефимов, И. В. Глушков
Syndr. Obes., 10, 101 (2017).
и др., Химия и технология пероксида водорода (Чу-
ваш. ун-т, Чебоксары, 2020).
19. K. Z. Guyton, D. Loomis, Ya. Grosse, et al., Lancet,
35. Г. Эйхгорн, Неорганическая биохимия (Мир, М.,
16
(5),
490
(2015).
DOI:
10.1016/S1470-
1978).
2045(15)70134-8
36. K. G. Welinder, L. B. Smillie, and G. R. Schonhaum,
20. D. Cressey, Nature
(2015). DOI:
10.1038/na-
Canad. J. Biochem., 50 (1), 44 (1972).
ture.2015.17181
37. H. H. Угарова, О. В. Лебедева и А. П. Савицкий,
21. IARC Monographs, V. 112: Evaluation of Five Organo-
Пероксидазный катализ и его применение (МГУ, М.,
phosphate Insecticides and Herbicides (International
1981).
Agency for Research on Cancer, World Health Organi-
38. А. П. Савицкий, H. H. Угарова и И. В. Березин,
zation, 20 March 2015).
Биоорган. химия, 3 (9), 1242 (1977).
22. Е. А. Саратовских, М. В. Личина, Б. Л. Психа и др.,
39. R. K. DiNello and D. H. Dolphin, J. Biol. Chem., 56
Изв. АН СССР. Сер. хим., № 9, 1984 (1989).
(13), 6903 (1981).
23. Е. А. Саратовских, Л. А. Коршунова, Р. И. Гвоздев
40. K. G. Welinder, Eur. J. Biochem., 151, 497 (1985).
и др., Изв. АН. Сер. хим., № 5, 1284 (2005).
41. Т. Н. Аммосова, И. В. Упоров, М. Ю. Рубцова и
24. J. K. Chang and C. L. Fоу, Biосhеm. Physiol., 18 (2),
др., Биохимия, 62 (4), 516 (1997).
141 (1982).
42. M. Gajhede, P. Osmark, F. M. Poulsen, et al., Nature
25. Н. Н. Мельников, Пестициды. Химия, технология и
Struct. Biol., 3, 1040 (1996).
применение (Химия, М., 1987).
43. D. J. Schuller, N. Ban, R. B. van Huystee, et al., Struc-
26. Т. П. Позднякова, Методы выделения и очистки ор-
ture, 4, 311 (1996).
ганических соединений (НТИ МГУДТ, Новоси-
44. И. Г. Газарян, И. В. Упоров, Т. А. Чубарь и др.,
бирск, 2008).
Биохимия, 63 (5), 708 (1998).
27. К. G. Paul, The Enzymes (Acad. Press, N-Y., 1963).
45. N. N. Ugarova, G. D. Kutuzova, V. V. Rogozhin, et al.,
28. Т. А. Большова, Г. Д. Брыкина, А. В. Гармаш и др.,
Bioch. Biophys. Acta,
790
(1),
22
(1984). DOI:
Основы аналитической химии (Акад., М., 2012).
10.1016/0167-4838(84)90327-3
Kinetics and Mechanism of Inhibition of Horseradish Peroxidase Activity
by N-Phosphonomethyl-Glycine
L.V. Avdeeva*, Ya.V. Vakhterova**, and E.A. Saratovskikh*
*Federal Research Center for Problems of Chemical Physics and Medical Chemistry, Russian Academy of Sciences,
prosp. N.N. Semenova 5, Chernogolovka, Moscow Region, 142432 Russia
**Lomonosov Moscow State University, Leninskie Gory 1/51, Moscow, 119912 Russia
The inhibition of horseradish peroxidase activity by N-phosphonomethyl-glycine, an active ingredient in the
most extensively used glyphosate-based herbicide (Roundup) in agricultural applications worldwide, was in-
vestigated. It has been shown that N-phosphonomethyl-glycine inhibits the activity of peroxidase from horse-
radish roots. This inhibition is of a competitive nature, the value of Ki = 0.1004 mM. The Michaelis constant
(Km = 0.1776 mM) and herbicide concentration (I50 of Roundup = 0.302 mM) were determined. The results
demonstrate that N-phosphonomethyl-glycine can suppress the activity of the antioxidant system, and in
warm-blooded organisms it may cause the accumulation of free radicals, thereby contributing to expanding
knowledge of biological targets Roundup is applied to.
Keywords: Roundup (glyphosate), horseradish peroxidase, enzyme inhibition
БИОФИЗИКА том 68
№ 3
2023