БИОФИЗИКА, 2023, том 68, № 3, с. 461-465
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.353
ОСОБЕННОСТИ ОЛИГОМЕРИЗАЦИИ ГЛАДКОМЫШЕЧНОГО ТИТИНА
И СКЕЛЕТНОГО МИОЗИН-СВЯЗЫВАЮЩЕГО БЕЛКА С
© 2023 г. Л.Г. Бобылёва*, М.А. Тимченко*, Э.И. Якупова**,
И.М. Вихлянцев*, ***, А.Г. Бобылёв*
*Институт теоретической и экспериментальной биофизики РАН,
ул. Институтская, 3, Пущино Московской области, 142290, Россия
**Научно-исследовательский институт физико-химической биологии имени А.Н. Белозерского Московского
государственного университета имени М.В. Ломоносова, Ленинские горы, 1, Москва, 119234, Россия
***Институт фундаментальной медицины и биологии Казанского федерального университета,
ул. Карла Маркса, 76, Казань, 420015, Россия
E-mail: bobylev1982@gmail.com
Поступила в редакцию 07.04.2023 г.
После доработки 07.04.2023 г.
Принята к публикации 19.04.2023 г.
Белковые олигомеры являются важными промежуточными звеньями на пути образования
амилоидных фибрилл. При амилоидозах, например, болезни Альцгеймера, олигомеры способны
оказывать токсическое действие на клетки. В данной работе описаны отличительные особенности
олигомеризации мультидоменных мышечных белков - гладкомышечного титина и миозин-
связывающего белка С (С-белка) скелетных мышц, состоящих из FnIII-подобных и IgC2-подобных
доменов и способных формировать амилоидные аморфные агрегаты in vitro. С-белок в условиях
низкой ионной силы (ниже физиологических значений) формировал стабильные олигомеры, не
участвующие в дальнейшей агрегации. Титин гладких мышц формировал олигомеры в условиях
высокой ионной силы (μ ~ 0.6), которые являлись предшественниками амилоидных аморфных
агрегатов этого белка. Полученные результаты расширяют представления о процессе белковой
агрегации.
Ключевые слова: мультидоменные мышечные белки, миозин-связывающий белок С, титин, агрегация,
амилоиды, олигомеризация, олигомеры.
DOI: 10.31857/S0006302923030055, EDN: FQJHUE
Процесс агрегации белка - это сложный и ма-
[9-14]. Вследствие этого олигомеры являются
лоизученный процесс, который происходит в
перспективным объектом исследования с целью
клетках живых организмов вследствие множества
разработки лекарственных препаратов для лече-
причин и связан либо с развитием патологиче-
ния амилоидозов.
ских изменений, либо с выполнением определен-
Известно, что помимо амилоидных фибрилл
ных функций [1]. На одной из стадий амилоид-
белки могут образовывать другие типы агрегатов,
ной агрегации происходит образование олигоме-
например, растворимые олигомеры и аморфные
ров - надмолекулярных структур, состоящих из
агрегаты. Имеется мнение, что амилоидными мо-
нескольких нековалентно-связанных молекул
гут быть только фибриллы, в то время как аморф-
белка. Олигомеры представлены широким спек-
ные агрегаты имеют неамилоидную природу, од-
тром морфологического разнообразия [2-4] и яв-
нако это спорная точка зрения. Аморфные агре-
ляются важными промежуточными продуктами
гаты обычно образуются за более короткие
процесса формирования фибриллярных агрега-
промежутки времени, чем фибриллы. Для их об-
тов, как показано для различных амилоидоген-
разования не требуется какой-то особой укладки
ных белков [5-8]. Известно, что олигомеры ами-
(конформации) белковой молекулы. Многие бел-
лоидных белков обладают более выраженными
ки с неупорядоченной структурой, а также ча-
цитотоксическими свойствами, чем их фибрил-
стично развернутые белки формируют аморфные
лы, образующиеся, в частности, при таких забо-
агрегаты. Для образования упорядоченных фиб-
леваниях как болезнь Альцгеймера и Паркинсона
рилл, как известно, необходимы особые условия,
461
462
БОБЫЛЁВА и др.
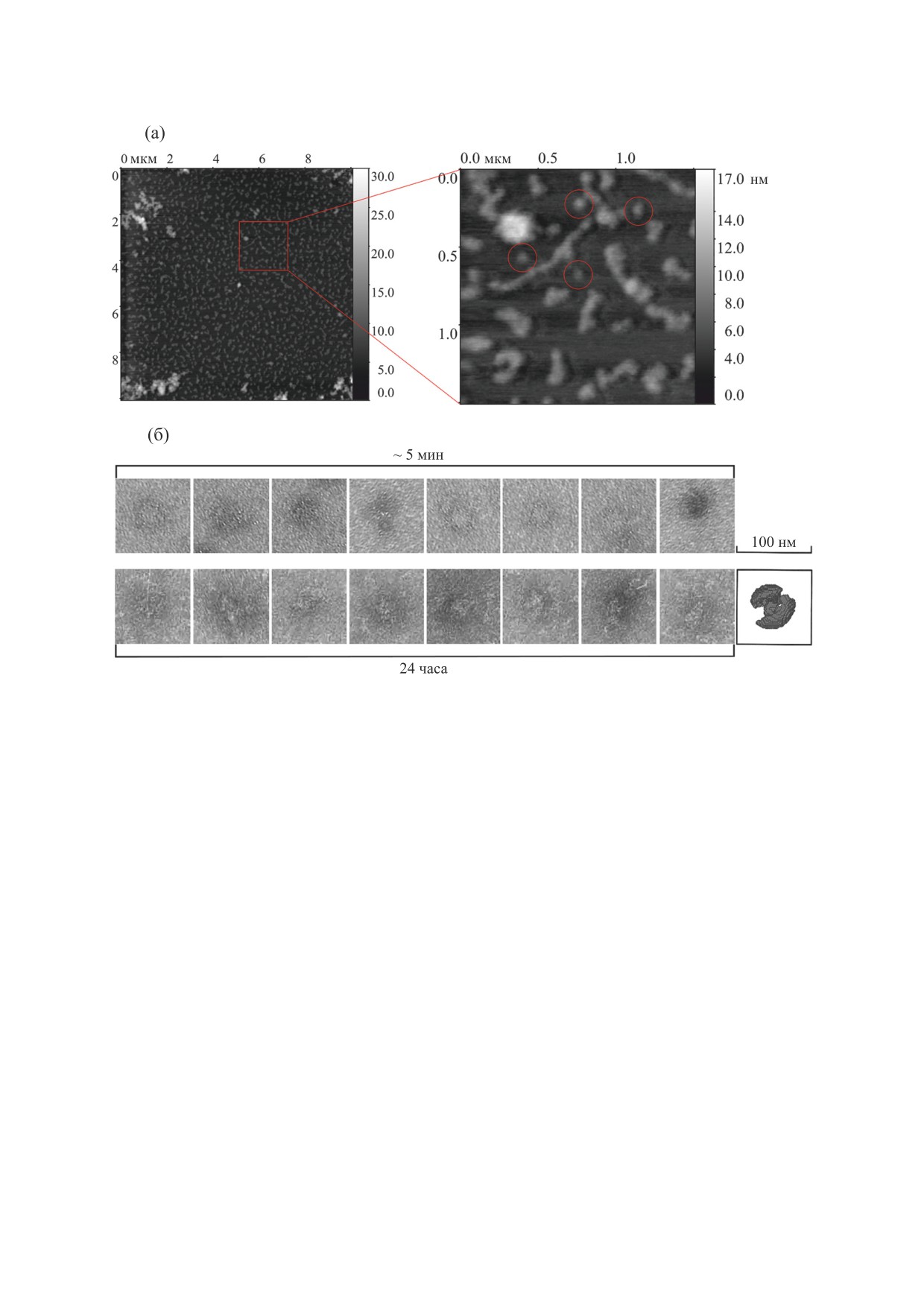
Рис. 1. Атомно-силовая микроскопия и электронная микроскопия олигомеров С-белка. (а) - Атомно-силовая
микроскопия аморфных агрегатов и олигомеров С-белка, сформированных в течение 24 ч. Отдельно лежащие
олигомеры показаны в светлых кругах. (б) - Электронная микроскопия олигомеров С-белка, сформированных в
течение ~5 мин и 24 ч. Справа внизу приведена для сравнения смоделированная структура олигомера С-белка,
полученная с помощью программы DAMMIF на основе данных малоуглового рентгеновского рассеяния [19]. Размер
одного квадрата 100×100 нм. Условия формирования агрегатов: 0.15 М глицин-КОН, рН 7.0, 4°С.
способствующие формированию специфической
аморфных агрегатов в течение первых пяти минут
укладки в амилоидную структуру. Данная специ-
агрегации формирует ряд стабильных олигоме-
фическая укладка может появляться уже на ста-
ров, претерпевающих незначительный рост в те-
дии формирования растворимых олигомеров [15].
чение последующих 16-24 часов агрегации [19].
Исследуемые нами титин и С-белок формиру-
На рис. 1 представлены данные атомно-силовой
ют амилоидные аморфные агрегаты [16-20]. Этот
и электронной микроскопии, на которых показа-
результат расходится с общепринятой научной
ны преимущественно олигомеры С-белка, имею-
точкой зрения, заключающейся в том, что амило-
щие сферическую форму с диаметром 30-50 нм и
идными могут быть только высокоупорядочен-
высотой 10 нм, сформированные в течение 5 мин
ные фибриллы. Таким образом, амилоидные
и 24 ч агрегации. Примечательно, что смоделиро-
свойства аморфных агрегатов титина и С-белка
ванная трехмерная структура олигомеров С-бел-
являются особенностью этих мышечных белков.
ка, полученная на основе данных малоуглового
Поэтому процесс олигомеризации у исследуемых
рентгеновского рассеяния, также близка к сфери-
белков представляет фундаментальный интерес.
ческой (рис. 1б) [19]. Таким образом, данные ви-
Анализ проведенных нами исследований по-
зуальных методов анализа, а также данные, полу-
казал, что С-белок после образования крупных ченные с помощью динамического светорассея-
БИОФИЗИКА том 68
№ 3
2023
ОСОБЕННОСТИ ОЛИГОМЕРИЗАЦИИ ГЛАДКОМЫШЕЧНОГО ТИТИНА
463
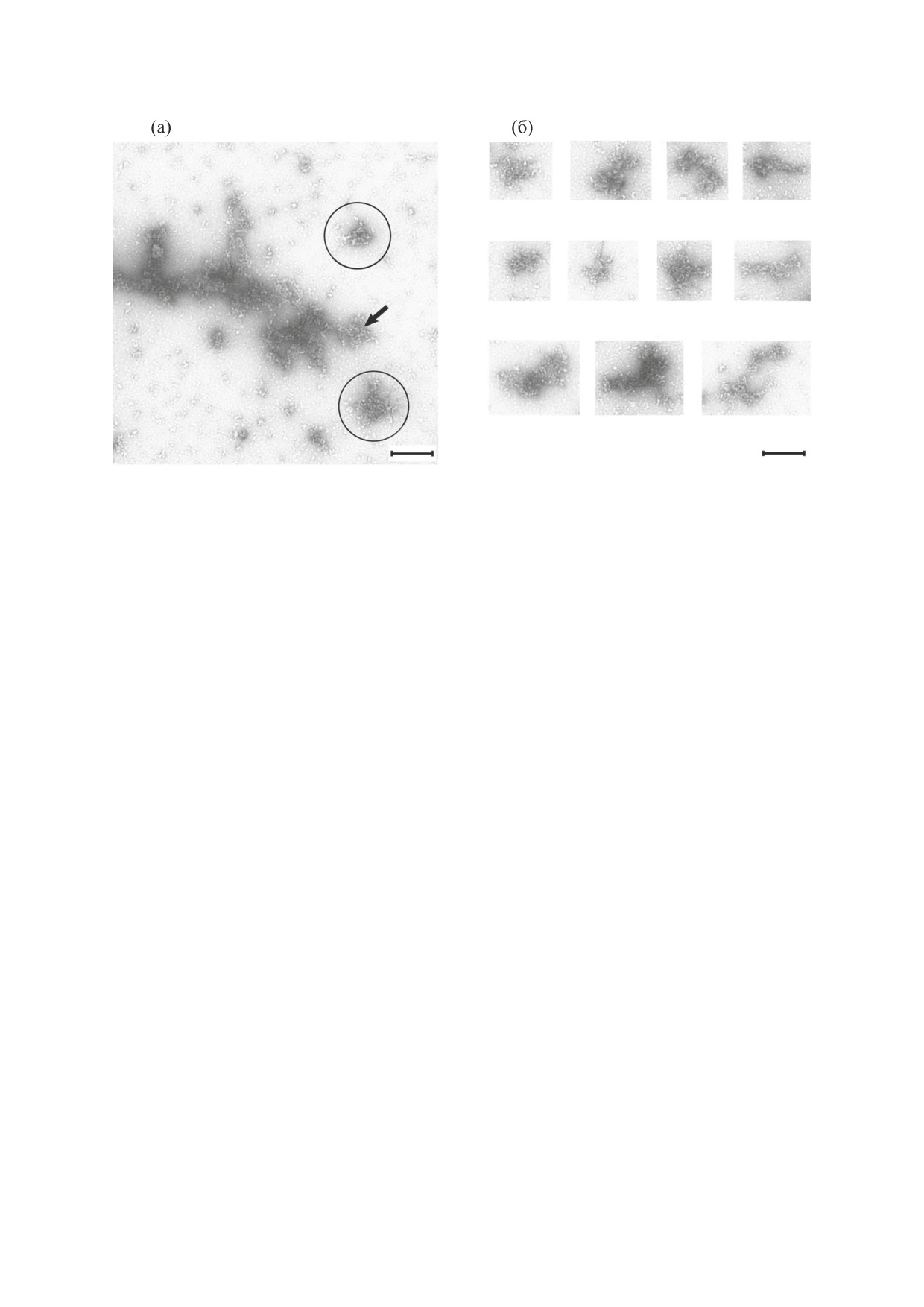
Рис. 2. (а) - Электронная микроскопия аморфных агрегатов и олигомеров гладкомышечного титина, сформированных
в течение трех часов. Отдельно лежащие олигомеры показаны в черных кругах. (б) - Электронная микроскопия
олигомеров гладкомышечного титина. Условия формирования агрегатов: 0.15 М глицин-КОН, рН 7.0, 4°С. Шкала
500 нм.
ния и показывающие появление олигомеров С-
ками (формой, размером) является признаком
белка через 5 мин агрегации и незначительный их
того, что существует общий механизм, по которо-
рост впоследствии [19], могут указывать на то, что
му образуются олигомеры независимо от белка-
олигомеры С-белка являются стабильными и не
предшественника.
участвуют в образовании крупных агрегатов или
Отдельного внимания заслуживает анализ
фибрилл.
структуры олигомеров титина. Способность это-
Согласно известной модели [15], на начальных
го белка формировать олигомеры была впервые
этапах фибриллообразования мономерный ами-
показана в 2003 г. [24]. С помощью атомно-сило-
лоидогенный белок может образовывать одно-
вой микроскопии было обнаружено, что молеку-
временно несколько типов олигомерных форм с
лы титина, выделенные из скелетных мышц кро-
различной внутренней конформацией. Разные
лика, при снижении ионной силы раствора (с
типы олигомеров могут давать начало более круп-
0.6 М до 0.2 M KCl) в течение 10 мин формирова-
ным агрегатам различной структуры, как фиб-
ли олигомеры [24]. При этом авторы наблюдали
риллярным, так и аморфным, либо представлять
присутствие как отдельно лежащих молекул ти-
собой относительно стабильные структуры, не за-
тина, так и его олигомеров разного порядка - ди-
пускающие дальнейшую агрегацию [15]. К тако-
меров, тримеров, тетрамеров и структур более вы-
вым относятся олигомеры С-белка. По результа-
сокого порядка. Мономеры в олигомерах титина
там динамического светорассеяния количество
взаимодействовали друг с другом глобулярными
мономеров С-белка в олигомере составляет 10-
образованиями - головками, формируя уплотне-
12; по данным малоуглового рентгеновского рас-
ние в центре олигомера [24]. Подобные олигоме-
сеяния молекулярная масса олигомера составляет
ры, по нашим данным, формирует и гладкомы-
900 ± 60 кДа, а радиус гирации - 86 ± 4 Å [19].
шечный титин [20]. Однако, в отличие от титина
Примечательно, что характеристики, получен-
поперечно-полосатых мышц, гладкомышечный
ные для олигомеров С-белка, близки к таковым
титин формировал олигомеры в условиях более
для олигомеров белка YB-1 [21-23]. Учитывая
высокой ионной силы (~0.6). т.е. для олигомери-
большую разницу в структуре между YB-1 и С-бел-
зации гладкомышечного титина не требовалось
ком, можно предположить, что способность фор-
снижать ионную силу раствора, как это было не-
мировать олигомеры со схожими характеристи-
обходимо в случае с титином поперечно-полоса-
БИОФИЗИКА том 68
№ 3
2023
464
БОБЫЛЁВА и др.
тых мышц [24]. При снижении ионной силы оли-
СПИСОК ЛИТЕРАТУРЫ
гомеры гладкомышечного титина, имеющие диа-
1.
E. I. Yakupova, L. G. Bobyleva, S. A. Shumeyko, et al.,
метр
~500 нм, формировали более крупные
Biology (Basel), 10 (5), 394 (2021)
аморфные агрегаты (рис. 2).
2.
M. Ahmed, J. Davis, D. Aucoin, et al., Nat. Struct.
На рис. 2а можно наблюдать крупный агрегат,
Mol. Biol., 17, 561 (2010).
отдельно лежащие олигомеры (черные круги) и
3.
H. A. Lashuel, D. Hartley, B. M. Petre, et al., Nature,
множество более мелких частиц, предположи-
418, 291 (2002).
тельно мономеров белка. При этом видно, что
4.
H. A. Lashuel, C. R. Overk, A. Oueslati, and E. Masli-
крупный аморфный агрегат состоит из отдельных
ah, Nat. Rev. Neurosci., 14, 38 (2013).
олигомеров (рис 2а, стрелка). Полученные дан-
ные указывают на то, что укрупнение и рост агре-
5.
P. Narayan, A. Orte, R. W. Clarke, et al., Nat. Struct.
Mol. Biol., 19, 79 (2011).
гатов гладкомышечного титина происходит за
счет олигомеров этого белка.
6.
N. Cremades, S. I. Cohen, E. Deas, et al., Cell, 149,
1048 (2012).
Итак, оба исследованных нами белка форми-
7.
S. L. Shammas, G. A. Garcia, S. Kumar, et al., Nat.
руют олигомеры. Однако С-белок при снижении
Commun., 6, 7025 (2015).
ионной силы формирует группу стабильных оли-
гомеров, которые не участвуют в дальнейшей его
8.
J. Yang, A. J. Dear, T. C. T. Michaels, et al., J. Am.
агрегации. Нельзя исключить, что формирование
Chem. Soc., 140, 2493 (2018).
подобных стабильных олигомеров свидетельству-
9.
B. Winner, R. Jappelli, S. K. Maji, et al., Proc. Natl.
ет о неком адаптивном механизме, созданным
Acad. Sci. USA, 108, 4194 (2011).
природой, предотвращающим дальнейшую агре-
10.
M. J. Guerrero-Muñoz, D. L. Castillo-Carranza,
гацию С-белка в клетках, которая могла бы при-
S. Krishnamurthy, et al., Neurobiol. Dis., 71,
14
водить к негативным последствиям. Гладкомы-
(2014).
шечный титин, в отличие от С-белка, формирует
11.
K. A. Conway, S. J. Lee, J. C. Rochet, et al., Proc. Natl.
олигомеры в условиях высокой ионной силы, де-
Acad. Sci. USA, 97, 571 (2000).
монстрируя этим высокую склонность к ассоциа-
12.
J. P. Cleary, D. M. Walsh, J. J. Hofmeister, et al., Nat.
ции. При понижении ионной силы олигомеры
Neurosci., 8, 79 (2005).
гладкомышечного титина формируют крупные
аморфные агрегаты, которые способны дезагре-
13.
F. Chiti and C. M. Dobson, Biochemistry, 86, 27
гировать при повышении ионной силы [17, 20].
(2017).
Подобные свойства титина, возможно, являются
14.
M. Bucciantini, E. Giannoni, F. Chiti, et al., Nature,
отражением какой-либо функциональной роли
416, 507 (2002).
его олигомеров или агрегатов, образующихся в
15.
V. N. Uversky FEBS J., 277, 2940 (2010).
гладкомышечных клетках.
16.
A. G. Bobylev, O. V. Galzitskaya, R. S. Fadeev, et al.,
Biosci. Rep., 36 (3), e00334 (2016).
ФИНАНСИРОВАНИЕ РАБОТЫ
17.
E. I. Yakupova, I. M. Vikhlyantsev, L. G. Bobyleva,
et al., J. Biomol. Struct. Dyn., 36 (9), 2237 (2018).
Работа выполнена при финансовой поддержке
18.
A. G. Bobylev, E. I. Yakupova, L. G. Bobyleva, et al.,
Российского научного фонда, грант № 22-24-
Mol Biol. (Moscow), 54 (4), 643 (2020).
00805 (задача, касающаяся выделения и подбора
условий для агрегации С-белка).
19.
L. G.Bobyleva, S. A. Shumeyko, E. I. Yakupova, et al.,
Int. J. Mol. Sci., 22, 731 (2021).
20. A. G. Bobylev, E. I. Yakupova, and L. G. Bobyleva, Int
КОНФЛИКТ ИНТЕРЕСОВ
J Mol Sci., 24 (2),1056. (2023).
21. V. M. Evdokimova, C. L. Wei, A. S. Sitikov, et al., J.
Авторы заявляют об отсутствии конфликта
Biol. Chem., 270, 3186 (1995).
интересов.
22. S. R. Tafuri and A. P. Wolffe, New Biol., 4, 349 (1992).
23. M. A. Skabkin, O. I. Kiselyova, K. G. Chernov, et al.,
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Nucl. Acids Res., 32, 5621 (2004).
Все применимые международные, националь-
24. M. S. Kellermayer, C. Bustamante, and H. L. Granzier,
ные и институциональные принципы ухода и ис-
Biochim. Biophys. Acta, 1604 (2), 105 (2003).
пользования животных при выполнении работы
25. S. Kumar and J. Walter, Aging (Albany NY), 3 (8), 803
были соблюдены.
(2011).
БИОФИЗИКА том 68
№ 3
2023
ОСОБЕННОСТИ ОЛИГОМЕРИЗАЦИИ ГЛАДКОМЫШЕЧНОГО ТИТИНА
465
Peculiarities of Oligomerization of Smooth Muscle Titin
and Skeletal Myosin-Binding Protein C
L.G. Bobyleva*, M.A. Timchenko*, E.I. Yakupova**, I.M. Vikhlyantsev*, ***, and A.G. Bobylev*
*Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
**Belozersky Institute of Physico-Chemical Biology, Lomonosov Moscow State University,
Leninskie Gory, 1, Moscow, 119234 Russia
***Institute of Fundamental Medicine and Biology, Kazan Federal University, ul. Karla Marksa 76, Kazan, 420015 Russia
Protein oligomers are important intermediates in the formation of amyloid fibrils. In amyloidoses, for in-
stance, in Alzheimer's disease, oligomers are able to exert toxic effects on cells. This paper describes the dis-
tinctive features of oligomerization of multidomain muscle proteins such as smooth muscle titin and myosin-
binding protein C (MyBP-C) of skeletal muscles, which consist of FnIII-like and IgC2-like domains and
form amorphous amyloid aggregates in vitro. MyBP-C at low ionic strength (below physiological values)
formed stable oligomers that did not participate in further aggregation. In high ionic strength conditions
(μ ~ 0.6), smooth muscle titin formed oligomers, which were precursors of amyloid amorphous aggregates of
this protein. The results obtained help expand existing knowledge about the process of protein aggregation.
Keywords: multidomain muscle proteins, myosin-binding protein C, titin, aggregation, amyloids, oligomerization,
oligomers
БИОФИЗИКА том 68
№ 3
2023