БИОФИЗИКА, 2023, том 68, № 4, с. 685-694
БИОФИЗИКА КЛЕТКИ
УДК 576.32/.36
АНТАГОНИСТ РЕЦЕПТОРОВ СИГМА-1 ГАЛОПЕРИДОЛ ИНГИБИРУЕТ
Са2+-ОТВЕТЫ В ПЕРИТОНЕАЛЬНЫХ МАКРОФАГАХ КРЫСЫ
© 2023 г. Л.С. Миленина*, #, З.И. Крутецкая*, В.Г. Антонов**, Н.И. Крутецкая*
*Санкт-Петербургский государственный университет,
Университетская наб., 7/9, Санкт-Петербург, 199034, Россия
**Санкт-Петербургский государственный педиатрический медицинский университет,
Литовская ул., 2, Санкт-Петербург, 194100, Россия
#E-mail: l.milenina@spbu.ru
Поступила в редакцию 16.02.2023 г.
После доработки 28.03.2023 г.
Принята к публикации 05.04.2023 г.
Рецепторы сигма-1 - повсеместные многофункциональные лигандрегулируемые молекулярные
шапероны в мембране эндоплазматического ретикулума, имеющие уникальную историю, структу-
ру и фармакологический профиль. Рецепторы сигма-1 модулируют широкий спектр клеточных
процессов в норме и патологии, включая процессы Ca2+-сигнализации. С использованием флуо-
ресцентного Са2+-зонда Fura-2AM мы показали, что антагонист рецепторов сигма-1 нейролептик
галоперидол значительно подавляет мобилизацию Са2+ из внутриклеточных Са2+-депо и последу-
ющий депозависимый вход Са2+ в клетки, вызываемые ингибиторами эндоплазматических Са2+-
АТФаз тапсигаргином и циклопьязониковой кислотой, а также иммуномодуляторами глутоксимом
и моликсаном в перитонеальных макрофагах крысы. Результаты свидетельствуют об участии рецеп-
торов сигма-1 в комплексном сигнальном каскаде, вызываемом глутоксимом или моликсаном и
приводящем к увеличению внутриклеточной концентрации Са2+ в макрофагах, а также об участии
рецепторов сигма-1 в регуляции депозависимого входа Са2+ в макрофагах.
Ключевые слова: галоперидол, рецепторы сигма-1, внутриклеточная концентрация Са2+, макрофаги.
DOI: 10.31857/S0006302923040075, EDN: KJXKZD
мической структуре и фармакологическому дей-
Важными участниками процессов Са2+-сиг-
ствию соединения: антидепрессанты (флувокса-
нализации в клетках являются рецепторы сиг-
мин, сертралин, имипрамин), нейролептики
ма-1, имеющие уникальную историю, структуру и
(галоперидол, хлорпромазин), анальгетики (пен-
фармакологию, и модулирующие широкий
тазоцин), анксиолитики (афобазол), противосу-
спектр клеточных процессов в норме и патологии
дорожные (фенитоин), противокашлевые (декс-
[1-5]. Рецепторы сигма-1 представляют собой
трометорфан, карбетапентан) и антигистамин-
уникальные многофункциональные лигандре-
ные (хлорфенамин) препараты, наркотические
гулируемые молекулярные шапероны, локализо-
средства (метамфетамин и кокаин) и препараты,
ванные в мембране эндоплазматического рети-
применяемые при лечении нейродегенеративных
кулума, на границе с митохондриями (MAM -
заболеваний (амантадин, мемантин, донепезил)
mitochondria-associated endoplasmic reticulum
[6-8]. Типичные нейролептики (галоперидол,
membrane) [1-5]. Они могут также транслоциро-
флуфеназин, хлорпромазин, трифлуоперазин)
ваться к плазмалемме и взаимодействовать с дру-
имеют высокое сродство к рецепторам сигма-1
гими рецепторами и ионными каналами; встре-
[9].
чаются и в ядерной оболочке, где участвуют в ре-
Выполняя функции шаперонов, рецепторы
гуляции транскрипции
[1]. Эти рецепторы
сигма-1 взаимодействуют с белками-мишенями
экспрессированы в клетках различных типов,
(ионными каналами, рецепторами в плазмалемме
включая иммунные [2, 3, 5]. Рецепторы сигма-1
и др.) и модулируют многие клеточные процессы,
имеют очень широкий фармакологический про-
включая процессы Са2+-сигнализации [1, 3, 10]. В
филь. Их лигандами являются различные по хи-
плазмалемме они взаимодействуют с потенциал-
Сокращения: ЦПК
- циклопьязониковая кислота,
зависимыми Ca2+-, Na+- и K+-каналами, про-
[Ca2+]i - внутриклеточная концентрация Са2+.
тон-активируемыми
ионными каналами,
685
686
МИЛЕНИНА и др.
NMDA-рецепторами, рецепторами, связанными
пензию клеток помещали в бакпечатки, содержа-
с G-белками (мускариновыми ацетилхолиновы-
щие кварцевые стекла размером 10 × 10 мм. Клет-
ми рецепторами, μ-опиоидными и D1- и D2-до-
ки на стеклах культивировали в течение 1-3 сут
фаминовыми рецепторами) и другими белками-
при 37°С в среде 199 (рН 7.2), содержащей 20%
мишенями [1, 3]. В мембране эндоплазматиче-
сыворотки крови быка, глутамин (3%), пеницил-
ского ретикулума рецептор сигма-1 взаимодей-
лин (100 ед/мл) и стрептомицин (100 мг/мл). Тест
ствует с рецептором инозитол-1,4,5-трифосфата
на α-нафтилэстеразу [20] показал, что по мень-
3-го типа, с другим молекулярным шапероном
шей мере 96% клеток в монослоях были макрофа-
белком BiP (binding immunoglobulin protein) [11] и
гами.
Са2+-сенсором белком STIM1 [12]. Обнаружено,
Эксперименты проводили при комнатной
что, взаимодействуя с рецепторами инозитол-
температуре (22-24°С) через одни-двое суток по-
1,4,5-трифосфата, рецепторы сигма-1 модулиру-
сле начала культивирования клеток. Кварцевые
ют процессы Са2+-сигнализации в клетках - мо-
стекла с клетками помещали в эксперименталь-
ную камеру, заполненную физиологическим рас-
билизацию Са2+ из депо и вход Са2+ из наружной
твором следующего ионного состава: 140 мМ Na-
среды [10, 11]. Показано их участие в регуляции
Cl, 5 мМ KCl, 1 мМ CaCl2, 1 мМ MgCl2 и 5 мМ
депозависимого входа Са2+ в клетках [12-14].
HEPES-NaOH, рН 7.3-7.4. Бескальциевая среда
Ранее нами было впервые показано, что ли-
отличалась тем, что содержала 0 мМ CaCl2 и 1 мМ
ганды рецепторов сигма-1, нейролептики фено-
ЭГТА.
тиазинового ряда хлорпромазин и трифлуопера-
Реактивы. В работе использовали реактивы
зин, значительно подавляют обе фазы Са2+-отве-
фирмы Sigma-Aldrich (США). Маточные раство-
тов,
вызываемых дисульфидсодержащими
ры Fura-2AM (1 мМ), циклопьязоникой кислоты
иммуномодуляторами глутоксимом® (динатрие-
(10 мМ) и тапсигаргина (0.5 мМ) готовили в диме-
вая соль окисленного глутатиона с d-металлом в
тилсульфоксиде. Препараты глутоксим и молик-
наноконцентрации) и моликсаном® (комплекс
сан были предоставлены фирмой ФАРМА-ВАМ
глутоксима и нуклеозида инозина) и ингибитора-
(Санкт-Петербург). Маточные растворы галопе-
ми эндоплазматических Са2+-АТФаз тапсигарги-
ридола (5 мг/мл), глутоксима (50 мг/мл) и молик-
ном и циклопьязониковой кислотой (ЦПК) в пе-
сана (50 мг/мл) готовили в воде.
ритонеальных макрофагах крысы [15, 16].
Измерение внутриклеточной концентрации
Для подтверждения участия рецепторов сиг-
Са2+. Для измерения внутриклеточной концен-
ма-1 в регуляции процессов Са2+ сигнализации в
трации Са2+
([Ca2+]i) использовали флуорес-
макрофагах, представлялось целесообразным ис-
следовать влияние других, структурно отличных,
центный зонд Fura-2AM (Sigma-Aldrich, США).
Макрофаги инкубировали в течение 45 мин в фи-
лигандов рецепторов сигма-1 на Са2+-ответы,
зиологическом растворе, содержащем 2 мкМ Fu-
индуцируемые глутоксимом и моликсаном, а так-
ra-2AM, при 22-24°С. Стекла с окрашенными
же тапсигаргином и ЦПК, в перитонеальных
клетками отмывали физиологическим раствором
макрофагах крысы, что и составило предмет на-
и переносили в экспериментальную камеру флуо-
стоящего исследования.
ресцентного микроскопа DM 4000B (Leica Micro-
В экспериментах использовали антагонист ре-
systems, Германия). Возбуждение флуоресценции
цепторов сигма-1 - нейролептик галоперидол
объекта производили при длинах волн 340 и
(производное бутирофенона) [17], относящийся к
380 нм через объектив микроскопа. Для выделе-
первому поколению типичных нейролептиков
ния соответствующих участков спектра исполь-
(антипсихотических агентов), и имеющий долгую
зовали узкополосные оптические фильтры.
историю использования в клинике для терапии
Эмиссию регистрировали при длине волны
шизофрении и других психических заболеваний
510 нм при помощи специализированной видео-
[18].
камеры DFC340FX (Leica Microsystems, Герма-
ния). Для управления экспериментом использо-
вали систему обработки изображения ImageJ
МАТЕРИАЛЫ И МЕТОДЫ
(плагин Micro-Manager 1.4).
Выделение и культивирование перитонеальных
Результатом измерений являлось отношение
макрофагов крыс. Эксперименты проводили на
интенсивностей флуоресценции Fura-2AM при
культивируемых резидентных перитонеальных
облучении светом с длиной волны 340 нм к ин-
макрофагах крыс линии Wistar. Резидентные мак-
тенсивности флуоресценции при облучении све-
рофаги выделяли из перитонеальной полости
том с длиной волны 380 нм (F340/F380), где F340 -
крыс массой 180-250 г по методу, описанному ра-
интенсивность флуоресценции Fura-2AM, свя-
нее [19]. Сразу после выделения клетки имели
сферическую форму (диаметр 10-20 мкм). Сус-
занного с Са2+, а F380 - интенсивность флуорес-
БИОФИЗИКА том 68
№ 4
2023
АНТАГОНИСТ РЕЦЕПТОРОВ СИГМА-1 ГАЛОПЕРИДОЛ
687
ценции Fura-2AM, не связанного с Са2+. Это от-
В среднем увеличение [Ca2+]i во время входа
ношение отражает изменения [Ca2+]i в клетках во
Са2+ составило 223 ± 22 нМ (n = 7, p < 0.05) и
время измерений [21]. Для избежания фотовыго-
202 ± 20 нМ (n = 6, p < 0.05) для глутоксима и мо-
рания измерения проводили через каждые 20 с,
ликсана соответственно.
облучая объект в течение 2 с. В экспериментах
Обнаружено, что преинкубация макрофагов с
применяли объектив 10× с апертурой 8 мм. Зна-
30 мкг/мл галоперидола в течение 10 мин до вве-
чения [Ca2+]i рассчитывали по уравнению Грин-
дения 100 мкг/мл глутоксима приводила к значи-
кевича [22].
тельному подавлению как мобилизации Са2+ из
депо (на 50.3 ± 8.4%, n = 7, p < 0.05), так и после-
Статистический анализ проводили с примене-
нием t-критерия Стьюдента. Данные представле-
дующего депозависимого входа Са2+ в клетку (на
ны в виде среднего и стандартного отклонения.
54.5 ± 9.5%, n = 7, p < 0.05), индуцируемых глуток-
Каждую регистрацию получали для группы из
симом (рис. 1б). Сходные данные были получены
40-50 клеток. На рисунках представлены резуль-
в опытах по влиянию 30 мкг/мл галоперидола на
таты однотипных экспериментов из шести-вось-
Са2+-ответы, вызываемые 100 мкг/мл моликсана
ми независимых. Достоверными считали разли-
(рис. 2б). Так, галоперидол вызывал подавление
чия при p ≤ 0.05.
мобилизации Са2+ из депо на 49.3 ± 8.1% (n = 7,
p < 0.05) и подавление входа Са2+ в клетки на
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
47.6 ± 9.7% (n = 7, p < 0.05), индуцируемых молик-
саном. Это свидетельствует об участии рецепто-
Влияние галоперидола на Са2+-ответы, вызыва-
ров сигма-1 в активации депозависимого входа
емые дисульфидсодержащими иммуномодулятора-
Са2+, индуцируемого глутоксимом или моликса-
ми в макрофагах. Фармакологические аналоги
ном, в макрофагах.
окисленного глутатиона (глутоксим и моликсан)
Кроме того, выявлено, что добавление
используются как иммуномодуляторы и цито-
30 мкг/мл галоперидола на фоне развившегося
протекторы в комплексной терапии бактериаль-
ных, вирусных и онкологических заболеваний
входа Са2+, индуцированного глутоксимом
[23-26]. Эти препараты оказывают комплексное
(рис. 1а) или моликсаном (рис. 2б), вызывает зна-
влияние на процессы редокс-регуляции в клет-
чительное (на 51.4 ± 9.0 %, n = 12, p < 0.05) подав-
ках, однако тонкие биофизические механизмы их
ление депозависимого входа Са2+ в макрофаги.
действия далеки от полного понимания. Клини-
Влияние галоперидола на Са2+-ответы, индуци-
ческие исследования показали, что моликсан эф-
фективен в профилактике и лечении коронави-
руемые ингибиторами эндоплазматических Са2+-
русной инфекции COVID-19. Он приводит к бо-
АТФаз. В контрольных экспериментах было об-
лее быстрому регрессу тяжести заболевания в
наружено, что добавление 0.5 мкМ тапсигаргина
более легкую форму [27]. Ранее [28, 29] нами
к макрофагам, находящимся в бескальциевой
впервые было показано, что глутоксим и молик-
среде, вызывает незначительное увеличение
сан увеличивают [Ca2+]i, вызывая мобилизацию
[Ca2+]i, отражающее мобилизацию Са2+ из внут-
Са2+ из тапсигаргинчувствительных Са2+-депо и
риклеточных Са2+-депо (рис. 3а). В среднем уве-
последующий депозависимый вход Са2+ в пери-
личение [Ca2+]i во время фазы мобилизации со-
тонеальные макрофаги крыс.
ставило 31 ± 9 нМ (n = 7, p < 0.05). При последую-
В настоящей работе контрольные экспери-
щем введении в наружную среду 2 мМ Са2+
менты показали, что инкубация макрофагов в те-
наблюдали депозависимый вход Са2+ в цитозоль
чение 20 мин со 100 мкг/мл глутоксима (рис. 1а)
(рис. 3а). В среднем увеличение [Ca2+]i во время
или 100 мкг/мл моликсана (рис. 2а) в бескальцие-
вой среде вызывает медленно нарастающее уве-
входа Са2+ составило 152 ± 20 нМ (n = 7, p < 0.05).
Сходные результаты мы получили при использо-
личение [Ca2+]i, отражающее мобилизацию Са2+
вании 10 мкМ ЦПК (рис. 4а). В среднем увеличе-
из внутриклеточных Са2+-депо. Через 20 мин по-
ние [Ca2+]i во время фазы мобилизации Са2+ из
сле добавления агентов [Ca2+]i в среднем увели-
депо, вызываемой ЦПК, составило 26 ± 9 нМ
чивалась от базального уровня, равного 90 ± 18,
(n = 7, p < 0.05), а во время входа Са2+ в макрофа-
до 135 ± 18 нМ (n = 7, p < 0.05) для глутоксима и
ги - 141 ± 22 нМ (n = 7, p < 0.05).
134 ± 20 нМ (n = 6, p < 0.05) для моликсана. При
Показано, что преинкубация макрофагов с
введении в наружную среду 2 мМ Са2+ наблюдали
30 мкг/мл галоперидола в течение 10 мин до вве-
дальнейшее повышение [Ca2+]i, отражающее де-
дения 0.5 мкМ тапсигаргина вызывала подавле-
позависимый вход Са2+ в цитозоль (рис. 1а и 2а).
ние обеих фаз Са2+-ответа, индуцируемого тап-
БИОФИЗИКА том 68
№ 4
2023
688
МИЛЕНИНА и др.
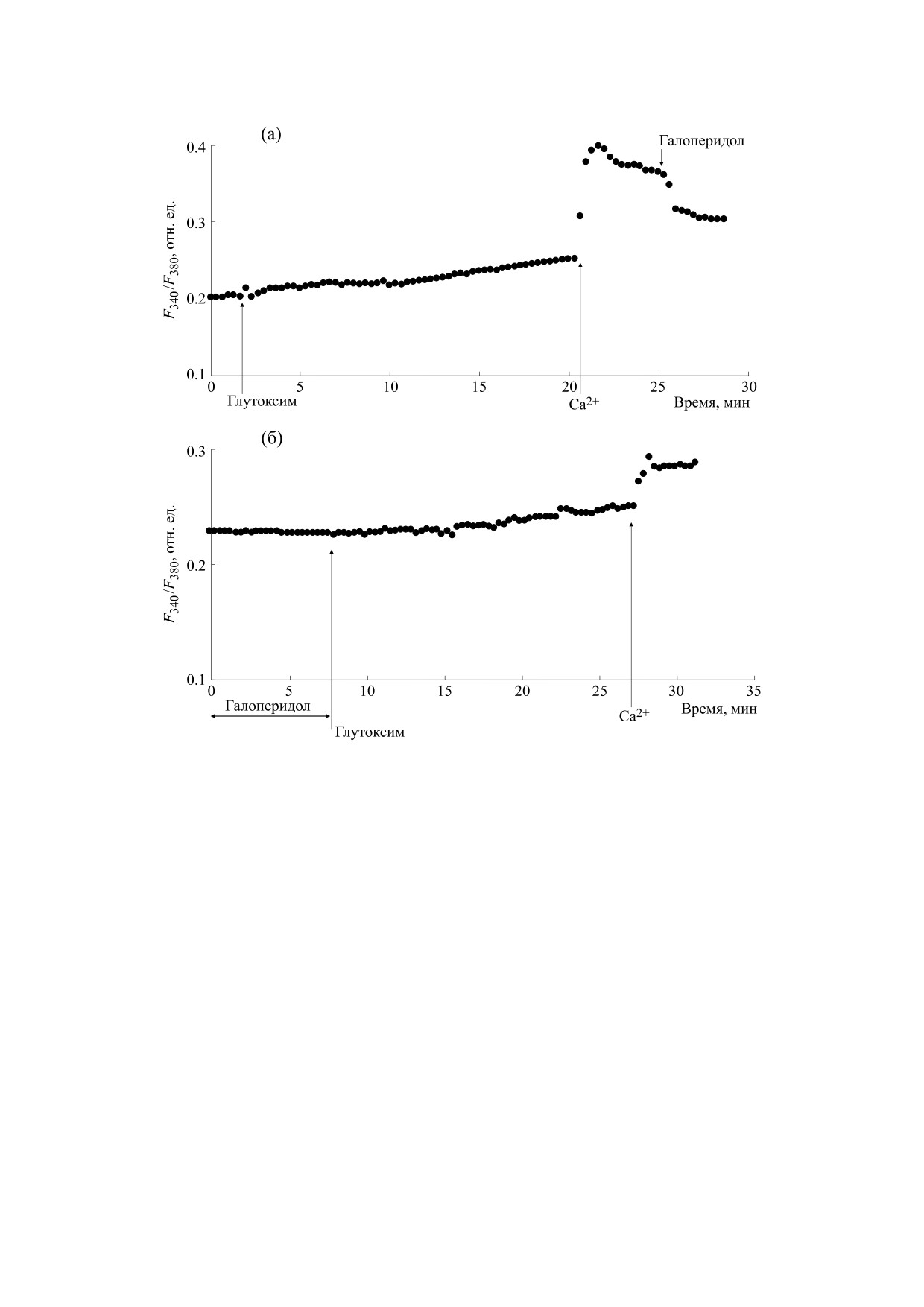
Рис. 1. Влияние галоперидола на увеличение [Ca2+]i в макрофагах крыс, вызываемое глутоксимом: (а) - клетки
инкубировали в течение 20 мин в присутствии 100 мкг/мл глутоксима в номинально бескальциевой среде, затем вход
Са2+ инициировали введением в наружную среду 2 мМ Са2+; на фоне развившегося входа Са2+ добавляли 30 мкг/мл
галоперидола; (б) - макрофаги предварительно инкубировали в течение 10 мин с 30 мкг/мл галоперидола в
бескальциевой среде, затем добавляли 100 мкг/мл глутоксима, через 20 мин вход Са2+ инициировали введением в
наружную среду 2 мМ Са2+. Здесь и далее на рис. 2-4: по оси ординат - отношение интенсивностей флуоресценции Fu-
ra-2AM при длинах волн возбуждающего излучения 340 и 380 нм (F340/F380, отн. ед.), по оси абсцисс - время (мин).
Каждая регистрация получена для группы из 40-50 клеток и представляет собой типичный вариант из шести-восьми
независимых экспериментов.
сигаргином (рис. 3б). В среднем галоперидол по-
активации депозависимого входа Са2+, индуци-
давлял фазу мобилизации Са2+ из депо на
руемого тапсигаргином или ЦПК в макрофагах.
23.2 ± 7.9% (n = 7, p < 0.05), а последующий депо-
Кроме того, было обнаружено, что добавление
зависимый вход Са2+ в макрофаги - на 42.3 ±
30 мкг/мл галоперидола на фоне развившегося
± 13.6% (n = 7, p < 0.05). Сходные результаты были
входа Са2+, индуцированного тапсигаргином
получены в опытах с применением 10 мкМ ЦПК
(рис. 3а) или ЦПК (рис. 4а), вызывает значитель-
(рис. 4б). В среднем галоперидол вызывал подав-
ное подавление депозависимого входа Са2+ в
ление мобилизации Са2+ из депо на 25.9 ± 8.0%
макрофаги. Так, подавление входа Са2+ состави-
(n = 7, p < 0.05) и подавление входа Са2+ на 43.8 ±
ло: 48.5 ± 17.1% (n = 7, p < 0.05) для тапсигаргина
± 12.5% (n = 7, p < 0.05), индуцируемых ЦПК. Это
и 48.1 ± 16.9% (n = 7, p < 0.05) для ЦПК. Это сви-
свидетельствует об участии рецепторов сигма-1 в
детельствует об участии рецепторов сигма-1 не
БИОФИЗИКА том 68
№ 4
2023
АНТАГОНИСТ РЕЦЕПТОРОВ СИГМА-1 ГАЛОПЕРИДОЛ
689
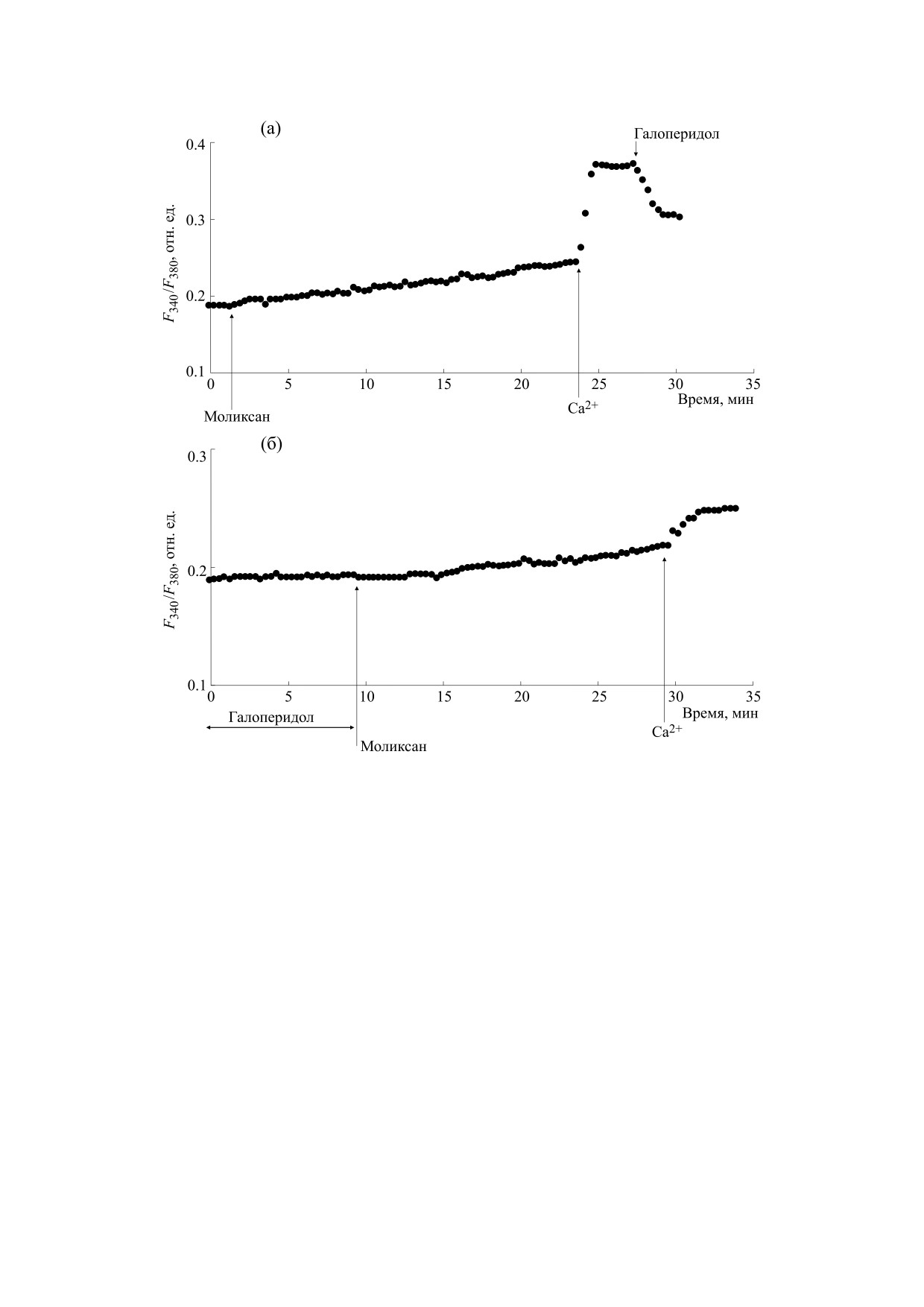
Рис. 2. Влияние галоперидола на увеличение [Ca2+]i в макрофагах крыс, вызываемое моликсаном: (а) - клетки
инкубировали в течение 20 мин в присутствии 100 мкг/мл моликсана в номинально бескальциевой среде, затем вход
Са2+ инициировали введением в наружную среду 2 мМ Са2+; на фоне развившегося входа Са2+ добавляли 30 мкг/мл
галоперидола; (б) - макрофаги предварительно инкубировали в течение 10 мин с 30 мкг/мл галоперидола в
бескальциевой среде, затем добавляли 100 мкг/мл моликсана, через 20 мин вход Са2+ инициировали введением в
наружную среду 2 мМ Са2+.
только в активации, но и в поддержании депоза-
ющий депозависимый вход Са2+, вызываемые
висимого входа Са2+ в макрофаги.
АТФ или тапсигаргином, в клетках лейкоза чело-
века (линия HL-60) [30, 31]. Показано также, что
Таким образом, в настоящей работе мы впер-
хлорпромазин ингибирует депозависимый вход
вые на перитонеальных макрофагах крысы пока-
зали, что антагонист рецепторов сигма-1 нейро-
Са2+, индуцируемый брадикинином или тапси-
лептик галоперидол подавляет в макрофагах обе
гаргином в клетках феохромоцитомы крысы (ли-
ния PC12) [32], а преинкубация клеток с трифлу-
фазы Са2+-ответов, вызываемых глутоксимом
операзином приводит к существенному подавле-
или моликсаном, а также тапсигаргином и ЦПК.
Результаты согласуются с данными исследований
нию депозависимого входа Са2+, вызываемого
других авторов, которые обнаружили, что лиган-
тапсигаргином, в клетках эмбриональной почки
ды рецепторов сигма-1 нейролептики фенотиа-
человека (линия НЕК-293) [33]. Обнаружено, что
зинового ряда хлорпромазин и трифлуоперазин
антагонисты сигма-1 рецепторов (вещества
подавляют мобилизацию Са2+ из депо и последу- BD1063 и BD1047) ингибируют депозависимый
БИОФИЗИКА том 68
№ 4
2023
690
МИЛЕНИНА и др.
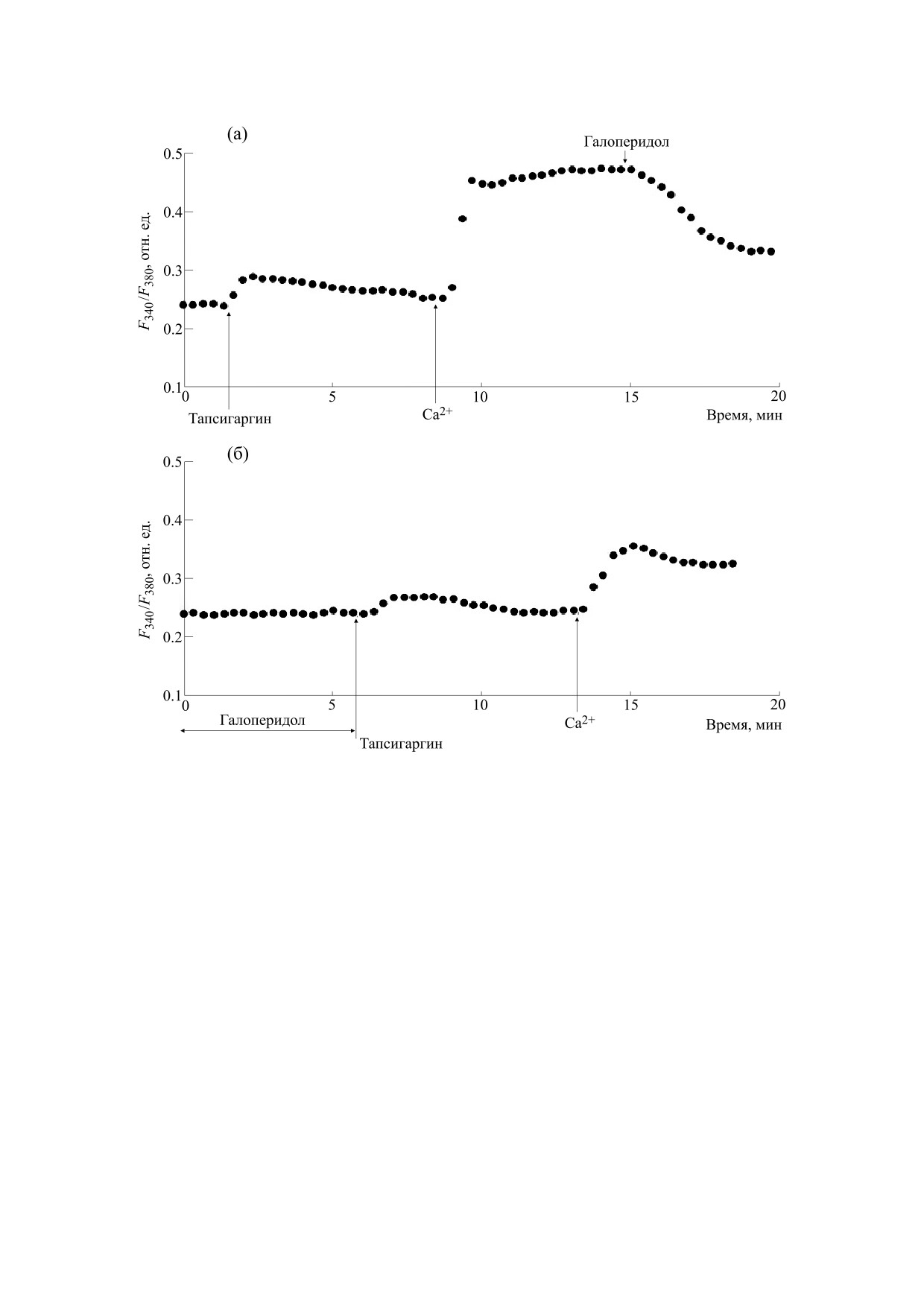
Рис. 3. Влияние галоперидола на Са2+-ответы, индуцируемые тапсигаргином в перитонеальных макрофагах крысы:
(а) - макрофаги стимулировали 0.5 мкМ тапсигаргина в номинально бескальциевой среде, затем вход Са2+
инициировали введением в наружную среду 2 мМ Са2+; на фоне развившегося депозависимого входа Са2+ добавляли
30 мкг/мл галоперидола; (б) - макрофаги предварительно инкубировали в течение 10 мин с 30 мкг/мл галоперидола в
бескальциевой среде, затем добавляли 0.5 мкМ тапсигаргина, после чего вход Са2+ инициировали введением в
наружную среду 2 мМ Са2+.
вход Са2+, индуцируемый гистамином в эндоте-
миоцитах крысы [38], Са2+-каналы N-, L-, P/Q- и
лиальных клетках подкожной вены ноги человека
R-типов в симпатических и парасимпатических
[34], а BD1063 значительно подавляет депозави-
нейронах крысы [39] и Са2+-каналы Т-типа в
симый вход Са2+, вызываемый тапсигаргином, в
клетках эмбриональной почки человека (линия
клетках аденокарциномы молочной железы чело-
HEK293) [40].
века (линия MCF7) [35].
Результаты настоящей работы о подавлении
Кроме того, известно, что галоперидол инги-
антагонистом рецепторов сигма-1 галоперидо-
бирует потенциалзависимые Са2+-каналы в клет-
лом Са2+-ответов, вызываемых глутоксимом и
ках разных типов. Так, галоперидол и хлорпрома-
моликсаном в макрофагах, свидетельствуют о
возможном участии рецепторов сигма-1 в ком-
зин блокируют потенциалзависимые Са2+-кана-
лы в гладкомышечных клетках аорты кролика
плексном сигнальном каскаде, запускаемом глу-
токсимом или моликсаном и приводящем к уве-
[36]. Галоперидол ингибирует Са2+-каналы L-ти-
па в нейронах гиппокампа мыши [37] и кардио- личению [Ca2+]i в перитонеальных макрофагах
БИОФИЗИКА том 68
№ 4
2023
АНТАГОНИСТ РЕЦЕПТОРОВ СИГМА-1 ГАЛОПЕРИДОЛ
691
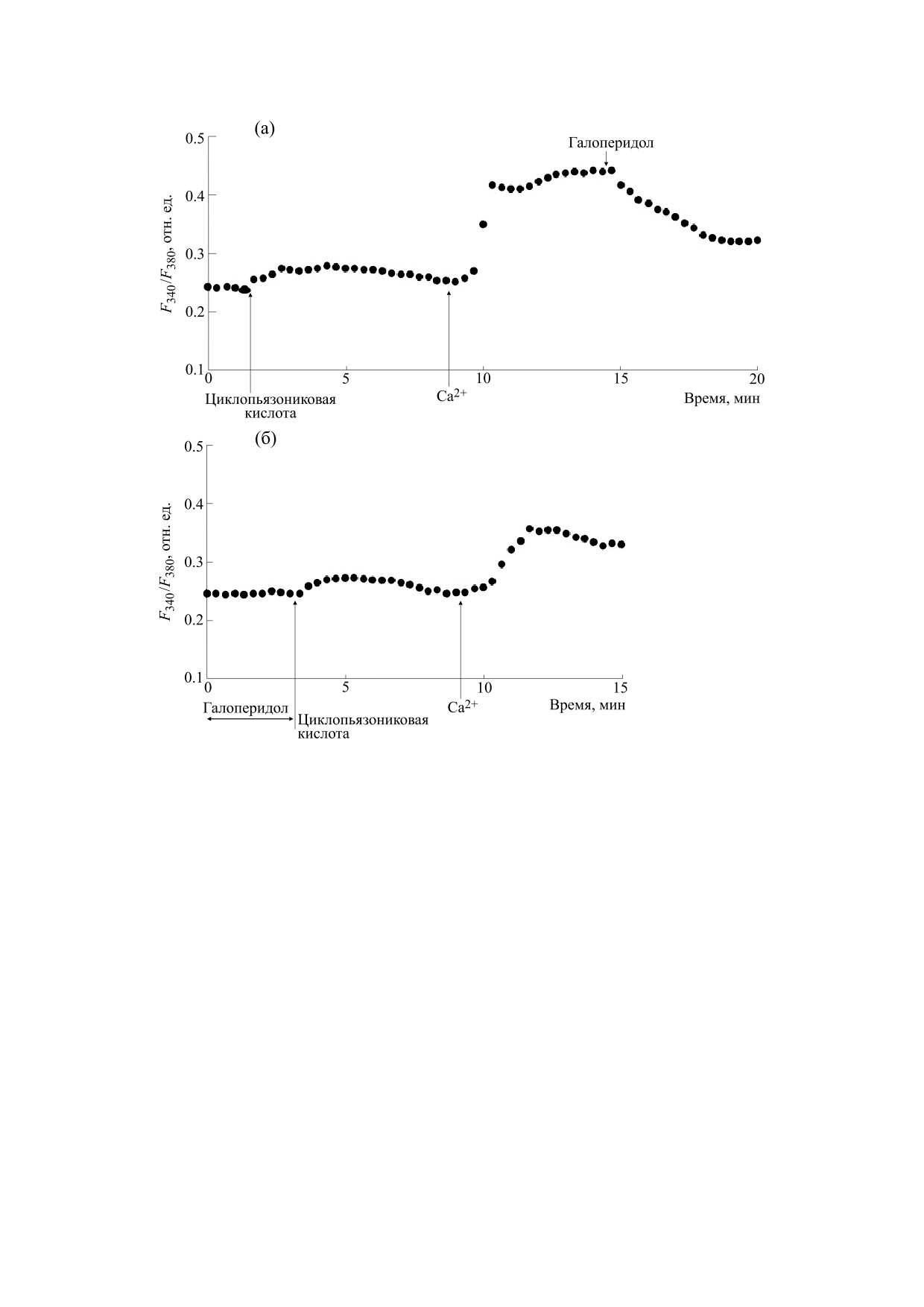
Рис. 4. Влияние галоперидола на Са2+-ответы, индуцируемые циклопьязониковой кислотой в перитонеальных
макрофагах крысы: (а)
- макрофаги стимулировали
10 мкМ циклопьязониковой кислоты в номинально
бескальциевой среде, затем вход Са2+ инициировали введением в наружную среду 2 мМ Са2+; на фоне развившегося
депозависимого входа Са2+ добавляли 30 мкг/мл галоперидола; (б) - макрофаги предварительно инкубировали в
течение 10 мин с 30 мкг/мл галоперидола в бескальциевой среде, затем добавляли 10 мкМ циклопьязониковой
кислоты, после чего вход Са2+ инициировали введением в наружную среду 2 мМ Са2+.
крыс. Результаты указывают также на нежела-
зависимый вход Са2+, модулируя связывание
тельность совместного применения в клиниче-
между основными компонентами белкового ком-
ской практике препаратов глутоксима или мо-
плекса депозависимого входа Са2+ - белками
ликсана и нейролептика галоперидола.
STIM1 в мембране эндоплазматического ретику-
Полученные нами данные свидетельствуют
лума и Orai1 в плазмалемме [12].
также об участии рецепторов сигма-1 в регуляции
Результаты могут также способствовать более
депозависимого входа Са2+, индуцируемого ди-
детальному пониманию молекулярных механиз-
сульфидсодержащими иммуномодуляторами и
мов фармакологического действия нейролепти-
ингибиторами эндоплазматических Са2+-АТФаз,
ков первого поколения. Кроме того, полученные
в перитонеальных макрофагах крыс, и позволяют
данные могут иметь значение для терапии заболе-
рассматривать рецепторы сигма-1 в качестве но-
ваний, опосредованных нарушением функцио-
вого регуляторного компонента сигнального
нирования рецепторов сигма-1. Так, известно,
комплекса депозависимого входа Са2+ в макро-
что изменения субклеточной локализации,
фагах. Рецепторы сигма-1 могут влиять на депо-
экспрессии и сигнальных функций рецепторов
БИОФИЗИКА том 68
№ 4
2023
692
МИЛЕНИНА и др.
сигма-1 приводят к развитию широкого ряда за-
каторы потенциалзависимых Са2+-каналов ни-
болеваний человека [2-5]. Выявлено участие этих
федипин и амлодипин снижают смертность и
рецепторов в патофизиологии нейропсихиатри-
уменьшают риск необходимости искусственной
ческих (шизофрении, тревожных расстройств,
вентиляции легких у пожилых пациентов с
депрессивных состояний и деменции), нейроде-
COVID-19 и гипертонией [53, 54]. Показано так-
генеративных (болезней Альцгеймера, Хантинг-
же, что внутривенное введение пациентам с тяже-
тона и Паркинсона, бокового амиотрофического
лой пневмонией при COVID-19 блокатора депо-
склероза), онкологических и сердечнососудистых
зависимых Са2+-каналов соединения Auxora ста-
заболеваний, болевых синдромов и ретинопатий
билизирует эндотелий легких и ингибирует
[2-5, 10, 41, 42]. Это позволило рассматривать ре-
выделение провоспалительных цитокинов, тем
цепторы сигма-1 как перспективные фармаколо-
самым существенно облегчая и ускоряя выздо-
гические мишени для терапии этих заболеваний.
ровление пациентов [55, 56].
В последнее время изучается также возможная
Таким образом, полученные нами данные о
роль сигма-1 рецепторов в патофизиологии коро-
подавлении антагонистом рецепторов сигма-1 га-
навирусной инфекции (COVID-19). Появляются
лоперидолом обеих фаз Са2+-ответов, индуциру-
данные, что рецепторы сигма-1 могут быть пер-
спективной терапевтической мишенью при лече-
емых дисульфидсодержащими иммуномодулято-
нии пациентов с COVID-19. Полагают, что ре-
рами и ингибиторами эндоплазматических Са2+-
цепторы сигма-1 регулируют ключевые механиз-
АТФаз в перитонеальных макрофагах крыс, до-
мы адаптивного стрессового ответа клеток-хозяев
полнительно подтверждают многогранность эф-
и принимают участие в ранних стадиях реплика-
фектов нейролептиков и свидетельствуют в поль-
ции вируса [43, 44]. Обнаружено, что белок NSP6
зу их терапевтического потенциала, как лигандов
вируса SARS-CoV-2 взаимодействует с рецепто-
рецепторов сигма-1.
рами сигма-1, играющими важную роль в регуля-
ции стресса эндоплазматического ретикулума
ФИНАНСИРОВАНИЕ РАБОТЫ
[45].
Многие перепрофилированные лекарства,
Работа выполнена в рамках договоров СПбГУ
включенные в схемы комплексной терапии паци-
на выполнение научно-исследовательских работ
ентов с COVID-19, часто идентифицируются как
№ 01/18-НИОКР от 05.03.2018 и № 05/03-20 от
лиганды рецепторов сигма-1. К их числу относят-
12.03.2020.
ся нейролептики галоперидол, хлорпромазин и
трифлуоперазин [43, 46]. Показано, что они эф-
КОНФЛИКТ ИНТЕРЕСОВ
фективно ингибируют репликацию и рост вируса
SARS-CoV-2 [45]. Так, галоперидол имеет значи-
Авторы заявляют об отсутствии конфликта
тельную антивирусную активность, сильно свя-
интересов.
зывается с белком NSP6 вируса SARS-CoV-2 [47]
и ингибирует репликацию SARS-CoV-2 в клетках
эпителия легких человека (линия Calu-3) и клет-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
ках обезьяны (линия VeroE6) [45, 48]. Лиганды
Содержание животных и все манипуляции с
рецепторов сигма-1 галоперидол [49] и хлорпро-
ними выполняли в соответствии с нормативными
мазин [50] уже прошли клинические испытания в
документами и требованиями Приказа Минздра-
качестве препаратов для терапии пациентов с
ва России № 267 от 19.06.03 “Об утверждении
COVID-19.
правил лабораторной практики в Российской Фе-
Известно также, что вирусы выработали меха-
дерации”.
низмы нарушения Ca2+-гомеостаза клеток-хозя-
ев и увеличивают [Ca2+]i, поскольку Ca2+ необхо-
СПИСОК ЛИТЕРАТУРЫ
дим для проникновения вируса в клетку, для ре-
1. T.-P. Su, T.-C. Su, Y. Nakamura, et al., Trends Phar-
пликации, созревания и освобождения вируса
macol. Sci., 37, 262 (2016).
[51, 52]. В связи с этим, блокирование вызванного
2. C. G. Rousseaux and S. F. Greene, J. Recept. Signal
вирусом увеличения [Ca2+]i путем ингибирова-
Transduct., 36, 327 (2016).
ния каналов кальциевого выброса в мембране эн-
3. H. R. Schmidt and A. C. Kruse, Trends Pharmacol.
доплазматического ретикулума (рецепторов ино-
зитол-1,4,5-трифосфата и рианодиновых рецеп-
Sci., 40, 636 (2019).
торов) или каналов входа Ca2+ в плазмалемме
4. R. Aishwarya, C. S. Abdullah, M. Morshed, et al.,
Front. Physiol., 12, 705575 (2021).
(потенциалзависимых и депозависимых Ca2+-ка-
налов) является одним из подходов в терапии ви-
5. B. Penke, L. Fulop, M. Szucs, et al., Curr. Neurophar-
русных инфекций [52]. Так, обнаружено, что бло-
macol., 16, 97 (2018).
БИОФИЗИКА том 68
№ 4
2023
АНТАГОНИСТ РЕЦЕПТОРОВ СИГМА-1 ГАЛОПЕРИДОЛ
693
6. E. J. Cobos, J. M. Entrena, F. R. Nieto, et al., Curr.
32. S.-Y. Choi, Y.-H. Kim, Y.-K. Lee, et al., British J.
Neuropharmacol., 6, 344 (2008).
Pharmacol., 132, 411 (2001).
7. T. Maurice and T.-P. Su, Pharmacol. Ther., 124, 195
33. L. Wang, L. Zhang, S. Li et al., Sci. Rep., 5, 1 (2015).
(2009).
34. M. S. Amer, L. McKeown, S. Tumova, et al., Brit. J.
8. U. B. Chu and A. E. Ruoho, Mol. Pharmacol., 89, 142
Pharmacol., 168, 1445 (2013).
(2016).
35. G. Gasparre, C. Abate, R. Carlucci, et al., Pharmacol.
9. S. W. Tam and L. Cook, Proc. Natl. Acad. Sci. USA,
Rep., 69, 542 (2017).
81, 5618 (1984).
10. I. Pontisso and L. Combettes, Genes, 12, 139 (2021).
36. S. F. Flaim, M. D. Brannan, S. C. Swioart et, al., Proc.
11. T. Hayashi and T.-P. Su, Cell, 131, 596 (2007).
Natl. Acad. Sci. USA, 82, 1237 (1985).
12. S. Srivats, D. Balasuriya, M. Pasche, et al., J. Cell Biol.,
37. J. Church and E .J. Fletcher, Brit. J. Pharmacol., 116,
213, 65 (2016).
2801 (1995).
13. G. C. Brailoiu, E. Deliu, L. M. Console-Bram, et al.,
38. B. Tarabova, M. Novakova, and L. Lacinova, Gen.
Biochem. J., 473, 1 (2016).
Physiol. Biophys., 28, 249 (2009).
14. S. Berlansky, C. Humer, M. Sallinger, et al., Int. J. Mol.
39. H. Zhang and J. Cuevas, J. Neurophysiol., 87, 2867
Sci., 22, 471 (2021).
(2002).
15. Л. С. Миленина, З. И. Крутецкая, В. Г. Антонов
и др., Биофизика, 66 (1), 92 (2021).
40. C. M. Santi, F. S. Cayabyab, K. G. Sutton, et al., J.
Neurosci., 22, 396 (2002).
16. Л. С. Миленина, З. И. Крутецкая, В. Г. Антонов
и др., Цитология, 64 (1), 58 (2022).
41. S.-Y. Tsai, T. Hayashi, T. Mori, et al., Cent. Nerv. Syst.
17. E. J. Cobos, E. Del Pozo, and J. M. Baeyens, J. Neuro-
Agents Med. Chem., 9, 184 (2009).
chem., 102, 812 (2007).
42. M. V. Voronin, Y. V. Vakhitova, and S. B. Seredenin,
18. G. Ayano, Res. Rev. J. Chem,. 5, 53 (2016).
Int. J. Mol. Sci., 21, 7088 (2020).
19. C. Randriamampita and A. Trautmann, Cell. Biol.,
43. J. M. Vela, Front. Pharmacol., 11, 582310 (2020).
105, 761 (1987).
44. K. Hashimoto, Eur. Arch. Psychiatry Clin. Neurosci.,
20. R. A. Monahan, H. F. Dvorak, and A. M. Dvorak,
271, 249 (2021).
Blood, 58, 1089 (1981).
21. Q. Xie, Y. Zhang, C. Zhai, et al., J. Biol. Chem., 277,
45. D. E. Gordon, G. M. Jang, M. Bouhaddou, et al., Na-
16559 (2002).
ture, 583, 459 (2020).
22. G. Grynkiewicz, M. Poenie, and R. Y. Tsien, J. Biol.
46. M. Plaze, D. Attali, A.-C. Petit, et al., L’Encephale, 46,
Chem., 260, 3440 (1985).
169 ( 2020).
23. А. Е. Борисов, Л. А. Кожемякин, А. Е. Антушевич
47. P. Pandey, K. Prasad, A. Prakash, et al., J. Mol. Med.,
и др., Вестн. хирургии им. И.И. Грекова, 4 (2), 32
98, 1659 (2020).
(2001).
24. Г. Б. Соколова, М. В. Синицын, Л. А. Кожемякин
48. B. L. Le, G. Andreoletti, T. Oskotsky, et al., Sci. Rep.,
и др., Антибиотики и химиотерапия, 47 (2), 20
11, 12310 (2021).
(2002).
49. N. Hoertel, M. Sanchez-Rico, R. Vernet, et al., PLoS
25. А. А. Антушевич, В. Г. Антонов, А. Н. Гребенюк и
One, 16, e0247122 (2021).
др., Вестн. Рос. воен.-мед. акад., 3 (43), 32 (2013).
50. N. Hoertel, M. Sanchez-Rico,· R. Vernet, et al., Clin.
26. О. А. Толстой, В. Н. Цыган, А. Г. Климов и др., Из-
Drug Invest., 41, 221 (2021).
вестия Рос. воен.-мед. акад., 38 (1), 271 (2019).
51. Y. Zhoua, T. K. Freyb, and J. J. Yanga, Cell Calcium,
27. M. V. Dubina, V. V. Gomonova, A. E. Taraskina, et al.,
46, 1 (2009).
iv.org 06.10.2020) (2020).
52. X. Chen, R. Cao, and W. Zhong, Cells, 9, 94 (2019).
28. Л. С. Курилова, З. И. Крутецкая, О. Е. Лебедев
53. I. Solaimanzadeh, Cureus, 12, e8069 (2020).
и др., Цитология, 50 (5), 452 (2008).
54. L.-K. Zhang, Y. Sun, H. Zeng, et al., Cell Discovery, 6,
29. Л. С. Курилова, З. И. Крутецкая, О. Е. Лебедев
96 (2020).
и др., Цитология, 54 (2), 135 (2012).
55. J. Miller, C. Bruen, M. Schnaus, et al., Crit. Care, 24,
30. J. L. Harper, Y. Shin, and J. W. Daly, Proc. Natl. Acad.
502 (2020).
Sci. USA, 94, 14912 (1997).
31. J. L. Harper and J. W. Daly, Drug Dev. Res., 47, 107
56. S. Berlansky, M. Sallinger, H. Grabmayr, et al., Cells,
(1999).
11, 253 (2022).
БИОФИЗИКА том 68
№ 4
2023
694
МИЛЕНИНА и др.
Haloperidol, a Sigma-1 Receptor Antagonist, Inhibits Ca2+ Responses
in Rat Peritoneal Macrophages
L.S. Milenina*, Z.I. Krutetskaya*, V.G. Antonov**, and N.I. Krutetskaya*
*Saint-Petersburg State University, Universitetskaya nab. 7/9, Saint-Petersburg, 199034 Russia
**Saint-Petersburg State Pediatric Medical University, Litovskaya ul. 2, Saint-Petersburg, 194100 Russia
Sigma-1 receptors are ubiquitous multifunctional ligand-operated molecular chaperones in the endoplasmic
reticulum membrane and have a unique history, structure, and pharmacological profile. Sigma-1 receptors
modulate a wide range of cellular processes in health and disease and Ca2+ signaling processes. Using the
Ca2+ sensitive fluorescent ratiometric dye Fura-2AM, it has been shown that neuroleptic (haloperidol, an an-
tagonist of sigma-1 receptors) significantly suppresses Ca2+ mobilization from intracellular Ca2+ stores and
subsequent store-dependent Ca2+ entry, induced by thapsigargin and cyclopiazonic acid, as inhibitors of en-
doplasmic reticulum Ca2+-ATPases, and also by glutoxim and molixan, disulfide-containing immunomod-
ulatory drugs, in rat peritoneal macrophages. Findings of the study revealed that sigma-1 receptors are in-
volved in the complex signaling cascade triggered by glutoxim or molixan that leads to the increase in the in-
tracellular Ca2+ concentration in macrophages and participate in regulation of store-dependent Ca2+ entry in
macrophages.
Keywords: haloperidol, sigma-1 receptors, intracellular Ca2+ concentration, macrophages
БИОФИЗИКА том 68
№ 4
2023