БИОФИЗИКА, 2023, том 68, № 4, с. 718-723
БИОФИЗИКА КЛЕТКИ
УДК 577.35+612.17
ОТЛИЧИЕ ОТВЕТОВ ПРЕМОТОРНЫХ ИНТЕРНЕЙРОНОВ
НА СЕРОТОНИН И ПРЕДШЕСТВЕННИК ЕГО СИНТЕЗА
5-ГИДРОКСИТРИПТОФАН У ИНТАКТНЫХ
И СЕНСИТИЗИРОВАННЫХ УЛИТОК
© 2023 г. Т.Х. Богодвид*, **, #, В.В. Андрианов*, Л.Н. Муранова*, Х.Л. Гайнутдинов*
*Институт фундаментальной медицины и биологии, Казанского (Приволжского) федерального университета,
Кремлевская ул., 18, Казань, 420008, Россия
*Поволжский государственный университет физической культуры, спорта и туризма,
Деревня Универсиады, 35, Казань, 420010, Россия
#E-mail: tat-gain@mail.ru
Поступила в редакцию 15.02.2023 г.
После доработки 20.03.2023 г.
Принята к публикации 05.04.2023 г.
Исследованы реакции премоторных интернейронов LPa3 and RPa3 улитки на аппликацию
серотонина и предшественника его синтеза 5-гидрокситриптофана в раствор, омывающий
препарат центральной нервной системы интактных улиток и улиток, после выработки
долговременной сенситизации. Измерения электрических характеристик показали, что при
аппликации серотонина мембранный потенциал интернейронов LPa3 and RPa3 интактных улиток
достоверно снижается на 3.7 мВ, а пороговый потенциал недостоверно увеличивается. Такая же
картина наблюдалась и при аппликации
5-гидрокситриптофана: достоверное снижение
мембранного потенциала на 3.1 мВ и недостоверное увеличение порога генерации потенциалов
действия. Найдено, что аппликация серотонина вызывает достоверное уменьшение мембранного
потенциала интернейронов LPa3 and RPa3 сенситизированных улиток на 4.6 мВ (деполяризация) и
недостоверное увеличение порогового потенциала премоторных интернейронов на 0.9 мВ.
Аппликация 5-гидрокситриптофана, напротив, вызывает недостоверное увеличение на 2.5 мВ
мембранного потенциала и также недостоверное увеличение порогового потенциала на 0.8 мВ.
Ключевые слова: серотонин,
5-гидрокситриптофан, долговременная сенситизация, мембранный
потенциал, порог генерации потенциалов действия.
DOI: 10.31857/S0006302923040117, EDN: KLJUCJ
сенситизацию (ДС), длящуюся дни и недели [7].
Длительные модификации поведенческих ре-
Это состояние характеризуется резким усилени-
акций, происходящие при обучении, являются
ем оборонительных реакций, сопровождающихся
следствием пластических изменений нейронов и
повышением возбудимости основных элементов
синаптической передачи [1-3]. Одной из форм
нейронной сети - сенсорных либо командных
пластичности является сенситизация, форма
нейронов [3, 8-11].
неассоциативного обучения, при которой у жи-
вотного происходит значительное усиление вели-
Известно, что долговременное облегчение
чины вызванного рефлекса, происходящее
связей между сенсорным и моторным нейронами
вследствие нанесения сильной (или даже повре-
рефлекса отдергивания жабер у аплизии опосре-
ждающей) стимуляции [4-6]. Если отдельный
дуется серотонином (5-HT), эта форма синапти-
сильный стимул хвоста у аплизии или головы
ческой пластичности была найдена критичным
улитки вызывает кратковременную сенситиза-
клеточным механизмом поведенческой сенсити-
цию, длящуюся минуты, то повторение повре-
зации [1]. Показано, что 5-HT является основ-
ждающей стимуляции вызывает долговременную
ным медиатором, который опосредует оборони-
тельное поведение у моллюсков и обучение и сен-
Сокращения: ДС - долговременная сенситизация, 5-HT -
ситизацию на основе
оборонительных
серотонин (5-гидрокситриптамин), 5-HTP - 5-гидроксит-
риптофан, Vm - мембранный потенциал, Vt - пороговый
рефлексов) [12-15]. Было найдено, что когда ап-
потенциал.
лизия получает опасный (сильный) стимул, на-
718
ОТЛИЧИЕ ОТВЕТОВ ПРЕМОТОРНЫХ ИНТЕРНЕЙРОНОВ
719
пример, электрошок хвоста, то сети серотонинер-
активном состоянии во влажной атмосфере, при
гических нейронов моллюска выделяют эндоген-
комнатной температуре и избытке пищи. У всех
ный серотонин [16]. Этот выделенный 5-HT
улиток вырабатывали долговременную сенсити-
вызывает целый ряд клеточных изменений, кото-
зацию оборонительного рефлекса. Процедура
рые ведут к усилению оборонительного рефлекса.
формирования ДС проходила по отработанной
Эксперименты продемонстрировали, что для
схеме [22]. Улиткам предъявляли электрические
формирования такой формы пластичности, как
стимулы в область головы четыре раза в сутки в
долговременная сенситизация, 5-HT необходим
течение четырех суток с интервалом в полтора-
как у аплизии [17], так и у виноградной улитки
два часа. Длительность каждого стимула состав-
[18]. Применением аппликаций 5-HT в омываю-
ляла 0.5 с. Характеристики стимула: прямоуголь-
щий центральную нервную систему раствор были
ные импульсы тока амплитудой 6-8 мА, длитель-
воспроизведены электрофизиологические корре-
ностью 10 мс, частотой 50 Гц. Действительную
ляты пластичности [1, 11]. Недавно было показа-
амплитуду тока при стимуляции контролировали
но [19], что у прудовика Lymnaea stagnalis одни
по экрану осциллографа. Использованный ток не
сутки лишения пищи повышали способность к
вызывал повреждений кожи улиток, которые мо-
обучению (аверзии на пищу) за счет снижения со-
гут возникать в виде пигментированных участков
держания 5-HT в центральной нервной системе.
при более значительной величине тока [23]. За
Однако после пяти суток голодания способность
двое суток до начала эксперимента и во время
к обучению и концентрация 5-НТ возвращалась к
сенситизации (в течение четырех суток) экспери-
исходному уровню. При этом концентрация
ментальных улиток переставали кормить. Лише-
триптофана в центральной нервной системе была
ние виноградной улитки пищи во время форми-
выше у тех улиток, которых не кормили пять су-
рования условных рефлексов является стандарт-
ток, чем у улиток, лишенных пищи в течение од-
ным приемом, оно не связано с метаболизмом
них суток. Результаты показывают, что 5-HT мо-
определенных веществ, а определяется необходи-
жет действовать на внесинаптические серотони-
мостью активного состояния животного [24, 25].
новые рецепторы [14, 20]. Ранее мы изучали, как
Улиток контрольных групп на протяжении всего
изменяется возбудимость премоторных интер-
эксперимента содержали в тех же условиях, что и
нейронов виноградной улитки на аппликацию
улиток экспериментальных групп.
5рHT и предшественника его синтеза 5-гидрок-
Критерием выработки ДС служило значитель-
ситриптофана (5-HTP) у интактных и обученных
ное увеличение времени закрытого состояния
моллюсков. Было найдено, что аппликация 5-HT
пневмостома в ответ на предъявление тестирую-
и 5-HTP вызывала уменьшение мембранного по-
щего раздражения по сравнению с исходной ре-
тенциала (Vm) премоторных интернейронов как
акцией. Только полное закрытие пневмостома
интактных, так и обученных улиток [21]. В то же
определялось как положительная реакция на сти-
время только у обученных улиток, в отличие от
мул. Выбор реакции закрытия пневмостома был
интактных, аппликация 5-HT и 5-HTP вызывала
обусловлен тем, что она является начальной ком-
повышение порогового потенциала (Vt) премо-
понентой оборонительных реакций, позволяю-
торных интернейронов LPa3 и RPa3.
щей проводить объективную регистрацию [26].
Тестирование проводили в специальной установ-
В связи с этим в продолжение предыдущих ра-
бот мы провели исследование изменений элек-
ке, состоящей из резервуара с водой, в котором
трических характеристик, влияющих на возбуди-
плавал легкий полиэтиленовый шар, и штатива с
мость премоторных интернейронов виноградной
кронштейном, к которому жестко крепили рако-
вину моллюска. Улитки свободно ползали по ша-
улитки в ответ на аппликацию 5-HT и предше-
ру, вращая его. Такая установка позволяла прово-
ственника его синтеза 5-HTP у интактных улиток
и улиток после ДС.
дить объективную регистрацию движения мышц
легочной полости и раздражать любую точку тела
улитки.
МЕТОДИКА ИССЛЕДОВАНИЯ
Анализ электрических характеристик прово-
Эксперименты проводили на виноградной
дили на премоторных интернейронах оборони-
улитке Helix lucorum, нервная система которой со-
тельного рефлекса LPa3 и RPa3. Измерения про-
держит ряд идентифицированных нейронов, поз-
водили при комнатной температуре (21-25°С) с
воляя проводить исследования свойств нервных
помощью внутриклеточных стеклянных микро-
клеток с учетом их позиции в нейронной сети, что
электродов, заполненных 2.5 М КCl и имеющих
делает этот вид улиток одним из модельных для
сопротивление 5-15 МОм. Регистрировали сле-
нейробиологических исследований [21]. Для экс-
дующие параметры нервных клеток: мембранный
периментов выбирали улиток примерно одной
потенциал покоя - Vm (исходное значение перед
массы (около 20-25 г). Перед началом экспери-
началом серии тактильных раздражений или
ментов улитки не менее двух недель находились в
электрической стимуляции и его величина в ходе
БИОФИЗИКА том 68
№ 4
2023
720
БОГОДВИД и др.
эксперимента) и порог генерации потенциала
РЕЗУЛЬТАТЫ
действия - Vt (пороговый потенциал). Порого-
Для формирования ДС улиткам предъявляли
вый потенциал оценивали как разницу между Vm
электрические стимулы в область головы четыре
и значением потенциала во время генерации по-
раза в сутки в течение четырех суток с интервалом
тенциала действия, при котором скорость его
в полтора-два часа. Тестирование формирования
увеличения (первая производная потенциала по
ДС показывает постепенное увеличение времени
времени) достигла определенного значения [27]
закрытия пневмостома в процессе выработки ДС
(для нейронов LPa3 и RPa3 была найдена величи-
у улиток с 16.3 ± 1.1 с до 66.7 ± 3.2 с (p < 0.01,
на 1 В/с) [28]. Поскольку премоторные интерней-
n = 26). Этот результат демонстрирует формиро-
роны LPa3 и RPa3 в норме являются молчащими,
вание ДС у улитки [22, 29].
то для вызова потенциала действия в изолирован-
На следующий день после окончания четырех-
ном препарате через регистрирующий микро-
суточного формирования ДС и тестирования,
электрод на клетку подавали импульс тока пря-
подтверждающего формирование ДС, проводили
моугольной формы продолжительностью 1 с;
электрофизиологические эксперименты по ис-
величину тока стимуляции подбирали минималь-
следованию изменений возбудимости премотор-
ной для генерации двух-пяти потенциалов дей-
ных интернейронов виноградной улитки на ап-
ствия. В проведенных сериях экспериментов эта
пликацию 5-HT (n = 13) и предшественника его
величина тока варьировала от 1.7 до 3.5 нА.
синтеза 5-HTP (n = 13) у улиток после ДС. Для
сравнения были проведены исследования изме-
В основной части экспериментов исследовали
нений возбудимости премоторных интернейро-
величины Vm и Vt нейронов при аппликации в те-
нов виноградной улитки на аппликацию 5-HT
чение 30 мин в раствор, омывающий препарат
(n = 15) и предшественника его синтеза 5-HTP
подглоточного комплекса ганглиев интактных и
(n = 15) у интактных улиток.
сенситизированных улиток, следующих веществ:
Измерения электрических характеристик пре-
серотонина в концентрации 10-3 М и 5-гидрок-
моторных интернейронов (LPa3 и RPa3) интакт-
ситриптофана, предшественника синтеза серото-
ных улиток показали, что Vm у них был равен -
нина, в концентрации 10-3 М.
60.7 ± 0.6 мВ (n = 12), Vt - 19.7 ± 0.5 мВ (n = 10).
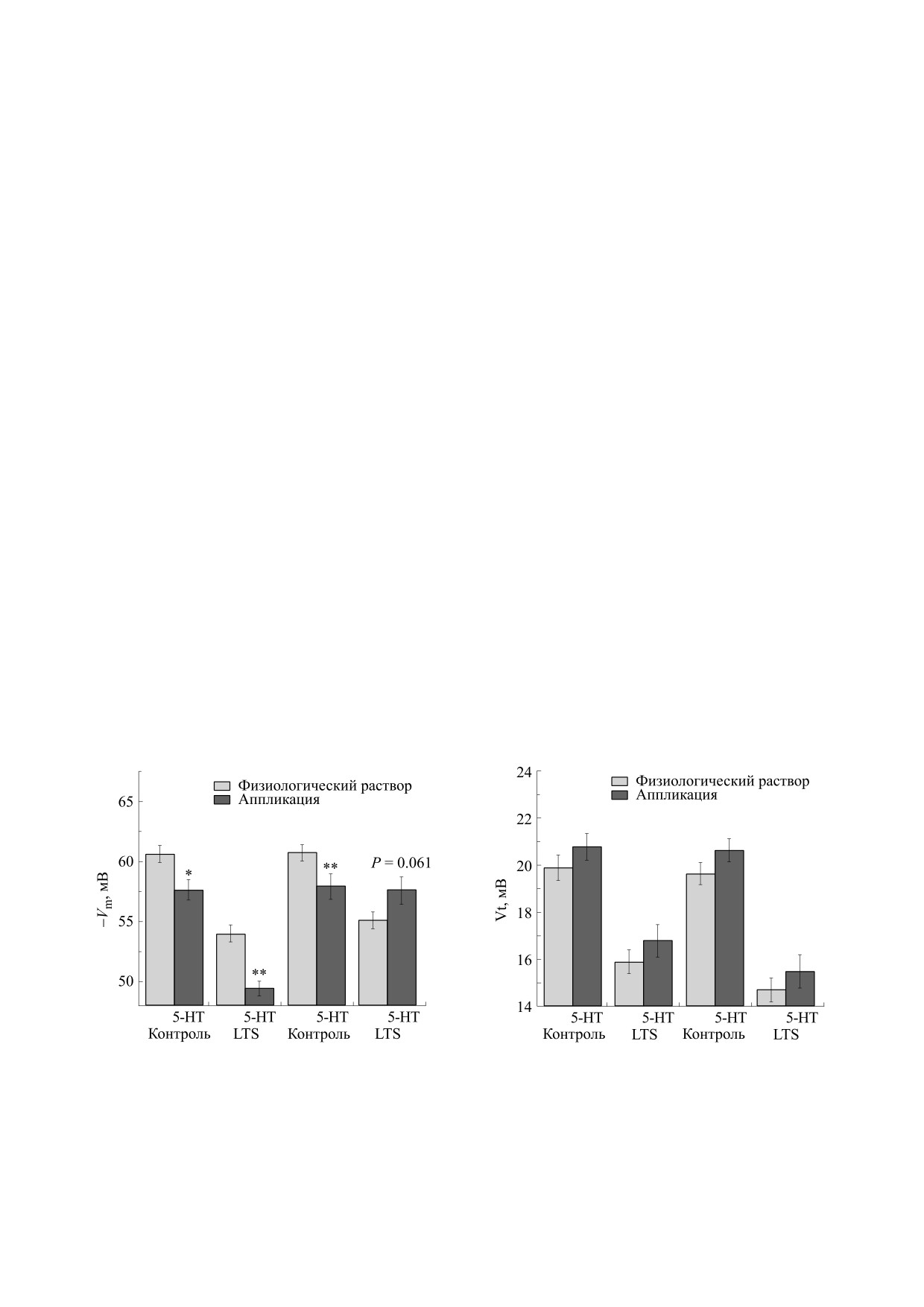
При аппликации 5-HT в раствор, омывающий
Результаты статистически обработаны и пред-
препарат интактных улиток, было показано до-
ставлены как среднее ± SEM. Достоверность раз-
стоверное (p < 0.01) снижение Vm (деполяризация
личий оценивали по t-критерию Стьюдента (с
на 3.7 мВ) до -57.0 ± 1.0 мВ, (n = 12) и недостовер-
проверками нормальности и равенства диспер-
ное увеличение Vt до 20.5 ± 0.6 мВ (n = 10) (рис. 1,
сий) и U-критерию Манна-Уитни. Статистиче-
2). Такая же картина наблюдалась и при апплика-
скую значимость оценивали по p < 0.05.
Рис. 1. Влияние аппликации серотонина (5-HT) и
Рис. 2. Влияние аппликации серотонина (5-HT) и
предшественника его синтеза 5-гидрокситриптофана
предшественника его синтеза 5-гидрокситриптофана
(5-HTP) в раствор на величину мембранного
(5-HTP) в раствор на величину порога генерации
потенциала премоторных нейронов оборонительного
потенциала действия (Vt) премоторных нейронов
рефлекса LPa3 и RPa3 у интактных (Control) и
оборонительного рефлекса LPa3 и RPa3 у интактных
сенситизированных (LTS) улиток.
(Control) и сенситизированных (LTS) улиток.
БИОФИЗИКА том 68
№ 4
2023
ОТЛИЧИЕ ОТВЕТОВ ПРЕМОТОРНЫХ ИНТЕРНЕЙРОНОВ
721
ции 5-HTP: достоверное (p < 0.05) снижение (де-
скрипции CREB-1, который, в свою очередь, ин-
поляризация на 3.1 мВ) мембранного потенциала
дуцирует транскрипцию выбранных генов, ответ-
(с -61.1 ± 0.7 мВ до -58.0 ± 1.0 мВ, n = 12) и недо-
ственных за долговременную память, обеспечи-
стоверное увеличение порога генерации ПД (с
вая молекулярную связь между кратковременной
19.1 ± 0.6 до 20.3 ± 0.5 мВ (n = 12) (рис. 1 и 2).
и долговременной сенситизацией [39]. Есть пред-
положение, что основной функцией, связанной с
В экспериментальной серии было найдено,
активацией серотонинергической системы апли-
что аппликация 5-HT в раствор, омывающий
зии, вызванной повреждающими стимулами, яв-
препарат улиток после формирования ДС, вы-
ляется запуск защитной реакции возбуждения
зывает достоверное уменьшение мембранного
[19]. Увеличение высвобождения 5-HT после воз-
потенциала (деполяризация на 4.6 мВ) 5-HT: с -
действия его предшественника 5-HTP прояви-
54.0 ± 0.7 мВ до -49.4 ± 0.6 мВ, p < 0.01, n = 9) и не-
лось в облегчении сенсомоторных синапсов, уве-
достоверное увеличение порогового потенциала
личении возбуждения серотонинергических ней-
5-HT: с 15.9 ± 0.5 до 16.8 ± 0.7 мВ, n = 8 (рис. 1 и 2).
ронов в педальном и брюшном ганглиях и
Если рассматривать изменение мембранного по-
усилении высвобождения 5-HT, вызванного шо-
тенциала в результате аппликации 5-HT относи-
ком хвостового нерва. Когда 5-HTP вводили сво-
тельно уровня Vm несенситизированных улиток,
бодно движущимся улиткам, он вызывал силь-
то это будет деполяризация на 8.3 мВ.
ную реакцию возбуждения, характеризующуюся
При аппликации 5-HTP в раствор, омываю-
повышенной локомоцией и увеличением частоты
щий препарат улиток после формирования ДС,
сердечных сокращений, что напоминало защит-
наблюдается недостоверное увеличение (гипер-
ную реакцию возбуждения, вызванную повре-
поляризация на 2.5 мВ) как мембранного потен-
ждающей стимуляцией [33].
циала относительно уровня Vm улиток после сен-
Известно, что аппликация 5-HT вызывает эф-
ситизации: с -55.1 ± 0.7 мВ до -57.6 ± 1.1 мВ,
фекты, сходные с облегчением дегабитуирующих
p < 0.05, n = 11, так и порогового потенциала: с
и сенситизирующих стимулов на нервную сеть,
14.7 ± 0.5 до 15.5 ± 0.7 мВ, n = 10) (рис. 1 и 2). Если
лежащую в основе оборонительного ответа. По-
рассматривать изменение мембранного потенци-
средством аппликаций 5-HT в омывающий цен-
ала в результате аппликации 5-HTP относительно
тральную нервную систему раствор также удается
уровня Vm несенситизированных улиток, то это
воспроизвести электрофизиологические корре-
будет деполяризация на 3.5 мВ.
ляты пластичности. В ряде экспериментов, в том
числе и с нашим участием, были показаны мем-
бранные корреляты пластичности [10, 40-42].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Было высказано предположение, что изменение
Серотонин - один из основных медиаторов,
возбудимости ключевых компонентов (сенсор-
обеспечивающих нейромодуляцию [13, 30, 31].
ных и командных нейронов) является одним из
Он является медиатором в синаптической пере-
важных компонентов обучения и сенситизации
даче, но, кроме того, может выполнять и интегра-
[3, 43, 44]. Нами в проведенных исследованиях
тивные функции при выделении его во внекле-
найдено, что аппликация 5-НТ и 5-HTP вызывает
точную среду [32-34]. Существует концепция [31,
достоверное снижение (на 3.7 и 3.1 мВ как резуль-
35] о том, что важнейшую роль в механизмах па-
тат аппликации 5-НТ и 5-HTP соответственно)
мяти у моллюсков играет объемная (внесинапти-
мембранного потенциала премоторных интер-
ческая) передача 5-HT. Д.А. Сахаров с сотрудни-
нейронов интактных улиток, что демонстрирует
ками предположил, что динамическими флюкту-
повышение возбудимости этих нейронов. Это,
ациями содержания нейроактивных молекул
вероятно, происходит за счет активации серото-
(прежде всего 5-HT у моллюсков) в локальной
ниновых рецепторов первого типа, которые при-
межклеточной среде определяются физиологиче-
сутствуют на соме премоторных интернейронов
ские свойства и рецепторный профиль индивиду-
улитки [20, 45]. Также найдено недостоверное
альных нейронов и, таким образом, характер их
увеличение Vt на 1 мВ.
самоорганизации в паттерн-генерирующий ан-
самбль [32, 35, 36]. Показано также, что значи-
Таким образом, нами было показано, что при
тельное количество 5-HT может выделяться во
аппликации серотонина в раствор, омывающий
внесинаптическую среду при долговременной
препарат, происходит деполяризация мембраны
синаптической активности [37]. Известно, что
премоторных интернейронов одновременно с не-
множественные киназные каскады вносят вклад
достоверным увеличением порогового потенциа-
в индуцированное серотонином кратковремен-
ла как у интактных, так и у сенситизированных
ное синаптическое облегчение, включая проте-
улиток. Реакция премоторных интернейронов на
инкиназу A и протеинкиназу C [38]. Исследова-
аппликацию предшественника синтеза серото-
ния клеточных культур показали, что серотонин
нина 5-HTP в раствор, омывающий препарат,
индуцирует фосфорилирование фактора тран-
противоположная: совершенно другая: деполя-
БИОФИЗИКА том 68
№ 4
2023
722
БОГОДВИД и др.
ризация мембраны у инактных улиток и гиперпо-
16. J. Levenson, J. N. Byrne, and A. Eskin, J. Neurosci., 19
ляризация мембраны (недостоверная) у сенсити-
(18), 8094 (1999).
зированных улиток при недостоверном увеличе-
17. D. L. Glanzman, S. L. Mackey, R. D. Hawkins, et al.,
нии порогового потенциала.
J. Neurosci., 12, 4200 (1989).
18. Х. Л. Гайнутдинов, В. В. Андрианов и Т. Х. Гайнут-
динова, Журн. высш. нервн. деятельности, 49 (1),
ФИНАНСИРОВАНИЕ РАБОТЫ
48 (1999).
Работа поддержана Программой стратегиче-
19. Y. Totani, J. Nakai, D. Hatakeyama, et al., Nutr. Neu-
ского академического лидерства Казанского фе-
rosci.,
26
(3),
217
(2023).
DOI:
дерального университета (ПРИОРИТЕТ-2030).
10.1080/1028415X.2022.2033045.
20. М. С. Абрамова, В. Л. Нистратова, А. А. Москви-
тин и др., Журн. высш. нервн. деятельности, 55 (3),
КОНФЛИКТ ИНТЕРЕСОВ
385 (2005).
Авторы заявляют об отсутствии конфликта
21. T. Kh. Bogodvid, V. V. Andrianov, I. B. Deryabina,
интересов.
et al., Front. Cell. Neurosci., 11, 403, (2017). DOI:
10.3389/fncel.2017.00403
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
22. Т. Х. Гайнутдинова, В. В. Андрианов, Р. Р. Назы-
рова и др., Журн. высш. нервн. деятельности, 49
Настоящая работа не содержит описания ис-
(6), 1063 (1999).
следований с использованием людей и животных
23. Х. Л. Гайнутдинов и Н. А. Береговой, Журн. высш.
в качестве объектов.
нерв. деятельности, 44 (2), 307 (1994).
24. V.P. Nikitin, S.V.Solntseva, S.A. Kozyrev, et al., Be-
СПИСОК ЛИТЕРАТУРЫ
havioural Brain Res.
345,
72
(2018). DOI:
10.1016/j.bbr.2018.02.036
1.
R. D. Hawkins, E. R. Kandel, and C. H. Bailey, Biol.
25. I.B. Deryabina, L.N. Muranova, V.V. Andrianov, et al.,
Bull., 210 (3), 174 (2006).
Int. J. Mol. Sci.
21,
2087
(2020). DOI:
2.
П. М. Балабан и Т. А. Коршунова, Успехи физиол.
10.3390/ijms21062087
наук, 42 (4), 3 (2011).
26. П. М. Балабан и И. С. Захаров, Обучение и развитие -
3.
Х. Л. Гайнутдинов, В. В. Андрианов и Т. Х. Гайнут-
основа двух явлений (Наука, М., 1992).
динова, Успехи физиол. наук, 42 (1), 33 (2011).
27. Б. И. Ходоров, Проблема возбудимости (Медицина,
4.
V. F. Castellucci, W. N. Frost, P. Goelet, et al., J. Phy-
Л., 1969).
siol. (Paris), 81, 349 (1986).
28. Д. И. Силантьева, В. В. Андрианов, Т. Х. Гайнут-
5.
Н. А. Береговой, Х. Л. Гайнутдинов, О. Г. Сафро-
динова и Х. Л. Гайнутдинов, Журн. высш. нервн.
нова и др., Журн. высш. нервн. деят., 40 (3), 594
деятельности, 58 (2), 183 (2008).
(1990).
29. A. W. Chihab, V. V. Andrianov, T. K. Bogodvid, et al.,
6.
S. Herdegen, C. Conte, S. Kamal, et al., PLoS One, 9
BioNanoScience,
11,
238
(2021).
DOI:
(12),
e114481
(2014).
DOI:
10.1371/jour-
10.1007/s12668-020-00814-1
nal.pone.0114481
30. R. Gillette, Integr. Comp. Biol., 46, 838 (2006).
7.
G. T. Philips, C. M. Sherff, S. A. Menges, et al., Lear-
ning & Memory,
18
(4),
272
(2011). DOI:
31. В. Н. Иерусалимский и П. М. Балабан, Журн.
10.1101/lm.2125311
высш. нервн. деятельности, 60 (5), 515 (2010).
8.
Х. Л. Гайнутдинов, В. В. Андрианов, Т. Х. Гайнут-
32. Д. А. Сахаров, Журн. общ. биологии, 51 (4), 437
динова и др., Журн. высш. нерв. деятельности, 48
(1990).
(6), 1004 (1998).
33. S. Marinesco, N. Wickremasinghe, K. E. Kolkman,
9.
L. J. Cleary, W. L. Lee, and J. H. Byrne, J. Neurosci.,
et al., J. Neurophysiol., 92, 2487 (2004).
18, 5988 (1998).
34. K. Bonnick, K. Bayas, D. Belchenko, et al., PLoS One,
10.
R. Mozzachiodi, F. D. Lorenzetti, D. A. Baxter, et al.,
7
(10), e47378
(2012).
DOI:
10.1371/jour-
Nature Neurosci., 11, 1146 (2008).
nal.pone.0047378
11.
I. Jin, S. Kassabov, E. R. Kandel, et al., Learning &
35. Д. А. Сахаров, Журн. общ. биологии, 73 (5), 324
Memory, 28, 218 (2021). DOI: 10.1101/lm.053124.120
(2012).
12.
P. M. Balaban, A. Vehovzsky, O. A. Maksimova, et al.,
36. V. Dyakonova, L. Hernádi, E. Ito, et al., Biophysics,
Brain Res., 404, 201 (1987).
11, 55 (2015).
13.
В. Е. Дьяконова, Успехи физиол. наук, 38 (3), 3
37. C. Leon-Pinzon, M. G. Cercós, P. Noguez, et al.,
(2007).
Front. Cell. Neurosci., 8 (169), 169 (2014). DOI:
14.
J. Il-Han, T. Janes, and K. Lukowiak, J. Exp. Biol.,
10.3389/fncel.2014.00169
213, 3603 (2010).
38. N. G. Jin and T. Crow, J. Neurophysiol. 106, 2557
15.
V. V. Andrianov, T. Kh. Bogodvid, I. B. Deryabina,
(2011).
et al., Front. Behav. Neurosci., 9, 279, (2015).
39. E. R. Kandel, Science, 294, 1030 (2001).
БИОФИЗИКА том 68
№ 4
2023
ОТЛИЧИЕ ОТВЕТОВ ПРЕМОТОРНЫХ ИНТЕРНЕЙРОНОВ
723
40. Н. А. Береговой и Х. Л. Гайнутдинов, Докл. АН
43. W. Zhang and D. J. Linden, Nature Rev. Neurosci., 4,
СССР, 301 (4), 989 (1988).
885 (2003).
41. D. Debanne and M.-M. Poo, Front. Synap. Neurosci.,
44. E. S. Nikitin, P. M. Balaban, and G. Kemenes, Curr.
2 (21), 1 (2010).
Biol., 23, 614 (2013).
42. J. Farruggella, J. Acebo, L. Lloyd, et al., Behav. Brain
45. А. С. Пивоваров и В. Л. Нистратова, Бюл. экспе-
Res., 360, 341 (2019). DOI: 10.1016/j.bbr.2018.12.010
рим. биологии и медицины, 136 (2), 114 (2003).
Differences in Responses of Premotor Interneurons to Serotonin
and 5-Hydroxytryptophan, a Precursor for Serotonin Synthesis,
in Naive and Trained Snails
T.K. Bogodvid*, **, V.V. Andrianov*, L.N. Muranova*, and Kh.L. Gainutdinov*
*Institute of Fundamental Medicine and Biology, Kazan Federal University, Kremlevskaya ul. 18, Kazan, 420008 Russia
**Volga Region State University of Physical Culture, Sport and Tourism, Universiade village 35, Kazan, 420010 Russia
This study investigated the responses of premotor interneurons LPa3 and RPa3 of the snails to applications
of serotonin and 5-hydroxytryptophan (5-HTP), a precursor for serotonin synthesis, as ingredients of the
broth that bathes the central nervous system of naive snails and snails after the formation of long-term sensi-
tization. Measurements of the electrical characteristics have shown that a membrane potential of interneu-
rons LPa3 and RPa3 in naive snails was significantly depolarized (3.7 mV) in the presence of serotonin, while
the threshold potential was increased (unsupported hypothesis). The similar pattern was observed in the pres-
ence of 5-hydroxytryptophan: true depolarization to 3.1 mV occurred in interneurons until reaching the un-
reliable rise in the threshold potential inducing an action potential. It was found that application of serotonin
causes a significant decrease in the membrane potential of interneurons LPa3 and RPa3 of trained snails (de-
polarization to 4.6 mV) and the unreliable increase in the threshold potential of premotor interneurons
(0.9 mV). In contrast, application of 5-hydroxytryptophan causes an unreliable increase (2.5 mV) of the
membrane potential and also an unreliable increase (0.8 mV) in the threshold potential.
Keywords: serotonin, 5-hydroxytryptophan, long-term sensitization, membrane potential, threshold potential
БИОФИЗИКА том 68
№ 4
2023