БИОФИЗИКА, 2023, том 68, № 4, с. 724-729
БИОФИЗИКА КЛЕТКИ
УДК 577.3
ВОЗРАСТНЫЕ ОСОБЕННОСТИ ВЛИЯНИЯ СТИМУЛЯЦИИ
α2-АДРЕНОРЕЦЕПТОРОВ НА ЭЛЕКТРИЧЕСКУЮ АКТИВНОСТЬ
КАРДИОМИОЦИТОВ КРЫСЫ
© 2023 г. А.М. Галиева*, #, Н.И. Зиятдинова*, Н. Мансур*, Л.И. Фасхутдинов*, Т.Л. Зефиров*
*Казанский (Приволжский) федеральный университет, Кремлевская ул., 18, Казань, 420008, Россия
#E-mail: galieva_alina94@mail.ru
Поступила в редакцию 15.02.2023 г.
После доработки 27.03.2023 г.
Принята к публикации 03.05.2023 г.
Изучено влияние агониста α2-адренорецепторов клонидина гидрохлорида на параметры
электрической активности миокарда предсердий при навязанном ритме. Клонидин гидрохлорид в
рабочих кардиомиоцитах с навязанным ритмом вызывает уменьшение длительности потенциала
действия на уровне 50 и 90% у взрослых крыс. У недельных и трехнедельных крыс данный агонист
вызывает увеличение длительности потенциала действия на уровне 50 и 90%.
Ключевые слова: α2-адренорецепторы, сердце, электрофизиология.
DOI: 10.31857/S0006302923040129, EDN: KLKWEN
ми или трансгенной сверхэкспрессией соот-
Адренергические рецепторы (АР, также из-
ветствующих генов in vivo [2].
вестны как адренорецепторы) относятся к супер-
семейству гуанин-нуклеотид-связывающих G-бе-
Однако первые препараты, вызывающие фар-
лок-связанных рецепторов и являются мембран-
макологический эффект при воздействии на ад-
ными рецепторами, которые активируют гетеро-
ренорецепторы, были разработаны и введены в
тримерные G-белки после связывания лиганда.
медицинскую терапию еще за несколько десяти-
Данные рецепторы состоят из одного внеклеточ-
летий до этих открытий. Агонист α2-адреноре-
ного N-концевого домена, семи трансмембран-
цепторов клонидин был разработан в начале
ных доменов, трех внутри- и трех внеклеточных
1960-х годов. Он стал первым клинически ис-
петель и одного внутриклеточного С-концевого
пользуемым селективным агонистом α2-АР [3].
хвоста. Эти гептахелические трансмембранные
Клонидин вызывает ряд фармакологических дей-
сенсоры составляют около 4% всего генома, ко-
ствий, большинство из которых до сих пор ис-
дирующего белки, и считаются наиболее важны-
пользуются в современной терапии, включая се-
ми лекарственными мишенями в медицине и фи-
дативное воздействие, гипноз, симпатическое
зиологии. G-белки обычно стимулируют (через
торможение, гипотензию, анальгезию, снижение
Gs-белок) или ингибируют (через Gi-белок) фер-
внутриглазного давления [4]. Однако большой
мент аденилатциклазу или активируют (через Gq-
спектр клинических эффектов клонидина огра-
белок) фосфолипазу С.
ничивает его более широкое применение в кли-
нической медицине. В частности, побочные эф-
Семейство адренорецепторов включает в себя
фекты на сердечно-сосудистую систему, а имен-
девять членов, которые можно классифициро-
но гипотония и брадикардия, а также седативный
вать по трем различным подгруппам, содержа-
эффект являются ограничениями для примене-
щим три подтипа α1-АР (α1A, α1B и α1D), три
ния клонидина в других областях медицины [5].
подтипа α2-АР (α2A, α2B и α2C) и три подтипа
В настоящее время выделено три подтипа
β-АР (β1, β2 и β3) [1]. Физиологические и фарма-
α2-АР: α2A-, α2B- и α2CАР. Существование не-
кологические функции отдельных подтипов ре-
большого количества α2АР в сердце человека бы-
цепторов в основном были раскрыты путем со-
ло продемонстрировано методами молекулярной
здания отдельных моделей с целевыми делеция-
биологии. Поэтому неудивительно, что рецепто-
Сокращения: АР - адренергические рецепторы, ПД -
ры данного подтипа в сердце человека изучены
потенциал действия.
недостаточно [6].
724
ВОЗРАСТНЫЕ ОСОБЕННОСТИ ВЛИЯНИЯ СТИМУЛЯЦИИ
725
Несколько групп исследователей продемон-
перфузии [14]. Подобные наблюдения указывают
стрировали, что α2АР играют важную роль в пре-
на функциональную роль α2-АР в сердечной тка-
синаптической регуляции высвобождения норад-
ни, где они могут участвовать в регуляции пери-
реналина в сердце человека. Так, существование
ферического адренергического ответа. Посколь-
пресинаптических α2АР, ингибирующих высво-
ку вклад постсинаптических α2-АР остается не-
бождение норадреналина, было прямо продемон-
достаточно изученным, ряд исследователей
стрировано ex vivo в изолированном правом пред-
считает необходимым переоценку функциональ-
сердии человека и косвенно in vivo при системном
ной роли этих рецепторов в клетках миокарда.
и внутрикоронарном применении фентоламина
В то время как β-АР и α1-АР непосредственно
[7]. В этом контексте интересно отметить, что
участвуют в регуляции сократительной активно-
влияние фентоламина на уровень норадреналина
сти миокарда [15], традиционно считалось, что
в плазме крови было гораздо более выраженными
α2-АР играют ограниченную роль в сердце. В
у пациентов с сердечной недостаточностью (у ко-
первую очередь было обнаружено, что агонисты
торых повышена симпатическая активность), чем
α2-АР действуют в коронарных артериях и сер-
у здоровых людей. Однако до сих пор остается
дечных нервах, но не в самом миокарде [16].
спорным утверждение о том, что пресинаптиче-
Фактически экспрессия поли(А)+РНК α2A,
ские α2-АР, присутствующие в сердце человека,
α2B и α2C в сердце крыс была незначительной по
являются α2ААР или α2САР [8].
сравнению с уровнем этих рецепторов в нейро-
В зависимости от расположения α2-адреноре-
нах, тканях почек, печени или аорты [17]. Однако
цептора и нейромедиатора, высвобождение кото-
более поздние исследования с использованием
рого модулируется этими рецепторами, были
вестерн-блоттинга выявили экспрессию белков
введены термины «ауторецепторы» и «гетероре-
всех трех α2-рецепторов в сердце крыс, но в желу-
цепторы». Под
«ауторецепторами» понимают
дочковых миоцитах были обнаружены только
α2-адренорецепторы, которые расположены в
α2A-АР и α2C-АР [18]. У человека распределение
пресинаптической мембране адренергических
мРНК α2-АР в целом отличается от такового у
нейронов и ингибируют экзоцитоз нейротранс-
крысы, а ткани желудочков характеризуются пре-
миттеров, норадреналина или адреналина, дей-
имущественным присутствием α2C и отсутствием
ствуя как часть петли обратной отрицательной
мРНК α2A [19]. Идентифицированная экспрес-
связи [9].
сия изоформ α2-АР в клетках миокарда безуслов-
α2-АР подавляют симпатический и надпочеч-
но заслуживает внимания и указывает на потен-
никовый выброс катехоламинов по короткой об-
циальный вклад этих рецепторов в регуляцию
ратной связи и, таким образом, в целом ингиби-
миокарда.
руют симпатоадренергические воздействия [10].
Таким образом, α2-АР в основном участвуют в
Вопреки парадигме, согласно которой α2-АР
антиноцицептивном, седативном, центральном
оказывают минимальное прямое воздействие на
гипотензивном, гипотермическом и поведенче-
кардиомиоциты, недавние исследования с изоли-
ском действии специфических агонистов [11].
рованными желудочковыми кардиомиоцитами
крысы выявили не только наличие всех трех под-
Поскольку постоянная симпатическая стиму-
типов α2А-АР, α2B-АР и α2C-АР как на уровне
ляция сердца была связана с дезадаптивным ре-
моделированием сердца, а также с развитием и
экспрессии мРНК, так и на уровне белка, но так-
прогрессированием сердечной недостаточности,
же выявили их ранее непризнанный кардиопро-
нарушение функции α2-АР рассматривается как
текторный потенциал [20]. Кроме того, было
риск возникновения и развития сердечно-сосу-
определено, что α2-АР экспрессируются как в
дистых заболеваний. Действительно, избыточная
процессе эмбрионального развития сердца, так и
смертность у мышей, лишенных изоформ α2A и
во взрослом возрасте у мышей, а также в кардио-
миоцитах, дифференцированных in vitro из эм-
α2C, объяснялась повышением уровня циркули-
бриональных стволовых клеток [21]. Экспрессия
рующих катехоламинов, усугублением гипертро-
α2-адренергических рецепторов (α2-АР) очень
фии левого желудочка, фиброзом и развитием
высока в сердце плода крыс, хотя их количество
сердечной недостаточности [12]. Однако целена-
снижается с увеличением срока беременности.
правленное восстановление изоформ этих рецеп-
Экспрессия α2A и α2C, но не α2B, была подтвер-
торов в симпатических нейронах обеспечило
ждена в популяции миоцитов с помощью непря-
лишь частичное восстановление реакции левого
мой иммунофлуоресцентной микроскопии с под-
желудочка на внутривенное введение агонистов
тип-специфическими антителами и методом ве-
α2-АР [13]. В то же время прекондиционирование
стерн-блоттинга. Селективный агонист α2-АР и
с использованием агониста α2-АР дексмедетоми-
дина способствует фосфорилированию Erk1/2,
норадреналин увеличивали организацию актино-
Akt и eNOS в миоцитах левого желудочка и улуч-
вого цитоскелета, и это увеличение блокирова-
шает восстановление сердца после ишемии/ре-
лось селективным антагонистом α2-АР атипаме-
БИОФИЗИКА том 68
№ 4
2023
726
ГАЛИЕВА и др.
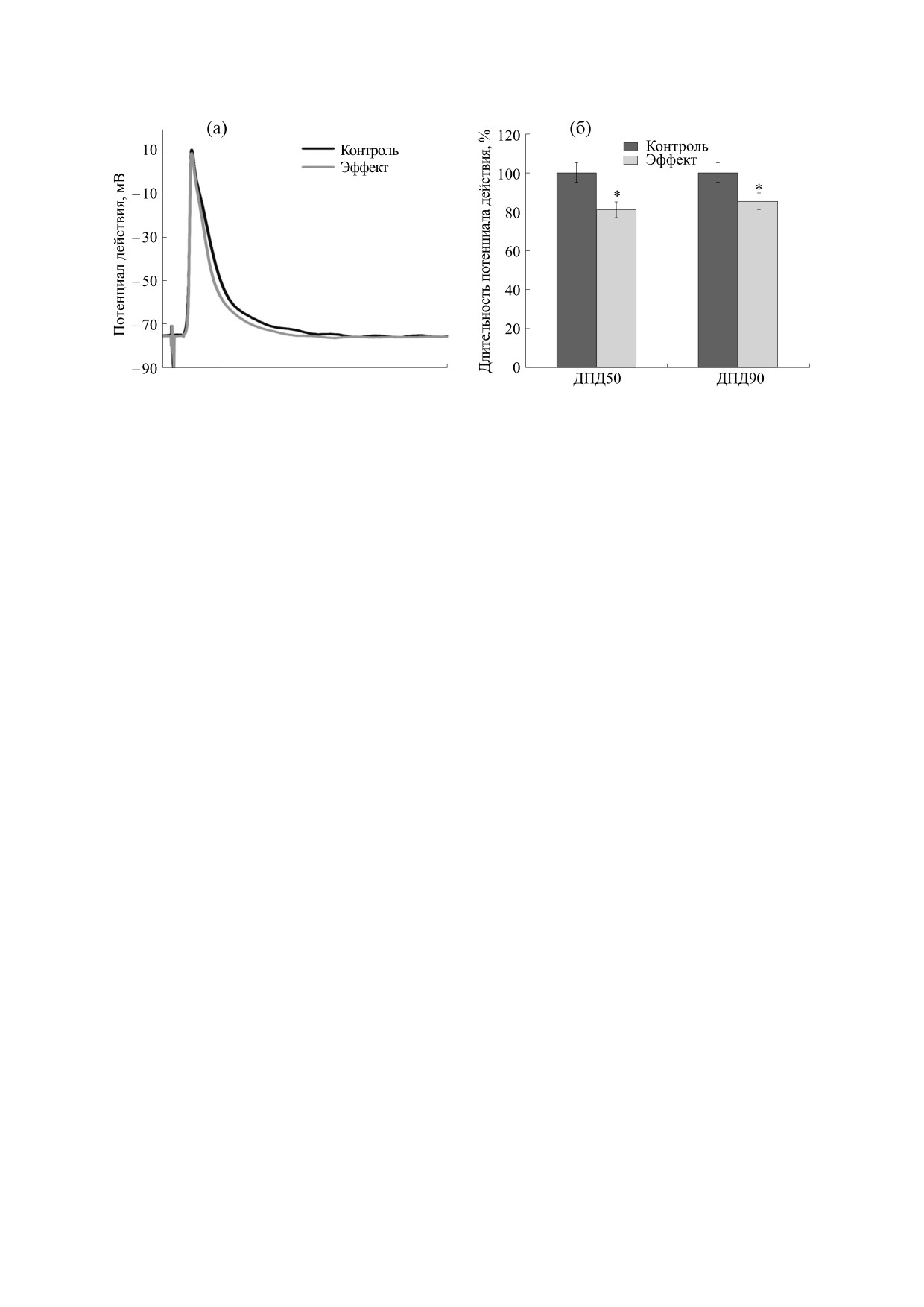
Рис. 1. (а) - Влияние клонидина гидрохлорида (10-6 М) на длительность потенциала действия миокарда предсердия с
навязанным ритмом у взрослых крыс; (б) - влияние клонидина гидрохлорида (10-6 М) на длительность потенциала
действия на уровне 50% (p < 0.05) и 90% (p < 0.05) миокарда предсердия с навязанным ритмом у взрослых крыс.
золом. Кроме того, дексмедетомидин ингибиро-
вязанном ритме c частотой
5 Гц. Внешнее
вал стимулируемое изопротеренолом накопление
раздражение осуществляли через платиновые
цАМФ в изолированном сердце плода крысы, и
электроды. Полученные записи электрической
это блокировалось раувольцином. Следователь-
активности миокарда анализировали с помощью
но, функциональные подтипы α2A и α2B присут-
оригинальной программы Elph 3.0. Раствор аго-
ствуют в сердце эмбриональной крысы, где они
ниста α2-адренорецепторов клонидина гидро-
могут играть определенную роль в развитии
хлорида (10-6 М) подавали в течение 20 мин. Ис-
сердца.
следовали следующие параметры потенциала
Все вышесказанное указывает на то, что α2-АР
действия (ПД): мембранный потенциал, длитель-
ность фазы деполяризации, амплитуда потенциа-
могут быть вовлечены в механизмы регуляции
ла действия и длительность потенциала действия
сердца и могут служить потенциальными мише-
на уровне 50% (ДПД50%) и 90% (ДПД90%) репо-
нями в терапии сердечно-сосудистых заболева-
ляризации. Длительность фазы реполяризации
ний [22].
рассчитывали как время от пика ПД до спада ПД
на уровне 50% и 90% [23]. Достоверность разли-
МАТЕРИАЛЫ И МЕТОДЫ
чий рассчитывали по t-критерию Стьюдента
(p < 0.05).
Исследование было проведено на белых лабо-
раторных крысах в возрасте 1 неделя (n = 7), 3 не-
дели (n = 9) и 16 недель (n = 7) с учетом биоэтиче-
РЕЗУЛЬТАТЫ
ских норм. В качестве наркоза использовали
25%-й раствор уретана из расчета 1.2 г/кг массы
Агонист α2-адренорецепторов клонидин гид-
животного, который вводили внутрибрюшинно.
рохлорид в концентрации 10-6 М не вызывал до-
Наркотизированным животным вскрывали груд-
стоверных изменений значений мембранного по-
ную клетку, сердце быстро извлекали и помещали
тенциала, длительности фазы деполяризации и
в чашку Петри с раствором Тироде (Sigma-Al-
амплитуды потенциала действия во всех исследо-
drich, США), в состав которого входили 7.54 г/л
ванных возрастных группах животных.
NaCl, 0.3 г/л КСl; 0.134 г/л СаС12, 0.06 г/л MgSO4,
0.14г/л NaH2PO4, 1.68 г/л NaHCO3, 0.9 г/л глюко-
Аппликация клонидина гидрохлорида в кон-
зы (37°С, рН 7.4). Раствор обогащали карбогеном
центрации 10-6 М приводила к уменьшению дли-
в течение всего эксперимента (95% О2 и 5% СО2).
тельности потенциала действия на уровне 50%
Сердце препарировали и изготавливали много-
реполяризации у взрослых крыс с 8.88 ± 0.80 мс
клеточный препарат с ушком правого предсер-
до 7.9 ± 0.18 мс (p < 0.05), что составило 19.12%
дия, поперечным гребешком и фрагментами
(рис. 1а,б). У трехнедельных и однонедельных
верхней и нижней полой вен. Электрическую ак-
крысят указанная концентрация, наоборот, вы-
тивность кардиомиоцитов изучали с использова-
зывала удлинение ДПД50% с 6.18 ± 0.74 мс до
нием внутриклеточного микроэлектродного от-
8.12 ± 0.94 мс (p < 0.05) у трехнедельных и с
ведения на препарате правого предсердия при на-
20.15 ± 3.27 мс до 23.98 ± 2.98 мс (p < 0.05) у не-
БИОФИЗИКА том 68
№ 4
2023
ВОЗРАСТНЫЕ ОСОБЕННОСТИ ВЛИЯНИЯ СТИМУЛЯЦИИ
727
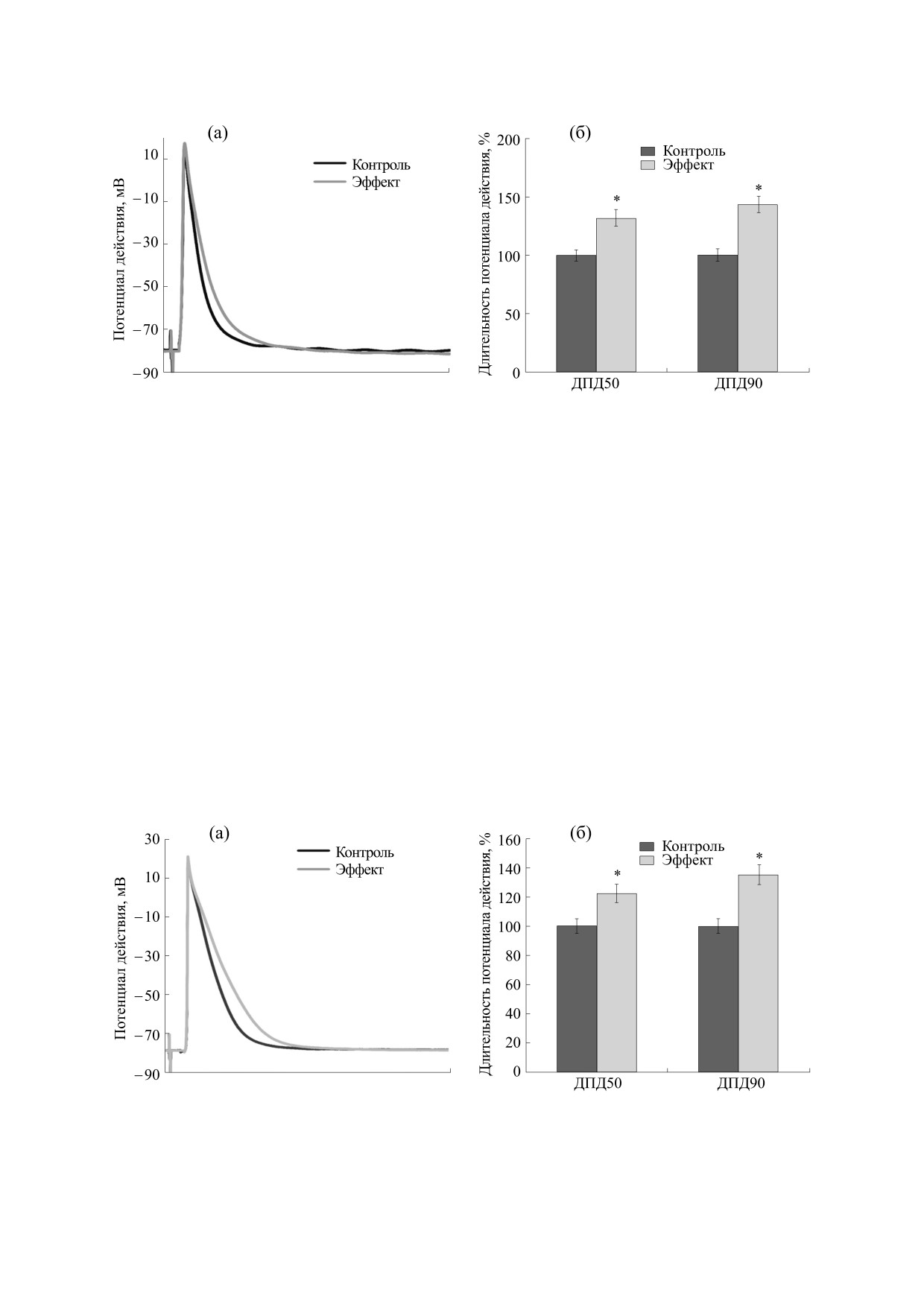
Рис. 2. (а) - Влияние клонидина гидрохлорида (10-6 М) на длительность потенциала действия миокарда предсердия с
навязанным ритмом у трехнедельных крысят; (б) - влияние клонидина гидрохлорида (10-6 М) на длительность
потенциала действия на уровне 50% (p < 0.05) и 90% (p < 0.05) миокарда предсердия с навязанным ритмом у
трехнедельных крысят.
дельных крысят, т.е. на 32.47% (рис. 2а,б) и
поляризации в данных возрастных группах увели-
22.24% (рис. 3а,б) соответственно.
чивалась соответственно на 44.32% (рис. 2а,б) и
35.03% (рис. 3а,б).
Также было выявлено, что длительность по-
тенциала действия на уровне 90% у взрослых
крыс уменьшилась с
26.47
±
6.43 мс на
ВЫВОДЫ
22.24 ± 2.69 мс (p < 0.05), что составило 14.79%
В раннее проведенных исследованиях нами
(рис. 1а,б). Но у трехнедельных и однонедельных
было рассмотрено влияние клонидина гидрохло-
было выявлено удлинение данного параметра при
рида на параметры изолированного сердца и вы-
введении клонидина гидрохлорида в концентра-
явлено, что агонист α2-АР изменял частоту сер-
ции 10-6 М. У трехнедельных животных ДПД90%
дечных сокращений и коронарный поток изоли-
увеличивался с 16.63 ± 1.41 мс до 23.41 ± 1.57 мс
рованного сердца трехнедельных крыс.
(p < 0.05) мс, а у однонедельных крысят значение
Возможно, что стимуляция α2-АР приводит к ак-
данного показателя возрастало с 50.48 ± 8.28 мс
тивации ингибирующих G-белков и, как след-
до 66.41 ± 9.40 мс (p < 0.05). Таким образом, дли-
ствие, к возникновению брадикардии. Кроме то-
тельность потенциала действия на уровне 90% ре-
го, разнонаправленная динамика показателей ча-
Рис. 3. (а) - Влияние клонидина гидрохлорида (10-6 М) на длительность потенциала действия миокарда предсердия с
навязанным ритмом у недельных крысят; (б) - влияние клонидина гидрохлорида (10-6 М) на длительность потенциала
действия на уровне 50% (p < 0.05) и 90% (p < 0.05) миокарда предсердия с навязанным ритмом у недельных крысят.
БИОФИЗИКА том 68
№ 4
2023
728
ГАЛИЕВА и др.
стоты сердцебиения и коронарного потока
нию К+-тока, что может служить объяснением
изолированного сердца при введении клонидина
укорочения длительности реполяризации у
имеет концентрационную зависимость [24].
взрослых животных [28]. Особенности механиз-
В исследованиях влияния стимуляции α2-АР
мов удлинения реполяризации у крысят одно- и
на сократимость полосок миокарда предсердий
трехнедельного возраста могут служить предме-
новорожденных, трехнедельных и взрослых крыс
том дискуссии. Так или иначе, полученные ре-
было показано, что агонист α2-АР в концентра-
зультаты показывают, что эффекты стимуляции
ции 10-6 М оказывал отрицательный инотроп-
α2-АР зависят от активации различных уровней
ный эффект [25].
регуляции сердечной деятельности, что, без-
условно, следует учитывать при применении этих
Проведенные электрофизиологические иссле-
препаратов в терапии сердечно-сосудистых забо-
дования с постоянным навязанным ритмом поз-
леваний.
воляют сделать вывод о существенной роли
α2-АР в регуляции электрической активности ра-
бочих кардиомиоцитов. Стимуляция α2-адрено-
ФИНАНСИРОВАНИЕ РАБОТЫ
рецепторов неселективным агонистом в кардио-
Исследование выполнено при финансовой
миоцитах однонедельных, трехнедельных и
поддержке Российского научного фонда (грант
взрослых крыс с навязанным ритмом в концен-
трации 10-6 М приводила к разнонаправленному
эффекту длительности фазы реполяризации по-
тенциала действия, что, возможно, связано с воз-
КОНФЛИКТ ИНТЕРЕСОВ
растными особенностями каскадов внутрикле-
Авторы заявляют об отсутствии конфликта
точных посредников данного типа адренорецеп-
интересов.
торов сердца. Согласно литературным данным,
семисуточные крысята характеризуются отсут-
ствием симпатической влияний в сердце, у 21-су-
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
точных животных наблюдается пик частоты сер-
Все эксперименты на животных проводили в
дечных сокращений и начало формирования
соответствии с национальными и международ-
адренергической иннервации сердца, а у 100-су-
ными руководящими принципами по уходу и гу-
точных животных симпатическая иннервация
манному использованию животных.
сердца является полностью сформированной и
симпатические регуляторные воздействия приоб-
ретают черты, характерные для взрослых живот-
СПИСОК ЛИТЕРАТУРЫ
ных. Таким образом, нами рассматриваются жи-
1.
1.. B. Bylund, D. C. Eikenberg, J. P. Hieble, et al.,
вотные с различными уровнями развития симпа-
Pharmacol. Rev., 46, 121 (1994).
тической иннервации сердца [26].
2. M. Philipp and L. Hein, Pharmacol. Ther., 101, 65
Известно, что длительность фазы реполяриза-
(2004).
ции ПД в кардиомиоцитах зависит от выходящих
3. W. Hoefke and W. Kobinger, Arzneimittelforschung,
калиевых токов - IKur (сверхбыстрый выходящий
16, 1038 (1966).
ток задержанного выпрямления), Ito (транзитор-
4. R. D. Sanders and M. Maze Adrenergic and choliner-
ный выходящий ток), IKr и IKs (быстрый и мед-
gic compounds. In Handbook of experimental pharma-
ленный компоненты токов задержанного вы-
cology, Vol. 177. Analgesia, Ed. by C. Stein (Springer,
прямления) [27], IK1 (ток аномального выпрямле-
Heidelberg, 2007), pp. 251-264.
ния) и некоторые другие. Токи задержанного
5. R. Gilsbach, J. Albarran-Juarez, and L. Hein, Curr.
выпрямления протекают через потенциалзависи-
Topics in Membranes, 67, 139 (2011).
мые калиевые каналы. У человека и крысы дли-
6. O.-E. Brodde and M. C. Michel, Pharmacol. Rev., 51,
тельность фазы реполяризации ПД в основном
651 (1999).
определяется током IKr. Kалиевые каналы играют
7. S. Minatoguchi, H. Ito, K. Ishimura, et al., Am. Heart
важную роль в формировании потенциала покоя
J., 130, 516 (1995).
и потенциала действия в кардиомиоцитах. Кали-
8. O.-E. Brodde, H. Bruck, and K. Leineweber, J. Phar-
евые каналы, по сравнению с натриевыми и каль-
macol. Sci., 100, 323 (2006).
циевыми, наиболее разнообразны как в кардио-
9. K. Starke, J. Neurochem., 78, 685 (2001).
миоцитах, так и в мембранах других клеток. Сти-
10. A. U. Trendelenburg, W. Klebroff, L. Hein, and
муляция
α2-AR
может
активировать
K. Starke, Naunyn-Schmiedeberg’s Arch. Pharmacol.,
протеинкиназу C, что приводит к высвобожде-
364 (2), 117 (2001).
нию ионов Ca2+. Повышение внутриклеточного
11. J. Lähdesmäki, J. Sallinen, E. MacDonald, et al., Neu-
Ca2+ активирует Ca2+/кальмодулин-зависимую
roscience, 113 (2), 289 (2002). DOI: 10.1016/S0306-
киназу и протеинкиназу C; это приводит к усиле-
4522(02)00185-9
БИОФИЗИКА том 68
№ 4
2023
ВОЗРАСТНЫЕ ОСОБЕННОСТИ ВЛИЯНИЯ СТИМУЛЯЦИИ
729
12. M. Brede, G. Nagy, M. Philipp, et al., Mol. Endocri-
21. A. Martinez-Fernandez, T. J. Nelson, S. Reyes, et al.,
nol., 17 (8), 1640 (2003).
Circulation. Cardiovasc. Genetics, 7 (5), 667 (2014).
13. R. Gilsbach, J. Schneider, A. Lother, et al., Cardiovasc.
22. A. E. Alekseev, S. Park, O. Y. Pimenov, et al., Pharma-
Res., 86 (3), 432 (2010).
col. Therapeut., 197, 179 (2019).
23. A. A. Zverev, T. A. Anikina, N. G. Iskakov, et al., Bull.
14. Y. Yoshikawa, N. Hirata, R. Kawaguchi, et al, Anesthe-
Exp. Biol. Med., 165 (5), 610 (2018).
sia & Analgesia, 126 (2), 443 (2018).
24. А. М. Купцова, И. И. Хабибрахманов, А. М. Гали-
15. B.-E. Myagmar, J. M. Flynn, P. M. Cowley, et al., Circ.
ева и др., в Сб. тезисов III Международного конгрес-
Res., 120 (7), 1103 (2017).
са «Фундаментальная и клиническая электрофизио-
16. M. Hongo, S. Fujisawa, T. Adachi, et al., J. Pharmacol.
логия. Актуальные вопросы аритмологии» (2019),
Sci., 131 (2), 118 (2016).
сс. 65-66.
25. Л. И. Фасхутдинов, Н. И. Зиятдинова, Р. С. Кобза-
17. W. Lorenz, J. W. Lomasney, S. Collins, et al., Mol.
рев и Т. Л. Зефиров, Рос. кардиол. журн., № 27
Pharmacol., 38 (5), 599 (1990).
(S5), 113 2022.
18. M. Ibacache, G. Sanchez, Z. Pedrozo, et al., Biochim.
26. Ф. Г. Ситдиков и Т. Л. Зефиров, Лекции по возраст-
Biophys. Acta - Molecular Basis of Disease, 1822 (4),
ной физиологии сердца (ТГГПУ, Казань, 2006).
537 (2012).
27. С. А. Кодиров, В. Л. Журавлев, Т. А. Сафонова и
19. D. E. Berkowitz, D. T. Price, E. A. Bello, et al., J. Am.
др., Обзоры по клинич. и лекарств. фармакологии
Soc. Anesthesiol., 81 (5), 1235 (1994).
3 (4), 27 (2004).
20. Y. M. Kokoz, E. V. Evdokimovskii, A. V. Maltsev, et al.,
28. C. M. J. Tan, P. Green, N. Tapoulal, et al., Front.
J. Mol. Cell. Cardiol., 100, 9 (2016).
Physiol., 9, 1 (2018).
Age Peculiarities in the Effect of Stimulation of α2-Adrenergic Receptor on Electrical
Activity of Rat Cardiomyocytes
А.M. Galieva*, N.I. Ziyatdinova*, N. Mansour*, L.I. Fashutdinov*, and T.L. Zefirov*
*Kazan Federal University, Kremlevskaya ul. 18, Kazan, 420008 Russia
Clonidine hydrochloride, an agonist of the α2-adrenergic receptor, was tested for its effect on the parameters
of the electrical activity of the atrial myocardium induced by pacing. In the experimental rat cardiomyocyte
pacing model, clonidine hydrochloride caused a decrease (approximately 50% and 90%) in action potential
duration in adult rats. Treatment of one- and three-week-old rats with this agonist led to an increase (around
50% and 90%) in action potential duration
Keywords: α2-adrenergic receptors, heart, electrophysiology
БИОФИЗИКА том 68
№ 4
2023