БИОФИЗИКА, 2023, том 68, № 4, с. 761-769
БИОФИЗИКА CЛОЖНЫX CИCТЕМ
УДК 577.334
РАДИОМИТИГАТОРНЫЕ СВОЙСТВА α-ЛИПОЕВОЙ КИСЛОТЫ
ПРИ ИЗОЛИРОВАННОМ И СОЧЕТАННОМ С МЕТФОРМИНОМ
ИЛИ ЭТИЛМЕТИЛГИДРОКСИПИРИДИНА СУКЦИНАТОМ
(МЕКСИДОЛОМ) ПРИМЕНЕНИИ У МЫШЕЙ
ПОСЛЕ РЕНТГЕНОВСКОГО ОБЛУЧЕНИЯ
© 2023 г. Е.Е. Карманова*, **, #, А.В. Черников*, А.М. Усачева*, В.И. Брусков*
*Институт теоретической и экспериментальной биофизики РАН,
ул. Институтская, 3, Пущино Московской области, 142290, Россия
**Институт биофизики клетки - обособленное подразделение Федерального исследовательского центра
«Пущинский научный центр биологических исследований РАН»,
Институтская ул., 3, Пущино Московской области, 142290, Россия
#E-mail: silisti@bk.ru
Поступила в редакцию 21.12.2022 г.
После доработки 21.12.2022 г.
Принята к публикации 17.01.2023 г.
Исследованы радиомитигаторные свойств α-липоевой кислоты и использование ее совместно с
метформином и мексидолом (этилметилгидроксипиридина сукцинатом) при остром рентгенов-
ском облучении животных. Изучение радиационных повреждений ДНК полихроматофильных
эритроцитов красного костного мозга мышей с помощью микроядерного теста показало, что α-ли-
поевая кислота обладает генопротекторными и радиомитигаторными свойствами in vivo. Исследо-
вание 30-суточной выживаемости мышей при облучении в летальной дозе подтвердило, что α-ли-
поевая кислота обладает радиомитигаторными свойствами. Радиомитигаторное действие α-липое-
вой кислоты является концентрационно-зависимым, причем более эффективны низкие дозы
препарата. При сочетанном с мексидолом и метформином действии радиомитигаторные свойства
α-липоевой кислоты ослабляются.
Ключевые слова: липоевая (тиоктовая) кислота, рентгеновское излучение, генопротектор, радиомити-
гатор.
DOI: 10.31857/S0006302923040178, EDN: KMZNJH
С началом использования ядерных технологий
билизаторы [2]. Из этих групп наиболее изучены
радиопротекторы, которые являются перехватчи-
и в настоящее время актуальной является пробле-
ками свободных радикалов, генерируемых иони-
ма защиты человека от облучения ионизирую-
зирующим излучением, и уменьшают его повре-
щим излучением. Активное развитие атомной
ждающие действие. Их вводят в момент облуче-
энергетики и ядерной медицины, исследование
ния или незадолго до него. Радиомитигаторы
космоса требуют наличия различных способов
являются терапевтическими соединениями, при-
предупреждения радиационного поражения че-
меняемыми для нейтрализации и компенсации
ловека. Кроме того, существование ядерного ору-
повреждений после облучения, как в ближайшее
жия и риск радиологического терроризма делают
время, так и в отдаленный от облучения период.
проблему поиска эффективных противолучевых
Известных радиомитигаторов гораздо меньше,
препаратов еще более важной. В настоящее время
чем радиопротекторов, и большинство из них на-
существует несколько групп радиомодулирую-
ходится только на начальных стадиях клиниче-
щих веществ: радиопротекторы, радиомитигато-
ских испытаний. Кроме того, они не всегда доста-
ры [1, 2], терапевтические агенты и радиосенси-
точно эффективны или имеют побочные эффек-
Сокращения: ЛК
- α-липоевая (тиоктовая) кислота,
ты [2].
ЭМГПС - этилметилгидроксипиридина сукцинат (мекси-
Критическими характеристиками эффектив-
дол), МФ - метформин, ПХЭ - полихроматофильные
эритроциты, LD -летальная доза, СПЖ - средняя продол-
ного радиомитигатора являются его антиокси-
жительность жизни.
дантные, иммуномодулирующие, противовоспа-
761
762
КАРМАНОВА и др.
лительные, антистрессорные свойства и эффек-
и воспалительных биомаркеров [19]. Ранее в ряде
тивность перехвата свободных радикалов [2-4].
работ было продемонстрировано радиозащитное
Актуальным является поиск радиозащитных те-
действие липоевой кислоты [20-23]. ЛК как
рапевтических средств среди лекарственных пре-
in vitro, так и in vivo проявляет антиоксидантную
паратов, которые уже широко применяются в ме-
[20, 24] и генопротекторную [21, 24] активности.
дицинской практике для лечения различных за-
Показано радиомитигаторное действие ЛК in vivo
болеваний. Токсичность таких препаратов,
как при монотерапии [22, 23], так и в комплексе с
возможные побочные эффекты их применения
другими антиоксидантами [20], но не в тесте на
хорошо изучены, для них также известны тера-
выживаемость [21].
певтические дозы и противопоказания.
При поиске потенциальных радиомитигато-
В основе негативного действия ионизирующе-
ров среди лекарственных препаратов нами ранее
го излучения на биообъекты лежат повреждения
были исследованы этилметилгидроксипиридина
макромолекул, образование активных форм кис-
сукцинат и метформин. Этилметилгидроксипи-
лорода [5, 6], нарушение антиоксидантной защи-
ридина сукцинат (ЭМГПС, мексидол) - отече-
ты клеток и редокс-гомеостаза. Это, в свою оче-
ственное лекарственное средство, обладающее
редь, приводит развитию окислительного стрес-
антиоксидантной и антигипоксической активно-
са, который является одной из основных причин
стью [25]. Есть данные о его успешном примене-
развития мутагенеза, онкогенеза, метаболическо-
нии в комбинированной терапии опухолей [26],
го синдрома, нейродегенеративных процессов и
нейродегенеративных процессов [27] и в качестве
старения. Поэтому перспективен поиск потенци-
радиозащитного агента [28]. Метформин (МФ,
альных радиомитигаторов среди препаратов, для
1,1-диметилбигуанидина гидрохлорид) - фарма-
которых показано системное редокс-модулирую-
цевтический препарат, давно и успешно приме-
щее и плейотропное действие на организм.
няемый для лечения сахарного диабета 2 типа, в
последнее время предлагается в качестве радио-
Одним из таких препаратов является α-липое-
модулятора при лучевой терапии опухолей и дру-
вая кислота (ЛК, тиоктовая кислота, (R-5-(1,2-
гих патологий [29, 30]. Ранее нами были получе-
дитиолан-3-ил)пентановая кислота) - восьмиуг-
ны данные об антиоксидантных и генопротектор-
леродный дисульфид, являющийся антиокси-
ных свойствах ЭМГПС и МФ на различных
дантом, митохондриальным метаболитом и ко-
моделях in vitro и на мышах in vivo [31, 32]. Целью
энзимом [7]. Тиоловые группы ЛК могут быть
данной работы было исследование радиомитига-
окисленными (липоевая кислота) или восстанов-
торных свойств ЛК при совместном ее использо-
ленными (дигидролипоевая кислота), и этот
вании с МФ и ЭМГПС при остром рентгенов-
окислительно-восстановительный процесс про-
ском облучении животных.
исходит in vivo. Как дигидролипоевая, так и липо-
евая кислота обладают способностью к хелатиро-
ванию ионов металлов и перехвату активных
МАТЕРИАЛЫ И МЕТОДЫ
форм кислорода, но только дигидролипоевая
Материалы. В работе использовали: 1,1-диме-
кислота способна регенерировать эндогенные
тилбигуанида гидрохлорид (метформин) (Sigma-
низкомолекулярные антиоксиданты и способ-
Aldrich, США), масло иммерсионное, краситель
ствовать восстановлению окислительных повре-
Гимзы-Романовского (Panreac, Испания), ап-
ждений биомакромолекул. Дигидролипоевая
течные препараты: раствор для инъекций «На-
кислота может восстанавливать витамины E и C,
трия хлорид буфус» (АО ПФК «Обновление Рене-
а также метионинсульфоксидредуктазу, а через
вал», Россия), раствор для внутримышечного и
нее - окисленные белки [8].
внутривенного введения «Мексидол» (этилмети-
В настоящее время ЛК используется в терапии
лгидроксиперидина сукцинат)
(«Фармасофт»,
многих патологий, в том числе сахарного диабета,
Россия), концентрат для приготовления раствора
болезней Альцгеймера и Паркинсона, заболева-
для инфузий «Берлитион 600» (тиоктовая кисло-
ний печени, ожирения [7], рассеянного склероза
та) (Berlin-Chemie, Германия). Все реагенты ис-
[9] и нейропатий [10, 11]. ЛК также обладает си-
пользовали без дополнительной очистки.
стемным положительным эффектом на функции
Рентгеновское облучение. Тотальное облучение
головного мозга и является эффективным геро-
животных проводили на рентгеновской терапев-
протектором
[12]. ЛК модулирует уровни
тической установке РУТ-15 («МосРентген», Рос-
5'-АМФ-активированной протеинкиназы в тка-
сия) при мощности дозы 1 Гр/мин (фокусное рас-
нях [13, 14], повышает экспрессию цAMФ [15].
стояние 0.375 м, 20 мА, 200 кВ). Рентгеновское
Она также запускает экспрессию множественных
облучение проводили в Центре коллективного
белков антиокcидантного ответа [16, 17]. При
пользования ИБК РАН.
фармакологическом применении ЛК снижает
уровни С-реактивного белка [18] и триглицери-
Животные. В экспериментах использовали
дов в крови, улучшает показатели гликемических
самцов аутбредных мышей Kv:SHK в возрасте 6-
БИОФИЗИКА том 68
№ 4
2023
РАДИОМИТИГАТОРНЫЕ СВОЙСТВА α-ЛИПОЕВОЙ КИСЛОТЫ
763
8 недель и массой 29 ± 4 г (питомник «Крюково»
дисперсионному анализу (ANOVA) с последую-
РАН). Животных содержали в виварии при тем-
щим апостериорным тестом Бонферрони. Про-
пературе 23 ± 2°С. У мышей был постоянный до-
центное соотношение указано для средних значе-
ступ к коммерческому гранулированному корму
ний. Для статистической и графической обработ-
для грызунов («Лабораторкорм», Россия) и пи-
ки данных применяли программное обеспечение
тьевой воде. Умерщвляли животных методом
Origin 8.1.
цервикальной дислокации. Препараты для па-
рентерального введения готовили в растворе для
РЕЗУЛЬТАТЫ
инъекций или разбавляли им аптечные препара-
ты (ЭМГПС, ЛК) до нужной концентрации. Кон-
Влияние α-липоевой кислоты на образование
трольные животные получали 0.9%-й раствор
повреждений ДНК in vivo. Система кроветворения
NaCl без добавок. Растворы вводили внутрибрю-
является одной из наиболее уязвимых к действию
шинно в объеме 0.3 мл/мышь или перорально с
ионизирующего излучения, и радиочувствитель-
помощью пипетки (20 мкл/мышь). В контроль-
ность клеток красного костного мозга чрезвычай-
ных группах были интактные животные и облу-
но высока. Микроядерный тест клеток красного
ченные мыши, которым вводили физиологиче-
костного мозга позволяет in vivo определить по-
ский раствор.
вреждения ядерной ДНК после облучения живот-
Микроядерный тест. Цитогенетические повре-
ных. Микроядерный тест является одним из рас-
ждения клеток красного костного мозга мышей
пространенных методов изучения генотоксично-
определяли по образованию полихроматофиль-
сти ионизирующего излучения [33].
ных эритроцитов (ПХЭ), содержащих микроядра.
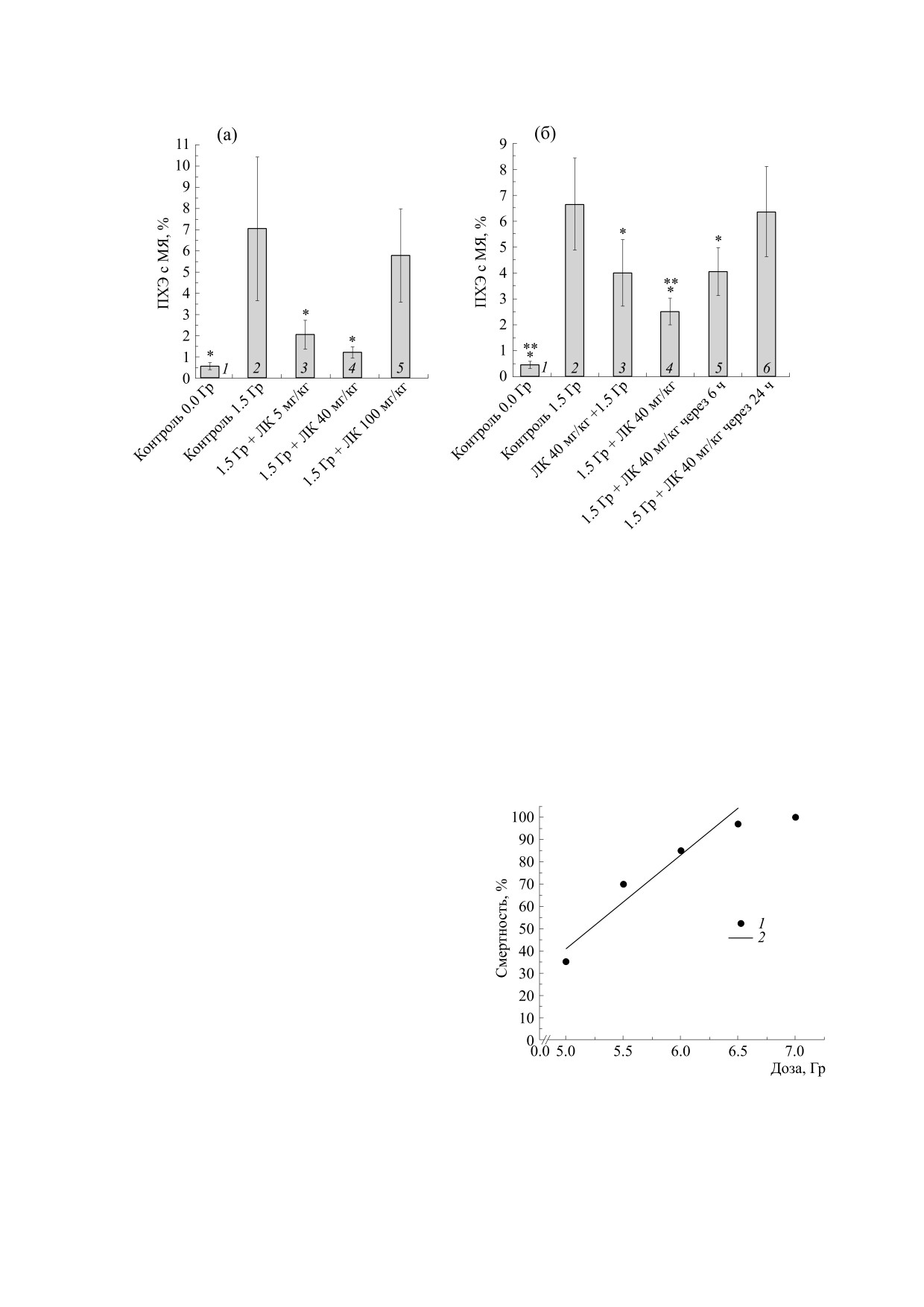
Влияние ЛК на частоту образования ПХЭ с
Мышей умерщвляли через 28 ч после рентгенов-
микроядрами при введении препарата мышам до
ского облучения (1.5-2.0 Гр), поскольку макси-
или после облучения в дозе 1.5 Гр представлено на
мальный выход ПХЭ с микроядрами наблюдается
рис. 1. Установлено, что ЛК в дозах 5.0 и 40 мг/кг
примерно через сутки
[33]. Гистологические
веса животного снижает частоту образования
слайды изготовляли по стандартной методике с
микроядер в ПХЭ костного мозга мышей на 70 и
некоторыми изменениями [34]. При подсчете
75% соответственно (рис. 1а). ЛК в дозе 100 мг/кг
ПХЭ, содержащих микроядра, использовали све-
не оказывает статистически достоверного влия-
товой микроскоп «МикМед-2» (ЛОМО, Россия) с
ния на частоту образования микроядер. Допол-
иммерсионным объективом при увеличении
нительный тест показал, что ЛК в дозе 40 мг/кг
1000×. Подсчитывали не менее 2000 ПХЭ на
при введении мышам сразу после облучения сни-
мышь, по пять животных в каждой группе.
жает процент образования микроядер в ПХЭ на
Тест на выживаемость. Радиомитигаторные
65%, а при введении за 15 мин до облучения и че-
свойства препаратов in vivo исследовали на мы-
рез 6 ч после - на 40% (рис. 1б). При введении ЛК
шах с помощью теста на 30-тисуточную выживае-
через 24 ч после облучения статистически значи-
мость после острого облучения в сублетальной
мый положительный эффект не зафиксирован.
или абсолютно летальной дозе (LD). Всего было
Таким образом, показаны как радиопротек-
проведено четыре типа испытаний: № 1 - кривая
торные, так и радиомитигаторные свойства ЛК.
«доза-эффект» (проверка радиочувствительно-
Данные эффекты сильно зависят от концентра-
сти используемых животных и подтверждение ле-
ции ЛК, при избытке которой наблюдаются ра-
тальных доз), № 2 - первичное исследование ра-
диосенсибилизирующее и слабое токсическое
диомитигаторных свойств, № 3 - эксперимент по
действие in vivo. Отсутствие эффекта ЛК в дозе
комбинированию ЛК с другими потенциальными
100 мг/кг на мышах хорошо согласуется с литера-
радиомитигаторами, № 4 - подбор «концентра-
турными данными о токсичности высоких (от
ционного окна». Препараты вводили животным
50 мг/кг) доз ЛК, наблюдающейся при много-
внутрибрюшинно через 15 мин после острого то-
кратном приеме препарата [35, 36].
тального рентгеновского облучения в дозе 6.5
Влияние α-липоевой кислоты на выживаемость
(LD 95/30) или 7.0 Гр (LD 100/30) и перорально в те-
мышей после облучения в летальной дозе. Тест на
чение следующих 10 суток. В испытании № 1 бы-
30-тисуточную выживаемость является стандарт-
ло использовано 20 мышей на группу, в группах
ным методом исследования в радиобиологии. Он
6.5 и 7.0 Гр испытания № 3 - по 20 и 14 животных
позволяет на модели острого облучения живот-
соответственно, во всех остальных группах было
ных в летальной дозе оценить эффективность ра-
по 10 мышей.
диозащитных свойств исследуемых препаратов.
Статистическая обработка данных. Данные
Предварительно для мышей Kv:SHK была полу-
представлены как средние значения и их стан-
чена кривая «доза-эффект» в диапазоне доз от 5.0
дартные отклонения (для микроядерных тестов,
до 7.0 Гр (рис. 1). В диапазоне от 5.0 до 6.5 Гр за-
n = 5). Различия считали достоверными при
висимость имела форму, близкую к линейной
p < 0.05. Данные подвергали одностороннему
(рис. 1, прямая 2). При дозе 5.0 Гр смертность бы-
БИОФИЗИКА том 68
№ 4
2023
764
КАРМАНОВА и др.
Рис. 1. Влияние введения α-липоевой кислоты на образование микроядер (МЯ) в полихроматофильных эритроцитах
красного костного мозга мышей под действием рентгеновского излучения в дозе 1.5 Гр. (а) - Зависимость от дозиров-
ки α-липоевой кислоты; * - отличия от облученного контроля статистически достоверны (ANOVA, p < 0.05). (б) - За-
висимость от времени введения α-липоевой кислоты (40 мг/кг) при облучении; * - отличия от облученного контроля
статистически достоверны, ** - отличия от групп 3 и 5 статистически достоверны (ANOVA, p < 0.05).
ла на уровне 35%, а при 6.5 Гр составляла 95% (по-
получения витамина С, при этом СПЖ увеличи-
лулетальная доза LD50/30 = 5.4 Гр). В диапазоне от
валась до 18.1 сут. При курсовом применении ЛК
6.5 до 7.0 Гр смертность достигает максимума -
наблюдался радиосенсибилизирующий эффект.
100%. В дальнейшем в качестве сублетальной
СПЖ мышей при курсовом применении ЛК со-
(LD95/30) для данных животных была использова-
на доза 6.5 Гр, а доза 7.0 Гр была взята в качестве
минимальной абсолютно летальной дозы
(LD100/30).
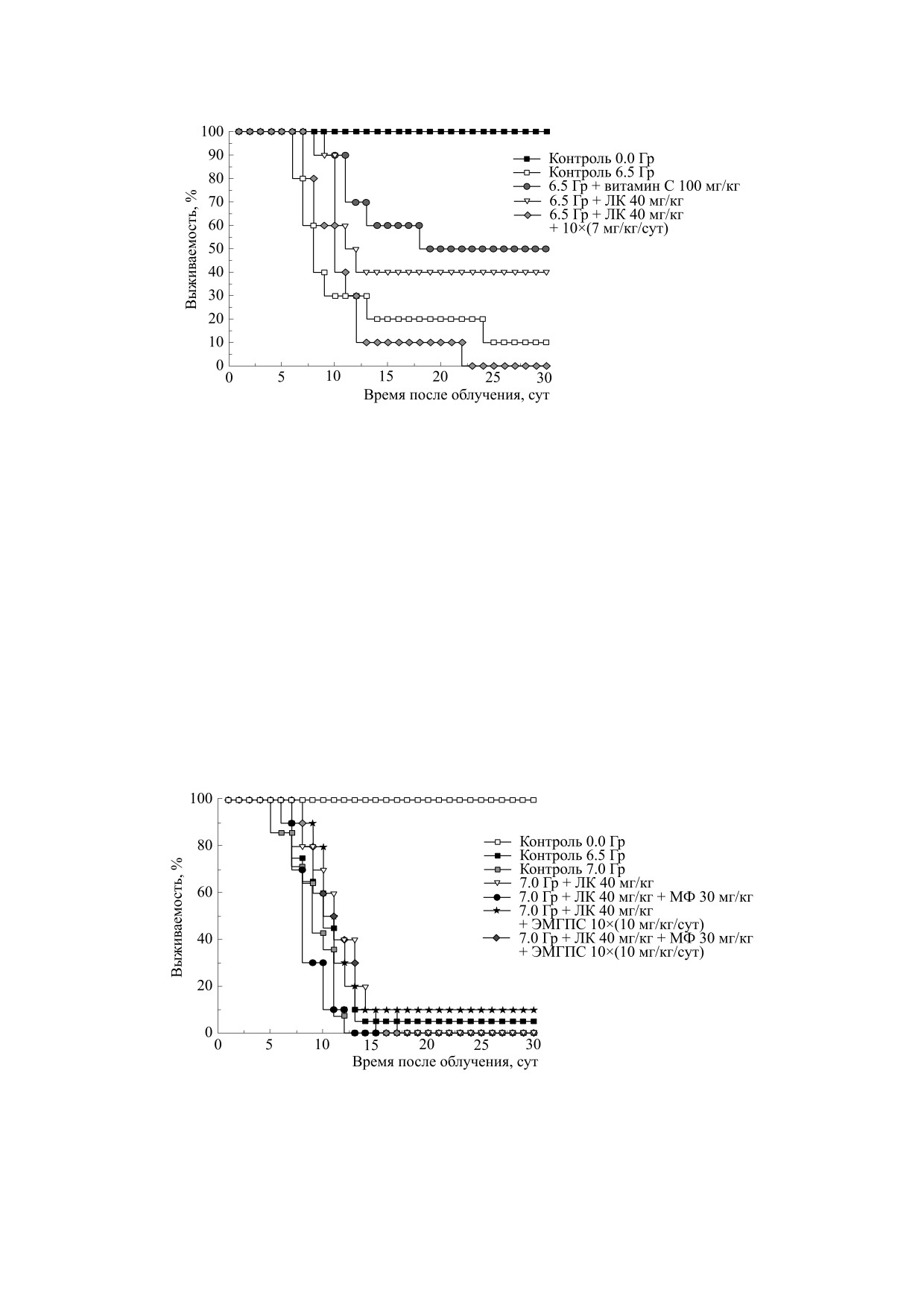
Для начального теста на выживаемость (рис. 3)
подбирали дозировку ЛК, исходя из результатов
микроядерного теста и литературных данных [36].
ЛК вводили мышам в дозе 40 мг/кг однократно.
Дополнительно в группе курсового применения
ЛК на протяжении 10 дней давали перорально
1 раз в сутки по 7 мг/кг, поскольку, согласно ли-
тературным данным, ЛК чаще применяют в виде
курсовой терапии. Для сравнения мышам кон-
трольной группы вводили известный радиоза-
щитный препарат - перехватчик свободных ра-
дикалов аскорбиновую кислоту (витамин С) в до-
зе
100 мг/кг. В группе облученных мышей,
которым вводили изотонический раствор, сред-
няя продолжительность жизни (СПЖ) составила
Рис 2. Смертность мышей Kv:SHK при остром тоталь-
11.8 сут, а выжило к 30-м суткам 10% животных.
ном однократном рентгеновском облучении в диапа-
ЛК при однократном введении увеличивала вы-
зоне доз от 5.0 до 7.0 Гр с шагом 0.5 Гр: 1 - смертность
живаемость до 40%, что на 10% ниже, чем в случае
в группе (n = 20), 2 - линейная аппроксимация.
БИОФИЗИКА том 68
№ 4
2023
РАДИОМИТИГАТОРНЫЕ СВОЙСТВА α-ЛИПОЕВОЙ КИСЛОТЫ
765
Рис. 3. Влияние α-липоевой кислоты на выживаемость мышей при внутрибрюшинном введении после рентгеновского
облучения в дозе 6.5 Гр.
ставила 9.6 суток, а 100%-я смертность наступила
группа 2 - ЛК 40 мг/кг + ЭМГПС 10 мг/кг per os в
на 23-е сутки.
течение 10 суток после облучения и группа 3 - ЛК
40 мг/кг + МФ 30 мг/кг + ЭМГПС 10 мг/кг per os
Далее было исследовано использование ЛК в
в течение 10 суток после облучения. Полученные
сочетании с ЭМГПС и МФ (рис. 4). Так как ис-
результаты не подтвердили выдвинутую гипотезу.
ходно предполагалось, что ЭМГПС и МФ усилят
В группах 1-3 ненулевая выживаемость (10%) бы-
радиомитигаторные свойства ЛК, то для экспери-
ла только в группе 2 - в сочетании ЛК с курсом
мента выбрали минимальную абсолютно леталь-
ЭМГПС, а СПЖ в группах 1-3 распределилась
ную дозу (7.0 Гр) и дополнительный контроль -
следующим образом: 8.3, 11.3 и 10.7 сут соответ-
6.5 Гр. В группе 6.5 Гр выжило 5% животных, в
ственно.
группе 7.0 Гр - 0%, но СПЖ различалась незна-
чительно: 8.5 и 8.9 сут соответственно. Опытные
Следующей целью был подбор «концентраци-
группы, облученные в дозе 7.0 Гр, были следую-
онного окна» для ЛК и проверка радиомитига-
щими: группа 1 - ЛК 40 мг/кг + МФ 30 мг/кг,
торных свойств ЛК в сочетании с МФ и ЭМГПС
Рис. 4. Влияние α-липоевой кислоты в сочетании с метформином и/или этилметилгидроксипиридина сукцинатом на
выживаемость мышей при внутрибрюшинном введении после рентгеновского облучения в дозе 7.0 Гр.
БИОФИЗИКА том 68
№ 4
2023
766
КАРМАНОВА и др.
Рис. 5. Влияние α-липоевой кислоты в различных дозировках в сочетании с метформином или этилметилгидроксипи-
ридина сукцинатом на выживаемость мышей при внутрибрюшинном введении после рентгеновского облучения в дозе
6.5 Гр.
при дозе 6.5 Гр (рис. 5). В табл. 1 представлены
эффективны низкие дозы: наилучший показатель
полученные значения СПЖ и процент выживае-
выживаемости наблюдается в группах 5 и 6. Во-
мости животных. Из результатов следуют два вы-
вторых, использование ЛК совместно с ЭМПГС
вода. Во-первых, радиомитигаторный эффект ЛК
ослабляет радиомитигаторный эффект ЛК (груп-
сильно зависит от ее дозировки, причем более
пы 8 и 9), а совместно с МФ - нейтрализует его
Таблица 1. Влияние α-липоевой кислоты в различных дозировках и в сочетании с метформином или
этилметилгидроксипиридина сукцинатом на выживаемость мышей при внутрибрюшинном введении после
рентгеновского облучения в дозе 6.5 Гр
№ группы
Группа
Средняя продолжительность
Выживаемость, %
жизни, сут
1
Контроль 0.0 Гр
30
100
2
Контроль 6.5 Гр
16.8
10
3
ЛК 40 мг/кг
19.2
30
4
ЛК 100 мг/кг
22.6
50
5
ЛК 5 мг/кг
24.2
60
6
ЛК 40 мг/кг +
23.2
60
10×(0.4 мг/кг/сут)
7
ЛК 40 мг/кг + 10×(4 мг/кг/сут)
22.6
40
8
ЛК 40 мг/кг +
12.3
20
ЭМГПС 100 мг/кг
9
ЛК 40 мг/кг +
14.1
10
ЭМГПС 10×(10 мг/кг/сут)
10
ЛК 40 мг/кг + МФ 30 мг/кг
13.8
10
11
ЛК 40 мг/кг +
14.7
0
МФ 10×(3 мг/кг/сут)
БИОФИЗИКА том 68
№ 4
2023
РАДИОМИТИГАТОРНЫЕ СВОЙСТВА α-ЛИПОЕВОЙ КИСЛОТЫ
767
(группа 10), и даже вызывает радиосенсибилиза-
функционирования митохондрий. ЛК суще-
цию (группа 11).
ственно влияет на метаболизм митохондрий в це-
лом [40] и способна уменьшать окислительное
повреждение митохондрий, поскольку она дей-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ствует как кофактор для α-кетоглутаратдегидро-
Полученные результаты можно объяснить
геназы, сенсора митохондриального редокс-ста-
предполагаемыми механизмами действия ЛК,
туса, который регулирует высвобождение мито-
которые были рассмотрены нами ранее [24] и
хондриального цитохрома с и гибель клеток [41].
подтверждаются литературными данными. Из-
ЛК способствуют изменению проницаемости
вестно, что ЛК является перехватчиком свобод-
мембран митохондрий, может быть связана с
ных радикалов, регенерирует низкомолекуляр-
продукцией активных форм кислорода и истоще-
ные антиоксиданты и повышает уровни антиок-
нием антиоксидантного резерва митохондрий [8].
сидантных ферментов. При этом сигнальный
Основное действие МФ связывают с ингибирова-
компонент ее действия считают основным in vivo
нием комплекса I в митохондриях [42, 43], акти-
[35]. Он подавляет передачу сигналов окисли-
вацией 5'-АМФ-активированной протеинкиназы
тельного стресса через ядерный фактор-
и последующим развитием сигнально-регулятор-
κB/трансформирующий фактор роста-β (NF-
ного каскада [29, 30]. Сукцинат, содержащийся в
κB/TGF-β) [22, 23], снижает уровни интерлейки-
составе ЭМГПС, модулирует митоходриальную
на-6 и циклооксигеназы-2 и повышает содержа-
активность через сукцинатоксидазный путь
ние γ-рецептора, активируемого пролиферато-
[44, 45].
ром пероксисом и противовоспалительного ин-
Однозначно определить схему влияния ком-
терлейкина-10, подавляющих окислительный
бинации препаратов сложно, так как, помимо
стресс [23]. Кроме того, есть данные о проокси-
многофакторного влияния непосредственно на
дантных свойствах ЛК за счет образования тиоло-
метаболизм митохондрий, для каждого препарата
вого радикала и дисульфидного анион-радикала
существует еще и сигнально-регуляторный ком-
из дигидролипоевой кислоты [8]. При этом мож-
понент воздействия на организм в целом. При
но предполагать, что радиомитигаторное дей-
этом сигнальные каскады могут быть сходны. На-
ствие ЛК в низких дозах обеспечивается через
пример, все три препарата влияют на активность
сигнально-регуляторные пути и
«добавочное»
ядерного фактора-κB и циклооксигеназы-2 [23,
опосредованное влияние на антиоксидантную
46, 47]. Таким образом, наблюдаемый эффект мо-
систему организма. При повышении доз ЛК на-
жет быть обусловлен как совокупным воздей-
чинают превалировать механизмы, которые мо-
ствием на митоходриальный метаболизм, так и
гут усугублять редокс-стресс либо за счет восста-
влиянием на сигнально-регуляторные пути цело-
новительного стресса, либо путем усиления окис-
го организма.
лительного стресса тиоловыми радикалами,
причем первое можно ожидать при курсовом ле-
чении, а второе - при однократном введении ЛК
ВЫВОДЫ
после облучения.
При комбинировании ЛК с ЭМГПС и МФ
ЛК обладает радиомитигаторными свойства-
ми у мышей при их рентгеновском облучении в
происходит ослабление ее радиомитигаторных
летальной дозе. Данный эффект зависит от кон-
свойств, предположительно, из-за влияния всех
центрации ЛК, причем более эффективны низ-
трех препаратов на митохондриальные процессы.
кие дозы препарата. При сочетанном с ЭМГПС и
При окислительном стрессе митохондрии дей-
МФ действии радиомитигаторные свойства ЛК
ствуют как сигнальные регуляторные органеллы,
ослабляются.
приводя к крупномасштабному производству
свободных радикалов [37] и окислительным по-
вреждениям ДНК [38]. Наиболее значимы окис-
ФИНАНСИРОВАНИЕ РАБОТЫ
лительные повреждения и мутации генов мтДНК,
кодирующих структуру субъединиц ферментов
Работа выполнена в рамках Государственного
дыхательной цепи. Этот процесс снижает продук-
задания ИТЭБ РАН № 075-01027-22-00.
цию АТФ, необходимой для процессов репара-
ции, что приводит к дальнейшему повреждению
КОНФЛИКТ ИНТЕРЕСОВ
самих митохондрий и мтДНК [39].
Все исследованные препараты реализуют си-
Авторы заявляют об отсутствии конфликта
стемное действие на организм через модуляцию
интересов.
БИОФИЗИКА том 68
№ 4
2023
768
КАРМАНОВА и др.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
24. Е. Е. Карманова, А. В. Черников, А. М. Усачева и
В. И. Брусков, Хим.-фармацевт. журн., 56 (3), 3
Все процедуры с мышами проводились с уче-
(2022).
том международных правил работы с лаборатор-
25. Т. А. Воронина, Рос. мед. журн., 24 (7), 434 (2016).
ными животными и требований Комиссии по
биологической безопасности и биоэтике ИТЭБ
26. Л. А. Балыкова, А. В. Сипров, В. И. Инчина и др.,
РАН (Протокол заседания Комиссии по биологи-
Вестн. «Биомедицина и Социология», 6 (3), 4
ческой безопасности и биоэтике ИТЭБ РАН
(2021).
№ 25/2021 от 09 февраля 2021 г.).
27. M. Ostrovskyi, ScienceRise: Med. Sci., 3 (42), 20
(2021).
28. А. Н. Гребенюк, В. А. Башарин, Р. А. Тарумов и
СПИСОК ЛИТЕРАТУРЫ
др., Вестн. Росс. воен.-мед. акад., 1 (41), 102 (2013).
1.
С. В. Гудков, Н. Р. Попова и В. И. Брусков,
29. K. Mortezaee, D. Shabeeb, A. E. Musa, et al., Cur.
Биофизика, 60 (4), 801 (2015).
Clin. Pharm., 14 (1), 41 (2019).
2.
E. Obrador, R. Salvador, J. I. Villaescusa, et al., Bio-
30. V. Piskovatska, K. B. Storey, A. M. Vaiserman, and
medicines, 8, 461 (2020).
O. Lushchak, in Reviews on New Drug Targets in Age-
3.
M. Srinivasan, N. Devipriya, K. B. Kalpana, and
Related Disorders. Advances in Experimental Medicine
V. Menon, Toxicology, 262, 43 (2009).
and Biology, v. 1260, Ed. By P. Guest (Springer, Cham.
4.
M. Cheki, A. Shirazi, A. Mahmoudzadeh, et al., Mut.
2020), pp. 319-332.
Res. Gen. Toxicol. Environ. Mutagenesis, 809, 24
31. E. E. Karmanova, S. A. Abdullaev, V. E. Ivanov, et al.,
(2016).
IOP Conf. Ser. Mat. Sci. Eng. 487, 012023 (2019).
5.
V. I. Bruskov, A. V. Chernikov, V. E. Ivanov, et al.,
32. Е. Е. Карманова, А. В. Черников, А. М. Усачева и
Рhysics of Wave Phenomena, 28 (2), 91 (2020).
В. И. Брусков, Хим.-фармацевт. журн., 54 (7), 10
6.
V. I. Bruskov, E. E. Karmanova, A. V. Chernikov, et al.,
(2020).
Рhysics of Wave Phenomena 29 (2), 94 (2021).
33. A. Vral, M. Fenech, and H. Thierens, Mutagenesis, 26
7.
K. P. Shay, R. F. Moreau, E. J. Smith, et al., Biochim.
(1), 11 (2011).
Biophys. Acta, 1790 (10), 1149 (2009).
8.
U. Cakatay, Med. Hypotheses, 66 (1), 110 (2006).
34. N. R. Asadullina, A. M. Usacheva, V. S. Smirnova and
S. V. Gudkov, Nucleosides, Nucleotides and Nucleic
9.
C. Waslo, D. Bourdette, N. Gray, et al., Curr. Treat.
Acids, 29, 786 (2010).
Options Neurol., 21 (6), 26 (2019).
35. A. Piechota-Polanczyk, M. Zielińska, D. Piekielny,
10.
10. Л. Ю. Моргунов, Мед. совет, 17, 90 (2014).
and J. Fichna, Biomed. Pharmacother., 84, 470 (2016).
11.
О. В. Курушина, А. Е. Барулин и Е. П. Чер-
новоленко, Мед. совет 1, 58 (2019).
36. А. М. Усачева, А. В. Черников, Е. Е. Карманова и
В. И. Брусков, Хим.-фармацевт. журн., 55 (11), 9
12.
С. Ю. Калинченко, Л. О. Ворслов, И. А. Тюзиков
и др., Фарматека, 6 (279), 43 (2014).
(2021).
13.
Y. Wang, N. Everaert, Z. Song, et al., Comp. Biochem.
37. N. S. Chandel, BMC Biology, 12, 34 (2014).
Physiol. A: Mol. Integr. Physiol., 211, 34 (2017).
38. D. C. Henstridge, M. Whitham, and M. A. Febbraio,
14.
L. Zhou and Y. Cheng, Neuropharmacology, 155, 98
Mol. Metabol., 3, 781 (2014).
(2019).
39. I. N. Todorov, Ros. Khimich. Zhurn., 51, 93 (2007).
15.
S. Salinthone, V. Yadav, R. V. Schillace, et al., PLoS
40. L. Rochette, G. Steliana, R. Carole, et al., Mol. Nutr.
One, 5 (9), e13058 (2010).
Food Res., 57, 114 (2013).
16.
J. K. Lee, D. Samanta, H. G. Nam, and R. N. Zare, J.
41. S. Dragomanova, S. Miteva, F. Nicoletti, et al., Antiox-
Am. Chem. Soc., 141 (27), 10585 (2019).
idants, 10, 1294 (2021).
17.
Y. Koriyama, Y. Nakayama, S. Matsugo, and S. Kato,
42. M. R. Owen, E. Doran, and A. P. Halestrap, Biochem.
Brain Res., 1499, 145 (2013).
J., 348, 607 (2000).
18.
S. Saboori, E. Falahi, E. Eslampour, et al., Nutr.
43. M.-Y. El-Mir, V. Nogueira, E. Fontaine, et al., J. Biol.
Metab. Cardiovasc. Dis., 28(8), 779 (2018).
Chem., 275, 223 (2000).
19.
M. Rahimlou, M. Asadi, N. B. Jahromi, and A. Man-
soori, Clin. Nutr. ESPEN, 32, 16 (2019).
44. Г. В. Бузник, В. В. Востриков и П. Д. Шабанов,
Вестн. Смоленской гос. мед. академии, 19 (4), 22
20. S. L. Brown, A. Kolozsvary, J. Liu, et al., Radiat Res.,
(2020).
173 (4), 462 (2010).
45. Н. А. Жаркинбекова, Медицина (Алматы), 3-4, 64
21. L. Ramachandran, C. Krishnan, and K. Nair, Mut.
Res. Gen. Toxicol. Environ. Mutagenesis 724,
52
(2020).
(2011).
46. R. Yahyapour, P. Amini, H. Saffar, et al., Cur. Drug
22. S. H. Ryu, E. Y. Park, S. Kwak, et al., Oncotarget, 7
Res. Rev., 11, 111 (2019).
(13), 15554 (2016).
47. И. Ю. Торшин, О. А. Громова, И. С. Сардарян
23. R. S. Said, A. Mohamed and D. H. Kassem, Toxicolo-
и др., Фармакокинетика и фармакодинамика,
gy, 442, 152536 (2020).
№ 4, 19 (2016).
БИОФИЗИКА том 68
№ 4
2023
РАДИОМИТИГАТОРНЫЕ СВОЙСТВА α-ЛИПОЕВОЙ КИСЛОТЫ
769
Radio-Mitigation Properties of α-Lipoic Acid when Used alone and in Combination
with Metformin or Ethylmethylhydroxypyridine Succinate (Mexidol) in Mice
after Exposure to X-ray Radiation
E.E. Karmanova*, **, A.V. Chernikov*, A.M. Usacheva*, and V.I. Bruskov*
*Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
**Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
This study explored the radio-mitigation properties of α-lipoic acid and combination of α-lipoic acid with
metformin and mexidol in animals during the process of X-ray irradiation. The results of the micronucleus
test for measuring radiation-induced DNA damage of polychromatophilic red blood cells in the bone marrow
of mice showed that α-lipoic acid has gene-protective and radio-mitigation properties in vivo. A study on the
survival rate of the lethal dose-irradiated mice within 30 days confirmed that α-lipoic acid has radio-mitiga-
tion properties. The radio-mitigation effect of α-lipoic acid is dose-dependent, the effect increases with de-
creasing dose. α-lipoic acid in combination with mexidol and metformin exhibited a weaker radio-mitigation
effect.
Keywords: lipoic (thioctic) acid, X-ray radiation, antioxidant, genoprotector, radiomitigator
БИОФИЗИКА том 68
№ 4
2023