БИОФИЗИКА, 2023, том 68, № 5, с. 871-877
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 547.962:541.63
КОНФОРМАЦИОННЫЕ ОСОБЕННОСТИ БЕТА-АМИЛОИДНОГО
ПЕПТИДА 25-35
© 2023 г. Г.А. Агаева*, #, Г.З. Наджафова**
*Институт физических проблем Бакинского государственного университета,
ул. З. Халилова, 23, Баку, AZ-1148, Азербайджан
**Азербайджано-французский университет, ул. Низами, 183, Баку, AZ1010, Азербайджан
#E-mail: gulshen@mail.ru
Поступила в редакцию 21.12.2022 г.
После доработки 21.12.2022 г.
Принята к публикации 21.06.2023 г.
При болезни Альцгеймера в механизме нейродегенерации важную роль играет бета-амилоидный
пептид (Аβ). Отдельный фрагмент бета-амилоидного пептида Aβ(25-35) (с последовательностью
GSNKGAIIGLM) считается функциональным доменом амилоидного пептида Aβ, ответственным
за его нейротоксические свойства и биологически активной областью Aβ. Конформационный ана-
лиз методом молекулярной механики каждого пептидного сегмента С-концевой части пептида вы-
явил ограниченное число наиболее вероятных конформаций и достаточно четко определил силы,
стабилизирующие структуры. Полученные результаты показали, что пептид Aβ(25-35) энергетиче-
ски предпочтительно принимает a-спиральную конформацию на С-концевом октапептидном сег-
менте. Для моделирования картины внутримолекулярной подвижности молекулы пептидa Aβ(25-
35) был применен метод молекулярной динамики. Показано, что в низкоэнергетических конфор-
мациях пептида Aβ(25-35) гибкие структуры в его N-концевой области по-разному ориентированы
по отношению к структурам в C-концевой части.
Ключевые слова: бета-амилоидный пептид 25-35, конформация, метод молекулярной механики, метод
молекулярной динамики.
DOI: 10.31857/S0006302923050058, EDN: PGRHNS
Как известно, болезнь Альцгеймера является
изучение конформационных свойств пептида
одним из наиболее распространенных нейродеге-
Аβ(25-35) в его растворимой мономерной форме
неративных заболеваний и причиной деменции.
может сыграть существенную роль в определении
Заболевание патологически характеризуется аг-
природы более ранних его видов до олигомера-
регацией двух белков в тканях головного мозга, а
ции. Можно сделать предположение, что кон-
именно бета-амилоида (Аβ) и тау-белка, специ-
формации, принимаемые пептидом Aβ(25-35) в
фичного для мозга. Имеются совокупные доказа-
растворе, чрезвычайно чувствительны к исполь-
зуемым методам и экспериментальным услови-
тельства того, что пептиды Aβ самообразуются в
ям. Среди стабильных структур с общей α-спи-
растворимые олигомеры и нерастворимые фиб-
ральной конформацией на С-конце наблюдается
риллы [1]. Пептид Aβ(25-35) обладает многими
значительное разнообразие различных конфор-
характеристиками полноразмерного Aβ(1-40/42),
маций на N-концевом тетрапептиде.
включая его амфифильную природу и склонность
к агрегации. Его присутствие in vivo было доказа-
Одни исследования были направлены на ис-
но лишь недавно, но токсичность фибриллярного
следование мембрано-опосредованной структу-
Aβ(25-35) по отношению к нейрональным клет-
ры амилоидного пептида Aβ(25-35) для выясне-
кам in vitro была показана ранее [2, 3]. Имеются
ния структурно-функциональных взаимосвязей
также данные о том, что мономерная форма этого
пептида [4, 5]. В других исследованиях была опре-
пептида сама по себе может быть цитотоксичной
делена конформация раствора пептида Aβ(25-35)
[3]. Механизм токсичности амилоидного пептида
с использованием гидрофобных растворителей,
остается невыясненным. Тем не менее, многие
таких как трифторэтанол и гексафторизопропа-
важные детали о растворимом пептиде Aβ, вклю-
нол. Например, исследование методом кругового
чая его пространственную структуру, отсутствуют
дихроизма показало, что Aβ(25-35) принимает
или противоречат друг другу. Следовательно,
упорядоченную конформацию, включающую не-
871
872
АГАЕВА, НАДЖАФОВА
которую α-спираль, с увеличением концентра-
водородные связи и торсионные потенциалы.
ции трифторэтанола [6], или же дает неупорядо-
Расчет проводили согласно фрагментарному ана-
ченные структуры в метаноле [7]. В исследовании
лизу молекулы. Использованная в данном иссле-
с использованием спектроскопии колебательно-
довании классификация пептидных структур и
го кругового дихроизма было показано, что
потенциальные функции расчетной схемы полу-
Aβ(25-35) в растворе диметилсульфоксида при-
эмпирического конформационного анализа и их
нимает структуру β-витка [8]. Кроме того, с помо-
параметризация описана в работах [16-19]. При
щью метода ядерно-магнитного резонанса была
обсуждении результатов расчета была использо-
определена трехмерная структура Aβ(25-35), бы-
вана принятая классификация пептидных струк-
ло показано, что в растворе, содержащем гек-
тур [20]. Конформационное состояние каждого
сафторизопропанол/воду (20/80 по объему), пеп-
остатка определялось значениями двугранных уг-
тид имеет менее регулярную свернутую форму в
лов ϕ, ψ и ω основной цепи и χi боковых цепей. Уг-
С-концевой области пептида с β-поворотом в
лы ϕ и ψ основной цепи в конформациях находятся
сегменте 25-28 [9]. Другое ЯМР-исследование
в низкоэнергетических областях стерической кар-
показало, что Aβ(25-35) принимает спирально-
ты: R (ϕ,ψ = -180°
0°), B (ϕ = -180°
0°,
÷
÷
витковую структуру в растворе, содержащем по
ψ = 0°÷
180°), L (ϕ,ψ = 0°÷
180°) и P (ϕ = 0°÷
180°,
меньшей мере 50% гексафторизопропанола. Эта
структура имеет частично упорядоченный пово-
ψ = -180°÷
0°). Введено понятие формы остатка,
рот на N-конце (остатки 26-28), за которым сле-
которое характеризует область (R, B, L или P)
дует α-спираль из остатков 28-31 и 310-спираль,
значений углов ϕ и ψ. Поиск минимумов потен-
охватывающая С-концевые остатки 32-34 [10]. В
циальной энергии осуществляли методом сопря-
то же время было обнаружено, что в растворе, со-
женных градиентов, ранее описанным и приме-
держащем 50% трифторэтанола, на участке от
ненным в работе [20]. Расчет стабильных конфор-
Ala30 до Met35 пептид Aβ(25-35) принимает α-
маций молекулы проводили с помощью
спиральную конформацию [11]. Были предпри-
программы [21], основанной на матричном мето-
няты попытки охарактеризовать конформацию
де определения координат атомов, предложен-
Aβ(25-35) в водных растворителях [10, 12-15]. В
ном Германсом и Ферро [22], и потенциальных
то же время расчеты энергетического ландшафта
функциях с параметризацией, разработанных
показывают, что развернутые конформации пеп-
Шерагой и др. [23]. Представленная программа
тида вместе с α-спиралью являются важными
позволяет рассчитывать энергетические и гео-
промежуточными продуктами для олигомериза-
метрические параметры исследуемых молекул. В
ции пептида Aβ(25-35), приводящей к образова-
текущей версии этой программы энергия рассчи-
нию амилоида [13]. Тем не менее, многие важные
тывается как сумма независимых вкладов энер-
детали о мономерном Aβ(25-35), включая его
гий невалентных, электростатических взаимо-
пространственную структуру, отсутствуют или
действий, энергий торсионных барьеров и водо-
противоречат друг другу. Следовательно изучение
родных связей. Затем минимизируют энергию
конформационных свойств пептида Аβ(25-35) в
поглощенной молекулы по методу Пауэлла-Дэ-
его растворимой мономерной форме может сыг-
видсона-Флетчера [24]. Невалентные взаимо-
рать существенную роль в определении природы
действия оценивали сначала с использованием
более ранних его видов до олигомеризации. Из-
потенциала Леннарда-Джонса с параметрами,
вестно, что для выяснения механизма биологиче-
предложенными Шерагой [23], а затем с исполь-
ского эффекта пептидной молекулы необходимо
зованием потенциалов, опубликованных в рабо-
знание пространственного строения и конфор-
тах [18, 19] с учетом известных эксперименталь-
мационных возможностей этого пептида. Поэто-
ных ограничений на расстояния и двугранные
му основной целью настоящей работы является
углы. Отсчет двугранных углов вращения ϕ, ψ, ω и
исследование конформационных свойств моле-
χi проведен согласно общепринятой номенклату-
кулы бета-амилоидного пептида (25-35), необхо-
ре IUPAC-IUB [25].
димых для определения основных структурных
Метод молекулярной динамики, основанный
требований для межмолекулярного взаимодей-
на компьютерном решении уравнения движения
ствия.
Ньютона, позволяет проследить конформацион-
ное поведение молекулы во времени. Достаточно
широкие диапазоны этого метода позволяют об-
МЕТОД РАСЧЕТА
ратиться к исследованию от небольших пептид-
Исследование пространственного строения
ных молекул до белков, в вакууме и в присутствии
молекулы бета-амилоидного пептид (25-35) про-
растворителя [26-32]. Молекулярная динамика
водили методом молекулярной механики с ис-
молекул проводилась в следующей последова-
пользованием стандартной геометрии. При кон-
тельности: 1) ввод начальных данных, 2) миними-
формационном расчете пептида учитывали нева-
зация энергии, 3) нагрев до 300К, 4) равновесные
лентные и электростатические взаимодействия,
симуляции, 5) молекулярное моделирование.
БИОФИЗИКА том 68
№ 5
2023
КОНФОРМАЦИОННЫЕ ОСОБЕННОСТИ
873
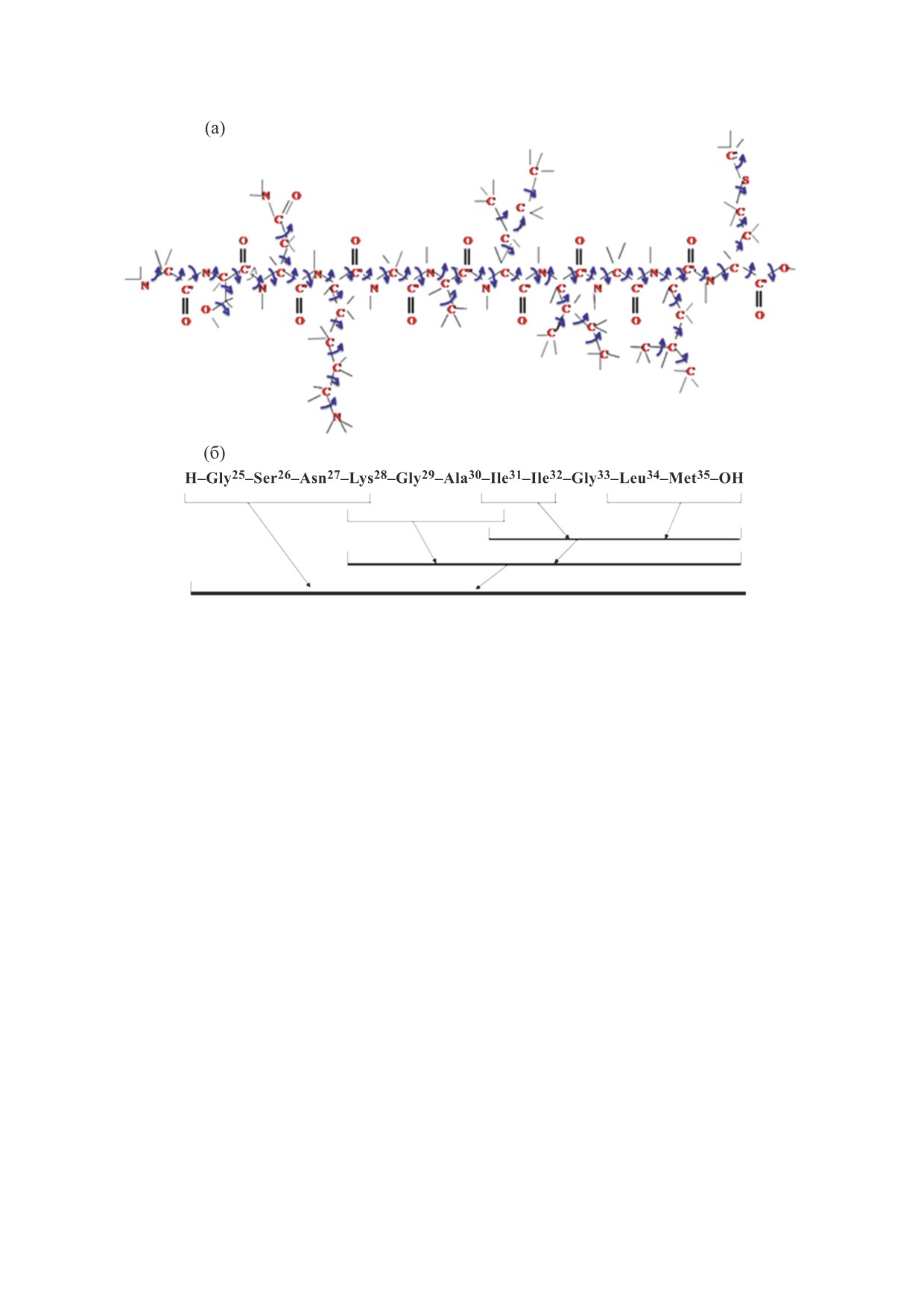
Рис. 1. Атомная расчетная модель и переменные двугранные углы молекулы бета-амилоидного пептида (25-35) (а) и
схема его фрагментарного расчета (б).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ваны либо наружу, либо внутрь. Остаток глицина,
у которого отсутствует боковая цепь, действует
Расчетная атомная модель амилоидного пеп-
как шарнирный элемент в этой тетрапептидной
тида Аβ(25-35), содержащая 157 атомов и 59 углов
цепи. Оптимальные конформации глицина пред-
вращения, показана на рис. 1а. Конформацион-
ставляют все четыре области графика конформа-
ный анализ этой молекулы был проведен на осно-
ции: R, B, L и P. Энергетическое распределение
ве расчетной схемы, представленной на рис. 1б.
оптимальных конформаций тетрапептида свиде-
Конформацию пептида Aβ(25-35) анализировали
тельствует о том, что этот фрагмент обладает зна-
с использованием пошагового подхода для срав-
чительной конформационной гибкостью. Но са-
нения конформационных свойств фрагментов.
мые низкоэнергетические конформации этого
Каждый шаг был разбит на несколько последова-
фрагмента принимают полностью свернутую
тельно решаемых структурных задач. На первом
структуру. Некоторые низкоэнергетические кон-
этапе конформационного анализа амилоидного
формации содержат повороты, на что указывает
пептида Аβ(25-35) исследовали конформацион-
расстояние между атомами Cα первого и четвер-
ные свойства его N-концевого тетрапептидного
того остатков, составляющее менее 7 Å. Осталь-
фрагмента Gly25-Ser26-Asn27-Lys28. Этот фраг-
ные конформации характеризуются полностью
мент содержит гидрофильный остаток лизина с
развернутой формой остова, что свидетельствует
положительно заряженной боковой цепью, по-
о наличии неупорядоченных структур. Наиболее
движный остаток глицина и два полярных остат-
низкоэнергетическими конформациями средне-
ка, серин и аспарагин. Варианты структуры этого
фрагмента составлены с учетом характеристик
го тетрапептида Lys28-Gly29-Ala30-Ile31 были
всех восьми возможных форм тетрапептида. На-
структуры, содержащие только две основные
чальные приближения конформационных состо-
формы. Один из них принимает полную α-спи-
яний пептида основывались на низкоэнергетиче-
ральную структуру, в то время как в другой основ-
ских конформационных состояниях соответству-
ной форме остаток Lys существует в конформаци-
ющих монопептидов, тогда как боковые цепи
онном состоянии B (φ = -180°-0°, ψ = 0°-180°),
остатков тетрапептида могли быть координиро-
за которым следует короткий α-спиральный сег-
БИОФИЗИКА том 68
№ 5
2023
874
АГАЕВА, НАДЖАФОВА
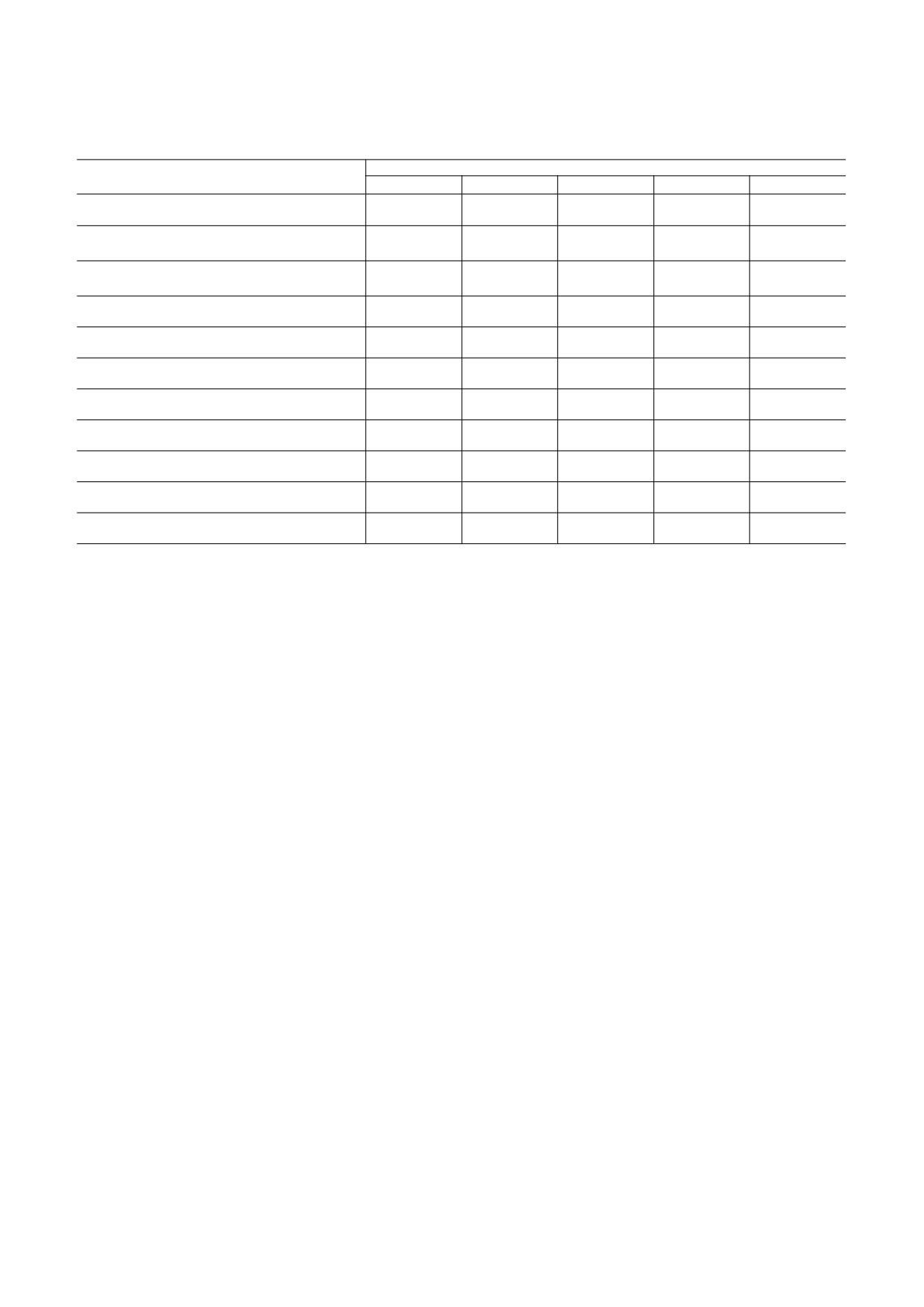
Таблица 1. Энергетические вклады в низкоэнергетических конформациях молекулы бета-амилоидного пептида
(25-35)
Энергетические вклады, ккал/мол
Конформация
Eнев
Eэлс
Eторс
Eабс
Eотн
RR1R1R32RR1R32R32RR21R32
-57.8
17.9
7.6
-32.3
0
RR1B3B12RR1R32R32RR21R32
-56.3
17.9
7.3
-31.1
1.2
BR1R3R22RR1R32R32RR21R32
-55.0
17.0
7.1
-30.9
1.4
RB1R3R22RR1R32R32RR21R32
-53.7
16.1
6.9
-30.8
1.5
BB1B1R32RR1R32R32RR21R32
-52.3
15.4
7.1
-29.9
2.4
BB1R1R22RR1R32R32RR21R32
-52.7
16.4
6.8
-29.6
2.7
RB1B1R22RR1R32R32RR21R32
-54.0
16.1
8.6
-29.3
3.0
BR1B3B12RR1R32R32RR21R32
-51.5
16.4
7.2
-27.9
4.4
BB1B1B32RR1R32R32RR21R32
-48.4
16.6
6.8
-25.0
7.3
RR2B2R22RR1R32R32RR21R32
-48.4
15.9
7.6
-24.9
7.4
BR1B3B12BB2R32R32BB21B32
-46.4
16.1
5.9
-24.4
7.9
мент. С-концевая часть пептидной последова-
гию, а все остальные низкоэнергетические кон-
тельности содержит в основном аминокислотные
формации имеют короткий α-спиральный виток
остатки с объемными гидрофобными боковыми
на С-конце молекулы. Другими словами, более
цепями. Почти все остатки С-концевого пента-
длинная α-спиральная структура на С-конце пеп-
пептида несут большие неполярные боковые це-
тида является наиболее благоприятной конфор-
пи, за исключением глицинового остатка, кото-
мацией для октапептида. Следующий этап наше-
рый вообще не имеет боковой цепи. Чтобы
го анализа касался оптимальных конформаций
уменьшить количество возможных начальных
полноразмерной молекулы ундекапептида Aβ(25-
приближений энергии для С-концевого пента-
35) на основе стабильных конформаций N-кон-
пептида, мы сначала определили оптимальные
цевого тетрапептида Gly25-Ser26-Asn27-Lys28 и
конформации фрагментов дипептида Ile31-Ile32
С-концевого (28-35) октапептид. Конформаци-
и Leu34-Met35. Их конформационный анализ
онный анализ каждого пептидного сегмента С-
определил набор допустимых конформаций для
концевой части выявил ограниченное число наи-
каждого дипептида; эти наборы использовали для
более вероятных конформаций и достаточно чет-
отбора исходных вариантов структуры С-конце-
ко определил силы, стабилизирующие структу-
вого пентапептида. Полученное энергетическое
ры. Конформационный анализ всей молекулы
распределение оптимальных структур данного
пептида Аβ(25-35) выявил ограниченное коли-
пентапептида приводит только к одной энергети-
чество низкоэнергетических структур. Поэтому
чески предпочтительной конформации только с
в качестве исходных конформаций пептида
α-спиральной структурой. Спиральный виток
Аβ(25-35) мы рассмотрели 600 конформаций,
сближает N- и С-концевые участки фрагмента с
относящихся к разным формам пептидного
образованием водородной связи NH(Met35)…
остова, и оптимизировали их геометрию за счет
CO(Ile31). В то же время боковая цепь Ile31 сбли-
минимизации энергии. Наши расчеты показали,
жена с боковыми цепями Leu34 и Met35, что об-
что пептид в свободном состоянии принимает
легчает их невалентные взаимодействия. После-
конформации с α-спиральной структурой
дующий анализ С-концевого октапептида прово-
RR1R1R32RR1R32R32RR21R32. Водородные связи
дили со стабильными конформациями,
между карбонильным кислородом и амидными
представляющими все восемь форм тетрапептида
группами пептидных звеньев NH(Gly33)…
Lys28-Gly29-Ala30-Ile31, и наиболее стабильны-
OC(Gly29),
NH(Leu34)…OC(Ala30)
и
ми конформациями С-концевого пентапептида.
NH(Met35)…OC(Ile31) характерны для всех низ-
Анализ рассчитанных вариантов С-концевого ок-
коэнергетических структур, содержащих α-спи-
тапептида (28-35) показал, что полностью α-спи-
раль структуру на С-конце. В табл. 1 представле-
ральная конформация имеет наименьшую энер-
ны энергетические вклады всех типов взаимодей-
БИОФИЗИКА том 68
№ 5
2023
КОНФОРМАЦИОННЫЕ ОСОБЕННОСТИ
875
Таблица 2. Величины двугранных углов (град) аминокислотных остатков ундекапептида бета-амилоидного
пептида (25-35) в низкоэнергетических конформациях
Основная цепь
Боковая цепь
Остаток
№ конформации
j
y
w
c1
c2
c3
c4
c5
I
-51
-57
181
Gly25
II
-61
-75
172
I
-78
-40
179
-59
180
Ser26
II
-64
-46
170
-59
180
I
-70
-31
-184
67
-94
Asn27
II
-89
133
183
182
93
I
-75
-45
-186
-65
181
180
180
180
Lys28
II
-120
108
183
-59
180
180
181
180
I
-65
-30
181
Gly29
II
-73
-31
183
I
-70
-50
185
60
Ala30
II
-69
-42
184
60
I
-70
-50
182
-65
184
173
187
İle31
II
-80
-47
182
-60
185
175
188
I
-66
-35
-183
-64
183
173
186
İle32
II
-68
-37
178
-64
184
172
186
I
-62
-38
-178
Gly33
II
-64
-34
182
I
-79
-64
-175
175
65
59
57
Leu34
II
-79
-64
185
175
65
60
57
I
-98
-52
-181
-59
180
181
180
Met35
II
-98
-52
179
-54
181
181
180
Примечание. Конформация I
- RR1R1R32RR1R32R32RR21R32 (Eотн
=
0.0 ккал/моль), конформация II
-
RR1B3B12RR1R32R32RR21R32 (Eотн = 1.2 ккал/моль).
ствий, связанных с низкоэнергетическими
туры необходима для облегчения межмолекуляр-
конформациями пептида Aβ(25-35). Исследова-
ной упаковки Aβ внутри олигомеров. Образова-
ние показало, что конформации молекулы унде-
ние внутримолекулярной α-спирали может
капептида Аβ(25-35) характеризуются подвижно-
происходить как естественное следствие про-
стью его N-концевого трипептида и в то же время
странственной укладки мономера Aβ(25-35). По-
значительной жесткостью его С-концевого окта-
сле формирования межмолекулярных взаимодей-
пептидного фрагмента. Среди стабильных струк-
ствий между этими спиральными мономерами
тур с общей α-спиральной конформацией на С-
Aβ происходит олигомеризация пептидов с их
конце наблюдается значительное разнообразие
последующей конформационной реорганизацией
различных конформаций на N-концевом тетра-
и образованием удлиненных β-листов, которые
пептиде. В табл. 2 приведены величины двугран-
составляют зрелые амилоидные фибриллы. Этот
ных углов двух стабильных конформационных
механизм
подтверждается
предыдущими
состояний бета-амилоидного пептида
(25-35).
исследованиями фибриллогенеза пептидов Aβ
[33], где было показано, что он действует при
Как можно видеть, в результате расчетов были
определены энергетически предпочтительные
фибриллогенезе модельного пептида «спираль-
области двугранных углов, взаимное расположе-
поворот-спираль»
[34]. В то же время α-
спиральный компонент в мономерной структуре
ние остатков и выявлена тенденция к образова-
пептида Aβ(25-35) в водном растворителе, по-
нию регулярной α-спиральной структуры в низ-
видимому, играет роль в инициировании аг-
коэнергетических конформациях бета-амилоид-
регации пептидов.
ного пептида (25-35). Соответственно, гибкие
структуры в N-концевой области Aβ(25-35) по-
На втором этапе исследования использовали
разному ориентированы по отношению к струк-
метод молекулярной динамики, который позво-
турам в C-концевой части в низкоэнергетических
лил моделировать картину внутримолекулярной
конформациях. Вполне вероятно, что укладка
подвижности молекулы бета-амилоидного пеп-
мономера Aβ(25-35) в виде α-спиральной струк-
тида (25-35). В качестве начальных приближений
БИОФИЗИКА том 68
№ 5
2023
876
АГАЕВА, НАДЖАФОВА
Рис. 2. Исходная структура и оптимизированная структура молекулы бета-амилоидного пептида (25-35) в условиях
вакуума (а) и явно заданного водного окружения (б). Жирной линией указан ход основной цепи.
были использованы наиболее стабильные
ченные данные позволяют заключить, что
конформационные состояния молекулы. Моле-
глобальная конформация бета-амилоидного
кулярно-динамическое моделирование для моле-
пептида (25-35) содержит устойчивые элементы
кулы бета-амилоидного пептида (25-35) в кон-
пространственной структуры, которые могут быть
формации с минимальным значением полной
ответственны за формирование стабильной
энергии проводили сначала в условиях вакуума, а
конформации, необходимой для связывания с ре-
затем в гипотетическом кубическом объеме с мо-
цепторами белков. Допустимые изменения вели-
лекулами воды с наложенными периодическими
чин двугранных углов внутреннего вращения при
граничными условиями. Размер ящика с водой
моделировании методом молекулярной динами-
подбирали в соответствии с размерами исследуе-
ки в вакууме и водном окружении наблюдаются и
мой молекулы. Далее проводили релаксацию мо-
в энергетически самой предпочтительной кон-
лекулы с учетом реального водного окружения.
формации пептида. Согласно полученным расчет-
Для имитации водного окружения частота столк-
ным результатам в течение симуляции в вакууме
новений атомов с молекулами воды задана рав-
молекулярного движения в предпочтительной
ной 50 пс-1. Исходная структура и оптимизиро-
конформации молекулы бета-амилоидного пеп-
ванная структура молекулы бета-амилоидного
тида (25-35) имеют место заметные флуктуации
пептида (25-35) в условиях вакуума и явно задан-
остатков, главным образом, в N-концевой части
ного водного окружения представлены на рис. 2.
молекулы. Следует отметить, что такая тенденция
Согласно результатам проведенного расчета
к изменению конформационного состояния
молекула бета-амилоидного пептида (25-35) со-
остатка Gly25 в пределах глобальной конформации
храняет свернутый характер пептидной цепи до и
молекулы наблюдалась и в результатах теоретиче-
после оптимизации. В стабильных конформаци-
ского конформационного анализа, т.е. было полу-
ях водородные связи между СО- и NH-группами
чено несколько сравнимых по стабильности кон-
пептидной цепи не разрушаются в процессе мо-
формаций, различающихся лишь конформацион-
лекулярной динамики, несмотря на изменения во
внутримолекулярной энергии пептида на 10-
ным состоянием остатка Gly25. Полученные
15 ккал/моль. Устойчивость структуры отдельных
результаты могут быть полезны при исследовании
фрагментов подтверждают также значения дву-
механизма действия бета-амилоидного пептида
гранных углов в основной цепи молекулы. Полу-
(25-35).
БИОФИЗИКА том 68
№ 5
2023
КОНФОРМАЦИОННЫЕ ОСОБЕННОСТИ
877
КОНФЛИКТ ИНТЕРЕСОВ
16. R. F. McGuire, F. A. Momany, and H. A. Scheraga, J.
Phys. Chem., 76, 375 (1972).
Авторы заявляют об отсутствии конфликта
17. F. A. Momany, R. F. McGuire, A. W. Burgess, and
интересов.
H. A. Scheraga, J. Phys. Chem., 79, 2361 (1975).
18. H.A. Scheraga, Biopolymers, 22, 1 (1983) .
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
19. G. Nemethy, M. S. Pottle, and H. A. Scheraga, J. Phys.
Настоящая работа не содержит описания ка-
Chem., 87, 1883 (1983).
ких-либо исследований с использованием людей
20. E. M. Popov, Int. J. Quant. Chem., 16, 707 (1979).
и животных в качестве объектов.
21. I. S. Maksumov, L. I. Ismailova, and N. M. Godjaev, J.
Sruct. Khim., 24, 147 (1983).
22. J. Jr. Hermans and D. Ferro, Biopolymers, 10, 1121
СПИСОК ЛИТЕРАТУРЫ
(1971).
1. L. N. Zhao, L. Lu, L. Y. Chew, and Y. Mu, Int. J. Mol.
23. W. C. Davidon, AEC Res. Develop. Rep., ANL-5990
Sci., 15, 12631 (2014).
(1959).
2. E. Cerf, R. Sarroukh, S. Tamamizu-Kato, et al., Bio-
24. R. Fletcher and M. J. D. Powell, J. Computer, 6, 163
chem. J., 421, 415 (2009).
(1963).
3. R. Sultana, H. F. Poon, J. Cai, et al., Neurobiol. Dis.,
25. IUPAC-IUB Commission on Biochemical Nomencla-
22, 76 (2006).
ture Abbreviations and symbols for description of con-
4. T. Kohno, K. Kobayashi, T. Maeda, et al., Biochemis-
formation of polypeptide chains, Pure Appl. Chem.,
try, 35, 16094 (1996).
40, 291 (1974).
5. M. Coles, W. Bicknell, A. A. Watson, et al., Biochem-
26. S. Weiner, P. Kollman, D. T. Nguyen, and D. A. Case,
istry, 37, 11064 (1998).
J. Comput. Chem., 7, 230 (1986).
6. O. M. A. El-Agnaf, G. B. Irvine, G. Fitzpatrick, et al.,
27. N. L. Allinger and Y. Yuh, MM2 Program, QCPE 395
Biochem. J., 336 (Pt 2), 419 (1998)
(Indiana University, Indiana, 1982).
7. G. Shanmugam and R. Jayakumar, Biopolymers, 33,
28. D. White, J. Kuddock, and P. Edgington, in CHEM-
421 (2004).
MIN Program in Computer Aided Molecular Design, Ed.
8. G. Shanmugam, P. L. Polavarapu, Biophys. J., 87, 622
by W. G. Richards (IBC Technical Services, 1989).
(2004).
29. W. C. Still, MacroModel (Columbia University, NY,
9. A. M. D'Ursi, M. R. Armenante, R. Guerrini, et al., J.
USA).
Med. Chem, 12, 4231 (2004).
30. Quanta/CHARMm,
Molecular
Simulations
10. G. Wei and J. E. Shea, Biophys. J., 91, 1638 (2006).
(Warmshurst, Mass., USA).
11. S. Lee and Y. Kim, Bull. Korean Chem. Soc., 25, 838
31. J. W. Pitera, M. Falta, and W. F. van Gunsteren, Bio-
(2004).
phys. J., 80, 2546 (2001).
12. L. Millucci, L. Ghezzi, G. Bernardini, and A. Santucci,
32. G. A. Agaeva, U. T. Agaeva, and N. M. Godjaev, Bio-
Curr. Prot. Peptide Sci., 11, 54 (2010).
physics (Springer), 60, 365 (2015).
13. B. Ma and R. Nussinov, Biophys. J., 90, 3365 (2006).
33. M. D. Kirkitadze, M. M. Condron, and D. B. Teplow,
14. E. Terzi, G. Holzemann, and J. Seelig, Biochemistry,
J. Mol. Biol., 312, 1103 (2001).
33, 1345 (1994).
34. Y. Fezoui, D. M. Hartley, D. M. Walsh, et al., Nature
15. Y. Song, P. Li, L. Liu, et al., Sci. Rep., 8, 765 (2018).
Struct. Biol, 7, 1095 (2000).
Conformational Particularities of Beta-Amyloid Peptide 25-35
G.A. Agaeva* and G.Z. Najafova**
*Institute for Physical Problems, Baku State University, ul. Z. Khalilova 23, Baku, AZ-1148 Azerbaijan
**French-Azerbaijani University, ul. Nizami 183, Baku, AZ1010 Azerbaijan
In Alzheimer's disease, beta-amyloid peptide (Aβ) plays an important role in the mechanism of neurodegen-
eration. A small fragment of Aβ(25-35) (with the sequence GSNKGAIIGLLM) is regarded to be the func-
tional domain of Aβ, responsible for its neurotoxic properties and represents the biological active region of
Aβ. Conformational analysis of each C-terminal segment of the peptide by the method of molecular mechan-
ics revealed a limited number of most probable conformations and quite clearly helped to clarify what forces
stabilize the structures. The obtained results showed that Aβ(25-35) energetically has a propensity for adopt-
ing alpha-helix conformation of the C-terminal octapeptide segment. A molecular dynamics method was
used to build a model of intramolecular mobility in the Aβ(25-35) molecule. It was demonstrated that in low-
energy conformations, Aβ(25-35), the orientation of flexible structures of the N-terminal region with respect
to the structures of the C-terminal region is different.
Keywords: beta-amyloid peptide 25-35, conformation, molecular mechanics method, molecular dynamics method
БИОФИЗИКА том 68
№ 5
2023