БИОФИЗИКА, 2023, том 68, № 5, с. 885-891
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
УДК 577.322.7, 577.323.7, 535.56, 543.422.8
АНАЛИЗ ВТОРИЧНОЙ СТРУКТУРЫ ЛИНКЕРНЫХ БЕЛКОВ ХРОМАТИНА
HMGB1, H1 И ИХ КОМПЛЕКСОВ
© 2023 г. Е.В. Чихиржина*, А.М. Поляничко*, **, #
*Институт цитологии РАН, Тихорецкий просп., 4, Санкт-Петербург, 194064, Россия
**Санкт-Петербургский государственный университет,
Университетская наб., 7-9, Санкт-Петербург, 199034, Россия
#E-mail: a.polyanichko@spbu.ru
Поступила в редакцию 30.03.2023 г.
После доработки 20.04.2023 г.
Принята к публикации 03.05.2023 г.
Негистоновый хромосомный белок HMGB1 и гистон H1 представляют собой линкерные белки
хроматина. Функции линкерных белков тесно связаны с их конформационным состоянием. В
настоящее время активно изучается строение белков, играющих ключевую роль в формировании
высших уровней структурной организации хроматина. В данной работе проведен сравнительный
анализ вторичной структуры линкерного гистона H1 и негистонового белка HMGB1. Методами
кругового дихроизма в УФ-области и ИК-Фурье-спектроскопии показано, что положительно
заряженный гистон H1 связывается с С-концевым фрагментом HMGB1, стабилизируя
образующийся комплекс и индуцируя формирование дополнительных α-спиральных участков в
обоих белках.
Ключевые слова: линкерный гистон Н1, негистоновый хромосомный белок HMGB1, ИК-Фурье-
спектроскопия, круговой дихроизм.
DOI: 10.31857/S0006302923050071, EDN: PHSQYC
как транскрипция, репарация, рекомбинация
ДНК в ядре эукариотической клетки входит в
и др. [5, 7, 10].
состав сложного ДНК-белкового комплекса, спо-
собного обеспечивать не только его функциони-
Гистон Н1 состоит из центрального глобуляр-
рование, но и при необходимости высокую сте-
ного домена и двух неупорядоченных участков на
пень компактизации [1-6]. ДНК-связывающие
обоих концах полипептидной цепи [4, 11, 12].
белки в ядре клетки можно условно разделить на
Связывание гистона Н1 с ДНК происходит по
две большие группы - гистоновые и негистоно-
большой бороздке за счет глобулярного домена
вые белки хроматина. К первым относятся коро-
белка [4, 6]. Основными структурными элемента-
вые гистоны (Н2А, Н2В, Н3 и Н4), составляющие
ми белка HMGB1 являются два структурно кон-
белковую частицу, вокруг которой закручена
сервативных HMGB-домена, соединенных ко-
двойная спираль ДНК, и линкерный гистон Н1,
ротким линкером, и неупорядоченный отрица-
взаимодействующий с ДНК на межнуклеосом-
тельно заряженный С-концевой участок,
ных (линкерных) участках [3, 4, 6]. Среди осталь-
состоящий из непрерывной последовательности
ных (т. е. негистоновых) белков хроматина наи-
остатков глютаминовой и аспарагиновой амино-
более многочисленны представители обширной
кислот [5, 7, 9]. Белок HMGB1 взаимодействует с
группы белков с высокой электрофоретической
ДНК по малой бороздке посредством двух
подвижностью (High Mobility Group, или HMG),
HMGB-доменов, индуцируя заметный (до 130°)
некоторые из которых, так называемые белки
изгиб двойной спирали в направлении большой
HMGB, также функционируют в межнуклеосом-
бороздки [7]. При этом неупорядоченный С-кон-
ных областях хроматина [5, 7-9]. Эти белки ак-
цевой участок HMGB1 выступает в качестве мо-
тивно участвуют не только в регуляции структуры
дулятора межмолекулярных взаимодействий [5,
хроматина, но и принимают непосредственное
9]. Связываясь с ДНК по разным бороздкам, Н1 и
участие во многих клеточных процессах, таких
HMGB1 не только изменяют структуру ДНК
Сокращения: КД - круговой дихроизм, ИК - инфракрас-
сходным образом, но и способны узнавать и пред-
ный.
почтительно взаимодействовать с участками
885
886
ЧИХИРЖИНА, ПОЛЯНИЧКО
ДНК, обладающими различными структурными
нарушениями [3, 13, 14].
Функции линкерных белков тесно связаны с
их конформационным состоянием [9, 15-17]. В
настоящее время активно изучается строение
белков, играющих ключевую роль в формирова-
нии высших (наднуклеосомных) уровней струк-
турной организации хроматина. Наиболее рас-
пространенным методом первичного исследова-
ния структуры биополимеров является метод
кругового дихроизма (КД) в ультрафиолетовом
диапазоне [18-26]. Этот метод позволяет оцени-
вать основные параметры вторичной структуры
белков и нуклеиновых кислот, однако имеет
ограниченную применимость для изучения вто-
ричной структуры белков в составе надмолеку-
лярных комплексов. По этой причине за послед-
нее время вырос интерес к анализу колебатель-
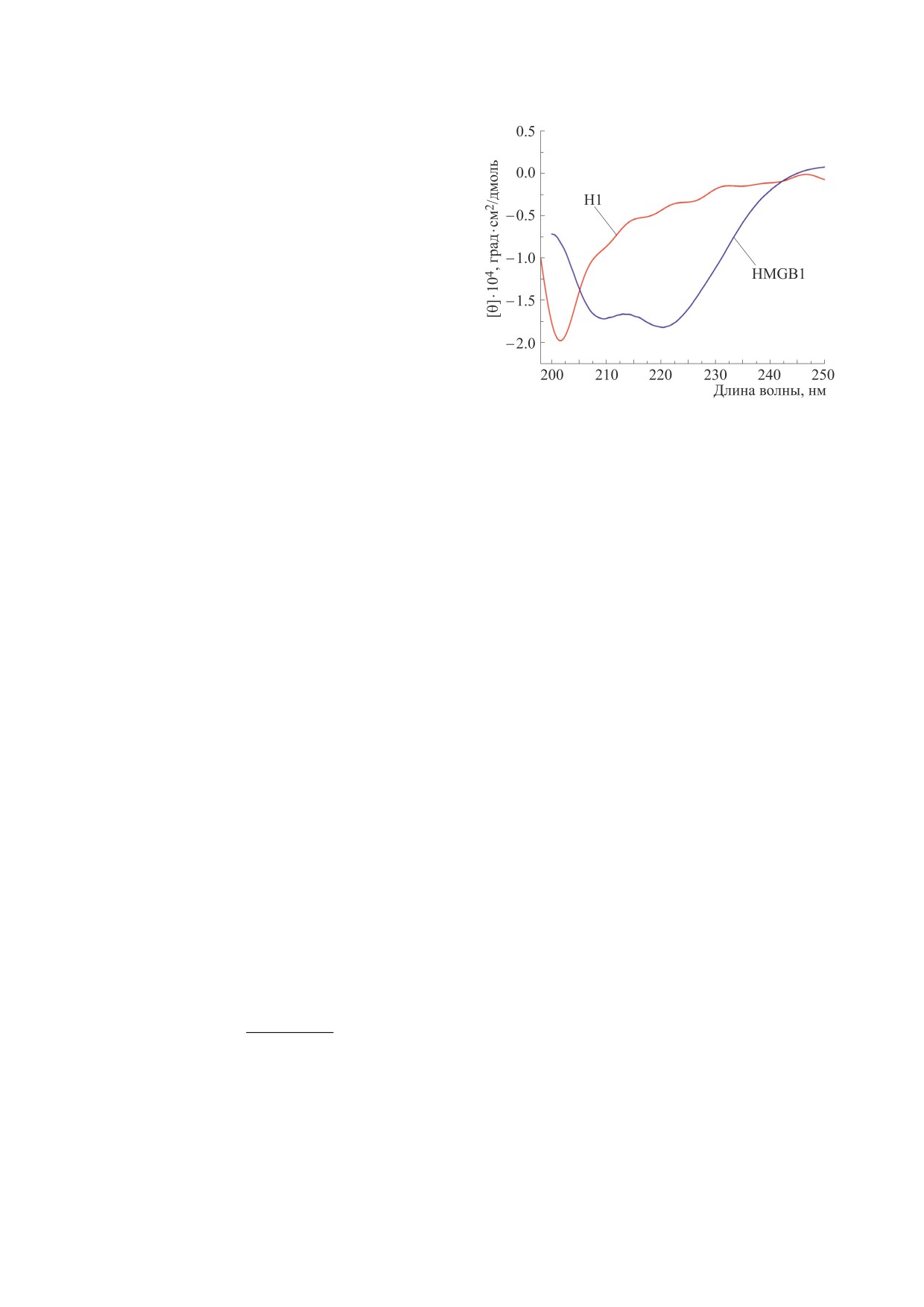
Рис. 1. КД-спектры негистонового белка HMGB1 и
ных спектров биомолекул. В частности, анализ
линкерного гистона H1.
спектров инфракрасного (ИК) поглощения поз-
воляет получить более точную и обширную ин-
формацию о вторичной структуре белковой моле-
нее методике [34]. Полученные образцы исследо-
кулы [27-29] по сравнению с традиционными ме-
вали в таблетках KBr на ИК-Фурье-спектрометре
тодами кругового дихроизма в ультрафиолетовом
Nicolet 6700 (Thermo Scientific, США), снабжен-
диапазоне.
ном низкошумящим MCT (HgCdTe) детектором.
В данной работе проведен сравнительный ана-
Регистрацию спектров проводили с разрешением
лиз вторичной структуры линкерного гистона H1
2 см-1 и усредняли по 128 накоплениям. Первич-
и негистонового белка HMGB1 с помощью КД-
ную обработку и анализ спектров проводили с по-
спектроскопии в ультрафиолетовой области
мощью программного обеспечения, поставляе-
спектра и ИК-Фурье-спектроскопии.
мого с прибором.
МАТЕРИАЛЫ И МЕТОДЫ
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Ядерные белки HMGB1 (мол. масса 26500 Да)
и H1 (мол. масса 21000 Да) выделяли из тимуса те-
Для анализа вторичной структуры линкерного
лят экстракцией 5%-й хлорной кислотой с после-
гистона H1 и негистонового белка HMGB1 мы
дующим осаждением 5.5 объемами подкисленно-
использовали метод кругового дихроизма в уль-
го ацетона при -20°С в соответствии с ранее опи-
трафиолетовом диапазоне. Характерные КД-
санной методикой
[30]. Чистоту белков
спектры белков представлены на рис. 1. В спектре
проверяли методом электрофореза в полиакрила-
гистона H1 доминирует отрицательная полоса с
мидном геле в присутствии додецилсульфата на-
минимумом в окрестности 200 нм. Такая форма
трия [31]. КД-спектры белков регистрировали на
спектра характерна для полипептидных цепей с
дихрографе Mark V (Jobin Yvon, Франция) в ци-
преимущественно неупорядоченной структурой.
линдрических кварцевых кюветах с длиной опти-
Количественная оценка степени α-спиральности
ческого пути 0.5 см в диапазоне длин волн 200-
дает для гистона H1 величину порядка 15%. КД-
260 нм. Степень α-спиральности оценивали с ис-
спектр белка HMGB1 имеет характерный для α-
пользованием сервера K2D3 [32], а также по вели-
спиральной структуры профиль с двумя миниму-
чине молярной эллиптичности при 222 нм [θ222]
мами при 209 и 222 нм. Количественный анализ
[33], используя соотношение:
этого спектра позволяет получить оценку доли α-
спиральных участков в белковой молекуле около
55%.
[
]+
222
θ
3000
α(%) =
Несмотря на то, что линкерный гистон H1 и
39000
негистоновый белок HMGB1 изучаются на про-
тяжении многих лет, до сих пор нет исчерпываю-
Для измерения ИК-спектров готовили водные
растворы белков и их комплексов в присутствии
щих данных об их пространственной структуре,
15 мМ NaCl, которые затем подвергали лиофили-
полученных прямыми методами, такими как
зации. Таблетированные образцы готовили при
рентгеноструктурный анализ или метод ядерного
помощи ручного пресса согласно описанной ра-
магнитного резонанса. На сегодняшний день ре-
БИОФИЗИКА том 68
№ 5
2023
АНАЛИЗ ВТОРИЧНОЙ СТРУКТУРЫ ЛИНКЕРНЫХ БЕЛКОВ ХРОМАТИНА
887
Особенностью белков HMGB1 и H1 является
наличие большого числа заряженных аминокис-
лотных остатков. Однако в физиологических
условиях заряды этих белков противоположны по
знаку. В составе HMGB1 преобладают отрица-
тельно заряженные группы, преимущественно за
счет дикарбоновых аминокислот С-концевого
фрагмента, тогда как гистон H1, богатый остатка-
ми лизина и аргинина, заряжен положительно.
Обладая противоположными зарядами, эти белки
способны образовывать достаточно устойчивый
комплекс, и в физиологических условиях прояв-
ляют склонность к агрегации, что приводит к зна-
чительному рассеянию света в образце [28, 30, 41,
42]. Последнее обстоятельство не позволяет по-
лучить КД-спектры, пригодные для анализа вто-
ричной структуры таких систем [27, 41]. По этой
причине для изучения структуры этих белков в
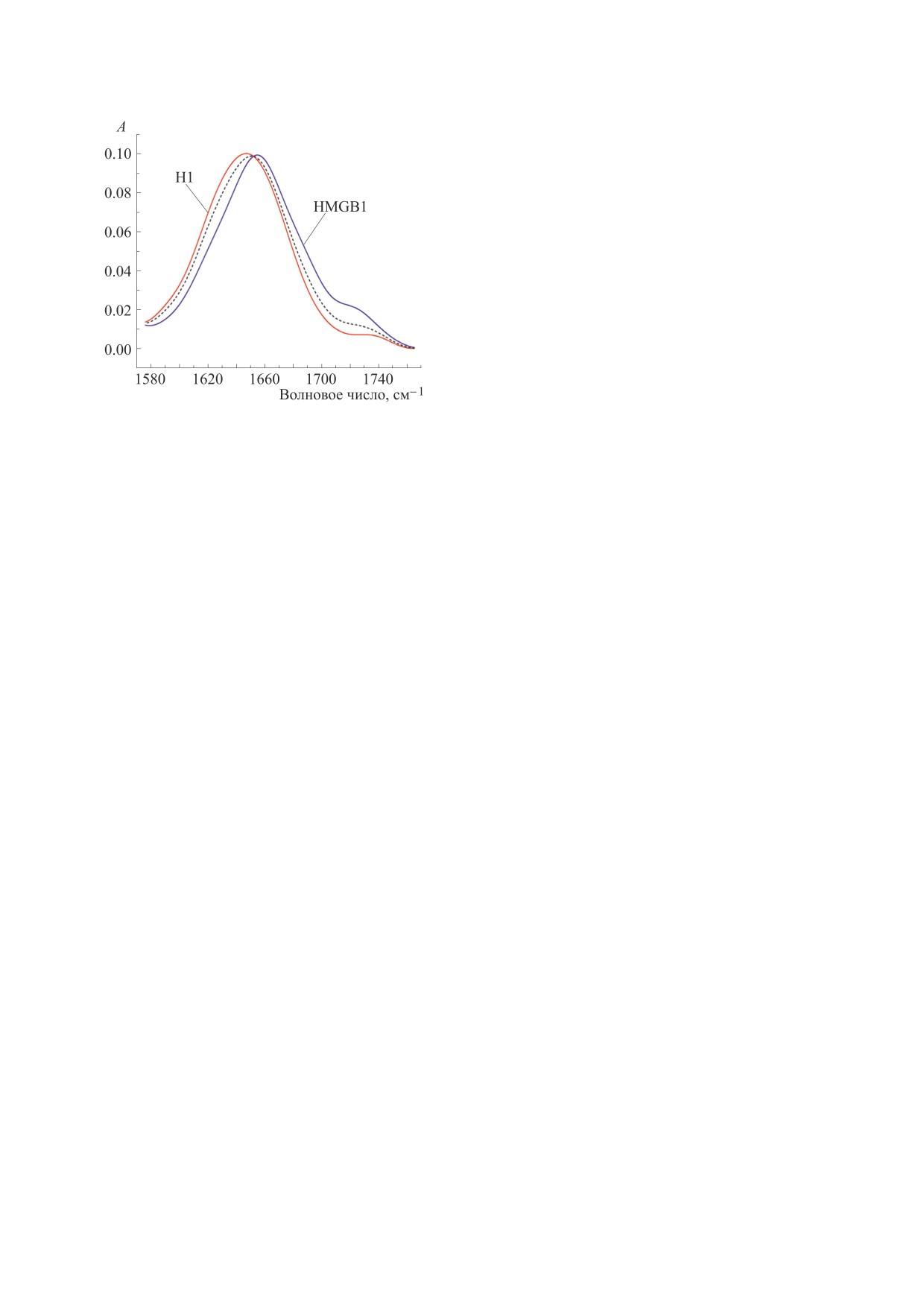
Рис. 2. Спектры ИК-поглощения негистонового белка
составе комплекса мы использовали метод ИК-
HMGB1 и линкерного гистона H1 в области полосы
«Амид I», полученные в таблетках KBr. Прерывистой
спектроскопии.
линией представлен спектр эквимолярной «смеси»
H1/HMGB1, полученный как сумма эксперименталь-
Пептиды и белки содержат в своей структуре
ных спектров отдельных белков, приведенных к соот-
многочисленные амидные группы, колебания ко-
ветствующей концентрации.
торых отчетливо проявляются в их ИК спектрах.
Характерные частоты этих колебаний находятся
шены лишь структуры отдельных изолированных
вблизи 1650, 1540 и 1240 см-1, а соответствующие
им полосы в ИК-спектре обычно называются по-
HMGB-доменов некоторых белков семейства
лосами «Амид I», «Амид II» и «Амид III» соответ-
HMGB [11, 12, 35] и глобулярного домена гистона
ственно. Данные спектральные полосы обуслов-
H1. Не так давно для этих белков были получены
лены преимущественно валентными колебаниями
предсказания пространственной структуры на
связей С=О, N-H, C-N и деформационными
основе численного эксперимента при помощи
колебаниями группы СNН в составе пептидной
алгоритма AlphaFold [36-39].
группы [43]. Для определения параметров вторич-
Полученные результаты хорошо согласуются с
ной структуры белков по спектрам ИК поглоще-
опубликованными ранее экспериментальными
ния мы анализировали полосу «Амид I» (1700-
данными. Анализ предсказанной структуры дает
1600 см-1), представляющую собой суперпози-
следующие оценки для основных параметров
цию колебаний, соответствующих разным кон-
вторичной структуры белков. Полипептидная
формациям полипептидных цепей (рис. 2). Эти
цепь линкерного гистона H1 содержит около 20%
колебания дают информацию об α-спиралях, β-
α-спиральных участков и порядка 80% участков в
структурах различного типа и неупорядочен-ных
неупорядоченной конформации. У негистоново-
участках белка. Отнесение полос поглоще-ния в
го белка HMGB1 в состав α-спиралей входят от
ИК спектре белков различным типам вто-
55% до 65% аминокислотных остатков. Разброс в
ричной структуры было описано ранее (см обзор
10% связан с тем, что α-спиральность на уровне
[44] и ссылки в нем).
55% обусловлена консервативной структурой
Для разложения полосы «Амид I» на составля-
HMGB-доменов в составе белка и подтверждена
ющие анализировали спектр второй производ-
экспериментально. Кроме того, численный экс-
ной, согласно описанной ранее методике [45,46].
перимент предсказал возможность формирова-
Долю каждого типа вторичной структуры оцени-
ния ещё 10% α-спиралей в отрицательно заря-
вали как площадь под соответствующим конту-
женном С-концевом фрагменте белка. Несмотря
ром, отнесенную к общей площади полосы
на то, что прямые структурные данные, подтвер-
«Амид I». Этот подход успешно применялся ра-
ждающие такую возможность, в настоящее время
нее для определения вторичной структуры раз-
отсутствуют, этот результат согласуется с анали-
личных белков [44-48]. В данной работе мы про-
зом ранее проведенных спектроскопических ис-
вели анализ вторичной структуры линкерного ги-
следований [40].
стона H1 и негистонового белка HMGB1.
БИОФИЗИКА том 68
№ 5
2023
888
ЧИХИРЖИНА, ПОЛЯНИЧКО
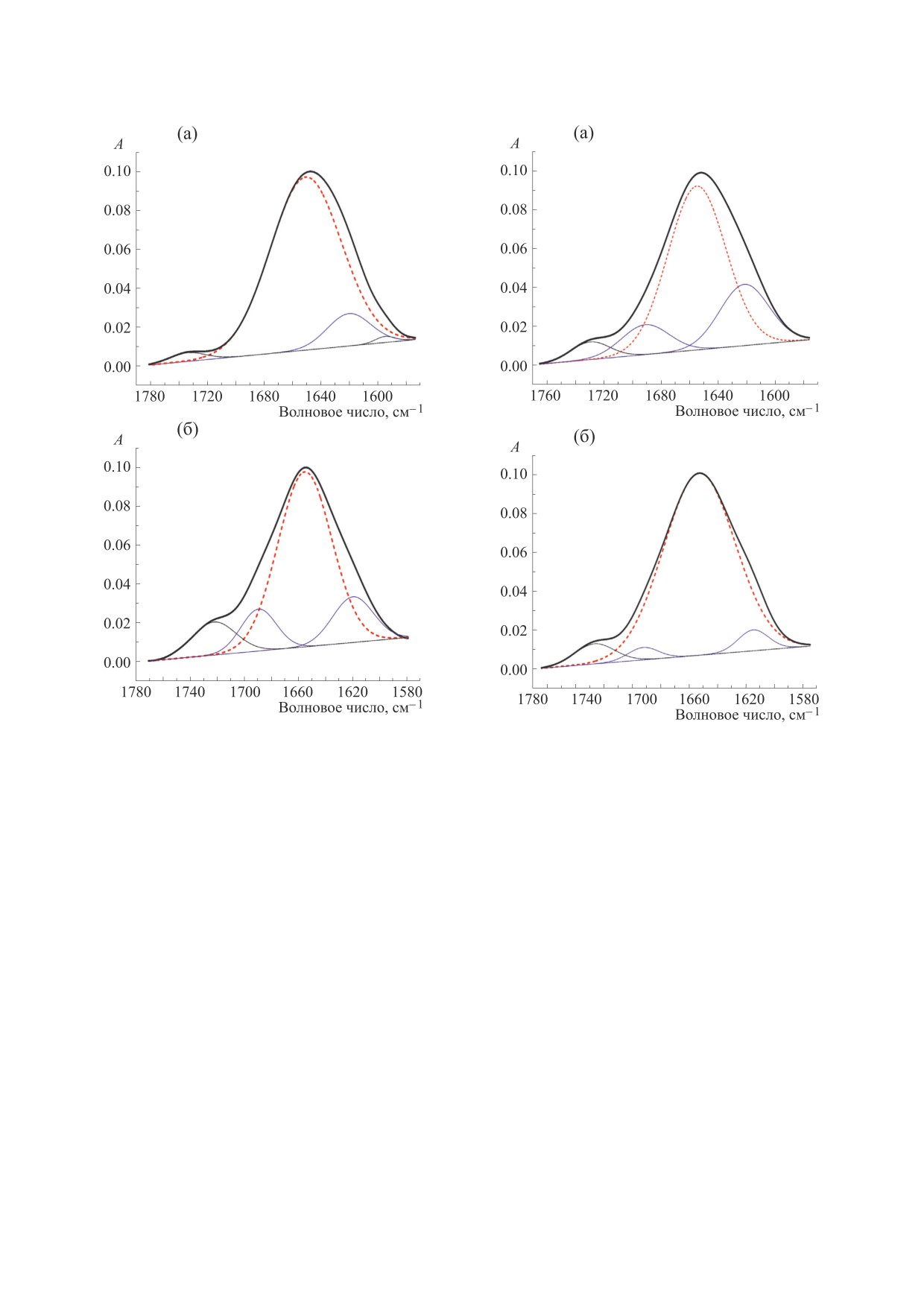
Рис. 3. Разложение полосы «Амид I» линкерного ги-
стона H1 (a) и негистонового хромосомного белка
Рис. 4. Разложение полосы «Амид I» методом второй
HMGB1 (б) методом второй производной. Прерыви-
производной для спектра эквимолярной «смеси»
стой линией представлены доминирующие в разложе-
H1/HMGB1, полученного как сумма эксперимен-
ниях полосы с максимумом: (а) при 1650 см-1, соот-
тальных спектров отдельных белков, приведенных к
ветствует неупорядоченной структуре полипептидной
соответствующей концентрации (а); спектра комп-
цепи; (б) при 1654 см-1, соответствует α-спиральной
лекса линкерного гистона H1 и негистонового хромо-
структуре полипептидной цепи.
сомного белка HMGB1 (б). Прерывистой линией
представлена доминирующая в разложениях полоса с
максимумом при
1654 см-1, соответствующая α-
Результаты разложения полосы «Амид I» в спек-
спиральной структуре полипептидной цепи.
трах белков представлены на рис. 3. Анализ полу-
ченных результатов показывает, что в составе по-
зультатами анализа КД-спектров, так и с теорети-
лосы «Амид I» спектра гистона H1 можно выде-
чески предсказанными структурами.
лить несколько составляющих, причем основной
Анализ вторичной структуры белков в составе
вклад (около 85%) приходится на полосу с макси-
комплекса H1-HMGB1 даст ответ на вопрос, со-
мумом в окрестности 1650 см-1, соответствую-
провождается ли формирование белкового ком-
щую неупорядоченной структуре полипептидной
плекса изменением структуры белков. Опираясь
цепи. Аналогичное разложение полосы «Амид I»
на полученные выше данные КД- и ИК-спектро-
в спектре HMGB1 демонстрирует, что основной
скопии, можно ожидать, что если формирование
вклад (около 65%) приходится на составляющую
комплекса H1-HMGB1 не приводит к изменени-
с максимум в окрестности 1655 см-1, соответству-
ям вторичной структуры белков, то общее содер-
ющую α-спиральным участкам. Полученные ре-
жание α-спиральных участков в комплексе соста-
зультаты находятся в разумном согласии как с ре-
вит порядка 60%. На рис. 2 представлен спектр
БИОФИЗИКА том 68
№ 5
2023
АНАЛИЗ ВТОРИЧНОЙ СТРУКТУРЫ ЛИНКЕРНЫХ БЕЛКОВ ХРОМАТИНА
889
«смеси» H1/HMGB1, полученный как сумма экс-
увеличение α-спиральности отражает изменения
периментальных спектров отдельных белков,
вторичной структуры белков происходящих при
приведенных к соответствующей концентрации.
формировании комплексов.
Анализ полосы «Амид I» этого спектра (рис. 4а)
показал, что в разложении доминирует полоса с
ЗАКЛЮЧЕНИЕ
максимумом в окрестности 1654 см-1, соответ-
Анализ вторичной структуры ядерных белков
ствующая α-спиральным элементам. Количе-
линкерного гистона H1 и негистонового белка
ственная оценка α-спиральности «смеси» белков
HMGB1 с использованием двух различных под-
дает величину 62%, близкую к ожидаемой. Для
ходов (КД- и ИК-спектроскопии) дает хорошо
анализа изменений вторичной структуры белков,
согласующиеся между собой результаты. Взаимо-
вызванных их взаимодействием, мы проанализи-
действие белков HMGB1 и H1 очень быстро при-
ровали ИК спектр их комплекса (рис. 4б). Коли-
водит к образованию в растворе достаточно круп-
чественный анализ разложения полосы «Амид I»
ных рассеивающих комплексов, что затрудняет
дает оценку степени α-спиральности в комплексе
анализ КД-спектров в ультрафиолетовой обла-
на уровне 85%. Данный результат показывает, что
сти. Вместе, даже такие относительно крупные
взаимодействие белков HMGB1 и H1 сопровож-
белковые комплексы не рассеивают свет в инфра-
дается изменением вторичной структуры, как ми-
красной области спектра, что позволяет анализи-
нимум одного из белков.
ровать вторичную структуру белков в комплексе
по их спектрам ИК поглощения.
Опираясь на результаты предсказания струк-
туры HMGB1 [38], можно предположить, что уве-
На основании анализа данных ИК-спектро-
личение доли α-спиральных участков в составе
скопии мы предположили, что первичное образо-
этого белка возможно за счет структуризации С-
вание комплекса происходит за счет электроста-
концевой последовательности дикарбоновых
тического взаимодействия между отрицательно
аминокислот. Обладая отрицательным зарядом,
заряженным С-концевым участком HMGB1 и
данная последовательность принимает активное
положительно заряженными группами гистона
участие в межмолекулярных взаимодействиях, в
H1. Последующее изменение вторичной структу-
том числе с другими белками, за счет взаимодей-
ры белков в комплексе приводит к образованию
ствия с их положительно заряженными группами
дополнительных α-спиральных участков в обоих
[5, 7, 9, 35]. Такой механизм, вероятнее всего, ре-
белках. Мы полагаем, что полученные данные бу-
ализуется и при взаимодействии с линкерным ги-
дут полезны при изучении структурных перестро-
стоном H1, богатым остатками лизина и аргини-
ек в хроматине на наднуклеосомном уровне. В
на, несущими положительный заряд [4, 49, 50].
частности, механизмы взаимодействия белков на
Однако увеличение доли α-спиральных участков
межнуклеосомном участке хроматина, подобные
в эквимолярном комплексе более чем на 20% по
тем, что были описаны в данной работе, могут
сравнению с исходным уровнем не может объяс-
оказаться существенными также в процессах эпи-
няться только лишь изменениями в структуре
генетического регулирования степени компакти-
HMGB1, так как соответствует увеличению α-
зации хроматина. На сегодняшний день остается
спиральности белка HMGB1 до уровня, превы-
открытым вопрос и о взаимодействии определен-
шающего 100%. Вместе с тем, согласно ранее
ных вариантов гистона Н1 с белком HMGB1, и о
опубликованным данным, для гистона H1 при
том, какое влияние эти взаимодействия могут
некоторых межмолекулярных взаимодействиях
оказывать на структуру и конкретные функции
также характерно формирование новых α-спи-
генома. Кроме того, знание механизма взаимо-
ральных участков [4, 19]. Поэтому при взаимо-
действия гистона Н1 и белка HMGB1 необходимо
действии между гистоном H1 и негистоновым
для понимания механизмов их взаимодействия с
белком HMGB1, скорее всего, наблюдается изме-
другими молекулам-партнерами при формирова-
нение в структуре обоих белков.
нии сложных функционально-значимых ком-
плексов в хроматине.
Таким образом, опираясь на полученные ре-
зультаты, мы предполагаем, что положительно
заряженный гистон H1 связывается с С-конце-
БЛАГОДАРНОСТИ
вым фрагментом HMGB1, стабилизируя образу-
ющийся комплекс и индуцируя формирование
Работа выполнена с использованием оборудо-
дополнительных α-спиральных участков в обоих
вания Научного парка СПбГУ (ресурсные центры
белках. Следует отметить, что, хотя реальный
«Оптические и лазерные методы исследования
процент состава вторичной структуры в растворе,
вещества», «Центр диагностики функциональ-
скорее всего, отличается от цифр, определенных
ных материалов для медицины фармакологии и
в сухом состоянии, тем не менее наблюдаемое
наноэлектроники», «Криогенный отдел»).
БИОФИЗИКА том 68
№ 5
2023
890
ЧИХИРЖИНА, ПОЛЯНИЧКО
КОНФЛИКТ ИНТЕРЕСОВ
23. A. Micsonai, F. Wien, L. Kernya, and J. Kardos, Bio-
phys. Comput. Biol., 112, E3095 (2015).
Авторы заявляют об отсутствии конфликта
24. Е. В. Чихиржина, Е. И. Костылева, В. И. Воробьев
интересов.
и А. М. Поляничко, Цитология 60, 923 (2018).
25. Y. Izumi, K. Matsuo, K. Fujii, et al., J. Radiat. Res., 59,
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
108 (2018).
Настоящая работа не содержит описания ка-
26. A. J. Miles, R. W. Janes, and B. A. Wallace, Chem. Soc.
ких-либо исследований с использованием людей
Rev., 50, 8400 (2021).
и животных в качестве объектов.
27. A. Polyanichko and H. Wieser, Biopolymers, 78, 329
(2005).
28. A. Polyanichko and E. Chikhirzhina, J. Mol. Struct.,
СПИСОК ЛИТЕРАТУРЫ
1044, 167 (2013).
1.
C. L. Woodcock and R. P. Ghosh, Cold Spring Harb.
29. А. М. Поляничко, В. И. Воробьев и Е. В. Чихиржи-
Perspect. Biol., 2, a000296 (2010).
на, Молекуляр. биология, 47, 338 (2013).
2.
K. Luger, M. L. Dechassa, and D. J. Tremethick, Nat.
30. Е. В. Чихиржина, А. М. Поляничко, А. Н. Сквор-
Rev. Mol. Cell Biol., 13, 436 (2012).
цов и др., Молекуляр. биология, 36, 525 (2002).
3.
A. E. White, A. R. Hieb, and K. Luger, Sci. Rep., 6,
31. U. K. Laemmli, Nature, 227, 680 (1970).
19122 (2016).
32. A. Louis-Jeune, M. A. Andrade-Navarro, and C. Pe-
4.
Е. В. Чихиржина, Т. Ю. Старкова и А. М. Поля-
rez-Iratxeta, Proteins, 80, 374 (2012).
ничко, Биофизика, 63, 1070 (2018).
33. J. A. Morrow, M. L. Segall, S. Lund-Katz et al., Bio-
5.
E. V. Chikhirzhina, T. Y. Starkova, A. Beljajev, et al.,
chemistry, 39 (38), 11657 (2000).
Int. J. Mol. Sci., 21, 7948 (2020).
34. Е. Е. Тымченко, А. А. Солдатова, Е. В. Чихиржина
6.
Е. В. Чихиржина, Т. Ю. Старкова и А. М. Поля-
и А. М. Поляничко, Биофизика, 67, 22 (2022).
ничко, Биофизика, 65, 237 (2020).
35. A. M. Read, P. D. Cary, C. Crane-Robinson, et al.,
7.
R. Reeves, DNA Repair, 36, 122 (2015).
Nucl. Acids Res., 21, 3427 (1993).
8.
Е. В. Чихиржина, А. М. Поляничко и Т. Ю. Стар-
36. J. Jumper, R. Evans, A. Pritzel, et al., Nature, 596, 583
кова, Цитология, 62, 716 (2020).
(2021).
9.
E. V. Chikhirzhina, T. Yu. Starkova, and A. M. Polyan-
37. M. Varadi, S. Anyango, M. Deshpande, et al., Nucl.
ichko, Biophysics, 66, 373 (2021).
Acids Res., 50 (D1), D439 (2022).
10.
A. Raucci, S. Di Maggio, F. Scavello, et al., Cell Mol.
Life Sci., 76, 211 (2019)
11.
V. Ramakrishnan, J. T. Fich, V. Graziano, et al., Na-
40. Т. Ю. Родионова, Е. В. Чихиржина, В. И. Воробьев
ture, 362, 219 (1993).
и А. М. Поляничко, Журн. структур. химии 50,
12.
C. Cerf, G. Lippens, V. Ramakrishnan, et al., Bio-
1009 (2009).
chemistry, 33, 11079 (1994).
41. M. Polyanichko, E. V. Chikhirzhina, A. N. Skvortsov,
13.
Y. V. Postnikov and M. Bustin, Biochim. Biophys. Ac-
et al., J. Biomolec. Struct. Dyn., 19, 1053 (2002).
ta, 1859, 462 (2016).
42. L. A. Kohlstaedt and R. D. Cole, Biochemistry, 3, 570
14.
F. Totsingan and A. J. Jr. Bell, Prot. Sci., 22, 1552
(1994).
(2013).
43. S. Kint and Y. A. Tomimatsu, Biopolimers, 18, 1073
15.
Е. В. Чихиржина, Е. И. Костылева, А. М. Поля-
(1979).
ничко и В. И. Воробьев, Цитология, 40, 883 (1998).
44. A. Barth, Biochim. Biophys. Acta, 1767, 1073 (2007).
16.
M. Watson, K. Stottm, and J. O. Thomas, Mol. Biol.,
374, 1286 (2007).
45. А. М. Поляничко, Н. М. Романов, Т. Ю. Старкова
и др., Цитология, 56, 316 (2014).
17.
K. Stott, M. Watson, F. S. Howe, et al., J. Mol. Biol.,
403, 706 (2010).
46. Е. А. Тельная, Л. В. Плотникова, А. Д. Гарифуллин
и др., Биофизика, 65, 1154 (2020).
18.
J. Zlatanova and J. Yaneva, DNA Cell Biol., 10, 239
(1991).
47. Л. В. Плотникова, А. М. Поляничко, М. В. Успен-
19.
Е. И. Рамм, Е. В. Чихиржина, Е. И. Костылева и
ская и др., Вестн. Санкт-Петербургского ун-та, 4,
В. И. Воробьев, Биохимия, 59, 150 (1995).
34 (2017).
48. Л. В. Плотникова, М. О. Кобелева, Е. В. Борисов
20. N. J. Greenfield, Nature Protocols, 1, 2876 (2006).
и др., Цитология, 60, 1037 (2018).
21. Е. В. Чихиржина, А. М. Поляничко, Е. И. Косты-
лева и В. И. Воробьев, Молекуляр. биология, 45,
49. J. Allan, T. Mitchell, and N. Harborne, J. Mol. Biol.,
356 (2011).
187, 591 (1986).
22. A. M. Polyanichko, V. V. Andrushchenko, P. Bour,
50. R. Vila, I. Ponte, M. Collado, et al., J. Biol. Chem.,
et al., In Circular Dichroism: Theory and Spectroscopy,
276, 46429 (2001).
ed. by D. S. Rodgers (Nova Science Publishers, N.-Y.,
51. Е. И. Рамм, Е. В. Чихиржина, Е. И. Костылева и
2012), pp. 67-126.
В. И. Воробьев, Биохимия, 59, 150 (1995).
БИОФИЗИКА том 68
№ 5
2023
АНАЛИЗ ВТОРИЧНОЙ СТРУКТУРЫ ЛИНКЕРНЫХ БЕЛКОВ ХРОМАТИНА
891
Analysis of the Secondary Structure of Chromatin Linker Proteins HMGB1, H1
and Their Complexes
E.V. Chikhirzhina* and A.M. Polyanichko*, **
*Institute of Cytology, Russian Academy of Sciences, Tikhoretsky prosp. 4, Saint-Petersburg, 194064 Russia
**St Petersburg State University, Universitetskaya nab. 7-9, Saint-Petersburg, 199034 Russia
The nonhistone chromosomal protein HMGB1 and histone H1 are chromatin linker proteins. The functions
of linker proteins are closely related to their conformational state. Currently, the structure of proteins that play
a key role in the formation of higher levels of chromatin structural organization is being actively studied. In
this work, a comparative analysis of the secondary structure of the linker histone H1 and the nonhistone pro-
tein HMGB1 was carried out. By using UV-circular dichroism and FTIR spectroscopy it was shown that the
positively charged histone H1 binds to the C-terminal fragment of HMGB1, stabilizing the resulting complex
and inducing the formation of additional α-helical regions in both proteins.
Keywords: linker histone Н1, nonhistone chromosomal protein HMGB1, FTIR spectroscopy, circular dichroism
БИОФИЗИКА том 68
№ 5
2023