БИОФИЗИКА, 2023, том 68, № 6, с. 1180-1186
БИОФИЗИКА КЛЕТКИ
УДК 577.3
СНИЖЕНИЕ ФОНОВОЙ ПРОДУКЦИИ АКТИВНЫХ ФОРМ КИСЛОРОДА
НЕЙТРОФИЛАМИ ПОСЛЕ ДЕЙСТВИЯ ГИПОМАГНИТНОГО ПОЛЯ
НЕ СОПРОВОЖДАЕТСЯ НАРУШЕНИЕМ
ИХ ХЕМИЛЮМИНЕСЦЕНТНОГО ОТВЕТА
НА АКТИВАТОРЫ РЕСПИРАТОРНОГО ВЗРЫВА
© 2023 г. В.В. Новиков*, #, Е.В. Яблокова*, И.А. Шаев*, Н.И. Новикова**, Е.Е. Фесенко*
*Институт биофизики клетки - обособленное подразделение ФИЦ «Пущинский научный центр биологических
исследований РАН», Институтская ул., 3, Пущино Московской области, 142290, Россия
#E-mail: docmag@mail.ru
**Филиал Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН,
просп. Науки, 6, Пущино Московской области, 142290, Россия
Поступила в редакцию 30.08.2023 г.
После доработки 03.09.2023 г.
Принята к публикации 06.09.2023 г.
Показано, что снижение фоновой продукции активных форм кислорода в перитонеальных
нейтрофилах мышей после кратковременного (40 минут) пребывания в гипомагнитных условиях
(остаточное поле ∼ 10 нТл) при физиологических температурах, выявляемое методом люцигенин-
зависимой хемилюминесценции, не сопровождается нарушением хемилюминесцентного ответа на
активаторы респираторного взрыва: формилированный пептид N-formyl-Met-Leu-Phe (fMLF) и
форболовый эфир форбол-12-меристат-13-ацетата (ФМА). Эти результаты получены методами
активированной хемилюминесценции с использованием люцигенина и люминола и различных
комбинаций применения активаторов продукции активных форм кислорода (форбол-12-меристат-
13-ацетат и/или N-formyl-Met-Leu-Phe). Проведенное исследование, в совокупности с ранее
полученными результатами, позволяет исключить системы, контролирующие респираторный
взрыв в нейтрофилах, из числа основных мишеней и акцепторов, реагирующих на
кратковременную депривацию магнитного поля.
Ключевые слова: гипомагнитное поле, нейтрофилы, активные формы кислорода, люцигенин, люминол,
хемилюминесценция.
DOI: 10.31857/S0006302923060091, EDN: RORBZG
использованием люцигенина [7], активатора хе-
Гипомагнитное поле относится к биологиче-
милюминесценции, относительно селективного
ски активным физическим факторам, и биофизи-
для супероксидного радикала [8]. При добавке
ческие механизмы его действия нуждаются в де-
малых концентраций (<1 мкМ) активаторов ре-
тальном изучении [1-5]. Ранее мы показали, что
спираторного взрыва, формилированного пепти-
в результате пребывания нейтрофилов в ослаб-
да N-formyl-Met-Leu-Phe (fMLF) или форболо-
ленном (в ∼2500 раз) с помощью системы магнит-
вого эфира форбол-12-меристат-13-ацетата
ных экранов геомагнитном поле фоновая продук-
(ФМА), в случае детекции флуоресцентным ме-
ция активных форм кислорода (АФК) в них суще-
тодом этот эффект гипомагнитного поля сохра-
ственно снижалась [6]. Эти результаты были
нялся, но по величине соответствовал эффектам,
получены методами флуоресцентной спектро-
полученным в опытах без этих активаторов [6].
скопии с использованием проникающих в клетку
На основании этих результатов было сложно сде-
флуоресцентных зондов (дихлордигидрофлуо-
лать выводы об основных источниках АФК, реа-
ресцеина-диацетата и дигидрородамина 123), а
гирующих на изменение магнитных условий. Да-
также методом хемилюминесцентного анализа с
лее с использованием ингибиторного анализа в
опытах на неактивированных нейтрофилах было
Сокращения: АФК - активные формы кислорода, fMLF -
N-formyl-Met-Leu-Phe, ФМА - форбол-12-меристат-13-
показано, что добавка динитрофенола - разоб-
ацетат.
щителя окисления и фосфорилирования в мито-
1180
СНИЖЕНИЕ ФОНОВОЙ ПРОДУКЦИИ АКТИВНЫХ ФОРМ КИСЛОРОДА
1181
хондриях - практически полностью нивелирует
милюминесценцию нейтрофилов и перевести эти
различия в продукции АФК между контрольны-
клетки в «одинаковое» состояние, характеризую-
ми (геомагнитное поле) и опытными (гипомаг-
щееся их равномерным хемилюминесцентным
нитное поле) группами, в отличие от дифенилйо-
ответом, что обеспечивало возможность стабиль-
дония - неспецифического ингибитора НАДФН-
ной работы с ними в течение экспериментально-
оксидазы, добавка которого приводила к сниже-
го дня. Количество выделенных клеток подсчи-
нию продукции АФК в обоих случаях и сохране-
тывали в камере Горяева. Жизнеспособность кле-
нию различий между контролем и опытом [7].
ток определяли, используя витальный краситель
Также на величину эффекта гипомагнитного по-
трипановый синий. Содержание живых клеток
ля влияла добавка ротенона (ингибитора ком-
при этом составляло не менее 98%.
плекса 1 ЭТС в митохондриях) [9]. Все эти резуль-
Для выполнения экспериментов суспензию
таты в большей степени свидетельствовали о роли
нейтрофилов разводили модифицированной
митохондрий, а не НАДФН-оксидазы в эффектах
средой Хенкса (138 мM NaCl, 6 мM KCl, 1 мМ
ослабленного геомагнитного поля. В связи с этим
MgSO4, 1 мM Na2HPO4, 5 мM NaHCO3, 5.5 мM
для более полного анализа эффектов гипомагнит-
ного поля в данной работе были проведены спе-
глюкозы, 1 мM CaCl2, 10 мМ HEPES, pH 7.4; Sig-
циальные эксперименты, чтобы определить, как
ma, США) до концентрации 1 млн кл/мл. Образ-
пребывание в гипомагнитном поле влияет на хе-
цы объемом 0.25 мл помещали в круглодонные
милюминесцентный ответ нейтрофилов на вве-
кюветы из полистирола (d = 1.2 см, l = 5.5 см), в
дение активаторов респираторного взрыва.
которых в дальнейшем проводили измерение хе-
милюминесценции. Нейтрофилы инкубировали
при 37.0 ± 0.1°С в течение 40 мин. Заданную тем-
МАТЕРИАЛЫ И МЕТОДЫ
пературу поддерживали с помощью циркуляци-
онного водного термостата UH 4 (MLW, Герма-
Действие гипомагнитного поля проверяли на
ния).
способность осуществлять предактивацию (прай-
минг)/деактивацию нейтрофилов. Для проверки
Образцы контрольных групп находились в ло-
этого действия суспензию нейтрофилов предва-
кальном геомагнитном поле с постоянной со-
рительно инкубировали на протяжении 40 мин в
ставляющей ∼44 мкТл и уровнем магнитного фо-
гипомагнитных условиях, затем к ней добавляли
на на 50 Гц 15-50 нТл при таком же температур-
активатор хемилюминесценции (люминол или
ном режиме, как и опытные образцы, и
люцигенин) и один из активаторов респиратор-
одновременно с ними (также одновременно про-
ного взрыва (формилированный пептид fMLF
водилась последующая регистрация хемилюми-
или другой активатор генерации АФК, форболо-
несценции контрольных и экспериментальных
вый эфир ФМА). Также проверяли варианты сов-
образцов). В опытах была использована специ-
местного использования этих двух активаторов
альная исследовательская аппаратура - установ-
продукции АФК, о чем будет сказано ниже.
ка для формирования гипомагнитных условий,
Работа выполнена на перитонеальных нейтро-
которая позволяла получить высокую степень
филах мышей. Для получения перитонеальных
ослабления геомагнитного поля - до 10000 раз
нейтрофилов использованы лабораторные мы-
(остаточное постоянное поле не превышало
ши-самцы линии Balb/c массой 24-26 г, получен-
10 нТл) и существенно ослабляла переменные
ные из питомника лабораторных животных
техногенные помехи (до единиц нТл). Эта уста-
ФИБХ РАН (Пущино, Московская область). Для
новка детально описана нами ранее [10]. Уста-
выполнения измерений в рамках одного экспери-
новка состояла из трех, вставленных соосно один
ментального дня использовали суспензию ней-
в другой цилиндрических магнитных экранов из
трофилов, полученную из одной мыши. Выделе-
пермаллоя (толщиной 1 мм) и была снабжена
ние клеток проводили в день проведения измере-
внутри специальным индуктором (соленоидом)
ний. Для получения клеток в перитонеальную
для проведения размагничивания системы и по-
полость мыши инъецировали 150 мкл суспензии
дачи в случае необходимости слабого постоянно-
опсонизированного зимозана с концентрацией
го тока для формирования постоянного магнит-
5 мг/мл (Zymozan A из Saccharomyces carevisiae,
ного поля заданной величины. Определение
Sigma, США). После этого через 16 ч животных
остаточных полей внутри установки проводили
умерщвляли методом цервикальной дислокации,
прямым измерением с помощью феррозондового
их брюшную полость промывали 3 мл охлажден-
магнитометра Mag-03 MS 100 (Bartington, Вели-
ного раствора Хенкса без кальция. Экссудат соби-
кобритания). Размеры экспериментального
рали пипеткой и центрифугировали в течение
участка внутри системы экранов (диаметр 20 см,
5 мин при 600 g. Супернатант декантировали, а
длина 40 см) позволяли поместить одновременно
осадок разводили в 1 мл бескальциевого раствора
в зону однородного слабого магнитного поля до-
Хенкса и оставляли не менее чем на 1 ч при 4°C.
статочное для опытов число экспериментальных
Эта процедура позволяла снизить спонтанную хе-
образцов (не менее 6).
БИОФИЗИКА том 68
№ 6
2023
1182
НОВИКОВ и др.
После инкубации нейтрофилов измеряли ин-
тов и регистрации люминол-зависимой хемилю-
тенсивность хемилюминесценции полученных
минесценции.
образцов при добавке в них раствора люминола
Результаты статистически обработаны с при-
(Enzo Life Sciences, США) в конечной концентра-
менением t-критерия Стьюдента. Значения ин-
ции 0.35 мМ. В суспензию нейтрофилов помимо
тенсивности люминесценции соответствовали
люминола был добавлен активатор генерации
световому потоку, т.е. количеству фотонов в еди-
АФК - хемотаксический формилированный
ницу времени: 1 вольт (В) соответствал ≈ 1000 фо-
пептид N-формил-Met-Leu-Phe (Sigma, США) в
тонов/сек. Часть результатов представлена для
конечной концентрации 1 мкМ. В разных вари-
наглядности в процентах по отношению к ампли-
антах опытов были использованы и другие кон-
тудам хемилюминесцентного ответа в контроле,
центрации fMLF. Для регистрации хемилюми-
принятым за 100%.
несценции был использован 12-канальный хеми-
люминометр Lum-1200 (ООО
«ДИСофт»,
Россия). Для анализа результатов использована
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
программа PowerGraph.
После инкубации суспензии нейтрофилов в
течение 40 мин в гипомагнитных условиях реги-
В части опытов вместо fMLF был добавлен
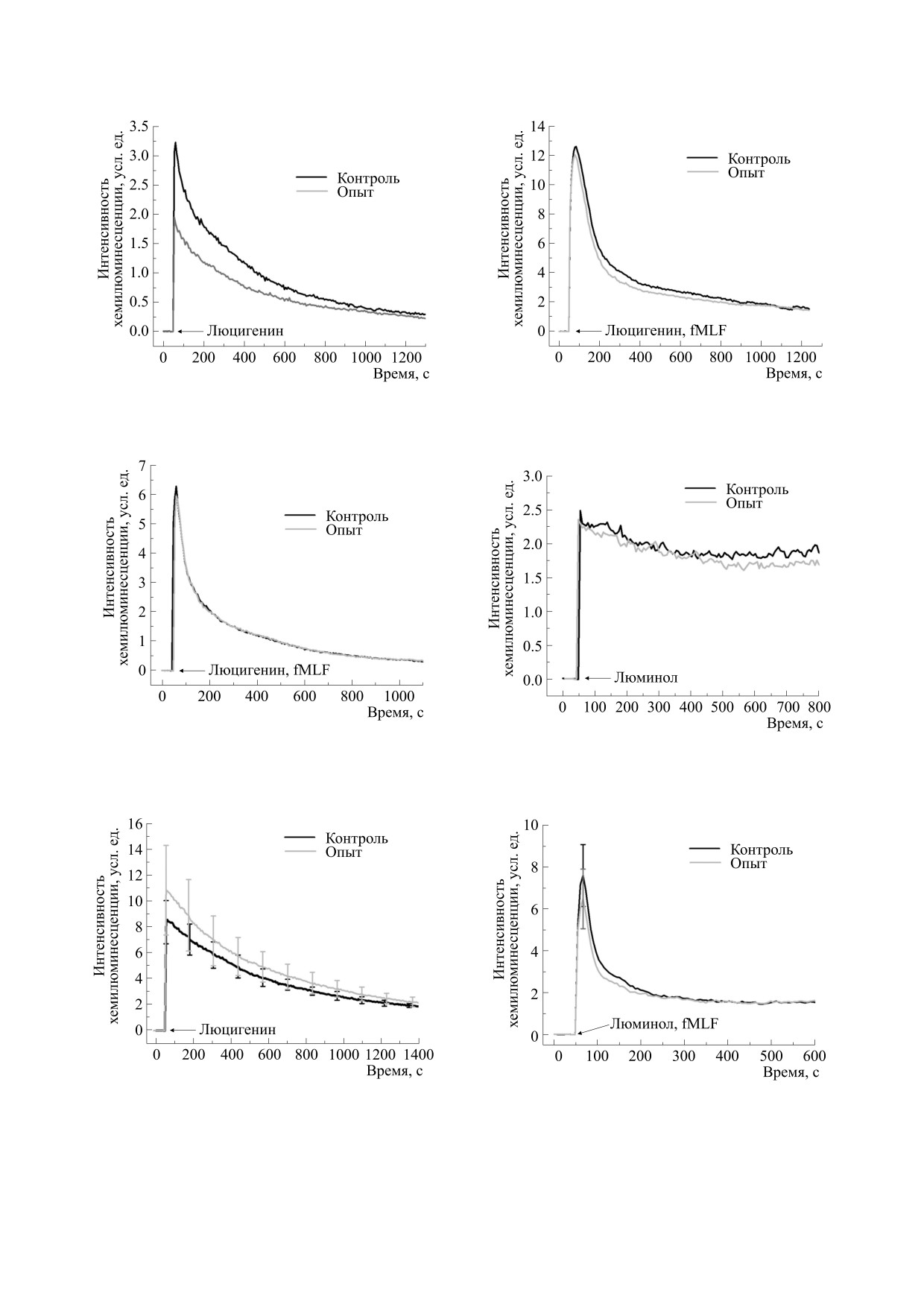
стрируется существенное снижение (примерно
другой активатор генерации АФК - форболовый
эфир форбол-12-меристат-13-ацетат (Sigma,
на 30%) хемилюминесцентного сигнала на введе-
США) в низких концентрациях (5 или 20 нМ).
ние 0.4 мМ люцигенина (табл. 1, рис. 1), что со-
гласуется с данными предыдущих работ [7, 14].
В другой части опытов была использована схе-
Введение активатора продукции АФК - 1 мкМ
ма двойной последовательной стимуляции ней-
fMLF - приводит к существенному (двукратно-
трофилов [11]. Для этого до начала инкубации в
му) росту амплитуды сигнала люцигенин-зависи-
гипомагнитном поле в суспензию клеток был до-
мой хемилюминесценции и нивелирует различия
бавлен активатор генерации АФК - ФМА в кон-
между контрольными и опытными образцами
центрации 5 нМ, а после окончания инкубации
(табл. 1, рис. 2). Также не проявляются различия
хемилюминесцентный ответ регистрировали в
при инкубации нейтрофилов в присутствии 5 нМ
ответ на введение люминола и пептида fMLF. В
ФМА и последующем введении 0.2 мМ люциге-
этом случае на первом этапе опытов нейтрофилы
нина (табл. 1, рис. 3), и в опытах с двойной после-
стимулировали ФМА, агентом с внутриклеточ-
довательной стимуляцией 5 нМ ФМА и 1 мкМ
ным механизмом действия (имитирующим диа-
fMLF (табл. 1, рис. 4). Таким образом, эти экспе-
цилглицерол и напрямую активирующим мем-
рименты, проведенные методом люцигенин-за-
бранную протеинкиназу С [12]), а на втором этапе
висимой хемилюминесценции, в совокупности
(при регистрации хемилюминесценции) прово-
показывают, что реакция систем нейтрофилов по
дили основную стимуляцию fMLF, агентом с вне-
продукции супероксида на введение активаторов
клеточным механизмом действия (осуществляю-
респираторного взрыва после кратковременного
щим передачу сигнала через рецепторы fMLP
пребывания в гипомагнитных условиях полно-
[13]). Такая двойная стимуляция приводила к бо-
стью сохраняется.
лее полному ответу нейтрофилов на эти стимулы
Хемилюминесцентный ответ на введение
и, следовательно, к возможности повышения
0.35 мМ люминола у нейтрофилов после 40 мин
чувствительности использованного метода [11].
пребывания в гипомагнитном поле не изменяется
Наряду с люминол-зависимой хемилюминес-
(табл. 1, рис. 5). Также не выявлено достоверных
ценцией регистрировали люцигенин-зависимую
отличий в реакции на введение 2 мкМ fMLF в
хемилюминесценцию нейтрофилов для опреде-
присутствии люминола (табл. 1, рис. 6), в опытах
ления спонтанной продукции АФК, а также при
с двойной последовательной стимуляцией
использовании активаторов АФК. Для этого по-
(табл. 1, рис. 7) и в реакции на ФМА (табл. 1,
сле инкубации суспензии нейтрофилов измеряли
рис. 8). Таким образом, эксперименты, прове-
интенсивность хемилюминесценции образцов в
денные методом люминол-зависимой хемилю-
контрольных и опытных случаях после добавки в
минесценции, дополнительно к опытам с люци-
них раствора люцигенина (Enzo Life Sciences,
генином, показывают, что продукция и других
США) в конечных концентрациях 0.2 или 0.4 мМ.
АФК (перекиси водорода, гипохлорита), помимо
Следует отметить, что в ряде случаев дополни-
супероксида, не нарушается в ответ на активато-
тельную стимуляцию активаторами продукции
ры респираторного взрыва после кратковремен-
АФК (ФМА или fMLF) не проводили, то есть в
ного пребывания нейтрофилов в гипомагнитных
этих опытах определяли фоновую продукцию су-
условиях. Единственным выявленным значи-
пероксидного анион-радикала в нейтрофилах. В
тельным эффектом гипомагнитного поля являет-
других вариантах опытов были использованы fM-
ся снижение фоновой продукции супероксида,
LF и/или ФМА в тех же концентрациях и после-
регистрируемое в опытах с люцигенином без ак-
довательности, что и ранее, при проведении опы-
тиваторов продукции АФК.
БИОФИЗИКА том 68
№ 6
2023
СНИЖЕНИЕ ФОНОВОЙ ПРОДУКЦИИ АКТИВНЫХ ФОРМ КИСЛОРОДА
1183
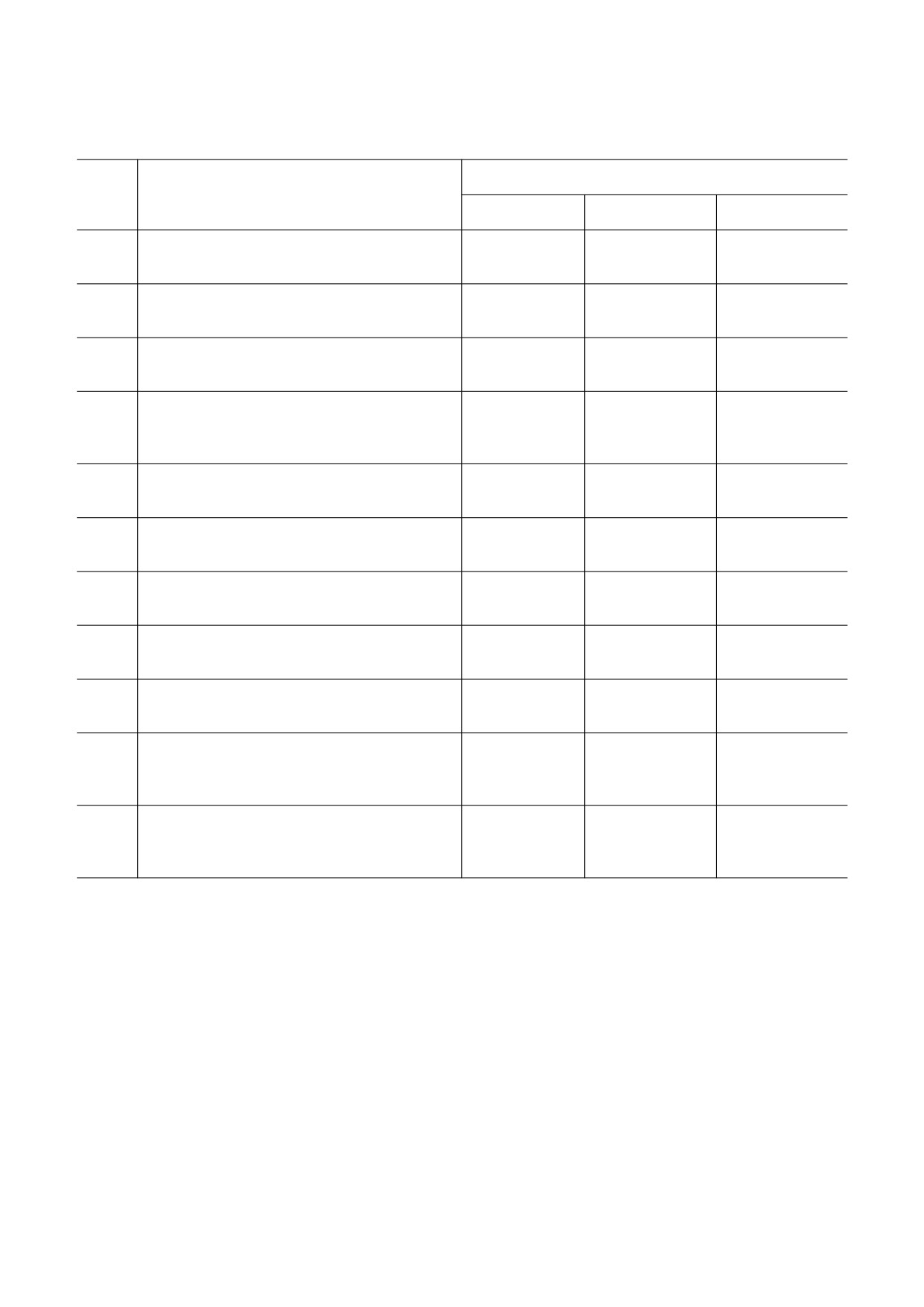
Таблица 1. Значения максимальной интенсивности
хемилюминесценции суспензии нейтрофилов после
действия «нулевого» магнитного поля
Интенсивность хемилюминесценции V, %
Методика определения хемилюминесценции,
№
(соответствие рисункам)
Контроль
Опыт
р
Люцигенин 0.4 мМ
3.41 ± 0.36
2.40 ± 0.16
1
0.00029
(рис. 1)
(100 ± 10.5%)
(70.4 ± 4.7%)
Люцигенин 0.4 мМ, fMLF 1 мкМ
6.37 ± 0.68
6.05 ± 0.51
2
0.41921
(рис. 2)
(100 ± 10.6%)
(95.0 ± 8.0%)
Люцигенин 0.2 мМ, ФМА 5 нМ в пробе
8.65 ± 1.60
10.94 ± 3.44
3
0.20986
(рис. 3)
(100 ± 18.5%)
(126.5 ± 39.8%)
Люцигенин 0.2 мМ, fMLF 1 мкМ, ФМА 5 нМ
13.31 ± 2.69
14.40 ± 4.00
4
в пробе
0.62516
(100 ± 20.2%)
(108.2 ± 30.1%)
(рис. 4)
Люминол 0.35 мМ
2.49 ± 0.22
2.41 ± 0.34
5
0.66769
(рис. 5)
(100 ± 9.00%)
(96.8 ± 13.7%)
Люминол, fMLF 2 мкМ
7.80 ± 1.59
6.78 ± 1.31
6.1
0.29786
(рис. 6)
(100 ± 20.4%)
(86.9 ± 16.8%)
6.69 ± 0.89
6.78 ± 1.31
6.2
Люминол, fMLF 2 мкМ, повторный опыт
0.90230
(100 ± 13.4%)
(101.4 ± 19.6%)
Люминол, fMLF 2мкМ, ФМА 20 нМ в пробе
9.89 ± 0.64
8.48 ± 1.40
7.1
0.07258
(рис. 7)
(100 ± 6.51%)
(85.7 ± 14.1%)
Люминол, fMLF 2мкМ, ФМА 20 нМ в пробе,
9.73 ± 0.64
10.29 ± 0.85
7.2
0.23412
повторный опыт
(100 ± 6.51%)
(85.7 ± 14.1%)
Люминол, ФМА 20 нМ добавлен
6.70 ± 0.23
6.50 ± 0.13
8.1
при регистрации ХЛ*
0.12049
(100 ± 3.39%)
(97.0 ± 1.9%)
(рис. 8)
Люминол, ФМА 20 нМ добавлен
6.70 ± 0.34
6.43 ± 0.24
8.2
при регистрации ХЛ**
0.37415
(100 ± 5.09%)
(96.0 ± 3.6%)
(рис. 8)
Примечание. Количество экспериментов n = 6; * - приведены средние максимальные значения по 20 точкам
из кинетических кривых, ** - приведены максимальные значения в 1 точке из кинетических кривых.
При анализе полученных результатов следует
(отмывка красителя) позволяет определить кон-
учесть, что в нейтрофилах имеется несколько ис-
центрации АФК исключительно внутриклеточ-
точников АФК, в том числе электрон-транспорт-
ной локализации [6]. В то же время метод люми-
ная цепь митохондрий и системы респираторного
нол-зависимой хемилюминесценции фиксирует
взрыва [15, 16]. При этом метод флуоресцентной
совокупный пул АФК, поскольку ввиду способ-
спектроскопии, примененный нами ранее для
ности АФК перераспределяться между внутри- и
исследования эффекта гипомагнитного поля [6],
внеклеточным пулами определение места проис-
ввиду особенностей используемых зондов (после
хождения этих метаболитов данным методом яв-
превращения в активный флуоресцирующий
ляется нетривиальной задачей. Тем не менее, в
продукт они теряют способность проходить через
опытах на нейтрофилах было показано, что при-
мембраны) и протокола выполнения процедур
мерно за половину свечения отвечают сами клет-
БИОФИЗИКА том 68
№ 6
2023
1184
НОВИКОВ и др.
Рис. 1. Кинетические кривые хемилюминесцентного
Рис. 4. Кинетические кривые хемилюминесцентного
ответа суспензии нейтрофилов на добавку 0.4 мМ
ответа суспензии нейтрофилов на добавку 0.2 мМ
люцигенина после действия «нулевого» магнитного
люцигенина и 1 мкМ fMLF после действия «нулевого»
поля.
магнитного поля в присутствии 5 нМ ФМА.
Рис. 2. Кинетические кривые хемилюминесцентного
Рис. 5. Кинетические кривые хемилюминесцентного
ответа суспензии нейтрофилов на добавку 0.4 мМ
ответа суспензии нейтрофилов на добавку 0.35 мМ
люцигенина и 1 мкМ fMLF после действия «нулевого»
люминола после действия
«нулевого» магнитного
магнитного поля.
поля.
Рис. 3. Кинетические кривые хемилюминесцентного
Рис. 6. Кинетические кривые хемилюминесцентного
ответа суспензии нейтрофилов на добавку 0.2 мМ
ответа суспензии нейтрофилов на добавку 0.35 мМ
люцигенина после действия «нулевого» магнитного
люминола и 2 мкМ fMLF после действия «нулевого»
поля в присутствии 5 нМ ФМА.
магнитного поля.
БИОФИЗИКА том 68
№ 6
2023
СНИЖЕНИЕ ФОНОВОЙ ПРОДУКЦИИ АКТИВНЫХ ФОРМ КИСЛОРОДА
1185
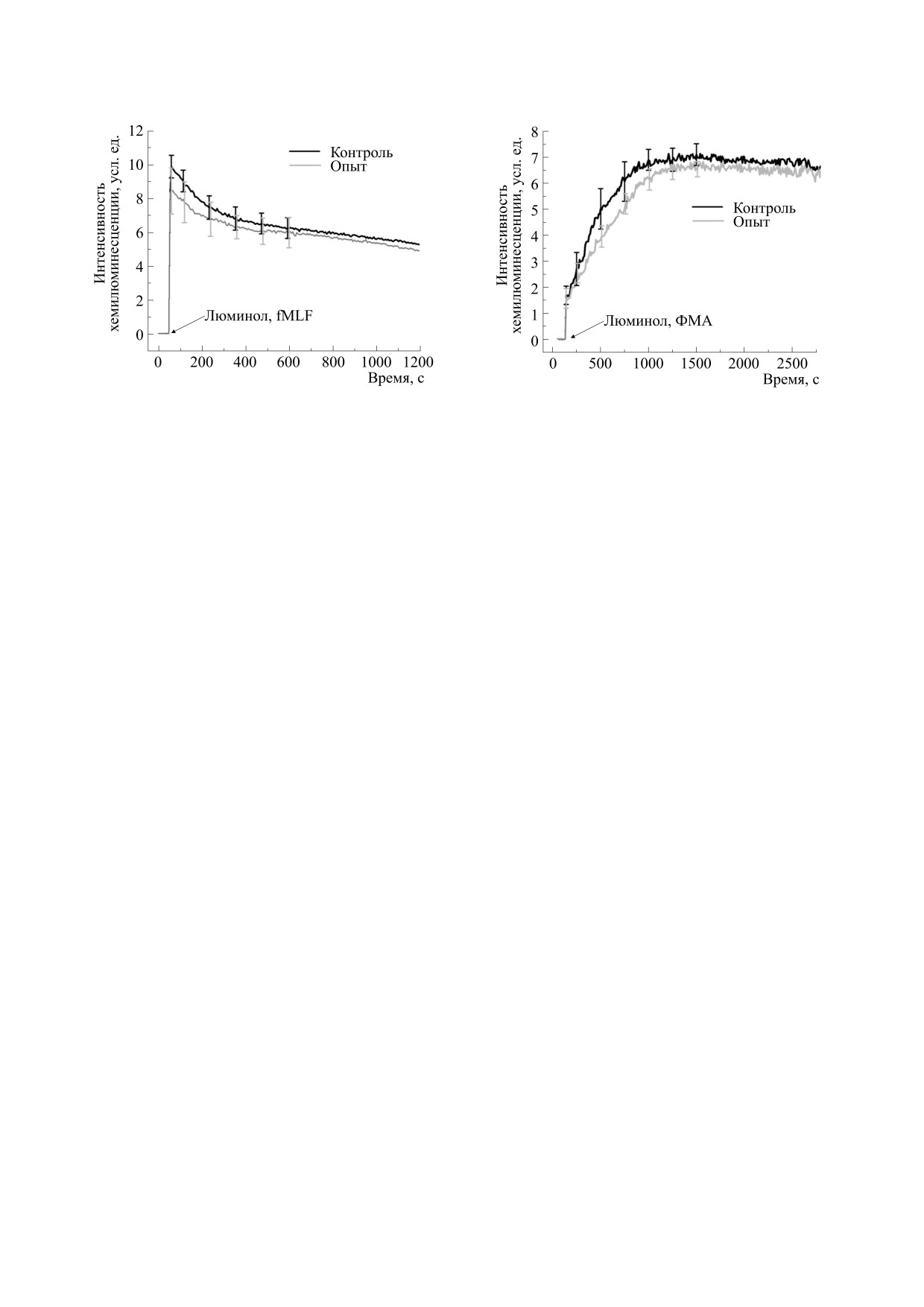
Рис. 7. Кинетические кривые хемилюминесцентного
Рис. 8. Кинетические кривые хемилюминесцентного
ответа суспензии нейтрофилов на добавку 0.35 мМ
ответа суспензии нейтрофилов на добавку 0.35 мМ
люминола и 2 мкМ fMLF после действия «нулевого»
люминола и 20 нМ ФМА после действия «нулевого»
магнитного поля в присутствии 20 нМ ФМА.
магнитного поля.
ки (этот сигнал тушат проникающие через мем-
ные электрон-транспортные цепи [7, 9]), в отли-
браны дитиотреитол и N-ацетилцистеин), а дру-
чие от систем, продуцирующих АФК во внекле-
гая половина формируется вне клеток и
точное пространство при активации нейтрофи-
полностью блокируется непроникающим восста-
лов хемоаттрактантами. Следует отметить, что
новленным глутатионом [17]. С учетом этого
сама активация не устраняет гипомагнитный эф-
можно предположить, что люминол-зависимая
фект, поскольку он обнаруживается флуорес-
хемилюминесценция не фиксирует изменений
центным методом и в случае стимулированных
АФК гипомагнитной этиологии ввиду затушевы-
нейтрофилов [6].
вания искомого сигнала, имеющего скорее всего
В свете полученных данных с учетом исполь-
внутриклеточное происхождение, на фоне обще-
зованных методов регистрации продукции АФК
го свечения. Такого же результата, возможно,
можно сделать вывод о наличии минорной ком-
следует ожидать и от изолюминола, так как про-
поненты АФК внутриклеточного происхожде-
странственная изомерия аминогруппы фталатно-
ния, модулируемой воздействием «нулевого» по-
го кольца в этом соединении определяет его боль-
ля и связанной, в том числе, с функцией мито-
шую гидрофильность и меньшую способность к
хондриального аппарата, и основной, за которую
преодолению биомембран [18].
отвечают системы респираторного взрыва, не ис-
пытывающей влияния депривационного факто-
При респираторном взрыве нейтрофилы могут
ра. Это позволяет более уверенно исключить си-
генерировать АФК как внутриклеточно, так и
стемы, контролирующие респираторный взрыв в
внеклеточно, в зависимости от локализации
нейтрофилах, из числа основных мишеней и ак-
сборки оксидазы, которая, в свою очередь, зави-
цепторов, реагирующих на магнитное экраниро-
сит от природы стимула [18]. Было показано, что
вание.
при стимуляции нейтрофилов fMLF запускалось
внеклеточное высвобождение АФК, при этом
продукция внутриклеточных АФК обнаружена не
КОНФЛИКТ ИНТЕРЕСОВ
была [19]. Ввиду этого тот факт, что магнитная де-
привация не отражается на продукции АФК при
Авторы заявляют об отсутствии конфликта
респираторном взрыве (при регистрации мето-
интересов.
дом активированной хемилюминесценции), мо-
жет быть объяснен доминированием сигнала от
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
внеклеточных АФК, системы генерации которых
невосприимчивы к действию «нулевого» поля.
Работа с лабораторными животными проводи-
Таким образом, системы генерации активных
лась в соответствии с положениями «Европей-
форм преимущественно во внутриклеточном
ской конвенции о защите позвоночных живот-
компартменте характеризуются чувствительно-
ных, используемых для эксперимента и других
стью к магнитной депривации [6] (данные инги-
научных целей» Основным документом, регла-
биторного анализа свидетельствуют, что в числе
ментирующим проведение настоящего исследо-
этих систем важную роль играют митохондриаль-
вания, являлось «Руководство по работе с лабора-
БИОФИЗИКА том 68
№ 6
2023
1186
НОВИКОВ и др.
торными животными ИБК PАН»
№ 57 от
9. В. В. Новиков, Е. В. Яблокова, Э. Р. Валеева и
30.12.2011 г.
Е. Е. Фесенко, Биофизика, 64 (4), 720 (2019).
10. В. В. Новиков, Е. В. Яблокова, И. А. Шаев и
Е. Е. Фесенко, Биофизика, 65 (2), 524 (2020).
СПИСОК ЛИТЕРАТУРЫ
11. Е. В. Проскурнина, М. М. Созарукова, А. М. По-
1. V. N. Binhi and F. S. Prato, PLoS One, 12 (6),
лимова и др., Бюл. эксперим. биологии и медици-
e0179340 (2017).
ны, 161 (2), 288 (2016).
2. B. Zhang and L. Tian, Bioelectromagnetics, 41 (8), 573
12. F. Rossi, P. Bellavite, G. Bertonet, et al., Adv. Exp.
(2020).
Med. Biol., 141, 283 (1982).
3. В. В. Крылов, Труды Ин-та биологии внутренних
13. В. Г. Сафронова, А. Г. Габдулхакова, А. В. Миллер
вод им. И.Д. Папанина РАН, № 84 (87), 7 (2018).
и др., Биохимия, 66, 840 (2001).
14. В. В. Новиков, Е. В. Яблокова, И. А. Шаев и
4. H. Zadeh-Haghighi, R. Rishabh, and C. Simon, Front.
Е. Е. Фесенко, Биофизика, 66 (3), 511 (2021).
Physiol.,
11,
1026460
(2023). DOI:
10.3389/
15. Ю. А. Владимиров и Е. В. Проскурнина, Успехи
fphy.2023.1026460.
биол. химии, 49, 341 (2009).
5. И. А. Шаев, В. В. Новиков, Е. В. Яблокова и
16. G. Fossati, D. A. Moulding, D. G. Spiller, et al., J.
Е. Е. Фесенко, Биофизика, 67 (2), 319 (2022).
Immunol., 170, 1964 (2003).
6. В. В. Новиков, Е. В. Яблокова и Е. Е. Фесенко,
17. М. А. Мурина, Д. И. Рощупкин, Н. С. Белакина
Биофизика, 63 (3), 484 (2018).
и др., Биофизика, 50, 1100 (2005).
7. В. В. Новиков, Е. В. Яблокова, И. А. Шаев и
18. C. Dahlgren and A. Karlsson, J. Immunol. Methods,
Е. Е. Фесенко, Биофизика, 65 (4), 735 (2020).
232 (1-2), 3 (1999).
8. T. B. Aasen, B. Bolann, J. Glette, et al., Scand. J. Clin.
19. H. Fu, J. Bylund, A. Karlsson, et al., Immunology, 12
Lab. Invest., 47, 673 (1987).
(2), 201 (2004).
Background Formation of Lower Levels of Reactive Oxygen Species by Neutrophils
after Hypomagnetic Field Exposure Is Not Accompanied by the Impairment
of Chemiluminescence Response of Neutrophils to Respiratory-Burst Stimuli
V.V. Novikov*, E.V. Yablokova*, I.A. Shaev*, N.I. Novikova**, and E.E. Fesenko*
*Institute of Cell Biophysics, Russian Academy of Sciences, Institutskaya ul. 3, Pushchino, Moscow Region, 142290 Russia
**Branch of Shemyakin-Ovchinnikov Institute of Bioorganic Chemistry, Russian Academy of Sciences,
prosp. Nauki 6, Pushchino, Moscow Region, 142290 Russia
This study shows that the background formation of lower levels of reactive oxygen species in mouse peritoneal
neutrophils after short-term (40 minutes) exposure to hypomagnetic fields with ∼10 nT residual field at phys-
iological temperatures, which has been detected by use of lucigenin-dependent chemiluminescence, is not
accompanied by the impairment of chemiluminescence response of neutrophils to respiratory-burst stimuli:
the formylated tripeptide N-formyl-Met-Leu-Phe (fMLF) and phorbol ester phorbol-12-myristate-13-ace-
tate (PMA). These results were obtained with lucigenin or luminol-enhanced activated chemiluminescence
and various combinations of reactive oxygen species production stimuli (phorbol-12-myristate-13-acetate
and/or N-formyl-Met-Leu-Phe). Based on the results of the present work as well as on those of previous
studies, this study reveal that the systems that control the respiratory burst in neutrophils can be excluded
from a list of main targets and acceptors that respond to short-term deprivation of the magnetic field.
Keywords: hypomagnetic field, neutrophils, reactive oxygen species, lucigenin, luminol, chemiluminescence
БИОФИЗИКА том 68
№ 6
2023