СОДЕРЖАНИЕ
ВВЕДЕНИЕ ..........................................................3
ХОЛИНОРЕЦЕПТОРЫ......................................4
ХОЛИНОРЕЦЕПТОРЫ В СЕРДЦЕ...................6
Мускариновые холинорецепторы в сердце...............6
Никотиновые холинорецепторы в сердце................8
Холинергические рецепторы в регуляции функций сердца......................................................9
Аутокринная ненейрональная холинергическая система сердца......................................................12
ХОЛИНОРЕЦЕПТОРЫ В КРОВЕНОСНЫХ СОСУДАХ..........................12
Мускариновые холинорецепторы в кровеносных сосудах ...........................................12
Никотиновые холинорецепторы в кровеносных сосудах ...........................................14
ЗАКЛЮЧЕНИЕ..................................................18
СПИСОК ЛИТЕРАТУРЫ..................................18
ВВЕДЕНИЕ
Сердечно-сосудистая система (ССС) – одна из важнейших систем органов большинства животных, обеспечивающая организм необходимыми веществами и удаляющая продукты жизнедеятельности клеток. Органы ССС – сердце и кровеносные сосуды, их функционирование поддерживает гомеостаз организма в постоянно изменяющихся условиях. Физиологическая функция сердца и сосудов контролируется хорошо организованным взаимодействием различных ионных каналов, насосов (АТPаз) и обменников, регулирующих градиенты ионов Na+, Ca2+ и K+. Из ионов, участвующих в сложной работе сердца, кальций считается, пожалуй, самым важным. Этот ион имеет решающее значение для процесса, называемого электромеханическим сопряжением и позволяющего камерам сердца сокращаться и расслабляться. Сердечные K+-каналы – ключевые участники реполяризации сердца, противодействующие деполяризующим потокам Na+ и Ca2+. Ионы K+, в отличие от Na+ и Ca2+, проводятся множеством различных каналов, различающихся кинетикой активации/деактивации, а также своим вкладом в разные фазы потенциала действия.
Согласованное функционирование ССС происходит посредством механизмов нервной и гуморальной регуляции. Главную роль в нервной регуляции играет автономная нервная система, осуществляющая регуляцию через парасимпатические и симпатические нервные волокна в составе блуждающего нерва и симпатических стволов спинного мозга. Передача сигналов осуществляется в основном посредством холинергических и адренергических механизмов. В сердце парасимпатическая стимуляция, осуществляемая холинергическим путем, приводит к отрицательным эффектам: инотропному, хронотропному и дромотропному. Холинорецепторы расположены в основном во внешней мембране кардиомиоцитов, и именно их активация приводит к снижению насосной функции сердца. Симпатическая стимуляция, осуществляемая адренергическим путем, напротив, приводит к увеличению производительности сердца. За некоторым исключением все кровеносные сосуды, содержащие в своей стенке гладкомышечные клетки, иннервируются норадренергическими и холинергическими нервными волокнами из симпатического отдела автономной нервной системы. Медиаторы, поступающие в кровь, осуществляют гуморальную регуляцию ССС. Существует целый ряд таких веществ, однако и здесь большую роль играют как адреналин, усиливающий сердечную деятельность, так и ацетилхолин, ослабляющий деятельность сердца. При гуморальной регуляции тонуса сосудов наиболее мощным сосудосуживающим действием обладают адреналин и норадреналин. Сосудорасширяющее действие присуще ацетилхолину и некоторым другим соединениям (брадикинин, простагландины, гистамин и др.). Помимо того, существует так называемая ненейрональная холинергическая система, обладающая как аутокринными, так и паракринными свойствами. Так, некоторые ненейрональные клетки способны синтезировать и высвобождать ацетилхолин, а другие клетки, не имеющие ни симпатической, ни парасимпатической иннервации (как, например, эндотелиальные клетки кровеносных сосудов), несут на своей поверхности рецепторы ацетилхолина. Приведенное довольно схематичное описание регуляции деятельности ССС, в которой участвует множество более тонких механизмов, дает, однако, представление о существенной роли холинергической системы в этом процессе [1].
ХОЛИНОРЕЦЕПТОРЫ
Существует два больших семейства рецепторов, управляемых ацетилхолином. Это так называемые мускариновые холинорецепторы (мХР), которые активируются как ацетилхолином, так и мускарином и блокируются атропином, и никотиновые холинорецепторы (нХР), которые активируются ацетилхолином или никотином и блокируются некоторыми алкалоидами (например, d-тубокурарином) и нейротоксинами животных ядов (например, белковыми α-нейротоксинами змей или α-конотоксинами, нейротоксическими пептидами из ядовитых морских моллюсков рода Conus).
мХР представляют собой метаботропные рецепторы, относятся к семейству рецепторов, связанных с G-белками (GPCR), и передают сигналы в клетку посредством взаимодействия с этими белками. Имеется пять подтипов мХР: M1, M2, M3, M4 и M5, обладающих высоким сходством аминокислотных последовательностей (64–68% идентичных аминокислотных остатков), но разными молекулярными и сигнальными свойствами [2, 3]. Так, в результате взаимодействия с определенными G-белками они выполняют различные физиологические функции. мХР разделяют на две группы в зависимости от типа G-белков, с которыми они взаимодействуют. Рецепторы М1, М3 и М5 связаны с белками Gq/11, которые опосредуют активацию фосфолипазы C, а рецепторы М2 и М4 связаны с белками Gi/o, которые опосредуют ингибирование аденилатциклазы (AЦ) и, таким образом, вызывают снижение уровня циклического аденозинмонофосфата (cAMP) [4]. Данные рентгеноструктурного анализа и криоэлектронной микроскопии показывают, что структурно мХР представляют собой интегральные мембранные белки, которые содержат семь трансмембранных спиралей [5, 6] (рис. 1а). Внеклеточный лиганд-связывающий домен состоит из нескольких петель, содержащих консервативную дисульфидную связь, которая стабилизирует структуру рецептора. Внутриклеточный домен взаимодействует с G-белками и другими сигнальными молекулами и осуществляет внутриклеточную передачу сигналов.
Рис. 1.
(а) – Пространственная структура мХР М2-типа, установленная методом рентгеноструктурного анализа [5]. В связывающем центре рецептора находится антагонист хинуклидил-3-бензилат (выделен зеленым цветом и окружностью); (б) – пространственная структура нХР типа α7 человека, определенная методом криоэлектронной микроскопии в липидном окружении [9]. В связывающем центре рецептора находится агонист эпибатидин (показан зеленым цветом, в одном из связывающих центров выделен окружностью).
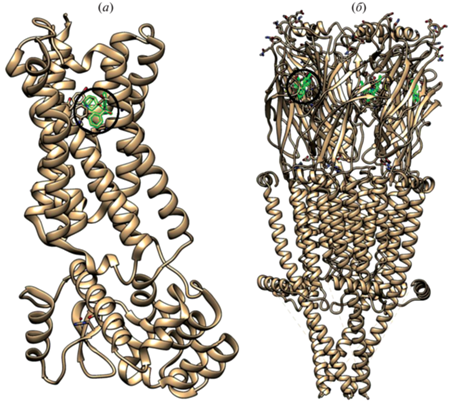
нХР – лиганд-управляемые ионные каналы, относящиеся к семейству Cys-петельных рецепторов, которое включает также ионотропные рецепторы гамма-аминомасляной кислоты (ГАМК), глициновые и серотониновые 5-HT3-рецепторы [7, 8]. нХР представляют собой пентамеры, включающие четыре различных типа субъединиц (α1–10, β1–4, γ либо ϵ, δ). Они существуют в виде гомомеров (со всеми субъединицами одного типа, например, (α7)5) или в виде гетеромеров, по крайней мере, с одной α- и одной β-субъединицей из пяти субъединиц, которые комбинируются в различных вариантах, например, (α1)2β1γδ, (α4)3(β2)2, (α4)2(β2)3, α4α6β3(β2)2. Сборки из пяти субъединиц образуют множество различных подтипов, которые имеют общую базовую структуру, но обладают специфическими фармакологическими и функциональными свойствами. Субъединицы нХР формируют пору, проницаемую для ионов Na+, K+ и Ca2+. Способность нХР изменять уровень внутриклеточного кальция приводит к активации различных внутриклеточных механизмов, которые могут играть ключевую роль в дальнейшей передаче сигналов. Все субъединицы имеют похожее строение и состоят из большого N-концевого внеклеточного домена, за которым следуют три гидрофобных трансмембранных домена (M1–M3), большая цитоплазматическая петля между доменами M3 и M4, четвертый гидрофобный трансмембранный домен (M4) и короткий внеклеточный С-концевой домен (рис. 1б). Трансмембранные домены M1–M4 расположены концентрическими слоями вокруг центральной поры: домен M2 выстилает пору, M1 и M3 защищают M2 от окружающего липидного двойного слоя, а M4 наиболее экспонирован в липидный бислой [9].
Холинорецепторы могут располагаться в различных отделах нервной и эндокринной систем, которые регулируют деятельность различных органов, в том числе ССС, при помощи медиаторов и гормонов, связывающихся с рецепторами иных типов. Поэтому холинорецепторы оказывают косвенное влияние на работу ССС, опосредованное, например, через ренин-ангиотензиновую систему [10]. Установлено, что никотин и другие агонисты нХР вызывают существенный подъем артериального давления (например, по данным Jutkiewicz et al. [11]). Однако эти эффекты опосредованы через нервную систему, и в процитированной работе они обусловлены активацией вегетативных ганглиев с участием некоторых подтипов нХР. В равной мере можно привести ряд примеров опосредованного влияния мХР на ССС. Так, исследование сонных артерий морских свинок показало, что М1 играет важную роль в модулировании высвобождения норадреналина, способствуя сужению сосудов [12]. М2, наоборот, задействован в опосредуемом карбахолом ингибировании высвобождения норадреналина, способствуя расслаблению мозговых артерий кошки [13]. М3-рецепторы, впрочем, также стимулируют выработку надпочечниками адреналина, который, в свою очередь, влияет на функцию сосудов при солечувствительной гипертензии [14].
Однако холинорецепторы располагаются также на мембранах клеток непосредственно сердца и кровеносных сосудов. В данном обзоре мы рассмотрим механизмы регуляции функций ССС с участием только тех холинорецепторов, которые сами находятся в ткани сердца и сосудов.
ХОЛИНОРЕЦЕПТОРЫ В СЕРДЦЕ
Хорошо известно, что парасимпатическая система, в которой основным нейромедиатором выступает ацетилхолин (АХ), играет существенную роль в регуляции сердечно-сосудистой функции. При нервной регуляции ССС сигнализация с участием холинорецепторов происходит в нейронных сетях парасимпатической нервной системы, а также между нейронными сетями и сердцем. Внутри нейронной сети преганглионарные волокна из продолговатого мозга, проходящие в блуждающем нерве, передают сигнал с участием нХР на плазматической мембране постганглионарных волокон. Затем эта стимуляция постганглионарных нервов приводит к секреции АХ, который связывается с рецепторами на плазматической мембране клеток сердца. Кроме того, установлено, что кардиомиоциты способны синтезировать и высвобождать АХ, и такая внутренняя холинергическая система известна как ненейрональная холинергическая система [15]. После высвобождения во внеклеточное пространство АХ может связываться с мХР или нХР и активировать специфические сигнальные пути в различных типах клеток ССС. Основные рецепторы АХ в сердце – мХР (M1–M5), которые гетерогенно распределены по всей ССС и выполняют в ней различные физиологические функции [16].
Мускариновые холинорецепторы в сердце
За последние годы в миокарде были обнаружены все пять известных типов мускариновых рецепторов, хотя их функциональная значимость сильно различается. В сердце преобладают изоформы подтипа М2.
Подтип М2. M2 мХР – основной мускариновый рецептор АХ в сердце млекопитающих. Он обильно экспрессируется в предсердиях и проводящей системе (синоатриальный и атриовентрикулярный узлы), тогда как его экспрессия в желудочках относительно низка по сравнению с предсердиями [16]. Исследования связывания радиолигандов в сердце человека подтверждают, что М2 имеет значительно более высокое содержание в предсердиях (до 2.5 раз) по сравнению с миокардом желудочков [16].
М2 мХР предпочтительно связывается с белками Gi, которые ингибируют аденилатциклазу (АЦ) и, таким образом, при активации ослабляют превращение АТР в cAMP. В целом стимуляция М2 оказывает прямое и косвенное влияние на функцию сердечной мышцы. М2, локализующиеся на постганглионарных симпатических нервных окончаниях, ингибируют высвобождение норадреналина, предотвращая активацию β-адренергических рецепторов миокарда. Это косвенное влияние, которое в данном обзоре не обсуждается. Прямое же влияние модулируется посредством взаимодействия с G-белком в мембранах кардиомиоцитов несколькими путями.
В первом пути М2 взаимодействует с α-субъединицей белка Gi, а βγ-субъединица белка Gi напрямую связывается с активируемым G-белком калиевым каналом внутреннего выпрямления (GIRK). Эти ионные каналы генерируют калиевый ток, активируемый ацетилхолином (IK,ACh). После активации канал становится проницаемым для K+, что приводит к ряду последствий, которые зависят от величины присущего конкретным клеткам мембранного потенциала во время диастолы: 1) к гиперполяризации в синоатриальном узле, что выражается в замедлении частоты сердечных сокращений; 2) к уменьшению продолжительности потенциала действия и эффективного рефрактерного периода у миоцитов предсердий, что делает эти клетки более восприимчивыми к преждевременным стимулам; 3) к снижению возбудимости клеток атриовентрикулярного узла, что замедляет распространение импульса от предсердий к желудочкам [17]. Каналы IK,ACh обнаружены и в желудочках, однако в гораздо меньшем количестве и с существенно меньшей восприимчивостью к стимуляции ацетилхолином, чем в предсердиях [18]. Считается, что М2, Gi и GIRK не имеют более никаких молекулярных посредников и для полноценного ответа должны физически взаимодействовать [17].
Во втором пути М2 модулирует cAMP-зависимый ответ на активацию β-адренергических рецепторов, которые активируют АЦ [19]. Здесь М2 связывается с βγ-субъединицей белка Gi, который посредством α-субъединицы ингибирует AЦ5/6, что приводит к снижению уровня внутриклеточного cAMP. Изменения в уровне cAMP в предсердиях напрямую влияют на каналы HCN (управляемые циклическими нуклеотидами гиперполяризационно-активируемые каналы водителя ритма, проницаемые для ионов Na+ и K+), а посредством активации протеинкиназы А – на кальциевые каналы L-типа. В желудочках эти изменения влияют на функционирование медленных выпрямляющих калиевых и хлорных каналов CFTR.
Однако есть еще и третий путь прямого влияния М2 на функцию сердца: М2 связывается с α‑субъединицей белка Gi, который своей βγ-субъединицей способствует активации АЦ4/7 β-адренорецептором, что приводит к усилению синтеза cAMP. Ингибиторное влияние М2 на синтез cAMP преобладает, оно выражено сильнее, но и заканчивается быстрее; активаторный эффект сохраняется дольше, поэтому сразу после прекращения раздражения блуждающего нерва или стимуляции ацетилхолином происходит резкое увеличение частоты сердечных сокращений и сократительной способности желудочков [19]. Кстати, ацетилхолин вызывает повышение уровня cAMP в миоцитах предсердий еще одним путем: М2 активирует фосфолипазу С для запуска фосфоинозитидного каскада, включающего, в свою очередь, каскад реакций с участием кальция/кальмодулина и протеинкиназы С. Это приводит к активации синтазы оксида азота (NOS); продукция оксида азота (NO) стимулирует выработку циклического гуанозинмонофосфата (cGMP) растворимой гуанилатциклазой. cGMP ингибирует фосфодиэстеразу-3, таким образом способствуя накоплению cAMP, и это приводит к отрицательному инотропному эффекту в отношении предсердий [20, 21].
Было отмечено, что М2 проявляют чувствительность к потенциалу, т.е. их сродство к лигандам изменяется в зависимости от потенциала мембраны [22]. Чувствительность М2 к потенциалу подразумевает, что сродство к АХ (и, следовательно, эффект АХ) изменяется в течение электрического цикла сердца. Моделирование этого процесса показало, что измененная чувствительность М2 к потенциалу может способствовать и возникновению, и развитию таких заболеваний, как мерцательная аритмия и неадекватная синусовая тахикардия [23].
В целом активация М2-рецептора приводит к снижению частоты сердечных сокращений (отрицательной хронотропии) и практически не влияет на сократительную способность сердца (отсутствие инотропного эффекта).
Подтип М3. М3 мХР преимущественно сопряжен с белком Gq. Этот белок передает сигнал от М3 к мембраносвязанному ферменту фосфоинозитидазе Cβ (фосфоинозитол-специфичной фосфолипазе С), при этом активация М3 усиливает активность фермента, вызывая образование фосфатидил-инозитол-4,5-дифосфата, который служит источником для образования двух посредников: инозитол-1,4,5-трифосфата и диацилглицерола. Эти две молекулы действуют как вторичные мессенджеры для мобилизации внутриклеточных запасов Ca2+ и активации протеинкиназы С.
Проведенные исследования показали, что подтип М3 также присутствует в клетках миокарда [24, 25]. Распределение М3 в сердце неравномерно; мРНК М3 была обнаружена в предсердиях и желудочках сердца человека, хотя и в меньшем количестве, чем мРНК М2. При этом экспрессия М3 в желудочках в 10 раз выше, чем в предсердиях. Кроме того, эксперименты по иммуноокрашиванию кардиомиоцитов желудочков человека показали, что концентрация М3 выше на вставочных дисках по сравнению с другими областями клеточной мембраны [26]. Предпочтительное распределение на вставочных дисках указывает на то, что М3 играет существенную роль в межклеточных коммуникациях кардиомиоцитов. Следует отметить, что имеется несколько функций М3-рецепторов сердца. Этот рецептор активирует не только путь протеинкиназы С, но и медленный компонент выпрямляющего калиевого тока, помогая таким образом регулировать частоту сердечных сокращений и реполяризацию кардиомиоцитов [27, 28]. Было также показано, что стимуляция М3-рецепторов вызывала выраженное укорочение длительности потенциала действия в предсердиях и желудочках функционирующего миокарда [29]. М3 присутствуют в водителе ритма и миокарде сердца мыши, где они опосредуют негативные холинергические эффекты, а именно замедление синусового ритма и укорочение потенциалов действия [29].
Подтип М1. М1 мХР обнаруживается в кардиомиоцитах предсердий и желудочков, но в разных количествах, а также, по-видимому, его содержание различается в зависимости от вида животного. Например, М1 был обнаружен как в желудочках [30], так и в предсердиях человека [18], а в предсердиях крыс линии Wistar – нет [16]. При этом локализация М1 в желудочках сердца обнаруживается у разных видов животных, хотя и в различных количествах. Было высказано предположение, что М1 в сердце человека играет определенную роль в гомеостатической регуляции. К тому же исследования на морских свинках показали, что активация М1 вызывает положительный инотропный эффект, который уравновешивает отрицательные эффекты активации М2 за счет усиления тока через Са2+-канал L-типа. Это в конечном итоге приводит к увеличению частоты и силы сокращений сердца [16]. Также для М1 мХР была показана возможность активации тока IK,Ach, который играет важную роль в патогенезе фибрилляции предсердий [31].
В согласии с вышесказанным, применение специфического блокатора М1 мХР пирензепина в высоких дозах приводит к тахикардии, но в малых дозах – к брадикардии. Поэтому блокированием М1 можно объяснить такой же парадоксальный двухфазный эффект низких и высоких доз неселективного антагониста мХР атропина [32]. Однако здесь следует быть осторожным в оценках, поскольку наиболее вероятный сценарий такой брадикардии – блокирование пресинаптического М1 блуждающего нерва, но не кардиомиоцитов; это облегчает высвобождение АХ и активацию им М2 сердца, сопровождающуюся вполне естественным замедлением ритма [32].
Подтип М4. Функция мХР М4 перекрывается с функцией М2, оба – рецепторы, связанные с белком Gi, и снижающие уровни cAMP. Имеющиеся к настоящему времени данные свидетельствуют о том, что М4, по-видимому, имеет большее значение в регуляции нервной системы, чем в сердечно-сосудистой, хотя мРНК, кодирующая М4, обнаружена в сердце. Данные, полученные с использованием тканей предсердий собаки, указывают на потенциальную роль М4 в контроле K+-каналов [33]. Недавнее исследование с использованием мышей, нокаутных по М4, показало, что рецепторы М4 могут также способствовать брадикардии, опосредованной рецептором М2 [16]. Было установлено, что тропикамид, ингибитор М4-подтипа, снижает частоту сердечных сокращений и минутный объем сердца у крыс, хотя величина ударного объема сердца увеличивается [34]. Однако необходимы дальнейшие исследования, чтобы уточнить, действительно ли (и каким именно образом) М4 участвует в функционировании ССС.
Подтип М5. мХР М5, как и другие члены этого семейства с нечетными номерами (М1 и М3), связан с белком Gq, однако данные о его функциональной роли в сердце весьма ограничены. Так, исследование экспрессии мРНК, кодирующей мХР у крыс, обнаружило мРНК М5 в предсердиях и желудочках сердца, где ее содержание составляет 5% от общей мРНК мХР [35]. Иммуноблоттинг с антителами, специфическими к определенному подтипу мХР, подтвердил присутствие белка М5 в препаратах мембран из тканей как предсердия, так и желудочка сердца человека. Плотность М5 была в ~5 раз ниже в ткани желудочка, чем в ткани предсердия. Одиночные миоциты желудочка окрашивались антителами к М5, и при конфокальной микроскопии характерная локализация М5 обнаружена на вставочных дисках [26].
Суммируя приведенные выше данные, можно заключить, что в сердце мХР подтипа М2 преобладают и играют наиболее важную роль в регуляции функционирования сердца.
Никотиновые холинорецепторы в сердце
Данные о наличии нХР в сердце немногочисленны. Тем не менее исследование онтогенетических изменений экспрессии α-субъединиц нХР в сердце крысы показало, что различные α-субъединицы нХР присутствуют на ненейрональных клетках сердца [36]. На всех постнатальных стадиях субъединица α3 была обнаружена только в предсердиях, в то время как субъединицы α2, α4, α5 и α7, по-видимому, экспрессируются и в предсердиях, и в желудочках. мРНК, кодирующая субъединицы α4, α5, α7 и α10, была обнаружена на всех стадиях развития. Ни на одной стадии развития не удалось получить однозначный сигнал для мРНК α9-субъединицы нХР. Иммуногистохимическое окрашивание показало наличие субъединицы α7 на нейронах сердца, фибробластах и кардиомиоцитах, а субъединиц α2 и α4 – на кардиомиоцитах с постнатальным перераспределением во вставочные диски. Эти данные свидетельствуют о ненейрональной экспрессии субъединиц нХР в сердце крысы [36]. В сердце крыс уровень экспрессии мРНК α7-субъединицы нХР измеряли с помощью ОТ-ПЦР и вестерн-блоттинга. Было показано наличие этого подтипа нХР в желудочках и предсердиях, при этом экспрессия в желудочках была существенно выше, чем в предсердиях [37]. Экспрессия мРНК практически всех субъединиц нХР, включая α2-, α3-, α4-, α5-, α6-, α7-, α9-, α10-, β1-, β2-, β4- и ε-субъединицы, была обнаружена методом количественной ПЦР в реальном времени в кардиомиоцитах новорожденных крыс и клетках H9c2 (клеточная линия, полученная из эмбриональной ткани сердца крыс BD1X) [38]. Однако по представленным в этой работе данным нельзя дать оценку уровням экспрессии отдельных субъединиц.
Использование 2-дезокси-2-[18F]фтор-D-глюкоз-A85380, избирательного радиолиганда α4β2-подтипа нХР, для визуализации этих рецепторов в сердце человека in vivo с применением позитронно-эмиссионной томографии выявило поглощение индикатора левым желудочком сердца [39]. Эти данные свидетельствуют о наличии α4β2-подтипа нХР в левом желудочке сердца человека. Однако полученное разрешение не позволило более точно локализовать эти рецепторы в конкретной ткани желудочка (ганглий, сосуд или мышца).
Активация нХР может приводить как к росту силы сокращения в левом желудочке [40, 41], так и к снижению силы сокращения предсердий [42]. Как обсуждалось выше, нХР участвуют в холинергической передаче в блуждающем нерве и вегетативных ганглиях, иннервирующих сердце. Поэтому иногда непросто дифференцировать воздействие холинергических лигандов на нХР самого сердца, исключив не только нХР синапсов, но и иные мишени. Так, никотин в физиологических условиях диффундирует через цитоплазматическую мембрану клетки и оказывает, причем в наномолярных концентрациях, токсическое воздействие на митохондрии, хотя сведения о возможном наличии нХР на мембранах митохондрий все еще недостаточно убедительны [43]. Например, в работе Nakatani et al. [42] отрицательные хронотропный и инотропный эффекты на изолированных мышцах предсердий крыс вызывались никотином в очень высоких концентрациях (0.3–1 мМ), но эти эффекты не предотвращались ни атропином (блокатор мХР), ни гексаметонием (блокатор ганглионарных нХР). Исходя из этого, авторы говорят о прямом влиянии никотина на мышцу сердца, но об участии нХР делают осторожное предположение, поскольку прямых доказательств (например, с использованием в опыте других блокаторов нХР) не приводят.
Холинергические рецепторы в регуляции функций сердца
Как обсуждалось выше, холинорецепторы играют существенную роль в различных сигнальных механизмах сердца, и наиболее ярко эта роль проявляется при некоторых патологических состояниях.
Когда говорят о регуляции ССС, обычно имеют в виду влияние на сократительную способность сердца и на сосудистый тонус. Как мы видим, такими регуляторами выступают мХР. Для нХР имеются лишь единичные сообщения о подобном прямом влиянии на ССС (в основном описывается косвенное). Однако нХР играют важную роль в осуществлении других физиологических и патологических процессов, которые специфичны именно для ССС (в частности, ангиогенез), или для которых эта система – основная мишень. Например, атеросклероз – это патология липидного обмена, но она связана с ССС и поражает в первую очередь ее, а все прочие проявления атеросклероза будут следствием этого поражения. Другой патологический процесс, который может затрагивать любые органы и системы организма, защитно-восстановительный – воспаление – так или иначе связан с целым рядом специфических состояний ССС (например, с инфарктом миокарда). Участвуя в различных патофизиологических процессах, нХР напрямую влияют на работу ССС, и мы считаем необходимым отразить этот аспект и здесь, и в разделе, посвященном регуляции функционирования кровеносных сосудов. Итак, холинергические лиганды могут предотвращать или ослаблять повреждения сердца, вызванные различными воздействиями. Эти лиганды выполняют свои функции, воздействуя на холинорецепторы, находящиеся в клетках парасимпатической нервной системы или непосредственно в клетках сердца.
Острый инфаркт миокарда (ОИМ) – наиболее частая причина острого повреждения миокарда и наиболее клинически значимая его форма. Считается, что основной метод лечения ОИМ – максимально быстрое восстановление адекватного коронарного кровотока (реперфузии) к ишемизированному миокарду. Между тем парадокс лечения заключается в том, что при восстановлении кровообращения в ишемизированной ткани доставка кислорода сопровождается образованием его активных форм, которые повреждают мембраны клеток. В результате этого возникает вторичное повреждение органа и развивается явление, названное ишемически-реперфузионным повреждением миокарда. Нарушение парасимпатической (вагусной) активности сердца – общий признак различных сердечно-сосудистых заболеваний, включая ОИМ.
Целый ряд исследований показывает, что увеличение секреции АХ при стимуляции блуждающего нерва защищает сердце, предотвращая ишемически-реперфузионное повреждение [44, 45] и повышая выживаемость в модели хронической сердечной недостаточности на животных [46, 47]. Стимуляция блуждающего нерва снижает частоту возникновения фибрилляции желудочков и уменьшает зону ОИМ в модели ишемии-реперфузии [48]. Кроме того, такая стимуляция защищает от дисфункции отдаленных сосудов миокарда, возникающей в результате ишемии-реперфузии, посредством холинергического противовоспалительного пути, в котором участвуют нХР α7-типа [49]. Недавно было также показано, что активация рецептора мХР M3 с помощью стимуляции блуждающего нерва модулирует митохондриальную динамику и улучшает митохондриальную функцию при ишемии миокарда, индуцированной изопротеренолом [50]. Более детально влияние активации блуждающего нерва на ишемически-реперфузионное повреждение миокарда рассмотрено в недавних обзорах [51, 52].
Что касается конкретных подтипов рецепторов, участвующих в кардиопротекции, то антагонисты М2 [53] или подавление экспрессии рецептора мХР М2 с помощью siRNA [54] устраняют эффекты АХ-индуцированной защиты в кардиомиоцитах, что свидетельствует о вовлеченности этого подтипа мХР в процесс кардиопротекции. М3-подтип мХР также играет защитную роль при сердечно-сосудистых заболеваниях [55]. Так, сообщалось, что активация рецептора М3 снижает гипертрофию сердца, индуцированную ангиотензином II, корректирует гемодинамическую дисфункцию сердца, ингибирует апоптоз клеток миокарда и уменьшает повреждение миокарда [56]. Фармакологическая активация М3-рецепторов также оказывает кардиопротекторное действие при ишемически-реперфузионном повреждении, что подтверждается использованием иодида 1,1-диметил-4-дифенилацетоксипиперидиния (4-DAMP), антагониста М3 [57]. Кроме того, гиперэкспрессия М3 в модели трансгенных мышей способствует снижению экспрессии аритмогенной микро-РНК miR-1, что, по некоторым данным, приводит к высвобождению субъединицы Kir2.1 соответствующего калиевого канала после ишемии-реперфузии. В итоге это приводит к увеличению калиевого тока внутреннего выпрямления и, как следствие, снижает частоту аритмий и смертельных исходов в модели ишемически-реперфузионного повреждения миокарда мыши [58].
Для выяснения роли нХР в ишемически-реперфузионном повреждении было исследовано влияние 3-(2,4-диметоксибензилиден)анабазеина (GTS21), селективного агониста нХР α7-типа, на функциональную активность сердца крысы in vivo и ex vivo. Введение GTS21 крысам, подвергшимся оперативной ишемии-реперфузии, или добавление этого реагента в перфузионный раствор изолированного сердца до ишемии приводило к значительному увеличению левожелудочкового давления и общего системного давления без влияния на частоту сердечных сокращений [59]. Совместное введение GTS21 с метилликаконитином, селективным антагонистом нХР α7-типа, блокировало эти положительные функциональные эффекты. In vivo введение GTS21 в начале реперфузии уменьшало размер инфаркта миокарда на 42% и количество активных форм кислорода в тканях на 62%. GTS21 нормализовал потенциал митохондриальной мембраны и концентрацию внутриклеточного АТР в культивируемых кардиомиоцитах, подвергшихся гипоксии/реоксигенации. Таким образом, активация нХР α7-типа обеспечивает терапевтический эффект при ишемически-реперфузионном повреждении сердца [59].
Уровень экспрессии мХР M2 и М4, а также нХР α7-типа при ишемически-реперфузионном повреждении измеряли с помощью ОТ-ПЦР и вестерн-блоттинга в изолированном сердце в течение 30 мин ишемии и 60 мин реперфузии [37]. Установлено, что до повреждения экспрессия M2 в левом желудочке была ниже, чем в предсердиях и правом желудочке, тогда как экспрессия нХР α7-типа была значительно выше в левом и правом желудочках, чем в предсердиях. После реперфузии экспрессия мРНК и белка M2 заметно увеличивалась в левом и правом желудочке, а экспрессия α7 нХР значительно усиливалась в левом желудочке. Экспрессия мРНК M4 заметно снижалась после ишемии и восстанавливалась до контрольного уровня после реперфузии в предсердиях, но уровень белка не менялся. Таким образом, увеличение уровня экспрессии M2 мХР и α7 нХР после реперфузии может быть компенсаторной реакцией на ишемически-реперфузионное повреждение миокарда [37].
Важный фактор ишемически-реперфузионного повреждения – клеточный окислительный стресс, один из ключевых медиаторов которого – пероксид водорода (Н2О2) [60]. Образование пероксида водорода при ишемически-реперфузионном повреждении приводит к перегрузке клеток Са2+ из-за усиления перекисного окисления липидов и окисления сульфгидрильных групп белков [61]. Следовательно, любой терапевтический подход, который может улучшить регуляцию и предотвратить перегрузку клеток Са2+, будет полезен для сердца, перенесшего реперфузию. Основываясь на предположении, что АХ может ослаблять изменение гомеостаза внутриклеточного Са2+, вызываемое H2O2 в кардиомиоцитах, было проведено исследование влияния АХ на внутриклеточную регуляцию кальция в изолированных кардиомиоцитах до или после их обработки H2O2 [62]. В миоцитах желудочков сердца крысы H2O2 значительно уменьшал как транзиторный вход внутриклеточного Са2+ в цитозоль, так и скорость его удаления из цитозоля в саркоплазматический ретикулум. Применение АХ до обработки H2O2 (но не после нее) ослабляло снижение транзиторного входа Са2+ и скорости его удаления. И атропин (блокатор мХР), и мекамиламин (блокатор нХР) значительно снижали защитное действие АХ от этого нарушения регуляции внутриклеточного Са2+. Более того, комбинация атропина и мекамиламина полностью устраняла защитное действие АХ. Таким образом, АХ ослабляет изменение гомеостаза внутриклеточного Са2+, индуцированное H2O2, активируя как мускариновые, так и никотиновые холинорецепторы [62].
Другой фактор, вызывающий гибель кардиомиоцитов и необратимые повреждения мышцы сердца, – это кардиотоксичность химиотерапевтических препаратов, в частности антрациклиновых антибиотиков, особенно доксорубицина. Важный патофизиологический признак кардиотоксичности доксорубицина – кардиальная вегетативная нейропатия и связанные с ней митохондриальная и клеточная дисфункции. Для исследования защитного действия лигандов холинорецепторов у крыс вызывали кардиотоксический эффект введением доксорубицина (3 мг/кг в день, 6 доз). Затем в течение 30 дней вводили либо агонист нХР α7 типа PNU-282 987 (3 мг/кг в день), либо агонист мХР бетанехол (12 мг/кг в день), либо оба агониста совместно. Активация α7 нХР способствовала слиянию митохондрий посредством усиления регуляции Mfn1-2 и ослабляла доксирубицин-индуцированную аутофагию, а активация мХР тормозила деление митохондрий и митофагию, что сопровождалось уменьшением митохондриального окислительного повреждения, а также апоптоза и воспаления [63].
Повреждение сердца может вызываться также вирусами. В частности, вирус Коксаки типа В3 инфицирует сердце и вызывает миокардит, сопровождающийся апоптозом кардиомиоцитов. Исследование защитной роли нХР при вирусном миокардите с использованием ПЦР в реальном времени показало, что уровень нХР, содержащего субъединицы α3β4, в кардиомиоцитах новорожденных крыс и клетках H9c2 (кардиомиобластах) возрастает при инфицировании вирусом Коксаки В3 [38]. Никотин при концентрации от 1 нМ до 1 мкМ ослаблял репликацию вируса в клетках H9c2 и кардиомиоцитах новорожденных крыс, однако при более высокой концентрации (10 мкМ) это влияние ослабевало. In vitro блокирование α3β4 нХР его специфическим ингибитором α-конотоксином AuIB отменяло опосредованную никотином защиту кардиомиоцитов от апоптоза, индуцированного вирусом, и это блокирование коррелирует с активацией пути PI3K/Akt и индукцией антиапоптотического белка сурвивина. In vivo у группы инфицированных мышей, получавших AuIB, были ниже выживаемость и хуже систолическая функция желудочков, а также более тяжелое воспаление, чем у группы мышей, получавших только никотин. Таким образом, α3β4 нХР участвуют в опосредованной никотином защите кардиомиоцитов от вирус-индуцированного апоптоза in vivo и in vitro [38].
Низкие дозы никотина способствуют аутофагии кардиомиоцитов новорожденных мышей, ингибируя апоптоз, но в высоких дозах никотин ингибирует аутофагию и способствует апоптозу. Более того, никотин в низких дозах повышал экспрессию гемоксигеназы-1, а нокдаун гена гемоксигеназы-1 отменял эффекты никотина на аутофагию и апоптоз. Селективный блокатор α7 нХР метилликаконитин ингибировал и экспрессию гемоксигеназы-1, и влияние никотина на аутофагию и апоптоз. Эти данные дополнительно подтверждают то, что активация α7 нХР никотином в низких дозах способствует аутофагии и ингибирует апоптоз кардиомиоцитов [64].
Суммарно представленные данные указывают на то, что активация холинорецепторов оказывает кардиопротекторное действие. Сам АХ как лекарственное средство не используется в силу целого ряда причин, включая быстрое расщепление в организме, множественность биологических эффектов и др., но в целом лиганды холинорецепторов могут рассматриваться в качестве защитных средств. Например, холин, взаимодействуя с холинорецепторами, проявляет множественные защитные эффекты против различных сердечно-сосудистых заболеваний, включая ОИМ [65], аритмии [66], сердечную гипертрофию [67, 68] и ишемически-реперфузионное повреждение [69]. Показано, что холин оказывает защитное действие против повреждения сосудов у крыс после ишемически-реперфузионного повреждения [70]. Эти защитные эффекты могут быть связаны с активацией рецептора М3 [57]. Исследование влияния холина на развитие сердечного фиброза показало, что он значительно ингибировал интерстициальный фиброз, и это благотворное действие было нейтрализовано 4‑DAMP, селективным антагонистом М3 мХР [71]. Роль M3 в пролиферации сердечных фибробластов подтверждена путем подавления экспрессии M3 с помощью специфической малой интерферирующей РНК. Уровень белка M3, определенный вестерн-блоттингом, был выше у мышей с сердечным фиброзом. Холин регулирует сердечный фиброз и связанные с ним заболевания сердца, возможно, воздействуя на M3 [71]. Нельзя исключать, что наблюдаемые положительные эффекты холина объясняются увеличением или облегчением синтеза ацетилхолина с последующим возрастанием способности нейронов к массированному (или более длительному) выбросу в синапсы уже ацетилхолина. В принципе, не важно, сам ли холин или его производное ацетилхолин в конечном итоге оказывает описываемые эффекты [70]. Важно, что участие мХР (предположительно М3) в рассматриваемых процессах действительно подтверждено Zhao et al. при помощи его блокатора 4-DAMP [71].
Впрочем, гиперактивация холинорецепторов, в том числе М2, может причинить вред ССС. Кардиопатия, как следствие болезни Шагаса, – наиболее частое осложнение хронической протозойной инфекции, вызываемой простейшим Trypanosoma cruzi. У 30% пациентов, инфицированных T. cruzi, заболевание развивается до состояния, которое может привести к сердечной недостаточности и внезапной смерти. Иммуноглобулины пациентов с хронической формой болезни распознают кислый аминокислотный кластер во второй внеклеточной петле (el2) мХР М2 сердца [72]. Эти остатки соответствуют общему сайту связывания различных аллостерических агентов. Характеристика взаимодействия рецептора с антителами выявила положительный кооперативный эффект между эндогенным лигандом и антителами, приводящий к брадикардии. Аллостерический антагонист М2 галантамин и пептид, соответствующий петле el2, блокировали этот эффект. Таким образом, при хронической кардиомиопатии, вызванной болезнью Шагаса, усиление ответа М2 на АХ за счет аллостерического взаимодействия с антителами может объяснить основные симптомы, о которых сообщается при этом заболевании, такие как синусовая брадикардия и блокада атриовентрикулярной проводимости [72].
Аутокринная ненейрональная холинергическая система сердца
Известно, что миокард желудочков имеет весьма немногочисленную автономную иннервацию, при этом аппликациям АХ присуща однозначно кардиопротекторная направленность и для желудочков сердца. Как стало очевидно в последнее десятилетие, кардиомиоциты, подобно холинергическим нейронам, способны к синтезу и высвобождению АХ, а также к обратному поглощению холина для синтеза АХ. Главный смысл ненейрональной холинергической системы сердца – в паракринном распространении сигнала, поступившего от водителя ритма, от первых кардиомиоцитов к следующим кардиомиоцитам уже без участия нервной ткани, причем с амплификацией и одновременным вовлечением все большего числа соседних кардиомиоцитов. Медиатор этой системы – АХ, а основным рецептором считается мускариновый рецептор М2. Функции системы – распространение потенциала действия, контроль частоты сердечных сокращений, включая циркадный ритм сердца, ограничительное влияние на энергетический метаболизм и гипертрофию миокарда [15]. Интересно, что эта система регулирует ангиогенез коронарных артерий при ОИМ и другие ответы на гипоксию, однако эти эффекты опосредуются опять же через М2, а не через нХР, как в случаях ангиогенеза в других органах.
Кроме АХ, кардиомиоциты способны продуцировать пептид катестатин – неконкурентный блокатор нХР, ингибирующий секрецию катехоламинов в нервной ткани. Защитный эффект катестатина при ишемически-реперфузионном повреждении подобен таковому карбамоилхолина и блокируется атропином и AF-DX116, селективным антагонистом М2 мХР, но не перензепином, антагонистом М1. Более детальные исследования молекулярного механизма показали, что катестатин связывается с рецептором M2 и активирует пути ERK1/2 и PI3 K/Akt, ингибируя таким образом апоптоз клеток, вызванный стрессом эндоплазматического ретикулума. Это приводит к ослаблению ишемически-реперфузионного повреждения. Из данных результатов следует, что за кардиопротекторный эффект катестатина отвечает не блокирование нХР, а активация им М2 мХР [73].
ХОЛИНОРЕЦЕПТОРЫ В КРОВЕНОСНЫХ СОСУДАХ
Следует отметить, что такие кровеносные сосуды, как артерии и вены, состоят из трех слоев, включая внутренний эндотелиальный слой, который играет важную роль в контроле артериального давления, регуляции компонентов свертывания крови и ангиогенезе, и средний слой, содержащий гладкие мышцы, которые контролируют диаметр сосуда. Клетки обоих слоев могут содержать холинорецепторы, регулирующие функциональную активность кровеносных сосудов [74, 75]. Проведенные исследования показали, что релаксация сосудов, вызванная АХ, полностью зависит от интактного эндотелия и опосредована релаксирующими факторами эндотелиального происхождения, включая оксид азота.
Мускариновые холинорецепторы в кровеносных сосудах
Агонисты мХР могут вызывать как сокращение, так и расслабление стенки кровеносного сосуда. Подтипы мХР и результирующий эффект различаются в зависимости от анатомического расположения конкретного кровеносного сосуда, от того, повреждена ли эндотелиальная оболочка кровеносного сосуда, и даже от вида животного [76]. В общем виде М3 и/или М5 клеток эндотелия сосудов посредством белка Gq активируют фосфолипазу С, что приводит к синтезу инозитолтрифосфата и диацилглицерола с активацией протеинкиназы C и последующим высвобождением внутриклеточного кальция, который активирует эпителиальную NO-синтазу eNOS, конститутивно экспрессируемую в эндотелиальных клетках. Сосудистые эндотелиальные клетки могут вызывать вазодилатацию, высвобождая множество факторов релаксации, но основной эффект стимуляции мускариновых рецепторов в коронарных сосудах человека – вазодилатация за счет высвобождения оксида азота (NO) из функционального эндотелия [77]. Затем это мощное сосудорасширяющее соединение диффундирует в гладкомышечное волокно, где стимулирует синтез cGMP растворимой гуанилатциклазой, который через активацию протеинкиназы G запускает процесс вазорелаксации.
Однако у человека и некоторых других видов активация мХР также может вызывать вазоконстрикцию за счет активации рецепторов, присутствующих на гладких мышцах кровеносных сосудов (в частности, легочной артерии) [78]. В общем виде стимуляция М1 и/или М3 гладкомышечных клеток приводит аналогичным путем к высвобождению уже их собственного внутриклеточного кальция и активации кальмодулин-зависимой киназы, которая фосфорилирует киназу легкой цепи миозина, что в итоге приводит к мышечному сокращению. В отсутствие функционального эндотелия эффект холинергической стимуляции гладкой мускулатуры становится незамаскированным, и в результате может наблюдаться вазоконстрикция [79].
Подтип М1. Рецептор М1 широко распространен по всей сосудистой системе, обнаруживается в эндотелии, артериях и легочных венах [80, 81]. Активация М1 в сосудистой сети способствует индукции вазодилатации. Вазодилатация зависит от интактного эндотелия из-за необходимой продукции NO. NO индуцирует вазодилатацию путем активации растворимой гуанилатциклазы, которая диффундирует в гладкомышечные клетки из эндотелия, что приводит к превращению GTP в cGMP. Затем cGMP активирует cGMP-зависимую протеинкиназу G, что приводит к удалению цитозольного Ca2+, ингибированию сократительного аппарата и стимулированию вазодилатации.
Характеристика подтипов мХР, вызывающих АХ-индуцированную эндотелий-независимую вазодилатацию в брыжеечных артериях крыс, показала, что в артериях с интактным эндотелием уровень экспрессии М1 и М3 был значительно выше, чем М2 [81]. Удаление эндотелия значительно снижало уровни экспрессии М2 и М3, но не М1.
В отличие от М3, М1 может вызывать дилатацию сосудов, не связанную с наличием эпителия. В перфузируемых мезентериальных сосудистых руслах с интактным эндотелием и активным тонусом экзогенный АХ (1, 10 и 100 нМ) вызывал концентрационно-зависимую и длительную вазодилатацию. В препаратах без эндотелия АХ в концентрации 1 нМ к релаксации не приводил, но АХ при 10 и 100 нМ вызывал длительную вазодилатацию, которая заметно блокировалась при обработке пирензепином (антагонист М1) или 4-DAMP (антагонист М1 и М3) совместно с гексаметонием (антагонист нХР), но не метоктрамином (антагонист М2 и М4). Эти результаты свидетельствуют о том, что в брыжеечных артериях крысы присутствует в основном мХР подтипа M1, и его (и/или M3-подтипа) активация вызывает эндотелий-независимую вазодилатацию [81].
Однако М1 также играет определенную роль в вазоконстрикции. В частности, активация рецепторов M1 в гладкомышечных клетках сосудов может вызывать вазоконстрикцию в отсутствие эндотелия [17]. Этот подтип связан с вазоконстрикцией мозговых артерий кошек [82], подкожных вен собак [83] и церебральных артериол мышей [84]. Фармакологическая характеристика подтипов мХР, опосредующих сокращение пупочной вены человека, выявила участие рецепторов М1 в данном процессе. И в этом случае вазомоторная активность, вызванная АХ, по-видимому, не модулируется эндотелиальными факторами [85].
Разработка специфических агонистов для рецепторов М1 может быть полезной для противодействия любому повышению артериального давления в малом круге кровообращения [74]. Интересно, что в этом круге имеется также и рецептор М3, а агонист М3 С1213 эффективен при легочной гипертензии [86]. Следует отметить еще один интересный факт о роли М1. На изолированных перфузируемых легких кроликов при моделировании тромбоэмболии легочной артерии в условиях инфузии ацетилхолина показано, что блокатор М1 пирензепин не дает в этих условиях сильно повышаться давлению в легочной артерии [87].
АХ вызывает заложенность носа за счет вазодилатации интраназальных задних собирательных вен в сочетании с вазоконтракцией экстраназальных вен оттока (дорсальная носовая вена и клиновидно-небная вена). Характеристика подтипов мХР, участвующих в индуцированном АХ расслаблении и сокращении носовых вен собак, показала, что подтипы М1 и М3 локализованы в гладкой мускулатуре вен обоих типов. Это означает, что АХ расслабляет интраназальные вены и сужает экстраназальные вены в первую очередь за счет мХР М1 и М3, что указывает на терапевтическую ценность М1/М3-специфических или высокоселективных антихолинергических средств при заложенности носа [88].
Подтип М2. Хотя мХР подтипа М2 в основном связан с сердцем, он также обнаруживается по всей сосудистой сети, особенно в эндотелии коронарных сосудов. Физиологический эффект, связанный с активацией рецепторов этого подтипа, заключается в расширении сосудов [16]. Сосудорасширяющий эффект проявляется за счет высвобождения NO. Использование карбахола или пирензепина позволяет предположить, что М1 и М2 могут быть обнаружены в правой коронарной артерии человека, что также было подтверждено авторадиографическими исследованиями сердца человека, хотя эти результаты предполагают, что М2 в основном экспрессируется в наружной оболочке коронарной артерии [16]. Методом ОТ-ПЦР гены рецепторов М2 и М3 были обнаружены в коронарных артериях человека [89]. Ни М1, ни М4 в исследованных образцах не экспрессировались.
Подтип М3. Рецепторы М3 также обнаружены в сосудистой системе, как в слое эндотелиальных клеток, так и в гладкомышечных клетках сосудов. Ген, кодирующий рецепторы М3, обнаружен в коронарных артериях человека [89]. Эти рецепторы, по-видимому, играют доминирующую роль в АХ-индуцированной вазодилатации большинства кровеносных сосудов [90]. М3 опосредует вазодилатацию в бедренной артерии и грудной аорте только за счет продукции оксида азота эпителием сосудов [90]. Однако ответ на АХ зависит от функциональной целостности эндотелия. В сосудистой системе активация рецепторов M3 и M5 в эпителиальных клетках вызывает вазорелаксацию, в то время как активация рецепторов M3 или M1 в гладкомышечных клетках сосудов в отсутствие эндотелия может вызывать вазоконстрикцию [17]. Так, у кошек активация М3 при интактном эндотелии ведет к вазодилатации, тогда как активация гладкой мускулатуры в отсутствие эндотелия вызывает вазоконстрикцию [91]. При патологиях, при которых эндотелиальный слой повреждается или удаляется, активация М3 на гладкомышечных клетках вызывает вазоконстрикцию [92]. АХ-индуцированная вазоконстрикция, опосредованная стимуляцией подтипа М3 рецепторов при удалении или разрушении эндотелиального слоя, описана для легочной артерии человека [80], перфорирующей ветви внутренней грудной артерии человека [79], коронарной артерии крупного рогатого скота [93] и коронарных артерий свиней [94]. Не исключается участие рецепторов М3 (вместе с М1) и в индуцированной АХ вазоконстрикции в кольцах пупочной вены человека [85].
Исследование мХР М3 в глазных артериях мыши с помощью ПЦР в реальном времени показало, что в артериях с интактным эндотелием имеется мРНК, кодирующая все пять подтипов мХР, но с наибольшим содержанием мРНК рецептора М3. В артериях с удаленным эндотелием рецепторы М1, М2 и М3 демонстрировали сходные уровни экспрессии мРНК, которые были выше, чем у рецепторов М4 и М5. АХ вызывал сужение сосудов в артериях с удаленным эндотелием, которое практически исчезало после инкубации с атропином, блокирующим мХР. Данные, полученные с использованием мышей, дефицитных по М3 (M3R–/–), свидетельствуют о том, что в глазных артериях мыши М3 опосредует холинергическую эндотелий-зависимую вазодилатацию и эндотелий-независимую вазоконстрикцию [92].
Рецепторы М3 локализованы в гладкой мускулатуре интраназальных задних собирательных вен и экстраназальных вен оттока (дорсальная носовая вена и клиновидно-небная вена), а также в эндотелии интраназальных вен носа собаки и, возможно, наряду с М1 и М2, участвуют в индуцированном АХ расслаблении интраназальных и сокращении экстраназальных вен [88].
Подтипы М4 и М5. Информация о наличии мХР подтипов М4 и М5 в кровеносных сосудах весьма ограничена. Так, использование селективного блокатора мХР М4-подтипа холинорецепторов тропикамида в опытах на крысах показало, что в зависимости от дозы у животных наблюдался целый ряд сосудистых эффектов. В частности, ингибирование М4 тропикамидом в дозах 1–100 мкг/кг (не превышающих порог селективности препарата) вызывает транзиторное и дозозависимое снижение артериального давления и общего периферического сосудистого сопротивления [34]. Интересно, что хотя сосудорасширяющий эффект тропикамида не органоспецифичный, он ярко проявляется только в отношении исследованных артерий; при этом скорость органного портального кровотока у большинства животных не изменяется, а у 25% крыс она временно незначительно возрастает [95]. На основании полученных данных авторы предполагают возможное участие М4 в ацетилхолин-индуцированной вазоконстрикции.
Что касается мХР подтипа М5, то сообщается, что этот рецептор опосредует холинергические реакции в церебральных кровеносных сосудах (данные получены с использованием нокаутных мышей M5R–/–) [96]. Воздействуя на М5 эндотелия сосудов, ацетилхолин дозозависимо вызывает повышение концентрации внутриклеточного Ca2+ в эндотелии через его резкий выброс из внутриклеточных депо с последующим поддержанием за счет входа внеклеточного Ca2+. Путь включает активацию фосфолипазы Сβ и синтез инозитолтрифосфата InsP3R3, что в конечном итоге приводит к выработке оксида азота и к эндотелий-зависимой вазодилатации [97]. Интересно, что результаты исследований с использованием мышей, нокаутных по М1, М3 и М5, показали, что за пределами церебральных сосудов М5, по-видимому, не играет значительной роли в вазодилатации [98].
Никотиновые холинорецепторы в кровеносных сосудах
Следует отметить, что в кровеносных сосудах обнаружены практически все субъединицы нХР. Так, экспрессия нХР α7-типа в кровеносных сосудах была первоначально описана в эндотелиальных клетках бычьей аорты [99]. Вскоре после этого α7 нХР были аналогичным образом идентифицированы в эндотелиальных клетках человека из микроциркуляторного русла и вен пуповины, где они вносят вклад в ангиогенный ответ на гипоксию и ишемию [100].
Распределение различных α-субъединиц нХР в артериальной системе крыс исследовали in situ с помощью ОТ-ПЦР и иммуногистохимии [101, 102]. Было обнаружено, что в эндотелиальных клетках экспрессируются субъединицы α3, α5, α7 и α10, что позволяет предположить формирование каналов, предпочтительно проницаемых как для кальция (гомопентамерные α7 нХР), так и для моновалентных катионов (гетеропентамеры, содержащие α3- и α5-субъединицы). Все подтипы α-субъединиц, кроме α9, экспрессировались гладкомышечными клетками сосудов с высокоспецифичным паттерном распределения по сосудистому дереву, в то время как каждая из субъединиц, кроме α9, была обнаружена в грудной аорте, внутрилегочные артериальные ветви содержали только иммунореактивную α7-субъединицу, а другие сосудистые русла занимали промежуточное положение по степени разнообразия экспрессируемых α-субъединиц [101].
Экспрессия α7 нХР также установлена в клетках гладкой мускулатуры аорты крыс [103], базилярной артерии морской свинки [104], церебральных артерий человека [105] и артерий пуповины [106]. Наличие субъединиц α3, α4, α5, α7 и α10 в гладкомышечных клетках показано в целом ряде работ (например, [99, 107]). Интересно, что α4-субъединица была обнаружена в брюшной аорте и не обнаруживается в восходящей аорте, легочном стволе, мышечных, почечных или и легочных артериях [101, 107]. α7-нХР экспрессируется на гладкомышечных клетках большинства сосудов, за исключением сосудов почек, и внутрилегочных артериях [107, 108]. В дополнение к указанным выше еще несколько работ показывают, что субъединицы α3-, α5-, α7-, α10- и β2–β4 также обнаруживаются в эндотелиальных клетках сосудов человека [99, 109, 110]. Кроме того, иммуногистохимическое окрашивание с использованием антител, специфичных к определенным субъединицам нХР, показало, что субъединицы α3, α4, α7, β2 и β4 экспрессируются эндотелиальными клетками пупочной вены человека [100]. Также было обнаружено, что эндотелиальные клетки коронарных микрососудов крысы экспрессировали мРНК субъединиц α2, α3, α4, α5 и α7, а также β2 и β4 нХР, в то время как мРНК β3‑субъединицы не была обнаружена [111].
Методом позитронно-эмиссионной томографии in vivo с использованием радиоактивно меченого 2-18F-фтор-3-[2(S)-2-азетидинилметокси]пиридина ([18F]-2-фтор-A85380), обладающего высоким сродством к нХР, содержащим β2-субъединицу, проведена визуализация артериальных нХР человека [112]. Наличие [18F]-2-фтор-A85380 количественно обнаруживалось в восходящей и нисходящей аорте, дуге аорты и сонных артериях. Было продемонстрировано специфическое поглощение индикатора стенками артерий. Значительно более высокие значения поглощения были обнаружены в нисходящей аорте [112].
Из приведенных данных следует, что в сосудистой системе нХР представлены существенно шире, чем мХР, но, в отличие от последних, они мало связаны с регуляцией сосудистого тонуса, хотя такие сведения также имеются.
В частности, при ингибировании мХР атропином нХР опосредуют вызванное АХ расслабление аорты крыс [113]. Как уже отмечалось, АХ вызывает эндотелий-зависимую релаксацию в аорте, и мХР играют существенную роль в этом процессе. Однако никотин индуцировал эндотелий-зависимую релаксацию как у гипертензивных, так и у нормотензивных крыс посредством активации α7 нХР. Таким образом, активация нХР может способствовать индуцированной АХ эндотелий-зависимой релаксации в аорте, т.е. эти рецепторы участвуют в эндотелий-зависимой регуляции сосудистого тонуса [113].
Следовательно, нХР играют значительную роль в осуществлении контроля нескольких важнейших для ССС физиологических и патофизиологических процессов.
Хорошо известна модулирующая роль эндотелиального α7 нХР как в физиологическом, так и в патологическом ангиогенезе [114, 115]. Проведенные исследования показали, что активация эндотелиального α7 нХР – существенна для процессов пролиферации, миграции, старения и выживания клеток эндотелия [100, 104, 115–117]. В эндотелии сосудов специфические ионотропные свойства α7 нХР (высокая проницаемость для Ca2+) и последующие Ca2+-опосредованные внутриклеточные каскады могут играть важную роль в физиологии (ангиогенез) и патологии (воспаление и атерогенез). Механизмы, лежащие в основе этих эффектов, включают повышение внутриклеточной концентрации Ca2+, активацию митоген-активируемой протеинкиназы, фосфатидилинозитол-3-киназы, эндотелиальной NOS и NF-κB, повышение активности сиртуина 1 и активацию циклина [100, 104, 115, 116, 118].
С использованием комбинации фармакологических и биохимических методов, а также флуоресцентной микроскопии показано, что α7 нХР в клетках эндотелия артерий крыс и эндотелия вен человека обнаруживаются при чрезвычайно низких уровнях экспрессии (∼50 фмоль/мг белка), однако никотин в концентрации 50 мкМ увеличивает экспрессию рецептора в ∼300 раз с одновременным увеличением его экспонированности на поверхности клетки, и этот эффект зависит от липидного состава мембраны клеток [119]. Воздействие никотина заметно стимулировало миграцию клеток и ускоряло заживление ран, этот процесс замедлялся в клетках, лишенных стерола. Ангиогенный эффект никотина усиливался при увеличении содержания холестерина в мембране.
Установлено, что нХР вовлечены в развитие ряда патологий и заболеваний ССС. Курение представляет собой один из наиболее важных факторов риска развития сердечно-сосудистых заболеваний, и никотин играет в этих процессах существенную роль. Никотин вызывает дисфункцию сосудов, изменяя вазореактивность посредством эндотелий-зависимых и/или эндотелий-независимых механизмов и приводя к клиническим проявлениям. Помимо этого, никотин индуцирует ремоделирование сосудов за счет своего влияния на пролиферацию, миграцию и продукцию матрикса как эндотелия сосудов, так и клеток гладкой мускулатуры сосудов [120]. Хотя начальные проявления сосудистой дисфункции, вызванной никотином, могут быть обнаружены не сразу, эти изменения вносят вклад в патогенез серьезных заболеваний, включая атеросклероз, аневризму брюшной аорты, ишемическую болезнь сердца и ОИМ [121–123].
Накопленные данные указывают на то, что вредное воздействие никотина в составе табачного дыма на артериальную стенку может быть опосредовано именно нХР [100, 108–111, 124]. Эти опосредующие эффекты нХР связаны с контролем пролиферации гладкомышечных клеток и ангиогенеза, пролиферации эндотелиальных клеток, среди прочего, путем индукции экспрессии эндотелиальных факторов роста и повышения уровня эндотелиальной NOS в эндотелиальных клетках. Ранее уже обсуждалось, что как эндотелиальные, так и гладкомышечные клетки сосудов экспрессируют множественные α- и β-субъединицы нХР [102, 111, 115, 125, 126], что делает сосудистую сеть прямой мишенью для никотина.
В частности, обнаружена существенная роль α7 нХР в развитии сосудистых патологий. Изменение активности и распределения в клетках этого типа нХР связаны с ангиогенезом (миграция ранозаживляющих клеток) и атерогенезом (изменение содержания холестерина) в эндотелиальных клетках. В гладкомышечных клетках сосудов активация α7 нХР связана с модуляцией миграции, подавлением окислительного стресса, ингибированием гиперплазии неоинтимы, аневризмы брюшной аорты и ремоделированием цитоскелета [127]. Интересно, что неоваскуляризация, миграция/пролиферация гладкомышечных клеток сосудов, ремоделирование сосудов и окислительный стресс способствуют возникновению и прогрессированию атеросклеротических бляшек [128].
Атеросклероз – медленно прогрессирующее хроническое воспалительное заболевание артерий большого и среднего калибра; он включает сложное рекрутирование иммунных клеток, накопление липидов и структурное ремоделирование сосудов. В нескольких типах клеток, участвующих в генезе и прогрессировании атеросклероза, включая макрофаги, дендритные клетки, Т- и В-клетки, эндотелиальные клетки сосудов и гладкомышечные клетки, обнаружена экспрессия нХР α7-типа. Кроме того, α7 нХР – важный регулятор воспаления, поскольку этот рецептор опосредует ингибирование синтеза провоспалительных цитокинов, что приводит к ослаблению атеросклеротического процесса. С другой стороны, активация α7 нХР способствует ангиогенезу и пролиферации гладкомышечных клеток сосудов, что может усиливать атеросклеротические изменения. Вследствие всех этих эффектов α7 нХР – один из ключевых элементов сложной патофизиологии атеросклероза и может представлять многообещающую мишень для лечения воспаления сосудов и атеросклероза [127].
Показано, что нарушение функции α7 нХР с помощью фармакологических антагонистов (например, α-бунгаротоксина или метиликаконитина) или с использованием методологии siРНК ослабляет ангиогенез в экспериментальных моделях ишемического повреждения [114, 124]. Таким образом, агенты, ингибирующие α7 нХР, могут быть полезны для подавления ангиогенеза бляшек при атеросклерозе [129].
Интересно, что нХР, содержащий α1-субъединицу, так называемый мышечный нХР, также может быть вовлечен в патогенез атеросклероза [6, 43]. Так, введение плазмидной ДНК, экспрессирующей siRNA для α1-субъединицы, мышам с дефицитом аполипопротеина Е (ApoE–/–), получавшим атеросклеротическую диету с высоким содержанием жиров, приводило к снижению уровней α1 нХР, значительному уменьшению площади атеросклеротического поражения и других проявлений атеросклероза [130, 131]. Следовательно, продукт гена α1-субъединицы нХР в стенке артерии обладает некоторым функционалом, и снижение его экспрессии замедляет развитие атеросклеротической бляшки.
Таким образом, нХР играют важную роль в процессах, способствующих развитию бляшек и включающих миграцию и пролиферацию гладкомышечных клеток, а также неоваскуляризацию бляшек [132]. Ранее уже обсуждалось использование меченного радиоактивным изотопом лиганда нХР для обнаружения нХР в ткани сонных артерий, дуги аорты и нисходящей аорты [112], а также сердца у человека in vivo [39]. Вполне возможно, что такие агенты могут быть использованы для визуализации атеросклеротических бляшек у пациентов.
Следовательно, никотиновый холинергический путь регулирует несколько компонентов атерогенеза, включая воспаление, фенотип гладкомышечных клеток, их пролиферацию и миграцию, а также неоваскуляризацию бляшек. Все это говорит о возможном использовании лигандов нХР в терапии атеросклероза.
ЗАКЛЮЧЕНИЕ
Холинорецепторы, как метаботропные мускариновые, так и ионотропные никотиновые, участвуют в важнейших физиологических и патофизиологических процессах, протекающих в сердечно-сосудистой системе (табл. 1). При этом разные подтипы холинорецепторов различным образом вовлечены в эти процессы. Для более точного описания таких процессов требуется намного больше информации о структуре и функционировании данных рецепторов. Такая информация может быть получена с применением лигандов, селективных к определенным подтипам холинорецепторов, в этом плане более удобны селективные блокаторы, “выключающие” тот или иной подтип рецептора. Поиск таких соединений – важная фундаментальная задача биоорганической химии.
Таблица 1.
Участие холинорецепторов в регуляции сердечно-сосудистой системы*
| Мускариновый холинорецептор. | Никотиновый холинорецептор. | |||||||
|---|---|---|---|---|---|---|---|---|
| Метаботропный рецептор, сопряженный с G-белком | Ионотропный рецептор – катионный канал | |||||||
| М1 | М2 | М3 | М4 | М5 | α1β1γδ | α3β4 | α7** | |
| Принципиальные локации в ССС | Миокард (желудочки), эндотелий и мышечная стенка сосудов |
Предсердия, проводящая система сердца, эндотелий коронарных сосудов | Миокард, водитель ритма, эндотелий и мышечная стенка сосудов | Предсердия, сосуды | Эндотелий церебральных сосудов | – | Кардиомиоциты | Проводящая система сердца, фибробласты, кардиомиоциты |
| Регулируемые процессы | Сократительная способность сердца | – | – | – | – | Холинергический противовоспалительный путь, ангиогенез, апоптоз | ||
| – | Реперфузия после ишемии миокарда | |||||||
| Паракринное распространение возбуждения, ангиогенез коронарных артерий | – | |||||||
| Тонус кровеносных сосудов | ||||||||
| Влияние на сердце | Увеличение частоты и силы сокращений сердца | Замедление ритма | Замедление синусового ритма и укорочение потенциалов действия | Брадикардия (возможно) | – | – | Защита кардиомиоцитов от вирус-индуцированного апоптоза | Кардиопротекция, ингибирование апоптоза кардиомиоцитов |
| Кардиопротекция | ||||||||
| Влияние на сосуды | Эндотелий-зависимая и независимая вазодилатация, вазоконстрикция некоторых сосудов | Эндотелий-зависимая вазодилатация | Эндотелий-зависимая вазодилатация, эндотелий-независимая вазоконстрикция | Вазоконстрикция | Вазодилатация | Развитие атеросклеротических бляшек | – | Пролиферация и выживание эндотелиальных и мышечных клеток сосудов, эндотелий-зависимая релаксация аорты, неоваскуляризация атеросклеротических бляшек |
| Общие агонисты*** | Ацетилхолин, карбахол, бетанехол | Ацетилхолин, никотин (кроме α9), холин | ||||||
| Селективные агонисты*** | – | Катестатин | С1213, холин | – | – | – | – | PNU-282987, GTS21 |
| Общие антагонисты*** | Мускарин | Катестатин, мекамиламин | ||||||
| Гексаметоний | ||||||||
| Селективные антагонисты*** | Пирензепин, 4-DAMP (менее предпочтительно) | Галантамин****, AF-DX116, метоктрамин |
4-DAMP (более предпочтительно) | Тропикамид, метоктрамин | – | α-Бунгаротоксин, тубокурарин | α-Конотоксин AuIB | Метиликаконитин, α-бунгаротоксин |
* Табл. 1 отражает не все сведения об ацетилхолиновых рецепторах; она суммирует данные, которые связаны с участием ацетилхолиновых рецепторов в регуляции ССС и обсуждаются в данном обзоре. ** В тканях сердца и сосудов описана экспрессия ряда других подтипов нХР (или их субъединиц), но их роль в регуляции ССС не установлена. *** В качестве примера приведены те соединения, которые обсуждаются в тексте, или наиболее широко известные препараты. **** Антихолинэстеразное вещество, одновременно выступающее аллостерическим ингибитором М2-подтипа мХР.
Для борьбы с некоторыми заболеваниями ССС, например, с аритмиями, медицина уже использует ряд лигандов холинорецепторов. Приведенные в обзоре результаты многочисленных экспериментов показывают, что положительное влияние на здоровье достигается чаще активацией рецепторов при соответствующих состояниях. Следовательно, поиск таких соединений, прежде всего активаторов (холиномиметиков), селективных к конкретным подтипам холинорецепторов, имеет уже и прикладное значение, поскольку будет способствовать решению ряда важных медицинских проблем. Среди них – лечение и профилактика аритмий, нарушений сосудистого тонуса, атеросклероза, миокардитов и других связанных с воспалением ССС нозологий.