СОДЕРЖАНИЕ
ВВЕДЕНИЕ.......................................................259
ПРИМЕРЫ МНОГОФУНКЦИОНАЛЬНЫХ БЕЛКОВ.............................................................260
ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТ- ДЕГИДРОГЕНАЗА...........................................262
Функциональное разнообразие GAPDH...............262
Фосфорилирование GAPDH.................................262
Нитрозилирование GAPDH.................................263
Участие GAPDH в метаболизме гема.................263
Апоптотическая и другие роли SNO-GAPDH.....263
Модификация GAPDH N-ацетилглюкозамином......265
МЕЖКЛЕТОЧНЫЕ ВЗАИМОДЕЙСТВИЯ И МНОГОФУНКЦИОНАЛЬНЫЕ БЕЛКИ........266
ПСЕВДОФЕРМЕНТЫ.....................................267
МЕТАМОРФЫ И МОРФЕИНЫ.....................268
ЗАКЛЮЧЕНИЕ................................................269
СПИСОК ЛИТЕРАТУРЫ................................269
ВВЕДЕНИЕ
Многочисленные исследования продемонстрировали, что отдельные белки могут работать “по совместительству” – это означает, что они могут выполнять множество функций в зависимости от локализации в клетке, экспрессии в различных типах клеток, взаимодействия с другими белками с образованием мультимеров и иных механизмов.
В 1982 г. T. Ingolia и E. Craig сообщили об определении первичной последовательности ДНК четырех белков теплового шока (hsp22, hsp23, hsp26 и hsp27) у дрозофилы [1]. Когда эти последовательности белков теплового шока сравнили с последовательностями других известных белков, авторы обнаружили, что они гомологичны α-кристаллину млекопитающих – белку, который составляет 35% хрусталика глаза позвоночных [1]. Белок α-кристаллин несет в себе структурную функцию, которая заключается в содействии поддержанию надлежащего показателя преломления в хрусталике. В дальнейшем было показано, что α-кристаллин экспрессируется в других тканях помимо хрусталика [2–5]. Более того, α‑кристаллин, выделенный из глаз млекопитающих, обладал шаперонной активностью in vitro, указывая на то, что в тканях хрусталика сохранялась эта активность. Вскоре было обнаружено, что другие кристаллины, специфичные для птиц и рептилий, имеют очень высокое сходство последовательностей с метаболическими ферментами, проявляют эти метаболические ферментативные активности при выделении из ткани хрусталика и кодируются тем же геном [6, 7]. Очевидный и неожиданный вывод заключался в том, что некоторые кристаллины, кодируемые одним и тем же геном, могут выполнять две совершенно разные функции.
В 1988 г. J. Piatigorsky и его коллеги впервые описали явление, при котором белок, кодируемый одним геном, выполняет две или более несвязанные функции в клетке или организме [6, 8]. В 1999 г. C. Jeffrey использовала термин “moonlighting proteins”, чтобы лучше описать эти белки, выполняющие несколько функций в клетке или организме [9]. На нынешнем этапе исследования таких белков стало понятным, что они имеют широкое распространение, обеспечивая молекулярные связи между биологическими процессами, которые кажутся совершенно разными.
Многие белки, совмещающие свои функции, выступают ферментами, рецепторами, ионными каналами или шаперонами. Наиболее распространенная основная функция многофункциональных белков – ферментативный катализ, но эти ферменты приобрели вторичные некаталитические роли. Некоторые примеры многофункциональности белков, вторичных по отношению к катализу, включают передачу сигнала, регуляцию транскрипции, апоптоза, подвижности и структурную функцию [10]. При этом проявление различных свойств таких белков может быть связано с их посттрансляционной модификацией, образованием нового комплекса с другим белком или с функционированием в неизменном нативном виде, но в новой роли.
ПРИМЕРЫ МНОГОФУНКЦИОНАЛЬНЫХ БЕЛКОВ
Белки, имеющие множество функций, были обнаружены в различных организмах, включая бактерии, дрожжи, растения и позвоночных [11].
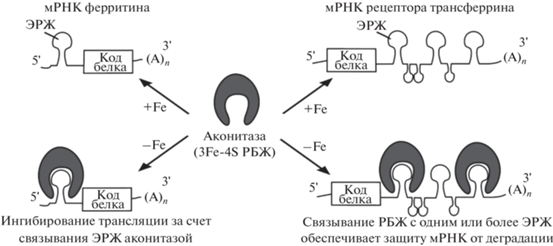
Метаболические ферменты часто совмещают первоначально выявленную функцию с передачей сигналов или регуляцией, например, транскрипции или трансляции. В качестве примера можно привести аконитазу из Mycobacterium tuberculosis [12–14]. Аконитазы – железосерные белки, кластеры которых не только участвуют в транспорте электронов при обратимой изомеризации цитрата и изоцитрата в цикле лимонной кислоты [15], но также служат сенсорами железа и кислорода в клетке [16, 17]. Бинарная активность проявляется посредством сборки и разборки кластеров железа и серы. Белок с интактным кластером 4Fe-4S функционирует как аконитаза, тогда как белок с 3Fe-4S – РНК-связывающий регулятор трансляции [18, 19]. На стабильность и функциональную активность аконитазы как регулятора трансляции влияет не только уровень железа, но и окислительный стресс, который побуждает эти регуляторные белки железа (РБЖ) связываться с элементами, реагирующими на железо (ЭРЖ), и поддерживать гомеостаз железа [20] путем посттранскрипционного связывания с консервативными РНК-структурами “стебель–петля” или ЭРЖ, присутствующими либо на 5'-, либо на 3'-концах нетранслируемых областей мРНК (рис. 1). В зависимости от того, находится ЭРЖ на 3'- или 5'-конце, связывание РБЖ с ЭРЖ либо защищает мРНК от деградации, либо ингибирует ее трансляцию [21, 22].
Рис. 1.
Регуляция трансляции ферритина и рецептора трансферрина. Аконитаза в роли регулятора белков железа (РБЖ) связывается с элементами, реагирующими на железо (ЭРЖ). При снижении уровня железа РБЖ связывается с ЭРЖ на 5' конце мРНК ферритина, выполняющего роль основного внутриклеточного депо железа. В этом случае блокируется трансляция ферритина. Для увеличения возникшего дефицита железа РБЖ связывается с ЭРЖ на 3' концах нетранслируемых областей мРНК рецептора трансферрина, что защищает мРНК от деградации. Дизайн рисунка по данным Beinert et al. [13].
Другой пример многофункционального белка, связывающего два родственных пути, – дигидролипоилтрансацетилаза (DLA2) из хлоропластов Chlamydomonas reinhardtii [23, 24]. Этот белок – часть пируватдегидрогеназного комплекса (PDC), превращающий пируват в ацетил-КоА [23, 25]. Ацетил-КоА далее превращается в малонил-КоА и используется для синтеза тилакоидной мембраны [26, 27]. Если ацетил-КоА синтезируется непосредственно из ацетата, DLA2 может покинуть PDC и взаимодействовать с мРНК, тем самым активируя трансляцию субъединицы D1 фотосистемы II, которая встраивается во вновь синтезированные мембраны. Таким образом, DLA2 связывает метаболический путь с регуляцией трансляции [23, 25]. Также в гликолизе были обнаружены многофункциональные белки, по-видимому, связывающие метаболизм с передачей сигналов. Гексокиназа – фермент, ответственный за удержание глюкозы в клетке путем превращения глюкозы в глюкозо-6-фосфат [28]. У дрожжей обнаружено, что этот фермент, помимо своей основной функции, взаимодействует с транскрипционным фактором Mig1 и ингибирует экспрессию генов, участвующих в углеводном обмене [29, 30].
Многофункциональные белки могут выполнять разные задачи не только внутри клетки, но и внеклеточно. Примером может быть фосфоглюкозоизомераза – еще один фермент, участвующий в гликолизе и катализирующий реакцию превращения глюкозо-6-фосфата в фруктозо-6-фосфат. Этот фермент также выполняет вторичные функции при его секреции из клетки. Было установлено, что последовательность кДНК фосфоглюкозоизомеразы мыши полностью идентична последовательности кДНК нейролейкина мыши [31, 32]. Последний изначально был обнаружен в скелетных мышцах, головном мозге, сердце и почках и известен своей поддерживающей функцией выживания эмбриональных, спинномозговых, скелетных двигательных и сенсорных нейронов. Обширные биохимические и структурные исследования фосфоглюкозоизомеразы установили, что она регулирует различные виды внеклеточной активности и в результате этого имеет много названий, в том числе аутокринный фактор подвижности (AMF) и фактор созревания [33, 34]. Фосфоглюкозоизомераза/AMF занимает особое место в онкогенезе, т.к. играет роль цитокина, который регулирует подвижность опухолевых клеток и является их маркером [35].
Распространенный фактор переключения функций белков подработки – стрессы окружающей среды. Например, пероксиредоксины в нормальных условиях представляют собой семейство пероксидаз, которые структурно – мономеры и поддерживают гомеостаз тиолов, катализируя восстановление органических гидропероксидов, H2O2 и пероксинитрита. Однако в условиях окислительного стресса или теплового шока пероксиредоксин претерпевает переход в более высокомолекулярный гомоолигомерный комплекс, состоящий из пяти димеров, связанных гидрофобными взаимодействиями [36]. Это приводит к изменению восстановительной функции у пероксидазы на шаперонную, заключающуюся в укладке, сворачивании и стабилизации белков, разрушенных в условиях клеточного стресса [37].
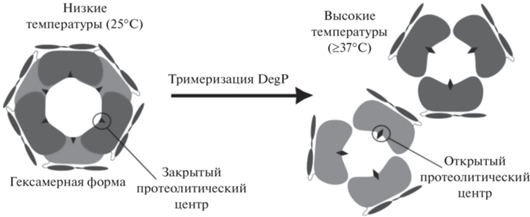
Другой пример – протеаза DegP, также имеющая температурно-зависимое изменение функции, когда она становится молекулярным шапероном. В условиях низких температур (25°C) DegP функционирует как молекулярный шаперон с инактивированным протеолитическим сайтом. При повышении температуры до 37°C и выше протеолитический сайт активируется за счет изменения конформации белка, и в результате DegP может катализировать деградацию белка (рис. 2) [38, 39].
Рис. 2.
Температурно-зависимое изменение функции протеазы DegP. Дизайн рисунка по данным Šulskis et al. [39].
Необходимо отметить, что примеры многофункциональных белков и механизмов их действия весьма многочисленны, но для раскрытия вопроса функций совмещения достаточно рассмотреть глицеральдегид-3-фосфатдегидрогеназу, хорошо известный белок гликолиза.
ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТДЕГИДРОГЕНАЗА
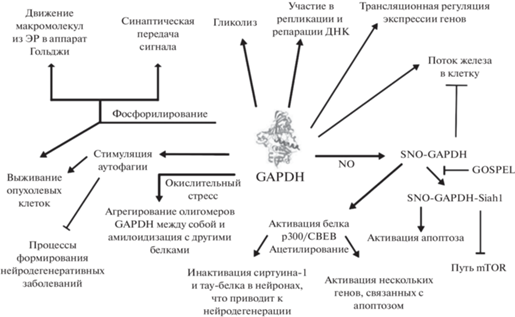
Глицеральдегид-3-фосфатдегидрогеназу (GAPDH, КФ 1.2.1.12) можно назвать классическим представителем многофункциональных белков. GAPDH хорошо известна своей ролью во время гликолиза для производства энергии в клетке – фермент катализирует превращение глицеральдегид-3-фосфата в D-глицерат-1,3-бисфосфат с одновременным образованием NADH. GAPDH долгое время считалась лишь классическим белком домашнего хозяйства, не представляющим особого интереса, за исключением роли в производстве энергии. GAPDH кодируется одним структурным геном GAPD [40, 41] с образованием одной мРНК при транскрипции и отсутствием альтернативных транскриптов [42], ее молекулярная масса составляет 37 кДа [43]. Олигомеры GAPDH способны образовывать активный тетрамер идентичных субъединиц в комплексе с NAD+. На основании этих факторов GAPDH использовалась в качестве стандарта для исследований экспрессии генов и структуры белков.
На сегодняшний день известно, что в дополнение к своей известной роли в гликолизе GAPDH участвует в апоптозе, транспорте железа, слиянии мембран, регуляции транскрипции, транспорте везикул из эндоплазматического ретикулума в аппарат Гольджи и клеточных ответах на внешние воздействия, таких как окислительный стресс и гипоксия. И что важно для многофункциональных белков, все эти функции GAPDH распределены в разных частях клетки, включая клеточную мембрану, цитозоль и ядро. Принимая во внимание все ее многочисленные функции, GAPDH можно рассматривать как ярчайший пример белка, совмещающего несколько функций.
Однако при таком множестве возможных совмещений ферментативной активности должны существовать механизмы, с помощью которых клетки регулируют функциональное разнообразие GAPDH. Это необходимо для того, чтобы клетки могли не только “выбирать”, какая из множества функций GAPDH может быть активирована в данный момент времени, но и для реализации потребности изменения в ее субклеточной локализации.
Функциональное разнообразие GAPDH
Различные исследования показали, что клетки используют посттрансляционную модификацию GAPDH в качестве основного механизма контроля, определяющего ее функции. Благодаря этим преобразованиям клетки могут использовать GAPDH для инициирования процессов в различных путях и субклеточных локализациях. Рассмотрение же принципов формирования “подрабатывающих” свойств у этого представителя белков домашнего хозяйства – хороший наглядный пример для понимания механизмов, отвечающих за функцию совмещения.
Многофункциональность GAPDH – прямой результат множества различных взаимодействий. Например, благодаря NAD+-связывающему домену GAPDH может взаимодействовать с последовательностями мРНК в 5'- или 3'-нетранслируемых областях, что важно для трансляционной регуляции экспрессии генов [44, 45]. В ядре GAPDH в виде мономерной изоформы была идентифицирована как специфический ДНК-связывающий белок, действующий как негистоновый ядерный белок, участвующий в усилении экспрессии генов. Кроме того, в ядре GAPDH может взаимодействовать с Ap4A, который участвует как в репликации ДНК, так и в ее репарации. Нарушение соотношения Ар4А/Ар3А (повышение уровня Ар4А и снижение Ар3А) связано с запрограммированной гибелью клеток [46].
В целом функции, которые выполняет GAPDH, формируются за счет ее киназной активности либо опосредованно через взаимодействие с другими белками.
Фосфорилирование GAPDH
Основная реакция фосфорилирования представляет собой опосредованное киназой добавление электроотрицательной фосфатной группы в качестве боковой цепи аминокислоты-мишени, что изменяет структуру белка из-за взаимодействий заряд–заряд, тем самым влияя на его функцию. Что касается GAPDH, недавно полученные данные демонстрируют, что посттрансляционное фосфорилирование GAPDH необходимо в нормальных соматических клетках для переноса веществ через мембрану и для синаптической передачи [47]. Этот механизм связан с фосфорилированием рецептора ГАМК GABAА, который обеспечивает быстрое торможение в головном мозге. Исследования показали, что GAPDH непосредственно фосфорилирует длинную внутриклеточную петлю субъединицы α1 рецептора GABAA по идентифицированным остаткам серина и треонина. Было обнаружено, что GAPDH и субъединица α1 локализованы на плазматической мембране нейронов. В соответствии с молекулярной ассоциацией рецепторов GAPDH/GABAA, гликолитический ATP, продуцируемый локально на плазматических мембранах, расходуется на фосфорилирование этой субъединицы α1.
Вновь синтезированные клеточные соединения могут нуждаться в сложных путях для их транспорта из одного субклеточного компартмента в другой. Таким образом, движение клеточных макромолекул из эндоплазматического ретикулума (ЭР) в аппарат Гольджи – важный транспортный механизм, обеспечивающий в конечном итоге секрецию этих макромолекул. Недавние исследования продемонстрировали, что Rab2 GTPаза ответственна за формирование так называемых везикулярных тубулярных кластеров, промежуточных соединений пре-Гольджи [48]. GAPDH была идентифицирована как неотъемлемая часть этого комплекса [49]. Однако была показана не только необходимость GAPDH для Rab2 GTPаза-опосредованного транспорта из ЭР в аппарат Гольджи, но также обнаружено обязательное условие для этого транспорта – два специфических последовательных посттрансляционных фосфорилирования GAPDH [50]. Анализ in vitro показал, что существует определенная временная последовательность фосфорилирования, заключающегося в образовании фосфорилированой по серину serPGAPDH с последующим образованием serPGAPDHtyr41P по тирозиновому остатку. Дальнейшие исследования показали, что serPGAPDH может участвовать в формировании промежуточной структуры пре-Гольджи, в то время как serPGAPDHtyr41P необходима для фактической транслокации комплекса из ЭР в аппарат Гольджи. Механизм же заключается во взаимодействии GAPDH как с тубулином, так и с динеином – белками, которые отвечают за транспорт. В первом случае GAPDH формирует путь, по которому движется комплекс, во втором – обеспечивает процесс перемещения комплекса по этому внутриклеточному пути.
Нитрозилирование GAPDH
Оксид азота (NO) – значимая молекула вторичной передачи сигнала in vivo. Недавние исследования продемонстрировали, что посттрансляционная модификация GAPDH оксидом азота в ее цистеиновом активном центре (SNO-GAPDH) приводит к включению последнего в метаболизм гема, иммунный ответ и апоптоз. Также SNO-GAPDH используется клетками в качестве нитрозилазы, переносящей фрагмент оксида азота на другой белок.
Участие GAPDH в метаболизме гема
GAPDH играет значительную роль без дополнительных посттрансляционных модификаций в поглощении железа [51], внутриклеточном транспорте [52] и включении железа в апогем [53]. В данном случае GAPDH лигирует гем через остаток гистидина (His53), расположенный на гибкой петле в межпротомерном участке в тетрамерной форме GAPDH. Замена этого гистидина и последующее снижение связывания гема GAPDH противодействует доставке гема как к цитозольным, так и к ядерным гемопротеинам-мишеням, включая индуцибельную синтазу оксида азота (iNOS) в макрофагах мыши и ядерный фактор транскрипции Hap1 в дрожжах, несмотря на то что GAPDH вызывала резкое повышение уровня лабильного гема в клетках. Таким образом, благодаря своему свойству лигирования гема нетрансформированная GAPDH создает пул, который биодоступен для нижестоящих белков.
Что касается SNO-GAPDH, серия исследований определила ее роль в регуляции метаболизма гема [54]. Первоначально было установлено, что оксид азота ингибирует включение гема в iNOS [55]. Однако впоследствии была определена взаимосвязь между образованием SNO-GAPDH, последующим уменьшением связывания гема, а также ингибированием встраивания гема в апо-iNOS [54]. Таким образом, в нативной форме GAPDH обеспечивает приток гема, а в окисленной форме его блокирует.
Апоптотическая и другие роли SNO-GAPDH
Роль GAPDH в апоптозе представляет собой, пожалуй, одну из наиболее значительных ее вспомогательных защитных функций. Механизм этой активности, в частности, определяется той же модификацией оксидом азота цистеина активного центра GAPDH. Это обеспечивает образование цитоплазматического комплекса SNO-GAPDH с белком Siah1 [56]. Siah1 действует как убиквитинлигаза E3 и участвует в апоптозе [57–59], служит для деградации ядерных белков во время запрограммированной гибели клеток в протеасомах. Однако сам по себе Siah1 нестабилен, характеризуется коротким периодом полураспада. Импульсный анализ в клетках показал, что трансфицированный Siah1 имеет период полураспада T1/2 ~ 5 мин. Напротив, котрансфекция с GAPDH с образованием комплекса приводила к увеличению его T1/2 до 40 мин [56]. Таким образом, Siah1 обеспечивает ядерную протеасомную деградацию белков при апоптозе вследствие стабилизации, опосредованной SNO-GAPDH.
Существует механизм регулирования взаимодействия GAPDH с Siah. В нейронах мышей был обнаружен цитоплазматический белок GOSPEL (конкурент GAPDH с Siah Protein Enhances Life), действующий как негативный регулятор пути SNO-GAPDH. Оценка уровней мРНК белка GOSPEL показала, что он присутствует в наибольшем количестве в органах, наиболее обогащенных GAPDH, таких как мозг, сердце, легкие и скелетные мышцы. S-Нитрозилирование GOSPEL способствует его связыванию с S-нитрозилированной GAPDH, конкурируя с Siah1, сохраняя связанную с GOSPEL GAPDH в цитозоле и предотвращая цитотоксический эффект [60]. Однако как только уровень нитрозативного стресса превышает пороговое значение, связывание GAPDH–Siah1 преобладает над взаимодействием GAPDH–GOSPEL, что приводит к гибели или дисфункции клеток. Альтернативный механизм нарушения связывания SNO-GAPDH с Siah1 включает опосредованное SNO-GAPDH транснитрозилирование B23/нуклеофозмина. Как следствие, это увеличивает взаимодействие SNO–B23 и Siah1, в то же время уменьшая уровень SNO-GAPDH и устраняя апоптотический эффект пути [61].
Также GAPDH вовлечена в последовательность апоптотических реакций, локализованных в ядре. Она связана с активацией белка p300/CBEB (CBP) путем образования комплекса с SNO-GAPDH. За этим происходит ацетилирование p53 комплексом CBP–SNO-GAPDH и последующая активация нескольких генов, связанных с апоптозом, включая PUMA, Bax и p21 [62].
Отметим, что помимо многообразия совмещения функций самой GAPDH, модификация этого белка молекулой NO показывает также многообразие функциональной активности. Дополнительные свойства модифицированной формы были обнаружены в других исследованиях патологических состояний, связанных с опухолями и неврологическими расстройствами.
Опухолевые клетки используют серин/треонинкиназу Akt (белок, участвующий в регуляции клеточной пролиферации) в качестве средства, способствующего их выживанию. Этот защитный механизм включает фосфорилирование белка p40, впоследствии идентифицированного как GAPDH. Значение этой посттрансляционной модификации GAPDH изначально исследовали в клетках рака яичников [63]. В клетках, обработанных перекисью в качестве индуктора апоптоза, фосфорилирование GAPDH приводило к ингибированию апоптоза. Иммуноцитохимический анализ показал цитоплазматическую локализацию GAPDHP, а в результате мутационного анализа был идентифицирован GAPDHthr237 как сайт фосфорилирования киназы Akt. Поскольку остаток thr237 расположен в сайте связывания комплекса SNO-GAPDH–Siah1, было высказано предположение, что эта посттрансляционная модификация предотвращает образование белкового комплекса SNO-GAPDH–Siah1 за счет стерических преобразований, тем самым предотвращая апоптотическое разрушение опухолевых клеток и обеспечивая их выживание.
С другой стороны, были проведены исследования нейродегенеративного и нейропротекторного действия факторов в отношении тау-белка [64, 65]. Тау-белок, который в большом количестве содержится в нейронах, первоначально был охарактеризован как белок, способный связывать и стабилизировать микротрубочки. Однако в настоящее время известно, что функции тау-белка выходят за рамки способности модулировать динамику микротрубочек: он играет опосредованную роль в аксональном транспорте, в синаптической структуре и функции, а также в сигнальных путях нейронов. Хотя тау-белок важен для функционирования нейронов, играет важную физиологическую роль в нейронах, его участие в нейродегенеративных заболеваниях и, что наиболее заметно, в патогенезе болезни Альцгеймера стимулировало исследования в этом направлении. Нейробелок тау интересен тем, что в проявлениях его биологических эффектов и патологических отклонений ключевая роль принадлежит GAPDH. Было обнаружено, что ацетилирование тау (Ac-tau) происходит опосредованно с SNO-GAPDH, которая одновременно инактивирует сиртуин-1 (Sirtl) и активирует p300/CBP-ацетилтрансферазу, увеличивая уровень нейронального Ac-tau. Последующая неправильная локализация тау-белка вызывает нейродегенерацию и нейроповеденческие нарушения, а также при этом Ac-tau накапливается в крови. В эксперименте на мышах блокирование S-нитрозилирования GAPDH, ингибирование p300/CBP или стимуляция Sirtl обеспечивало защиту от нейродегенерации, нейроповеденческих нарушений и накопления Ac-tau в крови и мозге. У пациентов же, получающих ингибиторы p300/CBP сальсалат или дифлунизал, наблюдалось снижение частоты симптомов болезни Альцгеймера [65].
Другое прогрессирующее нейродегенеративное заболевание – болезнь Гентингтона – пример наиболее сложных взаимодействий белков, в которых задействована GAPDH. Известно, что для поддержания гомеостаза белка клеткам необходимо обеспечить не только строгий контроль синтеза белка наряду с точным сворачиванием для поддержания правильной конформации белка, но и деградацию любых неправильно свернутых белков. Один из механизмов этой регуляции – аутофагия. Белки, ускользающие от “точек контроля качества”, могут образовывать агрегаты. Агрегация и неправильный фолдинг белков приводят к протеинопатиям, которые в случае нейрональных клеток служат фактором развития нейродегенеративных заболеваний. GAPDH играет важную роль в аутофагии за счет регуляции этого процесса различными путями [66, 67]. Установлено, что один из механизмов проявляется в условиях низкого уровня глюкозы, в результате которого наблюдается ингибирование передачи сигналов mTOR за счет взаимодействия между GAPDH и суперсемейством Ras GTPаз Rheb, что предотвращает связывание Rheb с mTOR и регулирует взаимодействие между путем гликолиза и путем mTORC1 [68]. Таким образом, GAPDH может стимулировать аутофагию, т.к. ингибирование mTOR индуцирует этот процесс [69]. Авторы, которые ранее установили роль GAPDH в качестве рецептора для белков-переносчиков железа трансферрина и лактоферрина, оценили связь мутантной формы белка гентингтина (mHtt), GAPDH и mTOR [70]. Используя модельную систему клеточной культуры со сверхэкспрессией GAPDH, экспрессирующую мутантный белок mHtt, авторы наблюдали меньшее количество неправильно свернутых белковых агрегатов и более высокий уровень аутофагии по сравнению с таковыми в контрольных клетках. Было установлено, что сверхэкспрессия GAPDH оказывает защитное действие на клетки, приводя к снижению нагрузки белковыми агрегатами, и способствует их расщеплению путем индукции аутофагии.
Важно подчеркнуть, что GAPDH оказывает негативное влияние на аутофагию. Было установлено, что GAPDH – ключевой фактор образования агрегатов с такими белками, как mHtt или β-амилоид, и формирования амилоидоза [71]. В исследованиях in vitro было показано, что окисление GAPDH вызывает структурные изменения и образование межмолекулярных дисульфидных связей, которые приводят к агрегации этого фермента [72]. Наиболее чувствительная мишень для оксидантов в GAPDH – остаток Cys152, находящийся в активном центре фермента и принимающий непосредственное участие в каталитической реакции. Окисленная форма фермента может легко диссоциировать, денатурировать, агрегировать или взаимодействовать с другими биомолекулами [73–75]. Именно окисленная GAPDH способна образовывать комплекс с растворимым β-амилоидом и ускорять его агрегацию [76]. Напротив, восстановленная форма GAPDH не способна образовывать устойчивый комплекс с β-амилоидом. В случае болезни Гентингтона сверхэкспрессия GAPDH или Siah1 усиливает ядерную транслокацию mHtt и, собственно, его цитотоксичность [77]. Нейропротекторное действие некоторых антиапоптотических препаратов включает блокаду системы GAPDH/Siah1 и ингибирование агрегации GAPDH для снижения последствий нейродегенеративных заболеваний [78, 79]. Таким образом, GAPDH – внутриклеточный сенсор окислительного стресса и ключевой фактор аутофагии, а ее олигомерное состояние и склонность к агрегации зависят от метаболического состояния клетки, т.е. от активности антиоксидантной системы и уровня окислительного стресса [80, 81].
С другой стороны, GAPDH может действовать как фактор выживания посредством индукции аутофагии при раке для поддержки потребления энергии за счет быстрой пролиферации клеток. Colell et al. показали, что ядерная GAPDH защищает клетки от каспазонезависимой гибели клеток, индуцируя аутофагию [82]. Поскольку ядерная GAPDH участвует в регуляции транскрипции [83], авторы предположили, что GAPDH может прямо или косвенно регулировать транскрипцию ATG12 – убиквитин-подобного белка, участвующего в образовании везикул для аутофагии. Таким образом, GAPDH координирует два метаболических пути, продуцирующих ATP путем гликолиза и удаляющих поврежденные митохондрии путем аутофагии, чтобы предотвратить каспазонезависимую гибель клеток [82, 84].
Модификация GAPDH N-ацетилглюкозамином
Структурно-функциональный анализ GAPDH позволяет предположить, что многие виды активности этого фермента зависят от олигомерной ассоциации. Например, тетрамерная структура GAPDH выполняет свою классическую роль в гликолизе.
Исследования этого вопроса свидетельствуют о том, что N-ацетилглюкозамин в связи с GAPDH может обеспечивать регуляцию третичной или четвертичной структуры GAPDH [85]. Было показано, что большая часть GAPDH, модифицированной N-ацетилглюкозамином, присутствует в виде мономера с молекулярной массой 37 кДа. Мутационный анализ продемонстрировал, что GAPDH, локализованная в цитоплазме, содержала модифицированную аминокислоту T227A в отличие от GAPDH с ядерной локализацией, в которой присутствовала N-ацетилглюкозаминовая модификация. За счет такого механизма транслокации в ядро клетки GAPDH принимает участие в регуляции во многих клеточных процессах, описанных выше, в нормальных условиях и при окислительном стрессе.
Таким образом, всевозможные функции белков-совместителей, показанные на примере GAPDH, проявляющей исключительную многофункциональность, могут быть опосредованы как самим белком, так и его модификациями (рис. 3).
Результирующий список всех функций даже одного белка сложно предсказать и определить. Поэтому для таких белков были созданы специальные отдельные базы данных об обнаруженных свойствах, как, например, MoonDB (http://moondb.hb.univ-amu.fr/) или MoonProt (http://www.moonlightingproteins.org/). Эти базы постоянно обновляются, пополняются все новыми белками и новыми открытыми функциями.
МЕЖКЛЕТОЧНЫЕ ВЗАИМОДЕЙСТВИЯ И МНОГОФУНКЦИОНАЛЬНЫЕ БЕЛКИ
Помимо описанных механизмов функционирования в клетках белки-совместители имеют и другие неожиданные свойства. Известно ~700 многофункциональных белков с изученными функциями, вовлеченных в вирулентность бактериальных и грибковых патогенов, при этом четверть из них – белки вирулентности патогенов [86]. Это прежде всего высококонсервативные белки домашнего хозяйства, имеющие функции шаперонов и участвующие в реакции на стресс или в метаболизме. Способность этих белков менять функцию во время патологического процесса зависит от их выведения из клетки, происходящего без использования характерных механизмов секреции [87–89]. Точно так же прикрепление этих белков к клеточной поверхности недостаточно изучено [89]. Оказавшись вне прокариотических или эукариотических патогенов, они опосредуют клеточную передачу сигналов или адгезию и могут даже действовать как токсины.
Во время межклеточных взаимодействий GAPDH берет на себя множество биологических функций. Например, она проявляет разную активность у четырех видов Streptococcus [87, 88]. У S. pyogenes GAPDH на клеточной поверхности действует как адгезин [90] и инвазин [91], а также передает сигналы клеткам-хозяевам [91, 92]. Она также функционирует как белок уклонения от нейтрофилов [93]. У S. agalactiae GAPDH выступает иммуномодулятором, стимулирующим В‑клетки [94]. У S. pneumoniae GAPDH связывает плазминоген [95], а у S. suis GAPDH функционирует как гем-связывающий белок [96], альбумин-связывающий белок [97] и адгезин [98]. GAPDH – важный фактор адгезии Mycoplasma hyrohinis и рецептор для захвата плазминогена хозяина, что увеличивает направленность протеолиза и способствует распространению M. hyorhinis [99]. Энтерогеморрагические и энтеропатогенные штаммы Escherichia coli также экспрессируют GAPDH на клеточной поверхности, тогда как у непатогенных штаммов этого не наблюдается. В патогенных штаммах GAPDH связывает фибриноген и плазминоген [88]. У M. genitalium GAPDH играет роль белка клеточной поверхности, участвующего в связывании муцина [100]. Вполне вероятно, что по мере изучения большего количества видов бактерий будет обнаружено больше дополнительных ролей GAPDH.
Енолаза – пример белка с похожим механизмом. Внутри клетки енолаза катализирует превращение 2-фосфоглицерата в фосфоенолпируват при гликолизе. Енолаза у Aeromonas hydrophila, Bacillus anthracis, Neisseria meningitidis, S. pneumoniae, Trichomoniasis vaginalis и Lactobacillus crispatus может связываться с плазминогеном хозяина [101–106]. Связывание плазминогена играет важную роль в инвазии тканей хозяина, потому что после связывания с рецептором клеточной поверхности плазминоген превращается в активную протеазу – плазмин, который может способствовать разрушению внеклеточного матрикса хозяина и инвазии тканей [107, 108]. У некоторых видов локализованная на поверхности енолаза и другие белки подработки связываются с другими белками-хозяевами поверхностей слизистых оболочек для модулирования иммунной системы хозяина. Енолаза S. suis также может связываться с фибронектином хозяина, а енолаза Staphylococcus aureus – с ламинином [109, 110].
Обнаруженные различные механизмы действия многофункциональных белков позволяют понять то, что все известные белки могут иметь множество еще не установленных функций за счет простых преобразований их структуры. Однако белки обладают и другими функциональными проявлениями помимо описанных примеров совмещения ролей. Небольшой ряд белков за счет их нетипичных свойств был выделен в отдельные классы псевдоферментов, метаморфов и морфеинов.
ПСЕВДОФЕРМЕНТЫ
Псевдофермент представляет собой белок или домен в белке, который имеет аминокислотную последовательность и трехмерную укладку, напоминающую обычный каталитически активный фермент, но не обладающий каталитической активностью [111–116].
Во многих случаях субъединица псевдофермента взаимодействует с каталитически активными гомологами посредством прямого связывания и регуляции катализа или служит каркасом для сборки мультибелкового комплекса, содержащего активные гомологи. Трехмерная структура псевдофермента может быть достаточно близкой к структуре активного гомолога для связывания субстрата, кофактора или металлов, но вместо использования каталитической активности связывание лиганда выступает в качестве регулятора другой функции.
Первым псевдоферментом, о котором было сообщено, был α-лактальбумин (LA), гомолог лизоцима, который экспрессируется в молочной железе и действует как регуляторная субъединица лактозосинтазы [117]. Лактозосинтаза представляет собой комплекс из каталитической субъединицы β-1,4-галактозилтрансферазы и некаталитической субъединицы LA (1 : 1). Без LA β-1,4-галактозилтрансфераза переносит галактозильный остаток UDP-галактозы на N-ацетилглюкозамин или олигосахариды, содержащие N-ацетилглюкозамин (рис. 4).
Рис. 4.
Участие β-1,4-галактозилтрансферазы в образовании лактата. Галактоза под действием β-1,4-галактозилтрансферазы может принимать участие в образовании глюкоконъюгатов при связывании с N-ацетилглюкозамином или лактозы в случае взаимодействия с лактозосинтазой, состоящей из β-1,4-галактозилтрансферазы и псевдофермента α‑лактальбумина.
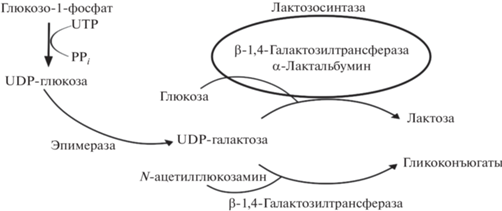
Когда LA связывается с β-1,4-галактозилтрансферазой, он помогает глюкозе связываться в активном центре фермента, образуя водородную связь с гидроксильной группой сахара, а также блокируя связывание олигосахаридов. Эти взаимодействия снижают Km для глюкозы в ~1000 раз, что способствует переносу остатка галактозила на глюкозу вместо N-ацетилглюкозамина и приводит к синтезу лактозы в молочных железах [118, 119].
Псевдоферменты в настоящее время известны в десятках семейств белков, включая псевдокиназы, псевдоубиквитинлигазы, псевдодеубиквитиназы, псевдонуклеазы и псевдонуклеозидтрифосфатазы.
МЕТАМОРФЫ И МОРФЕИНЫ
Метаморфные белки – следующий уровень сложности в нашем понимании структуры и функций белков [120, 121]. Они имеют две или более складчатых структур в качестве своих нативных форм, а в некоторых случаях разные структуры выполняют разные функции. В отличие от внутренне неупорядоченных белков, у которых нативные состояния свернуты или развернуты, метаморфные белки одновременно свернуты и структурированы. Взаимопревращения между этими формами обратимы, что означает, что в равновесии существует баланс между этими состояниями [122]. Хотя наличие двух стабильных форм фолдинга может противоречить термодинамическим принципам сворачивания белка, при которых конечная форма белка имеет в целом самую низкую свободную энергию, было показано, что две нативные структуры могут иметь одинаковую энергию с низкой активацией барьера рефолдинга [123]. К настоящему времени обнаружено небольшое количество метаморфных белков, в том числе лимфотактин, RfaH, CLIC1, Mad2, KaiB, IscU, селеказа и обратная транскриптаза ВИЧ-1, из которых первые три – также многофункциональные белки [124–131].
Для примера, хемокин лимфотактин семейства C (Ltn) – метаморфический белок, а также многофункциональный белок с гепарин-связывающей активностью [132]. В нормальных физиологических условиях (37°C и 150 мМ NaCl) лимфотактин находится в равновесии между двумя нативными состояниями, Ltn10 и Ltn40. Ltn10 представляет собой мономер, имеющий β-лист и α-спираль в канонической хемокиновой складке, который подвергается повторной укладке и димеризации, превращаясь в Ltn40, содержащий β‑сэндвич и удвоенную α-спираль (рис. 5).
Рис. 5.
Структуры цепей лимфотактина из базы данных белков Ltn10 (PDB: 2HDM) и Ltn40 (PDB: 2JP1). Ltn10 представлен мономером, имеющим β-лист и α-спираль. Ltn40 – результат димеризации с образованием β-сэндвича.
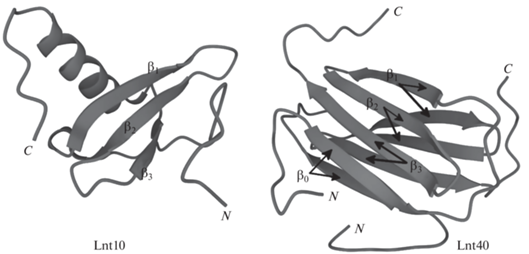
В то время как Ltn10 – агонист хемокинового рецептора 1, связанного с XC-мотивом G-белка (XCR1), Ltn40 не может связываться с XCR1, но вместо этого может связываться с гепарином, гликозаминогликановым компонентом внеклеточного матрикса. В равновесии имеется почти равное количество Ltn10 и Ltn40. Взаимопревращения между Ltn10 и Ltn40 можно контролировать небольшими изменениями концентрации соли и температуры. При высокой концентрации соли и низкой температуре преобладает вид Ltn10, однако при более низких концентрациях соли и более высоких температурах, но не превышающих 40°C, преобладает вид Ltn40 [133]. Большинство других хемокинов, по-видимому, не подвергаются этим превращениям, потому что они содержат две дисульфидные связи. Поскольку лимфотактин имеет только одну дисульфидную связь, он менее ограничен и более гибок в изменении конформации по сравнению с другими хемокинами, что частично объясняет обратимость между двумя различными нативными структурами.
Морфеины же представляют из себя субъединицы белков, образующие мультимер, который может разбираться, изменять конформацию (без рефолдинга) и собираться в другой мультимер [134].
Порфобилиногенсинтаза, известная как дегидратаза δ-аминолевулиновой кислоты, – это прототип морфеина. Она имеет два олигомерных состояния, которые коррелируют с различными уровнями ферментативной активности и связывания аллостерических эффекторов [135]. Октамер может распадаться на димеры. Будучи частями димера, домены внутри субъединиц могут сдвигаться в своих относительных положениях, что приводит к образованию субъединиц с другой конформацией, которые затем могут собираться в гексамер. В то время как эти различные гомомультимеры различаются по уровню активности фермента порфобилиногенсинтазы, этот белок также выступает белком подработки, поскольку у него есть вторая функция – связывание с протеасомой и ее ингибирование [136, 137].
Описанная на рис. 2 протеаза DegP также относится к морфеинам. У этого белка при низких температурах, помимо описанных конформационных изменений в тримерные и гексамерные формы, протеазная активность может быть запущена самими субстратами, которые опосредуют образование протеолитических 12/24-мерных единиц за счет временных взаимодействий между доменами [39].
ЗАКЛЮЧЕНИЕ
С тех пор как более 30 лет назад впервые была представлена концепция совместного использования генов для совмещения функций белков, по-новому стали оцениваться молекулярные связи между совершенно разными биологическими процессами.
Многофункциональные белки, включая метаморфные и морфеиновые, взаимодействуют по сложной схеме. Поскольку клеточные условия изменяются из-за метаболизма и факторов окружающей среды, функции этих белков преобразуются, что приводит к различным комбинациям межбелковых взаимодействий и процессов. В литературе, посвященной данному вопросу, четко прослеживается мысль о том, что многообразие проявлений поднимает важный вопрос о классификации этих белков. Их название в нынешнем виде не согласуется с теми функциями, которые белок выполняет. Ключевое разногласие исходит из того, что фермент называется по субстрату, когда функции самого белка могут выходить далеко за эти пределы. При этом сложность и различие в самих процессах и множестве объектов делают их исследование затруднительным. Хорошие примеры – фосфоглюкозоизомераза и глицеральдегид-3-фосфатдегидрогеназа. У первого фермента существуют другие названия – от нейролейкина до фактора созревания, что вносит больше путаницы, чем упорядочивания. У GAPDH нет подмножества названий, но ее обозначение никак не отражает всех ролей этого фермента.
С другой стороны, что более важно, это вопрос выявления механизмов и вовлеченности белков в совмещение ролей. Дизайн исследования процессов в клетке требует весьма многостороннего анализа и различных методов исследования. Открытие многофункциональных белков до сих пор носит случайный характер, и их целевой поиск весьма трудоемок, поэтому изучение обозначенной проблемы идет очень медленно. Однако раскрытие механизмов и функций в данной сфере однозначно может расширить наши представления о физиологии клетки и поднять медицину на совершенно иной уровень, т.к. проблемы лечения и разработки новых лекарственных средств – прямое отражение уровня нашего познания жизнедеятельности живых систем.