БИОХИМИЯ, 2019, том 84, вып. 10, с. 1371 - 1384
УДК 577.125
МЕХАНИЗМЫ РЕГУЛЯЦИИ ОНКОБЕЛКАМИ АЭРОБНОГО
ГЛИКОЛИЗА (ЭФФЕКТ ВАРБУРГА) В ПРОЦЕССЕ
КАНЦЕРОГЕНЕЗА
Обзор
© 2019 В.А. Кобляков
НМИЦ онкологии им. Н.Н. Блохина Минздрава России, 115478 Москва,
Россия; электронная почта: kobliakov@rambler.ru
Поступила в редакцию 04.02.2019
После доработки 17.06.2019
Принята к публикации 17.06.2019
По современным представлениям независимо от канцерогенного воздействия происходит нарушение
структуры онкогенов или/и дезактивация генов супрессоров. В результате функционирования нерегулиру
емых онкобелков происходит активация внеклеточных протеаз, разрушение межклеточного матрикса, вы
зывающее инвазию, разрушение межклеточных связей и метастазирование. Для реализации опухолевого
процесса необходима активация транскрипции, но многие онкогены не обладают этим свойством. Можно
заключить, что большинство онкобелков не являются конечными эффекторами развития опухоли, а пере
дают сигнал на некий элемент, транскрипционный фактор, который и «продвигает» опухолевый процесс.
В данном обзоре рассматриваются механизмы канцерогенеза, вызванного различными онкобелками, и де
лается заключение, что общим для них является активация аэробного гликолиза (эффект Варбурга), регу
лируемого, как правило, через стимуляцию транскрипционного фактора HIFα. Обсуждается роль аэробно
го гликолиза на ранних стадиях канцерогенеза.
КЛЮЧЕВЫЕ СЛОВА: гипоксия, эффект Варбурга, воспаление, RAS, SRC, HIFα, MYC, mTOR.
DOI: 10.1134/S0320972519100014
Основные характеристики злокачественного
опухоли [2, 3]. Уровень рН в клетках нормаль
опухолевого роста: инвазия - разрушение вне
ной и опухолевой ткани различен. Среднее зна
клеточного матрикса с последующим прораста
чение рН внутри клетки нормальной ткани име
нием опухоли в окружающую ткань, и метаста
ет нейтральное значение, а в межклеточном
зирование - нарушение межклеточных связей,
пространстве - слабо щелочное (7,35-7,45). В опу
приводящее к отрыву опухолевых клеток от ос
холевой клетке картина противоположная:
новной массы опухоли, способность этих кле
внутри клетки значение рН щелочное
ток выживать в жидкой среде, избегая аноикиса,
(7,12-7,90), вне клетки - кислое (6,2-6,9) [4].
и размножаться в отдаленном чужеродном орга
Подкисление межклеточного пространства сти
не. Эти физиологические особенности опухоле
мулирует активность металло и других протеаз,
вого процесса идут рука об руку и определяют ее
что вызывает разрушение межклеточного мат
злокачественность и отличие от поведения нор
рикса и межклеточное взаимодействие. Основ
мальных зрелых клеток. Можно заключить, что
ной фактор подкисления межклеточного прост
хотя бы на начальном этапе инвазия и метаста
ранства в ткани опухоли - это процесс гликоли
зирование реализуются по общему механизму.
за. Методом позитронно эмиссионной томо
Показано, что инвазия происходит из зон опу
графии с использованием меченого радиоактив
холи с пониженным уровнем рН, а в зонах опу
ным фтором аналога глюкозы (2 фтор 2 дезок
холи с нормальным уровнем рН инвазия не на
си D глюкозы) продемонстрировано, что инва
блюдается [1]. Введение животным с опухолью
зия происходит из зон опухоли с повышенным
слабо щелочного буфера (карбонатного или
потреблением глюкозы [5, 6], что характеризует
Tris HCl) уменьшает метастазирование и рост
гликолиз.
Процесс развития опухоли может быть выз
ван различными воздействиями: химическими
Принятые сокращения: МКТ - монокарбоксилат
транспортер, АФК - активные формы кислорода, NOX -
веществами, отличающимися по структуре и
комплекс НАДФН оксидазы.
механизму действия, облучением, биологиче
1371
1372
КОБЛЯКОВ
скими факторами (бактериальной и вирусной
При нормоксии в результате многочисленных
инфекцией), а также случайными спонтанными
ферментативных воздействий конечным про
мутациями (эффект «несчастного случая»). По
дуктом превращения глюкозы в цитоплазме яв
современным представлениям, независимо от
ляется пируват, который транспортируется в
канцерогенного воздействия, в клетках проис
митохондрии, и под действием фермента пиру
ходит нарушение структуры протоонкогенов
ватдегидрогеназы образует ацетилкоэнзим А,
и/или дезактивация генов супрессоров. Образу
компонент трикарбонового цикла (рис. 1). При
ющиеся нерегулируемые онкобелки вызывают
гипоксии конечным продуктом превращения
появление общих свойств у опухолевых клеток,
глюкозы является лактат, образующийся из пи
характеризующих злокачественность: инвазию
рувата. Важный фактор перехода клеток на гли
и метастазирование.
колиз - синтез фермента киназа пируватдегид
При этом в зависимости от канцерогенного
рогеназы, который фосфорилирует пируватде
воздействия активируются различные онкоге
гидрогеназу и делает ее неактивной. Синтезиру
ны, функционирующие в различных сигналь
ется также фермент лактатдегидрогеназа А, ко
ных цепях. Для реализации опухолевого процес
торый превращает пируват в лактат. Лактат, яв
са необходима экспрессия многих генов, коди
ляющийся кислотой, вместе с протоном транс
рующих белки, которые в нормальных клетках
портируется из клетки трансмембранным моно
взрослого организма, как правило, не активиро
карбоксилат транспортером (МКТ), что и вызы
ваны: теломераза, антиапоптические семейства
вает подкисление межклеточного пространства.
Bcl 2, белки гликолиза, антидифференцировоч
Активация перечисленных ферментов при ги
ные и др. Однако, многие протоонкогены не яв
поксии происходит благодаря функционирова
ляются транскрипционными факторами. Так,
нию транскрипционного фактора семейства
продукты генов семейства SRC являются тиро
HIFα (более подробно о регуляции HIFα см.
зинкиназами, продукты генов mTOR, RAF - се
ниже).
рин треониновыми киназами, а RAS - малыми
ГТФ азами. Можно сделать вывод, что онкобел
ки не являются конечными эффекторами разви
АЭРОБНЫЙ ГЛИКОЛИЗ
тия опухоли, а передают сигнал на некий другой
элемент, транскрипционный фактор, который и
При злокачественном росте гликолиз на
является двигателем опухолевого процесса.
блюдается также в зонах опухоли с достаточной
Существует ли для каждого типа онкобелка
оксигенацией. Впервые способность опухоле
«свой» канцерогенный «двигатель» или имеется
вых клеток переключаться с тканевого дыхания
общий универсальный элемент опухолевого
на гликолиз при достаточном количестве кисло
развития? В данном обзоре будут приведены
рода в клетке был описан Отто Варбургом в
данные, согласно которым анализируемые он
прошлом веке [7], и поэтому аэробный гликолиз
кобелки реализуют свой онкогенный потенциал
называют эффектом Варбурга.
по общему механизму.
Опухолевые клетки пластичны в регуляции
Поскольку основным элементом начального
биохимических процессов, протекающих в них,
этапа развития опухоли является подкисление
и примером такой пластичности является спо
межклеточного пространства, вызванного гли
собность к аэробному гликолизу. Необходимо
колизом, следует предположить, что независимо
заметить, что гликолиз является не только про
от канцерогенного воздействия происходит ак
цессом, обеспечивающим митохондрии компо
тивация гликолиза. Цель данного обзора - это
нентом для трикарбонового цикла и образова
анализ имеющихся данных по действию различ
ния АТФ, но в процессе превращения глюкозы
ных, наиболее часто встречающихся в челове
образуются «строительные материалы» необхо
ческой патологии, продуктов мутированных он
димые при клеточном делении, особенно при
когенов (RAS, SRC, mTOR, MYC) для получения
неконтролируемом опухолевом росте. Так, глю
ответа на вопрос: действительно ли они активи
козо 6 фосфат может превращаться не только в
руют аэробный гликолиз, и какое это имеет зна
фруктозо 6 фосфат и далее в пируват, но и под
чение в канцерогенезе?
действием глюкозо 6 фосфатдегидрогеназы
направляться в пентозный цикл с образованием
рибозы, необходимой для синтеза нуклеотидов
«КЛАССИЧЕСКИЙ» ПУТЬ
(рис. 1). При ферментативных реакциях в пен
АКТИВАЦИИ ГЛИКОЛИЗА
тозном цикле происходит восстановление
НАДФ до НАДФН, что важно для протекания
Гликолиз - естественный процесс, который
различных окислительно восстановительных
реализуется в нормальной ткани при гипоксии.
процессов в опухоли. Ввиду того, что процесс
БИОХИМИЯ том 84 вып. 10 2019
ЭФФЕКТ ВАРБУРГА - РЕГУЛЯЦИЯ ОНКОБЕЛКАМИ
1373
гликолиза происходит в цитоплазме, АТФ, об
fibroblast, CAF) переход на аэробный гликолиз
разующаяся при гликолизе, более доступна для
[8] по неизвестному в настоящий момент меха
клеточных функций, чем АТФ, образующаяся в
низму. В результате образующийся в них лактат,
митохондриях, и при этом не наблюдается син
накапливающийся в межклеточном простран
тез токсических активных форм кислорода
стве, транспортируется в клетки опухоли через
(АФК), как в митохондриях. Меньшая эффек
МКТ. Под действием лактатдегидрогеназы В
тивность образования АТФ при гликолизе, по
лактат превращается в пируват и является доба
сравнению с ее образованием в митохондриях,
вочным источником энергии для опухоли. Важ
компенсируется большим поступлением в клет
ным элементом регуляции функций клетки, как
ку глюкозы, благодаря увеличенному синтезу
при аэробном, так и анаэробном гликолизе, яв
транспортера глюкозы и других ферментов
ляется экспрессия генов множественной лекар
превращения глюкозы. Недавно введен в оби
ственной устойчивости [9], что позволяет опу
ход термин
«обратный эффект Варбурга»
холевым клеткам выживать в условиях химиоте
(reverse Warburg effect). Это словосочетание оз
рапии. Надо иметь также в виду, что в процессе
начает, что в процессе роста опухоли ее эпите
гликолиза и активации HIFα, помимо подкис
лиальные клетки стимулируют в окружающих
ления межклеточного пространства, происходят
опухоль фибробластах (Carcinoma associated
события необходимые для опухолевого роста.
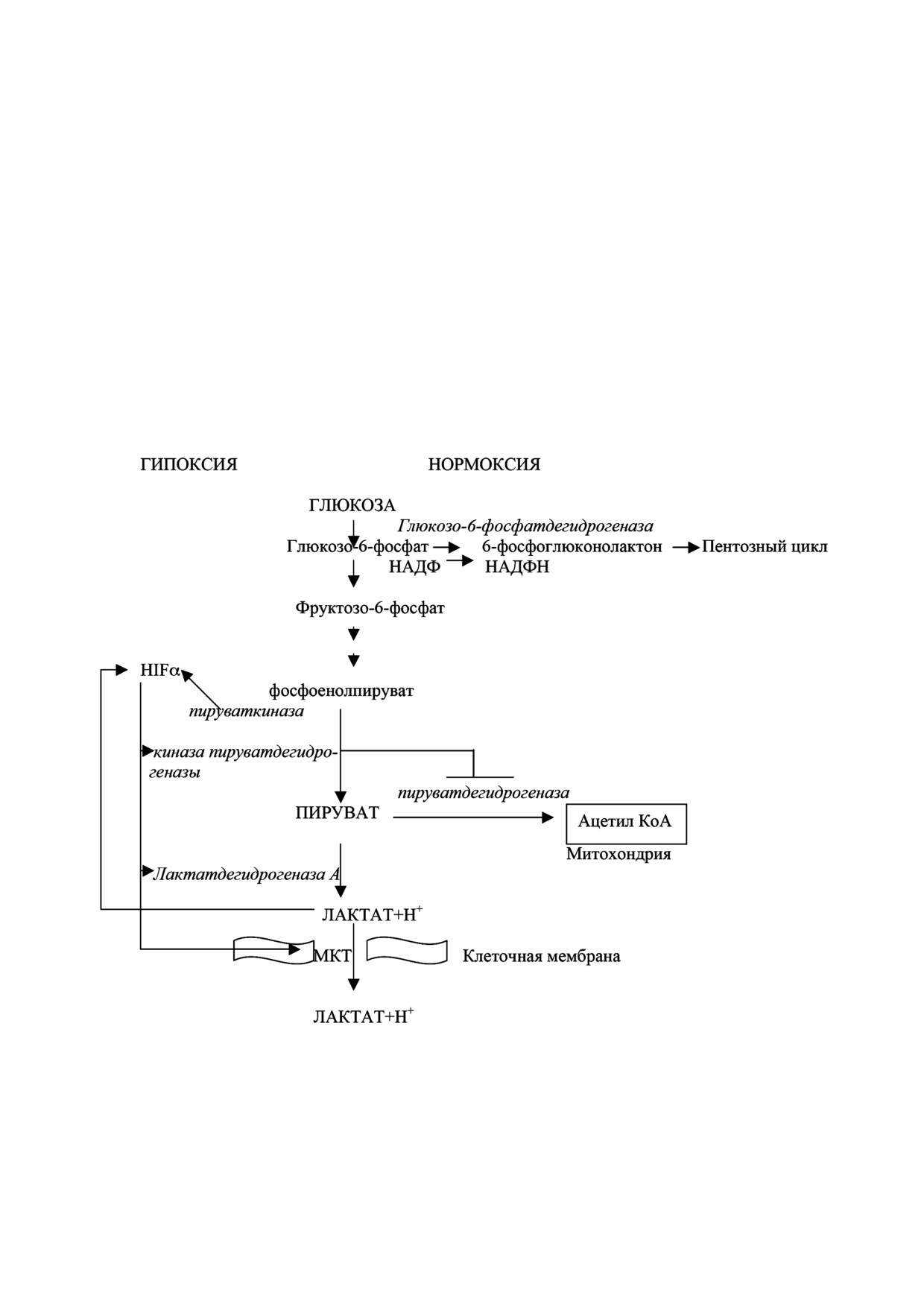
Рис. 1. Регуляция гликолиза при гипоксии и нормоксии. При нормоксии глюкоза в результате ряда ферментативных ре
акций образует пируват, который под действием пируватдегидрогеназного комплекса транспортируется в митохондрии,
где превращается в ацетилкоэнзим А. При гипоксии накапливается транскрипционный фактор HIFα, который в ком
плексе с белком ARNT вызывает синтез ингибитора пируватдегидрогеназы - киназы пируватдегидрогеназы. Стимулиру
ется синтез фермента лактатдегидрогеназа А, превращающего пируват в лактат и монокарбоксилат транспортера (МКТ),
транспортирующий (лактат + Н+) в межклеточное пространство. По механизму обратной связи пируваткиназа и лактат
усиливают действие HIFα. Ферменты показаны курсивом. (Более подробно в тексте)
БИОХИМИЯ том 84 вып. 10 2019
1374
КОБЛЯКОВ
Считается, что в антиапоптической защите опу
фермента киназы пируватдегидрогеназы, лак
холевых клеток принимает участие гексокина
татдегидрогеназы А и монокарбоксилат транс
за II, которая синтезируется в опухолевых клет
портера [21] (рис. 1). Помимо этого, комплекс
ках. Помимо участия в превращении глюкозы,
HIFα-ARNT участвует в более тонких настрой
гексокиназа II взаимодействует с белком VDAC,
ках в регуляции энергообеспечения клетки: сти
расположенным во внешней мембране митохон
мулирует экспрессию цитохромоксидазы изо
дрий, что приводит к ингибированию выхода
формы 4 2, которая более эффективно связыва
цитохрома С через VDAC каналы и ингибиро
ется с кислородом, чем изоформа 4 1, которая
ванию апоптоза [10]. При гипоксии, при учас
экспрессируется при нормоксии. Одновремен
тии HIFα, активируются гены дедифференци
но комплекс HIFα-ARNT стимулирует экс
ровки, и клетки опухоли поддерживаются в
прессию белка LON, который является протеа
«стволовом» состоянии [11, 12].
зой и специфически разрушает изоформу ци
Таким образом, аэробный гликолиз в опухо
тохромоксидазы 4 1 [22].
левых клетках важен для реализации опухолево
Регуляция HIFα происходит на уровне бел
го потенциала и характеризуется, как «визитная
ка. Уровень мРНК HIFα относительно постоя
карточка» злокачественного процесса.
нен. При нормоксии HIFα окисляется фермен
том пролилоксидазой по пролинам в положени
ях 402 и 405 (HIFα(OH2)) [23, 24]. Окисленный
ФУНКЦИИ И РЕГУЛЯЦИЯ HIFα
HIFα взаимодействует с убиквитинлигазным
комплексом VHL, убиквитинируется и направ
Одним из основных регуляторов перехода
ляется в протеасомы, где разрушается. Извест
клеток на гликолиз как при гипоксии, так и при
ны 3 изоформы пролилоксидазы. Наиболее эф
оксигенации, стимулирующих экспрессию ге
фективной в отношении HIFα является изо
нов гликолиза и блокирующих поступление пи
форма пролилоксидаза 2 [24]. Окисление HIFα
рувата, продукта превращения глюкозы, участ
сопровождается одновременным соокислением
вующего в трикарбоновом цикле в митохон
2 оксоглютарата до сукцината. Образующийся
дрии, является транскрипционный комплекс
сукцинат является ингибитором пролилоксида
HIFα-ARNT. Регуляторным звеном этого
зы [25]. «Классический» путь активации HIFα
комплекса являются белки семейства HIFα,
обусловлен образованием активных форм кис
поскольку уровень белка ARNT в клетке посто
лорода в дыхательной цепи митохондрий. При
янен. Известны 3 изоформы белка HIFα -
гипоксии АФК в форме супероксида синтезиру
HIF1α, HIF2α и HIF3α, все они активируются
ются в комплексах 1 и 3 дыхательной цепи мито
при гипоксии. Функционально HIF1α и HIF2α
хондрий. Благодаря структурным особенностям
близки между собой, а роль HIF3α в функцио
комплекса 1 образовавшиеся АФК направляют
нировании клетки в настоящий момент недо
ся в митохондриальный матрикс, а образовав
статочно изучена. Белки HIFα принадлежат к
шиеся в комплексе 3 - к митохондриальной
классу транскрипционных факторов, называе
мембране [26]. Под действием митохондриаль
мых «спираль петля спираль» (helix loop helix).
ной супероксиддисмутазы супероксид превра
Помимо переключения функционирования
щается в перекись водорода, которая свободно
клеток с тканевого дыхания на гликолиз и уси
проходит через митохондриальную мембрану в
ления синтеза всех ферментов гликолиза, в том
цитоплазму. В цитоплазме перекись водорода
числе транспортера глюкозы [13], комплекс
окисляет SH группы пролилоксидазы с образо
HIFα-ARNT вызывает экспрессию и других ге
ванием S-S связей и димеризацией фермента
нов, кодирующих белки, участвующие в разви
[27], что дезактивирует пролилоксидазу и ведет
тии опухолевого процесса: теломеразу, стимули
к накоплению HIFα [28]. Подтверждением ска
рующую иммортализацию [14]; VEGF, стимули
занного является то, что в клетках с отсутствием
рующий рост сосудов [15]; Bcl2, ингибирующий
митохондриальной ДНК, которая кодирует ком
апоптоз [16]. Происходит остановка дифферен
поненты дыхательной цепи, при гипоксии не
цировки и активация генов дедифференциров
происходит активация HIFα.[29]. В клетках с
ки [17, 18], синтез металлопротеаз матрикса
нокаутированным геном компонента дыхатель
[19], активация генов множественной лекар
ной цепи цитохрома С, в которых не образуется
ственной устойчивости [9], синтез лизилоксида
АФК, также не наблюдалась активация HIFα в
зы [20], фермента, участвующего в образовании
условиях гипоксии [30]. Предотвратить накопле
метастатических ниш. Происходит синтез раз
ние HIFα при гипоксии может только антиокси
личных протонных помп [21], транспортирую
дант, проникающий в митохондрии, Mito Q, а не
щих протоны в межклеточное пространство.
«классические» антиоксиданты типа ацетилцис
Комплекс HIFα-ARNT вызывает экспрессию
теина [31], функционирующие в цитоплазме.
БИОХИМИЯ том 84 вып. 10 2019
ЭФФЕКТ ВАРБУРГА - РЕГУЛЯЦИЯ ОНКОБЕЛКАМИ
1375
О том, что повышенная постоянная экспрес
кинов. Более ранние исследования связывали
сия HIFα является канцерогенным фактором,
опасность развития опухоли при хроническом
свидетельствуют эпидемиологические данные.
воспалении преимущественно с мутагенным
Известны случаи наследственных раков в семь
действием АФК [42, 43]. В настоящий момент
ях с инактивирующей мутацией в гене убикви
взгляд на механизм канцерогенного действия
тинлигазы VHL, ответственного за деградацию
хронического воспаления изменился, и образу
белка HIFα [32, 33], а также в семьях с инакти
ющиеся АФК рассматриваются не только как
вирующей мутацией гена SDH, приводящей к
потенциальные мутагены, но и как факторы,
постоянному высокому уровню сукцината в
способные стимулировать аэробный гликолиз.
клетке, блокированию активности пролилоксида
При воспалении основным производителем
зы сукцинатом и повышенному уровню HIFα [34].
АФК является лейкоцитарный мембран ассо
Переход клеток на гликолиз увеличивает ак
циированный ферментный комплекс семейства
тивность HIFα благодаря положительной об
НАДФН оксидазы (NOX). В настоящее время
ратной связи. Так, фермент пируваткиназа,
известно 7 изоформ NOX (NOX1-5, DUOX1,
экспрессия которого, как и всех генов гликоли
DUOX2) в мембранах различных как иммунных,
за, регулируется HIFα, катализирует протекание
так и не иммунных клеток. Одним из механиз
реакции образования пирувата из фосфоенол
мов активации NOX является, вызванное цито
пирувата и одновременно увеличивает связыва
кинами, образование комплекса с малыми
ние HIFα с узнающим участком ДНК, усиливая
ГТФазными белками семейства RAC [44]. В не
способность экспрессировать соответствующие
активном состоянии компоненты «разобраны»,
гены [35] (рис. 1). Лактат, являющийся конеч
а при необходимости происходит их сборка в
ным продуктом превращения глюкозы при гли
единый функциональный комплекс. NOX син
колизе, стабилизирует HIFα и увеличивает его
тезирует АФК в форме супероксида. Образова
активность [36].
ние супероксида происходит в результате пере
Уровень HIFα в нормальных клетках регули
носа электрона с НАДФН на флавин NOX, на
руется и вне стрессовых ситуаций, к которым
ходящийся в комплексе с цитохромом B, кото
можно отнести гипоксию.
рый осуществляет одноэлектронный перенос на
Количество HIFα на разных стадиях клеточ
кислород с образованием АФК [45]. Образовав
ного цикла неодинаково. На стадиях G2 и мито
шийся супероксид превращается в перекись во
за происходит стабилизация HIFα, благодаря
дорода или под воздействием супероксиддисму
фосфорилированию HIFα циклин зависимой
тазы, или спонтанно. АФК направляются как в
киназой 1 (cdk1) по Ser688, что наблюдается в
межклеточное, так и внутриклеточное простран
нормальных клетках в отсутствии гипоксии [37].
ство. В цитоплазме АФК взаимодействуют с
В работе лаборатории д ра Semenza подтвержда
сульфгидрильными группами пролилоксидазы,
ется, что на стадии G2/митоз происходит стаби
ингибируя ее функционирование. В результате в
лизация белка HIFα, а на стадии G1 происходит
клетке происходит накопление HIFα, что вызы
деградация HIFα [38]. Известно, что в печеноч
вает переход клеток на гликолиз, независимо от
ной дольке снабжение клеток кислородом пада
уровня кислорода в клетке. Показано, что при
ет от перипортальной зоны к перивенозной зо
воспалении происходит накопление HIFα [46].
не. Показано, что чем дальше клетки располо
В пользу того, что активация HIFα происходит
жены от перипортальной зоны, тем выше в них
в результате функционирования NOX говорит
экспрессия HIFα, ферментов гликолиза и дру
то, что ингибитор различных изоформ NOX
гих белков, регулируемых HIFα [39]. Также из
(дифенилениодония хлорид (diphenyleneiodo
вестно, что активированные Т лимфоциты при
nium chloride)) или воздействие siРНК препят
нормоксии переходят на гликолиз через актива
ствует активации HIFα [47]. Ксенографт опу
цию HIFα [40, 41].
холевых клеток кишечника HT 29, нокаутиро
ванных по NOX1, демонстрирует замедленный
рост сосудов, что, как считают авторы, связано
РЕГУЛЯЦИЯ АЭРОБНОГО
с падением уровня HIFα [48]. Постоянная
ГЛИКОЛИЗА И HIFα ПРИ РАЗЛИЧНЫХ
экспрессия NOX5 в клетках различных опухо
КАНЦЕРОГЕННЫХ ВОЗДЕЙСТВИЯХ
лей человека вызывает увеличение уровня
HIFα в оксигенированных клетках. Нокаут
Воспаление. Общеизвестно, что хроническое
NOX5 в этих клетках приводит к падению в них
воспаление является фактором, способствую
уровня HIFα и уменьшению злокачественно
щим развитию опухолевого процесса [42]. При
сти [49]. Таким образом образующиеся при
воспалении происходит образование АФК и ак
воспалении АФК увеличивают в клетках уро
тивация различных провоспалительных цито
вень HIFα. Высокий уровень экспрессии раз
БИОХИМИЯ том 84 вып. 10 2019
1376
КОБЛЯКОВ
личных изоформ NOX обнаружен во многих
нии механизма канцерогенного действия мути
опухолях человека [45, 50].
рованного RAS с мутацией в 12 м кодоне было
Другой механизм увеличения уровня HIFα
показано, что его трансформирующее действие
и, соответственно, гликолиза при воспалении
связано с образованием активных форм кисло
связан с активацией транскрипционного факто
рода [59, 60] и аккумуляцией HIFα [27]. По
ра NF κB. Он представляет собой димер, свя
скольку HIFα является основным регулятором
занный с ингибирующим участком, называе
перехода клеток на гликолиз, то его аккумуля
мым ингибиторным белком (inhibitory protein, I
ция в условиях оксигенации свидетельствует о
κβ) [51, 52]. При воспалении различные участ
переключении функционирования клеток на
ники воспалительного процесса активируют ки
аэробный гликолиз. Подтверждением того, что
назы семейства IKK, которые фосфорилируют
аккумуляция HIFα происходит в результате об
участок I κβ, что приводит к его деградации, а
разования АФК, являются эксперименты с вве
освободившаяся часть белкового комплекса
дением антиоксиданта N ацетилцистеина, ко
транспортируется в ядро, где функционирует
торый препятствует трансформирующему
как транскрипционный фактор, вызывая
действию мутированного RAS и накоплению
экспрессию различных генов, в том числе HIFα
HIFα. Образование АФК происходит в резуль
[53] (рис. 2, 1).
тате активации NOX белком RAS, поскольку ин
гибитор NOX дифенилениодония хлорид препя
Определить роль каждого из перечисленных
тствовал образованию АФК [60, 61]. Активация
факторов в канцерогенезе при воспалении в
NOX при действии мутированного белка RAS
настоящее время не представляется возмож
определяется двумя факторами. Во первых, он
ным. По видимому, это зависит от органа и ти
кобелок RAS активирует ГТФ азу RAС (рис. 2,
па клеток.
2). [62-64], которая, как говорилось выше, яв
Онкогенные белки семейства RAS. Наиболее
ляется активатором NOX. Делеция гена RAC у
часто встречающимися мутациями в онкогенах
мышей предотвращала развитие опухоли кожи,
опухолей человека являются мутации в генах се
поджелудочной железы и легких при введении
мейства RAS. Известны три основных предста
животным мутантного гена RAS [59]. У мышей с
вителя семейства генов RAS: N$RAS, K$RAS,
инактивирующей мутацией в гене Tiam1, про
H$RAS. Продукты этих генов неравномерно
дукт которого является активатором RAC, пре
распределены по клеткам органов. Наиболее
дотвращается развитие опухолей кожи, вызван
распространенным является К RAS. Показано,
ных геном RAS [65]. Помимо активации RAC,
что в большинстве опухолей легких, желудка,
при действии онкогенного RAS одновременно
кишечника и поджелудочной железы наблюда
наблюдают экспрессию NOX через активацию
ются мутации в этом семействе генов [54]. Бел
транскрипционного фактора GATA 6 (рис. 2, 2)
ки семейства RAS принадлежат к большой груп
[66, 67]. Активация происходит в результате
пе белков, носящих общее название «малые
фосфорилирования GATA 6 серин треонино
ГТФ азы». При активации белки этого семей
вой киназой ERK, активируемой постоянным
ства взаимодействуют с ГТФ, образуя функцио
функционированием Н RAS в регуляторной це
нально активный комплекс, взаимодействую
пи RAS-RAF-MEK-ERK [66]. Подтверждени
щий с белками мишенями, активируя их. Для
ем роли GATA 6 в активации NOX1 является то,
прекращения их активности и прерывания сиг
что инактивирующая мутация в гене GATA$6
нала необходимо взаимодействие с соответству
препятствовала накоплению NOX1 при
ющими ГТФ азами, которые дефосфорилируют
действии мутированного Н$RAS [66]. Для онко
ГТФ, превращая его в ГДФ. Комплекс RAS-
белка K RAS показано, что помимо активации
ГДФ неактивен и для последующей активации
белка RAС, он способен активировать образова
RAS необходимо вытеснение ГДФ специальным
ние АФК не только через активацию NOX, но и
регуляторным белком (GDF exchange factor),
благодаря способности взаимодействовать с
что делает возможным взаимодействие RAS с
мембраной митохондрий, изменяя функциони
ГТФ и его активацию. Распространенными он
рование дыхательной цепи митохондрий. Пока
комутациями в генах белков RAS являются му
зано также, что K RAS взаимодействует с мито
тации в 12 м, 13 м и 61 м кодонах, не позволя
хондриальной мембраной, что вызывает паде
ющей ГТФ азе взаимодействовать с комплек
ние на ~50% митохондриального потенциала,
сом RAS-ГТФ, что приводит к постоянной ак
уменьшение потребления кислорода, ингибиро
тивности комплекса [55, 56]. Показано, что по
вание комплекса 1 дыхательной цепи, но при
стоянно активный белок RAS вызывает
этом происходит значительное увеличение об
экспрессию ферментов гликолиза, блокируя ак
разования АФК, видимо, в комплексе 3 дыха
тивность митохондрий [57, 58]. При исследова
тельной цепи (рис. 2, 2) [68-70]. RAS вызывает
БИОХИМИЯ том 84 вып. 10 2019
ЭФФЕКТ ВАРБУРГА - РЕГУЛЯЦИЯ ОНКОБЕЛКАМИ
1377
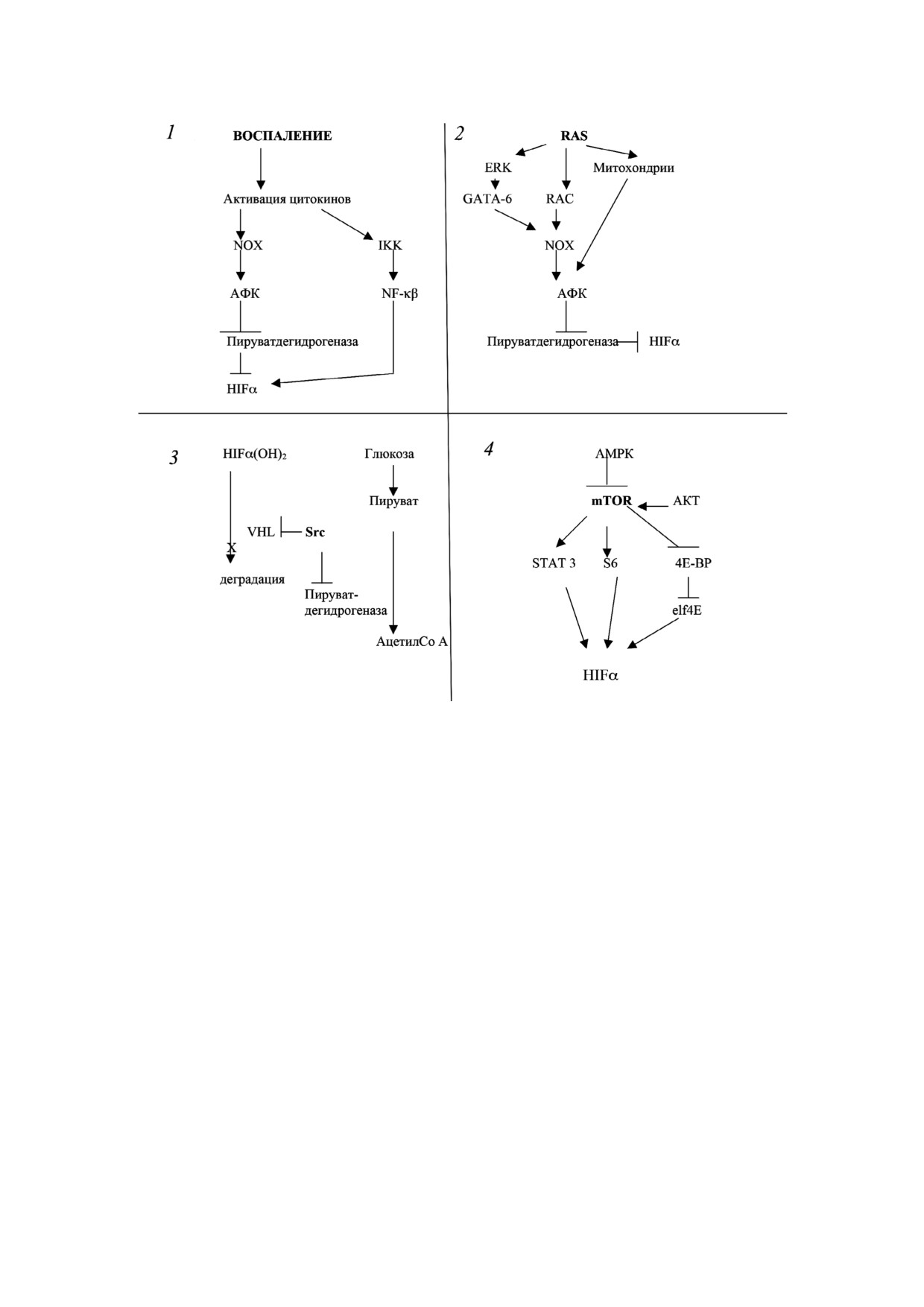
Рис. 2. Схемы активации HIFα и эффекта Варбурга при действии ряда онкобелков. 1 - При воспалении происходит ак
тивация НАДФ Н оксидазы (NOX) с образованием АФК, которые блокируют активности пролилоксидазы, что приводит
к увеличению уровня HIFα. Цитокины также активируют транскрипционный фактор NF κB, (через активацию киназы
IKK), который вызывает экспрессию HIFα. 2 - Мутированный белок RAS активирует белок RAC, который стимулирует
белок NOX с образованием АФК. Постоянно функционирующий RAS через ERK активирует транскрипционный фактор
GATA 6, который увеличивает синтез NOX. Мутированный К RAS взаимодействует с митохондриями, что приводит к
образованию АФК. 3 - Активированный белок SRC фосфорилирует убиквитинлигазу VHL, что предотвращает разруше
ние окисленного по пролинам HIFα (HIFα(ОН2)), а также фосфорилирует пируватдегидрогеназу, делая ее не активной.
4 - Белок mTOR активирует факторы трансляции S6 и elf4E, что увеличивает образование белков, в том числе HIFα.
mTOR фосфорилирует транскрипционный фактор STAT3, что увеличивает его активность. Одним из факторов тран
скрипции является ген HIFα
также падение уровня антиоксидантных фер
митохондрий ротеноном уменьшается субстрат
ментов: каталазы и супероксиддисмутазы 2 [69],
независимый рост опухолевых клеток в культуре
что способствует накоплению АФК в клетке.
и перевитой подкожно опухоли кишечника мы
Вызванная K RAS деполяризация митохондри
ши CT26 с мутированным геном K$Ras [69].
альной мембраны в некоторых случаях может
Онкогенные белки семейства SRC. Повышен
привести к выходу цитохрома С из митохондрий
ная активность семейства нерецепторных тиро
и к апоптозу [71]. Нарушение функций митохон
зинкиназ SRC наблюдается во многих опухолях
дрий различными воздействиями предотвраща
человека, таких как опухоли молочной железы,
ет канцерогенез, вызванный мутированным
кишечника, предстательной железы [72], гема
К$RAS. Ингибирование функционирования ге
тологические новообразования [73]. Тот факт,
на транскрипции в митохондриях препятствует
что белок SRC способен активировать аэробный
К$RAS вызванному канцерогенезу [68]. При ин
гликолиз, был впервые продемонстрирован еще
гибировании комплекса 1 дыхательной цепи
в 1978 г. Было показано, что введение в клетки
БИОХИМИЯ том 84 вып. 10 2019
1378
КОБЛЯКОВ
цыпленка термозависимого гена v$SRC перево
пятствует развитию рака у стареющих живот
дило клетки на гликолиз при пермиссивной
ных, [83], что свидетельствует о возможных об
температуре (температура, при которой ген v$SRC
щих механизмах в процессах старения и канце
функционировал), а при температуре, при кото
рогенеза. Одной из известных функций mTOR
рой происходило выключение функционирова
является стимуляция трансляции, благодаря
ния гена v$SRC, клетки переходили на тканевое
фосфорилированию белка 4E BP, что приводит
дыхание [74]. Наиболее вероятным казалась
к активации трансляционного белка elf4E и
возможность прямого фосфорилирования про
фосфорилированию белка S6K, также участвую
лилоксидазы белком SRC с инактивацией ее ак
щего в трансляционном процессе. В результате
тивности. Однако специально проведенное ис
усиления трансляции и синтеза белков увеличи
следование показало, что белок SRC не фосфо
вается количество производимого белка HIFα
рилирует пролилоксидазу [75]. Активирован
(рис. 2, 4). [84]. Кроме того, mTOR фосфорили
ный SRC, видимо, может увеличивать уровень
рует по серину транскрипционный фактор
HIFα по нескольким различным механизмам.
STAT3, активируя его [85, 86]. Среди генов,
Одним из механизмов действия белка SRC, свя
транскрипцию которых стимулирует STAT3,
занным с переводом клетки на аэробный глико
присутствует HIFα [86, 87] (рис. 2, 4). Одним из
лиз, является то, что он фосфорилирует по по
механизмов активации mTOR является соотно
ложению Tyr289 пируватдегидрогеназу, делая ее
шение АМФ/АТФ в клетке. При недостатке
неактивной. В результате в цитоплазме накап
энергетического потенциала и высоком уровне
ливается пируват, отключается митохондриаль
соотношения АМФ/АТФ активируется АМФ
ное дыхание, падает потребление кислорода, и
активируемая протеинкиназа, которая ингиби
клетка вынуждена переключиться на гликолиз
рует активность mTOR [88, 89]. Ингибирование
независимо от уровня кислорода [76] (рис. 2, 3).
этой протеинкиназы, приводящее к активации
Другой путь переключения клеток на гликолиз
mTOR, переводит клетку в аэробный гликолиз,
связан с тем, что SRC фосфорилирует белок
увеличивает уровень HIFα в условиях оксигена
VHL по Tyr185, после чего он направляется в
ции и ускоряет рост опухоли [90]. Другой меха
протеасомы на деградацию [77]. Поскольку бе
низм активации mTOR связан с функциониро
лок VHL является убиквитинлигазой для белка
ванием цепи: мембранный тирозинкиназный
HIFα, последний накапливается в клетке
рецептор - фосфоинозитол 3 киназа - проте
(рис. 2, 3). По видимому, некоторые клеточные
инкиназа В (другое название АКТ) - mTOR [91].
факторы реализуют свою способность накапли
Уменьшение активности АКТ приводит к паде
вать в клетке HIFα, активируя SRC. Так, показа
нию злокачественных свойств, таких как инва
но, что активация аэробного гликолиза при
зивность, способность к миграции клеток
действии глюкокортикостероидов обусловлена
SKOV 3 в культуре, а увеличение активности - к
активацией ими белка с SRC, который и накап
усилению этих свойств [92]. Grabiner et al. счита
ливает в клетке HIFα [78] по механизму, как
ют, что изменение активности АКТ влияет на
считают авторы, связанному с разрушением
активность mTOR, через функционирование
белка VHL, благодаря фосфорилированию ти
которого реализуются опухолеродные свойства
розинкиназой SRC.
АКТ [82]. Эти результаты подтверждают стиму
mTOR. В настоящий момент одним из наи
лирующую роль mTOR в развитии опухоли.
более изучаемых компонентов регуляторных це
Онкогенные белки семейства MYC. Онкобел
пей является серин треониновая киназа mTOR.
ки семейства MYC (L Myc, N Myc, с Myc), как
Считается, что эта киназа играет важную роль
и белки семейства HIFα, принадлежат к классу
как в реализации опухолевого процесса при
«спираль петля спираль» (helix loop helix). MYC
действии некоторых онкогенных факторов, так
является регуляторным звеном транскрипцион
и в процессе старения. Ингибирование mTOR
ного комплекса MYC-МАХ, который принима
вызывает продление жизни у нематод и мышей
ет участие в различных клеточных функциях, та
[79, 80]. Показано, что в некоторых опухолях че
ких как пролиферация, апоптоз, ингибирование
ловека, таких как опухоли толстого кишечника,
начальных стадий дифференцировки, стимуля
почек и молочной железы выявляются мутации
ция дедифференцировки и биогенез митохон
mTOR, что возможно является причиной разви
дрий [93-95].
тия опухоли [81, 82]. mTOR участвует в различ
В нормально функционирующих клетках
ных регуляторных цепях и может являться про
время жизни активированного комплекса ко
межуточным звеном в развитии опухолевого
ротко. Регуляция MYC происходит как на уров
процесса, вызванного различными онкогенами.
не транскрипции, так и на белковом уровне.
Рапамицин, ингибитор mTOR, не только прод
Повышенная экспрессия MYC наблюдается во
левает жизнь подопытным животным, но и пре
многих опухолях человека: молочной железы,
БИОХИМИЯ том 84 вып. 10 2019
ЭФФЕКТ ВАРБУРГА - РЕГУЛЯЦИЯ ОНКОБЕЛКАМИ
1379
кишечника, опухолях лимфоидной ткани [96].
пролиферации, вызванной HIFα. Таким обра
Высокая экспрессия MYC в опухолях связана с
зом, активированный MYC напрямую не влияет
различными генетическими событиями: увели
на HIFα, но увеличивает активность белка
чением числа копий, хромосомными трансло
опосредованно, через активацию гликолиза.
кациями, увеличением стабильности мРНК и
белка [96]. Считается, что развитие опухолевого
Важнейший элемент злокачественного роста
процесса в различных типах опухолей человека
опухоли - это разрушение межклеточного мат
связано с мутациями гена MYC, влияющими на
рикса, вызывающее инвазию и нарушение
протекание различных клеточных функций, в
межклеточного взаимодействия, являющегося
которых принимают участие, как онкогены, так
начальной стадией метастазирования. Оба эти
и гены супрессоры, такие как PTEN, BRCA b, и
процесса стимулируются подкислением внекле
другие [97]. В опухолевых клетках с повышен
точной среды, приводящим к активации проте
ной активностью MYC показана меньшая спо
аз. Уменьшение рН в межклеточном простран
собность клеток к взаимодействию с субстра
стве обусловлено переходом клетки с тканевого
том, благодаря уменьшению эспрессии Е кадхе
дыхания на гликолиз. В отличие от нормоксии
рина и повышенной нестабильности генома,
конечным продуктом превращения глюкозы яв
что приводит к образованию новых опухолевых
ляется лактат, который транспортируется вместе
клонов [98]. Показано, что активированный
с протоном в межклеточное пространство, под
комплекс MYC-МАХ стимулирует экспрессию
кисляя его. При нормальном уровне кислорода
различных генов, кодирующие белки гликолиза
основной путь энергообеспечения связан с
(мембранные транспортеры глюкозы, гексоки
функционированием дыхательной цепи мито
назу II и др.) [99], а также лактатдегидрогеназу А
хондрий, в которой образующийся из глюкозы
[100]. В результате происходит увеличение по
пируват превращается в ацетилкоэнзим А и
требления глюкозы и образование лактата. Од
включается в трикарбоновый цикл. В опухоле
новременно MYC стимулирует биосинтез мито
вых клетках происходят физиологические пере
хондрии и, соответственно, увеличивается син
стройки в метаболизме. Переход на гликолиз
тез митохондриальной АТФ благодаря увеличе
обусловлен, с одной стороны, гипоксией в опре
нию активности дыхательной цепи митохон
деленной части опухоли, связанной с увеличе
дрий, а также увеличивается пролиферативная
нием количество опухолевых клеток, характери
активность клеток опухоли [95]. Активация лак
зующих опухолевый рост, а с другой стороны,
татдегидрогеназы А, при функционировании
эффектом Варбурга, стимуляция которого, как
MYC, вызывает в клетке накопление лактата,
обсуждалось в данном обзоре, характерна для
который является стабилизатором HIFα [35,
действия различных онкогенов.
101]. Фермент пируваткиназа, экспрессия кото
Основным фактором переключения на гли
рого увеличивается при гликолизе, катализиру
колиз (как анаэробный, так и аэробный) являет
ет протекание реакции образования пирувата из
ся экспрессия гена киназы пируватдегидрогена
фосфоенолпирувата и одновременно увеличи
зы, продукт которого фосфорилирует пируват
вает связывание HIFα с узнающим участком
дегидрогеназу, делая ее неактивной, что приво
ДНК, усиливая способность экспрессировать
дит к накоплению в клетке пирувата, превраще
соответствующие гены [35].
нию в лактат и выходу его вместе с протоном из
клетки. Этот процесс переключения на глико
MYC и HIFα, поскольку принадлежат к од
лиз в большинстве случаев, как при достаточ
ному классу белков, могут конкурировать друг с
ном количестве кислорода, так и при гипоксии,
другом за связывание с MAX. В нормальных
регулируется белком HIFα. При гипоксии на
клетках при гипоксии HIFα выигрывает конку
копление этого белка связано с образованием
ренцию у MYC и блокирует его транскрипцион
АФК в митохондриях, приводящим к ингибиро
ную активность [102-104]. В этой ситуации
ванию регулятора HIFα пролилоксидазы. При
HIFα ингибирует пролиферацию, стимулиро
постоянно «включенных» онкобелках протека
ванную MYC [105, 106], возможно, благодаря
ние гликолиза в клетках поддерживается неза
активации ингибитора пролиферации белка р21
висимо от уровня кислорода в них. Механизмы
[105]. Однако в опухолях с высокой экспрессией
включения гликолиза онкобелками разнообраз
MYC, благодаря высокой концентрации белка,
ны и зависят от функций конкретного онкобел
HIFα не может конкурировать с MYC за MAX и
ка. В некоторых случаях происходит накопле
происходит транскрипция генов, чувствитель
ние АФК в цитоплазме, что вызывает инактива
ных как к MYC, так и HIFα [107], что усиливает
цию пролилоксидазы, как и при гипоксии. Воз
анаэробный гликолиз и протекание опухолевого
можна инактивация других участников регуля
процесса, и предотвращается ингибирование
ции гликолиза, таких как убиквитинлигазы
БИОХИМИЯ том 84 вып. 10 2019
1380
КОБЛЯКОВ
VHL, пируватдегидрогеназы. Увеличение уров
ционировании которых участвуют другие про
ня основного регулятора гликолиза HIFα про
тоонкогены, способные активировать HIFα или
исходит также благодаря стимуляции трансля
процесс гликолиза, реализуют свой онкогенный
ции и транскрипции. Транскрипционый фактор
потенциал благодаря их активации. Так, в
MYC вызывает экспрессию различных генов
трансформированных солями мышьяка уроэпи
гликолиза, приводящую, помимо прочего, к
телиальных клетках человека наблюдается по
усилению активности HIFα.
вышенная экспрессия гена рецептора эпители
На поставленный во введении вопрос: «Су
ального фактора роста HER2, а также функцио
ществует ли для каждого типа онкобелка “свой”
нально дальше расположенного гена SRC. В клет
канцерогенный “двигатель” или имеется общий
ках, нокаутированных по HER2, трансформа
универсальный элемент опухолевого разви
ция не наблюдается. Ингибирование активнос
тия?», мы склонны ответить, что таким общим
ти SRC также предотвращает трансформацию.
«двигателем» можно считать, с некоторыми ого
Zhou et al. считают, что трансформирующее
ворками, HIFα.
действие солями мышьяка реализуется, благода
Гипоксия наблюдается уже при относитель
ря активации ими HER2, который, в свою оче
но небольших размерах опухоли. Этот факт вы
редь, вызывает постоянную активность SRC, а
зывает вопросы: является ли эффект Варбурга
тот, в свою очередь, - HIFα [108].
необходимым элементом опухолевого процесса
В то же время некоторые гены супрессоры
и важно ли для развития опухоли свойство он
реализуют свой антиканцерогенный эффект,
когенов стимулировать эффект Варбурга или
блокируя активность HIFα. Показано, что про
оно не имеет функционального значения в раз
грессия многих типов злокачественных опухо
витии опухоли?
лей (молочной железы, кишечника, желудка и
других) обратно коррелирует с экспрессией бел
Мы предполагаем, что эффект Варбурга не
ка BRD7, являющегося белком супрессором
обходим, помимо прочего, для реализации раз
[109, 110]. Его действие обусловлено тем, что это
вития опухоли на самых ранних этапах. Одиноч
вещество ингибирует аэробный гликолиз, уско
ная опухолевая клетка или небольшое их коли
ряя убиквитирование HIFα по неизвестному
чество не способно преодолеть регуляторное
пока механизму [109].
воздействие окружающих нормальных клеток.
О важности HIFα в развитии опухолевого
В этих условиях анаэробный гликолиз дает воз
процесса говорит и то, что повышенный уро
можность, разрушая межклеточное взаимодей
вень экспрессии HIFα в различных типах опу
ствие, минимизировать регуляторное действие
холей является плохим прогностическим факто
окружающих нормальных клеток на образовав
ром [43, 111, 112]. Поэтому создание ингибито
шийся опухолевый клон.
ров функционирования HIFα может иметь важ
Надо иметь также в виду, что в процессе гли
ное клиническое значение. Создаются препара
колиза и активации HIFα, помимо подкисления
ты, ингибирующие функционирование HIFα, и
межклеточного пространства, происходят собы
они позиционируются в качестве веществ, обла
тия, необходимые для опухолевого роста. Счи
дающих противоопухолевой активностью [113,
тается, что в антиапоптической защите опухоле
114]. Но в настоящий момент ингибиторы HIFα
вых клеток принимает участие гексокиназа II,
в клиническую практику не вошли.
которая синтезируется преимущественно в опу
холевых клетках. Помимо участия в превраще
нии глюкозы, гексокиназа II взаимодействует с
Финансирование. Работа выполнена и фи
белком VDAC, расположенном во внешней
нансировалась в рамках бюджетной темы № АА
мембране митохондрий, что приводит к ингиби
АА А19 119031390107 7 «Генотоксическое действие
рованию выхода цитохрома С через VDAC ка
химиотерапевтических препаратов на медперсо
налы и ингибированию апоптоза [105]. При ги
нал при лечении онкологических пациентов».
поксии и при участии HIFα активируются гены
Конфликт интересов. Автор заявляет об отсут
дедифференцировки, и клетки опухоли поддер
ствии конфликта интересов.
живаются в «стволовом» состоянии [106, 107].
Соблюдение этических норм. Настоящая
Некоторые активированные онкогены, ко
статья не содержит описания каких либо иссле
торые напрямую не влияют на HIFα или глико
дований с участием людей или использованием
лиз, но находятся в сигнальных цепях, в функ
животных в качестве объектов.
БИОХИМИЯ том 84 вып. 10 2019
ЭФФЕКТ ВАРБУРГА - РЕГУЛЯЦИЯ ОНКОБЕЛКАМИ
1381
СПИСОК ЛИТЕРАТУРЫ
1.
Estrella, V., Chen, T., Lloyd, M., Wojtkowiak, J., Cornnell,
14.
Lou, F., Chen, X., Jalink, M., Zhu, Q., Ge, N., Zhao, S.,
H.H., Ibrahim Hashim, A., Bailey, K., Balagurunathan,
Fang, X., Fan, Y., Bjorkholm, M., Liu, Z., and Xu, D.
Y., Rothberg, J.M., Sloane, B.F., Johnson, J., Gatenby,
(2007) The opposing effect of hypoxia inducible factor
RA., and Gillies, R.J. (2013) Acidity generated by the
2alpha on expression of telomerase reverse transcriptase,
tumor microenvironment drives local invasion, Cancer
Mol. Cancer Res., 5, 793-800.
Res., 73, 1524-1535, doi: 10.1158/0008 5472.CAN 12 2796.
15.
Khromova, N.V., Kopnin, P.B., Stepanova, E.V., Agapova,
2.
McCarty, M.F., and Whitaker, J. (2010) Manipulating
L.S., and Kopnin, B.P. (2009) p53 Hot spot mutants
tumor acidification as a cancer treatment strategy, Altern.
increase tumor vascularization via ROS mediated activa
Med. Rev., 15, 264-272.
tion of the HIF1/VEGF A pathway, Cancer Lett., 276,
3.
Martin, N.K., Robey, I.F., Gaffney, E.A., Gillies, R.J.,
143-151, doi: 10.1016/j.canlet.2008.10.049.
Gatenby, R.A., and Maini, P.K. (2012) Predicting the safe
16.
Peng, X.H., Karna, P., Cao, Z., Jiang, B.H., Zhou, M.,
ty and efficacy of buffer therapy to raise tumour pHe: an
and Yang, L., (2006) Cross talk between epidermal growth
integrative modelling study, Br. J. Cancer, 106, 1280-1287,
factor receptor and hypoxia inducible factor 1alpha signal
doi: 10.1038/bjc.2012.58.
pathways increases resistance to apoptosis by up regulating
4.
Harguindey, S., Arranz, J.L., Polo Orozco, J.D., Rauch,
survivin gene expression, J. Biol. Chem.,
281,
C., Fais, S., Cardone, R.A., and Reshkin, S.J. (2013).
25903-25914.
Cariporide and other new and powerful NHE1 inhibitors as
17.
Zhu, H., Wang, D., Liu, Y., Su, Z., Zhang, L., Chen, F.,
potentially selective anticancer drugs - an integral molec
Zhou, Y., Wu, Y., Yu, M., Zhang, Z., and Shao, G. (2013)
ular/biochemical/metabolic/clinical approach after one
Role of the hypoxia inducible factor 1 alpha induced
hundred years of cancer research, J. Transl. Med., 11, 282,
autophagy in the conversion of non stem pancreatic cancer
doi: 10.1186/1479 5876 11 282.
cells into CD133+ pancreatic cancer stem like cells,
5.
Schlaepfer, I.R., Glode, L.M., Hitz, C.A., Pac, C.T.,
Cancer Cell Int., 13, 119, doi: 10.1186/1475 2867 13 119.
Boyle, K.E., Maroni, P., Deep, G., Agarwal, R., Lucia,
18.
Helczynska, K., Kronblad, A., Jogi, A., Nilsson, E.,
S.M., Cramer, S.D., Serkova, N.J., and Eckel, R.H. (2015)
Beckman, S., and Landberg, G. (2003) Hypoxia promotes
Inhibition of lipid oxidation increases glucose metabolism
a dedifferentiated phenotype in ductal breast carcinoma in
and enhances 2 deoxy 2 [(18)F]fluoro D glucose uptake
situ, Cancer Res., 63, 1441-1444.
in prostate cancer mouse xenografts, Mol. Imaging Biol.,
19.
Shin, D.H., Dier, U., Melendez, J.A., and Hempel, N.
17, 529-538, doi: 10.1007/s11307 014 0814 4.
(2015) Regulation of MMP 1 expression in response to
6.
Guan, Z.W., Xu, B.X., Wang, R.M., Sun, L., and Tian,
hypoxia is dependent on the intracellular redox status of
J.H. (2013) Hyperaccumulation of (18)F FDG in order to
metastatic bladder cancer cells, Biochim. Biophys. Acta,
differentiate solid pseudopapillary tumors from adenocar
1852, 2593-2602.
cinomas and from neuroendocrine pancreatic tumors and
20.
Erler, J. T., and Giaccia, A. J. (2006) Lysyl oxidase mediates
review of the literature, Hell. J. Nucl. Med., 16, 97-102,
hypoxic control of metastasis, Cancer Res., 66, 10238-10241.
doi: 10.1967/s002449910084.
21.
Kobliakov, VA. (2017) Role of proton pumps in tumorige
7.
Warburg, O., Posener, K and Negelein, E. (1924) Uber den
nesis, Biochemistry (Moscow), 82, 401-412, doi: 10.1134/
stoffwechsel der karzinomzellen, Biochemische Zeitschrift,
S0006297917040010.
152, 309-344.
22.
Fukuda, R., Zhang, H., Kim, J.W., Shimoda, L., Dang,
8.
Pavlides, S., Whitaker Menezes, D., Castello Cros, R.,
C.V., and Semenza, G.L.
(2007) HIF 1 regulates
Flomenberg, N., Witkiewicz, A.K., Frank, P.G., Casimiro,
cytochrome oxidase subunits to optimize efficiency of res
M.C., Wang, C., Fortina, P., Addya, S., Pestell, R.G.,
piration in hypoxic cells, Cell, 129, 111-122.
Martinez Outschoorn, U.E., Sotgia, F., and Lisanti, M.P.
23.
Lee, K.A., Roth, R.A., and LaPres, J.J. (2007) Hypoxia,
(2009 The reverse Warburg effect: aerobic glycolysis in can
drug therapy and toxicity, Pharmacol. Ther., 113, 229-246,
cer associated fibroblasts and the tumor stroma, Cell Cycle,
doi: 10.1016/j.pharmthera.2006.08.001.
8 3984-4001.
24.
Berra, E., Benizri, E., Ginouves, A., Volmat, V., Roux, D.,
9.
Yingqian, L.V., Shan, Z., Jinzhu, H., Likang, Z., Zixin, Y.,
and Pouyssegur, J. (2003) HIF prolyl hydroxylase 2 is the
and Zhao, L. (2015) Hypoxia inducible factor 1α induces
key oxygen sensor setting low steady state levels of HIF
multidrug resistance protein in colon cancer, Onco Targets
1alpha in normoxia, EMBO J., 22, 4082-4090.
Ther., 8, 1941-1948, doi: 10.2147/OTT.S82835.
25.
Selak, M.A., Armour, S.M., MacKenzie, E.D., Boulahbel,
10.
Krasnov, G.S., Dmitriev, A.A., and Lakunina, V.A. (2013)
H., Watson, D.G., Mansfield, K.D., Pan, Y., Simon,
Targeting VDAC bound hexokinase II: a promising
M.C., Thompson, C.B., and Gottlieb, E. (2005) Succinate
approach for concomitant anti cancer therapy, Expert
links TCA cycle dysfunction to oncogenesis by inhibiting
Opin. Ther. Targets,
17,
1221-1230, doi:
10.1517/
HIF alpha prolyl hydroxylase, Cancer Cell, 7, 77-85.
14728222.2013.833607.
26.
Chandel, N.S., McClintock, D.S., Feliciano, C.E., Wood,
11.
Mazumdar, J., Dondeti, V., and Simon, M.C. (2009)
T.M., Melendez, J.A., Rodriguez, A.M., and Schumacker,
Hypoxia inducible factors in stem cells and cancer, J. Cell.
P.T. (2000) Reactive oxygen species generated at mito
Mol. Med.,
13,
4319-28, doi:
10.1111/j.1582
chondrial complex III stabilize hypoxia inducible factor
4934.2009.00963.x.
1alpha during hypoxia: a mechanism of O2 sensing, J. Biol.
12.
Axelson, H., Fredlund, E., Ovenberger, M., Landberg, G.,
Chem., 275, 25130-25138.
and Pahlman, S. (2005) Hypoxia induced dedifferentia
27.
Lee, G., Won, H.S., Lee, Y.M., Choi, J.W., Oh, T.I., Jang,
tion of tumor cells - a mechanism behind heterogeneity
J.H., Choi, D.K., Lim, B.O., Kim, Y.J., Park, J.W.,
and aggressiveness of solid tumors, Semin. Cell Dev. Biol.,
Puigserver, P., and Lim, J.H. (2016) Oxidative dimerization
16, 554-563.
of PHD2 is responsible for its inactivation and contributes
13.
Marin Hernandez, A., Gallardo Perez, J.C., Ralph, S.J.,
to metabolic reprogramming via HIF 1α activation, Sci.
Rodriguez Enriquez, S., and Moreno Sanchez, R. (2009)
Rep., 6, 18928, doi: 10.1038/srep18928.
HIF 1alpha modulates energy metabolism in cancer cells
28.
Cash, T.P., Pan, Y., and Simon, M.C. (2007) Reactive oxy
by inducing over expression of specific glycolytic isoforms,
gen species and cellular oxygen sensing, Free Radic. Biol.
Mini Rev. Med. Chem., 9, 1084-1101.
Med., 43, 1219-1225.
БИОХИМИЯ том 84 вып. 10 2019
1382
КОБЛЯКОВ
29.
Chandel, N.S., E.Maltepe, E., Goldwasser, E., Mathieu, C.E.,
47.
Block, K., Gorin, Y., Hoover, P., Williams, P., Chelmicki, T.,
Simon, M.C., and Schumacker, P.T. (1998) Mitochondrial
Clark, R.A., Yoneda, T., and Abboud, H.E.
(2007)
reactive oxygen species trigger hypoxiainduced transcrip
NAD(P)H oxidases regulate HIF 2alpha protein expres
tion, Proc. Natl. Acad. Sci. USA, 95, 11715-11720.
sion, J. Biol. Chem., 282, 8019-8026.
30.
Mansfield, K.D., Guzy, R.D., Pan, Y., Young, R.M., Cash,
48.
Juhasz, A., Markel, S., Gaur, S., Liu, H., Lu, J., Jiang, G.,
T.P., Schumacker, P.T., and Simon, M.C.
(2005).
Wu, X., Antony, S., Wu, Y., Melillo, G., Meitzler, J.L.,
Mitochondrial dysfunction resulting from loss of
Haines, D.C., Butcher, D., Roy, K., and Doroshow, J.H.
cytochrome c impairs cellular oxygen sensing and hypoxic
(2017) NADPH oxidase 1 supports proliferation of colon
HIF alpha activation, Cell Metab., 1, 393-399.
cancer cells by modulating reactive oxygen species depen
31.
Bell, E.L., Klimova, T.A., Eisenbart, J., Moraes, C.T.,
dent signal transduction, J. Biol. Chem., 292, 7866-7887.
Murphy, M.P., Budinger, G.R., and Chandel, N.S. (2007)
49.
Antony, S., Jiang, G., Wu, Y., Meitzler, J.L., Makhlouf,
The Qo site of the mitochondrial complex III is required
H.R., Haines, D.C., Butcher, D., Hoon, D.S., Ji, J.,
for the transduction of hypoxic signaling via reactive oxy
Zhang, Y., Juhasz, A., Lu, J., Liu, H., Dahan, I., Konate,
gen species production, J. Cell Biol., 177, 1029-1036.
M., Roy, K.K., and Doroshow, J.H. (2017) NADPH oxi
32.
Henegan, J.C. Jr., and Gomez, C.R. (2016) Heritable can
dase 5 (NOX5) induced reactive oxygen signaling modu
cer syndromes related to the hypoxia pathway, Front.
lates normoxic HIF 1α and p27Kip1 expression in malig
Oncol., 6, 68, doi: 10.3389/fonc.2016.00068.
nant melanoma and other human tumors, Mol. Carcinog.,
33.
Yang, H., and Kaelin, W.G. Jr. (2001) Molecular patho
56, 2643-2662.
genesis of the von Hippel Lindau hereditary cancer syn
50.
Skonieczna, M., Hejmo, T., Poterala Hejmo, A., Cieslar
drome: implications for oxygen sensing, Cell Growth Differ.,
Pobuda, A., and Buldak, R.J. (2017) NADPH oxidases:
12, 447-455.
insights into selected functions and mechanisms of action
34
Zhao, T., Mu, X., and You, Q. (2017) Succinate: an initia
in cancer and stem cells, Oxid. Med. Cell. Longev., 2017,
tor in tumorigenesis and progression, Oncotarget, 8,
9420539, doi: 10.1155/2017/9420539.
53819-53828, doi: 10.18632/oncotarget.17734.
51.
Baeuerle, P.A., and Baltimore, D. (1996) NF kappa B: ten
35.
Luo, W., Hu, H., Chang, R., Zhong, J., Knabel, M.,
years after, Cell, 87, 13-20.
O’Meally, R., Cole, R.N., Pandey, A., and Semenza, G.L.
52.
D'Ignazio, L., Bandarra, D., and Rocha, S. (2016) NF κB
(2011) Pyruvate kinase M2 is a PHD3 stimulated coactiva
and HIF crosstalk in immune responses, FEBS J., 283,
tor for hypoxia inducible factor 1, Cell, 145, 732-744.
413-424, doi: 10.1111/febs.13578.
36.
De Saedeleer, C.J., Copetti, T., Porporato, P.E., Verrax, J.,
53.
Remels, A.H., Gosker, H.R., Verhees, K.J., Langen, R.C.,
Feron, O., and Sonveaux, P. (2012) Lactate activates HIF 1
and Schols, A.M. (2015) TNF α induced NF κB activation
in oxidative but not in Warburg phenotype human tumor
stimulates skeletal muscle glycolytic metabolism through
cells, PLoS One, 7, e46571, doi: 10.1371/journal.pone.
activation of HIF 1α, Endocrinology, 156, 1770-1781.
0046571.
54.
Pylayeva Gupta, Y., Grabocka, E., and Bar Sagi, D.
37.
Warfel, N.A., Dolloff, N.G., Dicker, D.T., Malysz, J., and
(2011) RAS oncogenes: weaving a tumorigenic web, Nat.
El Deiry,W.S. (2013) CDK1 stabilizes HIF 1α via direct
Rev. Cancer, 11, 761-774.
phosphorylation of Ser668 to promote tumor growth, Cell
55.
Scheffzek, K., Ahmadian, M.R., Kabsch, W. Wiesmuller, L.,
Cycle, 12, 3689-3701.
Lautwein, A., Schmitz, F., and Wittinghofer, A. (1997) The
38.
Hubbi, M.E., Gilkesa, D.M., Hu, H., Ahmede, I., and
Ras RasGAP complex: structural basis for GTPase activa
Semenza, G.L. (2014) Cyclin dependent kinases regulate
tion and its loss in oncogenic Ras mutants, Science, 277,
lysosomal degradation of hypoxia inducible factor 1α to
333-338.
promote cell cycle progression, Proc. Natl. Acad. Sci. USA,
56.
Bryant, K.L., Mancias, J.D., Kimmelman, A.C., and Der,
111, E3325-E3334.
C.J. (2014) KRAS: feeding pancreatic cancer proliferation,
39.
Kietzmann, T. (2017) Metabolic zonation of the liver: the
Trends Biochem. Sci., 39, 91-100, doi: 10.1016/j.tibs.
oxygen gradient revisited, Redox Biol., 11, 622-630.
2013.12.004.
40.
Phan, A.T., and Goldrath, A.W. (2015) Hypoxia inducible
57.
Hu, Y., Lu, W., Chen, G., Wang, P., Chen, Z., Zhou, Y.,
factors regulate T cell metabolism and function, Mol.
Ogasawara, M., Trachootham, D., Feng, L., and Pelicano,
Immunol.,
68,
527-535, doi:
10.1016/j.molimm.
H. (2012) K ras(G12V) transformation leads to mitochon
2015.08.004.
drial dysfunction and a metabolic switch from oxidative
41.
Michalekand, R.D., and Rathmell, J.C. (2010) The meta
phosphorylation to glycolysis, Cell Res., 22, 399-412.
bolic life and times of a T cell, Immunol. Rev., 236,
58.
Chesney, J., and Telang, S. (2013) Regulation of glycolytic
190-202, doi: 10.1111/j.1600 065X.2010.00911.x.
and mitochondrial metabolism by ras, Curr. Pharm.
42.
Ohshima, H., Tatemichi, M., and Sawa, T.
(2003)
Biotechnol., 14, 251-260.
Chemical basis of inflammation induced carcinogenesis,
59.
Irani, K., Xia, Y., Zweier, J.L., Sollott, S.J., Der, C.J.,
Arch. Biochem. Biophys., 417, 3-11.
Fearon, E.R., Sundaresan, M., Finkel, T., and
43.
Schwartsburd, P.M. (2003) Chronic inflammation as
Goldschmidt Clermont, P.J. (1997) Mitogenic signaling
inductor of pro cancer microenvironment: pathogenesis of
mediated by oxidants in Ras transformed fibroblasts,
dysregulated feedback control, Cancer Metastasis Rev., 22,
Science, 275, 1649-1652.
95-102.
60.
Mitsushita, J., Lambeth, J.D., and Kamata, T. (2004) The
44.
Bokoch, G.M., and Knaus, U.G. (2003) NADPH oxidas
superoxidegenerating oxidase Nox1 is functionally
es: not just for leukocytes anymore! Trends Biochem. Sci.,
required for Ras oncogene transformation, Cancer Res., 64,
28, 502-508.
3580-3585.
45.
Morry, J., Ngamcherdtraku, W., and Yantasee, W. (2017)
61.
Komatsu, D., Kato, M., Nakayama, J., Miyagawa, S., and
Oxidative stress in cancer and fibrosis: opportunity for
Kamata, T. (2008) NADPH oxidase 1 plays a critical medi
therapeutic intervention with antioxidant compounds,
ating role in oncogenic Ras induced vascular endothelial
enzymes, and nanoparticles, Redox Biol., 11, 240-253,
growth factor expression, Oncogene, 27, 4724-4732,
doi: 10.1016/j.redox.2016.12.011.
doi: 10.1038/onc.2008.102.
46.
Balamurugan, K. (2016) HIF 1 at the crossroads of hypox
62.
Qiu, R.G., Chen, J., Kirn, D., and Moon, A. (1995) An
ia, inflammation, and cancer, Int. J. Cancer, 138,
essential role for Rac in Ras transformation, Nature, 374,
1058-1066.
457-459.
БИОХИМИЯ том 84 вып. 10 2019
ЭФФЕКТ ВАРБУРГА - РЕГУЛЯЦИЯ ОНКОБЕЛКАМИ
1383
63.
Kissil, J.L., Walmsley, M.J., Hanlon, L., Haigis, K.M.,
79.
Leontieva, O.V., Demidenko, Z.N., and Blagosklonny,
Bender Kim, C.F., Sweet Cordero, A., Eckman, M.S.,
M.V. (2015) Dual mTORC1/C2 inhibitors suppress cellu
Tuveson, D.A., Capobianco, A.J., Tybulewicz, V.L., and
lar geroconversion (a senescence program), Oncotarget, 6,
Jacks, T. (2007) Requirement for Rac1 in a K ras induced
23238-23248.
lung cancer in the mouse, Cancer Res., 67, 8089-8094.
80.
Leontieva, O.V., and Blagosklonny, M.V. (2014) M TOR
64.
Kazanietz, M.G., and Caloca, M.J. (2017) The Rac
of pseudo hypoxic state in aging: Rapamycin to the rescue,
GTPase in cancer: from old concepts to new paradigms,
Cell Cycle, 13, 509-515.
Cancer Res., 77, 5445-5451.
81.
Sato, T., Nakashima, A., Guo, L., Coffman, K., and
65.
Malliri, A., van Der Kammen, R.A., Clark, K., van der
Tamanoi, F. (2010) Single amino acid changes that confer
Valk, M., Michiels, F., and Collard, J.G. (2002) Mice defi
constitutive activation of mTOR are discovered in human
cient in the Rac activator Tiam1 are resistant to Ras
cancer, Oncogene, 29, 2746-2752.
induced skin tumours, Nature, 417, 867-871.
82.
Grabiner, B.C., Nardi, V., Birsoy, K., Possemato, R.,
66.
Adachi, Y., Shibai, Y., Mitsushita, J., Shang, W.H., Hirose, K.,
Shen, K., Sinha, S., Jordan, A., Beck, A.H., and Sabatini,
and Kamata, T. (2008) Oncogenic Ras upregulates NADPH
D.M. (2014) A diverse array of cancer associated MTOR
oxidase 1 gene expression through MEK ERK dependent
mutations are hyperactivating and can predict rapamycin
phosphorylation of GATA 6, Oncogene, 27, 4921-4932.
sensitivity, Cancer Discov., 4, 554-563.
67.
Wu, R.F., and Terada, L.S. (2009) Ras and Nox: linked sig
83.
Blagosklonny, M.V. (2008) Prevention of cancer by inhibit
naling networks? Free Radic. Biol. Med., 47, 1276-1281,
ing aging, Cancer Biol. Ther., 7, 1520-1524.
doi: 10.1016/j.freeradbiomed.2009.05.037.
84.
Ma, X.M., and Blenis, J. (2009) Molecular mechanisms of
68.
Neuzil, J., Rohlena, J., and Dong, L.F. (2012) K Ras and
mTOR mediated translational control, Nat. Rev. Mol. Cell
mitochondria: dangerous liaisons, Cell Res., 22, 285-287,
Biol., 10, 307-318, doi: 10.1038/nrm2672.
doi: 10.1038/cr.2011.160.
85.
Busch, S., Renaud, S.J., Schleussner, E., Graham, C.H.,
69.
Weinberg, F., Hamanaka, R., Wheaton, W.W., Weinberg,
and Markert, U.R. (2009) mTOR mediates human tro
S., Joseph, J., Lopez, M., Kalyanaraman, B., Mutlu,
phoblast invasion through regulation of matrix remodeling
G.M., Budinger, G.R., and Chandel, N.S.
(2010).
enzymes and is associated with serine phosphorylation of
Mitochondrial metabolism and ROS generation are essen
STAT3, Exp. Cell Res., 315, 1724-1733, doi: 10.1016/j.
tial for K ras mediated tumorigenicity, Proc. Natl. Acad.
yexcr.2009.01.026.
Sci. USA, 107, 8788-8793.
86.
Dodd, K., Yang, J., Shen, M., Sampson, J., and Tee, A.
70.
Martin, T.D., Cook, D.R., Choi, M.Y., Li, M.Z., Haigis,
(2015) mTORC1 drives HIF 1α and VEGF A signaling via
K.M., and Elledge, S.J. (2017). Role for mitochondrial
multiple mechanisms involving 4E BP1, S6K1 and STAT3,
translation in promotion of viability in K Ras mutant cells,
Oncogene, 34, 2239-2250.
Cell Rep., 20, 427-438.
87.
Gao, P., Niu, N., Wei, T., Tozawa, H., Chen, X., Zhang,
71.
Heit, B., Yeung, T., and Grinstein, S. (2011) Changes in
C., Zhang, J., Wada, Y., Kapron, C.M., and Liu, J. (2017)
mitochondrial surface charge mediate recruitment of sig
The roles of signal transducer and activator of transcription
naling molecules during apoptosis, Am. J. Physiol. Cell
factor 3 in tumor angiogenesis, Oncotarget, 8, 69139-69161.
Physiol., 300, C33-C41.
88.
Shaw, R.J. (2009) LKB1 and AMP activated protein
72.
Irby, R.B., and Yeatman, T.J. (2000) Role of Src expression
kinase control of mTOR signalling and growth, Acta
and activation in human cancer, Oncogene, 19, 5636-5642.
Physiol. (Oxf.), 196, 65-80.
73.
Siveen, K.S., Prabhu, K.S., Achkar, I.W., Kuttikrishnan,
89.
Kim, I.Y., and Yu Ying, He. (2013) Targeting the AMP
S., Shyam, S., Khan, A.Q., Merhi, M., Dermime, S., and
activated protein kinase for cancer prevention and therapy,
Uddin, S. (2018) Role of non receptor tyrosine kinases in
Front. Oncol., 3, 175, doi: 10.3389/fonc.2013.00175.
hematological malignances and its targeting by natural
90.
Faubert, B., Boily, G., Izreig, S., Griss, T., Samborska, B.,
products, Mol. Cancer, 17, 31, doi: 10.1186/s12943 018
Dong, Z., Dupuy, F., Chambers, C., Fuerth, B.J., Viollet,
0788 y.
B., Mamer, O.A., Avizonis, D., DeBerardinis, R.J., Siegel,
74.
Carroll, R.C., Ash, J.F., Vogt, P.K., and Singer, S.J. (1978)
P.M., and Jones, R.G. (2013) AMPK is a negative regula
Reversion of transformed glycolysis to normal by inhibition
tor of the Warburg effect and suppresses tumor growth in
of protein synthesis in rat kidney cells infected with tem
vivo, Cell Metab., 17, 113-124.
perature sensitive mutant of Rous sarcoma virus, Proc.
91.
Schmelzle, T., and Hall, M. (2000) TOR, a central con
Natl. Acad. Sci. USA, 75, 5015-5019.
troller, Cell, 103, 253-262.
75.
Lee, H.Y., Lee, T., and Lee, N. (2011) Src activates HIF1α
92.
Kim, E.K., Yun, S.J., Ha, J.M., Kim, Y.W., Jin, I.H.,
not through direct phosphorylation of HIF1α specific pro
Yun, J., Shin, H.K., Song, S.H., Kim, J.H., Lee, J.S.,
lyl 4 hydroxylase 2 but through activation of the NADPH
Kim, C.D., and Bae, S.S. (2011) Selective activation of
oxidase/Rac pathway, Carcinogenesis, 32, 703-712.
Akt1 by mammalian target of rapamycin complex 2 regu
76.
Jin, Y., Cai, Q., Shenoy, A.K., Lim, S., Zhang, Y., Charles,
lates cancer cell migration, invasion, and metastasis,
S., Tarrash, M., Fu, X., Kamarajugadda, S., Trevino, J.G.,
Oncogene, 30, 2954-2963.
Tan, M., and Lu, J. (2016) Src drives the Warburg effect
93.
Prendergast, G.C. (1999) Mechanisms of apoptosis by
and therapy resistance by inactivating pyruvate dehydroge
c Myc, Oncogene, 18, 2967-2987.
nase through tyrosine 289 phosphorylation, Oncotarget, 7,
94.
Yoshida, G.J. (2018) Emerging roles of Myc in stem cell
25113-25124.
biology and novel tumor therapies, J. Exp. Clin. Cancer
77.
Chou, M.T., Anthony, J., Bjorge, J.D., and Fujita, D.J.
Res., 37, 173, doi: 10.1186/s13046 018 0835 y.
(2010) The von Hippel-Lindau tumor supressor protein is
95.
Wahlstrom, T., and Henriksson, M.A. (2015) Impact of
destabilized by Src: implications for tumor angiogenesis
MYC in regulation of tumor cell metabolism, Biochim.
and progression, Genes Cancer, 1, 225-238.
Biophys. Acta, 1849, 563-569.
78.
Vettori, A., Greenald, D., Wilson, G.K., Peron, M.,
96.
Kalkat, M., De Melo, J., Hickman, K.A., Lourenco, C.,
Facchinello, N., Markham, E., Sinnakaruppan, M.,
Redel, C., Resetca, D., Tamachi, A., Tu, W.B., and
Matthews, L.C., McKeating, J.A., Argenton, F., and van
Penn, L.Z. (2017) MYC deregulation in primary human
Eeden, F.J.M. (2017) Glucocorticoids promote von
cancers, Genes, 8, E151, doi: 10.3390/genes8060151.
Hippel-Lindau degradation and Hif1α stabilization, Proc.
97.
Schaub, F.X., Dhankani, V., Berger, A.C., Trivedi, M.,
Natl. Acad. Sci. USA, 114, 9948-9953.
Richardson, A.B., Shaw, R., Zhao, W., Zhang, X. Ventura, A.,
БИОХИМИЯ том 84 вып. 10 2019
1384
КОБЛЯКОВ
Ventura, Liu, Y., Ayer, D.E., Hurlin, P.J., Cherniack, A.D.,
106. Wang, L., Xue, M., and Chung, D.C. (2016) c Myc is reg
Eisenman, R.N., Bernard, B., and Grandori, C. (2018) Pan
ulated by HIF 2α in chronic hypoxia and influences sensi
cancer alterations of the MYC oncogene and its proximal net
tivity to
5 FU in colon cancer, Oncotarget,
7,
work across the cancer genome atlas, Cell Syst., 6, 282-300.
78910-78917.
98. Dang, C.V. (2012) MYC on the path to cancer, Cell, 149,
107. Dang, C.V., Kim, J.W., Gao, P., and Yustein, J. (2008) The
22-35.
interplay between MYC and HIF in cancer, Nat. Rev.
99. Osthus, R.C., Shim, H., Kim, S., Li, Q., Reddy, R.,
Cancer, 8, 51-56.
Mukherjee, M., Xu, Y., Wonsey, D., Lee, L.A., and Dang,
108. Zhou, Q., Jin, P., Liu, J., Wang, F., and Xi, S. (2018)
C.V. (2000) Deregulation of glucose transporter 1 and gly
HER2 and Src co regulate proliferation, migration and
colytic gene expression by c Myc, J. Biol. Chem., 275,
transformation by downstream signaling pathways in
21797-21800.
arsenite treated human uroepithelial cells, Metallomics,
100. He, T.L., Zhang, Y.J., Jiang, H., Li, X.H., Zhu, H., and
10, 1141-1159.
Zheng, K.L. (2015) The c Myc LDHA axis positively reg
109. Wang, L.H., Jiang, X.R., Yang, J.Y., Bao, X.F., Chen, J.L.,
ulates aerobic glycolysis and promotes tumor progression
Liu, X., Chen, G.L., and Wu, C.F. (2016). SYP 5, a novel
in pancreatic cancer, Med. Oncol., 32, 187, doi: 10.1007/
HIF1 inhibitor, suppresses tumor cells invasion and angio
s12032 015 0633 8.
genesis, Eur. J. Pharmacol., 791, 560-568.
101. Kim, J.W., Gao, P., Liu, Y.C., Semenza, G.L., and Dang,
110. Niu, W., Luo, Y., Wang, X., Zhou, Y., Li, H., Wang, H.,
C.V. (2007) Hypoxia inducible factor 1 and dysregulated
Fu, Y., Liu, S., Yin, S., Li, J., Zhao, R., Liu, Y., Fan, S.,
c Myc cooperatively induce vascular endothelial growth
Li, Z., Xiong, W., Li, X., Li, G., Ren, C., Tan, M., and
factor and metabolic switches hexokinase 2 and pyruvate
Zhou, M. (2018) BRD7 inhibits the Warburg effect and
dehydrogenase kinase 1, Mol. Cell. Biol., 27, 7381-7393.
tumor progression through inactivation of HIF1α/LDHA
102. Zarrabi, A.J., Kao, D., Nguyen, D.T., Loscalzo, J., and
axis in breast cancer, Cell Death Dis., 9, 519, doi: 10.1038/
Handy, D.E. (2017) Hypoxia induced suppression of
s41419 018 0536 7.
c Myc by HIF 2α in human pulmonary endothelial cells
111. Semenza, G.L. (2009) Regulation of cancer cell metabo
attenuates TFAM expression, Cell. Signal., 38, 230-237.
lism by hypoxia inducible factor 1, Semin. Cancer Biol., 19,
103. Huang, L.E. (2008) Carrot and stick: HIF alpha engages
12-16.
c Myc in hypoxic adaptation, Cell Death Differ., 15,
112. Masoud, G.N., and Li, W. (2015) HIF 1α pathway: role,
672-677, doi: 10.1038/sj.cdd.4402302.
regulation and intervention for cancer therapy, Acta Pharm.
104. Goda, N., Ryan, H.E., Khadivi, B., McNulty, W., Rickert,
Sin. B, 5, 378-389, doi: 10.1016/j.apsb.2015.05.007.
R.C., and Johnson, R.S. (2003) Hypoxia inducible factor
113. Park, K., Lee, H.E., Lee, S.H., Lee, D., Lee, T., and Lee,
1alpha is essential for cell cycle arrest during hypoxia, Mol.
Y.M. (2017) Molecular and functional evaluation of a novel
Cell. Biol., 23, 359-369.
HIF inhibitor, benzopyranyl 1,2,3 triazole compound,
105. Koshiji, M., Kageyama, Y., Pete, E.A., Horikawa, I.,
Oncotarget, 8, 7801-7813.
Barrett, J.C., and Huang, L.E. (2004) HIF 1alpha induces
114. Masoud, G.N., Wang, J., Chen, J., Miller, D., and Li, W.
cell cycle arrest by functionally counteracting Myc, EMBO
(2015) Design, synthesis and biological evaluation of novel
J., 23, 1949-1956.
HIF1α inhibitors, Anticancer Res., 35, 3849-3859.
MECHANISMS OF REGULATION OF AEROBIC GLYCOLYSIS
(WARBURG EFFECT) BY ONCOPROTEINS IN THE PROCESS
OF CARCINOGENESIS
Review
V. A. Kobliakov
Blokhin Russian Cancer Research Center, Ministry of Health
of the Russian Federation, 115478 Moscow, Russia;
E$mail: kobliakov@rambler.ru
Received February 4, 2019
Revised June 17, 2019
Accepted June 17, 2019
According to modern concepts of tumor formation, regardless of the carcinogenic effect, the structure of proto onco
genes is violated and/or the suppressor genes are deactivated. As a consequence, functioning of unregulated onco
proteins causes activation of extracellular proteases and destruction of intercellular matrix, resulting in the invasion,
breaking intercellular contacts, and metastasis. Tumor development requires the activation of some transcription fac
tors. However, many oncoproteins are not the transcription factors. It is possible to assume that many oncoproteins
are not the ultimate effectors of tumor development but the transmitters of the carcinogenic signal on certain tran
scription factor, which promotes the oncogenic process. The mechanisms of carcinogenesis caused by different onco
genes/oncoproteins are considered in the review, and the conclusion is made that common place for all of them is the
stimulation of aerobic glycolysis (Warburg effect) regulated, as a rule, via HIFα transcription factor. The role of aer
obic glycolysis at early stages of carcinogenesis is discussed.
Keywords: hypoxia, Warburg effect, inflammation, RAS, SRC, HIFα, MYC, mTOR
БИОХИМИЯ том 84 вып. 10 2019