БИОХИМИЯ, 2019, том 84, вып. 10, с. 1385 - 1400
УДК 616 006.04 + 612.015.39
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О МЕТАБОЛИЧЕСКОМ
ПЕРЕПРОГРАММИРОВАНИИ В ЗЛОКАЧЕСТВЕННЫХ
НОВООБРАЗОВАНИЯХ
Обзор
© 2019 Д.А. Коршунов*, И.В. Кондакова, Е.Е. Шашова
Томский национальный исследовательский медицинский центр,
634009 Томск, Россия; электронная почта: ieved@ya.ru
Поступила в редакцию 01.03.2019
После доработки 06.05.2019
Принята к публикации 20.06.2019
Метаболическое перепрограммирование является одной из центральных особенностей трансформирован
ных клеток. Постепенное выявление взаимодействия между сигнальными путями, специфичными для нео
плазии, и клеточными метаболическими процессами привело к обширным исследованиям перепрограмми
рования метаболизма опухолей. В обзоре обобщены ключевые результаты о катаболических и анаболичес
ких перестройках в опухолевых клетках, в частности, рассмотрены особенности углеводного, липидного,
аминокислотного и ацетатного обменов, участвующих в формировании фенотипа раковых клеток.
КЛЮЧЕВЫЕ СЛОВА: эффект Варбурга, пентозофосфатный путь, глутамин, липогенез, ацетат.
DOI: 10.1134/S0320972519100026
В настоящее время установлено, что в про
синтезу белка и активному синтезу ДНК [2].
цессе канцерогенеза клеткам требуется пере
Кроме того, с гликолитическим путем функцио
программировать свой катаболический и анабо
нально связано усиление синтеза жирных кис
лический метаболизм, чтобы поддерживать
лот de novo опухолевыми клетками [3].
жизнеспособность и интенсивный рост в усло
В настоящее время считается, что основные
виях высокой конкуренции с клетками микро
признаки рака включают активацию сигнализа
окружения. Для этого опухолевые клетки усили
ции, приводящую к усиленной пролиферации,
вают энергопродукцию и активируют биосинте
уклонение от супрессоров роста, ингибирова
тические процессы. Одно из ключевых измене
ние гибели клеток, формирование механизмов,
ний метаболизма опухолевых клеток было отк
обеспечивающих клеточное бессмертие, инду
рыто в 1920 х гг. Отто Варбургом. Он показал,
цирование ангиогенеза, инвазии и метастазиро
что раковые клетки усиленно потребляют глю
вания, перепрограммирование энергетического
козу и производят лактат в аэробных условиях
метаболизма (эффект Варбурга) и избегание им
(эффект Варбурга, называемый также аэробным
мунного надзора [4]. В данном обзоре излагают
гликолизом) [1]. Усиление активности гликоли
ся современные представления о перепрограм
за в опухолевых клетках по сравнению с нор
мировании метаболизма в опухолевых клетках.
мальными стало отличительной чертой транс
формированного фенотипа, который может
обеспечивать конкурентное преимущество зло
УГЛЕВОДНЫЙ ОБМЕН
качественных клеток. Раскрытие высокой зна
чимости эффекта Варбурга в канцерогенезе
В подавляющем большинстве злокачествен
инициировало дальнейшее изучение роли ли
ных опухолей наблюдается сверхэкспрессия
пидного, углеводного и белкового обмена в про
гликолиз связанных генов, которая приводит к
цессе канцерогенеза [2]. В результате этих ис
эффекту Варбурга - уникальному метаболичес
следований было установлено, что опухолевые
кому фенотипу раковых клеток, характеризую
клетки характеризуются высоким уровнем энер
щемуся повышением активности гликолиза в
гоемких процессов, приводящих к усиленному
200 раз по сравнению с нормальными клетками
независимо от уровня кислорода [5, 6]. Хотя
* Адресат для корреспонденции.
производство АТФ путем гликолиза менее эф
2
1385
1386
КОРШУНОВ и др.
фективно в расчете на единицу потребляемой
образованию функционально активного комп
глюкозы, но метаболические перестройки обес
лекса HIF 1α-HIF 1β, который активирует
печивают адекватное и быстрое поступление
транскрипцию ряда генов, связанных с иници
энергии для биосинтетических процессов рако
ированием ангиогенеза и регулированием кле
вых клеток и, следовательно, высокую жизне
точного метаболизма, что, в конечном счете,
способность даже при отсутствии достаточного
способствует опухолевой прогрессии [15]. Также
уровня кислорода в гипоксической области.
было установлено в эксперименте in vitro, что
Аэробный гликолиз протекает быстрее митохон
конститутивные уровни HIF 1α присутствуют в
дриального окислительного фосфорилирова
раковых клетках различных линий в условиях
ния, способствуя увеличению скорости гидро
нормальной оксигенации [16]. Это происходит в
лиза глюкозы. Это, в свою очередь, позволяет
результате инактивации множества различных
раковым клеткам успешно конкурировать с
генов супрессоров опухоли и активации много
нормальными клетками за поглощение глюкозы
численных онкогенов, изменяющих содержа
для поддержания непрерывного роста. Новые
ние различных факторов роста. Один из ключе
данные указывают на то, что аэробный гликолиз
вых путей активации HIF 1 связан с мутацией
при раке также способствует глутаминолизу, что
VHL. Исследования показывают, что β домен
необходимо для синтеза нуклеиновых кислот, и
белка pVHL напрямую взаимодействует с кисло
усиливает пентозофосфатный путь, необходи
род зависимыми доменами деградации субъе
мый для роста и пролиферации раковых клеток.
диниц HIF α, и в результате этого любые анало
Поступление конечного продукта аэробного
гичные мутации, влияющие на β домен pVHL,
гликолиза — лактата из клеток в межклеточное
будут предотвращать его ассоциацию с HIF 1α
пространство изменяет микроокружение опухо
[17].
ли и воздействует на связанные с раком клетки.
Также было показано, что на активацию и
В совокупности накопленные данные однознач
экспрессию HIF 1 влияют мутации, связанные
но демонстрируют, что аэробный гликолиз во
с инактивацией PTEN (гомолога фосфатазы и
влекает множество молекулярных и функцио
тензина). PTEN является опухолевым супрессо
нальных процессов для поддержки прогресси
ром, обладающим активностью липидфосфата
рования рака [6]. Изменение активности глико
зы [18]. При стимуляции сигнального PI3К ки
лиза и содержания соответствующих метаболи
назного пути его компоненты активируются за
тов было обнаружено в резистентных к лекар
счет превращения PIP 2 в PIP 3, PTEN ингиби
ственным препаратам клетках и тканях рака мо
рует процесс гидролиза PIP 3 до PIP 2, что, в
лочной железы, глиобластомы, аденокарцино
свою очередь, тормозит работу PI3K/AKT/
мы поджелудочной железы, рака желудка, мие
mTOR сигнального пути [18]. Мутации PTEN
лоидного лейкоза и немелкоклеточного рака
приводят к неконтролируемой активации Akt и
легкого [7-10].
mTOR, что, в конечном итоге, приводит к акти
В то же время известно, что опухолевые
вации HIF 1α [19].
клетки часто находятся в условиях гипоксии,
Существует предположение, что ингибиро
которая облегчает рост, миграцию и инвазию
вание аэробного гликолиза в опухолях может
клеток рака, а также повышает устойчивость
повысить эффективность противоопухолевой
клеток к противоопухолевым препаратам
терапии. Примером является дезоксиглюкоза,
[11-13]. Было установлено, что ключевая роль в
которая ингибирует гексокиназу, ассоцииро
реализации этих явлений в условиях гипоксии
ванную с митохондриями и формирующуюся
принадлежит гипоксия индуцибельному факто
именно при эффекте Варбурга в опухолевых
ру 1 (HIF 1). Этот фактор состоит из двух субъе
клетках. Благодаря тому, что этот ингибитор
диниц - HIF 1α и HIF 1β, при этом β субъеди
имеет более высокое сродство к митохондри
ница располагается в ядре, а состояние HIF 1α
ально связанной гексокиназе, чем цитозоль
зависит от содержания кислорода в клетке. При
ной, которая присутствует как при аэробном
наличии достаточного количества кислорода
гликолизе, так и в норме, дезоксиглюкоза ока
HIF 1α быстро гидроксилируется ферментами,
зывает противоопухолевый эффект с мини
принадлежащими к семейству пролилгидрокси
мальным токсическим воздействием на нор
лаз, после чего полиубиквитинируется белком
мальные клетки. В настоящее время дезокси
фон Хиппель-Линдау, который является уби
глюкоза проходит многочисленные клиниче
квитин лигазой, затем разрушается протеасомой
ские испытания [20].
[14]. В условиях гипоксии пролилгидроксилаза
Сейчас установлено, что наиболее сущест
не инактивирует HIF 1α, в результате чего
венный вклад в реализацию гликолитического
HIF 1α мигрирует в ядро клетки, где связывает
фенотипа осуществляют транспортеры глюко
ся с β субъединицей. Этот процесс приводит к
зы 1 и 3, гексокиназа 1 и 2, фосфофруктоки
БИОХИМИЯ том 84 вып. 10 2019
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О МЕТАБОЛИЗМЕ РАКА
1387
наза 1 и 2, альдолаза A и C, фосфоглицератки
ется в широком диапазоне злокачественных
наза 1, енолаза 1, пируваткиназа М2, киназа
опухолей, которые требуют повышенной глико
пируватдегидрогеназы 1 и, возможно, 2, лактат
литической активности [23]. В опухолевых клет
дегидрогеназа 5, а также монокарбоксилатный
ках ГК2 может находиться в цитозоле, но чаще
переносчик 4. Сверхэкспрессия транспортеров
она связана с трансмембранными потенциалза
глюкозы 1 и 3, индуцированная HIF 1, активно
висимыми аниоными каналами (VDAC), распо
поддерживает достаточно высокую скорость
ложенными во внешней митохондриальной
поглощения глюкозы в опухолевых клетках в
мембране [24]. Такая локализация препятствует
ответ на их повышенную потребность в энерге
освобождению цитохрома с из митохондрий,
тическом и строительном материале. Высокая
тем самым защищая раковую клетку от апопто
концентрация ферментов гексокиназы 1 и 2,
за. Более того, такое расположение ГК2 делает
фосфофруктокиназы 1 и 2, альдолазы С, фос
ее менее чувствительной к ингибированию глю
фоглицераткиназы 1, енолазы 1, пируваткина
козой 6 фосфатом, а также защищает ее от про
зы М2 непосредственно способствует увеличе
теолитической деградации. Встречается ГК2 в
нию интенсивности всех реакций гликолиза до
основном в скелетных мышцах и жировой тка
образования пирувата. При этом киназа пиру
ни, поэтому можно ожидать, что подавление
ватдегидрогеназы 1 и 2 ингибирует фермент пи
этого фермента будет сопровождаться мини
руватдегидрогеназу, который катализирует
мальным риском формирования побочных эф
окисление пирувата в ацетил КоА в митохон
фектов в других здоровых тканях [25]. На дан
дриях. Таким образом, HIF 1, активируя экс
ный момент были проведены эксперименты с
прессию этих киназ, обеспечивает превраще
ингибированием ГК, в которых было показано и
ние пирувата исключительно в лактат в услови
обращение вспять процесса эпителиально ме
ях гипоксии, а также своевременно способству
зенхимального перехода в клетках рака молоч
ет экспрессии лактатдегидрогеназы 5, которая
ной железы и подавление их инвазивного роста
преобразует пируват в лактат. Картина заверша
[26].
ется усилением производства монокарбокси
Глюкоза 6 фосфатизомераза (ГФИ) обрати
латного переносчика, отвечающего за выведе
мо катализирует изомеризацию глюкозо 6 фос
ние лактата из клетки.
фата в фруктозо 6 фосфат. ГФИ имеет несколь
Ряд изоферментов гликолиза требуют более
ко свойств: внутри клетки она действует как
детального рассмотрения, так как они вносят
гликолитический фермент, в то время как вне
значительный вклад в формирование фенотипа
клетки она ведет себя как цитокин. Молекуляр
аэробного гликолиза.
ное клонирование и секвенирование определи
Гексокиназа (ГК) отвечает за первую лими
ли ГФИ как аутокринный фактор подвижности
тирующую стадию гликолиза, при которой глю
(АФП), способный стимулировать миграцию
коза необратимо фосфорилируется с участием
раковых клеток. Было обнаружено, что уровень
АТФ в глюкозо 6 фосфат. Выделяют четыре
ГФИ/АФП выше как в крови, так и в опухолях
изоформы гексокиназы - ГК1, ГК2, ГК3 и ГК4
различных локализаций у онкобольных, и строго
(или глюкокиназа, ГлК) с различной внутрикле
связан с прогрессированием рака, ангиогенезом
точной локализацией, встречаемостью в тканях
и метастазированием [27-31]. Также установле
и кинетическими свойствами. Изоформы ГК
но, что экспрессия ГФИ/АФП в опухолевых
1-3 обладают более высокой аффинностью по
клетках, находящихся в состоянии гипоксии,
отношению к глюкозе, чем ГлК, и в отличие от
регулируется, по крайней мере частично, HIF 1
нее, ингибируются глюкозой 6 фосфатом [21].
[32]. Стимуляция подвижности опухолевых кле
В то время как ГлК состоит из одного домена
ток инициируется связыванием ГФИ/АФП на
белка, три другие изоформы состоят из двух
поверхности клеток с АФП рецептором. Funa
почти идентичных доменов. В ГК1 и ГК3 в N кон
saka T. et al. сообщают, что использование
цевом участке белка находятся сайты регуляции
миРНК для снижения уровня ГФИ/АФП в клет
активностей ферментов по принципу отрица
ках легких фибросаркомы человека привело к
тельной обратной связи, которая осуществляет
мезенхимально эпителиальному переходу и,
ся глюкозой 6 фосфатом, АДФ и неорганиче
вследствие этого, резкому сокращению метаста
ским фосфатом. Напротив, ГК2 сохраняет ката
тических свойств и подвижности клеток [33].
литическую способность в обоих C и N конце
Кроме того, роль ГФИ в инвазивности опухолей
вых частях, так что эта изоформа фактически
подтверждается тем, что этот фермент индуци
может удваивать скорость фосфорилирования
рует экспрессию матриксной металлопротеина
глюкозы, таким образом значительно ускоряя
зы 3 в клетках гепатомы, которая, разрушая
процесс гликолиза [22]. Эта особенность объяс
белки внеклеточного матрикса, способствует
няет, почему ГК2 преимущественно экспрессиру
миграции этих клеток [34]. Вероятно, именно
БИОХИМИЯ том 84 вып. 10 2019
2*
1388
КОРШУНОВ и др.
участие ГФИ в регуляции клеточной подвиж
лях происходит повторная экспрессия ПК M2 с
ности и является механизмом, посредством ко
подавлением ПК M1. Таким образом, ПК M2
торого этот фермент усиливает метастазирова
представляет собой опухоль специфическую
ние опухолей, и разработка его ингибиторов
форму пируваткиназы и достоверный диагнос
внесет вклад в создание новых противоопухоле
тический биомаркер для различных видов рака
вых препаратов с антиметастатическим эффек
[37]. Структурный анализ ПК M2 показал, что
том.
для своей ферментативной активности он нуж
Глицеральдегидфосфатдегидрогеназа (ГАФДГ)
дается в ионах металлов (Mg2+ и К+) [38]. HIF 1
представляет собой пример белка, относящего
активирует транскрипцию этой изоформы и, в
ся к т.н. подрабатывающим белкам («moonlight
свою очередь, ПК M2 выступает в качестве ко
ing protein»). Последние являются новым клас
активатора этого фактора по принципу положи
сом клеточных белков, которые проявляют мно
тельной обратной связи, стимулируя HIF 1
жественные активности в разных субклеточных
транскрипционную активность генов мишеней,
локализациях, помимо их первоначально хоро
и в особенности тех из них, которые кодируют
шо охарактеризованных функций. Кроме клас
некоторые ферменты гликолиза [39]. Также бы
сической роли в производстве энергии, обнару
ло установлено, что лактат и пируват активиру
жено, что мембранный ГАФДГ необходим для
ют экспрессию гипоксически индуцируемых
эндоцитоза и транспортировки железа [35]. Ци
генов независимо от наличия гипоксии, т.е. и
топлазматический ГАФДГ регулирует стабиль
при аэробном гликолизе, обеспечивая тем са
ность мРНК и требуется для обмена метаболи
мым поддержание конститутивных уровней
тами между эндоплазматическим ретикулумом
HIF 1α в раковых клетках даже в условиях нор
и комплексом Гольджи. Ядерный ГАФДГ участ
малной оксигенации [40]. Исследования пока
вует в апоптозе, регуляции транскрипции генов,
зали, что для накопления белка HIF 1α в глио
поддержание целостности ДНК, а также экс
мах человека и других линиях раковых клеток в
порте ядерной тРНК. Такая комплексная роль
аэробных условиях требуется высокие уровни
обеспечивает значительный вклад ГАФДГ в опу
пирувата. Было установлено, что пируват явля
холегенез. В частности, установлена его роль в
ется ключевым гликолитическим метаболитом,
выживаемости опухолевых клеток, опухолевом
способствующим накоплению HIF 1α в клетках
ангиогенезе, а также в контроле экспрессии ге
опухолей. Лактат также способен стимулировать
нов и посттранскрипционной регуляции мРНК
накопление HIF 1α, но его эффект менее выра
опухолевых клеток. Каждый из этих внутрикле
жен [40]. В то же время было показано, что ни
точных эффектов коррелирует с опухолевой
пируват, ни лактат не способны ингибировать
прогрессией и плохим прогнозом течения онко
протеасомную активность по отношению к
логического процесса [35]. Кроме того, ГАФДГ
HIF 1α, поэтому точный механизм, лежащий в
индуцирует аутофагию, которая способствует
основе активации накопления HIF 1α субстра
выживаемости клеток при сниженной митохон
тами гликолиза, остается неопределенным [40].
дриальной активности (т.е. в большинстве гли
В отличие от гомологичной ПК M1, которая
колитических раковых клетках) [36].
существует только в активной тетрамерной фор
Пируваткиназа (ПК) катализирует перенос
ме, ПК M2 меняет конформацию в зависимос
остатка фосфорной кислоты от фосфоенолпи
ти от физиологических условий между неактив
рувата к АДФ с образованием АТФ и пирувата.
ным димером и активным тетрамером с высо
У млекопитающих существует четыре гомотет
ким сродством к фосфоенолпирувату. Переход
рамерных изоформы ПК: изоформа ПК L, в ос
между двумя конформациями происходит за
новном, присутствует в глюконеогенных тканях
счет сложной аллостерической модуляции акти
(печень и почки); ПК R - в эритроцитах; ПК
ватором фруктозо 1,6 бисфосфатом или при
M1 локализована в высокоэнергозатратных тка
взаимодействии с некоторыми онкобелками
нях (мозг, сердце и скелетные мышцы); ПК M2
(HPV 16 Е7 и pp60V SRC киназой) [41]. Пред
располагается в клетках с высоким уровнем
положительно, такая регуляция димерных/тет
синтеза нуклеиновых кислот (эмбриональные,
рамерных переходов ПК M2 в опухолевых клет
взрослые стволовые клетки, лейкоциты, тром
ках позволяет балансировать между гликолити
боциты, раковые клетки). Первые две изофор
ческим производством АТФ (при высокоактив
мы (ПК L и ПК R) кодируются одним и тем же
ной тетрамерной форме) и синтезом строитель
геном, но под контролем различных промото
ных блоков клетки, таких как белки, жирные
ров. При тканевой дифференцировке в эмбрио
кислоты и липиды, которые необходимы для
генезе плода изоформы ПК M2 постепенно за
быстро пролиферирующих клеток (при неак
меняются соответствующими тканеспецифи
тивной димерной форме). Опухоли таким обра
ческими изоформами ПК. Напротив, в опухо
зом могут адаптироваться к изменениям концен
БИОХИМИЯ том 84 вып. 10 2019
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О МЕТАБОЛИЗМЕ РАКА
1389
траций питательных веществ в окружающей
ским фактором? На наш взгляд, метаболиче
среде благодаря функции «метаболического дат
ские изменения в опухолевых клетках вызыва
чика» ПК M2 [42]. Можно заключить, что ПК
ются многообразными канцерогенными воз
M2 имеет решающее значение для формирова
действиями, влекущими за собой регуляторные
ния аэробного гликолиза и обеспечивает преи
нарушения, приводящие в конечном итоге к
мущество в росте опухолей. Действительно, ин
функциональным изменениям в клетке. Под
гибирование экспрессии ПК M2 с помощью
тверждением этому являются исследования
миРНК и замена на изоформу M1 в линиях ра
аэробного гликолиза при вирусном канцероге
ковых клеток человека привели к сокращению
незе. ДНК вирусы (вирус герпеса, вирус Эпш
производства лактата и увеличению потребле
тейн-Барр, вирус папилломы) изменяют мета
ния кислорода in vitro, а также снижению спо
болизм глюкозы в трансформированных клет
собности образовывать опухоли in vivo, подтвер
ках на аэробный гликолиз, поддерживая быст
ждая тем самым, что переход на М2 изоформу
рую пролиферацию клеток. Кроме того, вирус
является необходимым моментом для формиро
ные белки увеличивают поглощение глюкозы и
вания опухолевого метаболического фенотипа
контролируют микроокружение опухоли, спо
(эффекта Варбурга) [43].
собствуя метастазированию опухолевых клеток
Таким образом, при оценке лишь ярко вы
[44]. Таким образом, онкогенные воздействия
раженных изменений гликолиза опухолевых
могут на уровне регуляции изменять метабо
клеток становиться понятно, что изменения
лизм клеток.
катаболизма затрагивают различные аспекты
патогенеза рака, в частности, влияя на процес
ПЕНТОЗОФОСФАТНЫЙ ПУТЬ
сы метастазирования и механизмы контроля
апоптоза. Осознание значимости эффекта Вар
Глюкоза, являясь «топливом» для многокле
бурга для развития злокачественного роста
точных организмов, также задействована в дру
клеток стало движущим фактором исследова
гих метаболических процессах, один из кото
ний метаболизма опухолевых клеток в целом.
рых — пентозофосфатный путь (ПФП), также
Однако, несмотря на значительные продвиже
известный как гексозный монофосфатный
ния в понимании изменений, определяющих
шунт. Для протекания этого процесса (как и для
формирование аэробного гликолиза, остается
гликолиза) не требуется кислорода (рис. 1).
нерешенным ключевой вопрос относительно
Образующийся на первых этапах гликолиза
канцерогенеза. В литературе обсуждается воп
глюкоза 6 фосфат (Г6Ф) может метаболизиро
рос: эффект Варбурга формируется как звено
ваться двумя путями: изомеризоваться во фрук
патогенеза рака или же является этиологиче
тозо 6 фосфат или подвергаться дегидрирова
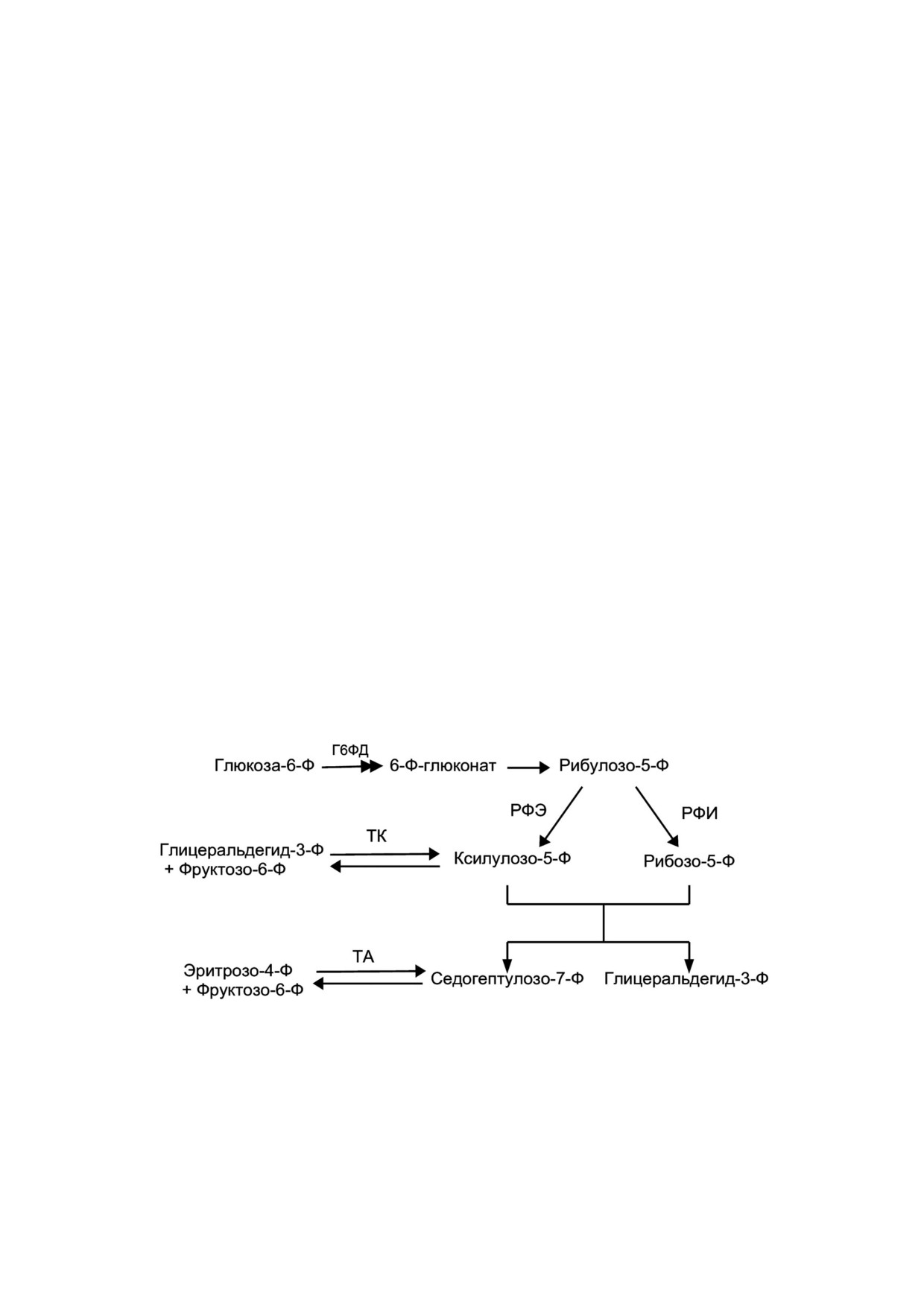
Рис. 1. Схема окислительного и неокислительного этапа пентозофосфатного пути (ПФП). ПФП важен для опухолевых
клеток тем, что он генерирует не только пентозные фосфаты для обеспечения высокой скорости синтеза нуклеиновых
кислот, но также дает прирост NADPH, необходимый как для синтеза жирных кислот, так и для выживаемости клеток в
условиях стресса. Окислительная ветвь в ПФП генерирует NADPH и рибонуклеотиды, имеет три необратимые реакции.
Неокислительная ветвь состоит из ряда обратимых реакций, включая в себя дополнительные гликолитические промежу
точные продукты, такие как фруктоза 6 фосфат и глицеральдегид 3 фосфат, которые могут быть превращены в пентозо
фосфаты и наоборот. Чаще сверхэкспрессия ферментов ПФП в опухолевых клетках приходится на глюкозо 6 фосфатде
гидрогеназу (Г6ФД), рибулозо 5 фосфат 3 эпимеразу (РФЭ), рибулозо 5 фосфатизомеразу (РФИ), а также транскетола
зу (ТК) и трансальдолазу (ТА)
БИОХИМИЯ том 84 вып. 10 2019
1390
КОРШУНОВ и др.
ниию Г6Ф дегидрогеназой (Г6ФД) с участием
продукции NADPH и Р5Ф для определения то
NADP+. ПФП включает окислительную и не
го, какая фаза ПФП активирована. Если клет
окислительную ветвь. Во время окислительной
кам требуется больше NADPH, чем Р5Ф для за
фазы NADP+ действует как акцептор электро
щиты от оксидантов или редуктивного биосин
нов в первой и последней окислительных реак
теза, например, для получения жирных кислот,
циях. Одна молекула глюкозы, окисленная и
Р5Ф превращается в Г3Ф и Ф6Ф, которые ис
метаболизируемая ПФП, может давать две мо
пользуются для синтеза Г6Ф глюконеогенным
лекулы NADPH, который играет ключевую роль
путем. Затем Г6Ф направляется обратно в окис
как в редуктивном биосинтезе (синтез липи
лительную фазу ПФП для получения большего
дов), так и в антиоксидантной защите клеток
количества NADPH. Напротив, если клеткам
[45].
требуется больше Р5Ф, чем NADPH для получе
Возможно, наиболее ценная роль окисли
ния нуклеотидных предшественников ДНК,
тельной ветви ПФП в опухолегенном процес
Г6Ф превращается в Г3Ф и Ф6Ф гликолитиче
се - защита от гибели клеток. Антиокислитель
ским путем, которые затем превращаются в Р5Ф
ная защита полностью неэффективна без ко
неокислительной фазой ПФП для синтеза нук
фактора NADPН, который служит основным
леотидов [48].
донором электронов как для антиоксидантных
Если Г6Ф дегидрогеназа непосредственно
ферментов, так и для катаболических реакций.
контролирует поток ПФП, который генерирует
NADPH поставляет протоны для поддержания
Р5Ф и NADPH, ожидаемо, что высокая актив
жизненно важных компонентов антиокисли
ность Г6ФД приведет к увеличению биосинтеза
тельной системы, а именно поддерживает ак
липидов и ДНК, необходимых для роста и деле
тивность каталазы и регенерацию глутатиона,
ния клеток. Таким образом, быстро пролифери
тиоредоксина и глутаредоксина [46]. Таким об
рующие или раковые клетки обычно увеличива
разом, интенсификация восстановления
ют поток ПФП путем активации Г6ФД для
NADP+ обеспечивает устойчивость к некото
удовлетворения биоэнергетических потребнос
рым методам лечения рака, которые активируют
тей во время пролиферации. Кроме того, 6 фос
окислительный стресс или повреждают ДНК.
фоглюконатдегидрогеназа
(6ФГДГ), другой
Кроме того, активность ПФП также увеличива
NADPH генерирующий фермент окислитель
ется в ответ на ионизирующую радиацию или
ного пути, может играть определенную роль в
химиотерапию как адаптивный ответ [46].
регуляции потока окислительного ПФП. По
Неокислительный путь ПФП не участвует в
добно Г6ФД, 6ФГДГ также может влиять на кле
детоксикации. Однако устойчивость к некото
точный редуктивный биосинтез и пролифера
рым повреждающим ДНК агентам, таким как
цию клеток путем модуляции продуцирования
5 фторурацил, ассоциируется с повышение ак
NADPH и Р5Ф [48].
тивности неокислительного этапа ПФП [47].
В целом механизм, устойчивости к фторурацилу
остается не до конца изученным. Известно, что
АМИНОКИСЛОТНЫЙ ОБМЕН
в процессе резистентности задействован обмен
серина и глицина, синтез которых связан с гли
Опухолевые клетки обладают большей по
колизом и неокислительным этапом ПФП [47].
требностью в аминокислотах, чем нормальные
Дальнейшее изучение неокислительного этапа
клетки вследствие повышенного белкового об
ПФП и путей его ингибирования может привес
мена. Аминокислоты, являясь основными моле
ти к созданию новых терапевтических средств,
кулами, необходимыми для синтеза белка, име
препятствующих появлению химиорезистент
ют ряд других функций. Например, серин слу
ности в опухолях.
жит источником для синтеза нуклеотидов и ме
Другой важной молекулой, генерируемой
тилирования ДНК; лейцин, глутамин и аргинин
ПФП, является рибозо 5 фосфат (Р5Ф), кото
выступают сигнальными факторами, которые
рый может быть важным предшественником
активируют mTOR сигнальный путь, в частнос
многих биомолекул, таких как нуклеотиды. Пя
ти, mTOR 1; глутамин, глицин и аспартат необ
тиуглеродный сахар Р5Ф, который образуется из
ходимы для синтеза нуклеотидов [49, 50].
шестиуглеродной глюкозы во время неокисли
Однако в поддержке интенсивного роста
тельной фазы ПФП, обратимо превращается в
опухоли среди всех аминокислот особую роль
гликолитические промежуточные соединения
играет глутамин. Он является наиболее распро
глицеральдегид 3 фосфат (Г3Ф) и фруктозо 6
страненной свободно циркулирующей амино
фосфат (Ф6Ф) с помощью транскетолазы и
кислотой в плазме человека и служит в качестве
трансальдолазы. Поэтому гликолиз и глюконео
основного анаплеротического субстрата для об
генез связаны с ПФП для контроля клеточной
разования трикарбоновых кислот в цикле Креб
БИОХИМИЯ том 84 вып. 10 2019
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О МЕТАБОЛИЗМЕ РАКА
1391
са, источника азота для нуклеотидов и участвует
которые будут воздействовать на метаболизм
в биосинтезе гексозамина.
глутамина или глюкозы.
Транспортировка глутамина в клетки осуще
ствляется т.н. аланин серин цистеин транспор
тером 2. Поступивший в клетку глутамин сна
ЛИПОГЕНЕЗ
чала превращается в глутамат глутаминазой
(ГА), а затем преобразуется в α кетоглутарат,
Существует два источника жирных кислот
глутаматдегидрогеназой 1 (ГДГ1) или амино
для метаболизма: экзогенно полученные (дие
трансферазой. Полученный из глутамина α ке
тические) и эндогенно синтезированные. Био
тоглутарат пополняет цикл трикарбоновых кис
синтез жирных кислот катализируется многофунк
лот (ЦТК) оксалоацетатом, который конденси
циональной, гомодимерной синтазой жирных
руется с ацетил КоА для поддержания ЦТК и
кислот (СЖК). СЖК синтезирует длинноцепо
биосинтеза жирных кислот. Глутамин принима
чечные жирные кислоты с использованием аце
ет участие в поглощении незаменимых амино
тил КоА в качестве субстрата, малонил КoA в
кислот, поддержании сигнального пути mTOR и
качестве донора с двумя атомами углерода и
производстве NADPH для окислительно вос
NADPH в качестве восстановителя. Преоблада
становительного потенциала [49]. Комплекс
ющим продуктом СЖК является 16 углеродная
mTOR1 повышает содержание ГА и глутамина,
жирная кислота пальмитат [55-57]. У здоровых
влияя на S6K1 (p70 рибосомальная S6 киназа 1),
людей роль СЖК имеет второстепенное значе
экспрессия которой регулируется MYC [50].
ние из за достаточного количества диетических
Из за постоянной потери цитрата из ЦТК в
жирных кислот, поэтому вклад эндогенных
пролиферирующих клетках, особенно в раковых
жирных кислот в общей пул низок [58]. При
клетках, необходимо пополнение промежуточ
этом большинство нормальных клеток, даже те,
ных продуктов ЦТК (анаплероз), и потребление
у которых повышенный метаболизм, преиму
глутамина должно увеличиваться. Усиление об
щественно используют для синтеза новых
мена глутамина в опухолях используется в ана
структурных липидов циркулирующие липиды,
болическом метаболизме, направленном на
состоящие, в основном, из диетических жирных
синтез нуклеиновых кислот, липидов и белков
кислот.
[51], а также увеличивает производство глутати
В нормальных условиях СЖК превращает
она. Кроме того, более высокий уровень потреб
избыток углеводов в жирные кислоты, которые
ления глутамина в раковых клетках использует
затем используются для синтеза холестерола в
ся для обмена незаменимых аминокислот, кото
печени, либо эстерифицируются в жировой тка
рые необходимы для активации mTOR 1, кото
ни до триацилглицеринов и обеспечивают при
рый затем инициирует синтез белка и рост кле
необходимости теплопродукцию через β окис
ток [49]. В сочетании с повышенным потребле
ление. Концентрация СЖК обычно очень низка
нием глутамина в большинстве раковых клеток,
в нераковых клетках. Хотя активность СЖК, как
например, в трижды негативном раке молочной
известно, не регулируется аллостерическими
железы MX 1 [52], клетках нейробластомы [53]
эффекторами или ковалентной модификацией,
и человеческих миелоидных клетках KU812F,
экспрессия СЖК в липогенных тканях сильно
активность ГА намного выше, чем в нормальных
зависит от условий питания. Эндогенный био
клетках.
синтез жирных кислот в печени и жировой тка
Однако не во всех видах рака присутствует
ни под контролем СЖК стимулируется высоким
описанный тип изменений обмена глутамина.
содержанием углеводов, и, наоборот, подавляет
Есть раковые клетки, способные выживать и
ся присутствием небольшого количества жир
размножаться, используя только глюкозу, без
ных кислот в рационе и голодом [59-62].
глутамина. Cheng T. et al. выявили компенсатор
В отличие от нормальных тканей биосинтез
ную связь между ГА и пируваткарбоксилазой.
эндогенных жирных кислот в злокачественных
Пируват, полученный из глюкозы, служит в ка
опухолях и тканях при предраке высок незави
честве анаплеротического предшественника, и,
симо от уровня внеклеточных липидов. К сере
таким образом, клетки больше полагаются на
дине 1950 х гг., используя in vivo маркировку
глюкозу в условиях подавления экспрессии ГА.
14C глюкозой, было определено, что практиче
Активность пируваткарбоксилазы индуцируется
ски все эстерифицированные жирные кислоты в
в условиях низкого уровня глутамина и необхо
опухолевых моделях были получены синтезом
дима для того, чтобы клетки могли обходить
de novo [63]. Так, в отличие от нормальных кле
глутаминовую зависимость [54]. Это компенси
ток, в опухолевых клетках синтез de novo триа
рующее соотношение также необходимо учиты
цилглицериновых жирных кислот может дости
вать при разработке новых видов терапии рака,
гать 95%.
БИОХИМИЯ том 84 вып. 10 2019
1392
КОРШУНОВ и др.
Основная масса эндогенно синтезирован
Недавнее исследование, посвященное изучение
ных жирных кислот в раковых клетках эстери
роли аномалий числа копий генома в патофизио
фицируется преимущественно в фосфолипиды,
логии рака молочной железы, показало, что ген
и поэтому они преимущественно задействованы
AцК присутствует в рецидивирующих амплико
в формировании мембран пролиферирующих
нах, связанных с уменьшением выживаемости
опухолевых клеток [64-66]. Усиление липогене
при раке молочной железы [74].
за в опухолевых клетках связано с повышенной
В третьих, сверхэкспрессия и повышенная
активностью и экспрессией нескольких липо
активность СЖК, ключевого метаболического
генных ферментов (рис. 2).
мультифермента, ответственного за конечную
Во первых, чистая конверсия глюкозы в ли
каталитическую стадию синтеза жирных кислот
пиды зависит от способности клеток продуци
(конденсацию ацетил КоА и малонил KoA для
ровать цитозольный ацетил КоА из цитрата, по
получения насыщенного пальмитата), представ
лученного из митохондрий, посредством АТФ
ляет собой один из наиболее часто встречаю
цитратлиазы (АЦЛ). Так, повышенная АЦЛ
щихся фенотипических изменений в раковых
экспрессия и активность фермента были зареги
клетках. Иммуногистохимические исследова
стрированы в различных опухолевых клетках
ния показали чрезвычайно высокий уровень
[67-69]. РНК интерференция и ингибирование
СЖК во многих эпителиальных опухолях и пред
АЦЛ резко ограничивают пролиферацию и вы
опухолевых поражениях, включая молочные
живаемость раковых клеток in vitro с аэробным
железы, прямую кишку, простату, мочевой пу
гликолизом [68]. Актуальность АЦЛ управляе
зырь, яичник, пищевод, желудок, легкие, рото
мого каналирования глюкозы в синтезе липидов
вую полость, щитовидную железу и эндометрий,
de novo как важного компонента роста и транс
а также мезотелиомы, нефробластомы, рети
формации клеток также подтверждается тем
нобластомы, саркомы мягких тканей, кожных
фактом, что АЦЛ ингибирование также умень
меланоцитарных новообразований, в том числе
шает опухолегенез in vivo [69].
меланомы и гепатоцеллюлярной карциномы
Во вторых, было показано, что ацетил КоА
[75-78]. Важно отметить, что избыточная
карбоксилаза (AцК), катализирующая АТФ за
экспрессия СЖК и гиперактивность обычно
висимое карбоксилирование ацетил КоА с ма
возникают в карциномах с более высоким рис
лонил КоА [70], сверхэкспрессируется не толь
ком как рецидива заболевания, так и летальнос
ко в карциномах молочной железы, но также и в
ти пациентов [79-85].
преднеопластических поражениях [71]. Нокдаун
Многие гены, которые кодируют ферменты
AцК методом РНК интерференции ухудшает
биосинтетического пути жирных кислот, вклю
пролиферацию опухолевых клеток и вызывает
чая АЦЛ, AцК и СЖК, находятся на хромосоме
снижение жизнеспособности клеток [72, 73].
человека 17q. Хотя это сайт онкогенных ампли
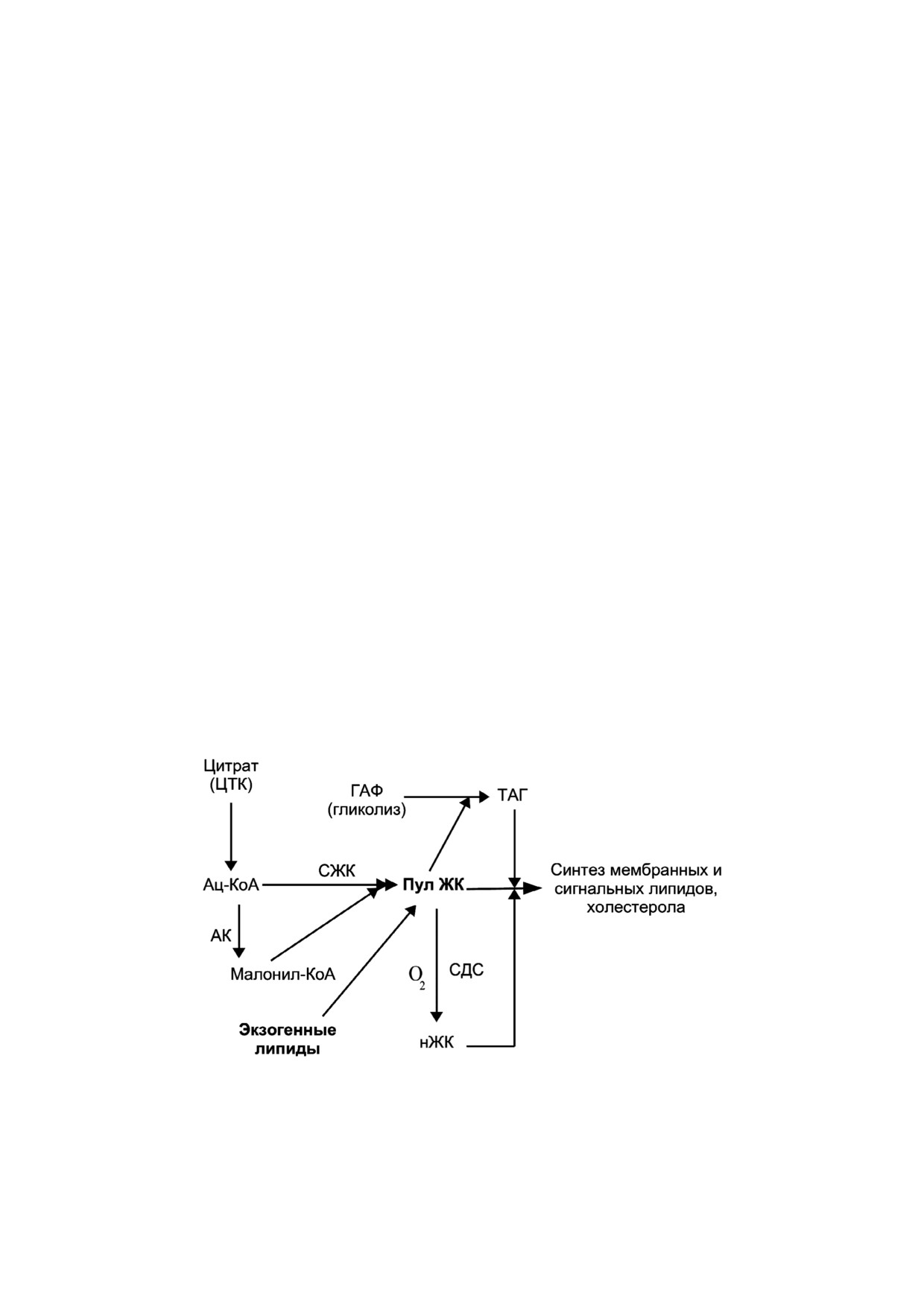
Рис. 2. Принципы синтеза и десатурации липидов. Субстратом для синтеза жирных кислот выступает ацетил КоА, обра
зующийся в основном через глутаминовый шунт. Для десатурации жирных кислот требуется кислород, поэтому в прог
рессирование рака этот компонент вносит незначительный вклад в условиях гипоксии. ГАФ - глицеральдегид 3 фосфат;
СЖК - синтаза жирных кислот; ТАГ - триацилглицериды; АК - ац КоА карбоксилаза; СДС - стеароил КоА десатура
за; ЖК - жирные кислоты; нЖК - ненасыщенные жирные кислоты
БИОХИМИЯ том 84 вып. 10 2019
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О МЕТАБОЛИЗМЕ РАКА
1393
фикаций [86], выявленные амплификации в этом
Ацетат также продуцируется в печени путем
участке были направлены, в основном, на один
окислительного катаболизма алкоголя. NAD+
ген и имели низкий процент встречаемости. Та
зависимый распад этанола в ацетальдегид алко
кие «точечные» модификации не объясняют
гольдегидрогеназами происходит главным обра
формирование опухолевого липогенеза. Повы
зом в цитозоле гепатоцитов. Впоследствии ацет
шение эндогенного метаболизма жирных кислот
альдегид диффундирует в митохондриальный
в опухолевых клетках, по видимому, связано с
матрикс и превращается в ацетат в другой реак
модуляцией нескольких липогенных ферментов
ции NAD+ зависимой реакции, катализируемой
на разных уровнях, включая усиление тран
альдегиддегидрогеназами [96]. К сожалению,
скрипции генов, ответственных за липидный об
большинство исследований, посвященных ал
мен и/или усиление стабилизации белков.
коголизму и раку, не изучает влияние ацетата,
Таким образом, метаболизм жирных кислот
полученного из этанола, на образование и рост
значительно активируется в опухолевых клетках
опухоли. Значительное увеличение уровней
и используется ими для обеспечения механиз
циркулирующего ацетата может использоваться
мов прогрессии.
некоторыми типами опухолей (например, клет
ками рака молочной железы, яичников и лег
ких) [97, 98], в которых повышено содержание
АЦЕТАТНЫЙ ОБМЕН
ацетил метаболизирующих ферментов, таких
как ацетил КоА синтетазы.
Пируват, образующийся при неканониче
В настоящее время исследование метаболиз
ском глутаминолизе, или через гликолиз в це
ма ацетата при раке сосредоточено на трех мета
лом, может переноситься в митохондрии и
болических путях: биосинтезе жирных кислот,
превращаться в ацетил КоА комплексом пиру
ЦТК и ацетилировании гистонов.
ватдегидрогеназы. В опухолевых клетках, в ко
торых наблюдается эффект Варбурга, пируват
не переходит в митохондрии [87]. В такой ситу
АЦЕТАТНЫЙ ВКЛАД В СИНТЕЗ
ации для поддержания высокого метаболизма и
ЖИРНЫХ КИСЛОТ
роста раковых клеток синтез ацетил КоА реали
зуется через альтернативные пути, особенно в
В геноме человека существует 26 ацетил
условиях гипоксии. Было установлено, что один
КоА синтетаз (АКС). Среди них три фермента
из таких путей синтеза ацетил КоА приходится
способны катализировать синтез ацетил КоА из
на ацетатный обмен.
ацетата [99, 100]. Ацетат в нормальных тканях в
Первые всесторонние исследования по ме
основном выступает как регулятор углеводного
таболизму ацетата при раке проводили еще в
обмена и его вклад в липогенез незначителен в
1950 х гг. Сиднеем Вайнхаусом. Его исследова
силу того, что АКС, хоть и широко распростра
ния по конкуренции субстрата между глюкозой,
нен в тканях, но экспрессия и активность фер
жирными кислотами и ацетатом показали не
мента в клетке низкая [101]. Иная ситуация об
только то, что ацетат можно использовать для
стоит с опухолевыми клетками.
стимулирования дыхания опухолей, но и то, что
Семейства АКС с короткой цепью, АКС1 и
окисление ацетата, в отличие от жирных кислот,
АКС3, являются митохондриальными фермен
было резистентно к увеличению концентрации
тами, а АКС2 локализуется как в цитоплазмати
глюкозы (например, эффект Кребтри) [88-90].
ческой, так и ядерной фракциях. Подавление
Результаты указывали, что ацетат представляет
экспрессии АКС2 в опухолевых клетках снижа
собой важный субстрат, используемый раковы
ет метаболизм ацетата сильнее, чем подавление
ми клетками.
АКС1 или АКС3. АКС2 высоко экспрессируется
Существуют экзогенные и эндогенные ис
в нескольких опухолях человека, а нокаут АКС2
точники ацетата для разных тканей организма
с помощью shRNA подавляет развитие опухоли
человека [91-93]. Ацетат плазмы у млекопитаю
на модели рака мыши со сверхэкспрессией cMyc
щих вырабатывается путем расщепления пище
в сочетании с нокаутом PTEN [102]. При мета
вых волокон микробиотой кишечника двумя
болическом стрессе, таком как гипоксия и/или
метаболическими путями: сахаролитической
в условиях недостаточного питания, экспрессия
ферментацией или ацетогенезом. В совокупнос
АКС2 повышается, что способствует поглоще
ти подавляющее большинство циркулирующего
нию ацетата для синтеза липидов и мембранных
ацетата, концентрация которого колеблется от
фосфолипидов в нескольких типах рака [103, 104].
50 мкМ до 200 мкМ в плазме человека, непосред
Синтез жирных кислот из ацетата включает в
ственно объясняется прокариотическим мета
себя три ферментативные стадии: лигирование
болизмом в кишечнике [94, 95].
ацетата с КоA с получением ацетил КоА с по
БИОХИМИЯ том 84 вып. 10 2019
1394
КОРШУНОВ и др.
мощью АКС2, карбоксилирование ацетил КоА
деленной степени, ключевая роль ацетата за
ферментом ацетил КоА карбоксилазой α и кон
ключается в ацетилировании гистонов (рис. 3).
денсацию ацетил КоА и/или малонил КоА с по
Роль АКС в регуляции ацетилирования гис
мощью СЖК. Этот ферментативный каскад ра
тонов была впервые определена у дрожжей [84,
ботает в цитозоле и использует цитозольный аце
98]. Было показано, что снижение экспрессии
тил КоА в качестве субстрата. Второй внутрикле
АКС резко уменьшало ацетилирование гистонов
точный пул ацетил КоА содержится в митохон
и вызывало глобальную транскрипционную реп
дриях и не может способствовать липогенезу без
рессию из за уменьшения уровня ацетил КоА
предварительного превращения в цитрат. В отли
пула в цитозоле и ядрах клеток [106]. Абляция
чие от ацетил КоА цитрат может быть перенесен
АКС2 в эмбриональных фибробластах мышей
в цитозоль и расщеплен АЦЛ для регенерации
или РНК опосредованное ингибирование АКС2
оксалоацетата и ацетил КоА. В исследованиях
в линиях раковых клеток также заметно ингиби
ксенотрансплантатов опухолей было установле
рует ацетилирование гистонов ацетатом [98].
но, что истощение АЦЛ ингибирует рост клеточ
И наоборот, добавление ацетата само по себе уве
ных линий с высокой гликолитической актив
личивает ацетилирование гистонов дозо зависи
ностью, и в то же время не влияет на клетки с
мым образом и снижает деацетилирование гисто
низкими скоростями гликолиза, что указывает на
нов, вызванное ингибированием АЦЛ
[99].
наличие альтернативных путей продуцирования
В последнее время показано, что добавление аце
ацетил КоА [105]. Впоследствии было показано,
тата к линиям раковых клеток, культивирован
что АКС2 активируется после истощения АЦЛ и
ных в условиях гипоксии, преимущественно ак
имеет решающее значение для выживания рако
тивирует экспрессию липогенных генов (т.е. аце
вых клеток, лишенных АЦЛ [106].
тил КоА карбоксилазу α и СЖК) путем ацети
В условиях избытка АЦЛ генерирует основ
лирования специфических лизиновых остатков
ную часть цитозольного ацетил КоА пула в
на гистоне H3, а экспрессия АКС1 и АКС2 в тка
большинстве тканей, включая опухоли [101,
нях, полученных от пациентов с гепатоцеллю
105, 106]. Однако метаболические стрессы, та
лярной карциномой, положительно коррелирует
кие как голодание или гипоксия, индуцируют
с ацетилированием гистонов и экспрессией СЖК
фосфорилирование пируватдегидрогеназы его
[108, 109]. Недавние исследования показали, что
киназой и ингибируют окисление пирувата в
кротонилирование гистона частично контроли
ЦТК [103, 104]. Это непосредственно ухудшает
руется экспрессией АКС2, что указывает на то,
производство цитрата (субстрат для АЦЛ) [103],
что субстратная специфичность АКС2 может не
поэтому для поддержания нуклеоцитозольных
ограничиваться только ацетатом [110, 111]. Инте
уровней ацетил КоА необходимо задействовать
ресно, что активация HIF 2 путем ацетилирова
альтернативные источники. Анализ пулов жир
ния при метаболическом стрессе зависит от гене
ных кислот в раковых клетках при метаболиче
рации ядерного ацетил КоА АКС2 [112, 113].
ском стрессе выявил, что опухолевые клетки ис
Из сказанного выше становится очевидно,
пользуют помимо глюкозы и глутамина другой
что метаболизм ацетата играет важную роль во
субстрат для липогенеза [83, 97]. Было показано,
многих различных типах рака. Некоторые опу
что физиологические концентрации ацетата
холи в основном используют его для производ
способны обеспечить половину необходимого
ства энергии, другие - для производства липи
субстрата для поддержки синтеза жирных кис
дов, а также как средство для регулирования
лот в гипоксических условиях, тогда как остав
ацетилирования гистонов и, как следствие,
шийся липогенный ацетил КоА, скорее всего,
транскрипции генов. Однако эти отдельные ме
получен из комбинации источников, включая
таболические пути ацетата не обязательно взаи
глюкозу, глутамин, кетоновые тела и аминокис
моисключают друг друга. Изучение того, почему
лоты с разветвленной цепью.
ткани используют ацетат такими разнообразны
Высокая экспрессия АКС2 часто встречается
ми способами, поможет понять механизм под
при инвазивных протоковых карциномах мо
держки роста опухоли и разработать новые про
лочной железы, трижды негативном раке мо
тивоопухолевые препараты.
лочной железы, глиобластоме, раке яичника,
раке легкого, колоректальном раке, связана с
Обширные исследования по эффекту Вар
низкой дифференцировкой и коррелирует с
бурга, его функции, а также детальное рассмот
плохой выживаемостью по сравнению с опухо
рение анаболических процессов в раковых клет
лями с низкой экспрессией АКС2 [97, 98, 107].
ках изменили наше представление о природе
Однако значение ацетил КоА ацетата не ог
злокачественных новообразований. Благодаря
раничивается ролью биоэнергетического суб
трансформации на уровне энергообеспечения
страта и липогенного предшественника. В опре
раковые клетки имеют конкурентное преиму
БИОХИМИЯ том 84 вып. 10 2019
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О МЕТАБОЛИЗМЕ РАКА
1395
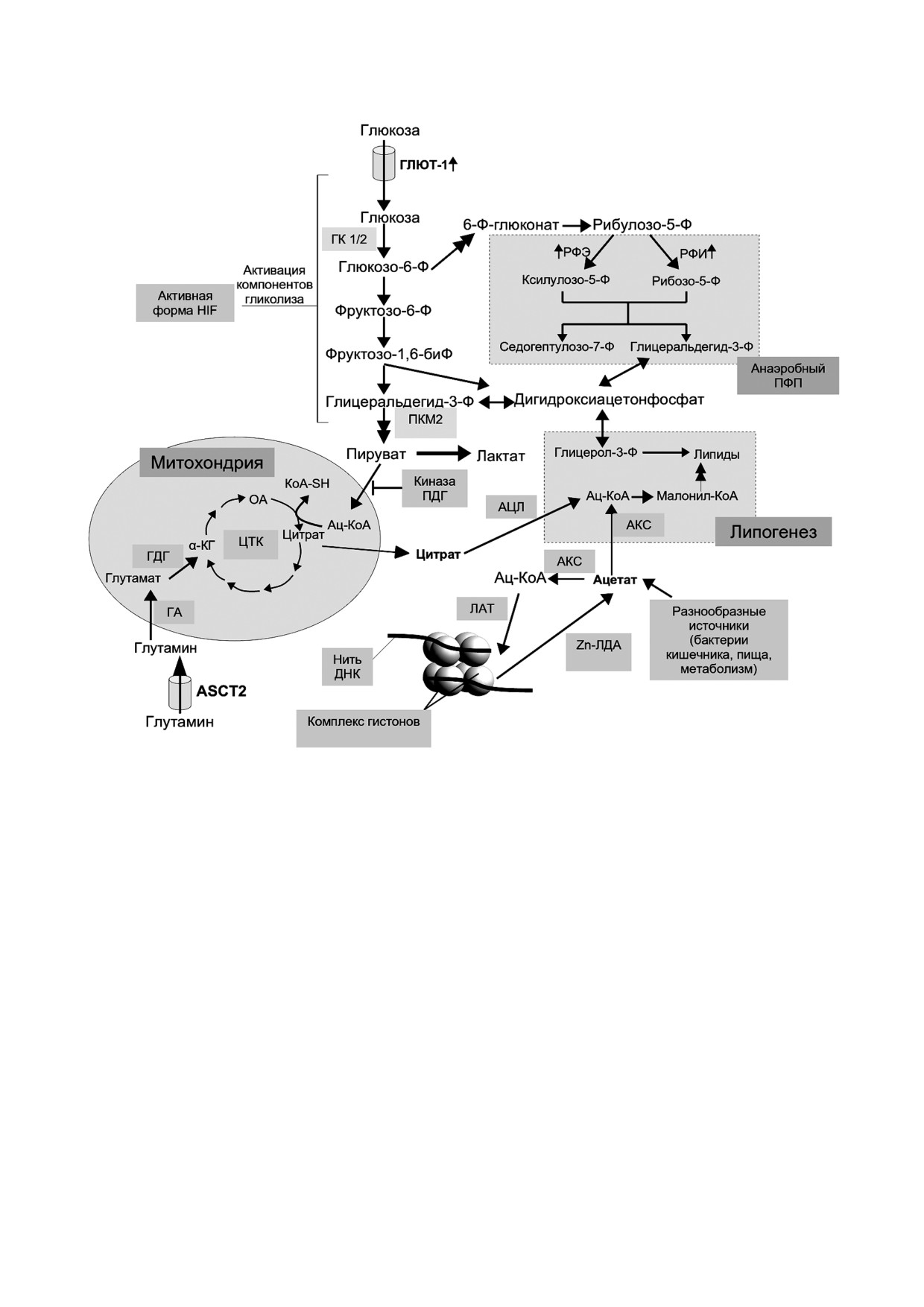
Рис. 3. Вклад ацетатного обмена в общую картину метаболизма при раке. Измененный обмен глюкозы поддерживает ги
перплазию опухолевых клеток как с катаболической, так и анаболической стороны. Глутамин активно поддерживает ли
погенез. В то же время ацетат дает дополнительный прирост Ац КоА для нужд клеток, в частности, обеспечивая ацетили
рование гистонов. ASCT2 - аминокислотный транспортер 2 типа ASC; ГА - глутаминаза; ГДГ - глутаматдегидрогеназа;
ОА - оксалоацетат; α КГ - α кетоглуторат; ГЛЮТ - транспортер глюкозы; HIF - гипоксия индуцибельный фактор; ГК
- гексокиназа; ПКМ2 - пируваткиназа М2; ПДГ - пируватдегидрогеназа; ПФП - пентозофосфатный путь; РФЭ - ри
булозо 5 фосфат 3 эпимераза; РФИ - рибулозо 5 фосфатизомераза; АЦЛ - АТФ цитратлиаза; АКС - ацетил КоА син
тетаза; ЛАТ - лизинацетилтрансфераза; Zn ЛДА - цинк зависимая лизиндеацетилаза
щество по сравнению с нормальной тканью.
в сравнении с нормальными обладают выражен
Высокий уровень липогенеза в опухолях за счет
ной пластичностью, позволяющей даже в усло
повышенного обмена глюкозы, глутамина и
виях метаболического стресса обеспечивать вы
ацетата независимо от уровня внеклеточных ли
сокий уровень обмена веществ. Однако вопрос о
пидов поддерживает агрессивный рост опухо
механизмах регуляции ответственных за актива
лей. Усиление активности компонентов пенто
цию этих процессов остается открытым, так как
зофосфатного пути позволяет синтезировать
установленные механизмы канцерогенеза не
нуклеиновые кислоты на высокой скорости, да
могут в полной мере объяснить многочислен
вая при этом прирост NADPH, необходимый
ные метаболические перестройки в опухолевых
как для синтеза жирных кислот, так и для выжи
клетках.
ваемости клеток в условиях окислительного
Открытие и изучение метаболического пе
стресса. Можно сказать, что опухолевые клетки репрограммирования опухолевых клеток стиму
БИОХИМИЯ том 84 вып. 10 2019
1396
КОРШУНОВ и др.
лировало поиск новых противоопухолевых ан
ния злокачественного заболевания на контро
тиметаболитов. В настоящее время множество
лируемый или способствовать полному излече
ингибиторов антиметаболического класса нахо
нию.
дятся на клинической стадии исследования, по
казав выраженный противоопухолевый эффект.
Конфликт интересов. Авторы заявляют, что у
Ключевой результат этих исследований откроет
них нет конфликта интересов.
перед нами возможность новых вариантов тера
Соблюдение этических норм. Данная статья
пии рака, которые в своем потенциале могут из
не содержит исследований, в которых в качестве
менить нынешний статус тяжелой формы тече
объектов использовали людей или животных.
СПИСОК ЛИТЕРАТУРЫ
1.
Warburg, O. (1925) The metabolism of carcinoma cells,
14.
Yu, F., White, S.B., Zhao, Q., and Lee, F.S.
(2001)
J. Cancer Res., 9, 148-163, doi: 10.1158/jcr.1925.148.
HIF-1alpha binding to VHL is regulated by stimulus sen
2.
De Berardinis, R.J., and Chandel, N.S.
(2016)
sitive proline hydroxylation, Proc. Natl. Acad. Sci. USA, 98,
Fundamentals of cancer metabolism, Sci. Adv.,
2,
9630-9635, doi: 10.1073/pnas.181341498.
e1600200, doi: 10.1126/sciadv.1600200.
15.
Semenza, G.L. (2010) HIF 1: upstream and downstream
3.
Kuhajda, F.P., Jenner, K., Wood, F.D., Hennigar, R.A.,
of cancer metabolism, Curr. Opin. Genet. Dev., 20, 51-56,
Jacobs, L.B., Dick, J.D., and Pasternack, G.R. (1994)
doi: 10.1016/j.gde.2009.10.009.
Fatty acid synthesis: a potential selective target for antineo
16.
Bergeron, M., Gidday, J.M., Yu, A.Y., Semenza, G.L.,
plastic therapy, Proc. Natl. Acad. Sci. USA, 5, 6379-6383.
Ferriero, D.M., and Sharp, F.R. (2000) Role of hypoxia
4.
Hanahan, D., and Weinberg, R.A. (2011) Hallmarks of
inducible factor 1 in hypoxia induced ischemic tolerance
cancer: the next generation, Cell,
144,
646-674,
in neonatal rat brain, Ann. Neurol.,
48,
285-296,
doi: 10.1016/j.cell.2011.02.013.
doi: 10.1002/1531 8249(200009)48:3<285::AID ANA2>3.0.
5.
Liberti, M.V., and Locasale, J.W. (2016) The warburg
CO;2 8.
effect: how does it benefit cancer cells? Trends
17.
Maxwell, P.H., Pugh, C.W., and Ratcliffe, P.J. (2001)
Biochem. Sci.,
41,
211-218, doi:
10.1016/j.tibs.
Activation of the HIF pathway in cancer, Curr. Opin. Genet.
2015.12.001.
Dev., 11, 293-299, doi: 10.1016/S0959 437X(00)00193 3.
6.
Ganapathy Kanniappan, S. (2019) Molecular intricacies
18.
Ciuffreda, L., Falcone, I., Incani, U.C., Del Curatolo, A.,
of aerobic glycolysis in cancer: current insights into the
Conciatori, F., Matteoni, S., Vari, S., Vaccaro, V.,
classic metabolic phenotype, Crit. Rev. Biochem. Mol. Biol.,
Cognetti, F., and Milella, M. (2014) PTEN expression and
53, 667-682, doi: 10.1080/10409238.2018.1556578.
function in adult cancer stem cells and prospects for thera
7.
Ruprecht, B., Zaal, E.A., Zecha, J., Wu, W., Berkers,
peutic targeting, Adv. Biol. Regul., 56, 66-80, doi: 10.1016/
C.R., Kuster, B., and Lemeer, S. (2017) Lapatinib resis
j.jbior.2014.07.002.
tance in breast cancer cells is accompanied by phosphory
19.
Hudson, C.C., Liu, M., Chiang, G.G., Otterness, D.M.,
lation mediated reprogramming of glycolysis, Cancer Res.,
Loomis, D.C., Kaper, F., Giaccia, A.J., and Abraham, R.T.
77, 1842-1853, doi: 10.1158/0008 5472.CAN 16 2976.
(2002) Regulation of hypoxia inducible factor 1 alpha
8.
Hudson, C.D., Hagemann, T., Mather, S.J., and Avril, N.
expression and function by the mammalian target of
(2014) Resistance to the tyrosine kinase inhibitor axitinib is
rapamycin, Mol. Cell. Biol., 22, 7004-7014, doi: 10.1128/
associated with increased glucose metabolism in pancreat
MCB.22.20.7004 7014.2002.
ic adenocarcinoma, Cell Death Dis., 5, 1160, doi: 10.1038/
20.
Woo, Y.M., Shin, Y., Lee, E.J., Lee, S., Jeong, S.H., Kong,
cddis.2014.125.
H.K., Park, E.Y., Kim, H.K., Han, J., Chang, M., and
9.
Qian, X., Xu, W., Xu, J., Shi, Q., Li, J., Weng, Y. Jiang, Z.,
Park, J.H. (2015) Inhibition of aerobic glycolysis represses
Feng, L., Wang, X., Zhou, J., and Jin, H. (2017) Enolase 1
Akt/mTOR/HIF 1α axis and restores tamoxifen sensitivi
stimulates glycolysis to promote chemoresistance in gastric
ty in antiestrogen resistant breast cancer cells, PLoS One,
cancer, Oncotarget, 8, 47691-47708, doi: 10.18632/onco
10, e0132285, doi: 10.1371/journal.pone.0132285.
target.17868.
21.
Wilson, J.E. (2003) Isozymes of mammalian hexokinase:
10.
Ye, M., Wang, S., Wan, T., Jiang, R., Qiu, Y., Pei, L., Pang, N.,
structure, subcellular localization and metabolic function,
Huang, Y., Huang, Y., Zhang, Z., and Yang, L. (2017)
J. Exp. Biol., 206, 2049-2057, doi: 10.1242/jeb.00241.
Combined inhibitions of glycolysis and AKT/autophagy
22.
Tsai, H.J., and Wilson, J.E. (1996) Functional organization
can overcome resistance to EGFR targeted therapy of lung
of mammalian hexokinases: both N and C terminal halves
cancer, J. Cancer, 8, 3774-3784, doi: 10.7150/jca.21035.
of the rat type II isozyme possess catalytic sites, Arch.
11.
Deng, X., Li, Z., Xiong, R., Liu, J., Liu, R., Peng, J.,
Biochem. Biophys., 329, 17-23, doi: 10.1006/abbi.1996.
Chen, Y., Lei, X., Cao, X., Zheng, X., Xie, Z., and Tang, G.
0186.
(2019) FS 7 inhibits MGC 803 cells growth in vitro and in
23.
Wolf, A., Agnihotri, S., Micallef ,J., Mukherjee, J., Sabha,
vivo via downregulating glycolysis, Biomed. Pharmacother.,
N., Cairns, R., Hawkins, C., and Guha, A.
(2011)
109, 1659-1669, doi: 10.1016/j.biopha.2018.11.001.
Hexokinase 2 is a key mediator of aerobic glycolysis and
12.
He, C., Wang, L., Zhang, J., and Xu, H. (2017) Hypoxia
promotes tumor growth in human glioblastoma multi
inducible microRNA 224 promotes the cell growth,
forme, J. Exp. Med., 208, 313-326, doi: 10.1084/jem.
migration and invasion by directly targeting RASSF8 in
20101470.
gastric cancer, Mol. Cancer, 16, 35, doi: 10.1186/s12943
24.
Mathupala, S.P., Ko, Y.H., and Pedersen, P.L. (2006)
017 0603 1.
Hexokinase II: cancer's double edged sword acting as both
13.
Xuan, Y., and Wang, Y.N. (2017) Hypoxia/IL 1α axis pro
facilitator and gatekeeper of malignancy when bound to
motes gastric cancer progression and drug resistance,
mitochondria, Oncogene, 25, 4777-4786, doi: 10.1038/
J. Dig. Dis., 18, 511-520, doi: 10.1111/1751 2980.12496.
sj.onc.1209603.
БИОХИМИЯ том 84 вып. 10 2019
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О МЕТАБОЛИЗМЕ РАКА
1397
25.
Mathupala, S.P, Ko, Y.H, and Pedersen, P.L. (2009)
tor for hypoxia inducible factor 1, Cell, 145, 732-744,
Hexokinase 2 bound to mitochondria: cancer’s stygian
doi: 10.1016/j.cell.2011.03.054.
link to the “Warburg Effect” and a pivotal target for effec
40.
Lu, H., Forbes, R.A., and Verma, A. (2002) Hypoxia
tive
therapy,
Semin.
Cancer Biol.,
17-24,
inducible factor 1 activation by aerobic glycolysis impli
doi: 10.1016/j.semcancer.2008.11.006.
cates the Warburg effect in carcinogenesis, J. Biol. Chem.,
26.
Lu, J., Wang, L., Chen, W., Wang, Y., Zhen, S., Chen, H.,
277, 23111-23115, doi: 10.1074/jbc.M202487200.
Cheng, J., Zhou, Y., Li, X., and Zhao, L. (2019) miR 603
41.
Mazurek, S., Boschek, C.B., Hugo F., and Eigenbrodt, E.
targeted hexokinase 2 to inhibit the malignancy of ovarian
(2005) Pyruvate kinase type M2 and its role in tumor
cancer cells, Arch. Biochem. Biophys., 661, 1-9, doi: 10.
growth and spreading, Semin. Cancer Biol., 15, 300-308,
1016/j.abb.2018.10.014.
doi: 10.1016/j.semcancer.2005.04.009.
27.
Baumann, M., Kappl, A., Lang, T., Brand, K., Siegfried, W.,
42.
Christofk, H.R., Vander Heiden, M.G., Wu, N., Asara,
and Paterok, E. (1990) The diagnostic validity of the serum
J.M., and Cantley, L.C. (2008) Pyruvate kinase M2 is a
tumor marker phosphohexose isomerase (PHI) in patients
phosphotyrosine binding protein, Nature, 452, 181-186,
with gastrointestinal, kidney, and breast cancer, Cancer
doi: 10.1038/nature06667.
Invest., 8, 351-356, doi: 10.3109/07357909009012053.
43.
Christofk, H.R., Vander Heiden, M.G., Harris, M.H.,
28.
Niinaka, Y., Paku, S., Haga, A., Watanabe, H., and Raz, A.
Ramanathan, A., Gerszten, R.E., Wei, R., Fleming, M.D.,
(1998) Expression and secretion of neuroleukin/phospho
Schreiber, S.L., and Cantley, L.C. (2008) The M2 splice
hexose isomerase/maturation factor as autocrine motility
isoform of pyruvate kinase is important for cancer metabo
factor by tumor cells, Cancer Res., 58, 2667-2674.
lism and tumour growth, Nature,
452,
230-233,
29.
Funasaka, T., Haga, A., Raz, A., and Nagase, H. (2001)
doi: 10.1038/nature06734.
Tumor autocrine motility factor is an angiogenic factor
44.
Mushtaq, M., Darekar, S., and Kashuba, E. (2016) DNA
that stimulates endothelial cell motility, Biochem. Biophys.
Tumor viruses and cell metabolism, Oxid. Med. Cell
Res. Commun., 284, 1116-1125, doi: 10.1006/bbrc.2001.
Longev., 2016, article ID 6468342, doi: 10.1155/2016/
5135.
6468342.
30.
Yanagawa, T., Funasaka, T., Tsutsumi, S., Watanabe, H.,
45.
Stincone, A., Prigione, A., Cramer, T., Wamelink, M.M.
and Raz, A. (2004) Novel roles of the autocrine motility
C., Campbell, K., Cheung, E., Olin Sandoval, V.,
factor/phosphoglucose isomerase in tumor malignancy,
Gruning, N.M., Kruger, A., Tauqeer Alam, M., Keller,
Endocr. Relat. Cancer, 11, 749-759, doi: 10.1677/erc.
M.A., Breitenbach, M., Brindle, K.M., Rabinowitz, J.D.,
1.00811.
and Ralser, M. (2014) The return of metabolism: biochem
31.
Tsutsumi, S., Fukasawa, T., Yamauchi, H., Kato, T.,
istry and physiology of the pentose phosphate pathway,
Kigure, W., Morita, H., Asao, T., and Kuwano, H. (2009)
Biol. Rev. Camb. Philos. Soc., 90, 927-963, doi:
10.
Phosphoglucose isomerase enhances colorectal cancer
1111/brv.12140.
metastasis, Int. J. Oncol., 35, 1117-1121, doi: 10.3892/ijo_
46.
Vucetic, M., Cormerais, Y., Parks, S.K., and Pouyssegur, J.
00000427.
(2017) The central role of amino acids in cancer redox
32.
Funasaka, T., Yanagawa, T., Hogan, V., and Raz, A. (2005)
homeostasis: vulnerability points of the cancer redox code,
Regulation of phosphoglucose isomerase/autocrine motil
Front. Oncol., 7, 319, doi: 10.3389/fonc.2017.00319.
ity factor expression by hypoxia, FASEB J., 19, 1422-1430,
47.
Shin, Y.K., Yoo, B.C., Hong, Y.S., Chang, H.J., Jung,
doi: 10.1096/fj.05 3699com.
K.H., Jeong, S.Y., and Park, J.G. (2009) Upregulation of
33.
Funasaka, T., Hu, H., Yanagawa, T., Hogan, V., and Raz, A.
glycolytic enzymes in proteins secreted from human colon
(2007) Down regulation of phosphoglucose isomerase/
cancer cells with 5 fluorouracil resistance, Electrophoresis,
autocrine motility factor results in mesenchymal to
30, 2182-2192, doi: 10.1002/elps.200800806.
epithelial transition of human lung fibrosarcoma cells,
48.
Jones, N.P., and Schulze, A. (2012) Targeting cancer
Cancer Res.,
67,
4236-4243, doi:
10.1158/0008
metabolism aiming at a tumour's sweet spot, Drug Discov.
5472.CAN 06 3935.
Today, 17, 232-241, doi: 10.1016/j.drudis.2011.12.017.
34.
Shih, W.L., Liao, M.H., Yu, F.L., Lin, P.Y., Hsu, H.Y., and
49.
Locasale, J.W. (2013) Serine, glycine and one carbon
Chiu, S.J. (2008) AMF/PGI transactivates the MMP 3
units: cancer metabolism in full circle, Nat. Rev. Cancer,
gene through the activation of Src RhoA phosphatidyli
13, 572-583, doi: 10.1038/nrc3557.
nositol 3 kinase signaling to induce hepatoma cell migra
50.
Yuan, L., Sheng, X., Willson, A.K., Roque, D.R., Stine,
tion, Cancer Lett., 270, 202-217, doi: 10.1016/j.can
J.E., Guo, H., Jones, H.M., Zhou, C., and Bae Jump,
let.2008.05.005.
V.L. (2015) Glutamine promotes ovarian cancer cell prolif
35.
Song, S., and Finkel, T. (2007) GAPDH and the search for
eration through the mTOR/S6 pathway, Endocr. Relat.
alternative energy, Nat. Cell. Biol.,
9,
869-870,
Cancer, 22, 577-5791, doi: 10.1530/ERC 15 0192.
doi: 10.1038/ncb0807 869.
51.
Gonzalez Herrera, K.N., Lee, J., and Haigis, M.C. (2015)
36.
Bagui, S., Ray, M., and Ray, S. (1999) Glyceraldehyde 3
Intersections between mitochondrial sirtuin signaling and
phosphate dehydrogenase from Ehrlich ascites carcinoma
tumor cell metabolism, Crit. Rev. Biochem. Mol. Biol., 50,
cells its possible role in the high glycolysis of malignant
242-255, doi: 10.3109/10409238.2015.1031879.
cells, Eur. J. Biochem., 262, 386-395, doi: 10.1046/j.1432
52.
Gross, M.I., Demo, S.D., Dennison, J.B., Chen, L.,
1327.1999.00384.x.
Chernov Rogan, T., Goyal, B., Janes, J.R., Laidig, G.J.,
37.
Mazurek, S. (2011) Pyruvate kinase type M2: a key regula
Lewis, E.R., Li, J., Mackinnon, A.L., Parlati, F.,
tor of the metabolic budget system in tumor cells, Int. J.
Rodriguez, M.L., Shwonek, P.J., Sjogren, E.B., Stanton,
Biochem. Cell Biol., 43, 969-980, doi: 10.1016/j.bio
T.F., Wang, T., Yang, J., Zhao, F., and Bennett, M.K.
cel.2010.02.005.
(2014) Antitumor activity of the glutaminase inhibitor
38.
Dombrauckas, J.D., Santarsiero, B.D., and Mesecar, A.D.
CB 839 in triple negative breast cancer, Mol. Cancer Ther.,
(2005) Structural basis for tumor pyruvate kinase M2
13, 890-901, doi: 10.1158/1535 7163.MCT 13 0870.
allosteric regulation and catalysis, Biochemistry, 44,
53.
Qing, G., Li, B., Vu, A., Skuli, N., Walton, Z.E., Liu, X.,
9417-9429, doi: 10.1021/bi0474923.
Mayes, P.A., Wise, D.R., Thompson, C.B., and Maris, J.M.
39.
Luo, W., Hu, H., Chang, R., Zhong, J., Knabel, M.,
(2012) ATF4 regulates MYC mediated neuroblastoma cell
O’Meally, R., Cole, R.N., Pandey, A., and Semenza, G.L.
death upon glutamine deprivation, Cancer Cell, 22,
(2011) Pyruvate kinase M2 is a PHD3 stimulated coactiva
631-644, doi: 10.1016/j.ccr.2012.09.021.
БИОХИМИЯ том 84 вып. 10 2019
1398
КОРШУНОВ и др.
54.
Cheng, T., Sudderth, J., Yang, C., Mullen, A.R., Jin, E.S.,
PGC 1α/PPARα regulatory pathway, Cell Metab., 4,
Mates, J.M., and De Berardinis, R.J. (2011) Pyruvate car
199-210, doi: 10.1016/j.cmet.2006.08.005.
boxylase is required for glutamine independent growth of
67.
Brown, M.S., and Goldstein, J.L. (1997) The SREBP
tumor cells, Proc. Natl. Acad. Sci. USA, 108, 8674-8679,
pathway: regulation of cholesterol metabolism by proteoly
doi: 10.1073/pnas.1016627108.
sis of a membrane bound transcription factor, Cell, 89,
55.
Zaidi, N., Swinnen, J.V., and Smans, K. (2012) ATP cit
331-340, doi: 10.1016/S0092 8674(00)80213 5.
rate lyase: a key player in cancer metabolism, Cancer Res.,
68.
Peterson T.R., Sengupta S.S., Harris T.E., Carmack A.E.,
72, 3709-3714, doi: 10.1158/0008 5472.CAN 11 4112.
Kang S.A., Balderas E., Guertin D.A., Madden K.L.,
56.
Brownsey, R.W., Boone, A.N., Elliott, J.E., Kulpa, J.E.,
Carpenter A.E., Finck B.N., and Sabatini D.M. (2011)
and Lee, W.M. (2006) Regulation of acetyl CoA carboxy
mTOR complex 1 regulates lipin 1 localization to control
lase, Biochem. Soc. Trans.,
34,
223-227, doi:
10.
the SREBP pathway, Cell, 146, 408-420, doi: 10.1016/j.
1042/BST20060223.
cell.2011.06.034.
57.
Maier, T., Leibundgut, M., and Ban, N. (2008) The crystal
69.
Han, J., Li, E., Chen, L., Zhang, Y., Wei, F., Liu, J., Deng, H.,
structure of a mammalian fatty acid synthase, Science, 321,
and Wang, Y. (2015) The CREB coactivator CRTC2 con
1315-1322, doi: 10.1126/science.1161269.
trols hepatic lipid metabolism by regulating SREBP1,
58.
Jakobsson, A., Westerberg, R., and Jacobsson, A. (2006)
Nature, 524, 243-246, doi: 10.1038/nature14557.
Fatty acid elongases in mammals: their regulation and roles
70.
Welcker, M., and Clurman, B.E. (2008) FBW7 ubiquitin
in metabolism, Prog. Lipid Res., 45, 237-249, doi: 10.
ligase: a tumour suppressor at the crossroads of cell divi
1016/j.plipres.2006.01.004.
sion, growth and differentiation, Nat. Rev. Cancer, 8,
59.
Yue, S., Li, J., Lee, S.Y., Lee, H.J., Shao, T., Song, B.,
83-89, doi: 10.1038/nrc2290.
Cheng, L., Masterson, T.A., Liu, X., Ratliff, T.L., and
71.
Sundqvist, A., Bengoechea Alonso, M.T., Ye, X., Luki
Cheng, J.X.
(2014) Cholesteryl ester accumulation
yanchuk, V., Jin, J., Harper, J.W., and Ericsson, J. (2005)
induced by PTEN loss and PI3K/AKT activation underlies
Control of lipid metabolism by phosphorylation depen
human prostate cancer aggressiveness, Cell Metab., 19,
dent degradation of the SREBP family of transcription fac
393-406, doi: 10.1016/j.cmet.2014.01.019.
tors by SCF(Fbw7), Cell Metab., 1, 379-391, doi: 10.1016/
60.
Li, J. Bosch Marce, M., Nanayakkara, A., Savransky, V.,
j.cmet.2005.04.010.
Fried, S.K., Semenza, G.L., and Polotsky, V.Y. (2006)
72.
Bengoechea Alonso, M.T., and Ericsson, J. (2009) A phos
Altered metabolic responses to intermittent hypoxia in
phorylation cascade controls the degradation of active
mice with partial deficiency of hypoxia inducible factor
SREBP1, J. Biol. Chem., 284, 5885-5895, doi: 10.1074/
1α, Physiol. Genom., 25, 450-457, doi: 10.1152/physiolge
jbc.M807906200.
nomics.00293.2005.
73.
Dang, C.V. (2012) MYC on the path to cancer, Cell, 149,
61.
Lewis, C.A., Brault, C., Peck, B. Bensaad, K., Griffiths, B.,
22-35, doi: 10.1016/j.cell.2012.03.003.
Mitter, R., Chakravarty, P., East, P., Dankworth, B.,
74.
Ventura, R., Mordec, K., Waszczuk, J., Wang, Z., Lai, J.,
Alibhai, D., Harris, A.L., and Schulze, A. (2015) SREBP
Fridlib, M., Buckley, D., Kemble, G., and Heuer, T.S.
maintains lipid biosynthesis and viability of cancer cells
(2015) Inhibition of de novo palmitate synthesis by fatty
under lipid and oxygen deprived conditions and defines a
acid synthase induces apoptosis in tumor cells by remodel
gene signature associated with poor survival in glioblastoma
ing cell membranes, inhibiting signaling pathways, and
multiforme, Oncogene, 43, 5128-5140, doi: 10.1038/onc.
reprogramming gene expression, EBioMedicine, 2, 806-820,
2014.439.
doi: 10.1016/j.ebiom.2015.06.020.
62.
Amemiya Kudo, M., Shimano, H., Hasty, A.H., Yahagi,
75.
Cai, Y. Crowther, J., Pastor, T., Abbasi Asbagh, L., Baietti,
N., Yoshikawa, T., Matsuzaka, T., Okazaki, H., Tamura,
M.F., De Troyer, M., Vazquez, I., Talebi, A., Renzi, F.,
Y., Iizuka, Y., Ohashi, K., Osuga, J., Harada, K., Gotoda,
Dehairs, J., Swinnen, J.V., and Sablina, A.A. (2016) Loss
T., Sato, R., Kimura, S., Ishibashi, S., and Yamada, N.
of chromosome 8p governs tumor progression and drug
(2002) Transcriptional activities of nuclear SREBP 1a,
response by altering lipid metabolism, Cancer Cell, 29,
1c, and
2 to different target promoters of lipogenic and
751-766, doi: 10.1016/j.ccell.2016.04.003.
cholesterogenic genes, J. Lipid Res., 43, 1220-1235,
76.
Nohturfft, A., and Zhang, S.C. (2009) Coordination of lipid
doi: 10.1194/jlr.M100417 JLR200.
metabolism in membrane biogenesis, Annu. Rev. Cell Dev. Biol.,
63.
Shimano, H., Yahagi, N., Amemiya Kudo, M., Hasty, A.H.,
25, 539-566, doi: 10.1146/annurev.cellbio.24.110707.175344.
Osuga, J., Tamura, Y., Shionoiri, F., Iizuka, Y., Ohashi, K.,
77.
Espenshade, P.J., and Hughes, A.L. (2007) Regulation of
Harada, K., Gotoda, T., Ishibashi, S., and Yamada, N.
sterol synthesis in eukaryotes, Annu. Rev. Genet., 41,
(1999) Sterol regulatory element binding protein 1 as a
401-427, doi: 10.1146/annurev.genet.41.110306.130315.
key transcription factor for nutritional induction of
78.
Horton, J.D., Goldstein, J.L., and Brown, M.S. (2002)
lipogenic enzyme genes, J. Biol. Chem., 274, 35832-35839,
SREBPs: activators of the complete program of cholesterol
doi: 10.1074/jbc.274.50.35832.
and fatty acid synthesis in the liver, J. Clin. Invest., 109,
64.
Walker, A.K., Jacobs, R.L., Watts, J.L., Rottiers, V., Jiang,
1125-1131, doi: 10.1172/JCI15593.
K., Finnegan, D.M., Shioda, T., Hansen, M., Yang, F.,
79.
Papandreou, I., Cairns, R.A., Fontana, L., Lim, A.L., and
Niebergall, L.J., Vance, D.E., Tzoneva, M., Hart, A.C.,
Denko, N.C. (2006) HIF 1 mediates adaptation to hypox
and Naar, A.M. (2011) A conserved SREBP 1/Phos
ia by actively downregulating mitochondrial oxygen con
phatidylcholine feedback circuit regulates lipogenesis in
sumption, Cell Metab., 3, 187-197, doi: 10.1016/j.cmet.
metazoans, Cell,
147,
840-852, doi:
10.1016/j.cell.
2006.01.012.
2011.09.045.
80.
Wise, D.R., Ward, P.S., Shay, J.E., Cross, J.R., Gruber, J.J.,
65.
Porstmann, T., Santos, C.R., Griffiths, B., Cully, M., Wu,
Sachdeva, U.M., Platt, J.M., DeMatteo, R.G., Simon, M.C.,
M., Leevers, S., Griffiths, J.R., Chung, Y.L., and Schulze, A.
and Thompson, C.B. (2011) Hypoxia promotes isocitrate
(2008) SREBP activity is regulated by mTORC1 and con
dehydrogenase dependent carboxylation of α ketoglu
tributes to Akt dependent cell growth, Cell Metab., 8,
tarate to citrate to support cell growth and viability, Proc.
224-236, doi: 10.1016/j.cmet.2008.07.007.
Natl. Acad. Sci. USA, 108, 19611-19616, doi: 10.1073/
66.
Finck, B.N., Gropler, M.C., Chen, Z., Leone, T.C.,
pnas.1117773108.
Croce, M.A., Harris, T.E., Lawrence, J.C. Jr., and Kelly,
81.
Metallo, C.M., Gameiro, P.A., Bell, E.L., Mattaini, K.R.,
D.P. (2006) Lipin 1 is an inducible amplifier of the hepatic
Yang, J., Hiller, K., Jewell, C.M., Johnson, Z.R., Irvine,
БИОХИМИЯ том 84 вып. 10 2019
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О МЕТАБОЛИЗМЕ РАКА
1399
D.J., Guarente, L., Kelleher, J.K., Vander Heiden, M.G.,
97. Rocco, A., Compare, D., Angrisani, D., Sanduzzi
Iliopoulos, O., and Stephanopoulos, G. (2011) Reductive
Zamparelli, M., and Nardone, G. (2014) Alcoholic dis
glutamine metabolism by IDH1 mediates lipogenesis
ease: liver and beyond, World J. Gastroenterol., 20,
under hypoxia, Nature, 481, 380-384, doi: 10.1038/
14652-14659, doi: 10.3748/wjg.v20.i40.14652.
nature10602.
98. Schug, Z.T. Peck, B., Jones, D.T., Zhang, Q., Grosskurth, S.,
82.
Kamphorst, J. J., Chung, M.K., Fan, J., and Rabinowitz, J.D.
Alam, I.S., Goodwin, L.M., Smethurst, E., Mason, S.,
(2014) Quantitative analysis of acetyl CoA production in
Blyth, K., McGarry, L., James, D., Shanks, E., Kalna, G.,
hypoxic cancer cells reveals substantial contribution from
Saunders, R.E., Jiang, M., Howell, M., Lassailly, F.,
acetate, Cancer Metab., 2, 23, doi: 10.1186/2049 3002 2
Thin, M.Z., Spencer Dene, B., Stamp, G., van den
23.
Broek, N.J., Mackay, G., Bulusu, V., Kamphorst, J.J.,
83.
Kamphorst, J. J., Cross, J.R., Fan, J., de Stanchina, E.,
Tardito, S., Strachan, D., Harris, A.L., Aboagye, E.O.,
Mathew, R., White, E.P., Thompson, C.B., and
Critchlow, S.E., Wakelam, M.J., Schulze, A., and Gottlieb, E.
Rabinowitz, J.D. (2013) Hypoxic and Ras transformed
(2015) Acetyl CoA synthetase 2 promotes acetate utiliza
cells support growth by scavenging unsaturated fatty acids
tion and maintains cancer cell growth under metabolic
from lysophospholipids, Proc. Natl. Acad. Sci. USA, 110,
stress, Cancer Cell, 27, 57-71, doi: 10.1016/j.ccell.2014.
8882-8887, doi: 10.1073/pnas.1307237110.
12.002.
84.
Bensaad, K., Favaro, E., Lewis, C.A., Peck, B., Lord, S.,
99. Comerford, S.A., Huang, Z., Du, X., Wang, Y., Cai, L.,
Collins, J.M., Pinnick, K.E., Wigfield, S., Buffa, F.M., Li,
Witkiewicz, A.K., Walters, H., Tantawy, M.N., Fu, A.,
J.L., Zhang, Q., Wakelam, M.J.O., Karpe, F., Schulze, A.,
Manning, H.C., Horton, J.D., Hammer, R.E., McKnight, S.L.,
and Harris, A.L. (2014) Fatty acid uptake and lipid storage
and Tu, B.P. (2014) Acetate dependence of tumors, Cell,
induced by HIF 1α contribute to cell growth and survival
159, 1591-1602, doi: 10.1016/j.cell.2014.11.020.
after hypoxia reoxygenation, Cell Rep., 9, 349-365,
100. Wellen, K.E., Hatzivassiliou, G., Sachdeva, U.M., Bui, T.V.,
doi: 10.1016/j.celrep.2014.08.056.
Cross, J.R., and Thompson, C.B. (2009) ATP citrate lyase
85.
Michiels, C., Tellier, C., and Feron, O. (2016) Cycling
links cellular metabolism to histone acetylation, Science,
hypoxia: a key feature of the tumor microenvironment,
324, 1076-1080, doi: 10.1126/science.1164097.
Biochim. Biophys. Acta, 1866, 76-86, doi: 10.1016/j.
101.
Canfora, E.E., and Blaak, E.E. (2017) Acetate: a diet derived
bbcan.2016.06.004.
key metabolite in energy metabolism: good or bad in context of
86.
Sinclair, C., Rowley, M., Naderi, A., and Couch, F. (2003)
obesity and glucose homeostasis? Curr. Opin. Clin. Nutr. Metab.
The 17q23 amplicon and breast cancer, Breast Cancer Res.
Care, 20, 477-483, doi: 10.1097/MCO.0000000000000408.
Treat., 78, 313-322, doi: 10.1023/A:1023081624133.
102. Bauer, D.E., Hatzivassiliou, G., Zhao, F., Andreadis, C.,
87.
Korshunov, D.A., Korshunova, Z.V., and Kondakova, I.V.
and Thompson, C.B. (2005) ATP citrate lyase is an impor
(2016) Inhibitors of carbohydrate metabolism in cancer
tant component of cell growth and transformation,
therapy, Mol. Med., 14, 3-7.
Oncogene, 24, 6314-6322, doi: 10.1038/sj.onc.1208773.
88.
Medes, G., Friedmann, B., and Weinhouse, S. (1956)
103. Kim, J.W., Tchernyshyov, I., Semenza, G.L., and Dang,
Fatty acid metabolism. VIII. Acetate metabolism in vitro
C.V. (2006) HIF 1 mediated expression of pyruvate
during hepatocarcinogenesis by p dimethylaminoazoben
dehydrogenase kinase: a metabolic switch required for cel
zene, Cancer Res., 16, 57-62.
lular adaptation to hypoxia, Cell Metab., 3, 177-185,
89.
Medes, G., and Weinhouse, S. (1958) Metabolism of neo
doi: 10.1016/j.cmet.2006.02.002.
plastic tissue. XIII. Substrate competition in fatty acid oxi
104. Spriet, L.L., Tunstall, R.J., Watt, M.J., Mehan, K.A.,
dation in ascites tumor cells, Cancer Res., 18, 352-359.
Hargreaves, M., and Cameron Smith, D. (2004) Pyruvate
90.
Medes, G., Paden, G., and Weinhouse, S.
(1957)
dehydrogenase activation and kinase expression in human
Metabolism of neoplastic tissues. XI. Absorption and oxi
skeletal muscle during fasting, J. Appl. Physiol., 96,
dation of dietary fatty acids by implanted tumors, Cancer
2082-2087, doi: 10.1152/japplphysiol.01318.2003.
Res., 17, 127-133.
105. Hatzivassiliou, G., Zhao, F., Bauer, D.E., Andreadis, C.,
91.
Suematsu, N., and Isohashi, F. (2006) Molecular cloning
Shaw, A.N., Dhanak, D., Hingorani, S.R., Tuveson, D.A.,
and functional expression of human cytosolic acetyl CoA
and Thompson, C.B. (2005) ATP citrate lyase inhibition
hydrolase, Acta. Biochim. Pol., 53, 553-561.
can suppress tumor cell growth, Cancer Cell, 8, 311-321,
92.
Horibata, Y., Ando, H., Itoh, M., and Sugimoto, H. (2013)
doi: 10.1016/j.ccr.2005.09.008.
Enzymatic and transcriptional regulation of the cytoplas
106. Zaidi, N., Royaux, I., Swinnen, J.V., and Smans, K. (2012)
mic acetyl CoA hydrolase ACOT12, J. Lipid Res., 54,
ATP citrate lyase knockdown induces growth arrest and
2049-2059, doi: 10.1194/jlr.M030163.
apoptosis through different cell and environment depen
93.
Scheppach, W., Pomare, E.W., Elia, M., and Cummings, J.H.
dent mechanisms, Mol. Cancer Ther., 11, 1925-1935,
(1991) The contribution of the large intestine to blood
doi: 10.1158/1535 7163.MCT 12 0095.
acetate in man, Clin. Sci. (Lond.),
80,
177-182,
107. Mashimo, T., Pichumani, K., Vemireddy, V., Hatanpaa, K.J.,
doi: 10.1042/cs0800177.
Singh, D.K., Sirasanagandla, S., Nannepaga, S.,
94.
Rey, F.E., Faith, J.J., Bain, J., Muehlbauer, M.J., Stevens, R.D.,
Piccirillo, S.G., Kovacs, Z., Foong, C., Huang, Z.,
Newgard, C.B., and Gordon, J.I. (2010) Dissecting the in
Barnett, S., Mickey, B.E., DeBerardinis, R.J., Tu, B.P.,
vivo metabolic potential of two human gut acetogens,
Maher, E.A., and Bachoo, R.M. (2014) Acetate is a bio
J. Biol. Chem., 285, 22082-22090, doi: 10.1074/jbc.
energetic substrate for human glioblastoma and brain meta
M110.117713.
stases, Cell, 159, 1603-1614, doi: 10.1016/j.cell.2014.
95.
Cummings, J.H., Pomare, E.W., Branch, W.J., Naylor, C.P.,
11.025.
and Macfarlane, G.T. (1987) Short chain fatty acids in
108. Takahashi, H., McCaffery, J.M., Irizarry, R.A., and Boeke, J.D.
human large intestine, portal, hepatic and venous blood,
(2006) Nucleocytosolic acetyl coenzyme a synthetase is
Gut, 28, 1221-1227.
required for histone acetylation and global transcription,
96.
Bloemen, J.G. Venema, K., van de Poll, M.C., Olde
Mol. Cell, 23, 207-217, doi: 10.1016/j.molcel.2006.05.040.
Damink, S.W., Buurman, W.A., and Dejong, C.H. (2009)
109. Gao, X., Lin, S.H., Ren, F., Li, J.T., Chen, J.J., Yao, C.B.,
Short chain fatty acids exchange across the gut and liver in
Yang, H.B., Jiang, S.X., Yan, G.Q., Wang, D., Wang, Y.,
humans measured at surgery, Clin. Nutr., 28, 657-661,
Liu, Y., Cai, Z., Xu, Y.Y., Chen, J., Yu, W., Yang, P.Y., and
doi: 10.1016/j.clnu.2009.05.011.
Lei, Q.Y.
(2016) Acetate functions as an epigenetic
БИОХИМИЯ том 84 вып. 10 2019
1400
КОРШУНОВ и др.
metabolite to promote lipid synthesis under hypoxia, Nat.
palmitoyltransferase 1C promotes cell survival and tumor
Commun., 7, 11960, doi: 10.1038/ncomms11960.
growth under conditions of metabolic stress, Genes Dev., 25,
110. Nath, A., and Chan, C. (2016) Genetic alterations in fatty
1041-1051, doi: 10.1101/gad.1987211.
acid transport and metabolism genes are associated with
112. Xu, M., Nagati, J.S., Xie, J., Li, J., Walters, H., Moon, Y.A.,
metastatic progression and poor prognosis of human can
Gerard, R.D., Huang, C.L., Comerford, S.A., Hammer, R.E.,
cers, Sci. Rep., 6, 18669, doi: 10.1038/srep18669.
Horton, J.D., Chen, R., and Garcia, J.A. (2014) An
111. Zaugg, K., Yao, Y., Reilly, P.T., Kannan, K., Kiarash, R.,
acetate switch regulates stress erythropoiesis, Nat. Med.,
Mason, J., Huang, P., Sawyer, S.K., Fuerth, B., Faubert, B.,
20, 1018-1026, doi: 10.1038/nm.3587.
Kalliomaki, T., Elia, A., Luo, X., Nadeem, V., Bungard, D.,
113. Chen, R., Xu, M., Nagati, J.S., Hogg, R.T., Das, A.,
Yalavarthi, S., Growney, J.D., Wakeham, A., Moolani, Y.,
Gerard, R.D., and Garcia, J.A. (2015) The acetate/ACSS2
Silvester, J., Ten,A.Y., Bakker, W., Tsuchihara, K., Berger, S.L.,
switch regulates HIF 2 stress signaling in the tumor cell
Hill, R.P., Jones, R.G., Tsao, M., Robinson, M.O.,
microenvironment, PLoS One, 10, e0116515, doi: 10.1371/
Thompson, C.B., Pan, G., and Mak, T.W. (2011) Carnitine
journal.pone.0116515.
MODERN REPRESENTATION ABOUT METABOLIC
REPROGRAMMING IN MALIGNANT NEOPLASMS
Review
D. A. Korshunov*, I. V. Kondakova, and E. E. Shashova
Tomsk National Research Medical Center, 634009 Tomsk, Russia;
E mail: ieved@ya.ru
Received March 1, 2019
Revised May 6, 2019
Accepted June 20, 2019
Metabolic reprogramming is one of the key features of transformed cells. The gradual revealing of the interaction
between oncogenic signaling and cellular metabolic processes led to extensive studies of reprogramming of tumor
metabolism. The review summarizes results on catabolic and anabolic rearrangements in tumor cells, in particular, the
features of carbohydrate, lipid, amino acid and acetate exchanges that form the phenotype of cancer cells are consi
dered.
Keywords: Warburg effect, pentose phosphate pathway, glutamine, lipogenesis, acetate
БИОХИМИЯ том 84 вып. 10 2019