БИОХИМИЯ, 2019, том 84, вып. 10, с. 1410 - 1420
УДК 577.125
ИЗУЧЕНИЕ ПРЯМОГО ДЕЙСТВИЯ РИМОНАБАНТА, АНТАГОНИСТА
РЕЦЕПТОРА СВ1, НА ПРОЦЕССЫ ОКИСЛЕНИЯ ЖИРНЫХ КИСЛОТ
И ГЛИКОГЕНОЛИЗ В КЛЕТКАХ ПЕЧЕНИ И МЫШЦ in vitro*
© 2019 G.A. Müller1,2**, S. Wied3, A.W. Herling3
1 Helmholtz Diabetes Center (HDC) at the Helmholtz Center for Health and
Environment Munich, Institute for Diabetes and Obesity (IDO),
85764 Oberschleissheim, Germany;
E mail: guenter.mueller@helmholtz muenchen.de
2 Ludwig Maximilians University Munich, Department Biology I, Genetics,
82152 Planegg Martinsried, Germany
3 Sanofi Pharma Germany GmbH, Diabetes Research,
65926 Frankfurt am Main, Germany
Поступила в редакцию 04.02.2019
После доработки 24.06.2019
Принята к публикации 25.06.2019
Результаты последних исследований фармакологического действия аноректика римонабанта, являющего!
ся антагонистом каннабиноидного рецептора типа 1 (CB1R), позволили говорить об отсутствии убедитель!
ных доказательств того факта, что все без исключения аспекты его воздействия на метаболизм и энергети!
ческий баланс у откормленных крыс линии Wistar опосредуются влиянием центральной нервной системы
на снижение потребляемых животными лишних калорий. Вместо этого, римонабант мог критически вли!
ять на метаболизм путем индукции гликогенолиза в печени, и это влияние сопровождалось кратковремен!
ным повышением окисления глюкозы и устойчивым повышением окисления жирных кислот. Возможно,
римонабант оказывал прямое стимулирующее воздействие на эти процессы в соответствующих первичных
и культивируемых клетках крыс в краткосрочной и долгосрочной перспективе. Было установлено, что при
длительном инкубировании римонабант несколько увеличивал интенсивность β!окисления длинноцепо!
чечных жирных кислот в культивируемых миоцитах крысы, экспрессирующих избыточное количество 4!й
изоформы глюкозного транспортера (Glut4), а также стимулировал фосфорилирование АМР!зависимой
протеинкиназы (АМРК) в первичных гепатоцитах крысы. Однако при кратковременном воздействии ри!
монабант практически не оказывал стимулирующего воздействия на β!окисление жирных кислот в мио!
цитах, миотубах и гепатоцитах, а также сколь!нибудь значительного влияния на фосфорилирование
АМРК, гликогенолиз и уровни сАМР в гепатоцитах. Критическое влияние римонабанта на состояние гли!
когена в печени (распад) и общий расход энергии (повышение) у нормально питающихся крыс не могло
объясняться его прямым стимулирующим воздействием на гликогенолиз и окисление жирных кислот в
мышцах и печени. Скорее всего, эти стимулирующие эффекты были опосредованы центральной нервной
системой.
КЛЮЧЕВЫЕ СЛОВА: АМР! и сАМР!зависимая сигнализация, каннабиноидный рецептор 1, метаболизм
глюкозы и липидов, ожирение.
DOI: 10.1134/S032097251910004X
Как уже было установлено, эндогенные кан!
(CCK), орексины, агути!родственный пептид
набиноиды и их рецепторы осуществляют конт!
(AGRP), меланин!концентрирующий гормон
роль потребления пищи [1-4]. Другими подоб!
(MCH), лептин, инсулин, проопиомеланокор!
ными регуляторными соединениями являются
тин (POMC) и CART (транскрипт, регулируе!
нейропептид Y (NPY), грелин, холецистокинин
мый кокаином и амфетамином) [5-7]. Все экс!
Принятые сокращения: ACC - ацетил!CoA карбоксилаза; AMPK - АМР!зависимая протеинкиназа; CB1R - кан!
набиноидный рецептор типа 1; (F)FA - свободные жирные кислоты; IBMX - изобутилметилксантин; PKA - протеинки!
наза А; AICAR - 5!aminoimidazole!4!carboxamide ribonucleotide.
* Первоначально английский вариант рукописи опубликован на сайте «Biochemistry» (Moscow) http://protein.bio.
msu.ru/biokhimiya, в рубрике «Papers in Press», BM19!029, 15.07.2019. Статья на английском языке опубликована в вып. 8
2019 г. журнала «Biochemistry» (Moscow).
** Адресат для корреспонденции.
1410
ПРЯМОЕ ДЕЙСТВИЕ РИМОНАБАНТА В КЛЕТКАХ ПЕЧЕНИ И МЫШЦ
1411
периментальные данные, полученные до насто!
снижения потребления пищи, как показано на
ящего времени, указывают на то, что заполне!
примере уменьшения триглицеридов и HDL!хо!
ние G!белок!связанного каннабиноидного ре!
лестерина в сыворотке крови у пациентов с ожи!
цептора типа 1 (CB1R) в латеральной гипотала!
рением, получавших римонабант, что не может
мической области эндогенными лигандами, эн!
быть объяснено только степенью снижения веса
доканнабиноидами, может приводить к гипер!
[10]. Кроме того, поскольку животные, получав!
активации нисходящей эндоканнабиноидной
шие римонабант, теряли массу тела в большей
системы. Это в сочетании с другими орексиген!
степени, чем животные, не получавшие римона!
ными сигналами [8] стимулирует прием пищи,
бант [15], механизмы, причинно не связанные с
возможно, способствуя перееданию и ожире!
приемом пищи, также работают. Эти механизмы
нию. Подтверждением наличия такого механиз!
могли основываться на расходовании энергии в
ма регуляции аппетита у грызунов и людей слу!
мышечной ткани и печени путем β!окисления
жат эксперименты с использованием синтети!
жирных кислот, высвободившихся из жировой
ческого селективного антагониста CB1R, римо!
ткани, и/или при окислении глюкозы, вышед!
набанта, который уменьшает индуцированный
шей из печени. Подобная гипотеза основана на
эндоканнабиноидами гиперфагический эффект
следующих недавних наблюдениях: (i) происхо!
потребления пищи и увеличения массы тела при
дящие многочисленные изменения в экспрес!
введении мышам с ожирением, вызванным дие!
сии генов, которые индуцируются в белом и бу!
той [9], и пациентам с ожирением [10]. Влияние
ром жире у тучных мышей и реверсируют при
на функционирование CB1R!опосредуемой
применении римонабанта, включая гены, ответ!
сигнальной системы эндогенных каннабинои!
ственные за β!окисление жирных кислот, за
дов и римонабанта подтверждается и наблюде!
цикл трикарбоновых кислот и др. [14]; (ii) од!
ниями на CB1R!нокаутированных мышах. Было
нократное воздействие римонабанта на откорм!
установлено, что эти мыши были склонны к ху!
ленных крыс линии Wistar приводило к резкому
добе, не были подвержены ожирению, вызван!
повышению уровня свободных жирных кислот
ному особенностью диеты [11], не реагировали
(FFA) в сыворотке крови, снижению запасов
на римонабант и значительно снижали потреб!
эндогенного гликогена и липидов в печени, а
ление пищи, когда находились на диете с повы!
также к увеличению общего расходования энер!
шенным содержанием жира [2, 12, 13].
гии, связанному с кратковременной стимуляци!
В отличие от, по!видимому, централизован!
ей окисления глюкозы и устойчивой стимуля!
ного и CB1R!опосредованного регулирования
цией окисления жирных кислот (неопублико!
снижения потребления пищи, показавшего
ванные данные).
большую эффективность у животных во время
Нами были изучены возможности прямого
возобновления кормления после временного
воздействия римонабанта на потенциальные пе!
лишения пищи, чем у животных, имеющих сво!
риферические клетки!мишени, которые важны
бодный доступ к пище [2, 12, 13], механизм(ы),
для регуляции расходования энергии, а также на
участвующие в снижении массы тела в ответ на
гликогенолиз и окисление жирных кислот в
прием римонабанта, кажутся менее ясными.
культивируемых мышечных и первичных пече!
Недавние наблюдения вызывают сомнения в
ночных клетках.
тот, что кратковременное снижение потребле!
ния пищи, вызванное антагонистом гипотала!
мических CB1R, римонабантом, является един!
МЕТОДЫ ИССЛЕДОВАНИЯ
ственным механизмом, ответственным за устой!
чивое снижение массы тела. Действительно,
Культуры мышечных клеток крысы L6. Мио!
чип!анализ генов, регулируемых на транскрип!
циты L6 и миоциты L6(Glut4), устойчиво
ционном уровне римонабантом в жировых тка!
экспрессирующие myc!меченый GLUT4 (клет!
нях мышей, находящихся на особой диете и яв!
ки L6!GLUT4myc), были предоставлены Dr. Amira
ляющихся мышиной моделью ожирения чело!
Klip (Programme in Cell Biology, The Hospital for
века [14], а также фармакологическая характе!
Sick Children, 555 University Ave., Toronto, ON,
ристика нормально питающихся крыс линии
Canada M5G 1X8). Миоциты культивировали в
Wistar после введения римонабанта (неопубли!
24!луночных микропланшетах в среде α!MEM,
кованные данные) позволяют предположить,
содержавшей 2%!ную (v/v) фетальную сыворот!
что существуют и альтернативные механизмы,
ку крупного рогатого скота, 1% (v/v) смесь анти!
вносящие вклад в долгосрочный эффект римо!
биотиков (100 ед/мл пенициллина, 100 мкг/мл
набанта, направленный против ожирения. Эти
стрептомицина, 250 нг/мл амфотерицина B)
предполагаемые механизмы могут осуществлять
при 37 °С в атмосфере 5% CO2, а затем диффе!
исправления параметров метаболизма путем
ренцировались в L6 миотубы в течение 7 дней в
БИОХИМИЯ том 84 вып. 10 2019
1412
MÜLLER и др.
той же среде. Культура миотуб содержала <20%
субстрата, плотности клеточного монослоя (ко!
моноядерных клеток.
личество белка), концентрации БСА, времени
Культуры первичных гепатоцитов крыс. Пер!
инкубации. Хотя концентрация субстрата, ис!
вичные гепатоциты были изолированы из пече!
пользуемого обычно (5 и 100 мкМ соответствен!
ни взрослых самцов крыс линии
но), и не была насыщающей, <0,2% [3H]пальми!
Sprague-Dawley («Mollegaard Breeding Centre
тата превращались в 3H20 контрольными клет!
Ltd.», Дания), кормили в свое удовольствие по
ками, и эта концентрация оставалась постоян!
стандартной методике с двухступенчатой пер!
ной в течение всего периода инкубации. Про!
фузией, в среде, свободной от Ca2+, с добавлени!
дукция 3H20 происходила линейно вплоть до
ем коллагеназы, как описано в работе Seglen
80 мкг клеточного белка на лунку, после этого
[16]. Нежизнеспособные клетки удаляли цен!
уровень активности переставал нарастать ли!
трифугированием в градиенте плотности Пер!
нейно. Все проведенные нами эксперименты
колла [17]. Качество конечного препарата кле!
были выполнены при 20-60 мкг белка в лунке.
ток оценивали с использованием трипанового
Первоначально окисление [3H]пальмитата оп!
синего. Жизнеспособность гепатоцитов состав!
ределяли в различных средах, включая (D)MEM
ляли ≥95%.
и HBSS, дополненных сывороткой и/или БСА
Окисление жирных кислот. Скорость реакции
в различных концентрациях. Оптимум актив!
β!окисления жирных кислот клетками опреде!
ности наблюдался в среде HBSS, содержащей
ляли с использованием в качестве субстрата
0,02 и 2% соответственно, свободного от жир!
[9,10(n)!3H]пальмитиновую кислоту и тестиро!
ных кислот БСА. Поскольку возрастание актив!
вали по выходу продукта реакции 3H2O [18].
ности происходило линейно от 1 до 4 ч инкуба!
Первичная культура гепатоцитов крысы: клетки
ции, измерения выполняли за период инкуба!
высевали в 24!луночные планшеты (2 × 105 кле!
ции 2 ч.
ток в лунку). После прикрепления клеток их ин!
Высвобождение глюкозы и содержание гликоC
кубировали в течение ночи в 5 мМ глюкозе с
гена. Для определения высвобождения глюкозы
10 нМ дексаметазона. Клетки промывали один
и содержания гликогена в гепатоцитах первич!
раз буфером PBS и затем инкубировали в среде
ную культуру клеток высевали в 96!луночные
DМЕМ, содержавшей
5 мкМ
(0,4 мкКи)
микропланшеты (3 × 104 клеток в лунку). После
[3H]пальмитиновой кислоты, 0,02% (w/v) БСА,
прикрепления клетки инкубировали в течение
500 мкМ L!карнитин, 0,1% (v/v) ДМСО в присут!
ночи в среде Вильяма (William’s E!Medium), а
ствии или в отсутствии глюкозы (25 мМ), римо!
затем добавляли 25 мМ глюкозы и 100 нМ инсу!
набанта и сорафена. Культивируемые миоциты:
лина для аккумуляции клетками глюкозы и на!
клетки лишали сыворотки на 5 ч, промывали
копления гликогена. Клетки 3× промывали
сбалансированным солевым раствором Эрла
прогретой насыщенной кислородом средой
(EBSS; 130 мМ NaCl, 26 мМ NaHCO3, 5 мМ KCl,
КНН (20 мМ Hepes; 115 мМ NaCl; 4,5 мМ KCl;
1,8 мМ CaCl2, 1 мМ NaH2PO4, 0,8 мМ MgSO4,
4,5 мМ CaCl2; 1,1 мМ KH2PO4; 1,1 мМ MgSO4;
pH 7,4) и инкубировали 30 мин при 37 °C в сре!
pH 7,4), а потом инкубировали 30 мин при 37 °C
де EBSS, содержащей 5 мМ глюкозу и 2% (w/v)
в 100 мкл среды КНН с 1% ДМСО и римонабан!
БСА, либо в среде EBSS, содержащей 0,1 мМ
том или WIN55.212!2, как указано ниже. Глико!
пальмитат (готовили 10 мМ раствор пальмита!
генолиз инициировали добавлением 10 мкл
та в этаноле и разбавляли средой EBSS, содер!
глюкагона (конечная концентрация 100 нМ).
жащей 2% БСА) и римонабант. β!Окисле!
Концентрацию высвободившейся в среду глю!
ние инициировали добавлением
0,5 мкКи
козы определяли с использованием набора
[3H]пальмитата в среду инкубации. Через 4 ч
Amplex Red Glucose Assay Kit («Molecular Probe»,
инкубации при 37 °C аликвоты из бесклеточно!
США) в соответствии с инструкцией произво!
го супернатанта наносили на картриджи Sep!
дителя. Для оценки количества накопленного
Pak («Waters», Германия). Величину несвязав!
гликогена первичную культуру гепатоцитов рас!
шейся радиоактивности определяли с исполь!
севали в 6!луночные планшеты (1,5 × 106 клеток
зованием жидкост!ного сцинтилляционного
в лунку). Клетки инкубировали в течение ночи в
счетчика.
среде Вильяма, а затем добавляли 25 мМ глюко!
Культуры первичных гепатоцитов крыс. Перед
зы и 100 нМ инсулина в присутствии или в отсут!
началом исследования мы оценили параметры
ствии римонабанта. Клетки 2× промывали и ли!
реакции окисления [9,10(n)!3H]пальмитата в
зировали в 200 мкл 100 мМ NaOH. Гликоген
контроле (в отсутствии римонабанта) с целью
изолировали и анализировали, как описано ра!
достижения максимально возможной активнос!
нее [19].
ти. Степень окисления оказалась зависимой от
Фосфорилирование аденозинмонофосфатC
четырех главных параметров: концентрации
зависимой протеинкиназы (АМПК). Для изуче!
БИОХИМИЯ том 84 вып. 10 2019
ПРЯМОЕ ДЕЙСТВИЕ РИМОНАБАНТА В КЛЕТКАХ ПЕЧЕНИ И МЫШЦ
1413
ния фосфорилирования АМПК первичную
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
культуру гепатоцитов инкубировали в течение
ночи в 5 мМ глюкозы и 10 нМ дексаметазона.
Римонабант не индуцирует кратковременную
Клетки промывали один раз буфером PBS, а
активацию βCокисления в культуре мышечных
затем инкубировали в присутствии или в отсут!
клеток и в культуре первичных гепатоцитов. Ранее
ствии римонабанта или 5!aminoimidazole!4!
было продемонстрированно, что под действием
carboxamide ribonucleotide (AICAR). По про!
римонабанта быстро повышались уровни FFA в
шествии 90 мин клетки лизировали в буфере,
сыворотке откормленных крыс линии Wistar.
содержавшем 50 мМ Tris!HCl, pH 7,5, 0,1%
При проведении непрямых калориметрических
(w/v) Triton X!100, 1 мМ ЭДТА, 1 мМ ЭГТА,
измерений было обнаружено продолжительное
50 мМ NaF, 10 мМ β!глицерофосфат Na, 1 мМ
увеличение уровней окисления липидов и кри!
Na3VO4, 5 мМ NaPPi, 1 мМ дитиотреитол и таб!
тическое снижение уровней содержания липи!
летки ингибиторов протеаз («Roche», Герма!
дов в печени (неопубликованные данные). Для
ния). Обломки клеток удаляли центрифугиро!
изучения предполагаемого прямого действия
ванием. Адиквоты, содержащие по 20 мкг бел!
римонабанта на β!окисление липидов в двух
ка разделяли методом DS!Na электрофореза в
главных оксидативных тканях, мышцах и пече!
(4-12)% ПААГ и переносили на PVDF (поли!
ни, сжигающих FFA, высвобождаемые из жиро!
винилидендифторид) мембраны. Мембраны
вой ткани под действием римонабанта, исполь!
инкубировали с антителами против фосфо!
зовались культивированные миоциты и миоту!
АМРКβ1 (Ser108; «Cell Signaling», США). Пос!
бы крыс, а также первичные гепатоциты крыс.
ле промывки мембраны обрабатывали в тече!
Кратковременная обработка римонабантом
ние 1 ч вторичными антителами против кро!
культуры L6 миоцитов и дифференцированных
личьих IgG, коньюгированных с пероксида!
in vitro L6 миотуб, демонстрировавших высокую
зой. Детектирование специфических белковых
скорость β!окисления (рис. 1), а также первич!
полос на блотах выполняли методом хемилю!
ных гепатоцитов (рис. 2), не приводила к суще!
минесценции с использованием набора Lumi!
ственному изменению скорости β!окисления
LIGHT («Roche», Германия).
экзогенной [3H]пальмитиновой кислоты. И в
Внутриклеточные уровни сАМP. Для опреде!
качестве контроля окисление пальмитата суще!
ления уровней внутриклеточного сАМР пер!
ственно стимулировалось в гепатоцитах в отсут!
вичную культуру гепатоциты рассевали в 96!лу!
ствии в культуральной среде глюкозы и сорафе!
ночные микропланшеты (по 3 × 104 клеток в
на, ингибитора ацетил!СоА карбоксилазы
лунку) и инкубировали в течение ночи в среде
(АСС).
Вильяма в присутствии 25 мМ глюкозы и 100 нМ
Одним из ключевых регуляторов окисления
инсулина. Затем клетки инкубировали в тече!
жирных кислот и расходования энергии являет!
ние 30 мин в среде КНН, дополненной 1 мМ
ся AMPK [21]. При фосфорилировании и акти!
изобутилметилксантина (IBMX), в присут!
вации в ответ на снижение энергетического ста!
ствии или в отсутствии глюкагона, римонабан!
туса клеток, AMPK инактивирует АСС и тем са!
та или CP55.940. Уровни сАМР определяли с
мым стимулирует окисление жирных кислот.
использованием набора HitHunter EFC cAMP
При кратковременной инкубации римонабант
chemiluminescence
assay
kit
(«Applied
не индуцировал фосфорилирование AMPK в
Biosystems», США) в соответствии с инструк!
первичных гепатоцитах, в то время как AICAR,
цией производителя.
фармакологический активатор AMPK, приво!
Разное. Римонабант был синтезирован, как
дил к резкому повышению уровня фосфорили!
описано ранее [9]. Концентрацию белка опре!
рования AMPK (рис. 3, a). Кроме того, было по!
деляли с использованием БСА в качестве стан!
казано, что введение агониста CB1R крысам не
дарта с набором фирмы «Pierce», США, Ds!Na
влияет на активность AMPK в скелетных мыш!
электроворез в 4-12% ПААГ проводили с набо!
цах [22]. Это согласуется с отсутствием в наших
ром фирмы «Novex», США. Иммуноблоттинг с
экспериментах кратковременной активации ри!
использованием поливинилидендифторидных
монабантом окисления жирных кислот в пери!
мембран и с последующим хемилюминисцент!
ферических клетках (рис. 1). Все эти данные в
ным детектированием - с помощью набора для
совокупности позволяют заключить, что римо!
ECL («Amersham!Buchler», Германия); количе!
набант не оказывал прямого и резкого воздей!
ственную оценку проводили с использованием
ствия на метаболические и регуляторные фер!
Люми!имиджера («Roche», Германия), снаб!
менты, принимающие участие в β!окислении
женного программой для обработки данных
длинноцепочечных жирных кислот в клетках
Graph!Pad Prism 4.03, как было описано ранее
мышц и печени. Напротив, при длительной ин!
[20].
кубации миоцитов L6, экспрессирующие повы!
БИОХИМИЯ том 84 вып. 10 2019
1414
MÜLLER и др.
−
+
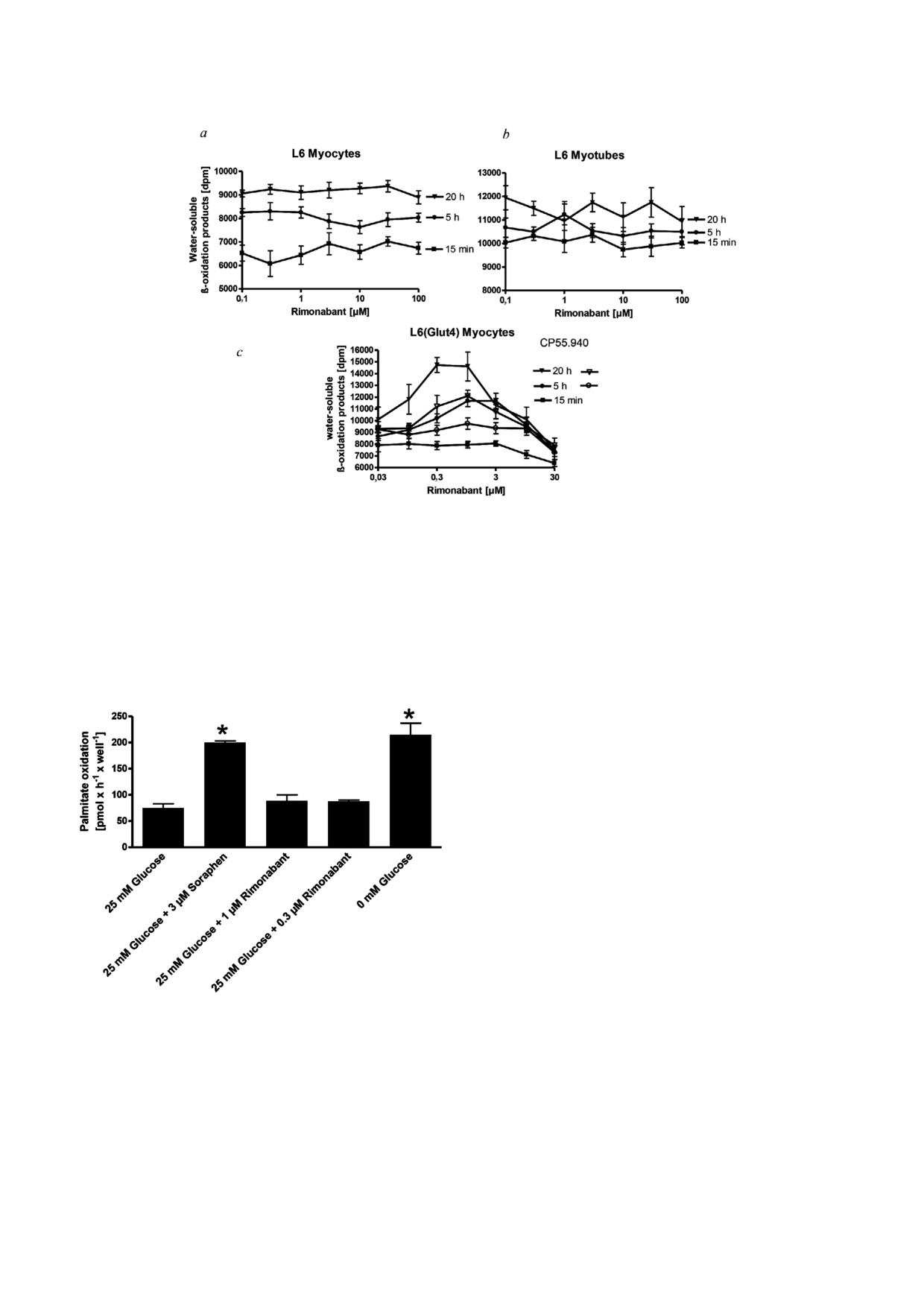
Рис. 1. Влияние римонабанта на β!окисление FFA в миоцитах различных клеточных культур. Лишенные сыворотки куль!
тивируемые миоциты L6 (a), дифференцированные миотубы L6 (b) или миоциты L6, экспрессирующие Glut4 (c), инку!
бировали при 37 °С в среде EBSS, содержащей глюкозу и БСА, а затем в среде EBSS, содержащей пальмитат и БСА в от!
сутствии или присутствии повышающихся концентраций римонабанта, различное время в отсутствии (L6 миоциты и ми!
отубы) или в присутствии 10 мкМ CP55.940 (миоциты L6[Glut4]). Реакцию начинали добавлением [3H]пальмитата и ин!
кубировали в течение 4 ч. Скорость β!окисления FFA определяли по количеству образовавшейся 3H2O (см. «Методы ис!
следования»). Данные представлены как средние значения ± S.D. (n = 3). 5000 dpm водорастворимых радиоактивных β!
продуктов окисления соответствуют 1149 пмоль/мг/ч образовавшейся 3H2O из [9,10(n)!3H]пальмитата
шенное количество Glut4, окисление жирных
кислот стимулировалось в средней степени
(вплоть до 1,5 раз над базальным уровнем за 20 ч
инкубации с 0,3-1 мкМ римонабанта); эта акти!
вация полностью нивелировалась при избытке
агониста CB1R (рис. 1). К тому же, длительная
инкубация (>90 мин) гепатоцитов с римонабан!
том приводила к незначительному повышению в
них уровня фосфорилирования AMPK (рис. 3, b).
Напротив, стимулирующее влияние AICAR на
β!окисление и на фосфорилирование AMPK де!
тектировалось уже через 30 мин (рис. 3, b и дан!
ные не представлены).
Для доказательства достоверности использо!
ванного нами метода определения степени ак!
тивации окисления жирных кислот была выпол!
нена группа других экспериментов с использо!
ванием метода иммуноблоттинга в целях тести!
Рис. 2. Влияние римонабата на β!окисление FFA в первич!
ных гепатоцитах крысы. Клетки инкубировали в течение
рования фосфорилированной формы ацетил!
4 ч с [3H] пальмитиновой кислотой в присутствии или в от!
СоА карбоксилазы (по Thr172) - ключевого
сутствии римонабанта или ингибитора АСС, сорафена, фермента, осуществляющего отрицательную ре!
при указанных концентрациях глюкозы. Данные представ! гуляцию окисления жирных кислот, в то время
лены как средние значения ± S. D. (n = 3). * p < 0,05. Окис!
как AMPK β1 осуществлял положительную ре!
лению 127 пмоль пальмитата на лунку за 1 ч в условиях
проведения реакции соответствуют 1000 dpm образовав!
гуляцию. Сравнение двух методов выявило
шейся 3H2O
лишь незначительные различия между степенью
БИОХИМИЯ том 84 вып. 10 2019
ПРЯМОЕ ДЕЙСТВИЕ РИМОНАБАНТА В КЛЕТКАХ ПЕЧЕНИ И МЫШЦ
1415
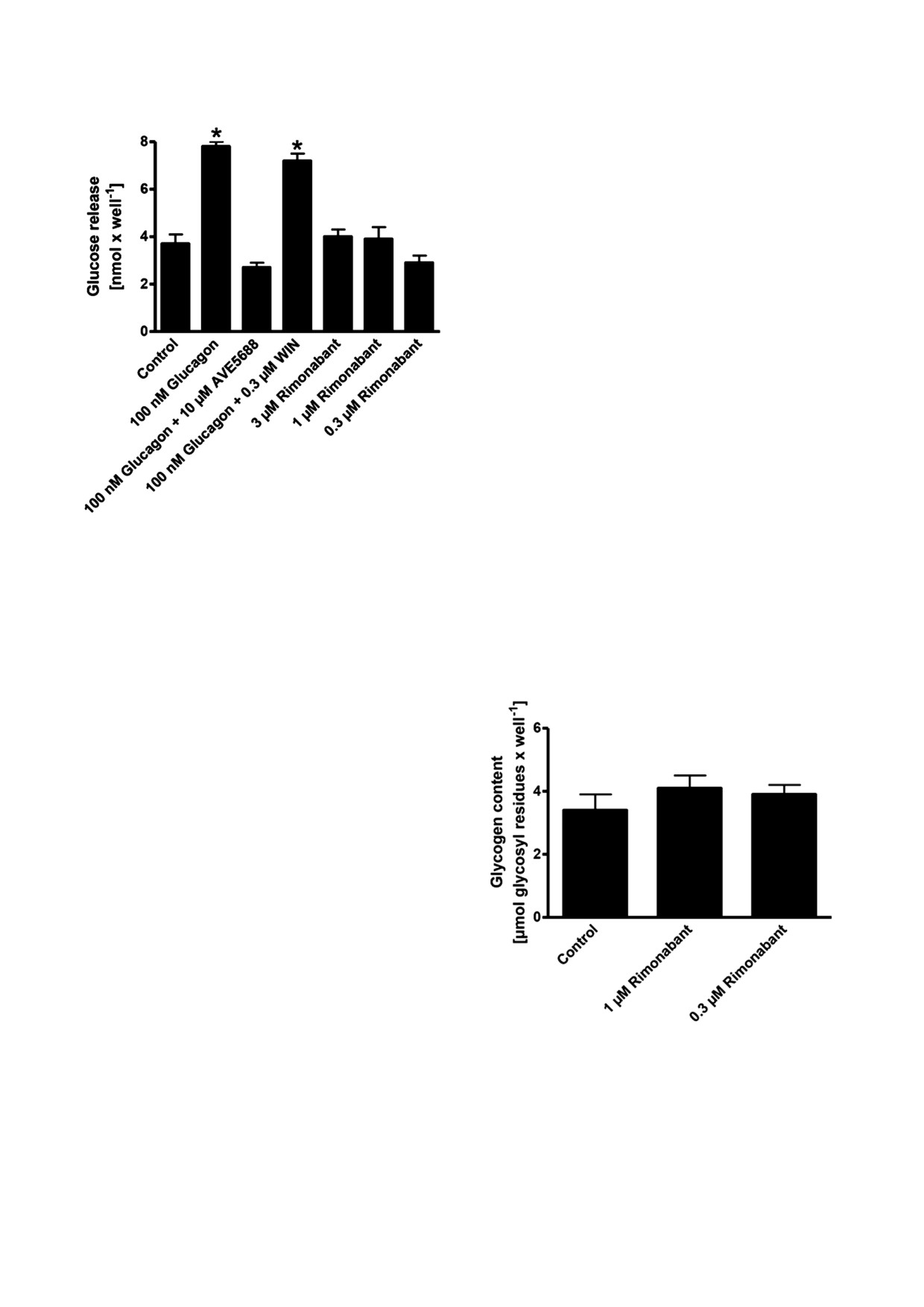
Рис. 3. Влияние римонабанта на фосфорилирование AMPK в первичных гепатоцитах крысы. a - Клетки инкубировали в
течение 90 мин в отсутствии (столбец С) и в присутствии 1 мкМ римонабанта (столбец R) или 0,5 мМ AICAR (столбец А).
Каждый эксперимент выполняли 4 раза. b - Клетки инкубировали различное время в присутствии 3 мкМ римонабанта
(панель R) или 0,5 мМ AICAR (панель A). Аликвоты клеточных лизатов (по 20 мкг белка) разделяли методом Ds!Na!ПААГ
электрофореза и анализировали методом иммуноблоттинга с использованием антител против фосфо!Ser108!AMPKβ1
или против AMPKα. Каждый эксперимент выполняли дважды. На панелях представлены репрезентативные иммунобло!
ты. Количественная оценка представлена в разах относительно контроля С (a) или в разах относительно нулевого момен!
та времени инкубации (b). Столбцы на гистограммах представляют средние значения ± S.D. При n = 4 или n = 2 для (a)
или (b) соответственно; * p
0,05 относительно контроля С или нулевого момента времени инкубации для (a) или (b) со!
ответственно
стимуляции фосфорилирования субъединицы
Отсутствие активации гликогенолиза римонаC
AMPK β1 и фосфорилированием АСС римона!
бантом в первичных клетках печени. Известно,
бантом и AICAR, а также выявилась лишь не!
что под действием римонабанта наблюдалось
значительная задержка во времени между фос!
критическое снижение содержания гликогена в
форилированием АСС и AMPK (данные не
печени крыс линии Wistar (неопубликованные
представлены). Таким образом, уровень фосфо!
данные). Для ответа на вопрос, связан ли этот
рилирования AMPK β1 может быть использован
эффект римонабанта с его прямым воздействи!
как надежный показатель степени активации
ем на метаболизм гликогена в печени, мы изу!
AMPK. Одновременное тестирование уровней
чили влияние этого соединения на высвобожде!
фосфорилирования AMPK и АСС одно!
ние глюкозы из запасов эндогенного гликогена
значно показывает, что римонабант не индуци!
с использованием в качестве объекта нагружен!
рует активацию AMPK как молекулярный меха!
ных гликогеном первичных гепатоцитов крысы
низм, лежащий в основе предполагаемой регу!
(рис. 4). Глюкагон увеличивал высвобождение
ляции окисления жирных кислот.
глюкозы из эндогенных запасов примерно в 2 раза.
БИОХИМИЯ том 84 вып. 10 2019
1416
MÜLLER и др.
зы, IBMX (рис. 6, a). Агонист CB1R, CP55.940,
не влиял на уровни АМР ни будучи один, ни в
комбинации с глюкагоном. Римонабант в кон!
центрации до 3 мкм, отдельно или в комбина!
ции с CP55.940, не оказывали существенного
влияния на содержание клеточного сАМР в
контрольном состоянии, т.е. в отсутствии глю!
кагона (рис. 6, b). Эти данные позволили заклю!
чить, что римонабант не оказывает прямого воз!
действия на первичные гепатоциты крысы при
посредстве системы вторичного мессенджера
сАМР.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В этой работе мы изучали механизмы, лежа!
щие в основе острых и подострых эффектов ри!
монабанта на гликогенолиз у откормленных
крыс Wistar, которые выражались в снижении за!
пасов гликогена в печени, активации окисления
глюкозы и жирных кислот и в стимуляции об!
щих энергозатрат (неопубликованные данные).
Рис. 4. Влияние римонабанта на высвобождение глюкозы
В частности, мы попытались ответить на вопрос,
из первичных гепатоцитов крысы. Высвобождение глюко!
может ли римонабант оказывать прямое (непо!
зы определяли (см. «Методы исследования») после инку!
бации клеток в отсутствии (контроль) или в присутствии
средственное) воздействие на культивируемые
глюкагона, AVE5688
(«Sanofi!Aventis»), WIN55.212!2
миоциты и первичные гепатоциты крысы. Демон!
(Tocris) или римонабанта в различных концентрациях.
страция прямой стимуляции липолиза в изоли!
* значительная стимуляция высвобождения глюкозы;
рованных адипоцитах крыс [23] и отсутствие
p
0,05
стимуляции окисления базальных FA и фосфо!
AVE5688, ингибитор гликогенфосфорилазы,
рилирования AMPK (рис. 3) в культивируемых
блокировал эффект глюкагона, демонстрируя,
что повышенное высвобождение глюкозы было
обусловлено именно стимуляцией деградации
гликогена. Агонист CB1R, WIN55.212!2, не ока!
зывал влияния на глюкагон!стимулируемое
высвобождение глюкозы. Римонабант в концен!
трации вплоть до 3 мкМ слабо повышал базаль!
ный уровень высвобождения глюкозы. Это наб!
людение находилось в согласии с измеренным
содержанием гликогена в культуре первичных
гепатоцитов, обработанных римонабантом, ко!
торое тоже незначительно изменялось даже пос!
ле инкубации римонабанта с клетками в течение
16 ч в присутствии глюкозы и инсулина (рис. 5).
Говоря в общем, эти данные свидетельство!
вали о том, что римонабант не оказывал прямо!
го воздействия на метаболизм печеночного гли!
когена. Эта точка зрения нашла дальнейшее
подтверждение при измерении уровней внут!
риклеточного сАМР, который опосредует сти!
мулирующий эффект глюкагона на гликогено!
Рис. 5. Влияние римонабанта на содержание гликогена в
первичных гепатоцитах крысы. Уровни содержания глико!
лиз. Как и ожидалось, глюкагон вызывал значи!
гена в клетках определяли (см. «Методы исследования»)
тельное увеличение уровней сАМР внутри пер!
после инкубации в течение ночи в среде, содержащей
вичных гепатоцитов прямо пропорционально
25 мМ глюкозы и 100 нМ инсулина в присутствии или в
своей концентрации; измерения были выполне!
отсутствии римонабанта. Данные представлены как сред!
ны в присутствии ингибитора фосфодиэстера!
ние значения ± S.D. (n = 3)
БИОХИМИЯ том 84 вып. 10 2019
ПРЯМОЕ ДЕЙСТВИЕ РИМОНАБАНТА В КЛЕТКАХ ПЕЧЕНИ И МЫШЦ
1417
миоцитах и миотубах (рис. 1), а также в первич!
сии генов является важным фактором для регу!
ных гепатоцитах крыс (рис. 2) в ответ на крат!
ляции метаболизма жирных кислот римонабан!
ковременное воздействие римонабанта позволя!
том при посредстве CB1R. Однако, поскольку
ет предположить, что in vivo римонабант!инду!
стимуляция окисления FA римонабантом не
цированное прямое высвобождение жирных
наблюдалась в миоцитах и миотубулах L6, не
кислот из жировой ткани в сыворотку приводит
экспрессирующих повышенные количества
к окислению жирных кислот в мышцах и тканях
Glut4 и требующих длительной (более 5 ч) инку!
печени без посторонней помощи. Эта комбина!
бации с римонабантом, то прямое CB1R!зависи!
ция прямых и косвенных периферических эф!
мое воздействие римонабанта на мышечную
фектов была бы совместима с острыми и подост!
ткань при однократном получении этого препа!
рыми эффектами римонабанта на липидный ме!
рата раскормленными крысами не может слу!
таболизм у откормленных крыс линии Wistar
жить объяснением резкого повышения скорости
(неопубликованные данные). Независимо от ме!
окисления жирных кислот. Таким образом, пер!
ханизма косвенной и критической стимуляции
вичная мишень для резкого стимулирующего
окисления жирных кислот in vivo, римонабант,
действия римонабанта на окисление жирных
по!видимому, прямо приводит в действие CB1R!
кислот и расходование энергии in vivo не может
зависимый способ положительного регулирова!
быть локализована в периферических тканях.
ния β!окисления жирных кислот (рис. 1), в ос!
Примечательно, что в первичных гепатоцитах
нове которого может лежать активация AMPK
не наблюдалось прямой стимуляции гликогено!
(рис. 3). Примечательно, что выполненный ра!
лиза римонабантом, что выражалось в высвобож!
нее анализ экспрессии генов у выкормленных на
дении глюкозы в среду инкубации (рис. 4) и в со!
высококалорийной диете ожиревших мышей,
держании гликогена в клетках (рис. 5), а также в
получавших римонабант в дозе 10 мг/кг/день в
базальном уровне синтеза сАМР в гепатоцитах
течение 40 дней, выявил индукцию ферментов
(рис. 6, b), несмотря на то что в гепатоцитах глико!
окисления жирных кислот, а также 2× увеличе!
генолиз регулируется cAMP, аналогично липолизу
ние уровня Glut4 в белой и бурой жировой тка!
в адипоцитах. Неспособность обнаружить CB1R!
нях в сравнении с контрольными животными, не
зависимую гликогенолитическую активность ри!
получавшими римонабант [14]. Эти данные
монабанта может зависеть от более низкой
подтверждают тот факт, что модуляция экспрес!
экспрессии или менее эффективной связи CB1R с
а
b
Рис. 6. Влияние римонабанта и CP55.940 на содержание сАМР в первичных гепатоцитах крысы. a - Уровни сАМР внут!
ри клеток определяли через 30 мин инкубации в присутствии глюкагона в различных концентрациях и в отсутствии (чер!
ные квадраты, сплошная линия) или в присутствии (светлые треугольники, пунктирная линия) 0,3 мкМ CP55.940.
b - Клетки инкубировали в течение 30 мин в присутствии или в отсутствии глюкагона, CP55.940 (CP) или римонабанта.
Уровни сАМР определяли по стандартному калибровочному графику, как отмечено в разделе «Методы исследования».
Данные представлены как средние значения ± S.D. (n = 3).
* Значительное повышение уровней сАМР в клетках по сравнению с нестимулированными клетками; p < 0,05
4 БИОХИМИЯ том 84 вып. 10 2019
1418
MÜLLER и др.
нисходящими эффекторами в печени по сравне!
положение о том, что липидные включения мо!
нию с жировыми клетками. Экспрессия CB1R,
гут являться первичной мишенью действия ри!
продемонстрированная в настоящее время в пер!
монабанта, согласуется с существующими наб!
вичных гепатоцитах крысы [24] и адипоцитах
людениями, свидетельствующими о ключевой
крысы и мыши [25], по!видимому, сильно зависит
роли липидных капельно!ассоциированных
от возраста животного!донора. Можно было ожи!
белков в регуляции липолиза [26, 27].
дать, что при связывании CB1R с эндогенными
Приведенные данные являются аргументами
каннабиноидами, которые конкурируют с римо!
в поддержку предположения о том, что взаимо!
набантом, должны были бы стимулироваться гли!
действие римонабанта (в высокой концентра!
когенолиз и липолиз, однако эта функция менее
ции) с поверхностью жировых включений, а так!
выражена или даже отсутствует в первичных гепа!
же его воздействие на CB1R в адипоцитах приво!
тоцитах по сравнению с адипоцитами. Единствен!
дят к увеличению доступности этих включений
ным прямым действием римонабанта на гепато!
для гормон!чувствительной липазы независи!
циты, о котором сообщалось до сих пор, является
мым и зависимым от фосфорилирования спосо!
ингибирование синтеза базальных и CB1R аго!
бами соответственно. Эти два механизма могут
нистов жирных кислот [24]. Подобные воздей!
вести к прямой и резкой стимуляции липолиза и,
ствия могут являться ответом на незначительные
следовательно, стимуляции окисления FA, осу!
изменения в сигналах AMPK и/или протеинки!
ществляемой римонабантом; они являются по!
назы A (PKA) с большей чувствительностью по
тенциальными мишенями для будущего лечения
сравнению с окислением жирных кислот либо
ожирения в обход гипоталамического CB1R.
осуществляющихся через другие сигнальные сис!
Заманчиво было предположить, что прямое
темы, инициированные CB1R печени, но опять!
воздействие римонабанта на липолиз не ограни!
таки, независимо от распада жирных кислот.
чивается его действием только на жировую
В любом случае описанные острые или подост!
ткань. Гормон!чувствительная липаза экспрес!
рые эффекты римонабанта на окисление глюко!
сируется во многих тканях и регулирует мобили!
зы и жирных кислот у откормленных крыс ли!
зацию запасов эндогенного жира в клетках раз!
нии Wistar, приводящие к резкому увеличению
личных типов, таких, как миоциты и гепатоциты
энергозатрат в организме (неопубликованные
[28]. Интересно, что индуцированное римона!
данные), являются, по!видимому, результатом
бантом увеличение уровней FFA в сыворотке
не периферического, а центрального CB1R!
раскормленных крыс было связано с повышени!
опосредованного действия римонабанта, либо
ем уровней внутримицелярных липидов через
они вторичны и возникают как ответ на приток
6 ч после однократного введения римонабанта,
субстратов, вызванный активацией липолиза и
которые впоследствии за 20 ч снижались до
гликогенолиза.
уровней более низких, чем у контрольных жи!
Ситуация может поменяться, при длитель!
вотных [29]. Это высвобождение FA из внутри!
ном приеме римонабанта, как это предусмотре!
мышечных/гепатоцеллюлярных липидов для их
но при лечении ожирения. Что касается предпо!
последующего окисления жирных кислот в мы!
лагаемого механизма реализации длительного
шечных/печеночных тканях может быть основа!
воздействия римонабанта, он может заключать!
но на стимуляции липолиза в миоцитах и гепато!
ся в том, что в высокой концентрации (>10 мкМ)
цитах как прямо, CB1R!зависимо, так и/или не!
и при длительном воздействии он способен сти!
зависимо, как это происходит в адипоцитах [23].
мулировать липолиз способом, независимым от
Таким образом, полученные результаты по!
функционального CB1R или других рецепторов,
зволяют по!новому взглянуть на наши предс!
связанных с системой вторичного мессенджера
тавления о рецептор!зависимом и независимом
сАМР-РКА [23]. Примечательно, что инкуба!
молекулярном действии CB1 и физиологичес!
ция с римонабантом нативных липидных вклю!
кой регуляции процессов деградации липидов и
чений, полученных из изолированных адипоци!
гликогена эндогенными каннабиноидами и их
тов крысы (но не эмульсии синтетических нейт!
антагонистами, в частности, аноректиком ри!
ральных липидов), приводила к повышению их
монабантом, который может быть апробирован
сродства к гормон!чувствительной липазе и
в будущем в качестве лекарственного лечебного
ускорению реакции липолиза. Механизм
препарата для терапии ожирения [30, 31].
действия римонабанта на липолиз в бесклеточ!
ной системе или на липидные включения, полу!
Конфликт интересов. Авторы заявляют об от!
ченные из обработанных римонабантом адипо!
сутствии конфликта интересов.
цитов, вероятно, опосредуется РКА!зависимым
Соблюдение этических норм. Данная статья
фосфорилированием жировых включений, а не
не содержит исследований с участием животных
самой гормон!чувствительной липазой. Пред!
или людей, выполненных кем!либо из авторов.
БИОХИМИЯ том 84 вып. 10 2019
ПРЯМОЕ ДЕЙСТВИЕ РИМОНАБАНТА В КЛЕТКАХ ПЕЧЕНИ И МЫШЦ
1419
СПИСОК ЛИТЕРАТУРЫ
1.
Sack, N., Hutcheson, J.R., Watts, J.M., and Webb, R.E.
17.
Kreamer, B.L., Steacker, J.L., Sawada, N., Sattler, G.L.,
(1990) Case report: the effect of tetrahydrocannabinol on
Hsia, M.T., and Pitot, H.C. (1986) Use of a low!speed, iso!
food intake during chemotherapy, J. Am. Coll. Nutr., 9,
density percoll centrifugation method to increase the via!
630-632.
bility of isolated rat hepatocyte preparations, In Vitro Cell.
2.
Di Marzo, V., Goparaju, S.K., Wang, L., Liu, J., Batkai,
Dev. Biol., 22, 201-211.
S., Jarai, Z., Fezza, F., Miura, G.I., and Palmiter, R.D.
18.
Minnich, A., Tian, N., Byan, L., and Bilder, G. (2001)
(2001) Leptin!regulated endocannabinoids are involved in
A potent PPARalpha agonist stimulates mitochondrial
maintaining food intake, Nature, 410, 822-825.
fatty acid beta!oxidation in liver and skeletal muscle,
3.
Di Marzo, V., and Matias, I. (2005) Endocannabinoid
Am. J. Physiol. Endocrinol. Metab., 280, E270-E279.
control of food intake and energy balance, Nature,
19.
Schmoll, D., Fuhrmann, E., Gebhardt, R., and
Neurosci., 8, 585-589.
Hamprecht, B. (1995) Significant amounts of glycogen are
4.
Cohen, K., Weizman, A., and Weinstein, A. (2019) Positive
synthesized from 3!carbon compounds in astroglial prima!
and negative effects of cannabis and cannabinoids on
ry cultures from mice with participation of the mitochon!
health, Clin. Pharmacol. Ther.,
105,
1139-1147,
drial phosphoenolpyruvate carboxykinase isoenzyme, Eur.
doi: 10.1002/cpt.1381.
J. Biochem., 227, 308-315.
5.
Benardis, L.L., and Bellinger, L.L. (1996) The lateral
20.
Muller, G., Jung, C., Wied, S., Welte, S., and Frick, W.
hypothalamic area revisited: ingestive behaviour, Neurosci.
(2001) Insulin!mimetic signaling by the sulfonylurea
Biobehav. Rev., 20, 189-287.
glimepiride and phosphoinositolglycans involves distinct
6.
Spiegelman, B.M., and Flier, J.S. (2001) Obesity and the
mechanisms for redistribution of lipid raft components,
regulation of energy balance, Cell, 104, 531-543.
Biochemistry, 40, 14603-14620.
7.
Barsh, G.S., and Schwartz, M.W.
(2002) Genetic
21.
Kahn, B.B., Alquier, T., Carling, D., and Hardie, D.G.
approaches to studying energy balance, Nat. Rev. Genet., 3,
(2005) AMP!activated protein kinase: ancient energy
589-600.
gauge provides clues to modern understanding of metabo!
8.
Hilairet, S., Bouaboula, M., Carriere, D., Le Fur, G., and
lism, Cell Metabolism, 1, 15-25.
Casellas, P. (2003) Hypersensitization of the orexin
1
22.
Kola, B., Hubina, E., Tucci, S.A., Kirkham, T.C.,
receptor by the CB1 receptor: evidence for cross!talk
Garcia, E.A., Mitchell, S.E., Williams, L.M., Hawley, S.A.,
blocked by the specific CB1 antagonist, SR141716, J. Biol.
Hardie, D.G., Grossman, A.B., and Korbonits, M. (2005)
Chem., 278, 23731-23737.
Cannabinoids and ghrelin have both central and peripher!
9.
Rinaldi!Carmona, M., Barth, F., Heaulme, M., Alonso, R.,
al metabolic and cardiac effects via AMP!activated protein
Shire, D., Congy, C., Soubrie, P., Breliere, J.C., and Le
kinase, J. Biol. Chem., 280, 25196-25201.
Fur, G. (1995) Biochemical and pharmacological charac!
23.
Muller, G.A., Herling, A.W., and Wied, S.
(2019)
terization of SR141716, the first potent and selective brain
Upregulation of phosphorylation of lipid droplet!associat!
cannabinoid receptor antagonist, Life Sci., 56, 1941-1947.
ed proteins in primary rat adipocytes by the cannabinoid
10.
Van Gaal, L.F., Rissanen, A.M., Scheen, A.J., Ziegler, O.,
receptor 1 antagonist rimonabant, Arch. Physiol., in press.
and Rossner, S. (2005) Effects of the cannabinoid!1 recep!
24.
Osei!Hyiaman D, DePetrillo M, Pacher P, Liu J, Radaeva S,
tor blocker rimonabant on weight reduction and cardiovas!
Batkai S, Harvey!White J, Mackie, K., Offertaler, L.,
cular risk factors in overweight patients: 1!year experience
Wang, L., and Kunos, G. (2005) Endocannabinoid activa!
from the RIO!Europe study, Lancet, 365, 1389-1397.
tion at hepatic CB1 receptors stimulates fatty acid synthesis
11.
Ravinet, T.C., Delgorge, C., Menet, C., Arnone, M., and
and contributes to diet!induced obesity, J. Clin. Invest.,
Soubrie, P. (2004) CB1 cannabinoid receptor knockout in
115, 1298-1305.
mice leads to leanness, resistance to diet!induced obesity
25.
Bensaid, M., Gary!Bobo, M., Esclangon, A., Maffrand, J.P.,
and enhanced leptin sensitivity, Int. J. Obes. Relat. Metab.
Le Fur, G., Oury!Donat, F., and Soubrie, P. (2003) The
Disord., 28, 640-648.
cannabinoid CB1 receptor antagonist SR141716 increases
12.
Gomez, R., Navarro, M., Ferrer, B., Trigo, J.M., Bilbao,
Acrp30 mRNA expression in adipose tissue of obese fa/fa rats
A., Del, A., Cippitelli, A., Nava, F., Piomelli, D., and
and in cultured adipocyte cells, Mol. Pharmacol., 63, 908-914.
Rodriguez, D.F. (2002) A peripheral mechanism for CB1
26.
Brown, D.A. (2001) Lipid droplets: proteins floating on a
cannabinoid receptor!dependent modulation of feeding,
pool of fat, Curr. Biol., 11, R446-R449.
J. Neurosci., 22, 9612-9617.
27.
Blanchette!Mackie, E.J., Dwyer, N.K., Barber, T., Coxey, R.A.,
13.
Freedland, C.S., Poston, J.S., and Porrino, L.J. (2000)
Takeda, T., Rondinone, C.M., Theodorakis, J.L.,
Effects of SR141716A, a central cannabinoid receptor
Greenberg, A.S. and Londos, C. (1995) Perilipin is located
antagonist, on food!maintained responsing, Pharmacol.
on the surface layer of intracellular lipid droplets in adipo!
Biochem. Behav., 67, 265-270.
cytes, J. Lipid Res., 36, 1211-1226.
14.
Jbilo, O., Ravinet!Trillou, C., Arnone, M., Buisson, I.,
28.
Yeaman, S.J. (2004) Hormone!sensitive lipase - new roles
Bribes, E., Peleraux, A., Penarier, G., Soubrie, P., Le Fur, G.,
for an old enzyme, Biochem. J., 379, 11-22.
Galiegue, S., and Casellas, P. (2005) The CB1 receptor
29.
Herling, A.W., Kilp, S., Juretschke, H.P., Neumann!
antagonist rimonabant reverses the diet!induced obesity
Haefelin, C., Gerl, M., and Kramer, W. (2008) Reversal of
phenotype through the regulation of lipolysis and energy
visceral adiposity in candy!diet fed female Wistar rats by
balance, FASEB J., 19, 1567-1569.
the CB1 receptor antagonist rimonabant, Int. J. Obes., 32,
15.
Ravinet, T.C., Arnone, M., Delgorge, C., Gonalons, N.,
1363-1372.
Keane, P., Maffrand, J.P., and Soubrie, P. (2003) Anti!obe!
30.
Lu, Y., and Anderson, H.D. (2017) Cannabinoid signaling
sity effect of SR141716, a CB1 receptor antagonist, in diet!
in health and disease, Can. J. Physiol. Pharmacol., 95,
induced obese mice, Am. J. Physiol. Regul. Integr. Comp.
311-327.
Physiol., 284, R345-R353.
31.
Simon, V., and Cota, D.
(2017) Mechanisms in
16.
Seglen, P.O. (1976) Preparation of isolated rat liver cells,
endocrinology: Endocannabinoids and metabolism: past,
Methods Cell Biol., 13, 29-83.
present and future, Eur. J. Endocrinol., 176, R309-R324.
БИОХИМИЯ том 84 вып. 10 2019
4*
1420
MÜLLER и др.
ANALYSIS OF DIRECT EFFECTS OF THE CB1 RECEPTOR
ANTAGONIST RIMONABANT ON FATTY ACID OXIDATION
AND GLYCOGENOLYSIS IN LIVER AND MUSCLE
CELLS in vitro
G. A. Müller1,2*, S. Wied3, and A. W. Herling3
1 Helmholtz Diabetes Center (HDC) at the Helmholtz Center for Health and Environment Munich, Institute for Diabetes
and Obesity (IDO), 85764 Oberschleissheim, Germany; E mail: guenter.mueller@helmholtz muenchen.de
2 Ludwig Maximilians University Munich, Department Biology I, Genetics, 82152 Planegg Martinsried, Germany
3 Sanofi Pharma Germany GmbH, Diabetes Research, 65926 Frankfurt am Main, Germany
Received February 4, 2019
Revised June 24, 2019
Accepted June 25, 2019
Recent pharmacological findings regarding rimonabant, an anorectic and cannabinoid type 1 receptor (CB1R) antag!
onist, strongly suggest that some of its effects on the metabolic parameters and energy balance in rats are not related
to the centrally mediated reduction in caloric intake. Instead, they may be associated with acute induction of
glycogenolysis in the liver, in combination with transient increase in glucose oxidation and persistent increase in fat
oxdation. It is possible that rimonabant produced direct short! or long!term stimulatory effect on these processes in
primary and cultured rat cells. Rimonabant slightly stimulated β!oxidation of long!chain fatty acids in cultured rat
myocytes overexpressing glucose transporter isoform 4, as well as activated phosphorylation of adenosine monophos!
phate!dependent protein kinase (AMPK) in primary rat hepatocytes upon long!term incubation. However, short!
term action of rimonabant failed to stimulate β!oxidation in myocytes, myotubes, and hepatocytes, as well as to
upregulate AMPK phosphorylation, glycogenolysis, and cAMP levels in hepatocytes. As a consequence, the acute
effects of rimonabant on hepatic glycogen content (reduction) and total energy expenditure (increase) in rats fed with
a standard diet cannot be explained by direct stimulation of glycogenolysis and fatty acid oxidation in muscles and
liver. Rather, these effects seem to be centrally mediated.
Keywords: AMP! and cAMP!dependent signaling, cannabinoid receptor 1, glucose and lipid metabolism, obesity
БИОХИМИЯ том 84 вып. 10 2019