БИОХИМИЯ, 2019, том 84, вып. 10, с. 1421 - 1436
УДК 577.24
ПРОТОНОФОРНОЕ И ФОТОДИНАМИЧЕСКОЕ ДЕЙСТВИЕ
КОНЪЮГАТА ФЛУОРЕСЦЕИНА
С ДЕЦИЛ(ТРИФЕНИЛ)ФОСФОНИЕМ НА ЭЛЕКТРИЧЕСКУЮ
АКТИВНОСТЬ НЕЙРОНОВ ПРУДОВИКА*
© 2019
Л.Б. Попова, А.Л. Камышева, Т.И. Рокицкая, Г.А. Коршунова, Р.С. Кирсанов,
Е.А. Котова, Ю.Н. Антоненко**
НИИ физико химической биологии им. А.Н. Белозерского,
Московский государственный университет им. М.В. Ломоносова,
119991 Москва, Россия; электронная почта: antonen@genebee.msu.ru
Поступила в редакцию 18.02.2019
После доработки 06.06.2019
Принята к публикации 17.06.2019
Разобщители окислительного фосфорилирования в митохондриях, сыгравшие ключевую роль в раскры!
тии основ биоэнергетики клетки, в последнее время вызывают значительный интерес как перспективные
соединения для создания медицинских препаратов, обладающие, в частности, нейропротекторными
свойствами. В настоящей работе изучено действие митофлуоресцеина (mitoFluo), нового протонофорно!
го разобщителя на основе флуоресцеина, представляющего собой конъюгат флуоресцеина с децил(трифе!
нил)фосфонием, на электрическую активность нейронов моллюска Lymnaea stagnalis. Показано, что
mitoFluo деполяризует нейроны и модифицирует спайковую активность, вызывая расширение спайков,
снижение их амплитуды и увеличение частоты. Длительное воздействие высоких (десятки микромолей)
концентраций mitoFluo приводит к полному подавлению электрической активности нейронов. Качест!
венно влияние mitoFluo на активность нейронов подобно соответствующим эффектам классического ми!
тохондриального разобщителя карбонилцианид!м!хлорфенилгидразона, но обнаруживается при гораздо
более длительном воздействии и больших концентрациях. Отличительной особенностью mitoFluo явля!
ется его фотоиндуцированное действие на электрическую активность нейронов. Наблюдаемые при осве!
щении в присутствии mitoFluo изменения параметров активности нейронов близки к светоиндуцирован!
ным эффектам известного фотосенсибилизатора бенгальского розового, но менее выражены. Предпола!
гается, что действие mitoFluo на электрическую активность нейронов, как митохондриального разобщи!
теля и как фотосенсибилизатора, опосредовано изменениями концентрации ионов кальция в цито!
плазме.
КЛЮЧЕВЫЕ СЛОВА: нейрон, мембранный потенциал, потенциал действия, разобщитель, протонофор,
митохондрии.
DOI: 10.1134/S0320972519100051
Известно, что восстановление кровотока
других травм [4] мозга, обусловленное, как
(реперфузия) после периода снижения крово!
предполагается, способностью разобщителей
снабжения (ишемии) приводит к значительным
окислительного фосфорилирования подавлять
повреждениям тканей мозга, связанным в зна!
генерацию АФК из!за ее зависимости от мем!
чительной степени с образованием активных
бранного потенциала митохондрий [2, 5-7]. Раз!
форм кислорода (АФК). В ряде работ показано
общители - это соединения, способные за счет
защитное действие митохондриальных разоб!
переноса протонов через мембрану [8] вызывать
щителей в моделях ишемии!реперфузии [1-3] и
диссипацию разности электрохимических по!
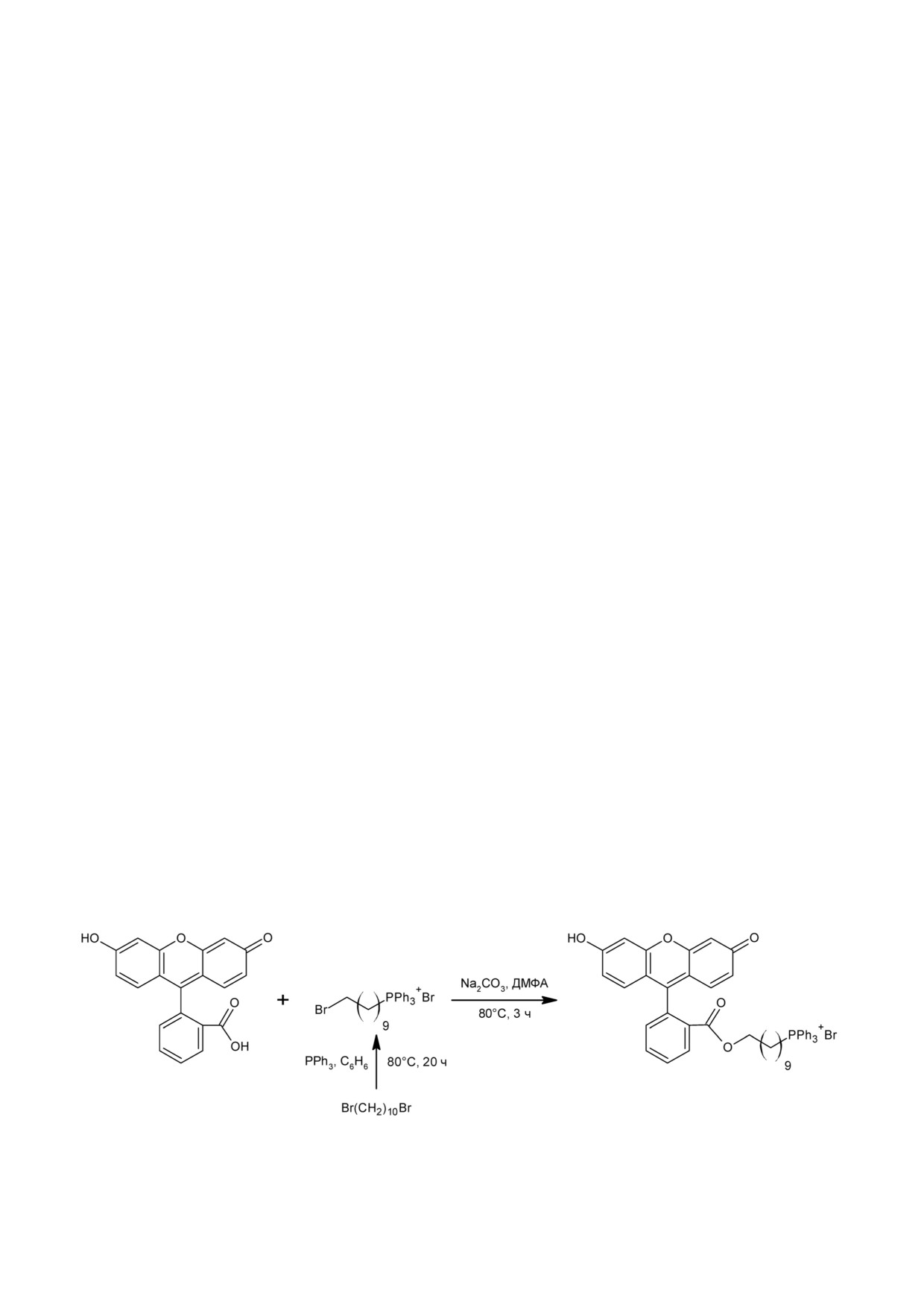
Принятые сокращения: mitoFluo (митофлуоресцеин) - {10![2!(3!гидрокси!6!оксоксантен!9!ил)бензоил]оксиде!
цил}(трифенил)фосфоний бромид; КЦХФ - карбонилцианид!м!хлорфенилгидразон; ФКФ - карбонилцианид!n!триф!
торметокси!фенилгидразон; ДНФ - 2,4!динитрофенол; DPhPC - дифитаноилфосфатидилхолин; гА - грамицидин А;
CGC - гигантский церебральный нейрон; B1, B2, B4 - буккальные нейроны; БЛМ - бислойная липидная мембрана;
АФК - активные формы кислорода.
*Первоначально английский вариант рукописи опубликован на сайте «Biochemistry» (Moscow) http://protein.bio.
msu.ru/biokhimiya, в рубрике «Papers in Press», BM19!041, 19.08.2019.
** Адресат для корреспонденции.
1421
1422
ПОПОВА и др.
тенциалов протонов на внутренней мембране
флуоресцеина, нового разобщителя на основе
митохондрий, тем самым нарушая сопряжение
флуоресцеина, представляющего собой конъю!
между переносом электрона по дыхательной це!
гат флуоресцеина с децил(трифенил)фосфони!
пи и синтезом АТФ [9, 10].
ем (mitoFluo, [12]) и традиционного разобщите!
Наблюдаемый в последние годы всплеск ин!
ля КЦХФ на электрическую активность нейро!
тереса к разобщителям наряду с перспективами
нов моллюска Lymnaea stagnalis. Наряду с темно!
их использования в борьбе с ожирением и бо!
вым действием, обнаружено и изучено фотоин!
лезнями, связанными с окислительным стрес!
дуцированное действие mitoFluo как на частоту
сом, включая нейродегенеративные заболева!
спайковой активности, так и на форму спайков.
ния, обусловлен также их антимикробным и
Показано, что разные типы нейронов моллюска
противораковым действием. В связи с этим в ря!
проявляют различную чувствительность к
де лабораторий предпринимаются попытки соз!
действию разобщителей.
дания разобщителей, обладающих новыми по!
лезными свойствами. Так, нами синтезированы
и изучены разобщители на основе производных
МЕТОДЫ ИССЛЕДОВАНИЯ
известного флуорофора флуоресцеина [4, 11, 12].
Особенностью этих разобщителей является на!
Большинство использованных в работе хи!
личие яркой флуоресценции, позволяющей су!
мических реактивов, в том числе КЦХФ, были
дить об их накоплении в клетках и их компарт!
приобретены у фирмы «Sigma» (США). Флуо!
ментах. Однако у фотоактивности может быть
ресцирующий разобщитель mitoFluo (митофлуо!
обратная сторона: как многие красители, произ!
ресцеин, конъюгат флуоресцеина и децил(три!
водные флуоресцеина могут быть фотодинами!
фенил)фосфония) был синтезирован как описа!
чески активны, т.е. способны сенсибилизиро!
но нами ранее [12]. Синтез был осуществлен в
вать фотоповреждение клеток в присутствии
две стадии (представлено на схеме). На первом
кислорода. Хорошей моделью для изучения
этапе раствор 1,10!дибромдекана (7,2 ммоль) и
действия разобщителей на нервные клетки яв!
трифенилфосфина (4,7 ммоль) в бензоле нагре!
ляется электрическая активность нейронов
вали при 80 °С в течение 20 ч в плотно закрытом
моллюсков. В работе [13] нами показано, что
сосуде. После завершения реакции смесь охлаж!
классические разобщители, такие как карбо!
дали до комнатной температуры и упаривали
нилцианид м!хлорфенил гидразон (КЦХФ) и
досуха. Далее продукт (10!бромдецил(трифе!
2,4!динитрофенол (ДНФ), вызывают деполяри!
нил)фосфоний бромид) выделяли многократ!
зацию плазматической мембраны нейронов и
ным переосаждением из дихлорметана диэтило!
расширение спайков, причем эти эффекты
вым эфиром с последующей очисткой колоночной
опосредованы, по всей видимости, действием
хроматографией (MN Kieselgel 60, 240-400 mesh),
разобщителей на митохондрии нейронов. В ли!
используя смесь этанол!дихлорометан (1 : 5) в
тературе также имеются данные о деполяриза!
качестве элюента. На втором этапе к раствору
ции плазматической мембраны культивируемых
флуоресцеина (2,0 ммоль) и карбоната натрия
нейрональных клеток, а также изолированных
(3,8 ммоль) в 40 мл ДМФА, нагретому до 60 °С,
нервных окончаний под действием таких клас!
прибавили раствор ранее полученного 10!бром!
сических разобщителей как КЦХФ [14] и карбо!
децил(трифенил)фосфоний бромида (2 ммоль)
нилцианид!n!трифторметокси!фенилгидразон
в минимальном объеме CH2Cl2. Реакцию прово!
(ФКФ) [14, 15]. В настоящей работе предприня!
дили 3 ч при 60 °С, затем охлаждали до комнат!
то сравнительное исследование влияния мито!
ной температуры и разбавляли 100 мл CH2Cl2.
-
-
Схема
БИОХИМИЯ том 84 вып. 10 2019
ДЕЙСТВИЕ МИТОФЛУОРЕСЦЕИНА НА НЕЙРОНЫ
1423
Продукт реакции, {10![2!(3!гидрокси!6!оксо!
потенциалов AxoClamp 2B (Axon Instruments),
ксантен!9!ил)бензоил]оксидецил}(трифенил)фос!
который позволяет инъецировать ток через
фоний бромид (mitoFluo), экстрагировали дих!
микроэлектрод. Полученные данные записыва!
лорметаном и очищали с помощью колоночной
ли на компьютер с помощью аналого!цифрово!
хроматографии на силикагеле, используя смесь
го преобразователя DigiData 1200 series и про!
этанол!дихлорметан (1 : 5) в качестве элюента
граммы pCLAMP 8 («Molecular Devices», United
(схема).
States). Статистическую обработку данных про!
Электрофизиологические эксперименты
водили с помощью программы SigmaPlot 9,0
проводили на нейронах брюхоногого моллюска
(«Systat Software», United States). Для количест!
прудовика Lymnaea stagnalis. Прудовиков выра!
венной оценки влияния вещества на работу
щивали в лаборатории в аквариуме с пресной
клетки измеряли межспайковый мембранный
водой. Центральную нервную систему моллюс!
потенциал нейрона, амплитуду спайка, полуши!
ка, состоящую из ганглиев окологлоточного
рину спайка, скорость деполяризации и реполя!
нервного кольца и буккальных ганглиев, выре!
ризации мембраны во время спайка, а также
зали и переносили в ванночку, выстланную си!
среднюю частоту спайков. Эти параметры изме!
ликоном (Silgard) и заполненную солевым раст!
ряли и усредняли в течение 1 мин перед добав!
вором. Стандартный солевой раствор содержал
лением вещества и в течение 1 мин после добав!
(мM): 44,0 NaCl, 2,0 KCl, 4,0 CaCl2, 1,5 MgCl2,
ления, в области, где реакция нейрона была на!
10,0 HEPES, pH 7,6. Чтобы облегчить проник!
иболее выражена. Иногда при высокой частоте
новение регистрирующих электродов в нейро!
потенциалов действия и равномерной работе
ны, оболочки ганглиев предварительно размяг!
клетки, интервал измерений сокращали до 30 с.
чали 0,1%!ным раствором проназы (protease
Для определения статистической значимости
Type XIV, «Sigma») в течение 10 мин. Затем пос!
различий парных измерений до и после добав!
ле отмывания фермента разрезали церебраль!
ления вещества для всех клеток использовали
ную комиссуру. Ганглии раскалывали на дне
парный t!критерий Стьюдента. В случаях, когда
ванночки миниатюрными иголками так, чтобы
данные не имели нормального распределения,
можно было хорошо видеть нейроны, которые
применяли метод непараметрической статисти!
визуально идентифицируются, и функции кото!
ки - t!критерий Вилкоксона.
рых хорошо изучены и описаны [16], в том чис!
Митохондрии выделяли из печени крыс по
ле гигантский церебральный нейрон (CGC),
методике, описанной в работе [18].
буккальные нейроны (B1, B2, B4) [17], а также
Бислойную липидную мембрану (БЛМ)
крупные нейроны из педального и висцерально!
формировали из 2%!ного раствора дифитаноил!
го ганглиев. Нейронную активность регистри!
фосфатидилхолина (DPhPC) (Avanti Polar
ровали с помощью внутриклеточных стеклян!
Lipids) в декане на отверстии в перегородке, раз!
ных микроэлектродов, заполненных 2 М KCl
деляющей на два отсека тефлоновую ячейку, со!
(сопротивление кончика 20-60 МОм). В неко!
держащую буферный раствор [19]. Диаметр от!
торых экспериментах под визуальным контро!
верстия составлял
0,5 мм. Грамицидин А
лем в нейрон вводили два микроэлектрода, один
(«Sigma») добавляли из концентрированного
из которых служил для пропускания токов, а
раствора в спирте в водный раствор с двух сто!
второй для измерения сдвигов потенциала. Из!
рон мембраны и тщательно перемешивали в те!
вестно, что изолированные ганглии моллюсков
чение 15 мин. MitoFluo добавляли из концен!
длительное время (более 10 ч) сохраняют спо!
трированных растворов в этаноле в водный
собность к выполнению функций, так сказать
раствор с транс!стороны мембраны (цис!сторо!
фиктивно, т.е. без афферентных и эфферентных
на являлась передней стороной по отношению к
органов. Действующее вещество в объеме 5-50 мкл
лампе!вспышке) и тщательно перемешивали в
добавляли из стокового раствора в ванночку (2 мл)
течение 20 мин. Водный раствор содержал 100 мМ
пипеткой в течение 20-30 с. В опытах по отмы!
KCl, 10 мМ Тris, рН 7,4. Все эксперименты про!
ванию mitoFluo его раствор в ванночке объемом
водили при комнатной температуре (23-25 °С).
2 мл с помощью 0,5!мл пипетки постепенно за!
Электрический ток через БЛМ регистрировали
меняли на солевой раствор. Использовали 20 мл
в условиях фиксации потенциала. Разность по!
чистого солевого раствора. Исходная концент!
тенциалов подавали на хлор!серебряные элект!
рация раствора mitoFluo уменьшалась в ~6000 раз.
роды, помещенные в тефлоновую ячейку. Ток
Освещение нейронов осуществляли светоди!
измеряли с помощью усилителя Keithley 428
одной лампой TDS!P005L8011 (свет белый 140",
(Keithley Instruments), оцифровывали с по!
350 люмен, 5 Ватт) через волоконный световод.
мощью NI!DAQmx (National Instruments) и ана!
Измерения мембранного потенциала прово!
лизировали с использованием компьютерной
дили с помощью двухканального усилителя био!
программы WinWCP Strathclyde Electrophysio!
БИОХИМИЯ том 84 вып. 10 2019
1424
ПОПОВА и др.
logy Software, написанной Дж. Демпстером
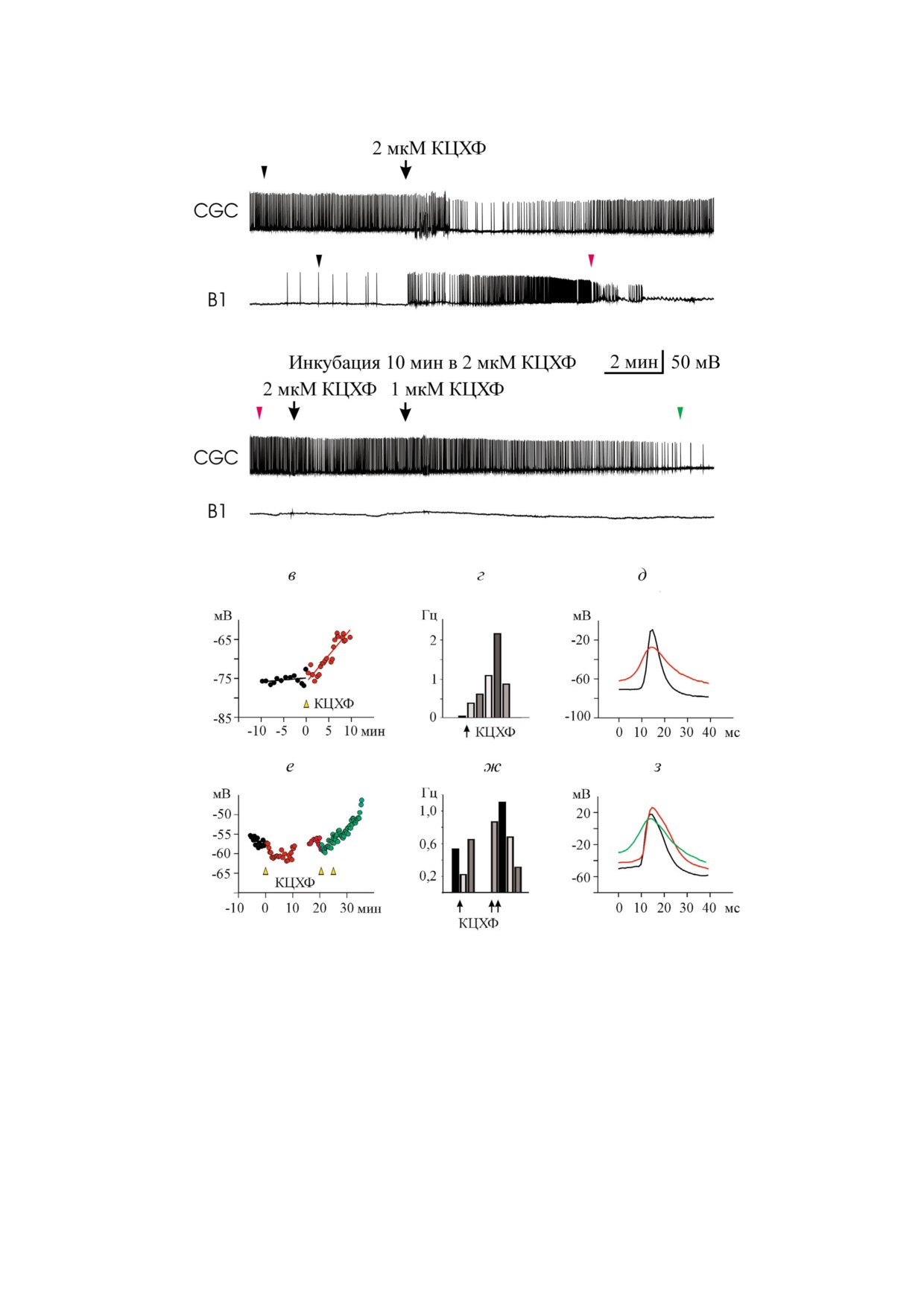
ции КЦХФ (рис. 1, в, рис. 2, в, рис. 1, е и рис. 2, е).
(University of Strathclyde). БЛМ освещали источ!
Для всех исследованных нами нейронов можно
ником постоянного света - галогеновой лампой
было подобрать концентрацию разобщителей,
(«Novaflex», World precision Instruments) с плот!
которая приводила к деполяризации плазмати!
ностью мощности 0,77 Вт/см2 в течение 60 с.
ческой мембраны, как это описано нами ранее
Стеклянный фильтр, отсекающий свет с длиной
на буккальных клетках [13]. Иногда перед депо!
волны < 500 нм, был помещен между лампой и
ляризацией развивалась небольшая гиперполя!
ячейкой.
ризация плазматической мембраны (рис. 1, в и
рис. 2, е).
Наряду с деполяризацией выявлена тенденция
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
к увеличению частоты генерации потенциалов
действия (рис. 1, г, рис. 2, г, рис. 1, ж и рис. 2, ж)
Действие классического разобщителя КЦХФ
в присутствии КЦХФ. Параллельно наблюда!
на электрическую активность клеток изолированG
лось падение амплитуды и расширение спайков
ных ганглиев Lymnaea stagnalis. В первой части
(рис. 1, д, рис. 2, д, рис. 1, з и рис. 2, з). В конеч!
работы подробно изучено действие традицион!
ном итоге происходило «замолкание» (полное
ного митохондриального разобщителя КЦХФ
подавление спайковой активности) нейронов,
на электрическую активность клеток изолиро!
причем у буккальной клетки оно наступало при
ванных ганглиев Lymnaea stagnalis. Среди рас!
существенно меньших концентрациях разобщи!
сматриваемых клеток были мотонейроны бук!
теля, чем у гигантской церебральной клетки.
кальных ганглиев (B1, B2, B4), участвующих в
Существенные изменения параметров электри!
работе буккального аппарата, гигантская клетка
ческой активности буккальных клеток наблюда!
церебральных ганглиев (CGC), регулирующая
лись уже после добавления 0,15 мкМ КЦХФ в
работу всего буккального аппарата и являющая!
омывающий раствор.
ся серотонинергической модулирующей клет!
В случае гигантской церебральной клетки
кой, а также клетки висцеральных и педальных
КЦХФ вызвал деполяризацию плазматической
ганглиев. Было проведено 13 экспериментов и
мембраны в концентрации 0,45 мкМ (рис. 1, е).
зарегистрирована электрическая активность
При этом средняя частота спайковой активнос!
10 гигантских церебральных нейронов, 10 бук!
ти нейрона CGC увеличилась почти в 2 раза
кальных, 7 висцеральных и 2 педальных клеток.
(рис. 1, ж). Средняя частота спайков всех заре!
Буккальные нейроны формируют центральный
гистрированных нейронов CGC под воздей!
генератор жевательного ритма, который в норме
ствием КЦХФ увеличилась на 33% с 0,69 Гц до
обеспечивает питание прудовика. О работе ге!
0,92 Гц (парный t!критерий Стьюдента: р = 0,05).
нератора можно судить по ритмичной смене
Данные для всех зарегистрированных буккаль!
залпов спайковой активности и периодов тор!
ных и церебральных нейронов показаны в табл. 1
можения нейронов В1, В2 и В4 [16]. Гигантский
и табл. 2. Отметим, что повышение частоты по!
церебральный нейрон не включен в генератор и
тенциалов действия под влиянием КЦХФ было
не имеет ритмичной активности. Он оказывает
описано ранее на кардиомиоцитах в работе [20].
модулирующее действие, т.е. регулирует интен!
Рис. 1, д, рис. 2, д, рис. 1, з и рис. 2, з иллюст!
сивность работы генератора [17]. На рис. 1 и
рируют влияние низких (от 0,15 мкМ) и высоких
рис. 2 показана одновременная регистрация
(от 2 мкм) концентраций КЦХФ на форму спай!
электрической активности буккального нейро!
ков клеток B1 и CGC, выбранных в моменты
на 1 (В1) и гигантского церебрального нейрона
времени, указанные треугольниками соответ!
(CGC) из изолированных ганглиев прудовика.
ствующих цветов на рис. 1, а, б и рис. 2, а, б. Пос!
При длительной регистрации этих клеток в
тепенное расширение спайков и уменьшение их
контроле (в течение 30-60 мин в изолирован!
амплитуды началось одновременно с деполяри!
ных ганглиях, помещенных в стандартный соле!
зацией плазматической мембраны и достигло
вой раствор) их мембранный потенциал, изме!
наибольшей величины перед тем, как клетка «за!
ренный в промежутках между спайками, коле!
молчала». Как видно из табл. 1, средняя ампли!
бался в пределах 5 мВ.
туда спайков всех зарегистрированных буккаль!
При добавлении КЦХФ спустя небольшой
ных клеток уменьшилась на 24%, с 56,52 ± 4,41 мВ
промежуток времени наблюдали деполяриза!
в контроле до 42,82 ± 3,75 мВ в присутствии
цию плазматической мембраны нейронов и су!
КЦХФ (указаны средние и стандартные ошиб!
щественные изменения в их спайковой актив!
ки; парный t!критерий: p = 0,027). Средняя
ности (рис. 1, а, б, рис. 2, а, б), причем увеличе!
амплитуда спайка клеток CGC (табл. 2), умень!
ние мембранного потенциала происходило пос!
шилась на 7%, с 74,92 ± 1,74 мВ в контроле до
ле лаг!периода, который зависел от концентра!
69,56 ± 2,11 мВ в присутствии КЦХФ (парный
БИОХИМИЯ том 84 вып. 10 2019
ДЕЙСТВИЕ МИТОФЛУОРЕСЦЕИНА НА НЕЙРОНЫ
1425
a
б
Рис. 1. Влияние субмикромолярной концентрации карбонилцианид!м!хлорфенилгидразона (КЦХФ) на спонтанную ак!
тивность нейронов прудовика. а - КЦХФ в концентрации 0,15мкМ вызывал деполяризацию плазматической мембраны,
учащение потенциалов действия и последующее «замолкание» буккального нейрона В1, при этом он не оказывал суще!
ственного влияния на работу гигантского церебрального нейрона (CGC); б - воздействие 0,15 мкМ КЦХФ в течение двух
часов незначительно повлияло на работу CGC. Увеличение концентрации до 0,45 мкМ КЦХФ привело к деполяризации
мембраны, учащению потенциалов действия и последующему «замолканию» церебрального нейрона; в, г, д - межспай!
ковый мембранный потенциал, средняя частота спайков и наложение потенциалов действия нейрона В1; е, ж, з - то же
для гигантского церебрального нейрона CGC; в, е - за 0 на шкале времени принят момент первого (в) или второго (е) до!
бавления КЦХФ (отмечены стрелками на а и б); ж - средняя частота спайков в 0,15 мкМ КЦХФ в течение двух часов не
отличалась от контрольной. Третий и четвертый столбец показывают среднюю частоту спайков в интервалы времени 0-5 мин
и 5-10 мин после третьего добавления КЦХФ; д, з - места расположения спайков отмечены треугольниками соответству!
ющих цветов на а и б. Контрольный спайк показан черным.
journal/biokhsm/
БИОХИМИЯ том 84 вып. 10 2019
1426
ПОПОВА и др.
а
б
Рис. 2. Карбонилцианид!м!хлорфенилгидразон (КЦХФ) в микромолярных концентрациях оказывал влияние на спон!
танную активность как буккального нейрона В1, так и гигантского церебрального нейрона (CGC) прудовика. а - При до!
бавлении 2 мкМ КЦХФ в нейроне В1 развивалась деполяризация плазматической мембраны, наблюдалось увеличение
частоты потенциалов действия и последующее «замолкание» нейрона, в то время как в нейроне CGC гиперполяризация
мембраны и торможение спайковой активности сменились небольшой деполяризацией и постепенным повышением ча!
стоты потенциалов действия; б -увеличение общей концентрации КЦХФ до 5 мкМ привело к дальнейшей деполяриза!
ции мембраны CGC и увеличению частоты спайков, которое сменилось полным торможением спайковой активности
нейрона CGC. Мембранный потенциал нейрона В1 менялся незначительно; в, г, д - межспайковый мембранный потен!
циал, средняя частота спайков и наложение потенциалов действия нейрона В1; е, ж, з - то же для гигантского церебраль!
ного нейрона CGC; в, е - за 0 на шкале времени принят момент первого добавления КЦХФ (отмечен стрелкой на А);
г, ж - гистограммы средней частоты спайков построены с интервалом времени 1,5 и 5 мин соответственно; д, з - места
расположения спайков отмечены треугольниками соответствующих цветов на а и б. Контрольный спайк показан черным.
journal/biokhsm/
БИОХИМИЯ том 84 вып. 10 2019
ДЕЙСТВИЕ МИТОФЛУОРЕСЦЕИНА НА НЕЙРОНЫ
1427
Таблица 1. Влияние карбонилцианид!м!хлорфенилгидразона (КЦХФ) на буккальные нейроны (В1, В2, В4) изолирован!
ных ганглиев прудовика (Lymnaea stagnalis)
Буккальные нейроны, n = 10
Контроль, среднее
КЦХФ, среднее
Парный t!критерий
Изменение в процентах
значение ± ст.
значение ± ст.
Стьюдента или
ошибка
ошибка
t!критерий Вилкоксона
Мембранный потенциал (мВ)
-49,88 ± 4,58
-43,48 ± 4,77
p = 0,011
деполяризация на 9%
Амплитуда спайка (мВ)
56,52 ± 4,41
42,82 ± 3,75
p = 0,027
уменьшение на 24%
Полуширина спайка (мс)
7,76 ± 1,44
12,35 ± 1,68
p = 0,005
расширение на 59%
Макс. скорость деполяриза!
21,92 ± 3,73
10,22 ± 2,57
p = 0,014
замедление на 46,6%
ции спайка (мВ/мс)
Макс. Скорость реполяриза!
-10,47 ± 1,76
-5,50 ± 1,45
p = 0,011
замедление на 52,5%
ции спайка (мВ/мс)
Средняя частота спайков (Гц)
1,98 ± 0,60
5,65 ± 1,23
p = 0,002
увеличение на 185%
Таблица 2. Влияние карбонилцианид!м!хлорфенилгидразона (КЦХФ) на гигантские церебральные нейроны (CGC)
изолированных ганглиев прудовика (Lymnaea stagnalis)
Гигантский церебральный
Контроль, среднее
КЦХФ, среднее
Парный t!критерий
Изменение
нейрон (CGC), n = 10
значение ± ст.
значение ± ст.
Стьюдента или
в процентах
ошибка
ошибка
t!критерий Вилкоксона
Мембранный потенциал (мВ)
-59,10 ± 4,56
-52,72 ± 4,17
p < 0,001
деполяризация на 11%
Амплитуда спайка (мВ)
74,92 ± 1,74
69,56 ± 2,11
p = 0,001
уменьшение на 7%
Полуширина спайка (мс)
16,44 ± 2,29
18,96 ± 1,86
p = 0,020
расширение на 15%
Макс. скорость деполяриза!
17,01 ± 1,29
12,90 ± 1,23
p = 0,002
замедление на 24%
ции спайка (мВ/мс)
Макс. скорость реполяриза!
-6,10 ± 0,60
-3,98 ± 0,35
p = 0,004
замедление на 35%
ции спайка (мВ/мс)
Средняя частота спайков (Гц)
0,69 ± 0,06
0,92 ± 0,07
p = 0,050
увеличение на 34%
t критерий: р = 0,001). Существенно измени!
ны во время спайка на 20-30% сопровождалось
лись скорости деполяризации и реполяризации
расширением спайков в растворе КЦХФ. Так,
спайков. Так, у буккальных клеток максималь!
полуширина потенциалов действия буккальных
ные скорости деполяризации и реполяризации
клеток увеличилась в среднем на 59%, а полу!
спайка уменьшились приблизительно в 2 раза:
ширина спайков нейронов CGC - на 15% (пар!
с 21,92 ± 3,73 мВ/мс и -10,47 ± 1,76 мВ/мс, соот!
ный t!критерий: p = 0,005 и p = 0,020, соответ!
ветственно, в контроле до 10,22 ± 2,57 мВ/мс и
ственно; табл. 1 и табл. 2). Ранее наблюдалось
-5,50 ± 1,45 мВ/мс, соответственно, в присутствии
увеличение продолжительности потенциалов
КЦХФ (парный t!критерий: p = 0,014 и p = 0,011,
действия под действием КЦХФ и ФКФ на культу!
соответственно; табл. 1). У клеток CGC макси!
ре нейрональных клеток [14].
мальные скорости деполяризации и реполяриза!
Нами было проведено шесть экспериментов
ции спайка уменьшились с 17,01 ± 1,29 мВ/мс и
по исследованию влияния ДНФ на электриче!
-6,10 ± 0,6 мВ/мс, соответственно, в контроле
скую активность нейронов прудовика. Регист!
до 12,9 ± 1,23 мВ/мс и -3,98 ± 0,35 мВ/мс, со!
рировали нейроны разных типов и количество
ответственно, в присут!ствии КЦХФ (t!критерий
опытов недостаточно для определения статис!
Вилкоксона: p = 0,002 и парный t!критерий: p =
тической значимости различий парных измере!
0,004, соответственно; табл. 2). Замедление ско!
ний до и после добавления ДНФ. Однако, cле!
рости деполяризации и реполяризации мембра!
дует отметить, что действие ДНФ подобно опи!
БИОХИМИЯ том 84 вып. 10 2019
1428
ПОПОВА и др.
mitoFluo
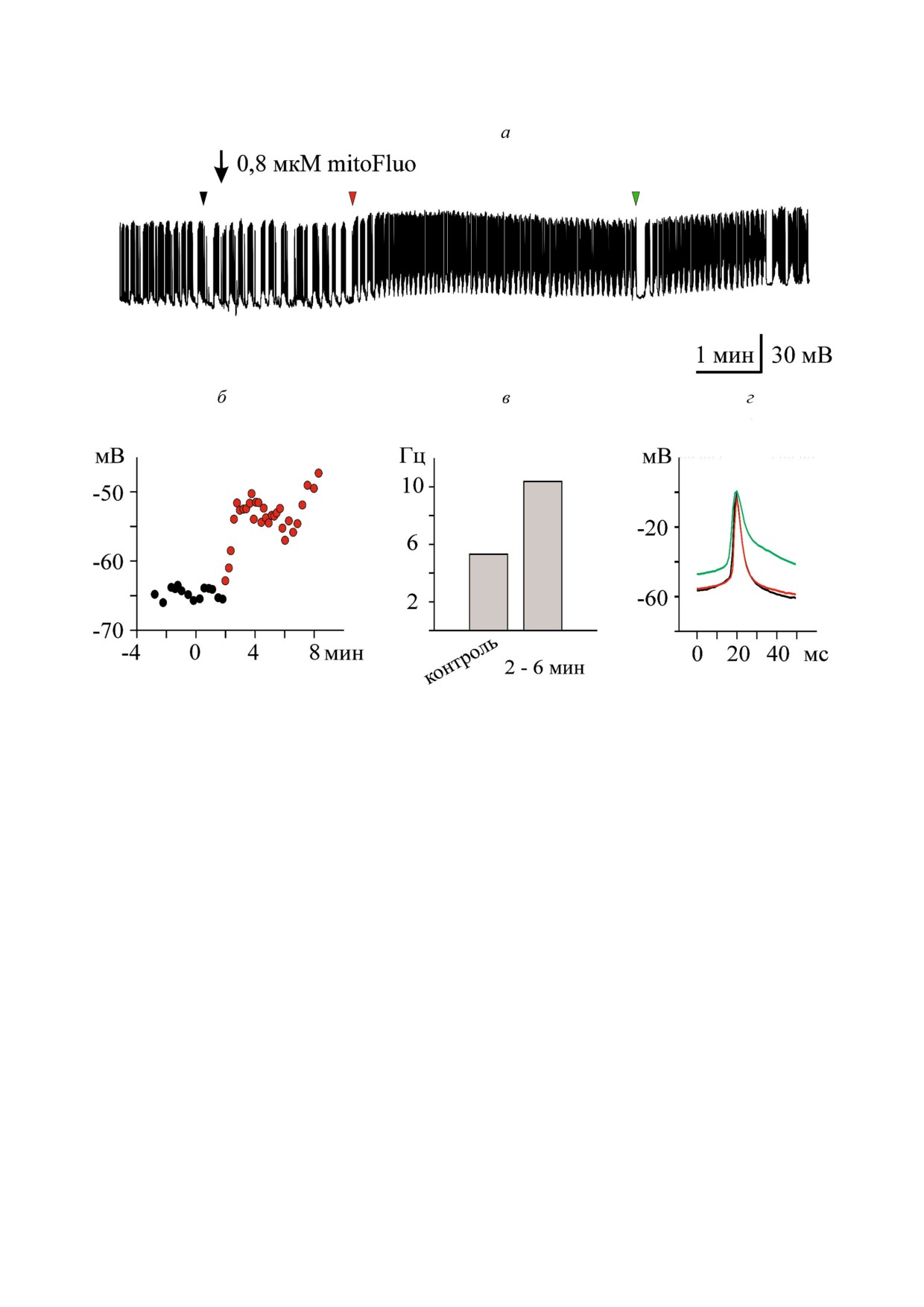
Рис. 3. Влияние низкой концентрации mitoFluo на спонтанную активность нейронов прудовика. а - MitoFluo в концен!
трации 0,8 мкМ вызывал деполяризацию плазматической мембраны и учащение потенциалов действия буккального ней!
рона В4; б - межспайковый мембранный потенциал быстро возрастал после добавления mitoFluo. За 0 на шкале времени
принят момент добавления mitoFluo. Латентный период реакции составил около 2 мин; в - средняя частота потенциалов
действия при добавлении mitoFluo увеличилась в 2 раза по сравнению с контролем. Первый столбец - средняя частота
спайков в течение 4 мин перед добавлением mitoFluo; второй столбец - средняя частота спайков в течение 4 мин через 2
мин после добавления mitoFluo; г - наложение потенциалов действия. MitoFluo снижал скорость деполяризации и репо!
ляризации спайка. Места расположения спайков отмечены треугольниками соответствующих цветов на а. Контрольный
спайк показан черным.
journal/biokhsm/
санному выше действию КЦХФ. Во всех экспе!
буккальные нейроны, тогда как гигантский це!
риментах наблюдалось увеличение мембранно!
ребральный нейрон реагировал существенно
го потенциала, расширение спайков и уменьше!
позже (данные не приведены).
ние их амплитуды, что согласуется с ранними
Влияние mitoFluo на электрическую активG
данными по действию ДНФ на электрическую
ность нейронов Lymnaea stagnalis. Для изучения
активность возбудимых мембран [21, 22], и в ко!
действия mitoFluo было проведено 20 экспери!
нечном итоге происходило прекращение элект!
ментов, при этом была зарегистрирована актив!
рической активности нейрона. Для возникнове!
ность
18 гигантских церебральных клеток,
ния таких изменений требовалось от 150 мкМ до
29 буккальных клеток, а также одной висцераль!
500 мкМ ДНФ. Как и в случае КЦХФ, от концен!
ной и одной педальной клетки. На рис. 3 пока!
трации сильно зависело время начала измене!
зан типичный опыт по действию низкой кон!
ния активности нейронов. Если при 150 мкМ
центрации mitoFluo на работу буккального ней!
это были десятки минут, то при 500 мкМ требо!
рона B4. Добавление 0,8 мкМ разобщителя вы!
вались лишь минуты. Также первыми отвечали
зывало деполяризацию нейрона (рис. 3, б), уве!
БИОХИМИЯ том 84 вып. 10 2019
ДЕЙСТВИЕ МИТОФЛУОРЕСЦЕИНА НА НЕЙРОНЫ
1429
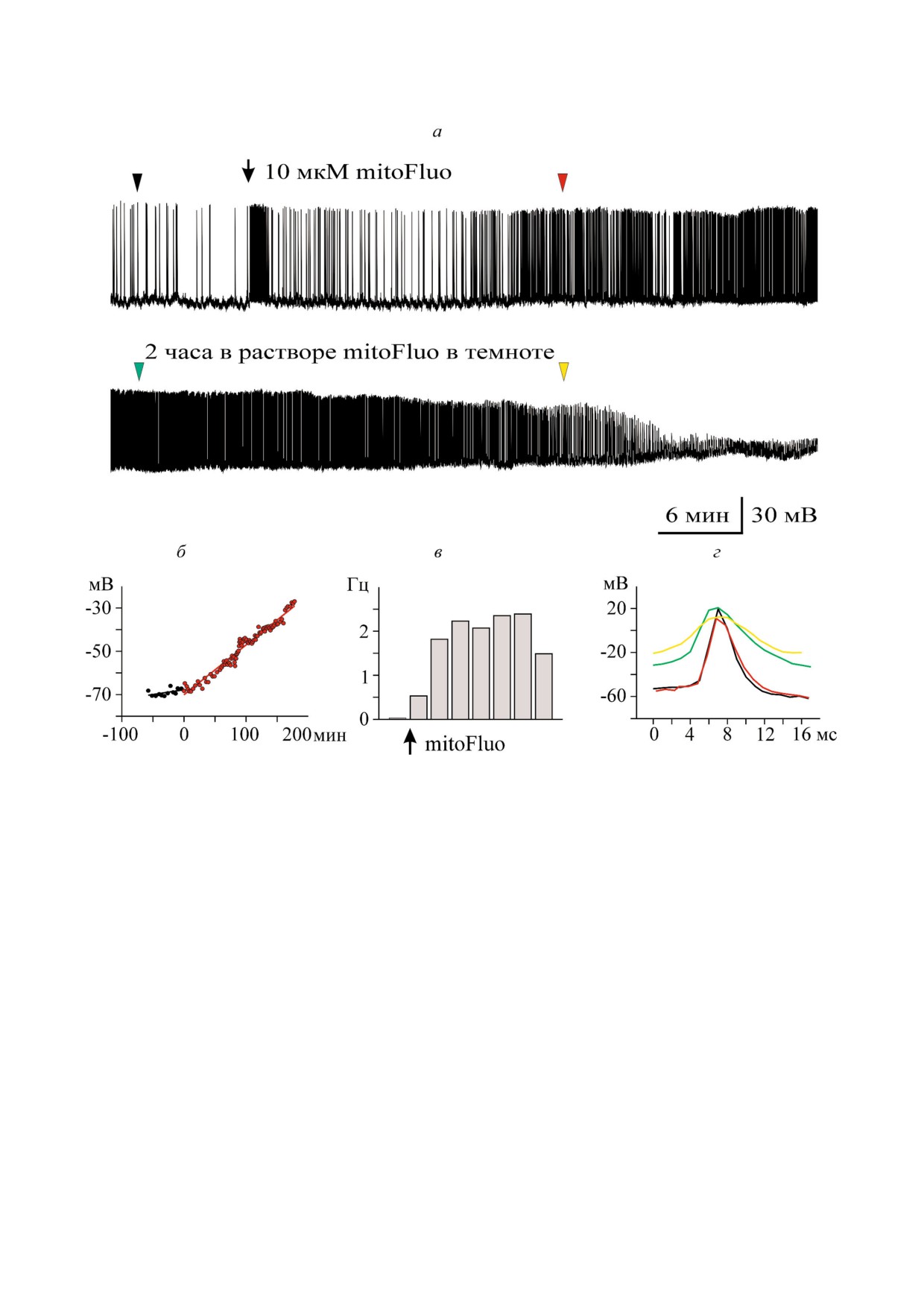
Рис. 4. MitoFluo в большой концентрации приводил к полному торможению спонтанной активности нейронов прудови!
ка. а - MitoFluo в концентрации 10 мкМ вызывал деполяризацию плазматической мембраны, увеличение частоты и
уменьшение амплитуды спайков буккального нейрона В4. Снижение частоты спайков началось через 2 часа после добав!
ления mitoFluo (а, нижняя панель); б - межспайковый мембранный потенциал плавно возрастал в присутствии mitoFluo
в течение всего эксперимента. За 0 на шкале времени принят момент добавления mitoFluo; в - средняя частота потенци!
алов действия в присутствии mitoFluo увеличилась более чем в 2 раза по сравнению с контролем. Гистограмма построена
с интервалом 20 мин; г - наложение потенциалов действия: mitoFluo снижал скорость деполяризации и реполяризации
спайка. Места расположения спайков отмечены треугольниками соответствующих цветов на а. Контрольный спайк по!
казан черным.
biokhsm/
личение частоты генерации потенциалов
электрической активности клетки B4. При до!
действия (рис. 3, в), снижение амплитуды и рас!
бавлении mitoFluo (10 мкM) спустя небольшой
ширение спайков (рис. 3, г). Влияние mitoFluo
временной промежуток (~15 мин) происходили
на работу нейронов не удавалось полностью
существенные изменения в активности нейро!
снять при отмывании ганглиев солевым раство!
на: медленно развивалась деполяризация плаз!
ром в течение 2!х ч.
матической мембраны (рис. 4, б), сильно (с 0,03
Рис. 4 иллюстрирует типичный опыт по
до 2,3 Гц) возрастала частота потенциалов
действию mitoFluo в более высокой концентра!
действия (рис. 4, в), снижалась скорость деполя!
ции. На рис. 4, а показана контрольная запись
ризации и реполяризации спайка (рис. 4, г).
БИОХИМИЯ том 84 вып. 10 2019
1430
ПОПОВА и др.
В конечном итоге добавление mitoFluo привело
t!критерий: p = 0,006 и p = 0,010, соответствен!
к «замолканию» буккальной клетки (рис. 4, а,
но). Полуширина спайков увеличилась в сред!
нижняя панель). Постепенное расширение
нем на 64% (табл. 3). Таким образом, mitoFluo
спайков началось одновременно с деполяриза!
вызывал изменения параметров спайков, каче!
цией плазматической мембраны и достигло наи!
ственно подобные тем, что наблюдались в при!
большего значения перед тем, как клетка «за!
сутствии КЦХФ (рис. 2, д, табл. 1). Влияние
молчала». В среднем, mitoFluo в концентрации 2
mitoFluo (2-60 мкМ) исследовалось на семнад!
и больше мкМ деполяризовал буккальные клет!
цати гигантских церебральных нейронах (табл. 4).
ки на 20%, с -54,56 ± 2,49 мВ в контроле до
Мембранный потенциал этих CGC под действи!
-43,43 ± 2,56 мВ в присутствии mitoFluo (пар!
ем mitoFluo изменился в среднем на 14%. Полу!
ный t!критерий: p < 0,001; n = 16 клеток; табл. 3).
ширина спайков увеличилась, в среднем, на
Средняя амплитуда спайков буккальных клеток
35%, с 15,84 ± 1,41 мс до 21,43 ± 1,9 мс (парный
уменьшилась на 13,7%. Максимальные скорос!
t!критерий: p = 0,002). Значительно более высо!
ти деполяризации и реполяризации спайков
кая концентрация mitoFluo (60 мкМ) приводила
уменьшились с 25,38 ± 3,96 мВ/мс и -13,39 ±
к полному торможению CGC (данные не пока!
2,17 мВ/мс, соответственно, в контроле до
заны). Таким образом, в случае mitoFluo, как и в
15,94 ± 3,92 мВ/мс и -8,47 ± 1,89 мВ/мс, соотве!
случае КЦХФ, гигантские церебральные нейро!
тственно, в присутствии mitoFluo (парный
ны оказались менее чувствительны, чем бук!
Таблица 3. Влияние mitoFluo на буккальные нейроны (В1, В2, В4) изолированных ганглиев прудовика
Контроль, среднее
mitoFluo,
Парный t!критерий
Буккальные нейроны, n = 16
значение ± ст.
среднее
Стьюдента или
Изменение в процентах
ошибка
значение ± ст.
t!критерий
ошибка
Вилкоксона
Мембранный потенциал (мВ)
-54,56 ± 2,49
-43,43 ± 2,56
p < 0,001
деполяризация на 20,4%
Амплитуда спайка (мВ)
60,56 ± 2,51
52,28 ± 3,63
p = 0,030
уменьшение на 13,7%
Полуширина спайка (мс)
7,12 ± 1,00
11,67 ± 1,94
p < 0,001
расширение на 64%
Макс. скорость деполяриза!
25,38 ± 3,96
15,94 ± 3,92
p = 0,006
замедление на 37%
ции спайка (мВ/мс)
Макс. скорость реполяриза!
-13,39 ± 2,17
-8,47 ± 1,89
p = 0,010
замедление на 36,7%
ции спайка (мВ/мс)
Средняя частота спайков (Гц)
1,68 ± 0,44
3,30 ± 0,65
p < 0,001
увеличение на 96%
Таблица 4. Влияние mitoFluo на гигантские церебральные нейроны (CGC) изолированных ганглиев прудовика
Гигантский церебральный
Контроль,
mitoFluo,
Парный t!критерий
нейрон (CGC), n = 17
среднее значение
среднее
Стьюдента или
Изменение в процентах
± ст. ошибка
значение ± ст.
t!критерий
ошибка
Вилкоксона
Мембранный потенциал (мВ)
-55,78 ± 8,44
-48,17 ± 8,22
p < 0,001
деполяризация на 14%
Амплитуда спайка (мВ)
78,70 ± 2,08
75,08 ± 2,72
p = 0,006
уменьшение на 5%
Полуширина спайка (мс)
15,84 ± 1,41
21,43 ± 1,90
p = 0,002
расширение на 35%
Макс. скорость деполяриза!
22,74 ± 2,27
17,52 ± 1,66
p = 0,002
замедление на 23%
ции спайка (мВ/мс)
Макс. скорость реполяриза!
-7,55 ± 0,8
-5,35 ± 0,4
p = 0,007
замедление на 30%
ции спайка (мВ/мс)
Средняя частота спайков (Гц)
0,59 ± 0,06
0,83 ± 0,05
p < 0,001
увеличение на 42%
БИОХИМИЯ том 84 вып. 10 2019
ДЕЙСТВИЕ МИТОФЛУОРЕСЦЕИНА НА НЕЙРОНЫ
1431
кальные. Устойчивость гигантского церебраль!
хондрий [29]. Поскольку mitoFluo обладает яр!
ного нейрона к действию разобщителей, вероят!
кой флуоресценцией, измерение выхода ионов
но, связана с его серотонинергической функци!
кальция из митохондрий печени крысы осуществ!
ей. На это указывает тот факт, что педальные се!
лялось нами с помощью кальций!селективного
ротонинергические нейроны в наших опытах
электрода, а не кальций!чувствительных флуо!
также проявляли повышенную устойчивость к
ресцирующих красителей (рис. 5). Видно, что
действию разобщителей (результаты не приве!
добавление mitoFluo в буферный раствор с изо!
дены).
лированными митохондриями печени крысы
Следует отметить, что в проведенных нами
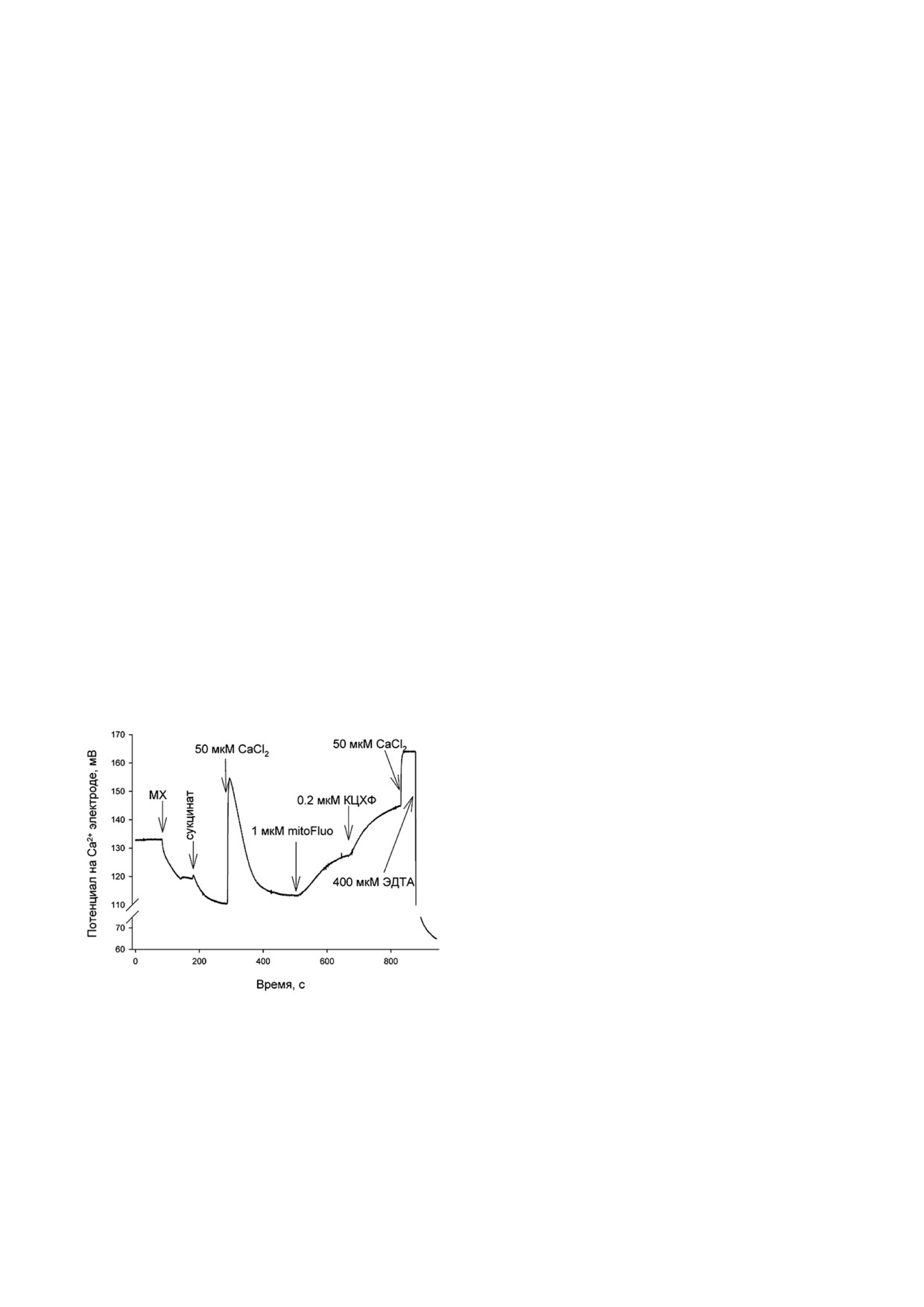
приводит к увеличению концентрации в среде
трех опытах по отмыванию mitoFluo активность
ионов Ca2+, высвобожденных из митохондрий.
нейронов не возвращалась к контрольному
Аналогичный эффект оказывает добавление в
уровню при наблюдении от 30 мин до 4!х ч.
среду КЦХФ.
Индукция выхода ионов кальция из митохонG
Фотоиндуцированное действие mitoFluo на
дрий под действием mitoFluo. Как и в случае с
электрическую активность нейронов моллюска.
КЦХФ и триклозаном, действие которого на
Фотоиндуцированное действие mitoFluo было
электрическую активность нейронов Lymnaea
исследовано в девяти экспериментах, при этом
stagnalis изучено в работе [13], изменения этой
была зарегистрирована активность 10 гигант!
активности под действием mitoFluo логично
ских церебральных нейронов, 13 буккальных и
связать с изменениями концентрации ионов
одного педального нейронов. На рис. 6, а пока!
кальция в цитоплазме. Концентрация ионов
зана запись активности трех нейронов: буккаль!
кальция в цитоплазме играет важную роль в ре!
ных нейронов В1 и В4 и церебрального гигант!
гуляции каналов плазматической мембраны
ского нейрона CGC после добавления 7 мкМ
[23-25]. Согласно многочисленным работам,
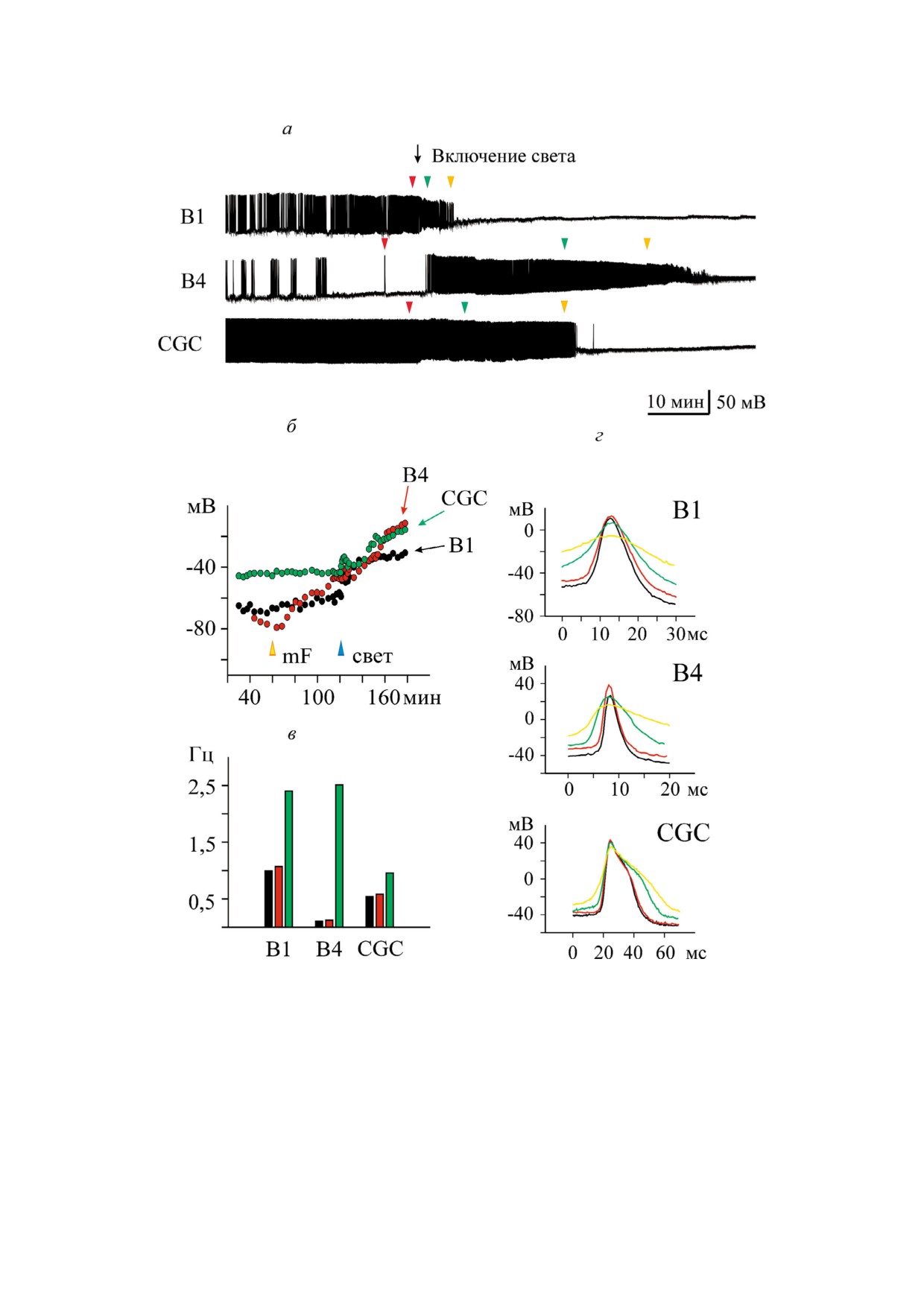
mitoFluo в темноте. Включение света приводило
например, [26-29], протонофорные разобщите!
к быстрому изменению активности этих нейро!
ли индуцируют выход ионов кальция, депони!
нов, которое выражалось в деполяризации
рованных в митохондриях, предположительно
мембраны (рис. 6, б) и увеличении частоты
за счет обращения работы электрогенного каль!
спайков (рис. 6, в, зеленые столбцы). Отметим,
циевого унипортера, посредством которого при
что клетка В4, молчащая перед включением све!
наличии мембранного потенциала осуществля!
та, отреагировала резким возбуждением в ответ
ется накопление кальция в матриксе митохон!
на освещение ганглиев. Изменился характер ак!
дрий, а при сбросе потенциала под действием
тивности буккальных клеток - полностью исчез
разобщителей происходит его выброс из мито!
пищевой жевательный ритм. В ряде опытов у
некоторых клеток перед деполяризацией на!
блюдалась кратковременная гиперполяризация
мембраны. Освещение ганглиев влияло на фор!
му спайков нейронов. По мере деполяризации
мембраны уменьшалась амплитуда и происхо!
дило расширение спайка (рис. 6, г). В конечном
итоге включение освещения в присутствии
mitoFluo блокировало способность нейронов ге!
нерировать потенциалы действия.
Логично было предположить, что влияние
освещения на электрическую активность ней!
ронов моллюсков, наблюдаемое в присутствии
mitoFluo, объясняется фотодинамическим
действием, где mitoFluo выполняет роль фото!
сенсибилизатора. Действительно, известно, что
флуоресцеин обладает способностью генериро!
вать синглетный кислород, хотя и с очень низ!
ким квантовым выходом, составляющим ~0,06 в
Рис. 5. Измерение выхода ионов Ca2+ из изолированных
водном растворе [30]. Было показано также, что
митохондрий печени крысы с помощью кальций!селек!
тивного электрода при добавлении mitoFluo и КЦХФ. До!
коньюгат флуоресцеина с цАМФ способен мо!
бавки веществ в среду отмечены стрелками. Концентрации
дифицировать цАМФ!зависимые каналы в от!
реагентов: Сукцинат - 2 мМ; Ca2+ - 50 мкМ; mitoFluo -
вет на освещение по фотодинамическому меха!
1 мкМ; КЦХФ - 200 нМ; Ca2+ - 50 мкМ; EDTA - 400 мкМ.
низму [31].
МХ - добавка суспензии митохондрий (1 мг/мл). Среда со!
держала 250 мМ сахарозы, 20 мМ Tris, 10 мМ KH2PO4, 1 мМ
Для проверки фотодинамической природы
MgCl2
светоиндуцированного действия mitoFluo на
БИОХИМИЯ том 84 вып. 10 2019
1432
ПОПОВА и др.
Рис. 6. Фотоиндуцированное изменение спонтанной активности нейронов прудовика в присутствии mitoFluo. а - Осве!
щение ганглиев на фоне 7 мкМ mitoFluo вызвало деполяризацию мембраны буккальных нейронов В1 и В4 и гигантского
церебрального нейрона CGC, влияло на амплитуду и частоту потенциалов действия. Фаза возбуждения сменялась пол!
ным торможением спайковой активности, которое развивалось с разной скоростью у разных нейронов; б - после добав!
ления mitoFluo (желтый треугольник) межспайковый мембранный потенциал буккальных клеток возрастал. В нейроне
CGC он менялся мало. Включение света (синий треугольник) приводило к значительной деполяризации всех трех клеток;
в - освещение препарата в присутствии 7 мкМ mitoFluo увеличило среднюю частоту спайков нейронов. Черным показана
средняя частота спайков в контроле, красным - в mitoFluo, зеленым - при освещении ганглиев; г - влияние освещения
в присутствии mitoFluo на форму спайков всех трех нейронов. Черным показан контрольный спайк. Места расположения
остальных спайков отмечены треугольниками соответствующих цветов на рис. 6, а.
journal/biokhsm/
БИОХИМИЯ том 84 вып. 10 2019
ДЕЙСТВИЕ МИТОФЛУОРЕСЦЕИНА НА НЕЙРОНЫ
1433
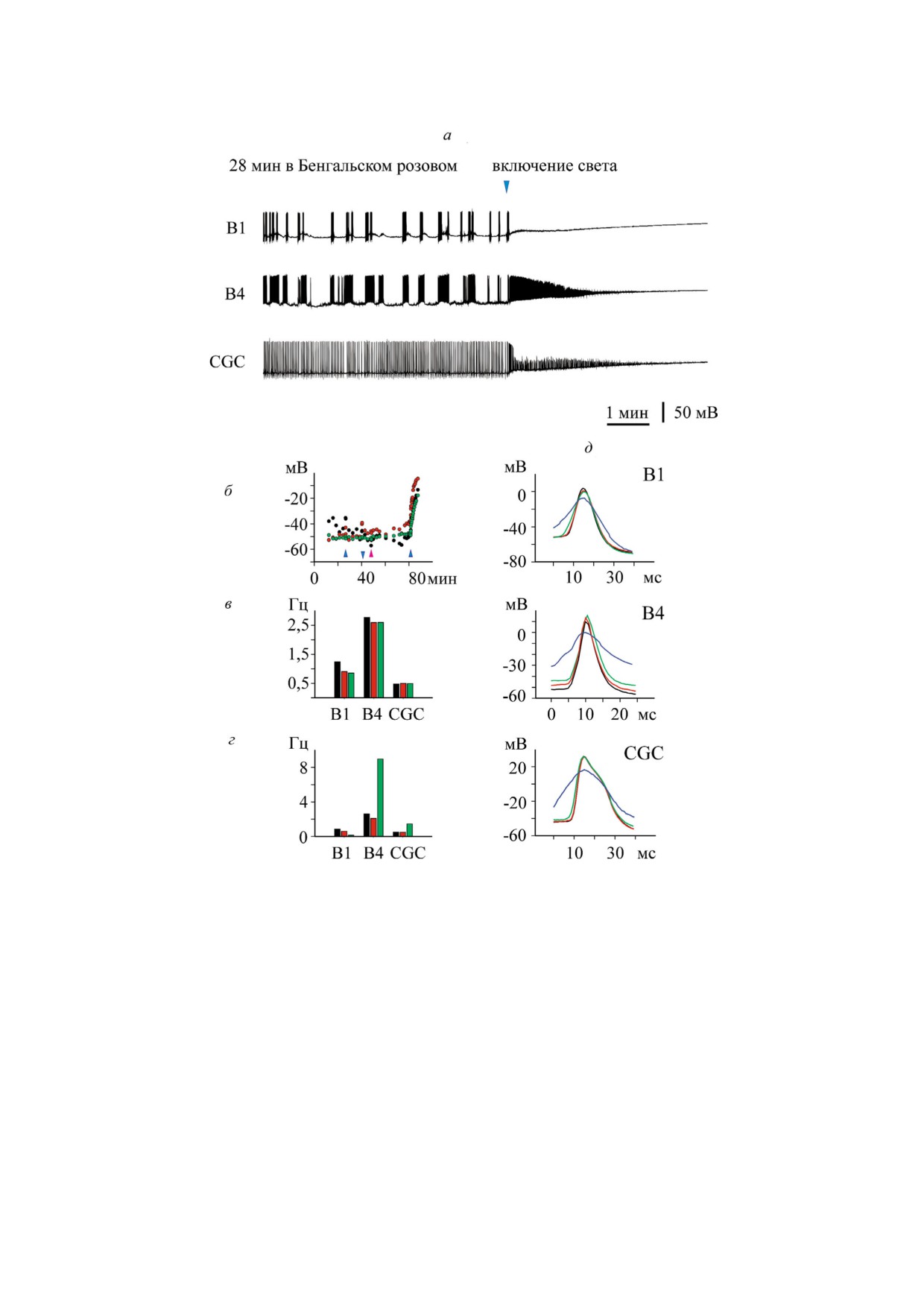
Рис. 7. Фотоиндуцированное изменение спонтанной активности нейронов прудовика в присутствии бенгальского розо!
вого. а - Освещение ганглиев на фоне 1 мкМ бенгальского розового вызвало быструю деполяризацию мембраны и «за!
молкание» нейронов в течение одной-двух мин; б - само по себе освещение ганглиев не меняло мембранный потенциал
нейронов, однако включение света на фоне бенгальского розового вызывало резкую деполяризацию мембран всех трех
исследованных клеток. Моменты включения и выключения света обозначены синими треугольниками, момент добавле!
ния бенгальского розового отмечен розовым треугольником; в - освещение ганглиев практически не влияло на среднюю
частоту генерации потенциалов действия. Черным обозначена средняя частота спайков в темноте, красным - при осве!
щении, зеленым - после выключения света; г - добавление бенгальского розового (1 мкМ, красные столбцы) мало отра!
жалось на средней частоте генерации потенциалов действия по сравнению с контролем (черные столбцы). Освещение в
присутствии бенгальского розового (зеленые столбцы) вызывало существенное повышение средней частоты генерации
спайков нейронов B4 и CGC. Нейрон В1 «замолчал» сразу после включения света (см. также рис. 7, a); д - наложение по!
тенциалов действия нейронов B1, B4 и CGC. Черным показан контрольный спайк в темноте, красным - при освещении,
зеленым показан спайк в присутствии бенгальского розового без освещения, и синим - в присутствии бенгальского ро!
зового при освещении. Фотоиндуцированное действие бенгальского розового на форму спайков всех трех нейронов раз!
вивалось в секундной шкале времени.
journal/biokhsm/
5 БИОХИМИЯ том 84 вып. 10 2019
1434
ПОПОВА и др.
электрическую активность нейронов мы провели
аналогичные опыты с классическим фотосенси!
билизатором бенгальским розовым. Было прове!
дено 4 опыта, в которых зарегистрирована актив!
ность 7 клеток CGC и 3 буккальных клеток. Из
данных, представленных на рис. 7, видно, что ос!
вещение в присутствии бенгальского розового
приводит к быстрой деполяризации плазмати!
ческой мембраны и в конечном итоге подавле!
нию электрической активности нейронов, кото!
рому у клеток B4 и CGC предшествует значи!
тельное увеличение частоты спайков. Интересно
отметить, что само по себе освещение изолиро!
ванных ганглиев прудовика белым светом не
влияло на мембранный потенциал (рис. 7, б) и
частоту спайков (рис. 7, в) нейронов. Освеще!
ние в присутствии бенгальского розового быст!
Рис. 8. Запись кинетики относительного тока (I/I0) при ос!
ро (в секундной шкале времени) и необратимо
вещении бислойной липидной мембраны (БЛМ) белым
изменяло эти показатели работы нейронов
светом (интервал освещения показан отрезком сверху ри!
(рис. 7, г). При этом сильно изменялась форма
сунка) в присутствии 1 мкM mitoFluo (черная кривая) или
в отсутствии фотосенсибилизатора (серая кривая). БЛМ
спайков (рис. 7, д). Таким образом, фотоинду!
была сформирована из DPhPC. Ток через мембрану (I0)
цированные эффекты бенгальского розового и
составлял 0,3 мкА
mitoFluo на электрическую активность нейро!
нов моллюска оказались принципиально схо!
жими, однако значительно различалось время
наблюдаемые в нашей работе изменения пара!
развития реакции.
метров электрической активности нейронов
Фотодинамическое действие mitoFluo на ионG
Lymnaea stagnalis при освещении клеток после
ные каналы грамицидина А. Для проверки спо!
длительной инкубации с mitoFluo можно объяс!
собности mitoFluo служить фотосенсибилизато!
нить выбросом ионов кальция в цитоплазму из
ром мы исследовали его в хорошо отработанной
эндоплазматического ретикулума под действием
нами ранее системе фотоинактивации ионных
АФК, образующихся в результате возбуждения
каналов грамицидина А (гА) в плоской бислой!
светом данного красителя. Образование продук!
ной липидной мембране (БЛМ) [32-35]. На
тов перекисного окисления липидов при дли!
рис. 8, а представлена запись тока через БЛМ,
тельном освещении клеточных гомогенатов в
вызванного добавлением 2 нМ гА в омывающий
присутствии флуоресцеина было показано в ра!
мембрану водный раствор 100 мM KCl при рН 7.
боте [46]. Известно, что изменения внутрикле!
В период времени, отмеченный черным отрез!
точной концентрации ионов кальция модулиру!
ком, происходило освещение мембраны белым
ют работу различных типов ионных каналов в
светом. В отсутствии mitoFluo освещение не
плазматической мембране, тем самым, оказывая
приводило к изменению тока БЛМ (кривая 1),
влияние на мембранный потенциал, генерацию
тогда как освещение в присутствии mitoFluo
потенциалов действия и другие процессы. Так, в
(кривая 2) вызывало заметное падение тока че!
работе [23] показано, что увеличение внутрикле!
рез грамицидиновые каналы. Подавление тока в
точной концентрации ионов кальция приводит к
присутствии mitoFluo было выражено заметно
инактивации кальциевых каналов в нейронах
меньше при добавлении 10 мМ азида натрия,
Lymnaea stagnalis. Рассматривая механизм свето!
который является тушителем синглетного кис!
индуцированного действия mitoFluo на актив!
лорода (данные не приведены).
ность нейронов Lymnaea stagnalis, нельзя исклю!
Отметим, что в литературе c давних времен
чить и возможность фотосенсибилизированной
имеются сведения о снижении амплитуды и рас!
модификации белков, образующих ионные ка!
ширении формы спайка [36-39] и возрастании
налы, как это предполагалось, например, в рабо!
частоты спайков при фотодинамическом воз!
те по фотохимической модификации натриевых
действии на возбудимые клетки [40-43]. Учиты!
токов в гигантских аксонах омара [47]. Приме!
вая литературные данные о возрастании концен!
ром именно такого механизма действия света на
трации ионов кальция в цитоплазме нейронов в
ионные каналы в присутствии фотосенсибили!
ответ на фотодинамическое воздействие [44] и
затора является рассмотренная выше фотодина!
стимуляции спайковой активности при повыше!
мическая инактивация грамицидиновых кана!
нии цитоплазматического кальция [24, 25, 45],
лов в модельной бислойной мембране.
БИОХИМИЯ том 84 вып. 10 2019
ДЕЙСТВИЕ МИТОФЛУОРЕСЦЕИНА НА НЕЙРОНЫ
1435
Финансирование. Работа выполнена при фи!
Соблюдение этических норм. Данная статья
нансовой поддержке Российского научного
не содержит каких!либо исследований, касаю!
фонда (грант 16!14!10025).
щихся использования людей или позвоночных
Конфликт интересов. Авторы заявляют об от!
животных в качестве объектов.
сутствии конфликта интересов.
СПИСОК ЛИТЕРАТУРЫ
1.
Korde, A.S., Pettigrew, L.C., Craddock, S.D., and
Antonenko, Y.N. (2018) Protonophoric action of triclosan
Maragos, W.F. (2005) The mitochondrial uncoupler 2,4!
causes calcium efflux from mitochondria, plasma mem!
dinitrophenol attenuates tissue damage and improves mito!
brane depolarization and bursts of miniature end!plate
chondrial homeostasis following transient focal cerebral
potentials, Biochim. Biophys. Acta, 1860, 1000-1007,
ischemia, J. Neurochem., 94, 1676-1684, doi: 10.1111/j.
doi: 10.1016/j.bbamem.2018.01.008.
1471!4159.2005.03328.x.
14.
Doebler, J. A. (2000) Effects of protonophores on mem!
2.
Silachev, D.N., Khailova, L.S., Babenko, V.A., Gulyaev, M.V.,
brane electrical characteristics in NG108!15 cells,
Kovalchuk, S.I., Zorova, L.D., Plotnikov, E.Y.,
Neurochem. Res., 25, 263-268.
Antonenko, Y.N., and Zorov, D.B. (2014) Neuroprotective
15.
Tretter, L., Chinopoulos, C., and Adam!Vizi, V. (1998)
effect of glutamate!substituted analog of gramicidin A is medi!
Plasma membrane depolarization and disturbed Na+
ated by the uncoupling of mitochondria, Biochim. Biophys.
homeostasis induced by the protonophore carbonyl
Acta, 1840, 3434-3442, doi: 10.1016/j.bbagen.2014.09.002.
cyanide!p!trifluoromethoxyphenyl!hydrazon in isolated
3.
Khailova, L.S., Silachev, D.N., Rokitskaya, T.I., Avetisyan, A.V.,
nerve terminals, Mol. Pharmacol., 53, 734-741.
Lyamzaev, K.G., Severina, I.I., Il’yasova, T.M., Gulyaev, M.V.,
16.
Benjamin, P.R., and Rose, R.M. (1979) Central generation
Dedukhova, V.I., Trendeleva, T.A., Plotnikov, E.Y.,
of bursting in the feeding system of the snail Lymnaeu stag
Zvyagilskaya, R.A., Chernyak, B.V., Zorov, D.B.,
nalis, J. Exp. Biol., 80, 93-118.
Antonenko, Y.N., and Skulachev, V.P. (2014) A short!chain
17.
McCrohan, C.R., and Benjamin, P.R. (1980) Patterns of
alkyl derivative of Rhodamine 19 acts as a mild uncoupler of
activity and axonal projections of the cerebral giant cells of
mitochondria and a neuroprotector, Biochim. Biophys. Acta,
the snail Lymnaea stagnalis, J. Exp. Biol., 85, 149-168.
1837, 1739-1747, doi: 10.1016/j.bbabio.2014.07.006.
18.
Johnson, D., and Lardy, H. (1967) Isolation of liver or kid!
4.
Antonenko, Y.N., Denisov, S.S., Silachev, D.N.,
ney mitochondria, Methods Enzymol., 10, 94-96.
Khailova, L.S., Jankauskas, S.S., Rokitskaya, T.I.,
19.
Mueller, P., Rudin, D.O., Tien, H.T., and Wescott, W.C.
Danilina, T.I., Kotova, E.A., Korshunova, G.A.,
(1963) Methods for the formation of single bimolecular
Plotnikov, E.Y., and Zorov, D.B. (2016) A long!linker con!
lipid membranes in aqueous solution, J. Phys. Chem., 67,
jugate of fluorescein and triphenylphosphonium as mito!
534-535.
chondria!targeted uncoupler and fluorescent neuro! and
20.
Zhao, Z., Gordan, R., Wen, H., Fefelova, N., Zang, W.!J.,
nephroprotector, Biochim. Biophys. Acta,
1860,
and Xie, L.!H. (2013) Modulation of intracellular calcium
2463-2473, doi: 10.1016/j.bbagen.2016.07.014.
waves and triggered activities by mitochondrial Ca flux in
5.
Boveris, A. (1977) Mitochondrial production of superoxide
mouse cardiomyocytes, PLoS One,
8, e80574,
radical and hydrogen peroxide, Adv. Exp. Med. Biol., 78, 67-82.
doi: 10.1371/journal.pone.0080574.
6.
Korshunov, S.S., Skulachev, V.P., and Starkov, A.A. (1997) High
21.
Bulbring, E., and Lullmann, H. (1957) The effect of meta!
protonic potential actuates a mechanism of production of reac!
bolic inhibitors on the electrical and mechanical activity of
tive oxygen species in mitochondria, FEBS Lett., 416, 15-18.
the smooth muscle of the Guinea!pig’s “taenia coli”,
7.
Liu, S.S. (1997) Generating, partitioning, targeting and
J. Physiol., 136, 310-323.
functioning of superoxide in mitochondria, Biosci. Rep.,
22.
Krnjevic, K., Puil, E., and Werman, R. (1978) Significance
17, 259-272.
of 2,4!dinitrophenol action on spinal motoneurones,
8.
McLaughlin, S.G., and Dilger, J.P. (1980) Transport of
J. Physiol., 275, 225-239.
protons across membranes by weak acids, Physiol. Rev., 60,
23.
Byerly, L., and Moody, W.J. (1984) Intracellular calcium
825-863, doi: 10.1152/physrev.1980.60.3.825.
ions and calcium currents in perfused neurones of the snail
9.
Liberman, E.A., Topaly, V.P., Tsofina, L.M., Jasaitis, A.A.,
Lymnaea stagnalis, J. Physiol., 352, 637-652.
and Skulachev, V.P. (1969) Mechanism of coupling of
24.
Tse, A., and Hille, B. (1992) GnRH!induced Ca2+ oscilla!
oxidative phosphorylation and the membrane potential of
tions and rhythmic hyperpolarizations of pituitary
mitochondria, Nature, 222, 1076-1078.
gonadotropes, Science, 255, 462-464.
10.
Terada, H. (1990) Uncouplers of oxidative phosphoryla!
25.
Stojilkovic, S.S. (2012) Molecular mechanisms of pituitary
tion, Environ. Health Perspect.,
87,
213-218,
endocrine cell calcium handling, Cell Calcium, 51,
doi: 10.1289/ehp.9087213.
212-221, doi: 10.1016/j.ceca.2011.11.003.
11.
Shchepinova, M.M., Denisov, S.S., Kotova, E.A.,
26.
Carafoli, E. (1967) In vivo effect of uncoupling agents on
Khailova, L.S., Knorre, D.A., Korshunova, G.A.,
the incorporation of calcium and strontium into mito!
Tashlitsky, V.N., Severin, F.F., and Antonenko, Y.N. (2014)
chondria and other subcellular fractions of rat liver, J. Gen.
Dodecyl and octyl esters of fluorescein as protonophores
Physiol., 50, 1849-1864.
and uncouplers of oxidative phosphorylation in mitochon!
27.
Rottenberg, H., and Scarpa, A. (1974) Calcium uptake and
dria at submicromolar concentrations, Biochim. Biophys.
membrane potential in mitochondria, Biochemistry, 13,
Acta, 1837, 149!158, doi: 10.1016/j.bbabio.2013.09.011.
4811-4817.
12.
Denisov, S.S., Kotova, E.A., Plotnikov, E.Y., Tikhonov, A.A.,
28.
Gunter, T.E., Gunter, K.K., Puskin, J.S., and Russell, P.R.
Zorov, D.B., Korshunova, G.A., and Antonenko, Y.N.
(1978) Efflux of Ca2+ and Mn2+ from rat liver mitochon!
(2014) A mitochondria!targeted protonophoric uncoupler
dria, Biochemistry, 17, 339-345.
derived from fluorescein, Chem. Commun.,
50,
29.
Bernardi, P., Paradisi, V., Pozzan, T., and Azzone, G.F.
15366-15369, doi: 10.1039/c4cc04996a.
(1984) Pathway for uncoupler!induced calcium efflux in
13.
Popova, L.B., Nosikova, E.S., Kotova, E.A., Tarasova, E.O.,
rat liver mitochondria: inhibition by ruthenium red,
Nazarov, P.A., Khailova, L.S., Balezina, O.P., and
Biochemistry, 23, 1645-1651.
БИОХИМИЯ том 84 вып. 10 2019
5*
1436
ПОПОВА и др.
30.
Usui, Y. (1973) Determination of quantum yield of singlet
39. Oxford, G.S., Pooler, J.P., and Narahashi, T.
(1977)
oxygen formation by photosensitization, Chemistry Lett., 2,
Internal and external application of photodynamic sensi!
743-744.
tizers on squid giant axons, J. Membr. Biol., 36, 159-173.
31.
Gao, W., Su, Z., Liu, Q., and Zhou, L. (2014) State!
40. Бурмистров Ю.М., Людковская Р.Г., Шуранова Ж.П.
dependent and site!directed photodynamic transformation
(1969) Электрическая активность нейронов речного
of HCN2 channel by singlet oxygen, J. Gen. Physiol., 143,
рака при витальной окраске метиленовой синью, Био
633-644, doi: 10.1085/jgp.201311112.
физика, 14, 495-500.
32.
Rokitskaya, T.I., Antonenko, Y.N., and Kotova, E.A.
41. Pooler, J., and Oxford, G.S. (1973) Photodynamic alter!
(1996) Photodynamic inactivation of gramicidin channels:
ation of lobster giant axons in calcium!free and calcium!
a flash!photolysis study, Biochim. Biophys. Acta, 1275,
rich media, J. Membr. Biol., 12, 339-348.
221-226.
42. Kress, M., Petersen, M., and Reeh, P.W. (1997) Methylene blue
33.
Rokitskaya, T.I., Block, M., Antonenko, Y.N.,
induces ongoing activity in rat cutaneous primary afferents and
Kotova, E.A., and Pohl, P. (2000) Photosensitizer binding
depolarization of DRG neurons via a photosensitive mecha!
to lipid bilayers as a precondition for the photoinactivation
nism, Naunyn Schmiedebergs Arch. Pharmacol., 356, 619-625.
of membrane channels, Biophys. J., 78, 2572-2580,
43. Uzdensky, A., Bragin, D., Kolosov, M., Dergacheva, O.,
doi: 10.1016/S0006!3495(00)76801!9.
Fedorenko, G., and Zhavoronkova, A. (2002) Photodynamic
34.
Антоненко Ю.Н., Котова Е.А., Рокицкая Т.И. (2005)
inactivation of isolated crayfish mechanoreceptor neuron:
Фотодинамическое воздействие как основа релакса!
different death modes under different photosensitizer con!
ционного метода изучения грамицидиновых каналов,
centrations, Photochem. Photobiol., 76, 431-437.
Биол. мембраны, 22, 275-289.
44. Neginskaya, M., Berezhnaya, E., Uzdensky, A.B., and
35.
Pashkovskaya, A.A., Sokolenko, E.A., Sokolov, V.S.,
Abramov, A.Y. (2018) Reactive oxygen species produced by
Kotova, E.A., and Antonenko, Y.N. (2007) Photodynamic
a photodynamic effect induced calcium signal in neurons
activity and binding of sulfonated metallophthalocyanines
and astrocytes, Mol. Neurobiol.,
55,
96-102,
to phospholipid membranes: contribution of metal!phos!
doi: 10.1007/s12035!017!0721!1.
phate coordination, Biochim. Biophys. Acta,
1768,
45. Grace, A.A., and Bunney, B.S. (1984) The control of firing
2459-2465, doi: 10.1016/j.bbamem.2007.05.018.
pattern in nigral dopamine neurons: burst firing,
36.
Людковская Р.Г. (1961) Некоторые закономерности
J. Neurosci., 4, 2877-2890.
возбуждения светом гигантского аксона каракатицы,
46. Hiramitsu, T., Miura, Y., and Machida, H. (1992) Photo!
Биофизика, 6, 300-308.
sensitizer!induced lipid peroxidation in retinal homogenates
37.
Pooler, J. (1968) Light!induced changes in dye!treated
under illumination, J. Clin. Biochem. Nutr., 12, 109-114.
lobster giant axons, Biophys. J., 8, 1009-1026.
47. Pooler, J.P., and Valenzeno, D.P. (1978) Kinetic factors
38.
Pooler, J. (1972) Photodynamic alteration of sodium cur!
governing sensitized photooxidation of excitable cell mem!
rents in lobster axons, J. Gen. Physiol., 60, 367-387.
branes, Photochem. Photobiol., 28, 219-226.
PROTONOPHORIC AND PHOTODYNAMIC ACTION
OF FLUORESCEIN DECYL(TRIPHENYL)PHOSPHONIUM
ESTER ON ELECTRICAL ACTIVITY
OF MOLLUSCAN NEURONS
L. B. Popova, A. L. Kamysheva, T. I. Rokitskaya, G. A. Korshunova, R. S. Kirsanov,
E. A. Kotova, and Y. N. Antonenko*
Belozersky Institute of Physico Chemical Biology, Lomonosov Moscow
State University, 119991 Moscow, Russia; E mail: antonen@genebee.msu.ru
Received February 18, 2019
Revised June 6, 2019
Accepted June 17, 2019
Uncouplers of oxidative phosphorylation in mitochondria, which have played a key role in uncovering the basic prin!
ciples of cell bioenergetics, have recently attracted considerable interest as promising compounds with a number of
beneficial therapeutic, e.g., neuroprotective properties. Here, we report our data on the effect of mitofluorescein
(mitoFluo), a new protonophoric uncoupler, a conjugate of fluorescein with decyl(triphenyl)phosphonium, on the
electrical activity of neurons from the mollusc Lymnaea stagnalis. Incubation with mitoFluo in the dark led to a
decrease in the absolute value of resting membrane potential of neurons and altered their spike activity, namely, caused
spike broadening, a reduction of spike amplitude and an increase in spike frequency. Prolonged incubation at high
(tens of micromoles) mitoFluo concentrations resulted in complete suppression of the electrical activity of neurons.
The impact of mitoFluo on the neuron activity was qualitatively similar to the corresponding effect of the classical
mitochondrial uncoupler carbonyl cyanide m!chlorophenylhydrazone but manifested itself at much longer incuba!
tion with higher concentrations. A distinctive feature of mitoFluo is its light!induced action on the electrical activity
of neurons. The changes in the parameters of the neuron activity observed upon illumination in the presence of
mitoFluo were close to the light!induced effects of the well!known photosensitizer Rose Bengal, but less pronounced.
It is assumed that the influence of mitoFluo on the electrical activity of neurons, both as a mitochondrial uncoupler
and as a photosensitizer, is mediated by changes in the concentration of calcium ions in the cytoplasm.
Keywords: neuron, membrane potential, action potential, uncoupler, protonophore, mitochondria
БИОХИМИЯ том 84 вып. 10 2019