БИОХИМИЯ, 2019, том 84, вып. 10, с. 1437 - 1449
УДК 577.125.54.616.832.543.51
ИЗМЕНЕНИЕ МЕТАБОЛИЗМА СФИНГОИДНЫХ ОСНОВАНИЙ В
СТРУКТУРАХ ГОЛОВНОГО И СПИННОГО МОЗГА ТРАНСГЕННЫХ
МЫШЕЙ ЛИНИИ FUS(1 359), МОДЕЛИРУЮЩИХ БОКОВОЙ
АМИОТРОФИЧЕСКИЙ СКЛЕРОЗ*
© 2019 У.А. Гутнер1, М.А. Шупик1, О.А. Малошицкая2, С.А. Соколов2,
А.П. Резвых3, С.Ю. Фуников3, А.Т. Лебедев2, А.А. Устюгов4, А.В. Алесенко1**
1 Институт биохимической физики им. Н.М. Эмануэля РАН,
119334 Москва, Россия; электронная почта: alicealessenko@gmail.com
2 Московский государственный университет им. М.В. Ломоносова,
химический факультет, 119991 Москва, Россия
3 Институт молекулярной биологии им. В.А. Энгельгарда
РАН, 119991 Москва, Россия
4 Институт физиологически активных веществ РАН,
142432 Черноголовка, Московская обл., Россия
Поступила в редакцию 07.03.2019
После доработки 17.06.2019
Принята к публикации 17.06.2019
Целью исследования является определение изменений в уровнях сфингоидных оснований - сфингозина
(СФЗ), сфинганина и сфингозин"1"фосфата (СФЗ"1"Ф) и экспрессии генов ферментов, участвующих в их
метаболизме, в структурах головного мозга (гиппокампе, коре и мозжечке) и спинного мозга трансгенных
мышей линии FUS (FUS(1"359)), моделирующих боковой амиотрофический склероз (БАС). В качестве мо"
дели БАС были использованы трансгенные мыши линии FUS(1"359), характеризующиеся наличием двига"
тельных нарушений. Липиды из структур головного и спинного мозга через 2, 3 и 4 мес развития заболева"
ния анализировали методом хромато"масс"спектрометрии. Методом РНК"секвенирования были иденти"
фицированы изменения в экспрессии следующих генов: SPHK1, SPHK2, SGPP2, SGPL1, ASAH1 и ASAH2. Ус"
тановлено резкое повышение уровня сфингоидных оснований - СФЗ и сфинганина, обладающих резко вы"
раженными проапоптотическими свойствами, в клетках спинного мозга на терминальной стадии развития
заболевания. Отношение антиапоптотического СФЗ"1"Ф к СФЗ и сфинганину резко снижается, что указы"
вает на интенсивное развитие апоптоза в клетках спинного мозга. Значительные нарушения в содержании
СФЗ и СФЗ"1"Ф и экспрессии генов их метаболизма обнаружены на терминальной стадии развития БАС в
спинном мозге. Резко активируется экспрессия СФЗ"1"Ф"лиазы и снижается экспрессия СФЗ"1"фосфата"
зы. Более глубокое понимание биологических путей, регулирующих метаболизм различных сфинголипидов
при развитии БАС, может привести к идентификации мишеней для лекарственных препаратов нового по"
коления.
КЛЮЧЕВЫЕ СЛОВА: боковой амиотрофический склероз, сфингозин, сфингозин"1"фосфат, SPHK2,
SGPP2, SGPL1, ASAH1, ASAH2.
DOI: 10.1134/S0320972519100063
Боковой амиотрофический склероз (БАС) -
тии мышечного истощения, нарушении речи и
неизлечимое нейродегенеративное заболевание,
глотания, фасцикуляции, изменении рефлексов
характеризующееся селективной дегенерацией
и пластичности. Основная причина смерти
двигательных нейронов спинного мозга и мо"
больных, которая наступает в среднем через 3-5
торной коры и ствола головного мозга. Клини"
лет с момента появления первых признаков за"
ческие признаки болезни выражаются в разви"
болевания, - паралич дыхательных путей. Око"
Принятые сокращения: БАС - боковой амиотрофический склероз, СФЗ - сфингозин, СФЗ"1"Ф - сфингозин"1"
фосфат, ПКС - протеинкиназа С, SPHK1 - ген сфингозин"киназы 1, SPHK2 - ген сфингозин"киназы 2, SGPP2 - ген
сфингозин"1"фосфатфосфатазы 2, SGPL1 - ген сфингозин"1"фосфат"лиазы 1, ASAH1 - ген кислой церамидазы
(А"CDase), ASAH2 - ген нейтральной церамидазы (N"CDase).
* Первоначально английский вариант рукописи опубликован на сайте «Biochemistry» (Moscow) http://protein.bio.
msu.ru/biokhimiya, в рубрике «Papers in Press», BM19"067, 09.09.2019.
** Адресат для корреспонденции.
1437
1438
ГУТНЕР и др.
ло 90% всех зарегистрированных случаев БАС
глии, потерей нейромышечных соединений и
имеют неизвестную этиологию и классифици"
последующей дегенерацией мотонейронов. При
руются как спорадические. Остальные 10% -
этом наблюдается повышенное содержание
это наследственные формы БАС, характеризую"
нейротоксичных молекул, таких как цитокины,
щиеся мутациями в ряде генов, в основном ауто"
в регуляции процессов синтеза которых актив"
сомно"доминантного характера [1].
ное участие принимают мессенджеры липидной
Мутации, которые связывают с БАС, в ос"
природы [17].
новном приводят к конформационной неста"
Среди липидов особое место занимают
бильности и агрегации белков (SOD"1 [2], VСP
сфинголипиды, которые являются наиболее
[3], OPTIN [4], UBQLN2 [5]), нарушениям про"
важными источниками вторичных мессендже"
цессинга и транспорта РНК (C9ORF72 [6],
ров, передающих сигналы клеточной пролифе"
TDP"43 [7], FUS [8, 9]) и изменению динамики
рации, дифференцировки и апоптоза [18]. Де"
цитоскелета (PFN1 [10], DCTN1 [11], TUBA4A
фекты метаболизма сфинголипидов обнаруже"
[12]) [13]. Исключительная генетическая измен"
ны и при таких наследственно"обусловленных
чивость, ассоциированная с БАС, объясняет
метаболических заболеваниях, как болезни
сложность заболевания, при котором гетероген"
Фабри, Ниманна-Пика и Гоше, относящиеся к
ные механизмы приводят к общему патогенезу.
лизосомным болезням накопления, и нейроде"
Ключевыми чертами течения данного заболева"
генеративные патологии - болезни Паркинсона
ния являются эксайтотоксичность, окислитель"
и Альцгеймера [19].
ный стресс, дисфункция митохондрий [2], ней"
В основе структур практически всех сфинго"
ровоспалительные и иммунные реакции [3, 4].
липидов присутствует сфингоидное основание -
В последнее время интенсивно исследуются ме"
сфингозин (СФЗ). Свободный сфингозин воз"
ханизмы апоптоза (программируемой гибели
никает в результате гидролиза церамида цера"
клеток), который может быть ответственен за
мидазой и вновь превращается в церамид с по"
дегенерацию двигательных нейронов при этом
мощью церамидсинтазы. Кроме того, в резуль"
заболевании [5].
тате действия двух киназ он способен фосфори"
В связи с этим большое внимание привлече"
лироваться до сфингозин"1"фосфата (СФЗ"1"Ф)
но к изучению нарушений липидного метабо"
(рис. 1).
лизма в процессе развития БАС. Липиды играют
Сфингозин способен оказывать влияние на
исключительно важную роль в центральной
рост, дифференцировку и гибель клеток [20, 21],
нервной системе: выполняют структурную
агрегацию тромбоцитов [22], ингибирование
функцию, являясь основными компонентами
свертываемости крови [23], стимуляцию мито"
клеточных мембран, служат источником энер"
генеза [24], он обладает противоопухолевой [25]
гии, участвуют в межклеточной коммуникации
и антимикробной активностью [26]. Особенно
и передаче клеточных сигналов апоптоза и диф"
большое значение СФЗ приобретает благодаря
ференцировки. Нарушение липидного баланса
своей способности индуцировать апоптоз [20,
оказывает негативное влияние на структурные и
27-32]. Механизмы апоптоза, опосредованные
физиологические свойства мозга, функции ней"
сфингозином, являются множественными. Бы"
ронов и нейроглии, включая мембранный
ло показано, что апоптоз в присутствии сфинго"
транспорт и контроль над активностью фермен"
зина развивается по каспазозависимому пути.
тов [14]. Разрушение клеточной мембраны явля"
Сфингозин способен расщеплять Bid, высво"
ется характерной чертой нейродегенерации,
бождать митохондриальный цитохром С, а так"
возникающей при хронических заболеваниях
же активировать эффекторные каспазы 3 или 7 и
ЦНС [15].
расщеплять PARP. Участие сфингозина в мито"
Различные нарушения липидного метабо"
хондриальном апоптозе определяется его влия"
лизма характерны как для спорадической, так и
нием на белки Bcl"2 и Bax, снижая уровень
наследственной формы БАС, наиболее часто
экспрессии Bcl"2 и вызывая расщепление Bax
наблюдаемые из них - дис" или гиперлипиде"
[27].
мия [16, 17]. Одним из характерных признаков
Наряду с церамидом, сфингозин ингибирует
БАС, наблюдаемых у ~66% пациентов c БАС,
протеинкиназу С (ПКС), наиболее значимый
является снижение веса вследствие гипермета"
липид"зависимый фермент, определяющий вы"
болизма, который непосредственно связан с ли"
живаемость клетки. Этот эффект обусловлен на"
пидным метаболизмом [16].
личием у сфингозина первичной аминогруппы
Регуляторная роль липидов, как вторичных
и длинного жирнокислотного остатка. Степень
мессенджеров, выявляется при исследовании
ингибирования зависит от присутствия в инку"
воспалительных процессов при развитии БАС,
бационной среде фосфатидилсерина, диацил"
которые сопровождаются активацией микро"
глицерина, ионов Са2+, лизофосфатидилхолина,
БИОХИМИЯ том 84 вып. 10 2019
СФИНГОИДНЫЕ ОСНОВАНИЯ ПРИ БОКОВОМ АМИОТРОФИЧЕСКОМ СКЛЕРОЗЕ
1439
форболовых эфиров и жирных кислот, которые
наз: казеинкиназу II [34], митоген"активируе"
являются активаторами ПКС [33]. Диацилгли"
мые протеинкиназы [35], киназу, активность ко"
церин в мембране облегчает транслокацию про"
торой специфически регулируется сфингозином
теинкиназы С из цитозоля в плазматическую
и диметилсфингозином (сфингозин"зависимая
мембрану и повышает ее сродство к Са"кальмо"
киназа) [36], с"Jun N"концевую киназу [37],
дулину, вызывая активацию фермента при более
протеинкиназу FA/GSK"3α, участвующую в про"
низкой концентрации ионов Са2+ в цитоплазме.
ведении сигнала теплового шока [38] и другие.
Форболовые эфиры имитируют действие диа"
Также СФЗ может оказывать влияние на
цилглицерина. Присутствие фосфолипидов и
множество других ферментов в клетке. Он акти"
жирных кислот необходимо для активации фер"
вирует GTP"циклогидролазу [39] и аденилат"
мента.
циклазу [40], фосфолипазу D [41] и фосфолипа"
Кроме влияния на активность ПКС, СФЗ
зу Сδ [42]. К ингибирующим эффектам сфинго"
способен активировать ряд других протеинки" зина относятся ингибирование НАДФH"окси"
Рис. 1. Схема метаболизма сфингоидных оснований
БИОХИМИЯ том 84 вып. 10 2019
1440
ГУТНЕР и др.
дазы [43], тканевого ростового фактора [44],
коллекция ИФАВ РАН, Россия), проявляющих
кальмодулинзависимой киназы [45], и тирозин"
характеристики БАС, в нервной системе кото"
киназной активности инсулинового рецептора
рых экспрессируется трансгенная последова"
[46], фосфогидролазы фосфатидной кислоты
тельность, кодирующая аберрантную форму
[47], регуляция активности ДАГ"киназы [48],
белка FUS человека с удаленным сигналом
ингибирование ЦТФ: фосфохолинцитидил"
ядерной локализации под нейронспецифичным
трансферазы [49]. СФЗ способен влиять на фос"
промотором Thy"1. Линию стабильно поддер"
форилирование различных рецепторных белков
живали в гемизиготном состоянии, согласно ра"
[44, 50, 51], а также вызывать мобилизацию Ca2+
нее описанному протоколу с переводом живот"
из внутриклеточных депо [52, 53].
ных на CD"1 генетический фон [57]. У трансген"
Проапоптотическое действие СФЗ связыва"
ных мышей накапливаются белковые включе"
ют с его способностью взаимодействовать с
ния в цитоплазме нервных клеток. Данный вид
ДНК, оказывать влияние на активность фер"
FUS"протеинопатии приводит к повреждению
ментов репликации и транскрипции [54] и на
аксонов мотонейронов, а также нейровоспали"
ДНК"связывающие свойства ряда регуляторных
тельной реакции и снижению численности тел
белков, включая транскрипционные факторы и
мотонейронов. Такая клиническая картина ха"
топоизомеразы [55, 56]. Некоторые свойства
рактеризуется относительно ранней манифеста"
сфингозина характерны также и для другого
цией заболевания (2,5-4,5 мес.) и быстрым ле"
сфингоидного основания - дигидросфингозина
тальным исходом (в течение нескольких дней с
или сфинганина - предшественника сфингози"
момента манифестации).
на в процессе его синтеза (рис. 1).
У модельных мышей выделяли структуры го"
Напротив, сфингозин"1"фосфат обладает
ловного мозга (гиппокамп, мозжечок и кору) и
антиапоптотическими свойствами и пролифе"
спинной мозг (поясничный отдел) в 2, 3 и 4 мес.
ративными эффектами. Особую роль в этих
жизни, что коррелировало с досимптомной,
процессах играет фермент сфингозин киназа,
ранней симптоматической и симптоматической
которая снижает уровень сфингозина в клетке,
фазой. В качестве контролей использовали од"
тем самым спасая ее от гибели [20, 27].
нопометных особей, не содержащих трансген"
Обладая яркими проапоптотическими свой"
ную кассету того же возраста, как и модельные.
ствами, сфингозин и сфинганин могут прини"
Липиды экстрагировали по методу Bligh и
мать непосредственное участие в гибели клеток
Dyer [58].
ЦНС в процессе развития БАС. Однако до сих
Сфингоидные основания (сфингозин и сфинга
пор практически не исследовали характер изме"
нин) и сфингозин 1 фосфат анализировали мето
нения уровня сфингоидных оснований при раз"
дом хромато масс спектрометрии [59]. Выделен"
витии БАС не только у людей, но и в модельных
ные липиды упаривали под током азота ПЭ"8920
экспериментах у животных. Характер измене"
(«Экросхим», Россия) и растворяли в смеси
ния СФЗ"1"Ф также мало изучен в ходе разви"
(хлороформ : метанол) = (2 : 1) (v/v) в концен"
тия БАС. Поэтому в нашей работе обращено
трации 6,8 мг/мл. Анализ липидов проводили
особое внимание на изменение содержания
методом ВЭЖХ/МС на приборе TSQ Endura
сфингозина и других сфингоидных оснований в
(«Thermo Scientific», США), снабженном
структурах головного и спинного мозга и на их
ВЭЖХ колонкой EclipsePlusC8
(«Agilent»,
возможное участие в гибели нейрональных кле"
США), в режиме мониторинга множественных
ток при БАС.
реакции (ММР). ММР переходы для сфингоид"
Целью исследования является определение
ных оснований указаны на схеме: сфингозин -
изменений в уровнях сфингоидных основа"
МН+ > (М"2Н2О)+, m/z 300 → m/z 264; сфинга"
ний - сфингозина, сфинганина и сфингозин"1"
нин: МН+ → (М"2Н2О)+, m/z302 > m/z 266;
фосфата и экспрессии генов ферментов, участ"
сфингозин"1"фосфат: МН+
→ (М"Н3РО4)+,
вующих в их метаболизме, в структурах голов"
m/z381 → m/z 264.
ного мозга (гиппокампе, коре и мозжечке) и в
Для построения калибровочных зависимос"
поясничном отделе спинного мозга трансген"
тей были использованы сфингозин, дейтеро"
ных мышей линии FUS(1"359), моделирующих
сфингозин, сфинганин и сфингозинфосфат С17
боковой амиотрофический склероз.
(«Avanti», США), (MRM переход: 366 > 250). Для
каждого липида вычисляли отношение площади
под хроматографическим пиком этой молекулы
МЕТОДЫ ИССЛЕДОВАНИЯ
к площади хроматографического пика от моле"
кулы стандарта.
В качестве модели БАС использовали линию
Анализ экспрессии генов ферментов метабо
трансгенных мышей FUS(1"359), (биоресурсная
лизма сфинголипидов проводили методом РНК"
БИОХИМИЯ том 84 вып. 10 2019
СФИНГОИДНЫЕ ОСНОВАНИЯ ПРИ БОКОВОМ АМИОТРОФИЧЕСКОМ СКЛЕРОЗЕ
1441
секвенирования. Библиотеки мРНК для секве"
нирования получены с помощью набора для вы"
деления поли(А)+ фракции мРНК от NEB
(«New England Biolabs», США) и набора для со"
здания библиотек NEBNext Ultra II Directional
RNA Library Prep Kit for Illumina («NEB», США)
по методике, предложенной производителем
[60]. Cеквенирование поли(А)"обогащенной
фракции РНК проводилось на платформе
Illumina NextSeq 500 («Illumina», США) в центре
коллективного пользования ИМБ РАН (http://
ботку данных проводили при помощи програм"
много обеспечения PPLine [61], она включала
триммирование коротких прочтений по качест"
Возраст животных, мес.
ву и длине при помощи программы Trimmomatic
[62], выравнивание прочтений на референсный
Рис. 2. Изменение уровня сфингозина в структурах голов"
геном версии GRCm38 программой STAR [63] и
ного мозга и в спинном мозге в процессе развития БАС у
подсчет прочтений, выравненных на гены прог"
мышей
раммой htseq"count [64].
Статистическая обработка данных и вычис"
ление дифференциальной экспрессии генов
не наблюдается. Напротив, в спинном мозге при
производили при помощи пакета edgeR [65], ис"
расчете количества сфингозина на мг фосфора
пользуемого в среде статистической обработки
установлены такие же резкие изменения, как и
данных языка R [66]. В ходе парного сравнения
при расчете на мг ткани.
экспериментальных групп для определения дос"
Содержание дигидросфингозина (сфинганина)
товерности дифференциальной экспреcсии ис"
в гиппокампе, мозжечке и коре головного мозга и в
пользовали стандартный F"тест Фишера, с при"
спинном мозге при развитии БАС у мышей. При
менением метода Беньямини-Хохберга для
анализе содержания дигидросфингозина (сфин"
внесения поправки на множественное тестиро"
ганина) в тех же условиях мы обнаружили прак"
вание [67]. Для визуализации полученных дан"
тически ту же картину, которую мы наблюдали
ных применяли пакет ggplot2 [68].
для сфингозина. Увеличение содержания этого
метаболита происходит в возрасте 4 мес. в спин"
ном мозге, но не так резко (только в 2 раза), как
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
это наблюдалось для сфингозина (рис. 3). В струк"
турах головного мозга его уровень на протяже"
Содержание сфингозина в гиппокампе, моз
жечке и коре головного мозга и в спинном мозге
при развитии БАС у мышей. Анализ сфингозина,
способного вызывать апоптоз в клетках ЦНС,
проводили в 2, 3 и 4"месячном возрасте. Коли"
чество сфингозина (пг) определяли в расчете на
мг ткани и на мг фосфора в липидном образце.
Изменений в количестве сфингозина, по отно"
шению к контрольным значениям, в расчетах на
вес ткани в мозжечке, коре и гиппокампе прак"
тически не наблюдается, в то время как в струк"
турах спинного мозга на терминальной стадии
(4 мес.) происходит 4× повышение уровня
сфингозина (рис. 2). В этот период происходит
резкая гибель клеток именно в спинном мозге.
Вполне возможно, что индуктором этой гибели
является сфингозин. При анализе изменений
Возраст животных, мес.
сфингозина в расчете на мг фосфора (данные не
представлены) можно отметить небольшое по"
Рис. 3. Изменение уровня сфинганина в структурах голов"
вышение в гиппокампе через 3 мес. и в коре через
ного мозга и в спинном мозге в процессе развития БАС
4 мес., однако в мозжечке никаких изменений
у мышей
БИОХИМИЯ том 84 вып. 10 2019
1442
ГУТНЕР и др.
нии всего срока наблюдений за развитием БАС у
СФЗ"1"Ф и изменения в содержании сфингози"
мышей практически не отличается от контро"
на и сфинганина только в спинном мозге, мы
лей. Эти результаты отмечены как при расчете
проанализировали экспрессию генов фермен"
его количества в ткани, так и на мг фосфора.
тов, участвующих непосредственно в их метабо"
Содержание сфингозин 1 фосфата в гиппо
лизме. Нами были тестированы гены ферментов
кампе, мозжечке и коре головного мозга и в спин
3"KSR, церамидазы, сфингозин киназы, сфин"
ном мозге при развитии БАС у мышей. Сфинго"
гозин"1"фосфат фосфатазы и СФЗ"1"Ф"лиазы
зин"1"фосфат - фосфорилированный продукт
(рис.
1).
3"KSR превращает 3"кетосфинганин
сфингозина в противоположность церамиду и
непосредственно в сфинганин. С помощью ди"
сфингозину, обладает антиапоптотическими
гидроцерамид синтазы сфинганин превращает"
свойствами и участвует в регуляции клеточной
ся в дигидроцерамид, который метаболизирует"
пролиферации [20]. Изменение его уровня и его
ся в церамид. Церамид с помощью церамидаз
отношения к сфингозину и сфинганину могут
превращается в сфингозин. Сфингозин в клетке
критическим способом влиять на выживаемость
появляется в результате именно этой реакции.
клеток ЦНС. В структурах головного мозга уро"
К настоящему времени известно 5 церамидаз
вень СФЗ"1"Ф имеет исходно низкий уровень и
[19]. Кислая церамидаза (ASAH1) локализована
практически не меняется в ходе заболевания
в лизосомальных компартментах, нейтральная
(рис. 4). В спинном мозге уровень данного
церамидаза (ASAH2) преимущественно нахо"
сфинголипида существенно выше, чем в струк"
дится в плазматической мембране, три щелоч"
турах головного мозга, и в процессе развития
ных церамидазы обнаружены в аппарате Гольд"
БАС его уровень достоверно не меняется в тече"
жи и плазматической мембране. А сфингозин
ние 4"х мес. Через 4 мес. отмечается лишь тен"
киназа фосфорилирует сфингозин, что приво"
денция к повышению. У контрольных животных
дит к появлению антиапоптотического агента -
с возрастом, напротив, отмечается тенденция к
сфингозин"1"фосфата (СФЗ"1"Ф), который, в
снижению уровня СФЗ"1"Ф. Этот эффект, веро"
свою очередь, при определенных условиях мо"
ятно, связан с возможным снижением защитных
жет превратиться снова в сфингозин с помощью
противоапоптотических резервов организма.
СФЗ"1"Ф фосфатазы или полностью быть выве"
Повышение содержания СФЗ"1"Ф у модельных
ден из метаболического цикла СФЗ"1"Ф лиазой
животных можно объяснить резким ростом
с образованием этаноламин"фосфата и гексаде"
сфингозина, из которого он образуется. Кроме
ценаля (рис. 1). Таким образом, для изменения
того, его отношение к СФЗ у этих животных рез"
уровня сфингозина в клетке имеется несколько
ко падает, т.е. нарушается баланс пролиферации
путей.
и апоптоза в клетках спинного мозга (рис. 2 и 4).
Вначале мы оценили уровень экспрессии ге"
Анализ экспрессии генов метаболизма сфинго
на 3=KSR, который участвует в синтезе сфинга"
зина, дигидросфингозина (сфинганина) и сфинго
нина, в ткани спинного мозга трансгенных мы"
зин 1 фосфата в спинном мозге мышей при разви
шей (FUS) и нетрансгенных животных дикого
тии БАС. В связи с тем, что мы обнаружили вы"
типа (WT). Нами обнаружено, что у 4"х месяч"
сокий исходный уровень СФЗ, сфинганина и
ных мышей уровень мРНК гена 3=KSR имеет
тенденцию к повышению по сравнению с конт"
рольными значениями. (рис. 5). Далее мы ис"
следовали уровень экспрессии 4"х генов, коди"
рующих церамидазу и обнаружили, что уровень
мРНК кислой церамидазы (ASAH1), локализо"
ванной в лизосомах, повышается, тогда как уро"
вень экспрессии нейтральной церамидазы
(ASAH2), которая находится на поверхности
плазматической мембраны, достоверно снижа"
ется в ходе прогрессии FUS"опосредованной
протеинопатии (p < 0,05, тест Фишера) (рис. 6).
Следует также отметить, что уровень мРНК ще"
лочных цермидаз (ACER2 и ACER3) остается без
изменений, а экспрессия ACER1 вообще отсут"
ствует в клетках спинного мозга (данные не
Возраст животных, мес.
приведены).
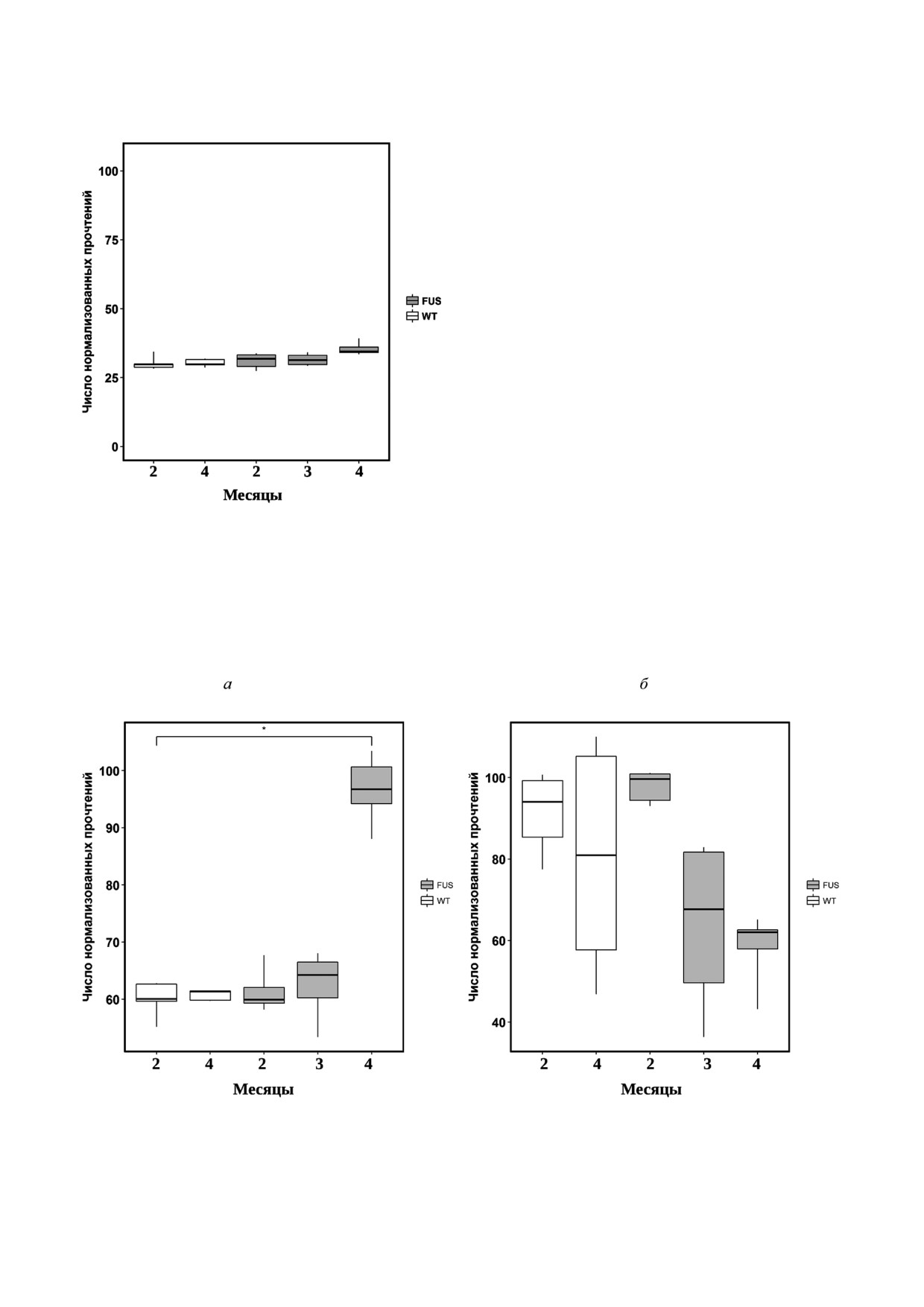
Анализ изменения экспрессии генов СФЗ"1"
Рис. 4. Изменение уровня СФЗ"1"Ф в структурах головно"
Ф"лиазы (SGPL) (рис. 7, а) и СФЗ"1"Ф"фосфа"
го мозга и в спинном мозге в процессе развития БАС
у мышей
тазы"2 (SGPP2) (рис. 7, б ), СФЗ"1"Ф"киназы 1
БИОХИМИЯ том 84 вып. 10 2019
СФИНГОИДНЫЕ ОСНОВАНИЯ ПРИ БОКОВОМ АМИОТРОФИЧЕСКОМ СКЛЕРОЗЕ
1443
3 KSR (3 Кетодигидросфингозин редуктаза)
(SPHK1) (рис.
7, в
), СФЗ"1"Ф"киназы
2
(SPHK2) (рис. 7, г) показал, что резко активиру"
ется распад СФЗ"1"Ф СФЗ"1"Ф"лиазой до ко"
нечных продуктов этаноламин"фосфата и гекса"
деценаля, падает фосфатазная активность и
наблюдается тенденция к снижению киназной
активности (рис. 7). Эти данные указывают на
то, что, несмотря на резкий рост СФЗ и сфинга"
нина, метаболизм СФЗ"1"Ф сдвинут в сторону
его деградации (рис. 7). Кроме того, отношение
содержания СФЗ"1"Ф к сфингоидным основа"
ниям резко падает, создавая условия для актив"
ного апоптоза.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
До сих пор механизмы дегенерации двига"
тельных нейронов при БАС не понятны, у этого
заболевания нет точно известных причин возник"
новения и нет эффективных методов лечения.
Однако в самых последних исследованиях было
Рис. 5. Уровень мРНК 3"кетодигидросфингозин"редукта"
установлено, что дегенерация моторных нейро"
зы в спинном мозге трансгенных мышей FUS(1"359) и не"
нов при БАС является формой апоптотической
трансгенных животных дикого типа (WT) в динамике раз" гибели клеток [5]. Апоптоз регулируется различ"
вития FUS"опосредованной протеинопатии. Данные по"
ными путями, которые взаимодействуют и в ко"
лучены в результате RNA"seq анализа и представлены в ви"
де количества картированных прочтений на миллион сек"
нечном итоге приводят к контролируемой гибели
венированных прочтений (CPM)
клеток. Помимо генетической регуляции, в каче"
ASAH1 (Кислая керамидаза)
ASAH2 (Нейтральная керамидаза)
Рис. 6. Уровень мРНК кислой (ASAH1) (a) и нейтральной (ASAH2) (б) церамидаз в спинном мозге трансгенных мышей
FUS(1"359) и нетрансгенных животных дикого типа (WT). * p < 0,05 (тест Фишера)
БИОХИМИЯ том 84 вып. 10 2019
1444
ГУТНЕР и др.
стве факторов, участвующих в контроле апоптоза,
и многие другие молекулы, связанные с апопто"
можно отметить свободные радикалы, рецепторы
зом. Различают апоптоз, инициируемый при по"
смерти, каспазы, проапоптозные белки семейства
вреждении ДНК, митохондрий и мембран лизо"
Вcl"2, ингибиторы белков апоптоза (IAP), белок"
сом. Ряд из этих типов апоптоза зафиксирован на
супрессор опухолей p53, фактор некроза опухоли"α
моделях БАС у животных [5, 69-71].
SGPL1 (Сфингозин 1 фосфат лиаза)
SGPP2 (Сфингозин 1 фосфатфосфатаза 2)
SPHK1 (Сфингозин киназа 1)
SPHK2 (Сфингозин киназа 2)
Рис. 7. Уровень экспрессии генов, кодирующих ферменты метаболизма Сфингозина и Сфингозин"1"Фосфата у трансген"
ных мышей FUS(1"359) и нетрансгенных животных дикого типа (WT). a - Сфингозин"1"фосфат"лиазы; б - сфингозин"
1"фосфатфосфатазы; в и г - уровень экспрессии сфингозин"киназы 1 и 2 соответственно. * p < 0,05 (тест Фишера)
БИОХИМИЯ том 84 вып. 10 2019
СФИНГОИДНЫЕ ОСНОВАНИЯ ПРИ БОКОВОМ АМИОТРОФИЧЕСКОМ СКЛЕРОЗЕ
1445
При дегенерации двигательных нейронов,
прогрессии FUS"опосредованной протеинопа"
вызванных мутантной супероксиддисмутазой"1
тии (рис. 6). Кислая церамидаза (ASAH1) лизо"
(mSOD1), развиваются события, характерные
сом гидролизует С10"С14"церамиды с насыщен"
для митохондриально"зависимого апоптоза у
ными связями или С18:1", С18:2"церамиды с не"
трансгенных мышей mSOD1 (проапоптотиче"
насыщенными связями. Субстратами ASAH2
ский белок Bax перемещается из цитозоля в ми"
являются С16"С22"церамиды или С26"С36"це"
тохондрии, а цитохром С переходит из митохон"
рамиды. Таким образом, сфингозин генерирует"
дрий в цитозоль, каспаза"9 активируется в спин"
ся лизосомальной церамидазой из церамидов с
ном мозге трансгенных мышей mSOD1 во время
более короткими жирными кислотами. Измене"
прогрессирования заболевания) [71].
ние активности лизосомальной церамидазы мо"
Несмотря на многочисленные работы, учас"
жет указывать на развитие «лизосомального»
тие сфинголипидов в развитии и регуляции
апоптоза. Следует также отметить, что уровень
апоптоза еще недостаточно изучено. Это связа"
мРНК щелочных цермидаз (ACER2 и ACER3) ос"
но, прежде всего, с разнообразием молекул
тается без изменений, а экспрессия ACER1 вооб"
сфинголипидов, сложной системой их метабо"
ще отсутствует в клетках спинного мозга. Эти
лизма и многоуровневым контролем выполне"
церамидазы локализуются в эндоплазматичес"
ния функций, а также с участием сфинголипи"
ком ретикулуме и в комплексе Гольджи, т.е. этот
дов практически во всех физиологических и па"
вид церамидаз не участвует в генерации сфинго"
тофизиологических процессах в клетке. Однако
зина из церамидов. Резкий скачок экспрессии
роль церамидов и сфингоидных оснований в
СФЗ"1"Ф"лиазы на терминальной стадии забо"
индукции апоптоза практически определена.
левания демонстрирует падение антиапоптоти"
Сфингозин способен индуцировать все выше"
ческих резервов клеток двигательных нейронов
перечисленные типы апоптоза. В частности, он
и стремительное развитие апоптоза. А усиление
вызывает деградацию ДНК [54], проводит ток"
экспрессии гена сфингозин"киназы на 2"й и 3"й
сический сигнал от фактора некроза опухоли"α
мес. эксперимента может объясняться защитны"
[28-30], индуцирует окислительный стресс, ак"
ми свойствами клеток двигательных нейронов
тивирует каспазы [31, 32] и многие другие сиг"
спинного мозга. Однако эти свойства нивелиру"
нальные молекулы апоптоза. Однако участие
ются в результате стремительного развития их
сфингоидных оснований в гибели двигательных
гибели на терминальной стадии в возрасте 4 мес.
нейронов при БАС практически не известно.
Применение метода масс"спектрометрии
Представленные результаты наших исследо"
позволило изучить различия в уровнях трех са"
ваний демонстрируют резко выраженную дис"
мых важных сфингоидных оснований, анализ
регуляцию в метаболизме сфингоидных основа"
которых другими методами довольно затрудни"
ний, включая сфингозин, сфинганин и сфинго"
телен. Мы впервые продемонстрировали учас"
зин"1"фосфат преимущественно в спинном
тие сфингоидных оснований в гибели клеток
мозге мышей, в то время как содержание этих
спинного мозга при развитии БАС. Кроме того,
сфинголипидов оказывается на низком уровне и
эти данные получены на модели, которая до"
практически не меняется в структурах головно"
вольно близко имитирует спорадическую форму
го мозга в процессе развития БАС. Это может
БАС у человека. Более глубокое понимание био"
определяться поражением именно двигатель"
логических путей, регулирующих метаболизм
ных нейронов при этом заболевании. При этом
различных сфинголипидов при развитии БАС,
резко снижается отношение антиапоптотиче"
может привести к идентификации мишеней для
ского агента - СФЗ"1"Ф к проапоптотияческим
лекарственных препаратов. В качестве таких
СФЗ и сфинганину, что указывает на резкую ин"
мишеней могут выступить ферменты метабо"
тенсификацию гибели клеток в структурах
лизма сфингоидных оснований, участвующих в
спинного мозга. Такого разрушительного про"
патогенезе БАС, например, ингибиторы кислой
цесса в головном мозге мы не наблюдаем.
церамидазы, ответственной за генерацию сфин"
Также значительные нарушения в экспрес"
гозина. Особый интерес в качестве потенциаль"
сии генов метаболизма сфинголипидов обнару"
ного лекарственного средства для лечения БАС
жены на разных стадиях развития БАС преиму"
представляет препарат Fingolimod - синтети"
щественно в спинном мозге. Из 4"х изученных
ческий аналог сфингозина, который в организ"
генов, кодирующих церамидазу, повышается
ме фосфорилируется и оказывает влияние, ха"
уровень мРНК кислой церамидазы ASAH1, ло"
рактерное для сфингозин"1"фосфата, антиапоп"
кализованной в лизосомах, тогда как уровень
тотического метаболита сфинголипидов [72].
экспрессии нейтральной церамидазы ASAH2,
Таким образом, подробное изучение изменений
которая находится на поверхности плазматиче"
в метаболизме сфингоидных оснований при
ской мембраны, достоверно снижается в ходе
БАС позволит более подробно понять его пато"
БИОХИМИЯ том 84 вып. 10 2019
1446
ГУТНЕР и др.
логические аспекты и создать новые лекар"
липидов в нейропатологиях выполнены в рамках
ственные средства для лечения данной нейроде"
госзадания ИБХФ РАН тема № 44.4 (Гос. Регист"
генеративной патологии.
рации 01201253310).
Благодарности. Содержание животных обес"
печено программой поддержки биоресурсных
Финансирование. Исследование нейродеге"
коллекций ИФАВ РАН и проведено на оборудо"
неративных процессов в модельных животных
вании ЦКП ИФАВ РАН. Анализ данных высо"
линии FUS(1"359) поддержано Российским на"
копроизводительного секвенирования был вы"
учным фондом (проект № 19"13"00378). Содер"
полнен на оборудовании ЦКП «Геном» ИМБ РАН
жание животных обеспечено программой поддер"
жки биоресурсных коллекций ИФАВ РАН и
Конфликт интересов. Авторы заявляют, что у
проведено на оборудовании ЦКП ИФАВ РАН в
них нет конфликта интересов.
рамках Гос. задания ИФАВ РАН «Поиск и иссле"
Соблюдение этических норм. Все примени"
дование механизмов действия нейропротекто"
мые международные, национальные и/или инс"
ров и стимуляторов когнитивных функций»
титуциональные принципы ухода и использова"
№
0090"2019"0005. Исследования по свойствам ния животных были соблюдены.
СПИСОК ЛИТЕРАТУРЫ
1.
Van Den Bosch, L. (2011) Genetic rodent models of amyo"
gene on chromosome 16 cause familial amyotrophic later"
trophic lateral sclerosis, J. Biomed. Biotechnol., 2011,
al sclerosis, Science, 323, 1205-1208, doi: 10.1126/
348765, doi: 10.1155/2011/348765.
science.1166066.
2.
Robberecht, W., Sapp, P., Viaene, M.K., Rosen, D.,
9.
Deng, H.X., Zhai, H., Bigio, E.H., Yan, J., Fecto, F.,
McKenna"Yasek, D., Haines, J., Horvitz, R., Theys, P.,
Ajroud, K., Mishra, M., Ajroud"Driss, S., Heller, S., Sufit, R.,
and Brown, R. Jr. (1994) Cu/Zn superoxide dismutase
Siddique, N., Mugnaini, E., and Siddique, T. (2010) FUS"
activity in familial and sporadic amyotrophic lateral sclero"
immunoreactive inclusions are a common feature in spo"
sis, J. Neurochem., 62, 384-387, doi: 10.1046/j.1471"
radic and nonSOD1 familial amyotrophic lateral sclerosis,
4159.1994.62010384.x.
Ann. Neurol., 67, 739-748, doi: 10.1002/ana.22051.
3.
Koppers, M., van Blitterswijk, M.M., Vlam, L., Rowicka,
10.
Daoud, H., Dobrzeniecka, S., Camu, W., Meininger, V.,
P.A., van Vught, P.W., Groen, E.J., Spliet, W.G., Engelen"
Dupre, N., Dion, P.A., and Rouleau, G.A.
(2013)
Lee, J., Schelhaas, H.J., de Visser, M., van der Kooi, A.J.,
Mutation analysis of PFN1 in familial amyotrophic lateral
van der Pol, W.L., Pasterkamp, R.J., Veldink, J.H., and van
sclerosis patients, Neurobiol. Aging, 34, 1311.e1-1311.e2,
den Berg, L.H. (2012) VCP mutations in familial and spo"
doi: 10.1016 /j.neurobiolaging.2012.09.001.
radic amyotrophic lateral sclerosis, Neurobiol. Aging, 33,
11.
Munch, C., Sedlmeier, R., Meyer, T., Homberg, V.,
837, doi: 10.1016/j.neurobiolaging.2011.10.006.
Sperfeld, A.D., Kurt, A., Prudlo, J., Peraus, G.,
4.
Daoud, H., Suhail, H., Szuto, A., Camu, W., Salachas, F.,
Hanemann, C.O., Stumm, G., and Ludolph, A.C. (2004)
Meininger, V., Bouchard, J.P., Dupre, N., Dion, P.A., and
Point mutations of the p150 subunit of dynactin (DCTN1)
Rouleau, G.A. (2012) UBQLN2 mutations are rare in
gene in ALS, Neurology, 63, 724-726, doi: 10.1212/01.
French and French"Canadian amyotrophic lateral sclero"
WNL.0000134608.83927.B1.
sis, Neurobiol. Aging, 33, 2230-2233, doi: 10.1016/j.neuro"
12.
Rademakers, R., and van Blitterswijk, M. (2014) Excess of
biolaging.2012.03.015.
rare damaging TUBA4A variants suggests cytoskeletal defects
5.
Sathasivam, S., Ince, P.G., and Shaw, P.J. (2001) Apoptosis
in ALS, Neuron, 84, 241-243, doi: 10.1016/j.neuron.
in amyotrophic lateral sclerosis: a review of the evidence,
2014.10.002.
Neuropathol. Appl. Neurobiol., 27, 257-274, doi: 10.1046/
13.
Ghasemi, M., and Brown, R.H. (2017) Genetics of amyotrophic
j.0305"1846.2001.00332.x.
lateral sclerosis, Cold Spring Harb. Perspect. Med., 7, a024125.
6.
DeJesus"Hernandez, M., Mackenzie, I.R., Boeve, B.F.,
14.
Hussain, G., Anwar, H., Rasul, A., Imran, A., Qasim, M.,
Boxer, A.L., Baker, M., et al. (2011) Expanded GGGGCC
Zafar, S., Imran, M., Kamran, S.K.S., Aziz, N., Razzaq, A.,
hexanucleotide repeat in noncoding region of C9ORF72
Ahmad, W., Shabbir, A., Iqbal, J., Baig, S.M., Ali, M.,
causes chromosome 9p"linked FTD and ALS, Neuron, 72,
Gonzalez de Aguilar, J.L., Sun, T., Muhammad, A., and
245-256, doi: 10.1016/j.neuron.2011.09.011.
Muhammad Umair, A. (2019) Lipids as biomarkers of
7.
Mackenzie, I.R., Bigio, E.H., Ince, P.G., Geser, F.,
brain disorders, Crit. Rev. Food Sci. Nut., 7, 1-24,
Neumann, M., Cairns, N.J., Kwong , L.K., Forman, M.S.,
doi: 10.1080/10408398.2018.1529653.
Ravits, J., Stewart, H., Eisen, A., McClusky, L.,
15.
Hussain, G., Wang, J., Rasul, A., Anwar, H., Imran, A.,
Kretzschmar, H.A., Monoranu, C.M., Highley, J.R.,
Qasim, M., Zafar, S., Kamran, S.K.S., Razzaq, A., Aziz, N.,
Kirby, J., Siddique, T., Shaw, P.J., Lee, V.M., and
Ahmad, W., Shabbir, A., and Iqbal, J., (2019) Role of cho"
Trojanowski, J.Q. (2007) Pathological TDP"43 distin"
lesterol and sphingolipids in brain development and neuro"
guishes sporadic amyotrophic lateral sclerosis from amyo"
logical diseases, Lipids Health Dis.,
18,
26-38,
trophic lateral sclerosis with SOD1 mutations, Ann.
doi: 10.1186/s12944"019"0965"z.
Neurol., 61, 427-434, doi: 10.1002/ana.21147.
16.
Dupuis, L., Corcia, P., Fergani, A., Gonzalez De Aguilar, J.L.,
8.
Kwiatkowski, T.J., Bosco, D.A., Leclerc, A.L., Tamrazian, E.,
Bonnefont"Rousselot, D., Bittar, R., Seilhean, D.,
and Vanderburg, C.R. (2009) Mutations in the FUS/TLS
Hauw, J.J., Lacomblez, L., Loeffler, J.P., and Meininger, V.
БИОХИМИЯ том 84 вып. 10 2019
СФИНГОИДНЫЕ ОСНОВАНИЯ ПРИ БОКОВОМ АМИОТРОФИЧЕСКОМ СКЛЕРОЗЕ
1447
(2008) Dyslipidemia is a protective factor in amyotrophic
MCF7 breast adenocarcinoma cells, Cell Death Differ., 8,
lateral
sclerosis,
Neurology,
70,
1004-1009,
162-171, doi: 10.1038/sj.cdd.4400793.
doi: 10.1212/01.wnl.0000285080.70324.27.
32.
Hung, W.C., Chang H.C., and Chuang, L.Y. (1999)
17.
Chen, X., Yazdani, S., Piehl, F., Magnusson, P.K.E., and
Activation of caspase"3"like proteases in apoptosis induced
Fang, F. (2018) Polygenic link between blood lipids and
by sphingosine and other long"chain bases in Hep3B
amyotrophic lateral sclerosis, Neurobiol. Aging,
67,
hepatoma cells, Biochem. J., 338, 161-166.
202.e1-202.e6, doi: 10.1016/j.neurobiolaging.2018.03.022.
33.
Smith, E.R., Merrill, A.H., Obeid, L.M., and Hannun,
18.
Albi, E., Alessenko, A., and Grosch, S. (2018), Mediators
Y.A. (2000) Effects of sphingosine and other sphingolipids
Inflamm., 2018, 1-3, doi: 10.1155/2018/7464702.
on protein kinase C, Methods Enzymol., 312, 361-373,
19.
Алесенко А.В. (2013) Потенциальная роль сфинголи"
doi: 10.1016/s0076"6879(00)12921"0.
пидов в нейропатогенезе болезни Альцгеймера, Био=
34.
McDonald, O.B., Hannun, Y.A., Reynolds, C.H., and
медицинская химия, 59, 25-50, doi: 10.18097/pbmc
Sahyoun, N. (1991) Activation of casein kinase II by sphin"
20135901025.
gosine, J. Biol. Chem., 266, 21773-21776.
20.
Maceyka, M., and Spiegel, S. (2014) Sphingolipid
35.
Coroneos, E., Wang, Y., Panuska, J.R., Templeton, D.J.,
metabolites in inflammatory disease, Nature, 510, 58-67,
and Kester, M. (1996) Sphingolipid metabolites differen"
doi: 10.1038/nature13475.
tially regulate extracellular signal"regulated kinase and
21.
Okuwa, H., Kanno, T., Fujita, Y., Gotoh, A., Tabata, C.,
stress"activated protein kinase cascades, Biochem J., 316,
Fukuoka, K., Nakano, T., and Nishizaki, T.
(2012)
13-17, doi: 10.1042/bj3160013.
Sphingosine suppresses mesothelioma cell proliferation by
36.
Megidish, T., White, T., Takio, K., Titani, K., Igarashi, Y.,
inhibiting PKC"δ and inducing cell cycle arrest at the
and Hakomori, S. (1995) The signal moleculator protein
G(0)/G(1) phase, Cell Physiol. Biochem., 30, 995-1004,
14"3"3 is a target a sphingosine" or N,N"dimethylsphingo"
doi: 10.1159/000341476.
sine"depend kinase in 3T3 (A31) cells, Biochem. Biophys.
22.
Hannun, Y.A., Loomis, C.R., Merrill, A.H. Jr., and Bell, R.M.
Res. Commun., 216, 739-747, doi: 10.1006/bbrc.1995.
(1986) Sphingosine inhibition of protein kinase C activity
2684.
and of phorbol dibutyrate binding in vitro and in human
37.
Pyne, S., and Pyne, N.J. (1996) The differential regulation
platelets, J. Biol. Chem., 261, 12604-12609.
of cyclic AMP by sphingomyelin"derived lipids and the
23.
Conkling, P.R., Patton, K.L., Hannun, Y.A., Greenberg, C.S.,
modulation of sphingolipid"stimulated extracellular signal
and Weinberg, J.B. (1989) Sphingosine inhibits monocyte
regulated kinase"2 in airway smooth, Biochem. J., 315,
tissue factor"initiated coagulation by altering factor VII
917-923, doi: 10.1042/bj3150917.
binding, J. Biol. Chem., 264, 18440-18444.
38.
Yang, S.D., Chang, H.C., and Lee, S.C. (1996) Okadaic
24.
Zhang, H., Buckley, N.E., Gibson, K., and Spiegel, S. (1990)
asid, sphingosine, and phorbol ester reversibly modulate
Sphingosine stimulates cellular proliferation via a protein
heat induction on protein kinase FA/GSK"3 alpha in A431
kinase C"independent pathway, J. Biol. Chem., 265, 76-81.
cells, J. Cell. Biochem., 60, 218-225, doi: 10.1002/(SICI)1097"
25.
Hakomori, S."I. (1992) Functional role of glycosphin"
4644(19960201)60:2<218::AID"JCB6>3.0.CO;2"#.
golipids in tumor progression, J. Exp. Med., 168, 211-222,
39.
Anastasiadis, P.Z., Kuhn, D.M., Blitz, J., Imerman, B.A.,
doi: 10.1620/tjem.168.211.
Louie, M.C., and Levine, R.A. (1996) Regulation of tyro"
26.
Bibel, D.J., Aly, R., and Shinefield, H.R. (1995) Topical
sine hydrolase and tetrahydrobiopterin biosynthetic in
sphingolipids in antisepsis and antifungal therapy, Clin.
PC12cells by NGF, EGF and IFN"gamma, Brain Res.,
Exp. Dermatol. Clin. Exp. Dermatol., 20, 395-400.
713, 125-133, doi: 10.1016/0006"8993(95)01494"2.
27.
Taha, T.A., Mullen, N.D., and Obeid, L.M. (2006)
40.
Zhou, H., Summers, S.A., Birnbaum, M.J., and Pittman, R.N.
A house divided: ceramide, sphingosine, and sphingosine"1"
(1998) Inhibition of Akt kinase by cell"permeable ceramide
phosphate in programmed cell death, Biochim. Biophys.
and its implications for ceramide"induced apoptosis,
Acta, 1758, 2027-2036.
J. Biol. Chem.,
273,
16568-16575, doi:
10.1074/
28.
Alessenko, A.V., and Khrenov, A.V. (1999) Role of sphin"
jbc.273.26.16568.
gosine in induced apoptosis, Lipids,
34, S75-S76,
41.
Lavie, Y., and Liscovitch, M. (1990) Activation of phos"
doi: 10.1007/bf02562235.
pholipase D by sphigoid bases in NG108"15 neural derived
29.
Krown, K.A., Page, Mt., Nguyen, C., Zechner, D.,
cells, J. Biol. Chem., 265, 3868-3872.
Gutierrez, V., Comstock, K.L., Gembotski, C.C.,
42.
Matecki, A., Stopa, M., Was, A., and Pawelczyk, T. (1997)
Quintana, P.J., and Sabbadini, R.A. (1996) Tumor necrosis
Effect of sphingomyelin and its metabolites on the activity
factor alpha"induced apoptosis in cardiac myocytes.
of human recombinant PLC delta 1, Int. Biochem. Cell.
Involvement of the sphingolipid signaling cascade in car"
Biol., 29, 815-828, doi: 10.1016/s1357"2725(97)00014"9.
diac cell death, J. Clin. Invest.,
98,
2854-2865,
43.
Sasaki, J.I., Yamaguchi, M., Yamane, H., Okamura, N.,
doi: 10.1172/jci119114.
and Ishibashi, S.
(1996) Sphingosine inhibition of
30.
Sweeney, E.A., Sakakura, C., Shirahama, T., Masamune,
NADPH oxidase activation in a cell"free system, J. Bio=
A., Ohta, H., Hakamori, S., and Igarashi, Y.
(1996)
chem. (Tokio), 120, 705-709, doi: 10.1093/oxfordjournals.
Sphingosine and its methylated derivative N,N"dimethyl"
jbchem.a021468.
sphingosine (DMS) induce apoptosis in a variety of human
44.
Pushkareva, M.Yu., Khan, W.A., Alessenko, A.V.,
cancer cell lines, Int. J. Cancer,
66,
358-366,
Sahyoun, N., and Hannun, Y.A. (1992) Sphingosine acti"
doi: 10.1002/(sici)1097"0215(19960503)66:3<358::aid"
vation of protein kinases in Jurkat T cells. In vitro phos"
ijc16>3.0.co;2"7.
phorylation of endogenous protein substrates and specifici"
31.
Cuvillier, O., Nava, V.T., Murthy, S.K., Edsall, L.C.,
ty of action, J. Biol. Chem., 267, 15246-15251.
Levade, T., Milstien, S., and Spiegel, S.
(2001)
45.
Jefferson, A.B., and Schulman, H. (1988) Sphingosine
Sphingosine generation, cytochrome c release, and activa"
inhibites calmoduline"depended enzymes, J. Biol. Chem.,
tion of caspase"7 in doxorubicin"induced apoptosis of
263, 15241-15244.
БИОХИМИЯ том 84 вып. 10 2019
1448
ГУТНЕР и др.
46.
Arnold, R.S., and Newton, A.C. (1991) Inhibition of the
phate by tandem mass spectrometry, Methods Enzymol.,
insulin receptor tyrosine kinase by sphingosine, Bioche=
312, 32-45, doi: 10.1016/S0076"6879(00)12898"8.
mistry, 30, 7747-7754.
60.
Funikov, S.Y., Rezvykh, A.P., Mazin, P.V., Morozov, A.V.,
47.
Mullmann, T.J., Siegel, M.I., Egan, R.W., and Billah, M.M.
Maltsev, A.V., Chicheva, M.M., Vikhareva, E.A.,
(1991) Sphingosine inhibits phosphatidate phosphohidro"
Evgen’ev, M.B., Ustyugov, A.A. (2018) FUS(1"359) trans"
lase in human neutrophils by a PKC"independed mecha"
genic mice as a model of ALS: pathophysiological and
nism, J. Biol. Chem., 266, 2013-2016.
molecular aspects of the proteinopathy, Neurogenetics, 19,
48.
Sakane, S., Takemura, H., Yamada, K., Imoto, K.,
189-204, doi: 10.1007/s10048"018"0553"9.
Kaneko, M., and Ohshika, H. (1996) Different effects of
61.
Krasnov, G.S., Dmitriev, A.A., Kudryavtseva, A.V.,
sphingosine, R59022 and anionic amphiphiles on two di"
Shargunov, A.V., Karpov, D.S., Uroshlev, L.A., Melnikova, N.V.,
acylglycerol kinase isozymes purified from porcine thymus
Blinov, V.M., Poverennaya, E.V., Archacov, A.I., Lisitsa, A.V.,
cytosol, J. Biol. Chem., 271, 1148-1155, doi: 10.1016/
and Ponomarenko, E.A. (2015) PPLine: An automated
0014"5793(89)81134"2.
pipeline for SNP, SAP, and splice variant detection in the
49.
Sohal, P.S., and Corne, R.B. (1990) Sphingosine inhibits
context of proteogenomics, J. Proteome Res.,
14,
the activity of rat liver CTP" phosphocholine cytidiltrans"
3729-3737, doi: 10.1021/acs.jproteome.5b00490.
ferase, J. Biol. Chem., 265, 11746-11750.
62.
Bolger, A.M., Lohse, M., and Usadel, B.
(2014)
50.
Davis, R.J., Girones, N., and Faucher, M. (1988) Two
Trimmomatic: a flexible trimmer for Illumina sequence
alternative mechanisms control the interconversion of
data, Bioinformatics, 30, 2114-2120, doi: 10.1093/bioin"
functional states of the epidermal growth factor receptor,
formatics/btu170.
J. Biol. Chem., 263, 5373-5379.
63.
Dobin, A., Davis, C.A., Schlesinger, F., Drenkow, J.,
51.
Fausher, M., Girones, N., Hannun, Y.A., Bell, R.M., and
Zaleski, C., Jha, S., Batut, P., Chaisson, M., and Gingeras, T.R.
Davis, R.J. (1988) Regulation of the epidermal growth fac"
(2013) STAR: ultrafast universal RNA"seq aligner,
tor receptor phosphorylation state by sphingosine in A431
Bioinformatics, 29, 15-21, doi: 10.1093/bioinformatics/bts635.
human epidermoid carcinoma cells, J. Biol. Chem., 263,
64.
Anders, S., Pyl, P.T., and Huber, W. (2015) HTSeq - a
5319-5327.
Python framework to work with high"throughput sequenc"
52.
Huang, W.C., and Chueh, S.H. (1996) Calcium mobiliza"
ing
data,
Bioinformatics,
31,
166-169,
tion from the intracellular mitochondrial and nonmito"
doi: 10.1101/002824.
chondrial stores of the rat cerebellum, Brain Res., 718,
65.
Robinson, M.D., McCarthy, D.J., and Smyth, G.K.
151-158, doi: 10.1016/0006"8993(96)00108"4.
(2010) edgeR: a bioconductor package for differential
53.
Czajkowski, R., and Baranska, J. (1999) Sphingosine and
expression analysis of digital gene expression data,
phorbol ester modulate protein kinase C activity and mod"
Bioinformatics, 26, 139-140, doi: 10.1093/bioinformatics/
ify ATP"evoked calcium mobilization in glioma C6 cells,
btp616.
Biochem. Biophys. Res. Commun.,
260,
614-618,
66.
RC Team (2000) R Language Definition, R Foundation for
doi: 10.1006/bbrc.1999.0946.
Statistical Computing, Vienna, Austria.
54.
Tamiya"Koizumi, K., Murate, T., Suzuki, M., Simbulan, C.M.,
67.
Thissen, D., Steinberg, L., and Kuang, D. (2002) Quick
Nakagawa, M., Takemura, M., Furuta, K., Izuta, S., and
and easy implementation of the Benjamini"Hochberg pro"
Yoshida, S. (1997) Inhibition of DNA primase by sphigo"
cedure for controlling the false positive rate in multiple
sine and its analogues paralleles with their growth suppres"
comparisons, J. Educ. and Behav. Stat., 27, 77-83,
sion of cultured human leukemic cells, Biochem. Mol. Biol.
doi: 10.3102/10769986027001077.
Int., 41, 1179-1189, doi: 10.1080/15216549700202271.
68.
Wickham, H. (2011) ggplot2, Wiley Interdisciplinary Re=
55.
Koiv, A., Palvimo, J., and Kinnunen, P.K. (1995) Evidence
views: Computational Statistics, 3, 180-185, doi:10.1002/wics.147.
for ternary complex formation by histone H1 and lipo"
69.
Hensley, K., Floyd, R.A., Gordon, B., Mou, S., Pye, Q.N.,
somes, Biochemistry,
34,
8018-8027, doi:
10.1021/
Stewart, C., West, M., and Williamson, K.
(2002)
bi00025a007.
Temporal patterns of cytokine and apoptosis"related gene
56.
Hwong, C.L., Chen, M.S., and Hwang, J.L. (1989)
expression in spinal cords of the G93A"SOD1 mouse
Phorbol ester transiently increases topoisomerase I mRNA
model of amyotrophic lateral sclerosis. J. Neurochem., 82,
levels in human skin fibroblasts, J. Biol. Chem., 264,
365-367, doi: 10.1046/j.1471"4159.2002.00968.x.
14923-14926.
70.
Ekegren, T., Grundstrom, E., Lindholm, D., and
57.
Дейкин А.В., Ковражкина Е.А., Овчинников Р.К.,
Aquilonius, S.M. (1999) Upregulation of Bax protein and
Броновицкий Е.В., Разинская О.Д., Смирнов А.П.,
increased DNA degradation in ALS spinal cord motor
Ермолкевич Т.Г., Еляков А.Б., Попов А.Н., Федоров Е.Н.,
neurons, Acta Neurol. Scand., 100, 317-21, doi: 10.1111/
Лыткина О.А., Кухарский М.С., Тарасова Т.В.,
j.1600"0404.1999.tb00403.x.
Шелковникова Т.А., Устюгов А.А., Нинкина Н.Н.,
71.
Guegan, C., Vila, M., Rosoklija, G., Hays, A.P., and
Гольдман И.Л., Садчиков Е.Р., Бачурин С.О.,
Przedborski, S. (2001) Recruitment of the mitochondrial"
Скворцова В.И. (2014) Модель бокового амиотрофи"
dependent apoptotic pathway in amyotrophic lateral scle"
ческого склероза на основе линии трансгенных мы"
rosis, J. Neurosci., 21, 6569-6576, doi: 10.1523/JNEU"
шей, экспрессирующих мутантную форму FUS белка
ROSCI.21"17"06569.2001.
человека, Журнал неврологии и психиатрии им.
72.
Berry, J.D., Paganoni, S., Atassi, N., Macklin, E.A.,
С.С. Корсакова, 8, 63-70.
Goyal, N., Rivner, M., Simpson, E., Appel, S., Grasso, D.L.,
58.
Bligh, T.G., and Dyer, W.J. (1959) A rapid method of total
Mejia, N.I., Mateen, F., Gill, A., Vieira, F., Tassinari, V.,
lipid extraction and purification, Can. J. Biochem. Physiol.,
and Perrin, S. (2017) Phase IIa trial of fingolimod for amy"
37, 911-917, doi: 10.1139/o59"099.
otrophic lateral sclerosis demonstrates acceptable acute
59.
Sullards, M.C. (2000) Analysis of sphingomyelin, glucosyl"
safety and tolerability, Muscle Nerve, 56, 107784, doi:
ceramide, ceramide, sphingosine, and sphingosine 1"phos"
10.1002/mus.25733.
БИОХИМИЯ том 84 вып. 10 2019
СФИНГОИДНЫЕ ОСНОВАНИЯ ПРИ БОКОВОМ АМИОТРОФИЧЕСКОМ СКЛЕРОЗЕ
1449
CHANGES IN METABOLISM OF SPHINGOID BASES
IN THE BRAIN AND SPINAL CORD OF TRANSGENIC
MICE FUS(1 359) MODELING AMYOTROPHIC
LATERAL SCLEROSIS
U. A. Gutner1, M. A. Shupik1, O. A. Maloshitskaya2, S. A. Sokolov2, A. P. Rezvykh3,
S. Yu. Funikov3, A. T. Lebedev2, A. A. Ustyugov4, and A. V. Alessenko1*
1 Emanuel Institute of Biochemical Physics, Russian Academy of Sciences,
119991 Moscow, Russia; E=mail: alicealessenko@gmail.com
2 Lomonosov Moscow State University, Faculty of Chemistry, 119999 Moscow, Russia
3 Engelhardt Institute of Molecular Biology, Russian Academy of Sciences,
119991 Moscow, Russia
4 Institute of Physiologically Active Compounds, Russian Academy
of Sciences, 142432 Chernogolovka, Moscow Region, Russia
Received March 7, 2019
Revised June 17, 2019
Accepted June 17, 2019
The aim of this study was to determine changes in the levels of sphingoid bases - sphingosine (SPH), sphinganine and
sphingosine"1"phosphate (S1P) - and expression of genes encoding enzymes, involved in their metabolism, in brain
structures (hippocampus, cortex and cerebellum) and in spinal cord of transgenic mice of the FUS(1"359) strain.
FUS(1"359) mice, possessing motor impairments, were used as an amyotrophic lateral sclerosis (ALS) model. Lipids
from the structures of the brain and spinal cord after 2, 3, and 4 months of disease development were analyzed by
chromato"mass"spectrometry. Expression of SPHK1, SPHK2, SGPP2, SGPL1, ASAH1, and ASAH2 genes was
changed. The level of SPH and sphinganine, sphingoid bases with pronounced pro"apoptotic properties, dramatical"
ly increased in spinal cord at the terminal stage of the disease. The ratio of anti"apoptotic S1P to SPH and sphinga"
nine was sharply reduced, indicating an intensive apoptosis in spinal cord cells. Significant changes in the content of
SPH and S1P and in the expression of genes related to their metabolism were found at the terminal stage of ALS in
spinal cord. Expression of SGPL gene (S1P lyase) was sharply activated and expression of SGPP2 gene (S1P phos"
phatase) was reduced. Deeper understanding of the regulation of metabolism of various sphingolipids in ALS will help
to identify targets for new"generation drugs.
Keywords: amyotrophic lateral sclerosis, sphingosine, sphingosine"1"phosphate, SPHK2, SGPP2, SGPL1,
ASAH1, ASAH2
6 БИОХИМИЯ том 84 вып. 10 2019