БИОХИМИЯ, 2019, том 84, вып. 10, с. 1460 - 1472
УДК 612.01.8;612.017.1;611.018.53
РОЛЬ КАСПАЗ В ПРОЯВЛЕНИИ ЦИТОТОКСИЧНОСТИ КЛЕТОК
NK 92 В РАЗЛИЧНЫХ МОДЕЛЯХ ИХ СОКУЛЬТИВИРОВАНИЯ
С КЛЕТКАМИ ТРОФОБЛАСТА*
© 2019 Ю.П. Милютина**, В.А. Михайлова, К.М. Пятыгина, Е.С. Демидова,
Д.А. Малыгина, Т.Е. Тертычная, А.В. Арутюнян, Д.И. Соколов, С.А. Сельков
Федеральное государственное бюджетное учреждение «НИИ акушерства
и гинекологии им. Д.О. Отта» Северо&Западного отделения РАМН,
199034 Санкт&Петербург, Россия; электронная почта: milyutina1010@mail.ru
Поступила в редакцию 17.04.2019
После доработки 18.06.2019
Принята к публикации 22.06.2019
Изучение особенностей взаимодействия естественных киллеров с клетками трофобласта и выявление усло
вий, при которых NK клетки способны реализовывать свою цитотоксическую функцию, имеет важное
фундаментальное и прикладное значение для понимания их роли в развитии патологических процессов и
осложнений в период беременности. В данной работе продемонстрированы особенности изменения содер
жания и активации каспаз в клетках трофобласта линии Jeg 3 в различных моделях их сокультивирования с
клетками линии NK 92 и показана необходимость непосредственного контакта между клетками данных по
пуляций для активации каспазы 8 и каспазы 3 в клетках трофобласта. В результате взаимодействия в клет
ках линии Jeg 3 обнаруживается цитотоксический белок гранзим B, что сопровождается снижением его ко
личества в клетках линии NK 92. Дистантное сокультивирование клеток линий NK 92 и Jeg 3 не приводит
к активации инициаторной и эффекторной каспаз в клетках линии Jeg 3, характерной для картины разви
тия апоптоза. При этом снижение исследуемых прокаспаз в клетках трофобласта может быть обусловлено
реализацией их альтернативных неапоптических функций.
КЛЮЧЕВЫЕ СЛОВА: каспазы, гранзим B, трофобласт, естественные киллеры, апоптоз.
DOI: 10.1134/S0320972519100087
При физиологически протекающей бере
плаценты, в частности, клетками иммунной
менности и формировании плаценты процессу
системы, определяющими феномен иммунно
апоптоза отводят одну из ключевых ролей. Ин
логической толерантности матери к отцовским
гибирование или гиперактивация апоптоза в ре
антигенам, которые экспрессируются клетками
зультате нарушения механизмов его регуляции
трофобласта [4]. Поскольку в число функций
может явиться причиной развития акушерских
NK клеток входит уничтожение аллогенных
осложнений и основой патогенеза различных
клеток, вопросы, связанные с взаимодействием
заболеваний плода
[1]. Изучение процесса
клеток трофобласта и NK клеток, до настояще
апоптоза в плаценте до настоящего времени вы
го времени являются объектом пристального
зывает ряд трудностей, что связано с проблемой
внимания. В мировой литературе накопилось
получения первичного биологического матери
достаточно большое количество сведений о де
ала и оценки вклада отдельных популяций кле
цидуальных NK клетках (dNK), вопрос о про
ток в данный процесс [2, 3]. Это определяет ак
исхождении которых до сих пор остается дис
туальность исследований, связанных с исполь
куссионным [5].
зованием различных моделей взаимодействия
Установлено, что dNK содержат в большем
клеток трофобласта с клетками, принимающи
количестве цитотоксические белки, такие как
ми активное участие в процессах формирования
порообразующий белок перфорин, специфи
ческие сериновые протеазы, в частности гран
зимы A и B, а также гранулизин [6-9]. Показа
* Первоначально английский вариант рукописи опубли
но, что dNK клетки продуцируют факторы,
участвующие в инвазии трофобласта и в ангио
msu.ru/biokhimiya, в рубрике «Papers in Press», BM19 121,
16.09.2019.
генезе. С другой стороны, они могут ограничи
** Адресат для корреспонденции.
вать глубину инвазии трофобласта, проявляя
1460
КАСПАЗЫ ТРОФОБЛАСТА ПРИ ВЗАИМОДЕЙСТВИИ С КЛЕТКАМИ NK 92
1461
цитотоксичность, в том числе, благодаря секре
среде Игла α модификации (α modification
ции фактора α некроза опухолей (TNF α) и ин
Minimum Essential Medium, α MEME), содер
терферона γ (IFN γ) [10, 11]. Одной из основ
жащей 12,5% ную инактивированную ЭТС,
ных причин изменения цитотоксичности NK
12,5% ную инактивированную лошадиную сы
клеток в плаценте в настоящее время считается
воротку, 0,02 мМ фолиевой кислоты, 0,2 мМ
ингибирующее действие трофобласта. Сниже
мио инозитола, 2 мМ L глутамина, 100 мкг/мл
ние цитотоксичности NK клеток до уровня, при
стрептомицина, 100 ед/мл пенициллина, 10 мМ
котором они не вызывают цитолиз трофоблас
HEPES, 0,1 мМ 2 меркаптоэтанола («Sigma
тов, является необходимым условием для их
Aldrich», СШA), 500 МЕ/мл рекомбинантного
нормальной инвазии. Однако результаты иссле
IL 2 (препарат «Ронколейкин», ООО «Биотех»,
дований, касающихся изучения изменения ци
Россия). Клетки линий NK 92 Jeg 3 культиви
тотоксической активности NK клеток при взаи
ровали в инкубаторе во влажной атмосфере при
модействии с различными клетками в области
37 °С, 5% ной СО2. Жизнеспособность клеток
маточно плацентарного контакта, противоре
оценивали с помощью раствора трипанового
чивы [6, 12-14].
синего, она составляла не менее 96%.
В настоящее время существует несколько
Дистантное сокультивирование NK клеток и
методов оценки цитотоксической активности
клеток трофобласта. Для исключения прямого
NK клеток. Один из них - это исследование
контакта между клетками линии NK 92 и клет
процесса активации внутриклеточных цистеи
ками линии Jeg 3 использовали эксперимен
новых протеаз (каспаз) [15]. Таким образом, с
тальную модель, получившую в литературе наз
учетом ключевой роли каспаз в реализации
вание системы transwell [21]. Использовали 6 лу
апоптотической гибели клеток, а также их воз
ночный планшет и вставки с поликарбонатной
можного участия в других биологических про
мембраной (диаметр поры - 1 мкм, площадь
цессах, таких как клеточная дифференцировка
мембраны - 4,8 см2) («BD», США). Эта модель
[16], интересным представляется оценка харак
обеспечивает межклеточное взаимодействие
тера активации каспаз в клетках трофобласта
только за счет растворимых факторов. Клетки
после их взаимодействия с NK клетками в сис
линии Jeg 3 инкубировали 24 ч до образования
теме in vitro.
конфлюэнтного монослоя в нижней камере
Целью данной работы является исследова
(лунка 6 луночного планшета) в концентрации
ние содержания цитотоксических белков в клет
1,2 × 106 клеток на лунку в 8 мл среды DMEM,
ках линии NK 92, а также анализ процесса ак
10% ной ЭТС. На второй день удаляли 4 мл сре
тивации инициаторной каспазы 8 и эффектор
ды из каждой лунки и помещали в них вставку с
ной каспазы 3 в клетках трофобласта линии Jeg 3
поликарбонатной мембраной, в которую вноси
в различных моделях их совместного культиви
ли 1,8 × 106 клеток линии NK 92 в 4 мл среды
рования.
α MEME, 12,5% ной ЭТС (рис.1, a). Клетки в
системе transwell инкубировали 24 ч. Экспери
менты проводили во влажной атмосфере, 37 °С,
МЕТОДЫ ИССЛЕДОВАНИЯ
5% ной СО2. В качестве контроля использовали
интактные клетки линий NK 92 и Jeg 3, проин
Клетки. Использовали клетки линии Jeg 3
кубированные раздельно.
(«ATCC», СШA), воспроизводящие морфологи
Контактное сокультивирование NK клеток и
ческие, фенотипические и функциональные ха
клеток трофобласта. Клетки линии Jeg 3 культи
рактеристики инвазивного трофобласта первого
вировали во флаконах площадью 75 см2 («BD») в
триместра беременности [17, 18]. Клетки куль
полной ростовой среде DMEM в концентрации
тивировали в полной ростовой среде DMEM с
2 × 106 клеток/мл в течение 24 ч для достижения
добавлением 10% ной эмбриональной телячьей
50% ного субконфлюэнтного монослоя. Затем
сыворотки (ЭТС), 100 ед/мл пенициллина и
клетки линии Jeg 3 окрашивали витальным кра
100 мкг/мл стрептомицина, 0,5 мМ L глутами
сителем CFSE (cукцинимидиловый эфир диаце
на, 1% незаменимых аминокислот 1 мл MEM,
тата 5(6)карбоксифлуоресцеина) в соответствии
1 мМ пирувата натрия («Sigma Aldrich Chem.
с указаниями производителя («Sigma», США).
Co.», США). Для дезинтеграции монослоя кле
Далее во флакон с окрашенными CFSE клетка
ток использовали раствор версена и трипсина
ми линии Jeg 3 вносили клетки линии NK 92 в
(«Biolot», Россия) (1 : 1). Клетки линии NK 92
концентрации 3 × 106 клеток/мл и инкубировали
(«ATCC») воспроизводят базовые фенотипичес
24 ч во влажной атмосфере, 37 °С, 5% ной СО2.
кие и функциональные характеристики активи
После инкубации клетки собирали из лунок,
рованных натуральных киллеров (NK клеток)
обрабатывая их раствором версена. В качестве
[19, 20]. Клетки культивировали в минимальной
контроля использовали клетки линий NK 92 и
БИОХИМИЯ том 84 вып. 10 2019
1462
МИЛЮТИНА и др.
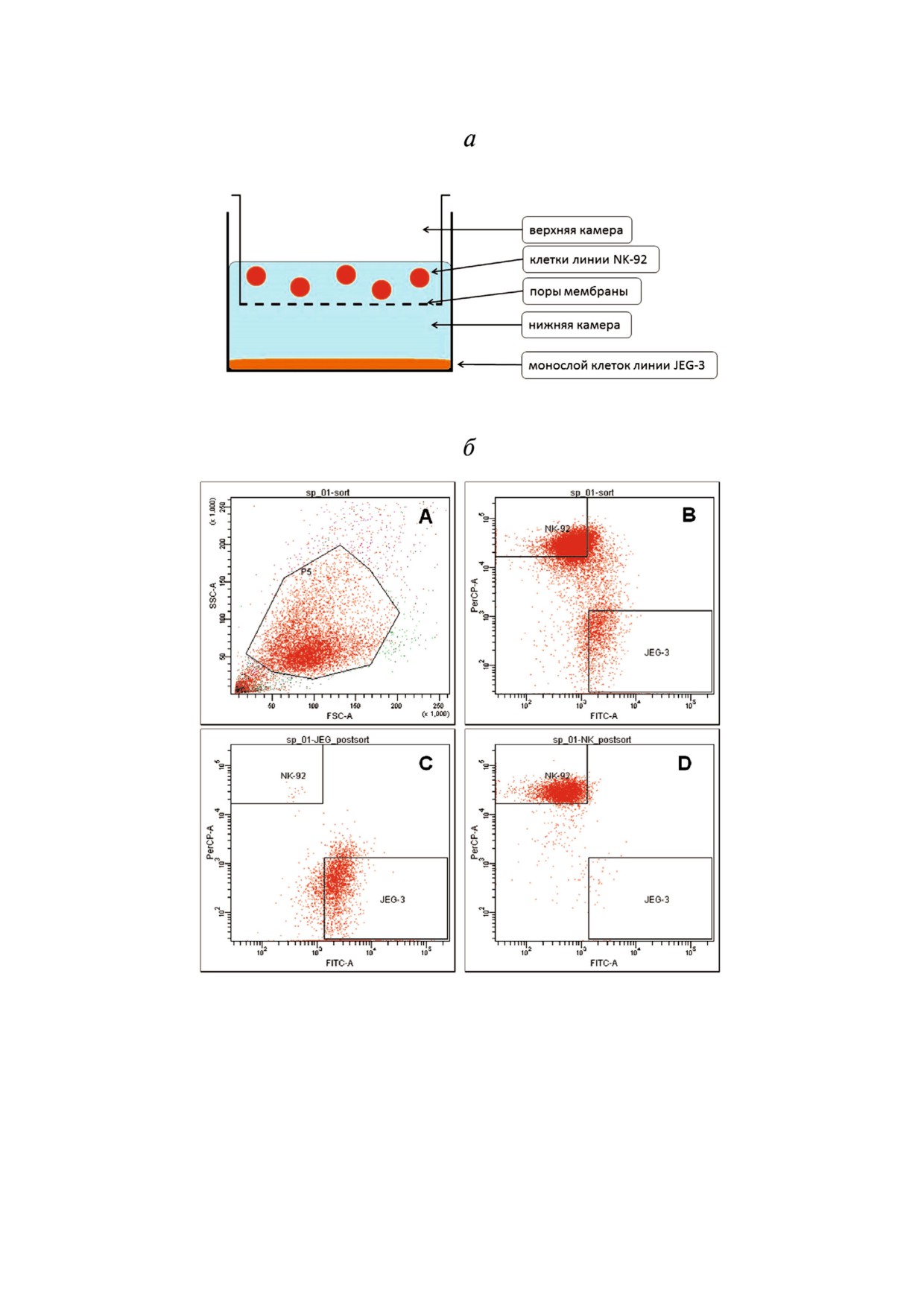
Рис. 1. Стратегия проведения экспериментов по дистантному и контактному сокультивированию клеток линии Jeg 3 и
клеток линии NK 92. a - Схема эксперимента дистантного сокультивирования клеток линий Jeg 3 и NK 92 в 6 луночном
планшете; б - стратегия гейтирования клеток линий NK 92 и Jeg 3, использованная при их сортировке после контактно
го сокультивирования (A -presort клеток линии NK 92, обработанных антителами к CD45(PerCp) и клеток линии Jeg 3,
меченных красителем CFSE(FITC); график распределения в координатах FSC SSC, гейт P5 содержит клетки линии NK
92 и Jeg 3. B - график распределения в координатах PerCP FITC. Квадрант NK 92 содержит клетки линии NK 92, ме
ченные CD45(PerCp). Квадрант Jeg 3 содержит клетки линии Jeg 3, меченные CFSE(FITC). C - postsort клеток линии Jeg 3
в координатах PerCP-FITC. D - postsort клеток линии NK 92 в координатах PerCP-FITC).
biokhsm/
БИОХИМИЯ том 84 вып. 10 2019
КАСПАЗЫ ТРОФОБЛАСТА ПРИ ВЗАИМОДЕЙСТВИИ С КЛЕТКАМИ NK 92
1463
Jeg 3, которые культивировали раздельно в ана
мощью специфичных первичных антител к кас
логичных условиях. Эксперименты по контакт
пазе 8 (Caspase 8 (1C12) mouse Ab 1:1000, «Cell
ному и дистантному сокультивированию про
Signaling», США), к каспазе 3 (Caspase 3 rabbit
водили четырежды, в каждом исследовании со
Ab, 1 : 1000, «Cell Signaling»). Содержание бел
культивированные клетки и контрольные ин
ков, входящих в состав литических гранул, ана
тактные клетки инкубировали в четырёх повто
лизировали с помощью моноклональных анти
рах.
тел против гранзима B (anti Granzyme B, mouse
Сортировка клеток. Разделение клеток линии
Ab, 1 : 1000, «Biolegend») или перфорина (Anti
NK 92 и клеток линии Jeg 3 после их контакт
Human Perforin, mouse Ab, 1 : 1000, «Bioscience
ного сокультивирования проводили с помощью
Inc.», CA). После инкубации с HRP конъюгиро
проточного цитофлуориметра сортировщика
ванными козьими антителами против кролика
клеток FacsAriaIII («BD»). Полученную после
или мыши (1 : 1000, «BioRad») сигналы регист
контактного сокультивирования суспензию
рировали с помощью усиленной хемилюминес
клеток в растворе версена трижды отмывали
ценции («ECL GE», Швеция). Полученные дан
теплой средой DMEM, центрифугируя при 200 g.
ные были нормализованы по β актину (beta
Затем суспензию клеток обрабатывали антите
Actin, Rabbit Ab, «Cell Signaling») либо по глице
лами к CD45 (PerCP) в соответствии с указания
ральдегид 3 фосфат дегидрогеназе (GAPDH
ми производителя («BD»). При контроле неспе
(14C10) Rabbit Ab, 1 : 1000, «Cell Signaling»). Ак
цифического связывания использовали антите
тивацию каспазы 3 оценивали как отношение
ла для изотопического контроля в соответствии
обнаруженного активного фрагмента каспазы 3
с протоколами производителя («BD»). Для раз
(p17), полученного в результате расщепления, к
деления клеток использовали протокол Purity
эндогенному уровню неактивного профермента
(рис. 1, б) и сопло диаметром 85 мкм. Популя
каспазы 3 (p35). Активацию каспазы 8 рассчи
цию клеток линии NK 92 выделяли по феноти
тывали как отношение ее активного фрагмента
пу CD45+(PerCp), клетки линии Jeg 3 - по мар
(p18) к прокаспазе 8 (p57) и выражали в услов
кировке CFSE (FITC). Разделение клеток про
ных единицах.
водили по прямому и боковому свечению, по
Статистическую обработку проводили с по
каналам FITC и PerCP. На основании измерения
мощью программы STATISTICA 10.0. Для срав
пробы, обработанной изотипическим контро
нения исследованных показателей был исполь
лем, устанавливали границы флуоресценции.
зован непараметрический U критерий Ман
На основании измерения пробы, обработанной
на-Уитни или t тест для независимых выборок.
антителами, выделяли целевые клетки для сор
Данные проверены на нормальность распреде
тировки (presort). Для подтверждения качества
ления с помощью критерия Шапиро-Уилка,
разделения клеток различных популяций про
однородность дисперсий оценивалась критери
водили процедуру, называемую postsort, согласно
ем Ливена. Переменные с нормальным распре
протоколу производителя. Во всех случаях чис
делением представлены как средние арифмети
тота выделения клеток линии NK 92 и клеток
ческие и стандартные отклонения (M ± sd). Ког
линии Jeg 3 составила не менее 99,0 ± 1,0%. До
да нормальное распределение отсутствовало,
лю жизнеспособных клеток после выделения на
использовали Медианы (25-75 ая перцентили).
сортировщике оценивали с помощью обработки
клеток раствором 7ААД («Biolegend», США),
она составила 91,6 ± 2,9%.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Иммуноблоттинг. Клетки, полученные после
экспериментов, промывали три раза охлажден
Данные, представленные на рис. 2, показы
ным фосфатным буфером (0,01M PBS, pH 7,4) и
вают, что после контактного сокультивирования
лизировали в буфере RIPA (50 мМ, Тris HCl,
данных популяций клеток, в лизатах клеток ли
pH 8,1, 1% ный Тriton Х 100, 0,1% ный SDS,
нии NK 92 снижено содержание гранзима B
0,5% ный дезоксихолат натрия, 1 мM ЭДТА, 150 мM,
(n = 6). Уровень перфорина при этом не отли
NaCl), содержащем коктейль ингибиторов про
чался от его уровня в интактных клетках линии
теаз («Roche», Швейцария). Пробы центрифу
NK 92. Не было выявлено различий в содержа
гировали 10 мин при 16 000 g для удаления кле
нии гранзима B и перфорина между клетками
точного дебриса. Концентрацию общего белка в
линии NK 92 после их дистантного сокультиви
пробах оценивали по методу Бредфорда [22].
рования с клетками линии Jeg 3 и интактными
Образцы клеточных лизатов разделяли в 10% ном
клетками линии NK 92 (n = 6). Установлено, что
полиакриламидном геле (ПААГ) по Лэммли и
в результате контактного сокультивирования
переносили на PVDF мембрану. Содержание
клеток линий Jeg 3 и NK 92, цитотоксический
прокаспаз и активных каспаз выявляли с по
белок гранзим B методом иммуноблоттинга об
БИОХИМИЯ том 84 вып. 10 2019
1464
МИЛЮТИНА и др.
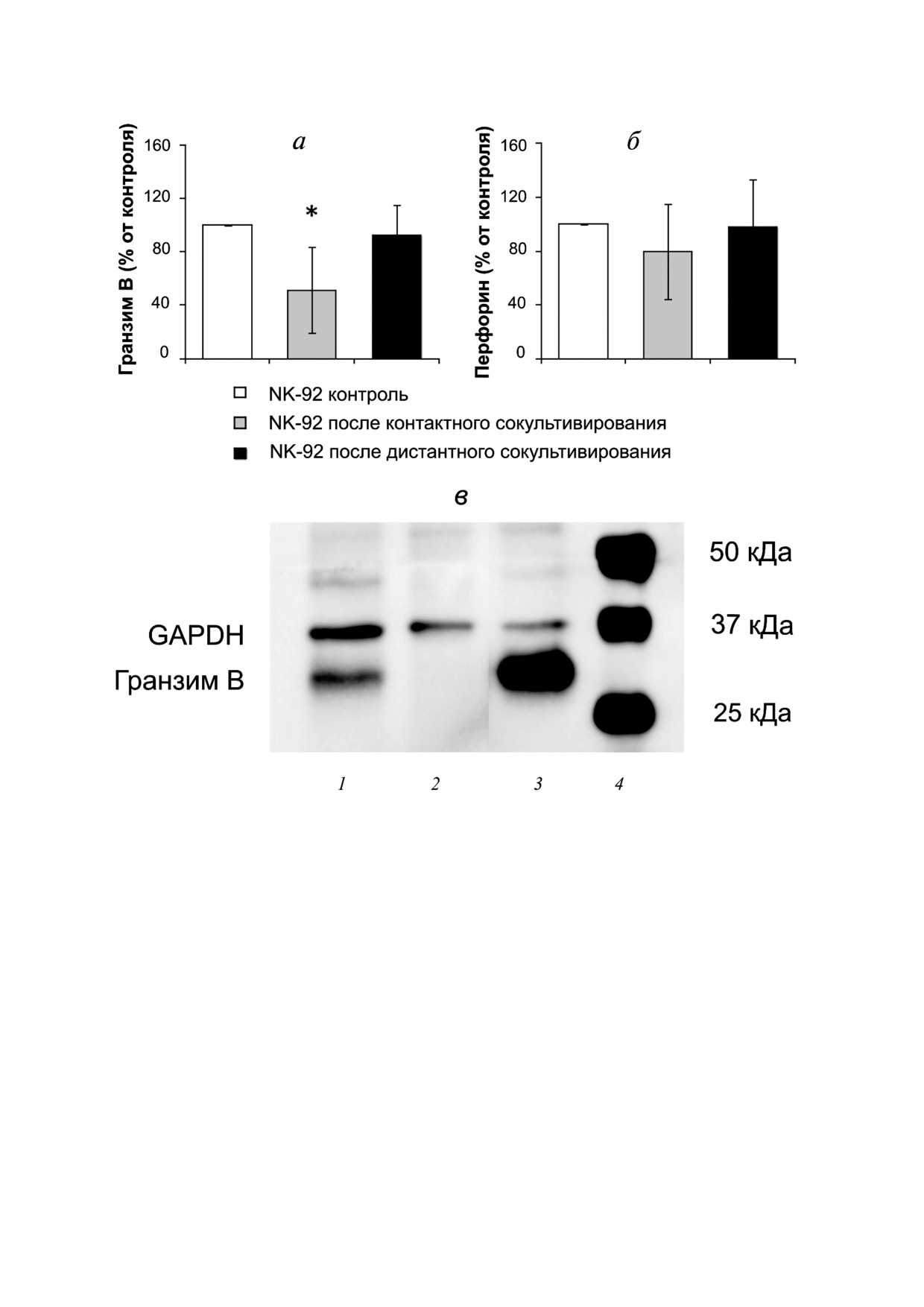
Рис. 2. Анализ содержания цитотоксических белков. а - Количественная оценка содержания гранзима B в лизатах клеток
линии NK 92 после контактного и дистантного сокультивирования с клетками линии Jeg 3 относительно его содержания
в интактных клетках линии NK 92 (контроль) (* p < 0,05 - отличие показателя в лизатах клеток линии NK 92 после сов
местного сокультивирования с клетками линии Jeg 3 от интактных клеток линии NK 92); б - количественная оценка со
держания перфорина в лизатах клеток линии NK 92 после контактного и дистантного сокультивирования с клетками ли
нии Jeg 3 относительно его содержания в интактных клетках линии NK 92 (контроль); в - иммуноблот, демонстрирую
щий содержание гранзима В в клетках линии Jeg 3 после контактного сокультивирования с клетками линии NK 92 (1 -
клетки линии Jeg 3 после совместного культивирования с клетками линии NK 92; 2 - клетки линии Jeg 3 культивирова
ннные спонтанно (интактные клетки); 3 - клетки линии NK 92 интактные; 4 - маркеры мол. массы)
наруживается в клетках линии Jeg 3. При этом
линии Jeg 3 (p < 0,05). При этом, несмотря на
после дистантного сокультивирования данных
отличие отношения фрагмента активной каспа
культур клеток гранзим B не выявлялся в клет
зы 3 к прокаспазе 3 в контрольных и опытных
ках линии Jeg 3.
клетках линии Jeg 3, достоверных различий в
В клетках линии Jeg 3 после их дистантного
уровне фрагмента активной каспазы 3 в лизатах
сокультивирования с клетками линии NK 92
клеток линии Jeg 3 после дистантного сокульти
(опыт) количество прокаспазы 3 было ниже по
вирования с клетками линии NK 92 и контроль
сравнению с интактными (контроль) клетками
ными клетками линии Jeg 3 обнаружено не бы
БИОХИМИЯ том 84 вып. 10 2019
КАСПАЗЫ ТРОФОБЛАСТА ПРИ ВЗАИМОДЕЙСТВИИ С КЛЕТКАМИ NK 92
1465
ло (n = 4) (рис. 3, а). Показано, что через 24 ч
В клетках линии Jeg 3 после контактного со
после дистантного сокультивирования с клетка
культивирования с клетками линии NK 92 была
ми линии NK 92 в клетках линии Jeg 3 содержа
обнаружена повышенная активация в них кас
ние прокаспазы 8 снижено по сравнению с ин
пазы 3 по сравнению с интактными клетками
тактными клетками линии Jeg 3. Содержание
линии Jeg 3. Оценка значения показателя ин
фрагмента активной каспазы 8 в клетках линии
тенсивность фрагмента активной каспазы 3/
Jeg 3 после дистантного сокультивирования с
интенсивность прокаспазы 3 выявила, что дан
клетками линии NK 92 не отличалось от его со
ная величина в клетках линии Jeg 3 после их
держания в контрольных клетках линии Jeg 3.
контактного сокультивирования с клетками ли
Различий в активации каспазы 8, выраженной в
нии NK 92 превышала аналогичный показатель
отношении интенсивность фрагмента активной
в интактных клетках Jeg 3 (p < 0,05) (n = 4). В от
каспазы 8/интенсивность прокаспазы 8 в клет
личие от дистантного сокультивирования изме
ках линии Jeg 3 после дистантного сокультиви
нение данного показателя связано с повышен
рования с клетками линии NK 92 и интактными
ным по сравнению с контрольными клетками
клетками линии Jeg 3, также не обнаруживалось
линии Jeg 3 уровнем фрагмента активной кас
(n = 4) (рис. 3, б).
пазы 3 в клетках линии Jeg 3 после контактного
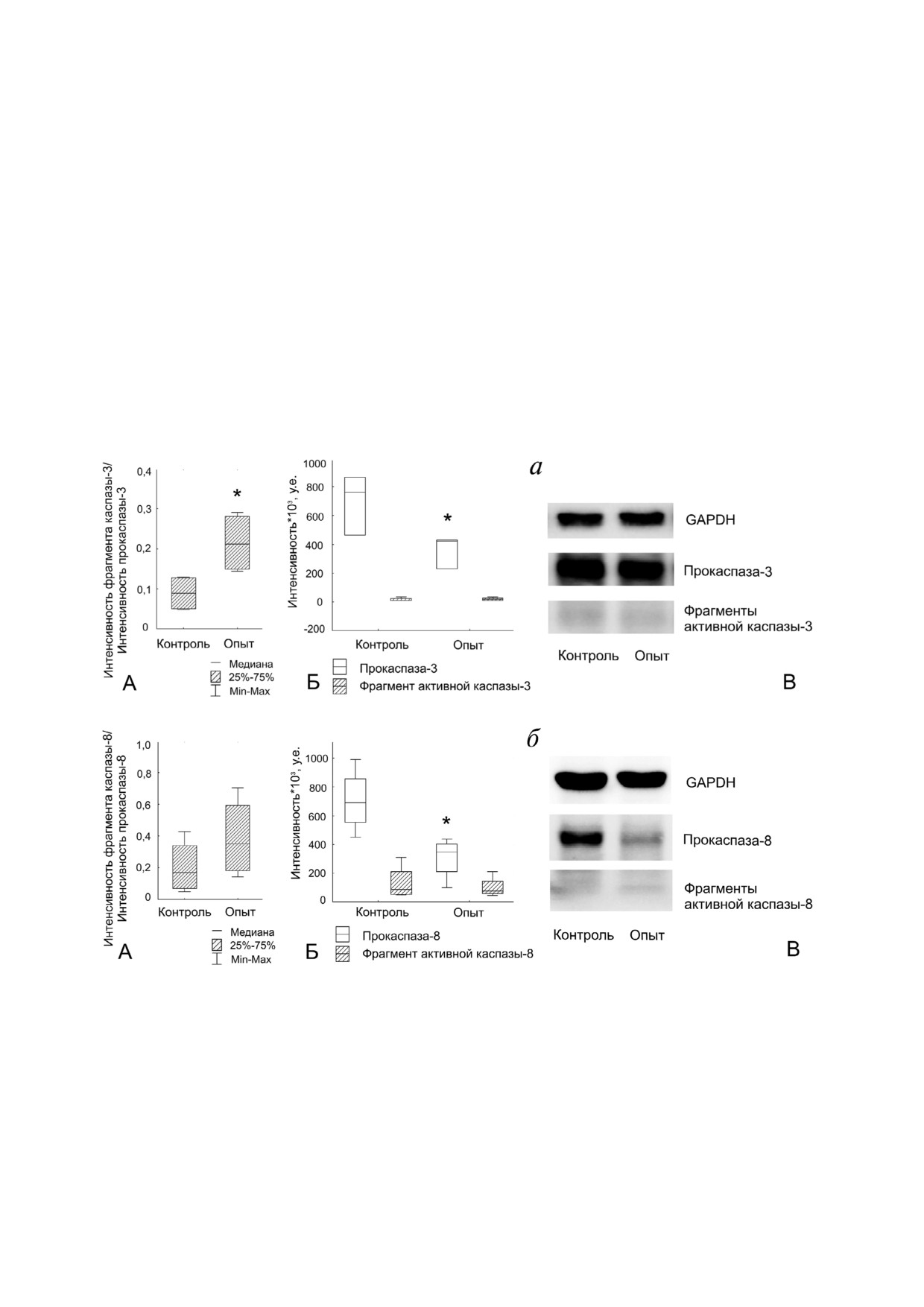
Рис. 3. Активация каспаз в клетках линии Jeg 3 после дистантного сокультивирования с клетками линии NK 92. а - Ак
тивация каспазы 3 в клетках линии Jeg 3. (А - отношение интенсивности фрагмента активной каспазы 3 к интенсивнос
ти прокаспазы 3 в интактных (контроль) клетках линии Jeg 3 и после дистантного сокультивирования с клетками линии
NK 92 (опыт). Б - влияние клеток линии NK 92 на интенсивность фрагмента каспазы 3 и интенсивность прокаспазы 3
в клетках линии Jeg 3 при дистантном сокультивировании. В -результат иммуноблоттинга каспазы 3 клеток линии Jeg 3);
б - активация каспазы 8 в клетках линии Jeg 3. (А - отношение интенсивности фрагмента активной каспазы 8 к интен
сивности прокаспазы 8 в интактных (контроль) клетках линии Jeg 3 и после дистантного сокультивирования с клетками
линии NK 92 (опыт). Б - влияние клеток линии NK 92 на интенсивность фрагмента каспазы 8 и интенсивность прокас
пазы 8 в клетках линии Jeg 3 при дистантном сокультивировании. В - результат иммуноблоттинга каспазы 8 клеток ли
нии Jeg 3); * p < 0,05 - отличие показателя в лизатах клеток линии Jeg 3 после совместного сокультивирования с клетка
ми линии NK 92 от интактных клеток линии Jeg 3
7 БИОХИМИЯ том 84 вып. 10 2019
1466
МИЛЮТИНА и др.
сокультивирования с клетками линии NK 92.
при интактном культивировании клеток линии
При этом в клетках линии Jeg 3 интенсивность
Jeg 3 в серии данных экспериментов не наблю
полос прокаспазы 3 в контроле и опыте не име
далось (n = 4) (рис. 4, б).
ла достоверных различий (n = 4) (рис. 4, а).
Одновременно с обнаружением фрагмента
активной каспазы 3 показано увеличение сте
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
пени активации каспазы 8, выраженной в виде
отношения фрагмента активной каспазы 8 к
Предотвращение гибели полуаллогенного
прокаспазе 8 в клетках линии Jeg 3, получен
трофобласта при взаимодействии с цитотокси
ных после их контактного сокультивирования с
ческими клетками иммунной системы матери
клетками линии NK 92 по сравнению с таковым
является стратегической физиологической зада
в интактных клетках линии Jeg 3 (р < 0,05)
чей, решаемой организмом в период беремен
(n = 4). При этом изменение данного отноше
ности. Поэтому клетки трофобласта обладают
ния связано только с обнаружением в опытных
мощным арсеналом средств защиты, направ
образцах фрагмента p18 каспазы 8 (p < 0,05), так
ленной на сохранение их жизнеспособности.
как отличия интенсивности полос прокаспазы 8
При контакте клеток трофобласта и NK клеток
в клетках линии Jeg 3 после контактного со
можно оценить взаимовлияние этих популяций
культивирования с клетками линии NK 92 и
клеток. В настоящее время показана иммуноре
Рис. 4. Активация каспаз в клетках линии Jeg 3 после контактного сокультивирования с клетками линии NK 92. а - Ак
тивация каспазы 3 в клетках линии Jeg 3 (А - отношение интенсивности фрагмента активной каспазы 3 к интенсивнос
ти прокаспазы 3 в интактных (контроль) клетках линии Jeg 3 и после контактного сокультивирования с клетками линии
NK 92 (опыт). Б - влияние клеток NK 92 на интенсивность фрагмента каспазы 3 и интенсивность прокаспазы 3 в клет
ках линии Jeg 3 при контактном сокультивировании. В - результат иммуноблоттинга каспазы 3 клеток линии Jeg 3);
б - активация каспазы 8 в клетках линии Jeg 3 (А - отношение интенсивности фрагмента активной каспазы 8 к интен
сивности прокаспазы 8 в интактных (контроль) клетках линии Jeg 3 и после контактного сокультивирования с клетками
линии NK 92 (опыт). Б - влияние клеток линии NK 92 на интенсивность фрагмента каспазы 8 и интенсивность прокас
пазы 8 в клетках линии Jeg 3 при контактном сокультивировании. B - результат иммуноблоттинга каспазы 8 клеток ли
нии Jeg 3); * p < 0,05 - отличие показателя в лизатах клеток линии Jeg 3 после совместного сокультивирования с клетка
ми линии NK 92 от интактных клеток линии Jeg 3
БИОХИМИЯ том 84 вып. 10 2019
КАСПАЗЫ ТРОФОБЛАСТА ПРИ ВЗАИМОДЕЙСТВИИ С КЛЕТКАМИ NK 92
1467
гуляторная (в основном, иммуносупрессивная)
мой методом иммуноблоттинга. [37]. В результа
роль ряда соединений, синтезируемых трофо
те этого процесса возрастает возможное количе
бластом (синцитин 1, лиганды NKG2D рецеп
ство расщепляемых субстратов, включая каспа
торов и др.) в отношении материнской иммун
зу 3. [38]. Обнаружение субъединицы p18 в
ной системы [23, 24]. Имеются данные о том,
клетках исследователи обычно расценивают как
что трофобласт продуцирует IL 10 [25, 26],
маркер активации каспазы 8. Многие неапоп
TGFβ [27].
тотические функции каспазы 8 зависят от фос
В результате взаимодействия NK клеток с
форилирования остатка тирозина (Tyr380), об
другими клетками при распознавании их, как
наруженного в области линкера между большой
клеток мишеней, происходит активация NK
и малой субъединицами фермента. Данный про
клеток, в частности NK клеток перифериче
цесс приводит к повышенной резистентности к
ской крови (pNK), а также использованных на
CD95 индуцированному апоптозу. Полагают,
ми клеток линии NK 92. В результате образова
что пониженная скорость апоптоза при этом
ния иммунологического синапса в цитоплазму
обусловлена сниженной скоростью расщепле
клетки мишени высвобождается массив цито
ния каспазы 8, что подтверждается уменьшени
токсических белков, что приводит к индукции
ем образования фрагмента p18 либо его полным
апоптоза [28-30]. Клетки NK 92 в условиях
исчезновением [37, 39]. Показано, что актива
контактного сокультивирования, по видимому,
ция каспазы 8, сопровождаемая экспрессией
способны реализовывать свое цитотоксическое
фосфатидилсерина на внешней стороне цитоп
действие в отношении клеток трофобласта.
лазматической мембраны, не всегда ассоцииру
Данное предположение подтверждается тем, что
ется с гибелью клетки. Подобное событие в тро
мы обнаруживаем в клетках линии Jeg 3 после
фобласте может являться следствием слияния
их контакта с клетками NK 92 гранзим B. Появ
клеток и формирования синцитиального слоя
ление гранзима B в клетках линии Jeg 3 сопро
[40], что продемонстрировано исследованиями,
вождается снижением его уровня в клетках
которые выполнены in vitro на модели хориокар
NK 92, что указывает на его адресную секрецию.
циномы JAR [41]. Однако клетки линии JAR
Кроме того, NK клетки могут активировать
также, как и клетки линии Jeg 3 по сравнению,
апоптоз в клетке мишени путем включения ре
например, с клетками BeWo, не подвергаются
цепторов смерти на клеточной поверхности, та
обширной синцитиализации [42-44]. При этом
ких как белки семейства рецепторов фактора
в исследованиях с клетками линии BeWo, подверг
некроза опухоли (TNFR), включая Fas (CD95)
нутых форсколиновому межклеточному слия
[31-33]. Нами показано, что контактное сокуль
нию, показано, что синцитиализация сопро
тивирование клеток линии NK 92 и клеток ли
вождается снижением уровня прокаспазы 3 (че
нии Jeg 3 приводит к активации инициаторной
рез 24 ч культивирования) и прокаспазы 8 (че
каспазы 8 контакт зависимого пути индукции
рез 48 ч культивирования), что является резуль
апоптоза в клетках линии Jeg 3. Показано, что
татом снижения экспрессии белков. Исследова
клетки трофобласта экспрессируют Fas и другие
тели подтверждают данное предположение об
рецепторы смерти (TRAIL R1 и TRAIL R2) на
наруженным снижением транс крипции соот
своей поверхности [34]. Каспаза 8 была перво
ветствующих мРНК при образовании синцития
начально охарактеризована как инициатор
и отсутствием появления активных фрагментов
внешнего пути апоптоза. Более поздние наблю
каспазы 3 и каспазы 8 [42]. Сходная картина,
дения, установившие, что каспаза 8 активирует
демонстрирующая снижение уровня прокаспа
ся во многих типах опухолей, привели к откры
зы 8 и прокаспазы 3, и отсутствие активных
тию ее альтернативных, неапоптотических
фрагментов соответствующих каспаз, отмечена
функций [35, 36]. Каспаза 8 полностью активи
нами в клетках Jeg 3 после их дистантного со
руется только после двухэтапного процесса,
культивирования с клетками NK 92. Исходя из
включающего начальную димеризацию прокас
этого, можно предположить, что в условиях дис
пазы 8. На этом этапе она проявляет низкую ка
тантного сокультивирования с клетками NK 92
талитическую активность с узким диапазоном
в клетках линии Jeg 3 усиливается процесс об
расщепляемых субстратов. Для полной актива
разования синцития, что требует дальнейшего
ции требуется вторая протеолитическая стадия.
исследования. В наших экспериментах по изу
Аутопроцессинг приводит к продуцированию
чению контактного сокультивирования клеток
малой субъединицы p10 и промежуточной p43
линий Jeg 3 и NK 92 уровень прокаспазы 8 и
(DEDs p18), а затем, в результате отщепления
прокаспазы 3 не отличался от контрольных об
эффекторных доменов смерти (DEDs), к высво
разцов, представленных только одной популя
бождению большой субъединицы p18, содержа
цией - клетками линии Jeg 3. Можно предпо
щей активный цистеиновый сайт, обнаруживае
ложить, что клетки NK 92 в результате контакт
БИОХИМИЯ том 84 вып. 10 2019
7*
1468
МИЛЮТИНА и др.
ного взаимодействия с клетками линии Jeg 3
гих каспаз, в частности каспазы 3 [53-55]. Он
стимулируют в них процессы расщепления кас
также способен активировать каспазы через ми
пазы 8, возможно, через активацию рецепторов
тохондриальный путь, стимулируя выброс ци
смерти. В то же время имеются сведения о со
тохрома C и других апоптогенных молекул в ци
держании в клетках Jeg 3 значительного коли
топлазму, активации каспазы 9 и, как следствие
чества мРНК TRAIL R3 - рецептора, не имею
этого активации каспазы 3 [56]. При этом само
щего функциональных доменов смерти и
наличие признаков апоптоза в клетках трофо
действующего как «приманка» [45], а также ре
бласта в присутствии NK клеток требует более
зистентности к TRAIL клеток хорионкарцино
детального исследования, так как трофобласт
мы [46]. Поэтому данные процессы требуют
имеет систему защиты от NK клеток в виде
дальнейшего изучения.
экспрессии HLA G и HLA E [57], а также
Каждая ступень апоптотического каскада в
экспрессирует лиганды рецепторов смерти как
трофобласте жестко контролируется эндоген
на поверхности, так и в растворимой форме [1].
ными ингибиторами, некоторые из которых
Безусловно, необходимо учитывать, что в дан
имеют значительную структурную гомологию с
ной модели in vitro использовалась клеточная
каспазой 8, что позволяет им блокировать ее ак
линия NK 92, по своим характеристикам нес
тивацию и предотвращать рецептор зависимый
колько отличная от pNK или dNK.
апоптоз [1]. Ряд исследователей полагает, что
Однако мы опирались как на проведенные
обнаружение с помощью иммуноблота расщеп
нами исследования NK клеток периферической
ления прокаспазы не означает, что рассматрива
крови [58], так и на данные других исследовате
емая каспаза активирована [47]. Они подчерки
лей [59], свидетельствующие о возможности
вают, что абсолютным требованием активации
экстраполяции такого рода сведений на маточ
каспазы является ее димеризация и расщепле
ные NK клетки, исходя из того, что клетки ли
ние в отсутствии димеризации не приводит к ее
нии NK 92 соответствуют основным фенотипи
активации [47-49]. Именно поэтому при изуче
ческим и функциональным характеристикам
нии активности каспазы 8 методом иммуноблот
NK клеток человека.
тинга, помимо оценки наличия расщепленного
Возможно, реализация цитотоксического
фрагмента p18, исследуют также активацию эф
ответа клеток NK 92 в отношении клеток тро
фекторной каспазы 3. Целесообразно также оп
фобласта может быть связана с недостаточ
ределять ферментативную активность с исполь
ностью ингибирующего сигнала со стороны
зованием специфических субстратов [50]. Одна
клеток Jeg 3. Отмечено, что NK 92 практически
ко перекрестная активность каспазы 8 и гран
не экспрессируют на своей поверхности рецеп
зима B в отношении большинства применяемых
торы семейства KIR [60]. Однако в клетках NK 92
субстратов, содержащих последовательность
установлена незначительная экспрессия KIR2DL4
Ile Glu Thr Asp, не позволило провести данный
и ILT 2/CD85, непосредственно распознающих
анализ в нашем исследовании. Кроме того, по
HLA G трофобласта, их экспрессия увеличива
казано, что в трофобласте осуществляются ме
ется при сокультивировании с клетками тро
ханизмы инактивации пути апоптоза уже после
фобласта линии BeWo [4]. Клетками NK 92 ак
активации каспазы 8 [51]. В то же время рас
тивно экспрессируются ингибирующие рецеп
щепление каспазы 3 в клетках Jeg 3, которое мы
торы NKG2A и NRG2B, лигандом которых слу
наблюдали после их контактного сокультивиро
жит HLA E [60]. Поэтому, несмотря на то что
вания с клетками NK 92, является признаком
клетки NK 92 считают популяцией клеток с по
необратимого развития апоптотического про
вышенной цитотоксической активностью, со
цесса. Данный факт может поставить под сом
держащих высокий уровень цитотоксических
нение предположение о том, что в нашем экспе
белков, трофобласт имеет различные пути реа
рименте по контактному сокультивированию
лизации своей ингибирующей функции в отно
реализуется механизм инактивации апоптоза
шении данных клеток.
клетками трофобласта. Активация каспазы 3
Изменений в содержании цитотоксических
может быть связана не только с воздействием
белков в клетках NK 92 при их дистантном со
каспазы 8, а также быть следствием других со
культивировании с клетками Jeg 3 не выявлено.
бытий, в частности, она может быть напрямую
Показано, что изменения в спектре секреции
активирована белками литических гранул, пос
цитокинов dNK клетками происходят только
тупающих из NK клеток в результате образова
при их контактном (но не дистантном) сокуль
ния иммунологического синапса [52]. Как отме
тивировании с клетками трофобласта [61]. Было
чалось выше, субстратная специфичность гран
продемонстрировано накопление гранулизина
зима B совпадает с каспазой 8, вследствие чего
dNK клеток в клетках EVT, являющихся наибо
он может расщеплять зимогенные формы дру
лее инвазивными клетками эмбрионального
БИОХИМИЯ том 84 вып. 10 2019
КАСПАЗЫ ТРОФОБЛАСТА ПРИ ВЗАИМОДЕЙСТВИИ С КЛЕТКАМИ NK 92
1469
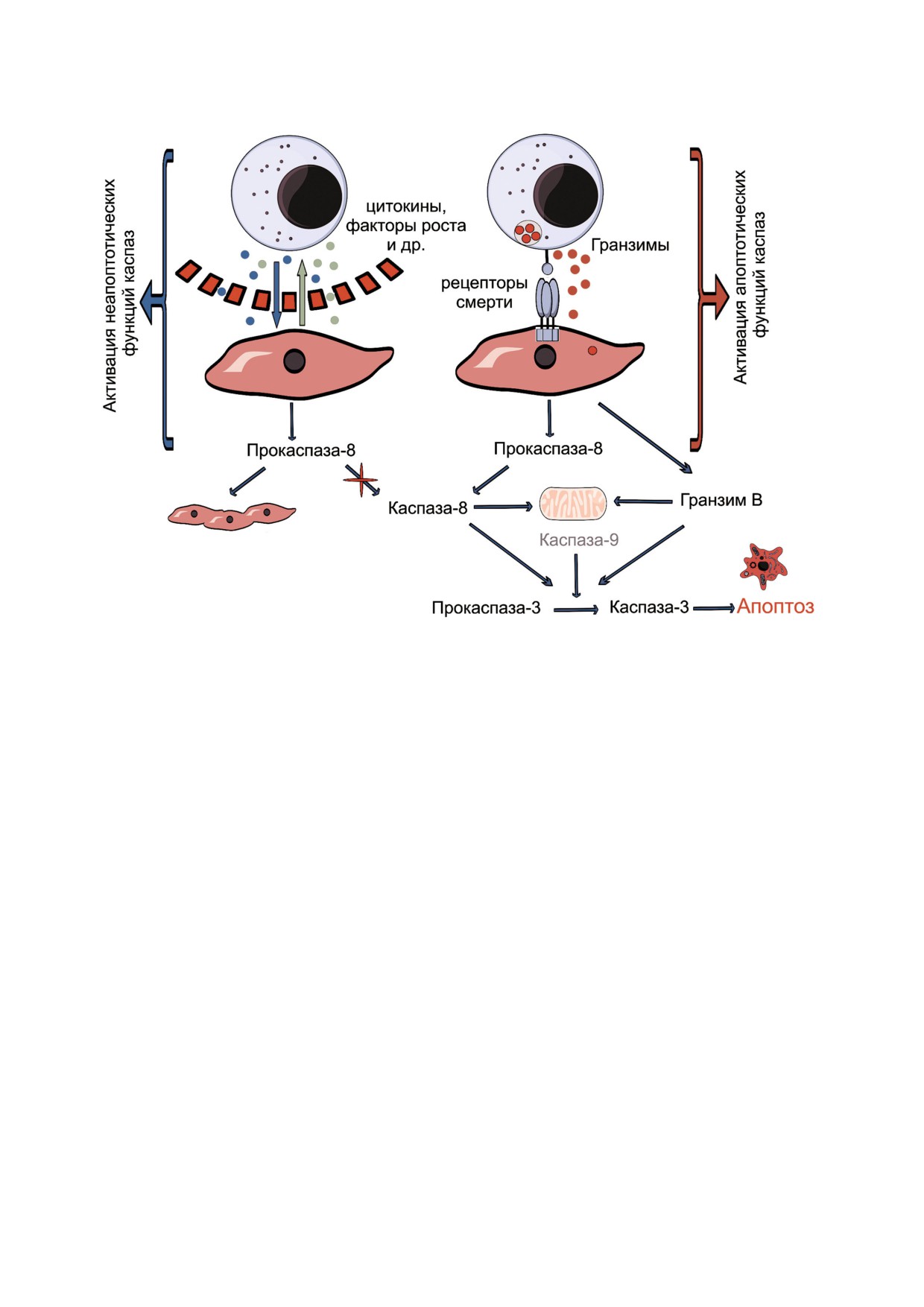
Рис. 5. Предполагаемая схема активации каспаз в клетках линии Jeg 3 после их взаимодействии с клетками линии NK 92
в системе in vitro в условиях наличия либо отсутствия их непосредственного контакта.
biokhsm/
происхождения, после их контактного сокуль
тивацией каспаз и может стать причиной гибели
тивирования, и как следствие, активация в клет
трофобласта. Характер изменения уровня ис
ках EVT процессов апоптоза [52]. Важную роль
следованных каспазы 8 и каспазы 3 в условиях
межклеточных контактов (не только раствори
отсутствия непосредственного контакта между
мых факторов) в функционировании трофо
клетками данных популяций позволяет выдви
бласта отмечали также и в других работах [62].
нуть предположение о возможном усилении
Полученные нами данные подтверждают значе
процессов, связанных с образованием синцития
ние контактного взаимодействия клеток тро
клетками линии Jeg 3.
фобласта и NK клеток.
Результаты взаимодействия клеток линий
NK 92 и Jeg 3 при наличии либо отсутствии не
Финансирование. Выполнено при финансо
посредственного контакта между ними, а также
вой поддержке НШ 2873.2018.7 и Госзадания
предполагаемые механизмы активации каспаз в
АААА А19 119021290116 1.
клетках трофобласта Jeg 3 при этом представле
Конфликт интересов. Авторы заявляют об от
ны на рис. 5. Приведенные результаты свиде
сутствии конфликта интересов.
тельствуют о том, что именно контактное со
Соблюдение этических норм. Настоящая
культивирование клеток линий Jeg 3 и NK 92 in
статья не содержит описания каких либо иссле
vitro характеризуется секрецией гранзима B
дований с использованием людей или животных
клетками линии NK 92, что сопровождается ак
в качестве объектов.
БИОХИМИЯ том 84 вып. 10 2019
1470
МИЛЮТИНА и др.
СПИСОК ЛИТЕРАТУРЫ
1.
Straszewski Chavez, S.L., Abrahams, V.M., and Mor, G.
15.
Langhans, B., Ahrendt, M., Nattermann, J., Sauerbruch,
(2005) The role of apoptosis in the regulation of tro
T., and Spengler, U. (2005) Comparative study of NK cell
phoblast survival and differentiation during pregnancy,
mediated cytotoxicity using radioactive and flow cytomet
Endocr. Rev., 26, 877-897, doi: 10.1210/er.2005 0003.
ric cytotoxicity assays, J. Immunol. Methods, 306, 161-168,
2.
Romanski, A., Uherek, C., Bug, G., Seifried, E.,
doi: 10.1016/j.jim.2005.08.010.
Klingemann, H., Wels, W.S., Ottmann, O.G., and Tonn, T.
16.
Shalini, S., Dorstyn, L., Dawar, S., and Kumar, S. (2015)
(2016) CD19 CAR engineered NK 92 cells are sufficient
Old, new and emerging functions of caspases, Cell Death
to overcome NK cell resistance in B cell malignancies,
Differ., 22, 526-539, doi: 10.1038/cdd.2014.216.
J. Cell. Mol. Med., 20, 1287-1294, doi: 10.1111/jcmm.12810.
17.
Jingting, C., Yangde, Z., Yi, Z., Huining, L., Rong, Y., and
3.
Crespo, A.C., Strominger, J.L., and Tilburgs, T. (2016)
Yu, Z. (2007) Heparanase expression correlates with
Expression of KIR2DS1 by decidual natural killer cells
metastatic capability in human choriocarcinoma, Gynecol.
increases their ability to control placental HCMV infec
Oncol., 107, 22-29, doi: 10.1016/j.ygyno.2007.05.042.
tion, Proc. Natl. Acad. Sci. USA, 113, 15072-15077,
18.
Kohler, P.O., and Bridson, W.E. (1971) Isolation of hor
doi: 10.1073/pnas.1617927114.
mone producing clonal lines of human choriocarcinoma,
4.
Liu, Y., Zhang, L., Gao, M., Zhang, F., Xu, X., Liu, X.,
J. Clin. Endocrinol. Metab., 32, 683-687, doi: 10.1210/
and Hu, X. (2013) Changes of inhibitory receptors on NK 92
jcem 32 5 683.
cells and HLA G on BeWo cells with Toxoplasma gondii
19.
Gong, J.H., Maki, G., and Klingemann, H.G. (1994)
infection, Inflammation, 36, 1440-1447, doi: 10.1007/
Characterization of a human cell line (NK 92) with phe
s10753 013 9684 1.
notypical and functional characteristics of activated natural
5.
Matson, B.C., and Caron, K.M. (2014) Uterine natural
killer cells, Leukemia, 8, 652-658.
killer cells as modulators of the maternal fetal vasculature,
20.
Komatsu, F., and Kajiwara, M. (1998) Relation of natural
Int. J. Dev. Biol., 58, 199-204, doi: 10.1387/ijdb.140032kc.
killer cell line NK 92 mediated cytolysis (NK 92 lysis)
6.
Manaster, I., and Mandelboim, O. (2010) The unique
with the surface markers of major histocompatibility com
properties of uterine NK cells, Am. J. Reprod. Immunol.,
plex class I antigens, adhesion molecules, and Fas of target
63, 434-444, doi: 10.1111/j.1600 0897.2009.00794.x.
cells, Oncol. Res., 10, 483-489.
7.
Vacca, P., Pietra, G., Falco, M., Romeo, E., Bottino, C.,
21.
Coulomb L’Hermine, A., Larousserie, F., Pflanz, S.,
Bellora, F., Prefumo, F., Fulcheri, E., Venturini, P.L.,
Bardel, E., Kastelein, R.A., and Devergne, O.
(2007)
Costa, M., Moretta, A., Moretta, L., and Mingari, M.C.
Expression of interleukin 27 by human trophoblast cells,
(2006) Analysis of natural killer cells isolated from human
Placenta,
28,
1133-1140, doi:
10.1016/j.placenta.
decidua: Evidence that 2B4 (CD244) functions as an
2007.06.004.
inhibitory receptor and blocks NK cell function, Blood,
22.
Bradford, M.M. (1976) A rapid and sensitive method for
108, 4078-4085, doi: 10.1182/blood 2006 04 017343.
the quantitation of microgram quantities of protein utilizing
8.
Koopman, L.A., Kopcow, H.D., Rybalov, B., Boyson, J.E.,
the principle of protein dye binding, Anal. Biochem., 72,
Orange, J.S., Schatz, F., Masch, R., Lockwood, C.J.,
248-254.
Schachter, A.D., Park, P.J., and Strominger, J.L. (2003)
23.
Hedlund, M., Stenqvist, A.C., Nagaeva, O., Kjellberg, L.,
Human decidual natural killer cells are a unique NK cell
Wulff, M., Baranov, V., and Mincheva Nilsson, L. (2009)
subset with immunomodulatory potential, J. Exp. Med.,
Human placenta expresses and secretes NKG2D ligands
198, 1201-1212, doi: 10.1084/jem.20030305.
via exosomes that down modulate the cognate receptor
9.
King, A., Wooding, P., Gardner, L., and Loke, Y.W. (1993)
expression: evidence for immunosuppressive function,
Expression of perforin, granzyme A and TIA 1 by human
J. Immunol., 183, 340-351, doi: 10.4049/jimmunol.
uterine CD56+ NK cells implies they are activated and
0803477.
capable of effector functions, Hum. Reprod., 8, 2061-2067,
24.
Lokossou, A.G., Toudic, C., and Barbeau, B. (2014)
doi: 10.1093/oxfordjournals.humrep.a137982.
Implication of human endogenous retrovirus envelope pro
10.
Lash, G.E., Robson, S.C., and Bulmer, J.N.
(2010)
teins in placental functions, Viruses, 6, 4609-4627,
Review: functional role of uterine natural killer (uNK) cells
doi: 10.3390/v6114609.
in human early pregnancy decidua, Placenta, 31 Suppl.,
25.
Hakam, M.S., Miranda Sayago, J.M., Hayrabedyan, S.,
87-92, doi: 10.1016/j.placenta.2009.12.022.
Todorova, K., Spencer, P.S., Jabeen, A., Barnea, E.R., and
11.
Ivanisevic, M., Segerer, S., Rieger, L., Kapp, M., Dietl, J.,
Fernandez, N. (2017) Preimplantation factor (PIF) pro
Kammerer, U., and Frambach, T. (2010) Antigen present
motes HLA G, E, F, C expression in JEG 3 choriocar
ing cells in pregnant and non pregnant human myometri
cinoma cells and endogenous progesterone activity, Cell.
um, Am. J. Reprod. Immunol., 64, 188-196, doi: 10.1111/
Physiol. Biochem.,
43,
2277-2296, doi:
10.1159/
j.1600 0897.2010.00858.x.
000484378.
12.
Kopcow, H.D., Allan, D.S., Chen, X., Rybalov, B.,
26.
Hanna, N., Hanna, I., Hleb, M., Wagner, E., Dougherty,
Andzelm, M.M., Ge, B., and Strominger, J.L. (2005)
J., Balkundi, D., Padbury, J., and Sharma, S.
(2000)
Human decidual NK cells form immature activating
Gestational age dependent expression of IL 10 and its
synapses and are not cytotoxic, Proc. Natl. Acad. Sci. USA,
receptor in human placental tissues and isolated cytotro
102, 15563-15568, doi: 10.1073/pnas.0507835102.
phoblasts, J. Immunol., 164, 5721-5728.
13.
Redzovic, A., Laskarin, G., Dominovic, M., Haller, H.,
27.
Knofler, M., and Pollheimer, J. (2012) IFPA Award in pla
and Rukavina, D. (2013) Mucins help to avoid alloreactiv
centology lecture: molecular regulation of human tro
ity at the maternal fetal interface, Clin. Dev. Immunol.,
phoblast invasion, Placenta, 33, 55-62, doi: 10.1016/j.pla
2013, 542152, doi: 10.1155/2013/542152.
centa.2011.09.019.
14.
Sun, J., Yang, M., Ban, Y., Gao, W., Song, B., Wang, Y.,
28.
Rousalova, I., and Krepela, E. (2010) Granzyme B
Zhang, Y., Shao, Q., Kong, B., and Qu, X. (2016) Tim 3 is
induced apoptosis in cancer cells and its regulation
upregulated in NK cells during early pregnancy and
(review), Int. J. Oncol., 37, 1361-1378.
inhibits NK cytotoxicity toward trophoblast in galectin 9
29.
Thiery, J., Keefe, D., Saffarian, S., Martinvalet, D., Walch, M.,
dependent pathway, PLoS One, 11, e0147186, doi: 10.
Boucrot, E., Kirchhausen, T., and Lieberman, J. (2010)
1371/journal.pone.0147186.
Perforin activates clathrin and dynamin dependent endo
БИОХИМИЯ том 84 вып. 10 2019
КАСПАЗЫ ТРОФОБЛАСТА ПРИ ВЗАИМОДЕЙСТВИИ С КЛЕТКАМИ NK 92
1471
cytosis, which is required for plasma membrane repair and
caspases in primary cultures of term human trophoblasts,
delivery of granzyme B for granzyme mediated apoptosis,
Pediatr. Res., 52, 411-415, doi: 10.1203/00006450
Blood, 115, 1582-1593, doi: 10.1182/blood 2009 10
200209000 00018.
246116.
47.
van Raam, B.J., and Salvesen, G.S. (2012) Proliferative
30.
Thiery, J., Keefe, D., Boulant, S., Boucrot, E., Walch, M.,
versus apoptotic functions of caspase 8 Hetero or homo:
Martinvalet, D., Goping, I.S., Bleackley, R.C.,
the caspase 8 dimer controls cell fate, Biochim. Biophys.
Kirchhausen, T., and Lieberman, J. (2011) Perforin pores
Acta, 1824, 113-122, doi: 10.1016/j.bbapap.2011.06.005.
in the endosomal membrane trigger the release of endocy
48.
Keller, N., Grutter, M.G., and Zerbe, O. (2010) Studies of
tosed granzyme B into the cytosol of target cells, Nat.
the molecular mechanism of caspase 8 activation by solu
Immunol., 12, 770-777, doi: 10.1038/ni.2050.
tion NMR, Cell Death Differ., 17, 710-718, doi: 10.
31.
Lieberman, J. (2003) The ABCs of granule mediated cyto
1038/cdd.2009.155.
toxicity: new weapons in the arsenal, Nat. Rev. Immunol.,
49.
Pop, C., Fitzgerald, P., Green, D.R., and Salvesen, G.S.
3, 361-370 doi: 10.1038/nri1083.
(2007) Role of proteolysis in caspase 8 activation and sta
32.
Orange, J.S., and Ballas, Z.K. (2006) Natural killer cells in
bilization, Biochemistry, 46, 4398-4407, doi: 10.1021/
human health and disease, Clin. Immunol., 118, 1-10,
bi602623b.
doi: 10.1016/j.clim.2005.10.011.
50.
Carrillo, I., Droguett, D., Castillo, C., Liempi, A., Munoz,
33.
Hazeldine, J., and Lord, J.M. (2013) The impact of ageing
L., Maya, J.D., Galanti, N., and Kemmerling, U. (2016)
on natural killer cell function and potential consequences
Caspase 8 activity is part of the BeWo trophoblast cell
for health in older adults, Ageing Res. Rev., 12, 1069-1078,
defense mechanisms against Trypanosoma cruzi infection,
doi: 10.1016/j.arr.2013.04.003.
Exp. Parasitol.,
168,
9-15, doi:
10.1016/j.exppara.
34.
Hammer, A., and Dohr, G. (2000) Expression of Fas lig
2016.06.008.
and in first trimester and term human placental villi, J. Re&
51.
Barnhart, B.C., and Peter, M.E. (2002) Two faces of cas
prod. Immunol., 46, 83-90.
pase 8, Nat. Immunol., 3, 896-898, doi: 10.1038/ni1002
35.
Salvesen, G.S., and Walsh, C.M. (2014) Functions of cas
896.
pase 8: the identified and the mysterious, Semin. Immunol.,
52.
Nakashima, A., Shiozaki, A., Myojo, S., Ito, M.,
26, 246-252, doi: 10.1016/j.smim.2014.03.005.
Tatematsu, M., Sakai, M., Takamori, Y., Ogawa, K.,
36.
Feltham, R., Vince, J.E., and Lawlor, K.E.
(2017)
Nagata, K., and Saito, S. (2008) Granulysin produced by
Caspase 8: not so silently deadly, Clin. Transl. Immunol., 6,
uterine natural killer cells induces apoptosis of extravillous
e124, doi: 10.1038/cti.2016.83.
trophoblasts in spontaneous abortion, Am. J. Pathol., 173,
37.
Cursi, S., Rufini, A., Stagni, V., Condo, I., Matafora, V.,
653-664, doi: 10.2353/ajpath.2008.071169.
Bachi, A., Bonifazi, A.P., Coppola, L., Superti Furga, G.,
53.
Sweeney, E.A., Inokuchi, J., and Igarashi, Y.
(1998)
Testi, R., and Barila, D. (2006) Src kinase phosphorylates
Inhibition of sphingolipid induced apoptosis by caspase
Caspase 8 on Tyr380: a novel mechanism of apoptosis sup
inhibitors indicates that sphingosine acts in an earlier part
pression, EMBO J., 25, 1895-1905, doi: 10.1038/sj.emboj.
of the apoptotic pathway than ceramide, FEBS Lett., 425,
7601085.
61-65.
38.
Powley, I.R., Hughes, M.A., Cain, K., and MacFarlane,
54.
Estebanez Perpina, E., Fuentes Prior, P., Belorgey, D.,
M.
(2016) Caspase 8 tyrosine 380 phosphorylation
Braun, M., Kiefersauer, R., Maskos, K., Huber, R., Rubin,
inhibits CD95 DISC function by preventing procaspase 8
H., and Bode, W. (2000) Crystal structure of the caspase
maturation and cycling within the complex, Oncogene, 35,
activator human granzyme B, a proteinase highly specific
5629-5640, doi: 10.1038/onc.2016.99.
for an Asp P1 residue, Biol. Chem., 381, 1203-1214,
39.
Cohen, G.M. (1997) Caspases: the executioners of apopto
doi: 10.1515/BC.2000.148.
sis, Biochem. J., 326 (Pt 1), 1-16.
55.
Watt, W., Koeplinger, K.A., Mildner, A.M., Heinrikson,
40.
Gauster, M., and Huppertz, B. (2010) The paradox of cas
R.L., Tomasselli, A.G., and Watenpaugh, K.D. (1999) The
pase 8 in human villous trophoblast fusion, Placenta, 31,
atomic resolution structure of human caspase 8, a key
82-88, doi: 10.1016/j.placenta.2009.12.007.
activator of apoptosis, Structure, 7, 1135-1143.
41.
Adler, R.R., Ng, A.K., and Rote, N.S. (1995) Monoclonal
56.
Afonina, I.S., Cullen, S.P., and Martin, S.J.
(2010)
antiphosphatidylserine antibody inhibits intercellular
Cytotoxic and non cytotoxic roles of the CTL/NK pro
fusion of the choriocarcinoma line, JAR, Biol. Reprod., 53,
tease granzyme B, Immunol. Rev., 235, 105-116, doi: 10.
905-910, doi: 10.1095/biolreprod53.4.905.
1111/j.0105 2896.2010.00908.x.
42.
Wei, B.R., Xu, C., and Rote, N.S. (2012) Increased resis
57.
Morandi, F., and Pistoia, V. (2014) Interactions between
tance to apoptosis during differentiation and syncytializa
HLA G and HLA E in physiological and pathological
tion of BeWo choriocarcinoma cells, Adv. Biosci.
conditions, Front. Immunol., 5, 394, doi: 10.3389/fimmu.
Biotechnol., 3, 805-813, doi: 10.4236/abb.2012.326100.
2014.00394.
43.
Borges, M., Bose, P., Frank, H.G., Kaufmann, P., and
58.
Mikhailova, V.A., Bazhenov, D.O., Viazmina, L.P.,
Potgens, A.J. (2003) A two colour fluorescence assay for
Agnaeva, A.O., Bespalova, O.N., Sel’kov, S.A., and
the measurement of syncytial fusion between trophoblast
Sokolov, D.I. (2019) Cytotoxic activity of peripheral blood
derived cell lines, Placenta, 24, 959-964, doi: 10.1016/
NK cells towards trophoblast cells during pregnancy, Bull.
S0143 4004(03)00173 5.
Exp. Biol. Med., 166, 567-573, doi: 10.1007/s10517 019
44.
Al Nasiry, S., Spitz, B., Hanssens, M., Luyten, C., and
04393 4.
Pijnenborg, R. (2006) Differential effects of inducers of
59.
Park, D.W., Lee, H.J., Park, C.W., Hong, S.R., Kwak
syncytialization and apoptosis on BeWo and JEG 3 chorio
Kim, J., and Yang, K.M. (2010) Peripheral blood NK cells
carcinoma cells, Hum. Reprod., 21, 193-201, doi: 10.
reflect changes in decidual NK cells in women with recur
1093/humrep/dei272.
rent miscarriages, Am. J. Reprod. Immunol., 63, 173-180,
45.
Phillips, T.A., Ni, J., Pan, G., Ruben, S.M., Wei, Y.F.,
doi: 10.1111/j.1600 0897.2009.00777.x.
Pace, J.L., and Hunt, J.S. (1999) TRAIL (Apo 2L) and
60.
Maki, G., Klingemann, H.G., Martinson, J.A., and Tam,
TRAIL receptors in human placentas: implications for
Y.K. (2001) Factors regulating the cytotoxic activity of the
immune privilege, J. Immunol., 162, 6053-6059.
human natural killer cell line, NK 92, J. Hematother. Stem.
46.
Yusuf, K., Smith, S.D., Sadovsky, Y., and Nelson, D.M.
Cell. Res., 10, 369-383, doi: 10.1089/15258160175028
(2002) Trophoblast differentiation modulates the activity of
8975.
БИОХИМИЯ том 84 вып. 10 2019
1472
МИЛЮТИНА и др.
61. Lash, G.E., Naruse, K., Robson, A., Innes, B.A., Searle,
62. Zhang, Y., Qu, D., Sun, J., Zhao, L., Wang, Q., Shao, Q.,
R.F., Robson, S.C., and Bulmer, J.N. (2011) Interaction
Kong, B., Zhang, Y., and Qu, X. (2016) Human tro
between uterine natural killer cells and extravillous tro
phoblast cells induced MDSCs from peripheral blood
phoblast cells: effect on cytokine and angiogenic growth
CD14(+) myelomonocytic cells via elevated levels of
factor production, Hum. Reprod., 26, 2289-2295, doi: 10.
CCL2, Cell. Mol. Immunol., 13, 615-627, doi:
10.
1093/humrep/der198.
1038/cmi.2015.41.
INDUCTION OF CASPASE CASCADE IN TROPHOBLAST
CELLS OF Jeg 3 LINE IN DIFFERENT MODELS
OF THEIR CO CULTIVATION WITH NK 92 CELLS
Yu. P. Milyutina*, V. A. Mikhailova, K. M. Pyatygina, E. S. Demidova,
D. A. Malygina, T. E. Tertychnaia, A. V. Arutjunyan,
D. I. Sokolov, and S. A. Selkov
Ott Institute of Obstetrics, Gynecology, and Reproductology,
199034 St. Petersburg, Russia; E&mail: milyutina1010@mail.ru
Received April 17, 2019
Revised June 18, 2019
Accepted June 22, 2019
Study of the interaction of natural killers (NK) with trophoblast cells and identification of the conditions favoring the
NK cells cytotoxicity is of fundamental and applied importance for understanding their role in pathologies and com
plications during pregnancy. In the present work, changes in the content and activation of caspases in the Jeg 3 tro
phoblast cells in various models of their co cultivation with NK 92 cells were examined. The necessity of the direct
contact between cells of these two populations for activation of caspase 8 and caspase 3 in trophoblast cells has been
shown. Under direct contact conditions, the cytotoxic granzyme B was found in the Jeg 3 cells, accompanied by a
decrease in its amount in the NK 92 cells. Distant co cultivation of the NK 92 and Jeg 3 cells is not accompanied by
the activation of the initiatory and effector caspases, characteristic of apoptosis, in the Jeg 3 cells. At that, a decrease
in the content of studied pro caspases in the trophoblast cells may be due to the realization of their alternative non
apoptotic functions.
Keywords: caspases, granzyme B, trophoblast, natural killers, apoptosis
БИОХИМИЯ том 84 вып. 10 2019