БИОХИМИЯ, 2019, том 84, вып. 10, с. 1481 - 1499
УДК 577.29
АНАЛИЗ РЕГУЛЯЦИИ БЕЛКА В ОГУРЕЧНЫХ ЛИСТЬЯХ
ПОСЛЕ ИНОКУЛЯЦИИ РАСТЕНИЙ Corynespora cassiicola:
ПРОТЕОМНЫЙ ПОДХОД*
© 2019 G. Yu1#, Y. Yu2#, H. Fan2,3**, D. Zhang2, N. Cui2, X. Wang1, S. Jia2, Y. Yang2, J. Zhao2
1 College of Horticulture, Shenyang Agricultural University, 110866 Shenyang, PR China
2 College of Bioscience and Biotechnology, Shenyang Agricultural University, Shenyang
110866, PR China; E mail: 1997500018@syau.edu.cn
3 Key Laboratory of Protected Horticulture of Ministry of Education, Shenyang Agricultural University, 110866 Shenyang, PR China
Поступила в редакцию 18.12.2018
После доработки 01.05.2019
Принята к публикации 10.06.2019
Мишеневидная пятнистость листьев огурца (CLS), вызываемая патогенным грибком Corynespora cassiicola,
является одним из наиболее широко распространенных болезней, поражающих листья культивируемых
сортов огурцов. Однако до сих пор не выяснены механизмы защиты огуречных растений в ответ на инфи$
цирование патогеном C. cassiicola. В данной работе с помощью протеомной техники iTRAQ (isobaric tags for
relative and absolute quantification) были проанализированы белки из устойчивых к возбудителю растений. Бы$
ло идентифицировано 286 дифференцированно экспрессируемых белков (p < 0,05, соотношение >1,2 или
<0,83) через 6 и 24 ч после инокуляции патогена в устойчивого сорта огурцов Jinyou 38. Полученные данные
доступны на сайте ProteomeXchange (идентификационный номер PXD012903). Выявлены некоторые ран$
ние реакции растений на инфицирование патогеном C. cassiicola и определены четыре значимых положе$
ния, которые могут привести к разгадке механизма возникновения устойчивости Cucumis sativus к CLS. Про$
теомный анализ позволил выявить модуляцию сигнальных путей в клетках устойчивых растений в ответ на
инфицирование C. cassiicola. Установлено, что иммунная система растений распознает патоген и иницииру$
ет экспрессию белков основного иммунного ответа, и в том числе белков, которые входят в системы защи$
ты и ответа на стресс, передачи сигнала, метаболизма клеток и регуляции редокс$состояния клеток. Втор$
жение патогена C. cassiicola вызывает активацию общих путей противодействия этому стрессу. В частности,
происходит активация белков локуса О устойчивости к действию плесени (MLO), играющих ключевую роль
в предотвращении развития CLS. Быстрая активация путей метаболизма углеводов и вторичного метабо$
лизма, модификация и укрепление клеточных стенок и приспособление апоплексической окружающей
среды к условиям высокого стресса крайне необходимы для возникновения устойчивости огурцов к болез$
ни CLS. Полученные результаты способствуют большему пониманию проблемы о несовместимых взаимо$
действиях между растениями и патогенами и позволяют взглянуть по$новому на роль молекулярных про$
цессов в возникновении устойчивости огурцов к болезням.
КЛЮЧЕВЫЕ СЛОВА: огурец, Corynespora cassiicola, iTRAQ, защитные белки, ОТ$ПЦР, гистохимическое окрашивание.
DOI: 10.1134/S0320972519100105
Принятые сокращения: CLS (corynespora leaf spot of cucumber, мишеневидная пятнистость листьев огурца, вызываемая
грибком Corynespora cassiicola); CGMMV (cucumber green mottle mosaic virus, вирус зеленой крапчатой мозаики огурца); PRs (patho
genesis related proteins, белки, ассоциированные с патогенезом); MLP (mlp like protein, белок, сходный с белками mlp); MLO
(белок семейства mlo); nsLTP (non specific lipid transfer protein, белок, участвующий в неспецифическом транспорте липидов);
SUBP (subtilisin like protease, субтилизин$подобная протеаза); ACC (acc oxidase, оксидаза АСС (1$аминоциклопропан$1$
карбоновой кислоты)); OPR1 (12$oxophytodienoate reductase 1, 12$оксофитодиеноатредуктаза 1); PLD (phospholipase D,
фосфолипаза D); S/TPK (serine/threonine protein kinase, серин$треониновая протеинкиназа); DIRP (дирижабль$подобный
белок); PPR (pentatricopeptide repeat containing protein, белок, содержащий пентатрикопептидные повторы); SAR (system acquired
resistance, приобретенная устойчивость системы (растения)); KAT2 (3$ketoacyl thiolase peroxisomal, пероксисомальная 3$кето$
ацилтиолаза); K7R7 (calcium dependent protein kinase 11, кальций$зависимая протеинкиназа 11); KJXO (кальций$зависимая
протеинкиназа 2); KTX6 (calprotectin$3, кальпротектин$3); LPP8 (calcium binding protein, кальций$связывающий белок); LKN6,
ACC (oxidase
6, оксидаза
1$аминоциклопропан$1$карбоновой кислоты
6); KAT2
(3$ketoacyl thiolase peroxisomal,
пероксисомальная 3$кетоацилтиолаза); OPDA (12$oxo phytodienoic acid, 12$оксофитодиеновая кислота); RBOHs (respiratory burst
oxidase homolog protein, белок$гомолог оксидазы дыхательного взрыва); CDPKs (calcium dependent protein kinases, кальций$
зависимые протеинкиназы); ROS (reactive oxygen species, активные формы кислорода); APX (ascorbic acid peroxidase,
аскорбатпероксидаза); SOD (superoxide dismutase, супероксиддисмутаза); CCR1 (cinnamoyl reductase 1, циннамоилредуктаза 1);
DIRP (dirigent like protein 2, дирижабль$подобный белок 2); CAD (cinnamyl alcohol dehydrogenase, дегидрогеназа коричного спирта).
* Приложение к статье на английском языке опубликовано на сайте журнала «Biochemistry» (Moscow) и на сайте
опубликована в вып. 8, 2019 г. журнала «Biochemistry» (Moscow).
** Адресат для корреспонденции.
# Авторы внесли равный вклад в работу.
8
1481
1482
G. YU и др.
Мишеневидная пятнистость листьев (CLS) -
нако не была охарактеризована роль белков, ас$
это болезнь огурцов, возникающая в результа$
социированных с устойчивыми разновидностя$
те их заражения грибком C. сassiicola, которая
ми огурцов во время их взаимодействия с пато$
регистрируется как в Азии, так и Европе. Сейчас
геном C. сassiicola. Поэтому нами был проведен
эту болезнь рассматривают как основное эпиде$
протеомный анализ, чтобы одновременно изу$
миологическое заболевание в регионах, где ши$
чить широкий спектр белковых профилей для
роко культивируются огурцы. В результате по$
выявления молекулярных механизмов, лежащих
ражения растений этим патогеном наблюдается
в основе защиты растений от патогенов.
снижение урожая огурцов на 60-70% [1, 2], в
В данной работе с помощью метода iTRAQ
связи с этим всё больше исследователей обра$
были исследованы листья необработанных и об$
щаются к этой проблеме. Однако есть некото$
работанных огурцов сорта Jinyou 38 через 0, 6 и
рые разногласия по вопросу генетического
24 ч после инокуляции C. cassiicola. В работе так$
контроля устойчивости растений к CLS. Так,
же был использован метод ОТ$ПЦР (qRT$PCR)
были дискуссии насчет того, один доминантный
для изучения динамики экспрессии генов, ко$
или рецессивный ген задействован в осущест$
дирующих белки, ассоциированные с возник$
влении этого контроля. В работе Abul$Hayja et
новением устойчивости к развитию CLS. Целью
al. было показано, что единственный доминант$
работы был анализ изменений экспрессии бел$
ный ген (Cca) делает огурцы сорта Royal sluis
ков или метаболических путей в устойчивом
72502 устойчивыми к CLS [3]. В то же время в
сорте огурцов, а также выявление сети взаимо$
других работах было показано, что одиночные
действий в клетках листьев огурца после иноку$
рецессивные гены cca 1, cca 2 и cca 3 контроли$
ляции растений патогеном C. cassiicola. Полу$
руют устойчивость к CLS [4, 5]. Использование
ченные результаты несут важную информацию,
одиночного гена для установления причины
касающуюся сопряженных с белками молеку$
возникновения устойчивости различных сортов
лярных механизмов, лежащих в основе устойчи$
огурца не привело к эффективному снижению
вости огурцов к мишеневидной пятнистости
потерь при выращивании огурцов. Поэтому
листьев, болезни, вызываемой грибковым пато$
лишь понимание молекулярных механизмов и
геном C. сassiicola.
идентификация молекулярных компонентов,
вовлеченных в защитные реакции устойчивых к
CLS огурцов, могут обеспечить обнадеживаю$
МЕТОДЫ ИССЛЕДОВАНИЯ
щий подход к контролю над этой болезнью рас$
тений.
Растительный материал и его заражение гриб4
Известно, что белки являются конечными
ками. C. sativus L. cv. Jinyou 38 и C. sativus L. cv.
исполнителями большинства биологических
Ludixianfeng являются специальными теплич$
процессов и могут играть жизненно важную
ными сортами гибридных огурцов, они были
роль в установлении взаимоотношений между
определены в нашей лаборатории фенотипичес$
пагогеном и растением. Сравнительная протео$
ки как высокоустойчивые и восприимчивые к
мика является наилучшим подходом к понима$
действию C. cassiicola сорта соответственно
нию процессов белковой динамики и многообе$
(рис. 1). Патоген C. cassiicola был получен из
щающим инструментом для глобального анали$
Центра хранения биологических видов Китай$
за профиля экспрессии белков в условиях стрес$
ской академии сельскохозяйственных наук.
са. В предыдущей работе с использованием про$
Семена огурца вымачивали в воде в течение
теомной техники iTRAQ (isobaric tags for relative
8 ч, далее для стерилизации их поверхность об$
and absolute quantification) нами было показано,
рабатывали 75%$ным спиртом 30 с и 2,5%$ной
что при инфицировании огурцов вирусом зеле$
NaClO 15 мин. После промывки стерильной во$
ной крапчатой мозаики (CGMMV) изменяется
дой (не менее трех раз) стерилизованные семена
уровень экспрессии 38 белков, которые были
высевали в горшки с торфом и вермикулитом в
идентифицированы при изучении процесса раз$
соотношении, равным 1 : 2 (v/v), и выдерживали
вития устойчивых к болезни растений) [6]. 71 диф$
в тепличных условиях (25 °C, 16 ч на свету/8 ч в
ференцированно экспрессируемый белок был
темноте).
идентифицирован при сравнении высоко устой$
Растения на стадии развития 2-3$х листьев
чивых и очень восприимчивых к инфекции сор$
опрыскивали суспензией спор C. сassiicola. Эти
тов огурцов после инокуляции Sphaerotheca fulig
споры были выращены в стерильной воде (ко$
inea. На основании полученных результатов бы$
нечная концентрация спор достигала 105 микро$
ло предположено, что устойчивые линии огур$
конидий на мл). Степень прогрессирования бо$
цов быстрее запускают свои защитные механиз$
лезни CLS & оценивали по тяжести поврежде$
мы, чем подверженные болезни линии [7]. Од$
ний (шрамов) листьев следующим образом: сте
БИОХИМИЯ том 84 вып. 10 2019
СИНТЕЗ БЕЛКОВ В ИНФИЦИРОВАННЫХ C. cassiicola ЛИСТЬЯХ ОГУРЦОВ
1483
пень 0: нет шрамов; степень 1: инфицировано
проводили несколько раз. Далее, чтобы блоки$
менее 1/10 площади листа; степень 3: 1/10-1/4
ровать восстановленные остатки цистеина, до$
площади листа инфицировано; степень
5:
бавляли 100 мкл 0,05 M раствора йодоацетамида
1/4-1/2 площади листа инфицировано; степень 7:
в буфере UA, и образцы инкубировали в темно$
1/2-3/4 площади листа инфицировано; степень 9:
те в течение 20 мин. Фильтры промывали три
более, чем 3/4 площади инфицировано. Индекс
раза по 100 мкл буфера UA и затем дважды по
заболевания = 100 × Σ (число больных листьев
100 мкл буфера DS (50 мМ триэтиламмонийби$
каждого сорта × степень заболевания)/(общее
карбоната, рН 8,5). Затем белковые суспензии
число листьев × 9) [8]. Кроме того, семена устой$
подвергали перевариванию в течение ночи при
чивых огурцов выдерживали при 25 °C после ино$
37 °C с помощью 2 мкг трипсина («Promega») в
куляции C. сassiicola, затем вторые листья, собран$
40 мкл буфера DS, и образующиеся пептиды со$
ные в определенный момент времени (0, 6 и 24 ч),
бирали в виде фильтрата. Содержание пептидов
были разделены на три группы (по три листа на
в образцах определяли по оптической плотнос$
группу). Образцы растительной ткани помещали в
ти при 280 нм с использованием коэффициента
жидкий азот и далее их хранили при -80 °C.
экстинкции, равного 1,1 для 0,1%$ного (г/л)
Выделение белков. Замороженные образцы
раствора. Это значение было получено на осно$
мелко измельчали и проводили экстракцию, об$
ве частоты нахождения остатков триптофана и
рабатывая осадок 10%$ным (в/о) раствором
тирозина в белках позвоночных.
трихлоруксусной кислоты, содержащим 65 мМ
Для проведения мечения каждый реагент
дитиотрейтола (DTT) при -20 °C в течение 1 ч.
iTRAQ растворяли в 70 мкл этанола и добавляли
После экстракции раствор центрифугировали
в соответствующую пептидную смесь. Образцы
при 10 000 g 45 мин. Супернатант удаляли, оса$
были обозначены следующим образом: (обра$
док высушивали в вакууме и солюбилизировали
зец 1)$113, (образец 2)$114, (образец 3)$115, (об$
в объемном соотношении 1/10 в буфере SDT
разец 4)$116, (образец 5)$117, (образец 6)$118,
(4%$ный SDS, 100 мМ DTT и 150 мМ Тris$HCl,
(образец 7)$119, (образец 8)$121, и были мультип$
pH 8,0). После инкубации в течение 3 мин в ки$
лексированы и высушены в вакууме.
пящей воде суспензии подвергали ультразвуко$
Сильная катионообменная хроматография
вому озвучиванию (80 Ватт, 10 обработок ульт$
(SCX). Меченые iTRAQ пептиды разделяли с
развуком продолжительностью 10 с каждая и пе$
помощью SCX$хроматографии с использовани$
рерывом между каждым озвучиванием в течение
ем системы AKTA Purifier («GE Healthcare»).
15 с) и затем инкубировали 3 мин. Полученный
Высушенную смесь пептидов растворяли и под$
грубый экстракт осветляли с помощью центри$
кисляли в 2 мл буфера A (10 мМ KH2PO4 в 25%$ном
фугирования при 13 000 g 10 мин. Концентра$
ацетонитриле, pH 2,7) и наносили на колонку
цию белка определяли с использованием набора
PolySULFOETHYL (4,6 × 100 мм) (5 мкм, 200 A),
BCA Protein Assay Reagent («Promega», США) [9,
(«PolyLC Inc.», США). Пептиды элюировали
10]. Образцы белков, полученные из необрабо$
при скорости потока
1 мл/мин. Сначала
танных листьев и листьев через 6 и 24 ч после
0-10%$ным градиентом буфера B (500 мМ KCl,
инфицирования C. сassiicola, замораживали. Для
10 мМ KH2PO4 в 25%$ном ацетонитриле, pH 2,7)
проведения сравнительного протеомного ана$
в течение 2 мин, затем 10-20%$ным градиентом
лиза с помощью метода iTRAQ использовали
буфера B в течение 25 мин, 20-45%$ным гради$
образцы, каждый из которых содержал по
ентом буфера B в течение 5 мин и 50-100%$ным
300 мкг общего белка.
градиентом буфера B в течение 5 мин. Монито$
Мечение iTRAQ. Анализ iTRAQ проводили в
ринг процесса элюции производили на основе
компании
«Shanghai Hoogen Biotechnology
регистрации оптической плотности при 214 нм.
Company». Переваривание белков осуществляли
Фракции отбирали каждую минуту. Собранные
согласно процедуре FASP: полученную смесь
фракции (всего ~30 фракций) объединяли в 10 объ$
пептидов метили с помощью реагента 4$plex/8$
единенных фракций и их обессоливали с ис$
plex iTRAQ в соответствии с инструкциями про$
пользованием картриджей C18. Каждую фрак$
изводителя («Applied Biosystems») [11]. 300 мкг
цию концентрировали путем центрифугирова$
белка каждого образца помещали в 30 мкл буфе$
ния в условиях вакуума и растворяли в 40 мкл
ра STD (4%$ный SDS, 100 мМ DTT, 150 мМ Тris$
0,1%$ной трифторуксусной кислоты. До прове$
HCl, pH 8,0). Удаление детергента, дитиотрейто$
дения анализа LC$MS/MS все образцы хранили
ла и других низкомолекулярных компонентов
при -80 °C.
осуществляли с помощью метода ультрафильт$
Тандемная масс4спектрометрия в сочетании с
рации (камеры фирмы «Microcon», 30 кД) с ис$
нанопоточной высокоэффективной жидкостной
пользованием буфера UA (8 M мочевина, 150 мМ
хроматографией (LC4MS/MS). Эксперименты
Тris$HCl, pH 8,0). Процедуру ультрафильтрации
были выполнены на масс$спектрометре
БИОХИМИЯ том 84 вып. 10 2019
8*
1484
G. YU и др.
Q Exactive, сопряженным с хроматографом Easy
картированы в соответствии с правилами Онто$
nLC (ранее
«Proxeon Biosystems», теперь
логии генов (GO - Gene Ontology), включая такие
«Thermo Fisher Scientific»). Для проведения тан$
параметры как биологический процесс, клеточ$
демной масс$спектрометрии в сочетании с на$
ный компонент и молекулярная функция, с ис$
нопоточной высокоэффективной жидкостной
пользованием программы BLAST против рефе$
хроматографией (nanoLC$MS/MS) из каждой
ренсной базы данных, загруженной с вебсайта
фракции отбирали образцы по десять микро$
(GO$Annotation@EBI) [12, 13]. Анализ метабо$
литров каждый. Пептидную смесь (5 мкг) нано$
лических путей дифференцированно экспрес$
сили на колонку C18 с обратной фазой (длина -
сируемых белков выполняли с помощью базы
15 см, внутренний диаметр - 5 мкм) с упакован$
данных метаболических путей KEGG (Kyoto
ной смолой RP$C18 (5 мкм) в буфере A (0,1%$ная
Encyclopedia of Genes and Genomes) (http://
муравьиная кислота), и разделение пептидов
достигалось при линейном градиенте буфера
Схема эксперимента и статистическая обра4
(80%$ный ацетонитрил и 0,1%$ная муравьиная
ботка данных. Все эксперименты повторяли три
кислота) при скорости потока 250 нл/мин,
раза. В качестве контроля проводили два биоло$
контролируемой технологией IntelliFlow более
гических параллельных измерения (0 ч - 1, 0 ч - 2).
140 мин. Данные масс$спектрометрии получали
В остальных случаях измерения проводили
с помощью метода отбора 10 лучших данных
трижды. Все данные представлены в виде ста$
(data dependent top 10 method), при котором наи$
тистических анализов, проведенных с использо$
более многочисленные предшествующие ионы
ванием критерия Стьюдента. Белки (значения
были динамически отобраны из обзорного ска$
p < 0,05, соотношение > 1,2 или <0,83) рассмат$
нирования (300-1800 m/z) для фрагментации
ривали как значимые и дифференцированно
HCD (higher energy collisional dissociation). Опре$
экспрессированные. Анализ контроля ожидае$
деление целевого значения было основано на
мой доли ложных отклонений гипотез (FDR)
принципе предсказываемого автоматического
проводили с использованием метода Бенджами$
регулирования усиления (pAGC - p redictive
ми-Хохберга по коррекции значений p (см. При$
automatic gain control). Продолжительность дина$
ложение, Table S1). Значения p и соотношений
мического исключения была равна 60 с. Обзор$
оценивали с помощью Excel 2007.
ные сканирования получали при разрешении
Количественная ПЦР с обратной транскрип4
70 000 при m/z 200, и разрешение спектров HCD
цией (ОТ4ПЦР, qRT4PCR). Препараты общей
было установлено равным 17 500 при m/z 200.
РНК из листьев обработанных и контрольных
Нормализованная энергия столкновений была
растений получали с использованием набора
равна 30 эВ, и незаполненное соотношение, ко$
RNAprep Pure Plant Kit. ~2,0 мкг общей РНК ис$
торое определяет минимальный процент целе$
пользовали для синтеза кДНК первой цепи с ис$
вого значения, которое желательно достичь во
пользованием набора TIANscript RT Kit в соот$
время максимального заполнения, было уста$
ветствии с инструкциями производителя. Белок$
новлено как 0,1%. Прибор работал с включен$
кодирующие последовательности были взяты из
ным режимом распознавания пептидов.
NCBI (National сenter for biotechnology information)
Анализ данных. Спектры MS/MS сравнивали
или базы данных Cucurbit Genomics Database.
со спектрами, хранящимися в базе данных
Праймеры для каждого кандидатного гена были
UniProt Cucurbitaceae и базе данных ложных це$
подобраны с помощью программы Primer 5.0, и
лей (decoy) с использованием инструмента MAS$
специфические праймеры были валидированы с
COT engine («Matrix Science», Великобритания,
помощью их сопоставления с базами данных
версия 2.2), встроенного в Proteome Discoverer 1.3
транскриптов огурца, размещенных в NCBI
(«Thermo Electron», CША). Для проведения
BLASTN (таблица). Для нормализации экспрес$
идентификации белков были использованы сле$
сии генов в качестве внутреннего стандарта ис$
дующие опции: допуск на расхождение между тео$
пользовали ген актина [15]. Реакцию проводили
ретической и экспериментальной массой пепти$
в течение 15 мин при 95 °C, затем 42 цикла при
да (peptide mass tolerance) = 20 ppm; допустимое
95 °C в течение 15 с каждый и при 60 °C в течение
расхождение массы пептида при MS/MS = 0,1 Да;
30 с. В ходе проведения ОТ$ПЦР на приборе
фермент - трипсин; пропущенные сайты рас$
фирмы «Roche» проводили три параллельных
щепления (missed cleavage) = 2; фиксированные
измерения для каждого образца и с технически$
модификации, карбамидометил (C), iTRAQ8plex
ми повторами. Статистические данные рассчи$
(K), iTRAQ8plex (N$term); вариабельная модифи$
тывали с помощью программы SPSS Statistics v.
кация, окисление (M); FDR
0,01.
17 с предельным значением p < 0,05.
Биоинформатический анализ белков. Диффе$
Размещение данных. Протеомные данные,
ренцированно экспрессируемые белки были
полученные с помощью масс$спектрометрии,
БИОХИМИЯ том 84 вып. 10 2019
СИНТЕЗ БЕЛКОВ В ИНФИЦИРОВАННЫХ C. cassiicola ЛИСТЬЯХ ОГУРЦОВ
1485
Последовательность праймеров, использованных при про$
стрировали симптомы, такие как некротические
ведении ОТ$ПЦР (qRT$PCR)
поражения, приводящие к пожелтению и атро$
фии (рис. 1, a). Несколько некротических пятен
Название гена
Последовательность праймера 5'-3'
было обнаружено у устойчивых растений
(Jinyou 38) (рис. 1, a). Индекс заболеваемости
прямой: TCGTGCTGGATTCTGGTG
для каждой разновидности огурцов показал, что
Actin
сорт Jinyou 38 является высоко устойчивым к за$
обратный: GGCAGTGGTGGTGAACAT
болеванию (рис. 1, b). Чтобы определить, может
прямой: ACCCAAAACCGAAGAACACC
ли вызванный CLS стресс привести к накопле$
S/TPK
нию активных форм кислорода (ROS - reactive
обратный: ACGAACGAATAACCAGGAGG
oxygen species) и лигнина в листьях огурца, мы
провели их определение с помощью метода гис$
прямой: ATGTATCCAAGAAGGGAACGC
PPR
тохимического окрашивания в определенные
обратный: TGAGGGCAAAGGGAATAAACT
моменты времени после инфицирования расте$
ний C. сassiicola (через 3, 6, 12, 24 и 48 ч) [16]
прямой: GCACTTTCTTCCTCCGTCATC
(рис. 2). Как было показано, H2O2 и O2-· начина$
ACC
ли накапливаться через 6 ч после инфицирова$
обратный: TTTTCGCAGAGCAAATCCAG
ния, однако это было более выражено в устой$
чивых растениях. Через 24 ч значительное на$
прямой: CTTTCCGCCGCAAATGAT
nsLTPs
копление лигнина, H2O2 и O2-· наблюдалось в
обратный: TGCTGGTGGTGCTGTCGTT
обеих разновидностях огурца [16]. Для проведе$
прямой: GCTTGCGGCTAGAAATGCC
ния протеомного анализа были отобраны две
OPR1
временные точки: 6 и 24 ч после инокуляции.
обратный: TCCCCACTCTGTCTCCACCTA
Дифференцированный протеомный анализ
огурца с помощью метода iTRAQ. Профили
прямой: ACAGGAAACGGCTGGGTCT
экспрессии белков огурца на ранней стадии
DIRP
листьев необработанных огурцов (0 ч) и листьев
обратный: GGGAACGATTTGGATTGAGG
огурцов, инфицированных патогеном C. cassiico
прямой: CCAACCATTTTCAACGACCG
la (через 6 и 24 ч), были проанализированы с
MLO
использованием метода iTRAQ (рис. 3). Кроме
обратный: GGAGGCAACTCTTCCCAACG
того, было определен состав белков с помощью
прямой: CTCTTGGTGGGAAACTTGTGAG
метода электрофореза в полиакриламидном геле
MLP
в присутствии додецилсульфата натрия (SDS$
обратный: ACCTCGGGTTTACCATCAGC
PAGE, SDS$ПААГ) (рис. 3, a). Всего был обна$
ружен 1891 белок, для каждого из которых были
прямой: GCCAAATGGAGATTCGGATAA
PLD
трижды проведены параллельные измерения,
обратный: CCTGAAAAGGGAGTGAAAGGGT
чтобы иметь возможность провести статисти$
ческую обработку полученных результатов. Все$
прямой: GCCTCACAATGAAGAACCCG
го в данной работе было идентифицировано 286
SUBP
обратный: TGCTGCTCCTCCTCCAGAAT
дифференцированно экспрессируемых белков.
Статистическая обработка полученных проте$
омных данных показала, что ответ листьев огур$
ца на инфицирование растений C. cassiicola в
были размещены в консорциуме Proteome$
различные моменты времени проявлялся в виде
Xchange через партнерский репозиторий PRIDE
широкого диапазона изменений уровней
под идентификационным номером PXD012903.
экспрессии белков. Количество идентифициро$
ванных белков в различные моменты времени
показано на рис. 3, b и c. На протяжении 24 ч
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
протеом подвергался непрерывному измене$
нию. Количество дифференцированно экспрес$
Тяжесть болезни растения и симптомы. Огур$
сируемых белков между различными моментами
цы выращивали в теплице и затем на стадии 2-3
времени (см. Приложение, Table S2) и картина
листьев подвергали инокуляции суспензией
перекрывания между этими дифференцирован$
спор патогена C. cassiicola. Внешний вид уязви$
но экспрессируемыми белками представлена на
мых и устойчивых растений после их обработки
рис. 3, c. В общей сложности, через 6 ч после
патогеном показан на рис. 1. Подверженные за$
инокуляции C. cassiicola происходило изменение
болеванию растения (сорт Ludixianfeng) демон$
уровня экспрессии 103 белков (повышение
БИОХИМИЯ том 84 вып. 10 2019
1486
G. YU и др.
Рис. 1. Устойчивые и восприимчивые растения после инокуляции патогена. a - Огуречные растения устойчивого сорта
Jinyou 38 и восприимчивого сорта Ludixianfeng, подвергшиеся обработке C. cassiicola в течение 0 и 5 дней; b - oценка симп$
томов болезни в сортах сортов Jinyou 38 и Ludixianfeng после их инфицирования C. cassiicola.
biokhsm/
уровня экспрессии 31 белка и снижение уровня
позволяет предположить, что белки с повышен$
экспрессии 72 белков). Через 24 ч после иноку$
ной экспрессией играют роль в процессе защи$
ляции изменилась картина экспрессии уже 128
ты растений. Кроме того, 22 белка с повышен$
белков (повышение уровня экспрессии 69 бел$
ной экспрессией и 37 белков с пониженной
ков и снижение уровня экспрессии 59 белков).
экспрессией выявлялись только в образцах, взя$
В то же время 19 белков экспрессировались в
тых через 6 ч (рис. 3, c), и эти белки в основном
различной степени во временных точках 6 и 0 ч
были вовлечены в различные биологические
и между 24 и 0 ч (рис. 3, c). Из этих 19 белков
процессы, включая функционирование рибосо$
один белок отличался повышенной экспрессией
мы, клеточный метаболизм, биологический
и 18 белков, напротив, экспрессировались в
контроль и внутриклеточная локализация, в от$
меньшей степени как через 6, так и через 24 ч
вет на стресс и перекиси. В то же время только
после инокуляции. Для двадцати белков была
через 24 ч выявлена повышенная экспрессия 20
установлена противоположная тенденция при
белков и снижение уровня экспрессии 22 белков
сравнении уровня их экспрессии между 6 и 0 ч и
(рис. 3, c), которые принимали участие в осуще$
между 24 и 6 ч. Семь из этих белков характери$
ствлении молекулярных функций, включая ме$
зовались повышением уровня экспрессии через
таболизм клетки, реакцию на стресс, рибосому
6 ч и его снижением через 24 ч, в то время как в
и защитные реакции.
случае других 13 белков наблюдалось снижение
Анализ CLS4респонсивных белков. С по$
уровня экспрессии через 6 ч, но через 24 ч их
мощью метода обогащения генов (GO) диффе$
экспрессия повышалась. При сравнении резуль$
ренцированно экспрессируемые белки были
татов, полученных для 6 ч и 24 ч, оказалось, что
классифицированы на 47 групп (биологический
через 24 ч больше белков повышенно экспрес$
процесс, компонент клетки и молекулярная
сировались, а снижение уровня экс$прессии ре$
функция), как показано на рис. 4, a. С помощью
гистрировалось у меньшего числа белков. Это
этого метода и анализа метаболических путей
БИОХИМИЯ том 84 вып. 10 2019
СИНТЕЗ БЕЛКОВ В ИНФИЦИРОВАННЫХ C. cassiicola ЛИСТЬЯХ ОГУРЦОВ
1487
Рис. 2. Накопление АФК и отложения лигнина были оценены в листьях огурца из необработанных и обработанных устой$
чивых/восприимчивых растений после инокуляции C. cassiicola с помощью: a - окрашивания диаминобензидином
(DAB); b - окрашивания нитроголубым тетразолием (NBT) и c - окрашивания лигнина [16].
biokhsm/
KEGG, белки, которые дифференцированно
Валидация дифференцированно экспрессируе4
экспрессируются в листьях огурца в ответ на об$
мых белков с помощью полимеразной реакции с
работку растений C. сassiicola, были в основном
обратной транскрипцией (qRT4PCR). Для провер$
классифицированы как защитные или стресс$
ки полученных протеомных данных был ис$
респонсивные белки, сигнальные белки, белки,
пользован метод ОТ$ПЦР (qRT$PCR), с по$
ассоциированные с клеточным метаболизмом,
мощью которого проведена оценка транскрип$
белки окислительного стресса, регуляторные
ции генов, кодирующих десять дифференциро$
белки и транспортные белки (рис. 4, b). В связи
ванно экспрессируемых белков, которые могут
с большим разнообразием функций дифферен$
иметь отношение к возникновению устойчивос$
цированно экспрессируемых белков далее будут
ти к болезни на многочисленных стадиях CLS$
рассмотрены только те белки, которые имеют
индуцированного стресса у огурца. К этим генам
отношение к защите, передаче внутриклеточно$
относятся: MLP (ген, кодирующий MLP$подоб$
го сигнала, окислительному стрессу и метабо$
ный белок), MLO (белок семейства белков локу$
лизму клеток.
са О устойчивости к ложномучнистой росе),
БИОХИМИЯ том 84 вып. 10 2019
1488
G. YU и др.
Рис. 3. Оценка уровня экспрессии белков на первых этапах взаимодействия огурца и патогена C. сassiicola с помощью ме$
тода iTRAQ. a - Качество образцов белков, выделенных из листьев через 0, 6 и 24 ч после инокуляции патогена, оцени$
вали с помощью SDS$ПААГ; b - количество дифференцированно накапливаемых белков при сравнении 6 ч против 0 ч,
24 ч против 0 ч и 6 ч против 24 ч в ответ на инфекцию C. cassiicola; c - изменения протеома до и после инфицирования па$
тогеном C. cassiicola: 6 ч против 0 ч, 24 ч против 0 ч и 6 ч против 24 ч. Диаграмма Венна, показывающая уникальные и об$
щие белки; n - число экстрагированных белков.
biokhsm/
nsLTP (неспецифический липид$переносящий
В то же время, напротив, было выявлено суще$
белок), SUBP (субтилизин$подобная протеаза),
ственное снижение уровня транскрипции четы$
ACC (ACC оксидаза), OPR1 (12$оксофитодиено$
рех генов, а именно, SUBP, MLP, nsLTP и MLO.
атредуктаза 1), PLD (фосфолипаза D), S/TPK
Уровни транскриптов генов MLP, SUBP, ACC,
(серин$треониновая протеинкиназа), DIRP (ди$
OPR1, PLD и DIRP хорошо коррелировали с
рижабль$подобный белок) и PPR (белок, содер$
уровнем соответствующих белков в одни и те же
жащий пентатрикопептидные повторы). Как
моменты времени. Однако корреляция между
показано на рис. 5, уровни транскриптов шести
уровнем мРНК и белка для PPR, nsLTP, S/TPK и
генов, а именно, ACC, OPR1, PLD, DIRP, S/TPK
MLO была незначительной. Эта разница могла
и PPR, были значительно повышены в заболев$
возникнуть в результате регуляции транскрип$
ших CLS растениях, по сравнению с контролем.
ции и посттрансляционных модификаций.
БИОХИМИЯ том 84 вып. 10 2019
СИНТЕЗ БЕЛКОВ В ИНФИЦИРОВАННЫХ C. cassiicola ЛИСТЬЯХ ОГУРЦОВ
1489
a
b
Biological process
Cellular component Molecular function
Рис. 4. Классификация онтологии генов (GO) и анализ путей KEGG всех идентифицированных белков огурца после ин$
фицирования патогеном C. cassiicola. a - Биологические процессы, клеточные компоненты и молекулярные функции
дифференцированно экспрессированных белков: 6 ч против 0 ч, 24 ч против 0 ч и 6 ч против 24 ч; b - анализ путей KEGG
дифференцированно экспрессируемых белков в различные моменты времени.
journal/biokhsm/
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
(D5LHU4). Большинство из этих белков демон$
стрировали повышенную экспрессию после
Информация о защитных механизмах расте$
инокуляции C. сassiicola, за исключением белков
ний огурца ограничена. В настоящей работе в
MLP, SUBP и PPR (рис. 6).
результате проведения количественного проте$
Защитные (PR) белки индуцируются в расте$
омного анализа с использованием метода
ниях в случае вторжения патогена. Общей важ$
iTRAQ было предположено возникновение ди$
ной функцией большинства PR$белков является
намических изменений на ранних стадиях
их противогрибковый эффект. Один из предста$
стресса, вызываемого грибками. Идентифици$
вителей этих белков, хитиназа, может предот$
рованные белки были в основном вовлечены в
вращать внедрение патогена, гидролизуя хитин
защитные реакции растений, передачу сигнала,
в клеточных стенках патогенных грибов [17].
окислительный стресс и метаболизм клеток.
Показано, что экспрессия хитиназы (PR$4)
Защитные метаболические пути. В работе бы$
(A0A0A0LIC8) значительно повышалась через
ли получены данные об изменении динамики
24 ч после инокуляции C. cassiicola. Поэтому
синтеза белков, связанных с защитными реак$
можно предположить, что PR$4 может обуслов$
циями огурцов во время CLS$инфекции. Эти
ливать устойчивость огурца к C. cassiicola. При
изменения касались следующих семейств бел$
сравнении аминокислотных последовательнос$
ков: хитиназа (PR$4), MLP, nsLTP (неспецифи$
тей и выявленной гомологии большинство
ческий липид$переносящий белок), SUBP (суб$
представителей белков MLP ассоциируются с
тилизин$подобная протеаза), цистеин$содержа$
семейством белков PR10, указывая на то, что
щей протеазы, PPR и белка теплового шока
белки MLP играют важную роль в защитных ре$
БИОХИМИЯ том 84 вып. 10 2019
1490
G. YU и др.
Рис. 5. Анализ экспрессии мРНК с помощью метода ОТ$ПЦР (qRT$PCR) для 10 кандидатных белков из листьев огурца
после обработки возбудителем. 0 ч - контрольные растения. Уровни относительной экспрессии были нормализованы
против внутреннего стандарта, актина. Каждая гистограмма представляет среднее значение трех биологических повторов,
и вертикальные столбики обозначают стандартную ошибку (n = 3). Строчные буквы обозначают существенные различия
в соответствии с критерием Дункана для проведения множественных сравнений (p < 0,05)
БИОХИМИЯ том 84 вып. 10 2019
СИНТЕЗ БЕЛКОВ В ИНФИЦИРОВАННЫХ C. cassiicola ЛИСТЬЯХ ОГУРЦОВ
1491
Рис. 6. Белки, которые показывают изменения сигнальных путей и клеточных механизмов при инфицировании возбуди$
телем. Каждый окрашенный квадрат обозначает белки, катализирующие этап в сигнальном пути, чей уровень экспрессии
повысился или понизился.
biokhsm/
акциях растений [18]. Было показано, что в
тических факторов [23]. В некоторых случаях
листьях винограда при патогенной инфекции
белки nsLTP классифицируются как белки PR$14,
наблюдается снижение уровня экспрессии MLP
т.е. принадлежащие к классу PR$белков, кото$
и последний прямо влияет на стресс, вызван$
рые у растений вовлечены в различные значи$
ный грибковой инфекцией [19]. Белок SUBP яв$
мые процессы, такие как поддержание стабиль$
ляется членом семейства сериновых протеаз,
ности клеточной мембраны, состава клеточной
которые принимают участие в передаче сигнала
стенки и передача внутриклеточного сигнала
и развитии растения. Индукция экспрессии
[24]. Белки nsLTP могут взаимодействовать с ли$
после инфицирования патогеном была показана
пидными молекулами с образованием соедине$
для отдельных представителей белков SUBP [20,
ний, которые, в свою очередь, могут вступать во
21]. Белок SBT3.3 был идентифицирован у
взаимодействия с белками грибков и конкури$
Arabidopsis thaliana как представитель субтили$
ровать за связывание с рецепторами. Эти соеди$
зин$подобных протеаз. Его экспрессия ассоции$
нения вовлечены в системную приобретенную
рована с процессом распознавания патогена и
устойчивость (SAR - systemic acquired resistance)
активацией сигнального пути. В другой работе
и имеют отношение к процессу передачи сигна$
был идентифицирован белок SUBP, содержа$
лов дальнего действия [6, 25, 26]. Однако выяв$
щий скрытый встроенный сигнал, который мо$
ленная картина экспрессии гена nsLTP прямо
жет привести к активации защитных генов у сое$
противоположна профилю экспрессии кодируе$
вых бобов [22]. Картина экспрессии защитных
мого этим геном белка (рис. 5). Дифференци$
генов, таких как MLP и SUBP, также была под$
альная регуляция различных компонентов
тверждена с помощью метода ОТ$ПЦР (qRT$
трансляционной машинерии означает сложный
PCR). Полученные результаты показали соответ$
контрольный механизм управления биосинте$
ствие между уровнем транскриптов и белков.
зом белка.
Это указывает на то, что уровни экспрессии ге$
Белки семейства MLO. Белки MLO представ$
нов MLP и SUBP ассоциированы с взаимодей$
ляют собой специфические растительные интег$
ствием между огурцом и патогеном C. cassiicola.
ральные мембранные белки, для которых харак$
Значительные изменения белкового уровня двух
терно наличие семи трансмембранных домена
белков nsLTP (A0A0A0K5X6 и A0A0A0LF44) бы$
[27]. Показано, что мутантный по гену mlo ячмень
ли выявлены как через 6 ч, так и через 24 ч пос$
обладает широкой устойчивостью к действию
ле инокуляции. Неспецифические липид$пере$
грибка мучнистой росы Blumeria graminis f.
носящие белки (nsLTPs) - это небольшие белки,
sp. hordei (Bgh) [28, 29]. У Arabidopsis тройные
которые были обнаружены в различных типах
мутантные растения Atmlo2Atmlo6 Atmlo12 пол$
растений, и они играют ключевую роль в защи$
ностью невосприимчивы к грибку мучнистой
те от действия различных биотических и абио$
росы, в то время как одиночная мутация в гене
БИОХИМИЯ том 84 вып. 10 2019
1492
G. YU и др.
mlo2 обеспечивает частичную устойчивость к
мерный комплекс, находящийся в неактивном
адаптированному патогену мучнистой росы
состоянии [32]. Связывание лиганда с GPCR
[30]. У Arabidopsis белки MLO образуют одно из
вызывает переход неактивного G$белка в его
наиболее крупных семейств белков, для струк$
активную конформацию, приводящую к диссо$
туры которых характерно наличие шести спира$
циации гетеротримерного G$белка на Gα и ди$
лей. Особенное строение их доменов напомина$
мер Gβγ, и активацию клеточного ответа [31].
ет структуру сопряженного с G$белком рецептора
Однако роль MLO как канонического GPCR у
(GPCR - G protein coupled receptor), который ак$
растений не установлена, и в настоящее время
тивирует ассоциированный с гетеротримерным
известны только два гетеротримерных G$белка
G$белком сигнальный путь у многоклеточных
(у Arabidopsis и риса) [33]. Белок MLO2 с семью
организмов [31]. Канонический GPCR$ассоци$
трансмембранными доменами имеет отноше$
ированный G$белок состоит из субъединиц Gα,
ние к устойчивости растений и защите от пато$
Gβ и Gγ, которые вместе образуют гетеротри$
генов у Arabidopsis, однако до сих пор неизвест$
Рис. 7. Схема ROP$регулируемых путей у растений [32]. Знаки вопроса означают то, что роли белка MLO и субъединиц
Gα, Gβ и Gγ гетеротримерного G$белка в ROP$зависимых путях еще не определены.
biokhsm/
БИОХИМИЯ том 84 вып. 10 2019
СИНТЕЗ БЕЛКОВ В ИНФИЦИРОВАННЫХ C. cassiicola ЛИСТЬЯХ ОГУРЦОВ
1493
но могут ли G$белки прямо сопрягать передачу
торными киназами (RLKs) [34]. В настоящей
сигнала через MLO2 [31]. Недавно было показа$
работе было предположено, что повышенная
но, что MLO2 (AT1G1130) может взаимодей$
экспрессия белка MLO (KRN4) после инфици$
ствовать с GCR1, который является кандидат$
рования C. cassiicola может свидетельствовать об
ным GPCR, основываясь на гомологии его пос$
его участии в этом ответе. Однако картина
ледовательности с белками GPCR у Dictyo
экспрессии гена MLO была противоположной
stelium и результатов двугибридного дрожжево$
профилю экспрессии белка, кодируемого этим
го анализа. В то же время GCR1 был определен
геном (рис. 5). В целом, нами было предположе$
как дополнительная кандидатная мишень для
но, что структура фактора чувствительности
взаимодействий с малой G$белок Rho$сходной
MLO напоминает структуру белков GPCR и для
ГТФазой растений (ROP) 5 (AT4G35950), ара$
сопротивляемости вторжению патогена необхо$
биногалактан$содержащим белком клеточной
димы белки трех различных семейств (MLOs,
стенки AGP27 (AT3G06360) и двумя белками$
RLKs и ROPs). Однако остается открытым воп$
транспортерами (NRAMP2, AT1G47240, и
рос о том, каким образом эти белки функцио$
транспортером аммония AMT1, AT4G13510)
нально связаны друг с другом. Поэтому необхо$
[34]. Есть доказательства того, что два из этих
димо продолжать изучение этих сложных меха$
взаимодействующих белков (MLO и ROP) так$
низмов.
же могут потенциально взаимодействовать с
Активация сигнальных каскадов и ответ на
белком GCR1.
окислительный стресс. АФК, салициловая кис$
Белки ROP (белки растений) являются чле$
лота (SA), жасмоновая кислота (JA) и этилен
нами подсемейства белков Rho и играют крити$
(ET ), опосредованные сигнальные пути извест$
ческую роль в контроле клеточного роста, син$
ны в основном по их значительной роли в защи$
тезе CCR1, образовании АФК, абсцизовой кис$
те растений от различных патогенов [38]. Были
лоты (ABA) и проявлении защитных реакций
выявлены существенные изменения уровня
растений [35]. Как молекулярные переключате$
экспрессии белков, ассоциированных с не$
ли, белки ROP инактивируют ГДФ$связанную и
сколькими сигнальными путями, такими как SA$,
активируют ГТФ$связанную форму, чьи быст$
JA$, ET$ и H2O2$ассоциированными путями пе$
рые взаимопревращения катализируются фак$
редачи сигнала (рис. 6).
торами обмена гуаниновых нуклеотидов (ROP
Растительные гормоны ET и JA являются ос$
GEFs - guanine exchange factors) и белками, акти$
новными сигналами защитной системы расте$
вирующими ГТФазу (ROP GAPs - GTPase acti
ний. Перекрестные связи между JA$ и ET$зави$
vating proteins). Когда вышележащий сигнал сти$
симыми сигнальными путями определяют акти$
мулирует рецепторную киназу (RLK), локализо$
вацию целого набора защитных ответных реак$
ванную на плазматической мембране (рис. 7), то
ций против патогенов [39]. ACC$оксидаза ката$
эти киназы взаимодействуют с белками GEF,
лизирует последнюю реакцию синтеза этилена
оказывая воздействие на структуру их домена
[40]. 3$кетоацил$КоАтиолаза (KAT) является
PRONE, что способствуют замене ГДФ на ГТФ
одним из ключевых ферментов, необходимых
и активации белков ROP, которые затем взаимо$
для бета$окисления в пути синтеза жасмоновой
действуют с нижележащими эффекторами [36].
кислоты. OPR может катализировать окисление
Была показана связь между гетеротримерны$
cis$(+)$12$оксо$фитодиеновой кислоты (OPDA)
ми G$белками и малой ГТФазой OsRAC1 в пе$
с образованием OPC$8:0, являющегося предше$
редаче сигнала устойчивости к болезни у риса.
ственником жасмоновой кислоты [41]. Было
Такие сигналы, идущие от белков GPCR, пере$
сделано предположение, что повышенное со$
даются на субъединицы Gα гетеротримерного
держание двух ACC$оксидаз, KAT и OPR подра$
G$белка, который может далее передать сигнал
зумевает участие этилена и жасмоновой кисло$
на Rho$ГТФазы через путь, ассоциированный с
ты в различных процессах у огурца, включая ре$
белками GEF и протеинкиназами [32, 36]. Му$
гуляцию экспрессии генов резистентности во
тантные рисовые растения с генотипом dwarf1
время адаптивного ответа на стресс, вызванный
(d1), у которых отсутствует ген Gα, показывают
CLS. Экспрессия генов, таких как ACC и OPR,
пониженную сопротивляемость грибковой ин$
более длительное время (6-48 ч) поддержива$
фекции. В то же время у них полностью подав$
лась на высоком уровне у устойчивых растений.
лено образование H2O2 [37]. Недавно при изуче$
Уровень экспрессии гена PLD был значительно
нии сети белок$белковых взаимодействий сиг$
повышен через 24 ч по сравнению с другими мо$
нальных мембранных белков с помощью метода
ментами времени (рис. 5), что также указывает
дрожжевого двугибридного анализа были полу$
на положительный эффект этого изменения с
чены прямые доказательства контактов между
точки зрения развития устойчивости к развитию
белками семейства MLO и различными рецеп$
CLS.
БИОХИМИЯ том 84 вып. 10 2019
1494
G. YU и др.
При вторжении патогенов происходит быст$
вторжение патогенных грибков. Гистохимичес$
рое образование и накопление активных форм
кое окрашивание позволило выявить более ран$
кислорода, которые в качестве первой линии
ний окислительный взрыв у устойчивых расте$
обороны против возбудителей болезней вызы$
ний по сравнению с восприимчивыми к инфек$
вают в их плазматической мембране реакции
ции растениями в условиях стресса, вызванного
перекисного окисления липидов и ингибируют
CLS. Это результат согласуется с результатами,
рост грибков [42]. АФК могут также действовать
полученными в работе Wang et al. [16]. На этом
как вторичные мессенджеры и активировать
основании можно предположить, что у огурцов
экспрессию защитных генов и укреплять меха$
защитная реакция растений происходит уже на
ническую устойчивость клеток растений к втор$
ранних стадиях вторжения патогена, что соответ$
жению патогенов [43]. Кроме того, у растений
ствует изменениям белковой экспрессии, выяв$
была выработана эффективная антиоксидант$
ленным с помощью метода iTRAQ. Благодаря
ная система, регулирующая процессы образова$
происходящим изменениям в передаче сигналов
ния АФК и поддерживающая редокс$гомеостаз
внутрь клеток, достигается адаптация огуреч$
клеток [44]. Показано, что через 6 ч после обра$
ных листьев к грибковой инфекции и снижается
ботки растений грибами происходит снижение
уровень повреждений листьев, вызываемый
уровня экспрессии двух ферментов, удаляющих
CLS. Таким образом, мы предположили сущест$
активные формы кислорода, а именно, аскор$
вование некой сети взаимодействующих белков,
батпероксидазы (APX) и супероксиддисмутазы
которая объясняет наличие изменений в сиг$
(SOD), что приводило к повышению уровня ак$
нальных путях при ответе листьев растений на
тивных форм кислорода в клетках. Более того,
CLS$инфекцию.
быстрая активация антиоксидантной системы
Активация метаболических путей. Реакция
способствует тому, что клетки организма$хозяи$
огурцов сорта Jinyou 38 на CLS$инфекцию была
на могут поддерживать их нормальную структу$
комплексной. Одной из нижележащих мишеней
ру и укреплять их сопротивляемость инфициро$
была сеть обмена энергией. У огурцов в резуль$
ванию патогеном. Малая ГТФаза OsRAC1 мо$
тате вторжения патогена C. cassiicola экспрессия
жет активировать белок CCR1 (циннамоилре$
большинства белков, которые участвуют в про$
дуктаза 1), ключевой фермент первого этапа био$
цессе фотосинтеза, гликолизе, цикле трикарбо$
синтеза предшественников лигнина (монолиг$
новых кислот и пентозофосфатном пути, суще$
нолы), которые могут под действием H2O2 поли$
ственно изменялась, что свидетельствует о том,
меризоваться и образовывать полимеры лигни$
что активация метаболических путей вносит
на. Эти полимеры играют важную роль в анти$
вклад в защитную реакцию у растений с резис$
микробной защите растений [45]. Снижение
тентным генотипом (рис. 8). Изменения этих
уровня экспрессии супероксиддисмутазы после
белков также предполагают, что инокуляция
инокуляции патогенов может привести к регу$
C. cassiicola влияет на фотосинтетическую ак$
лируемому перекисью водорода накоплению
тивность и что устойчивые огурцы нуждаются в
лигнина (рис. 6).
том, чтобы получить больше солнечного света,
H2O2 также функционируют в качестве сиг$
запасти больше энергии и высвободить больше
нальной молекулы в системе защиты растений.
кислорода, чтобы поддерживать активность их
Кроме того, было показано, что H2O2 задейство$
фотосинтетического аппарата и преодолеть ин$
вана в активации кальциевых каналов [46]. Не$
дуцированный патогенами стресс (рис. 8). Эти
сколько белков из числа дифференцированно
результаты указывают на большое значение об$
экспрессируемых в листьях огурца белков после
мена энергии в ответе растений на CLS$инфек$
инокуляции C. cassiicola оказались функцио$
цию.
нально ассоциированными с образованием и
Были идентифицированы несколько белков,
действием H2O2. АФК генерируются НАДФН$
такие как серин$треониновая протеинкиназа
оксидазами (RBOHs, оксидазы, вызывающие
(S/TPK) (A0A0A0KDU6), GrpE (A0A0A0LQA8)
дыхательный взрыв) и могут препятствовать ги$
и субъединица 26S протеасомы (A0A0A0K3C4),
бели клеток под действием салициловой кисло$
которые оказались вовлечены в процесс биоло$
ты в местах проникновения инфекции, что сви$
гической регуляции и передачу сигнала или же
детельствует о роли этих оксидаз в качестве сиг$
действовали в качестве шаперонов. Серин$трео$
нальных молекул [47]. Накопление оксидаз ды$
ниновые протеинкиназы принимают входящую
хательного окислительного взрыва в листьях
информацию, чтобы определить состояние ок$
огурца в условиях стресса, вызванного CLS, че$
ружающей среды, фитогормоны и другие внеш$
рез 24 ч после инфицирования растений показа$
ние факторы и затем инициировать передачу
ло, что огурцы могут увеличивать синтез актив$
внутриклеточного сигналов для генерации адек$
ных форм кислорода, чтобы предотвратить
ватных ответов, которые могут включать изме$
БИОХИМИЯ том 84 вып. 10 2019
СИНТЕЗ БЕЛКОВ В ИНФИЦИРОВАННЫХ C. cassiicola ЛИСТЬЯХ ОГУРЦОВ
1495
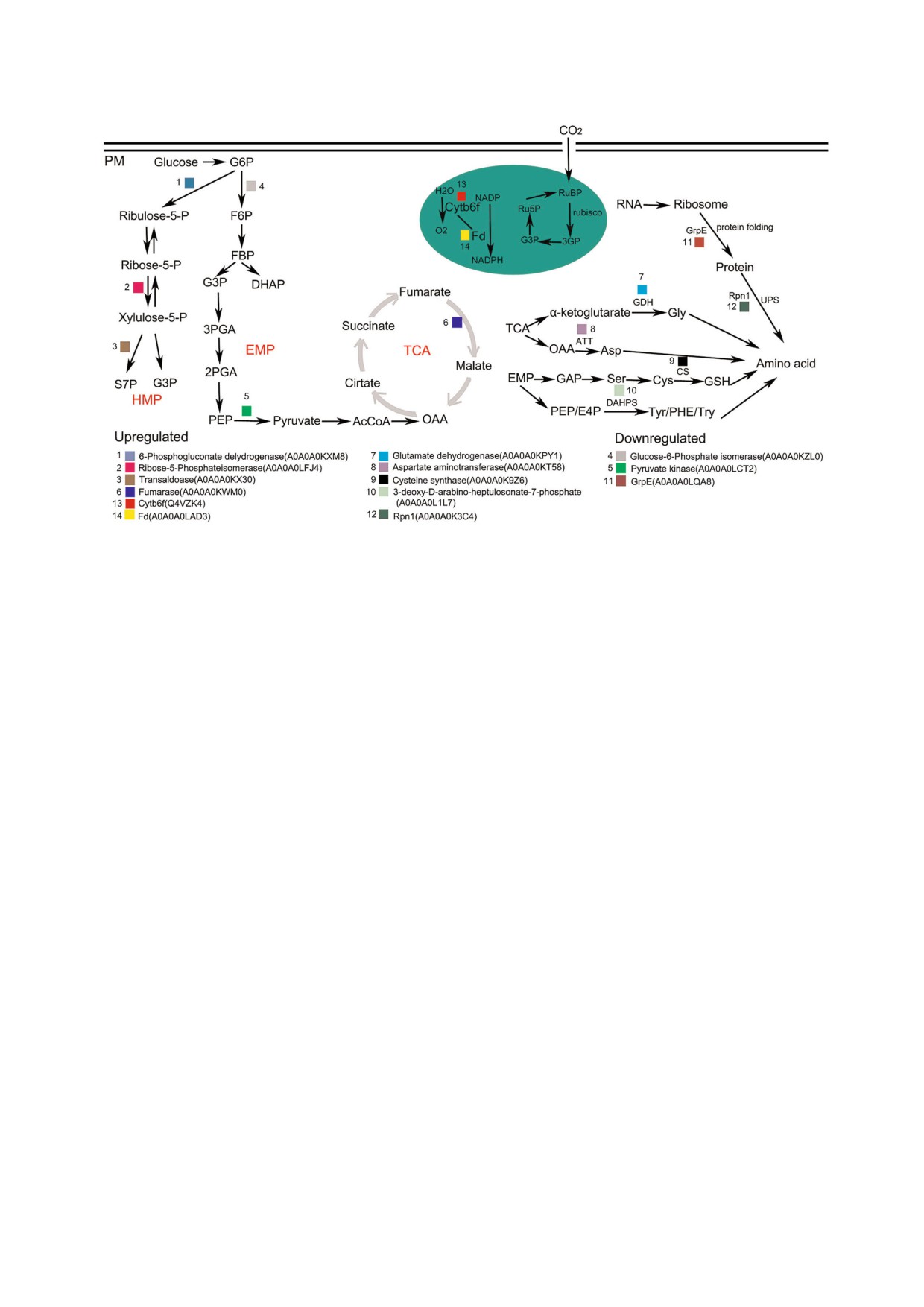
Рис. 8. Белки, участвующие в первичных метаболических ответах на инфекцию. Среди этих ответов: путь Эмпде$
на-Майерхофа (EMP - Embden Mayerhoff pathway), цикл трикарбоновых кислот, гексозомонофосфатный путь (HMP -
hexose monophosphate pathway), фотосинтез и обмен белков. Окрашенные квадраты обозначают белки, катализирующие
этап в метаболическом пути и экспрессия которых повысилась или уменьшилась.
biokhsm/
нения метаболизма, экспрессии генов и роста
мой убиквитина и 26S протеасомы (UPS), кото$
клеток [48, 49]. В настоящей работе было пока$
рая участвует почти на всех этапах защиты рас$
зано, что S/TPK повышенно экспрессируется
тений. Показано, что у Arabidopsis 26S протеасо$
через 24 ч после обработки растений грибками,
ма вносит вклад в защиту растений, в которой
в соответствии с результатами ОТ$ПЦР. Этот бе$
задействованы R$гены [51]. В настоящей работе
лок был идентифицирован как положительный
было показано увеличение содержания субъеди$
регулятор во время адаптивного ответа к стрес$
ницы Rpn1 26S протеасомы через 24 ч после
су, индуцированному CLS. Поэтому нами было
грибковой инфекции, что может иметь отноше$
высказано предположение, что накопление
ние к механизму устойчивости огурцов к заболе$
S/TPK может привести к активации сигнально$
ванию.
го пути и запуску экспрессии защитных генов.
Модификация клеточной стенки. Активация
Комплекс Dnak/Hsp70 является фактором об$
вторичных метаболических путей представляет
мена нуклеотидов и состоит из трех компонен$
собой способ защиты растений от вторжения
тов (Dnak/Hsp70, DnaJ и GrpE). Этот комплекс
патогенов. При гистохимическом окрашивании
действует как молекулярный шаперон, участву$
была выявлена высокая степень лигнификации
ющий в фолдинге пептидов, деполимеризации и
листьев огурцов через 24 ч после инокуляции
деформации белка [50]. Также нами было пока$
C. cassiicola. Кроме того, было выявлено сущест$
зано снижение экспрессии GrpE через 6 и 24 ч
венное изменение уровня экспрессии различ$
после попадания CLS$инфекции. Это сущест$
ных ферментов и белков, вовлеченных в про$
венное изменение уровня экспрессии белка
цессы биосинтеза лигнина, терпеноидов и каро$
GrpE указывает на то, что он играет ключевую
тиноидов через 6 и 24 ч после инфицирования
роль в распознавании и корректировке непра$
растений. Лигнин является важнейшим факто$
вильно свернутых белков и усиливает сопротив$
ром защитных систем растений, и он укрепляет
ляемость растений путем регуляции активности
клеточную стенку, являясь устойчивым к био$
комплекса Hsp70 при инфицировании огурцов
деградации механическим барьером на пути
возбудителем CLS. У растений процесс деграда$
большинства патогенных грибов [52-54]. Было
ции большинства белков контролируется систе$
показано, что у хлопчатника после инокуляции
БИОХИМИЯ том 84 вып. 10 2019
1496
G. YU и др.
Verticillium dahliae наблюдается повышение ак$
Другие функции. Кроме уже рассмотренных
тивности ферментов, участвующих в фенилпро$
белков, было показано существенное изменение
паноидном пути и биосинтезе лигнина [55]. В
уровня экспрессии белков, вовлеченных в син$
данной работе родственные белки, участвую$
тез аминокислот и метаболизм липидов. Синтез
щие в биосинтезе лигнина, такие как CCR1
аминокислот в растениях нарушается при пато$
(циннамоилредуктаза$1), 4$кумаратлигаза$по$
генной инфекции и таким образом он может
добный белок 7, малатдегидрогеназа, DIRP 2
быть индуцирован, чтобы обеспечить материал
(дирижабль$подобный белок), CAD (дегидроге$
для синтеза белков, необходимых для повыше$
наза коричного спирта) и 10 типов пероксидаз, в
ния сопротивляемости развитию болезни. По$
значительной степени накапливаются на ран$
казано, что экспрессия большинства белков,
ней стадии инфекции. Белок DIRP играет важ$
участвующих в биосинтезе аминокислот, повы$
ную роль во вторичном метаболизме растений и
шалась через 24 ч после инфицирования расте$
принимает участие в биосинтезе лигнина, лиг$
ний (рис. 8). Эти результаты говорят о том, что
нана и госсипола [56-58]. В настоящей работе с
быстрое повышение экспрессии этих белков в
помощью iTRAQ и qRT$PCR было показано,
огурцах может способствовать синтезу защит$
что определяемое этими методами последова$
ных белков на ранних стадиях инфицирования
тельное увеличение уровня экспрессии белка
растений патогеном C. cassiicola. Липиды играют
DIRP у огурца может привести к повышению
важную роль в поддержании клеточных функ$
содержания лигнина. Эти ключевые белки
ций и управлению стрессом, вызываемым фак$
предполагают ясную связь между грибковой ин$
торами окружающей среды, во время роста и
фекцией и модификацией клеточной стенки
развития растения. Липиды способствуют обра$
(рис. 8).
зованию и запасанию энергии, а мембранные
Терпеноиды представляют собой крупней$
липиды опосредуют передачу сигналов, ассоции$
ший и наиболее разнообразный класс химиче$
рованных с реакцией на стресс [23]. Нами были
ских соединений у растений. Растения использу$
идентифицированы несколько липид$ассоци$
ют метаболиты терпеноидов для осуществления
ированных белков, которые быстро индуциру$
различных основных функций, связанных с их
ются через 24 ч после обработки растений C.
ростом и развитием. Многие терпеноиды вовле$
cassiicola. Эти результаты показали, что ранние
чены в более специализированные функции и
события в метаболизме липидов нашли отраже$
защиту от неблагоприятных абиотических и био$
ние в протеомном ответе листьев огурцов во
тических факторов окружающей среды [59]. В
время развития противогрибкового ответа.
настоящей работе было обнаружено, что
Таким образом, в настоящей работе впервые
экспрессия пирофосфатсинтазы была значи$
с помощью метода iTRAQ были изучены изме$
тельно повышена через 24 ч после инфицирова$
нения уровня экспрессии белков в листьях огур$
ния патогеном. Пирофосфатсинтаза может ка$
цов в ответ на воздействие патогена C. cassiicola.
тализировать образование пирофосфата, что яв$
Идентифицировано большое количество диф$
ляется ключевой стадией синтеза терпеноидов у
ференцированно экспрессируемых белков, вов$
растений. Через 6 ч после инокуляции возбуди$
леченных в процессы синтеза защитных белков
теля C. cassiicola, экспрессия цитохромов Р450
и метаболитов, модификации клеточной стенки
снижалась. У многих растений цитохромы P450
и передачи сигнала, что может способствовать
участвуют в процессе биосинтеза вторичных ме$
усилению защитных реакций огурца на ранних
таболитов, таких как индол$содержащие алка$
стадиях. Регулирование количества отдельных
лоиды [60], брассинолид [61] и терпеноиды [62].
кандидатных белков, выявленное с помощью
Кроме того, в условиях ассоциированного с CLS
метода iTRAQ, было также подтверждено с ис$
стресса через 6 ч поле инокуляции патогена на$
пользованием ОТ$ПЦР, подтверждена динами$
блюдалось повышение уровня экспрессии бога$
ка количественных изменений содержания ак$
того глицином белка. Глицин$богатые белки яв$
тивных форм кислорода и лигнина. Также были
ляются необходимыми структурными белками и
получены важные данные относительно сопро$
входят в состав клеточной стенки высших расте$
тивляемости растений вида C. sativus болезни
ний. Синтез и накопление этих белков в сосу$
CLS. Во$первых, в ответе устойчивых растений
дистых тканях также является частью механизма
на вторжение C. cassiicola были задействованы
защиты растений от болезней [63]. Полученные
компоненты SA$, JA$, ET$ и редокс$зависимых
результаты позволяют предположить, что быст$
сигнальных путей. Во$вторых, белки, ассоции$
рые изменения состава клеточной стенки и на$
рованные с биотическим и абиотическим стрес$
копление вторичных метаболитов являются
сом, также были индуцированы C. cassiicola, что
важными факторами устойчивости огурцов к
указывает на активацию общего антистрессово$
стрессу, вызванному патогеном.
го пути. Более того, впервые показано, что бел$
БИОХИМИЯ том 84 вып. 10 2019
СИНТЕЗ БЕЛКОВ В ИНФИЦИРОВАННЫХ C. cassiicola ЛИСТЬЯХ ОГУРЦОВ
1497
ки MLO могут участвовать в предотвращении
ных респонсивных белков способствуют более
развития CLS. В$третьих, установлено, что
лучшему пониманию взаимодействий патогена
быстрая защитная реакция устойчивых расте$
C. сassiicola и огурцов и повышению устойчивос$
ний может быть тесным образом связана с бел$
ти растений к болезням с помощью технологий
ками, чья экспрессия в значительной степени
генной инженерии и клонирования генов, тем
изменяется в результате инфицирования пато$
самым формируя основу для культивирования
геном. Быстрая активация путей обмена углево$
разновидностей огурцов, которые будут устой$
дов и вторичных метаболических путей, моди$
чивы к разным патогенам.
фикация и укрепление клеточной стенки и
настройка апопластической среды к условиям
Финансирование. Исследование было выпол$
сильного стресса являются ключевыми момен$
нено при финансовой поддержке грантами На$
тами в возникновении устойчивости к патогену.
циональной ключевой R&D программы Китая
Таким образом, полученные результаты
(2016YFD0201004).
представляют собой наиболее полное протеом$
Вклад авторов. H. Fan задумал и спланировал
ное исследование листьев огурца после обработ$
исследование, G. Yu, Y. Yu, H. Fan, D. Zhang,
ки растений патогеном C. cassiicola. Проведен$
N. Cui, X. Wang, S. Jia, Y. Yang и J. Zhao провели
ный анализ предоставляет новые сведения, что$
эксперименты, G. Yu обработал результаты и
бы лучше понять молекулярные механизмы за$
подготовил статью. Все авторы прочли и одоб$
щиты, благодаря которым огурцы становятся
рили статью.
устойчивыми к болезни CLS. Были идентифи$
Конфликт интересов. Авторы заявляют об от$
цированы дополнительные белки$мишени, ко$
сутствии конфликта интересов.
торые могут стать кандидатами для разработки
Соблюдение этических норм. Настоящая
биотехнологических подходов, направленных
статья не содержит описания каких$либо иссле$
на укрепление систем защиты против C. cassiicola.
дований с использованием людей или животных
Исследования и количественная оценка защит$
в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Gao, W., Wang, Y., and Zhang, C. (2016) Resistance iden$
able for proteomic analysis of cucumber leaves, J. Shen.
tification of different cucumber varieties to Corynespora
Agricult. Uni., 39, 365-367.
leaf spot, North. Horticult., 11, 110112.
10. Castillejo, M.A., Fernandezaparicio, M., and Rubiales, D.
2.
Zhang, M., Jin, K., Liu, L., Shao, Z., Liu, H., Hu, S.,
(2011) Proteomic analysis by two$dimensional differential
Zhu, N., Dufresne, C.P., Chen, S., and Wang, Q. (2016)
in gel electrophoresis (2D DIGE) of the early response of
Critical role of COI1$dependent jasmonate pathway in
Pisum sativum to Orobanche crenata, J. Exper. Botany, 63,
AAL toxin induced PCD in tomato revealed by compara$
107-109.
tive proteomics, Sci. Rep., 6, 28451.
11. Sacute, W., Niewski, J.R., Zougman, A., Nagaraj, N., and
3.
Abul$Hayja, Z., Williams, P.H., and Peterson, C.E. (1978)
Mann, M. (2009) Universal sample preparation method for
Inheritance of resistance to anthracnose and target leaf
proteome analysis, Nature Methods, 6, 359-362.
spot in cucumbers, Plant Dis. Rep., 62, 43-45.
12. Ashburner, M., Ball, C.A., Blake, J.A., Botstein, D.,
4.
Yang, L., Koo, D.H., Li, Y., Zhang, X., Luan, F., Havey,
Butler, H., Cherry, J.M., Davis, A.P., Dolinski, K.,
M.J., Jiang, J., and Weng, Y. (2012) Chromosome
Dwight, S.S., and Eppig, J.T. (2000) Gene ontology: tool
rearrangements during domestication of cucumber as
for the unification of biology, Nature Genetics, 25, 25-29.
revealed by high$density genetic mapping and draft
13. Gotz, S., Garciagomez, J.M., Terol, J., Williams, T.D.,
genome assembly, Plant J., 71, 895-906.
Nagaraj, S.H., Nueda, M.J., Robles, M., Talon, M.,
5.
Wen, C., Mao, A., Dong, C., Liu, H., Yu, S., Guo, Y.D.,
Dopazo, J., and Conesa, A. (2008) High$throughput func$
Weng, Y., and Xu, Y. (2015) Fine genetic mapping of target
tional annotation and data mining with the Blast2GO
leaf spot resistance gene cca 3 in cucumber, Cucumis
suite, Nucleic Acids Res., 36, 3420-3435.
sativus L., Theor. Appl. Genetics, 128, 2495-2506.
14. Kanehisa, M., Goto, S., Sato, Y., Furumichi, M., and
6.
Liu, H.W., Liang, C.Q., Liu, P.F., Luo, L.X., and Li, J.Q.
Tanabe, M. (2012) KEGG for integration and interpreta$
(2015) Quantitative proteomics identifies 38 proteins that
tion of large$scale molecular data sets, Nucleic Acids Res.,
are differentially expressed in cucumber in response to
40, 109-114.
cucumber green mottle mosaic virus infection, Virology
15. Qi, X.H., Xu, X.W., Lin, X.J., Zhang, W.J., and Chen,
J., 12, 216.
X.H. (2010) Identification of differentially expressed genes
7.
Meng, X., Song, T., Fan, H., Yu, Y., Cui, N., Zhao, J., and
in cucumber (Cucumis sativus L.) root under waterlogging
Meng, K. (2016) A comparative cell wall proteomic analy$
stress by digital gene expression profile, Genomics, 95, 160-168.
sis of cucumber leaves under Sphaerotheca fuliginea stress,
16. Wang, X., Zhang, D., Cui, N., Yang, Y., Yu, G., and Fan, H.
Acta Physiol. Plant., 38, 260.
(2018) Transcriptome and miRNA analyses of the response
8.
Wang, Y., Liu, Y., He, P., Lamikanra, O., and Lu, J. (1998)
to Corynespora cassiicola in cucumber, Sci. Reports, 8,
Resistance of Chinese vitis species to Elsinoe ampelina (de
7798.
Bary) shear, Hortsci. Publ. Am. Soc. Horticult. Sci., 33, 123-126.
17. Xue, M., and Yi, H. (2017) Enhanced Arabidopsis disease
9.
Fan, H.Y., Chen, J., Zhang, C.Y., Guo, H., and Lin, Y.
resistance against Botrytis cinerea induced by sulfur dioxide,
(2008) A two$dimensional electrophoresis protocol suit$
Ecotoxicol. Environ. Saf., 147, 523-529.
9 БИОХИМИЯ том 84 вып. 10 2019
1498
G. YU и др.
18.
Osmark, P., Boyle, B., and Brisson, N. (1998) Sequential
interaction network for Arabidopsis version AMPv2, Front.
and structural homology between intracellular pathogene$
Physiol., 1, 24.
sis$related proteins and a group of latex proteins, Plant
35.
Burkart, G.M., Baskin, T.I., and Bezanilla, M. (2015)
Mol. Biol., 38, 1243-1246.
A family of ROP proteins that suppresses actin dynamics,
19.
Spagnolo, A., Magninrobert, M., Alayi, T.D., Cilindre, C.,
and is essential for polarized growth and cell adhesion,
Schaefferreiss, C., Van, D.A., Clement, C., Larignon, P.,
J. Cell Sci., 128, 2553-2564.
Ramirezsuero, M., and Chong, J. (2014) Differential
36.
Thomas, C., and Berken, A. (2010) Structure and function
responses of three grapevine cultivars to botryosphaeria
of ROPs and their GEFs, Inegr. G Prot. Signal. Plants,
dieback, Phytopathology, 104, 1021-1035.
49-69.
20.
Pearce, G., Yamaguchi, Y., Barona, G., and Ryan, C.A.
37.
Suharsono, U., Fujisawa, Y., Kawasaki, T., Iwasaki, Y.,
(2010) A subtilisin$like protein from soybean contains an
Satoh, H., and Shimamoto, K. (2002) The heterotrimeric
embedded, cryptic signal that activates defense$related
G protein alpha subunit acts upstream of the small GTPase
genes, Proc. Nat. Acad. Sci. USA, 107, 14921-14925.
Rac in disease resistance of rice, Proc. Natl. Acad. Sci. USA,
21.
Monteiro, F., Sebastiana, M., Pais, M.S., and Figueiredo,
99, 13307-13312.
A. (2012) Reference gene selection and validation for the
38.
Verma, V., Ravindran, P., and Kumar, P.P. (2016) Plant
early responses to downy mildew infection in susceptible
hormone$mediated regulation of stress responses, BMC
and resistant Vitis vinifera cultivars, PLoS One, 8, 611-620.
Plant Biol., 16, 86.
22.
Gregory, P., Yube, Y., Guido, B., and Ryan, C.A. (2010)
39.
Lorenzo, O., Piqueras, R., Sanchezserrano, J.J., and
A subtilisin$like protein from soybean contains an embed$
Solano, R. (2003) Ethylene response factor1 integrates sig$
ded, cryptic signal that activates defense$related genes,
nals from ethylene and jasmonate pathways in plant
Proc. Nat. Acad. Sci. USA, 107, 14921-14925.
defense, Plant Cell, 15, 165-178.
23.
Fang, L., Zhang, X., Lu, C., Zeng, X., Li, Y., Fu, D., and
40.
Chivasa, S., Hamilton, J.M., Pringle, R.S., Ndimba, B.K.,
Gang, W. (2015) Non$specific lipid transfer proteins in
Simon, W.J., Lindsey, K., and Slabas, A.R. (2006) Proteomic
plants: presenting new advances and an integrated func$
analysis of differentially expressed proteins in fungal elicitor$
tional analysis, J. Exper. Botany, 66, 5663-5681.
treated Arabidopsis cell cultures, J. Exper. Botany, 57, 1553-1562.
24.
Buhot, N., Douliez, J.P., Jacquemard, A., and Marion, D.
41.
Dave, A., and Graham, I.A. (2012) Oxylipin signaling: a
(2001) A lipid transfer protein binds to a receptor involved
distinct role for the jasmonic acid precursor cis$(+)$12$
in the control of plant defense responses, FEBS Lett., 509,
oxo$phytodienoic acid (cis$OPDA), Fron. Plant Sci., 3, 42.
27-30.
42.
Foyer, C.H., and Noctor, G. (2005) Redox homeostasis
25.
Suzuki, H., Xia, Y., Cameron, R., Shadle, G., Blount, J.,
and antioxidant signaling: a metabolic interface between stress
Lamb, C., and Dixon, R.A. (2004) Signals for local and
perception and physiological responses, Plant Cell, 17, 1866-1875.
systemic responses of plants to pathogen attack, J. Exper.
43.
Orozco$Cardenas, M.L., and Ryan, C.A. (2001) Hydrogen
Botany, 55, 169-179.
peroxide acts as a second messenger for the induction of
26.
Sarowar, S., Kim, Y.J., Kim, K.D., Hwang, B.K., Ok, S.H.,
defense genes in tomato plants in response to wounding,
and Shin, J.S. (2009) Overexpression of lipid transfer pro$
systemin, and methyl jasmonate, Plant Cell, 13, 179-191.
tein (LTP) genes enhances resistance to plant pathogens
44.
Mike, P., Nighat, S., Paszkiewicz, K., Florance, H., and
and LTP functions in long$distance systemic signaling in
Smirnoff, N. (2011) The influence of ascorbate on antho$
tobacco, Plant Cell Rep., 28, 419-427.
cyanin accumulation during high light acclimation in
27.
Kim, M.C., Lee, S.H., Kim, J.K., Chun, H.J., Choi, M.S.,
Arabidopsis thaliana: further evidence for redox control of
Chung, W.S., Moon, B.C., Kang, C.H., Park, C.Y., and
anthocyanin synthesis, Plant Cell Environ., 35, 388-404.
Yoo, J.H. (2002) Mlo, a modulator of plant defense and
45.
Kawasaki, T., Koita, H., Nakatsubo, T., Hasegawa, K.,
cell death, is a novel calmodulin$binding protein. Isolation
Wakabayashi, K., Takahashi, H., Umemura, K.,
and characterization of a rice Mlo homologue, J. Biol.
Umezawa, T., and Shimamoto, K. (2006) Cinnamoyl$CoA
Chem., 277, 19304-19314.
reductase, a key enzyme in Lignin Biosynthesis, is an effec$
28.
Devoto, A., Piffanelli, P., Nilsson, I., Wallin, E.,
tor of small GTPase rac in defense signaling in rice, Proc.
Panstruga, R., Von, H.G., and Schulzelefert, P. (1999)
Natl. Acad. Sci. USA, 103, 230-235.
Topology, subcellular localization, and sequence diversity
46.
Pei, Z., Murata, Y., Benning, G., Thomine, S., Klusener,
of the Mlo family in plants, J. Biol. Chem., 274,
B., Allen, G.J., Grill, E., and Schroeder, J.I.
(2000)
34993-35004.
Calcium channels activated by hydrogen peroxide mediate
29.
Devoto, A., and Turner, J.G. (2003) Regulation of jas$
abscisic acid signalling in guard cells, Nature, 406,
monate$mediated plant responses in Arabidopsis, Ann.
731-734.
Botany, 92, 329-337.
47.
Torres, M.A., Jones, J.D., and Dangl, J.L.
(2005)
30.
Consonni, C., Humphry, M.E., Hartmann, H.A., Livaja, M.,
Pathogen$induced, NADPH oxidase$derived reactive oxy$
Durner, J., Westphal, L., Vogel, J., Lipka V., Kemmerling, B.,
gen intermediates suppress spread of cell death in
and Schulzelefert, P. (2006) Conserved requirement for a
Arabidopsis thaliana, Nat. Genet., 37, 1130-1134.
plant host cell protein in powdery mildew pathogenesis,
48.
Hardie, D.G. (1999) Plant protein serine/threonine kinases:
Nature Genetics, 38, 716-720.
classification and functions, Annu. Rev. Plant Physiol.
31.
Lorek, J., Griebel, T., Jones, A.M., Kuhn, H., and
Plant Mol. Biol., 50, 97-131.
Panstruga, R. (2013) The role of Arabidopsis heterotrimer$
49.
Lee, K.J., and Kim, K. (2015) The rice serine/threonine
ic G$protein subunits in MLO2 function and MAMP$trig$
protein kinase OsPBL1 (Oryza Sativa Arabidopsis PBS1$
gered immunity, Mol. Plant Microbe Inter., 26, 991-1003.
LIKE 1) is potentially involved in resistance to rice stripe
32.
Berken, A. (2006) ROPs in the spotlight of plant signal
disease, Plant Growth Regul., 77, 1-9.
transduction, Cell. Mol. Life Sci., 63, 2446-2459.
50.
Mayer, M.P., and Bukau, B. (2005) Hsp70 chaperones: cel$
33.
Assmann, S.M. (2004) Plant G proteins, phytohormones,
lular functions and molecular mechanism, Cell. Mol. Life
and plasticity: three questions and a speculation, Sci. Sign.,
Sci., 62, 670-684.
206, 20.
51.
Roelofs, J., Park, S., Haas, W., Tian, G., Mcallister, F.E.,
34.
Lalonde, S., Sero, A., Pratelli, R., Pilot, G., Chen, J.,
Huo, Y., Lee, B.H., Zhang, F., Shi, Y., and Gygi, S.P.
Sardi, M.I., Parsa, S.A., Kim, D.Y., Acharya, B.R., and
(2009) Chaperone$mediated pathway of proteasome regu$
Stein E.V. (2010) A membrane protein/signaling protein
latory particle assembly, Nature, 459, 861-865.
БИОХИМИЯ том 84 вып. 10 2019
СИНТЕЗ БЕЛКОВ В ИНФИЦИРОВАННЫХ C. cassiicola ЛИСТЬЯХ ОГУРЦОВ
1499
52. Cartea, M.E., Francisco, M., Soengas, P., and Velasco, P. (2011)
58. Chu, A., Dinkova, A., Davin, L.B., Bedgar, D.L., and
Phenolic compounds in Brassica vegetables, Molecules,16, 251-280.
Lewis, N.G. (1993) Stereospecificity of (+)$pinoresinol
53. Lauvergeat, V., Lacomme, C., Lacombe, E., Lasserre, E.,
and (+)$lariciresinol reductases from Forsythia intermedia,
Roby, D., and Grima$Pettenati, J. (2001) Two cinnamoyl$
J. Biol. Chem., 268, 27026-27033.
CoA reductase (CCR) genes from Arabidopsis thaliana are
59. Tholl, D. (2015) Biosynthesis and biological functions of
differentially expressed during development and in response
terpenoids in plants, Adv. Biochem. Engineer. Biotechn.,
to infection with pathogenic bacteria, Phytochemistry, 57,
148, 63-106.
1187-1195.
60. Irmler, S., Schroder, G., St$Pierre, B., Crouch, N.P.,
54. Boubakri, H., Wahab, M.A., Chong, J., Gertz, C.,
Hotze, M., Schmidt, J., Strack, D., Matern, U., and
Gandoura, S., Mliki, A., Bertsch, C., and Soustre$
Schroder, J.
(2000) Indole alkaloid biosynthesis in
Gacougnolle, I. (2013) Methionine elicits H2O2 generation
Catharanthus roseus: new enzyme activities and identifica$
and defense gene expression in grapevine and reduces plas$
tion of cytochrome P450 CYP72A1 as secologanin syn$
mopara viticola infection, J. Plant Phys., 170, 1561-1568.
thase, Plant J., 24, 797-804.
55. Xu, L., Zhu, L., Tu, L., Liu, L.L., Yuan, D.J., Jin, L.,
61. Bancos, S., Nomura, T., Sato, T., Molnar, G., Bishop,
Long, L., and Zhang, X.L. (2011) Lignin metabolism has a
G.J., Koncz, C., Yokota, T., Nagy, F., and Szekeres, M.
central role in the resistance of cotton to the wilt fungus
(2002) Regulation of transcript levels of the Arabidopsis
Verticillium dahliae as revealed by RNA$Seq$dependent
cytochrome p450 genes involved in brassinosteroid biosyn$
transcriptional analysis and histochemistry, J. Exper.
thesis, Plant Physiol., 130, 504-513.
Botany, 62, 5607-5621.
62. Fukushima, E.O., Seki, H., and Muranaka, T. (2014) Plant
56. Umezawa, T., Davin, L.B., and Lewis, N.G. (1991)
cytochrome P450s in triterpenoid biosynthesis: diversity
Formation of lignans, (-)$secoisolariciresinol and (-)$
and application to combinatorial biosynthesis, in Fifty
matairesinol with Forsythia intermedia cell$free extracts,
Years of Cytochrome P450 Research (Yamazaki, H., ed.)
J. Biol. Chem., 266, 10210-10217.
Springer, Tokyo, pp. 125-133.
57. Katayama, T., Davin, L.B., and Lewis, N.G. (1992) An
63. Mousavi, A., and Hotta, Y. (2005) Glycine$rich proteins: a
extraordinary accumulation of (-)$pinoresinol in cell$free
class of novel proteins, Appl. Biochem. Biotechnol., 120,
extracts of Forsythia intermedia: evidence for enantiospecific
169-174.
reduction of (+)$pinoresinol, Phytochemistry, 31, 3875-3881.
ANALYSIS OF PROTEIN SYNTHESIS IN CUCUMBER
LEAVES AFTER INOCULATION WITH Corynespora cassiicola:
A PROTEOMIC APPROACH
G. Yu1#, Y. Yu2#, H. Fan2,3*, D. Zhang2, N. Cui2, X. Wang1,
S. Jia2, Y. Yang2, and J. Zhao2
1 College of Horticulture, Shenyang Agricultural University,
110866 Shenyang, PR China
2 College of Bioscience and Biotechnology, Shenyang Agricultural University,
Shenyang 110866, PR China; E mail: 1997500018@syau.edu.cn
3 Key Laboratory of Protected Horticulture of Ministry of Education,
Shenyang Agricultural University, 110866 Shenyang, PR China
Received December 18, 2018
Revised May 1, 2019
Accepted June 10, 2019
Cucumber target leaf spot (TLS) disease caused by Corynespora cassiicola has become one of the most important fun$
gal foliar diseases of cultivated cucumbers. However, the defense mechanisms of cucumber plants (Cucumis sativus)
against C. cassiicola are still poorly understood. Here, proteins from resistant cucumber plants were analyzed using
iTRAQ (isobaric tags for relative and absolute quantification) method. A total of 286 differentially expressed proteins
were identified (p < 0.05, ratio > 1.2 or < 0.83) 6 and 24 h after pathogen inoculation in the resistant cultivar Jinyou
38 (the data are available via ProteomeXchange; identifier, PXD012903). Some of the early responses to C. cassiicola
infection were revealed, and four factors related to the resistance of cucumber plants to TLS were discovered. First,
the proteomic approach revealed modulation of signaling pathways in resistant cucumber plants in response to C. cas
siicola infection. Second, the plant immune system recognizes the pathogen and initiates expression of immune
response proteins, including those related to plant defense, stress response, signal transduction, cell metabolism, and
redox regulation. Third, C. cassiicola activates common stress response pathways; in particular, mildew resistance
locus O (MLO) proteins were found to play a crucial role in the TLS prevention. Fourth, rapid activation of the car$
bohydrate and secondary metabolic pathways, modification and reinforcement of cell walls, and adjustment of the
apoplastic environment to the highly stressful conditions were crucial in the cucumber resistance to TLS. Overall, our
data contribute to the understanding of interactions between plants and their pathogens and provide new insight into
molecular processes involved in the resistance of cucumber plants to disease.
Keywords: cucumber, Corynespora cassiicola, iTRAQ, defense$related proteins, qRT$PCR, histochemical staining
БИОХИМИЯ том 84 вып. 10 2019
9*