БИОХИМИЯ, 2019, том 84, вып. 11, с. 1524 - 1537
УДК 577.2.08
РАЗВИТИЕ МЕТОДОЛОГИИ АНАЛИЗА СТРУКТУРЫ РНК
И ЕЕ ПРИМЕНЕНИЕ В МОЛЕКУЛЯРНОЙ БИОЛОГИИ
И ВИРУСОЛОГИИ
Обзор
© 2019
С.К. Василенко*
ГНЦ ВБ «Вектор», 630559 р.п. Кольцово, Новосибирская обл., Россия;
электронная почта: vasilen@vector.nsc.ru, vasilenko37@yandex.ru
Поступила в редакцию 20.06.2019
После доработки 27.07.2019
Принята к публикации 05.08.2019
В обзоре рассмотрены три самостоятельных блока исследований. В первом блоке описывается открытие,
выделение, исследование специфичности РНКаз из змеиных ядов (РЗЯ) и их применение при изучении
макроструктуры РНК. Было установлено, что РЗЯ неспецифичны к первичной структуре РНК, но специ%
фичны к спиральной конформации субстрата независимо от способа его образования: двойная спираль,
одиночная или гибридная. РЗЯ гидролизуют РНК до коротких олигомеров с 5’%концевым фосфатом. На
примере исследования кинетики и анализа продуктов гидролиза тРНК показаны возможности РЗЯ в иссле%
дованиях макроструктуры РНК. Во втором блоке рассматривается реализация сформулированного автором
принципа анализа первичной структуры нуклеиновых кислот и описывается метод прямого секвенирова%
ния РНК, в создании которого автор принимал участие. В третьем блоке рассмотрены результаты геноти%
пирования и этиологического контроля эпидемических вирусов гриппа А, циркулировавших на территории
СССР с 1968%го по 1992%й гг. Разработанный метод сравнительного анализа первичных структур геномов
вирусных изолятов позволил выявить и охарактеризовать эпидемические штаммы вируса гриппа, появив%
шиеся в циркуляции вследствие реактивации инактивированных вакцин.
КЛЮЧЕВЫЕ СЛОВА: змеиные яды, рибонуклеаза, РНК, макроструктура, первичная структура, молеку%
лярная вирусология.
DOI: 10.1134/S0320972519110010
Предложение опубликовать в юбилейном
евич Северин, выдающийся ученый и прекрас%
номере журнала «Биохимия» результаты моей
ный педагог. Мне крупно повезло, что я прошел
более, чем полувековой, научной деятельности я
обучение на кафедре, руководимой С.Е. Севе%
воспринял с большой благодарностью, посколь%
риным. Помню первое наше знакомство с ка%
ку считаю, что своим биохимическим образова%
федрой и преподавательским составом. Мне за%
нием и подготовкой к самостоятельным иссле%
помнилась вступительная лекция Сергея Ев%
дованиям я, в первую очередь, обязан своей
геньевича, в которой он обрисовал перспективу
Alma mater - кафедре биохимии биологическо%
нашего обучения. Как я понял, главной мыслью
го факультета МГУ, в который я поступил в
лекции было то, что невозможно за столь корот%
1954 г., сразу после окончания средней школы в
кий срок подготовить законченного, квалифи%
Костроме. Со второго курса я был зачислен на
цированного специалиста. Задача университет%
кафедру биохимии животных. В то время еще
ского курса и, в частности, кафедры - привить
были живы и трудились профессора и препода%
студентам базовые знания и эксперименталь%
ватели, которые получали образование до рево%
ные навыки, которые должны помочь им пра%
люции и в своем служении опирались на тради%
вильно ориентироваться в начале трудовой дея%
ции, заложенные отцами российской биологии.
тельности. Казалось, Сергей Евгеньевич мало
Наиболее ярким представителем «старой гвар%
занимался младшими курсами, хотя и был в кур%
дии» факультета был тогда основатель кафедры
се всех житейских ситуаций кафедры. С нами, в
биохимия животных профессор Сергей Евгень%
основном, занимались сотрудники кафедры,
которые очень внимательно и строго следили за
* Автор является выпускником кафедры биохимии биоло%
лабораторной практикой закрепленных за ними
гического факультета МГУ им. М.В. Ломоносова.
студентов. Эту строгость я испытал на себе. Не
1524
МЕТОДОЛОГИЯ АНАЛИЗА СТРУКТУРЫ РНК И ЕЕ ПРИМЕНЕНИЕ
1525
помню уже, что это был за эксперимент, над ко%
бонуклеиновых кислот. При распределении ро%
торым я работал целую неделю и получил хоро%
лей и тематик будущих исследований мне доста%
шие результаты. При приемке оказалось, что я
лись (почти по жребию) разработка методоло%
по небрежности завысил температуру опыта на
гии анализа нуклеотидной последовательности
несколько градусов. Это завышение никак не
в полирибонуклеотидах (в то время умели опре%
повлияло на конечный результат, но тем не ме%
делять только нуклеотидный состав нуклеино%
нее меня заставили снова повторить все с нача%
вых кислот, а об их первичной структуре еще
ла при нужной температуре. Сгоряча я посчитал
только мечтали) и далее подготовить необходи%
это придиркой, но со временем оценил муд%
мый для этого инструментарий, куда в первую
рость такого решения. Этот инцидент я запом%
очередь входил набор рибонуклеаз и фосфоди%
нил на всю жизнь и незаметно для себя изменил
эстераз (ФДЭ) с различной специфичностью.
свое отношение к чистоте выполнения экспери%
Д.Г. Кнорре посоветовал обратить особое вни%
ментов. Высокий уровень владения выпускни%
мание на ФДЭ из змеиных ядов - фермент, по%
ками кафедры биохимии МГУ техникой экспе%
следовательно отщепляющий монорибонуклео%
римента неоднократно отмечался российскими
тиды с 3’%конца полинуклеотида. Как он пола%
и зарубежными специалистами.
гал, кинетический анализ конечных продуктов
Со старшекурсниками С.Е. Северин работал
гидролиза РНК этим ферментом может дать по%
достаточно плотно, регулярно участвуя в об%
лезную информацию об очередности нуклеоти%
суждении хода выполнения курсовых и дип%
дов в цепи. Вскоре я отправился за змеиными
ломных работ, которые он чаще критиковал
ядами в Ташкент и привез оттуда образцы ядов
(иногда довольно жестко), чем хвалил. Часто он
пяти видов змей. С этого начались растянувши%
неожиданно переходил к темам, не связанным с
еся на многие годы исследования возможностей
предметом семинарского обсуждения. Помню
нуклеаз змеиных ядов в исследованиях структу%
начатый им разговор о роли мировоззрения в
ры РНК.
формировании естествоиспытателя. В другой
Исследование РНКаз из змеиных ядов мы
раз была лекция о роли этики в общении между
проводили с перерывами с 1963%го по 1982%й гг.
людьми. Многие из нас и слов таких не знали.
Большинство исследований было выполнено в
Следует помнить, что это был 1958 год, и стра%
моей лаборатории в Новосибирском институте
жи идеологии были еще в силе, да и прочитать
биоорганической химии СО АН СССР и после
об этом было негде. Позже я понял, что Сергей
моего перехода - в Новосибирском институте
Евгеньевич готовил нас к самостоятельной тру%
молекулярной биологии Главмикробиопрома.
довой деятельности и расставлял акценты и по%
РНКазы были обнаружены во всех тестирован%
веденческие маркеры. Эти беседы Сергея Ев%
ных ядах среднеазиатских змей. Исследование
геньевича для меня были бесценными, в труд%
ферментативных свойств РНКаз выявило их
ные минуты его заветы помогали мне находить
уникальную специфичность к спиральной кон%
решения как научных, так и житейских проб%
формации субстрата. Ферменты с такой специ%
лем. На последнем курсе С.Е. Северин предло%
фичностью были описаны нами впервые, и уже
жил быть руководителем моей дипломной ра%
более полувека они остаются уникальными,
боты. Естественно, я с радостью согласился.
поскольку РНКазы с такой специфичностью
Мне была предложена поисковая тема, в кото%
больше не были обнаружены. К сожалению,
рой на основе косвенных данных предполага%
статьи, обобщающей всю накопленную инфор%
лось исследовать возможное влияние паращи%
мацию, написано не было, поэтому я воспользо%
товидной железы на окислительное фосфори%
вался возможностью исправить этот недостаток
лирование. Нам удалось подтвердить высказан%
в настоящем обзоре. Крайне интересными и во
ное предположение, и защита диплома прошла
многом парадоксальными оказались результаты
успешно. Я вправе считать себя учеником
исследования кинетики гидролиза природных
С.Е. Северина, поскольку испытал на себе его
РНК РНКазами змеиных ядов. Эта информация
большое влияние, и память о нем пронес через
также изложена подробно, поскольку получен%
многие годы.
ные данные послужили основой для использо%
По завершении учебы в МГУ меня распреде%
вания РНКаз в исследованиях пространствен%
лили в Новосибирский институт органической
ной структуры РНК и их специфических ком%
химии Сибирского отделения АН СССР в лабо%
плексов с белками.
раторию, тогда еще кандидата химических наук,
Результаты наших исследований в свое вре%
Д.Г. Кнорре. На собрании лаборатории долго
мя были доложены на научных конференциях,
выбирали направление наших будущих исследо%
опубликованы в центральных научных журна%
ваний и пришли к выводу, что лучше всего за%
лах, получили признание в научном мире и за%
няться исследованием первичной структуры ри%
метно повлияли на формирование представле%
БИОХИМИЯ том 84 вып. 11 2019
1526
ВАСИЛЕНКО
ний о структурной организации РНК и РНП. В
ОБНАРУЖЕНИЕ, ХАРАКТЕРИЗАЦИЯ
настоящее время они стали частью истории био%
И ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
логической науки. В связи с этим я решил не
РИБОНУКЛЕАЗ ИЗ ЗМЕИНЫХ ЯДОВ
вносить в обзор довольно обширный блок ис%
следований, связанный с участием РНКаз из
Обнаружение и общая характеристика РНКаз
змеиных ядов в изучении макроструктуры спе%
из змеиных ядов. При сравнительном анализе
цифических комплексов тРНК с аминоацил%
фосфодиэстеразной активности ядов несколь%
тРНК%синтетазами и с фактором элонгации
ких видов змей было обнаружено, что в разных
EF%Tu, а также работы по изучению макрост%
ядах скорость расщепления бис%(пара%нитрофе%
руктуры бактериальных рибосом. При желании,
нил)фосфата не коррелирует со скоростью рас%
с материалами можно познакомиться в научных
щепления природных РНК. Это послужило ос%
публикациях, изданных в то время [1-5]. Из
нованием для предположения существования в
всего объема информации этого блока в обзоре
змеиных ядах, наряду с фосфодиэстеразами,
отмечены только данные, имевшие в то время
также и эндонуклеаз, не тестируемых реакцией с
приоритетное значение.
синтетическим субстратом. При последующем
Рис. 1. Хроматографические профили выделения РНКаз из змеиных ядов. а - Щитомордника, б - гюрзы, в - кобры;
1 - гель%хроматография на сефадексе G%75 (3,0 × 120 см), 2 - рехроматография РНКазных фракций на SE%целлюлозе
(1,0 × 60 см). Сплошная линия - поглощение при 280 нм; штриховая - ФДЭ активность; штрихпунктирная - РНКазная
активность
БИОХИМИЯ том 84 вып. 11 2019
МЕТОДОЛОГИЯ АНАЛИЗА СТРУКТУРЫ РНК И ЕЕ ПРИМЕНЕНИЕ
1527
Рис. 2. Сравнение кинетических кривых гидролиза РНКазой из яда кобры: а - poly(U), б - poly(G), в составе двойной
спирали (1) и в свободном виде (2)
хроматографическом анализе ядов пяти видов
тами предельного РНКазного гидролиза поли%
змей во всех случаях удалось обнаружить у них
рибонуклеотидов были короткие олигорибонук%
эндорибонуклеазную активность и количест%
леотиды с фосфатным остатком на 5’%конце мо%
венно отделить ее от фосфодиэстеразной. В
лекулы [10, 11]. РНКазы V1 оказались неспеци%
дальнейших исследованиях были использованы
фичными к первичной структуре РНК. ДНКаз%
яды гюрзы (Vipera lebetina), кобры (Naja naja oxi%
ная активность РНКазы V1 была приблизитель%
ana) и щитомордника (Agquistradon Palassii), пос%
но в 600 раз ниже РНКазной, что может быть
кольку они, с одной стороны, содержали наи%
связано с наличием примесей ДНКаз в препара%
большее количество фермента, а с другой сторо%
те фермента. За исключением молекулярных
ны, такой выбор источников давал возможность
масс РНКазы V1 из разных источников по фер%
сравнивать свойства нуклеаз из ядов змей, отно%
ментативным свойствам были практически
сящихся к разным таксономическим группам.
идентичными.
Разработанная нами процедура выделения из
Специфичность РНКаз змеиных ядов к макро@
ядов РНКаз и фосфодиэстераз заключалась в их
структуре полирибонуклеотидов. Специфичность
последовательном фракционировании гель%
РНКаз к гомополирибонуклеотидам. Несмотря на
фильтрацией на сефадексе G%75 и хроматогра%
отсутствие специфичности РНКаз V1 к природе
фией на SE%целлюлозе (рис. 1) [6-9].
азотистых оснований, скорости гидролиза ими
Препараты РНКаз были очищены (100-400)×
синтетических гомополирибонуклеотидов су%
и полностью освобождены от интерферирую%
щественно различались и убывали в ряду
щих примесей. РНКазная активность в яде коб%
poly(A), poly(C), poly(I), poly(U), а poly(G) была
ры была выше, чем в ядах гюрзы и щитомордни%
практически устойчива к гидролизу. Такие раз%
ка, соответственно, в 15-20 и в 5-10 раз. Опти%
личия в чувствительности РНКазы V1 к разным
мум рН РНКаз находился в пределах значений
гомополимерам объясняли влиянием вторич%
7,6-8,0, молекулярные массы ферментов, изме%
ной структуры, конформация и стабильность
ренные SDS%электрофорезом, соответствовали
которой, как известно, определяется природой
величинам 17 кДа - у гюрзы и кобры и 35 кДа -
азотистого основания. Подтверждение такого
у щитомордника. Установлено также, что у коб%
предположения было получено при сравнении
ры и гюрзы активная форма ферментов состоит
скоростей гидролиза poly(U) и poly(G) в свобод%
из двух одинаковых субъединиц, частично дис%
ном виде и в составе комплементарной двойной
социирующих в условиях гель%хроматографии.
спирали. Как показано на рис. 2, в комплексе с
РНКазы из ядов змей, зарегистрированные
poly(A) скорость гидролиза poly(U) возрастала
как РНКазы V1, были охарактеризованы, как
~10×, а скорость гидролиза poly(G) в комплексе
металлозависимые РНК%гидролазы, активируе%
с poly(C) была одинаковой со скоростью гидро%
мые ионами магния, и ингибируемые ионами
лиза poly(C). Ответ на вопрос, в какой мере спи%
цинка и меди, меркаптосоединениями и хелати%
ральная конформация субстрата обязательна
рующими агентами [7-9]. Конечными продук%
для его гидролиза РНКазы V1, был получен при
БИОХИМИЯ том 84 вып. 11 2019
1528
ВАСИЛЕНКО
ционно при еще мало изученном промежуточ%
ном состоянии макроструктуры синтезируемой
цепи РНК, РНКазы V1 отличаются тем, что для
реализации их активности требуется только
спиральная конформация атакуемого участка
цепи РНК. Условно, РНКазу из змеиного яда
можно считать вырожденной РНКазой процес%
синга. Можно предположить, что ферменты та%
кой специфичности не соответствуют и даже
противоречат общей структуре метаболизма и
могут существовать только в антиметаболичес%
ких системах.
Специфичность РНКаз к природным полирибо
нуклеотидам. Цепи природных РНК в отличие
от монотонной вторичной структуры гомополи%
рибонуклеотидов организованы в сложные
трехмерные образования с чередующимися спи%
ральными и петлевыми участками. Выяснение
влияния макроструктуры РНК на специфич%
ность РНКазы из яда кобры важно как для ана%
лиза макрокроструктуры самой РНК, так и для
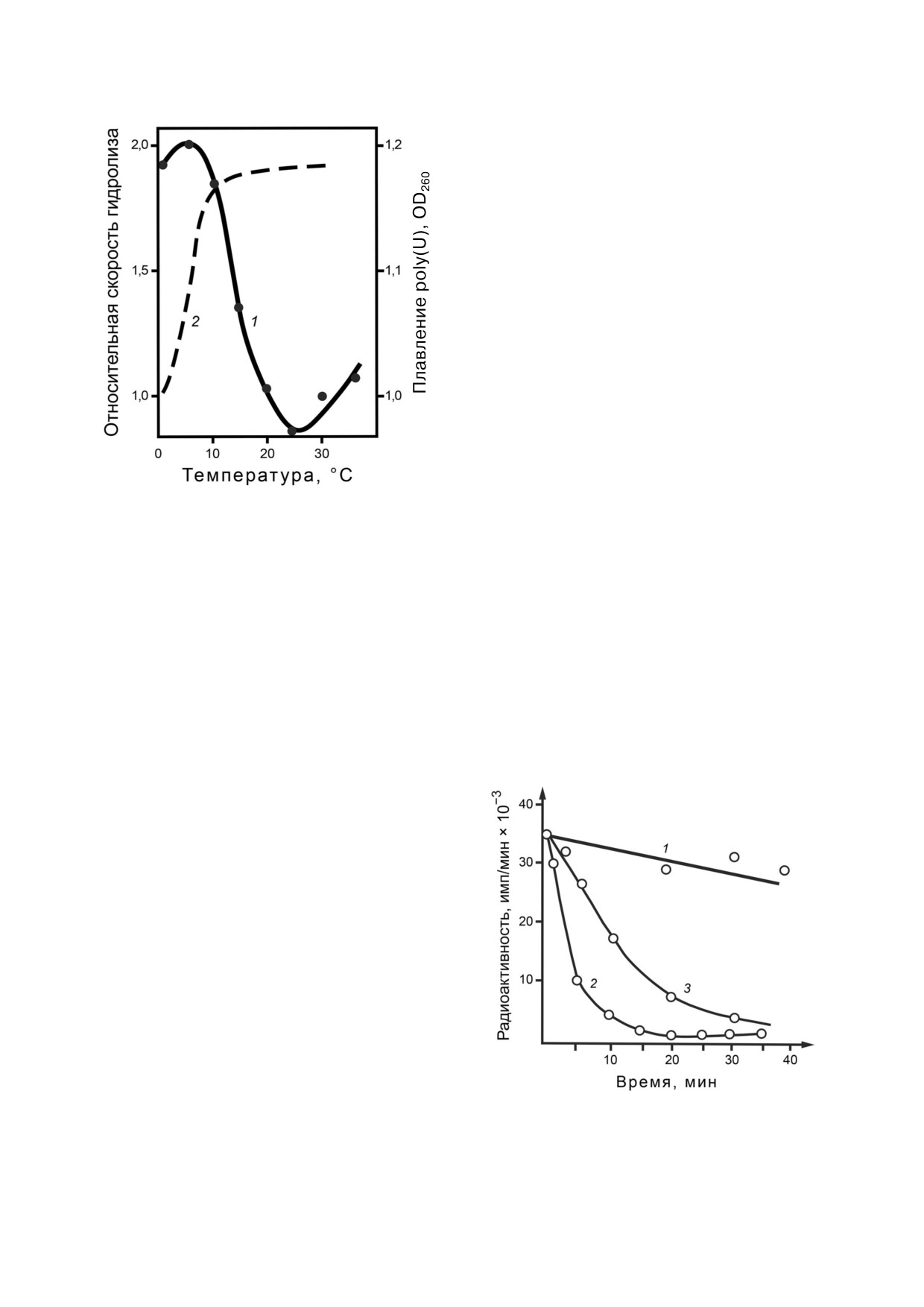
Рис. 3. Зависимость относительной скорости гидролиза
макроструктуры РНП%комплексов. При иссле%
poly(U) от температуры (1), кривая плавления poly(U) (2)
довании продуктов начальных стадий гидролиза
РНК фага MS%2, меченого на 3’%конце методом
исследовании зависимости скорости гидролиза
ферментативного лигирования 32P, была показа%
poly(U) от температуры. Как показано на рис. 3,
на высокая избирательность РНКаз к конкрет%
в определенном температурном интервале вы%
ным участкам цепи РНК. Так, места разрывов
полняется обратная зависимость между ско%
цепи оставались практически неизменными при
ростью гидролиза и температурой реакции. Та%
всех исследованных глубинах гидролиза, что
кая зависимость, необычная для традиционных
указывает на сохранение целостности макро%
представлений термодинамики ферментатив%
структуры РНК на ранних стадиях гидролиза.
ных реакций, становится объяснимой только
Сравнение высокочувствительным методом
при допущении, что непосредственному гидро%
нуклеазных разрывов цепи РНК РНКазы V1
лизу фосфодиэфирной связи в месте его непос%
кобры, гюрзы и щитомордника подтвердило
редственного контакта с ферментом должна
полную идентичность их специфичности. Это
предшествовать стадия преобразования участка
poly(U) в спиральную конформацию [12, 13].
Субстратные свойства гибридных спиралей
РНК-ДНК были изучены на примере гидроли%
за 32Р%радиоактивных транскриптов. Как пока%
зано на рис. 4, РНК в составе гибридной спира%
ли деградировала даже быстрее, чем сама РНК.
Способность РНКазы V1 гидролизовать РНК в
составе гибридной спирали может лишний раз
свидетельствовать о том, что фермент специфи%
чен к спиральной конформации полирибонук%
леотида независимо от способа ее образования
(двойная, гибридная или однотяжевая спираль).
Учитывая такую специфичность фермента,
можно предположить, что петлевые участки
РНК, которые не могут принять спиральную
конформацию в силу фиксированного положе%
ния их концов, должны быть устойчивы к гид%
ролизу. Такая специфичность РНКаз к спираль%
ной структуре РНК была описана нами впервые.
Рис. 4. Кривые гидролиза ДНК-РНК гибридных спира%
От своих ближайших аналогов, клеточных
лей: 1 - РНКазой А, 2 - РНКазой из яда кобры, 3 - кривая
РНКаз процессинга, работающих котранскрип%
гидролиза свободной РНК РНКазой из яда кобры
БИОХИМИЯ том 84 вып. 11 2019
МЕТОДОЛОГИЯ АНАЛИЗА СТРУКТУРЫ РНК И ЕЕ ПРИМЕНЕНИЕ
1529
дает все основания считать РНКазы функцио%
ем ее третичной структуры и предположили,
нально значимыми компонентами змеиных
что нативные тРНК по субстратным свойствам
ядов, хотя сами по себе они не считаются токси%
отличаются от промежуточных продуктов их
нами.
гидролиза. Это предположение было подтверж%
Биологическая роль РНКаз змеиных ядов
дено при исследовании влияния на гидролиз
остается непонятной. Во%первых, все субстраты
тРНК ее свежих добавок в ходе реакции. Как
этих ферментов могут находиться только внутри
показано на рис. 5, дополнительное введение в
клеток. Следовательно, фермент должен прео%
среду исходной тРНК на стадии ускорения ре%
долеть клеточную мембрану, не нарушая ее це%
акции приводит к немедленному снижению
лостности, что представляется достаточно проб%
скорости гидролиза до начальной. Такая зави%
лематичным. Из всех умозрительных гипотез
симость свидетельствует, с одной стороны, о
наиболее реальной мне представляется предпо%
повышенном сродстве РНКазы V1 к нативной
ложение, что РНКазы могут быть предназначе%
тРНК, а с другой - указывает на то, что стаби%
ны для блокирования иммунного ответа орга%
лизация фермент%субстратного комплекса сопро%
низма на змеиные яды. Можно предположить,
вождается снижением скорости гидролиза. Уве%
что РНКаза садится на один из рецепторов им%
личение стабильности тРНК-РНКазного
мунной клетки, и с его помощью интернируется
комплекса мы объяснили снижением энтро%
в цитоплазму, где закрепляется на мембране яд%
пийного фактора за счет более жесткой кон%
ра и начинает разрушать выходящие из ядра
формации нативной тРНК по сравнению с про%
мРНК, блокируя тем самым участие клетки в
дуктами ее гидролиза. Такое объяснение предс%
формировании иммунитета.
тавляется вполне естественным, если предпо%
Кинетические особенности гидролиза РНКа
ложить наличие в молекуле фермента области
зами из змеиных ядов транспортных РНК. Рас%
первичного связывания субстрата, отличной от
смотренная выше высокая избирательность
каталитического центра. Было сделано предпо%
РНКазы V1 к спиральным структурам РНК отк%
ложение, что такие центры есть в РНКазе III из
рывала новые возможности топографического
Escherichia coli [14]. Ограниченная подвижность
анализа спиральных элементов в их молекуле. К
РНКазы относительно тРНК в его первичном
началу наших исследований в этом направле%
комплексе может стать причиной затруднения
нии исследователи располагали только РНКаза%
перехода в компетентный гидролизу комплекс,
ми, специфичными к неспиральным петлевым
что и выражается в замедлении начальной ско%
участкам РНК, которые обычно занимают
рости гидролиза тРНК. Если принять, что внут%
меньше половины полинуклеотидной цепи
ренняя подвижность молекулы субстрата и ста%
РНК. Многочисленные исследования, в кото%
бильность фермент%субстратного комплекса
рых пытались определять области контакта
находятся в обратной корреляции, то его наи%
РНК с белками%лигандами, показали только,
более стабильные варианты должны реализо%
что петлевые участки не участвуют в формиро%
ваться, прежде всего, при взаимодействии фер%
вании специфических сайтов. Второй недоста%
мента с максимально фиксированными эле%
ток петлевых зон РНК связан с тем, что разрыв
ментами третичной структуры тРНК, что, в
цепи в петле, в отличие от разрыва цепи в спи%
свою очередь, должно привести к ограничению
ральной области РНК, приводит к более быст%
набора ФДЭ%связей, первично атакуемых фер%
рому снижению стабильности макроструктуры
ментом. Подтверждение этого предположения
РНК и к потере нативной конформации. При%
было получено при исследовании топографии
чина такого различия заключается в том, что
первичных РНКазных разрывов в цепях у девя%
разрыв связи в петле приводит к переходу мало%
ти разных тРНК: фенилаланиновой, валино%
подвижного петлевого участка в высокоподвиж%
вой, аспарагиновой и триптофановой из дрож%
ные концевые фрагменты, в то же время, при
жей, фенилаланиновой, метиониновой, глюта%
разрывах цепи внутри спирали ее конформация
миновой и триптофановой из E. coli и трипто%
может сохраняться.
фановой - из печени быка [1-4, 15, 16]. При
При исследовании гидролиза РНКазами V1
наложении разрывов, образующихся в процессе
природных РНК было обнаружено, что гидро%
гидролиза исследуемых тРНК на соответствую%
лиз проходит с автоускорением реакции. Такой
щие модели макроструктуры, показано, что все
феномен наблюдался впервые. Наиболее замет%
они, без исключения, расположились в спи%
но этот феномен проявился при гидролизе
ральных участках. В отличие от однозначно ад%
транспортных РНК, его скорость возрастала в
ресованных разрывов в центральной части мо%
3-4 раза после начальных разрывов нескольких
лекулы, 3’%конец тРНК атакуется ферментом
ФДЭ%связей (рис. 5). Причину необычной ки%
по пяти ФДЭ%связям, расположенным рядом,
нетики гидролиза тРНК мы объяснили влияни%
что, по%видимому, связано с повышенной гиб%
БИОХИМИЯ том 84 вып. 11 2019
1530
ВАСИЛЕНКО
РАЗРАБОТКА МЕТОДОЛОГИИ АНАЛИЗА
ПЕРВИЧНОЙ СТРУКТУРЫ РНК
В 1963 году на рабочем совещании, посвя%
щенном проблемам расшифровки нуклеотид%
ной последовательности тРНК, я предложил
новый подход к расшифровке нуклеотидной
последовательности в олигонуклеотидах. Суть
предложения заключалась в следующем: про%
дукты неполного гидролиза олигонуклеотида
фосфодиэстеразой змеиного яда, которая по%
следовательно отщепляет
5’%нуклеотиды с
3’%конца молекулы субстрата, разделяются ионо%
обменной хроматографией по молекулярным
массам в условиях, когда олигонуклеотиды вы%
ходят с колонки в порядке нарастания их поли%
мерности с шагом в один нуклеотид. Последую%
Рис. 5. Кинетические кривые гидролиза poly(A) (1) и дрож%
жевой тРНК (2). 3 - Кинетические кривые гидролиза
щий 3’%концевой анализ промежуточных про%
РНКазой из яда кобры. На кривой гидролиза тРНК стрел%
дуктов (при их щелочном гидролизе 3’%конец
кой отмечено время добавления в реакционную смесь све%
жей порции тРНК
переходит в нуклеозид) должен определить всю
нуклеотидную последовательность в олигонук%
леотиде [18]. Мое предложение было одобрено
костью этого участка тРНК. Измерение радио%
участниками совещания, которые поддержали
активности показало, что на ранних стадиях
наше предложение выполнять эту работу сов%
гидролиза на акцепторный стебель приходится
местно с ИХПС (позже Институт биоорганичес%
~80% всех разрывов. Помимо акцепторного
кой химии) АН СССР. Индивидуальных РНК
стебля общими для всех тРНК оказались разры%
тогда у нас еще не было, и для получения мо%
вы в антикодоновом стебле в положениях 28-30
дельного олигонуклеотида пришлось использо%
и 41-43. Остальные спиральные участки были
вать суммарную РНК, гидролизат которой
достаточно устойчивы к гидролизу. Разрывы
РНКазой А фракционировали хроматографией
связей в D%стебле в положении 13 обнаружены
в 7М мочевине. Суммарную пентануклеотид%
только у тРНКPhe, у тРНКTrp из всех трех источ%
ную фракцию рехроматографировали в кислой
ников разрывы РНКазой акцепторного стебля
среде. Для дальнейших исследований была
проходили только по положениям 65 и 69.
выбрана фракция с нуклеотидным составом
На основе этих данных нами был предложен
2G2A1C. На выделение и очистку пентарибо%
механизм образования фермент%субстратного
нуклеотида ушло ~2 месяца и всего несколько
комплекса. Фермент связывается центром пер%
дней - на определение его первичной структу%
вичного взаимодействия с наименее подвиж%
ры [19]. На несколько месяцев раньше нашей
ной центральной частью тРНК, а его каталити%
идентичная по замыслу работа вышла из лабо%
ческий центр при этом может взаимодейство%
ратории Холли. В этой лаборатории методом
вать только с ближайшими к месту первичного
противоточного распределения уже было выде%
связывания участками. Чем подвижнее эти
лено несколько индивидуальных тРНК, и бла%
участки, тем больше может возникнуть вариан%
годаря новому способу секвенирования олиго%
тов компетентного гидролизу комплекса [17].
нуклеотидов им удалось достаточно быстро ус%
В поддержку такого механизма свидетельствует
тановить первичную структуру аланиновой
расположение атакуемых РНКазой связей на
тРНК. Это была первая первичная структура
третичной структуре тРНК вокруг центральной
природной РНК. За эту работу в 1968 г. Холли
вогнутой части молекулы в радиусе 20-25 Å.
получил Нобелевскую премию. В появившихся
Следует отметить, что некоторые результаты
вскоре работах по модификации метода хрома%
наших исследований не потеряли своего значе%
тография была заменена на двумерный элект%
ния и сегодня. В первую очередь это касается
рофорез в полиакриламидном геле, что сущест%
самой рибонуклеазы из змеиных ядов, которая
венно упростило процедуру реализации метода,
до сих пор не имеет аналогов и остается един%
который стал общепринятым. Сформулирован%
ственным ферментом, способным тестировать
ный нами и группой Холли принцип впослед%
спиральные области в структуре РНК, не на%
ствии лег в основу широко известного химичес%
рушая при этом ее пространственной структу%
кого метода секвенирования ДНК Максама и
ры.
Гилберта.
БИОХИМИЯ том 84 вып. 11 2019
МЕТОДОЛОГИЯ АНАЛИЗА СТРУКТУРЫ РНК И ЕЕ ПРИМЕНЕНИЕ
1531
Вскоре моей группе пришлось сменить тема%
дежной, поскольку была собрана из многократ%
тику и переключиться на исследование свойств
но испытанных блоков. Не ясными оставались
РНКаз из змеиных ядов и на выделение индиви%
два момента: предельная длина фрагментов,
дуальных тРНК. Потребность в прямом секве%
способных циклизоваться лигазой и влияние на
нировании РНК возникла снова после того, как
циклизацию остаточной вторичной структуры
мы начали заниматься молекулярной вирусоло%
гидролизата. Второй способ был проще первого,
гией РНК%содержащих вирусов. Существовав%
но имел больше неопределенностей. Предпола%
шие в то время методы секвенирования РНК
галось провести мягкий химический гидролиз
страдали общим недостатком: необходимый для
примерно в 2-4 разрыва на молекулу РНК и за%
анализа гидролиз РНК был ферментативным и
тем, с помощью полинуклеотид фосфокиназы
проходил в условиях, при которых вторичная и
присоединить 32Pi к освободившимся при гидро%
третичная структуры РНК серьезно препятство%
лизе 5’%гидроксилам. После этого радиоактив%
вали достижению равномерной фрагментации
ную реакционную смесь предполагалось разде%
ее цепи. Оптимальную для анализа равномер%
лить электрофорезом в полиакриламидном геле,
ность фрагментации цепи удавалось получить
радиоактивные фракции вырезать из геля, под%
только при гидролизе РНК в денатурирующих
вергнуть щелочному гидролизу и разделить
условиях химическими способами. С другой
электрофорезом. Идентификация проявленных
стороны, при химическом способе фрагмента%
радиоактивных пятен определяется по их элект%
ции РНК непросто выстроить продукты гидро%
рофоретической подвижности, а порядок нук%
лиза в порядке, соответствующем нуклеотидной
леотидов в цепи РНК соответствует порядку ра%
последовательности. При анализе перспективы
диоактивных полос в полиакриламидном геле.
разработки полноценного метода прямого сек%
До экспериментальной проверки рассмотрен%
венирования РНК мы пришли к выводу, что ус%
ная схема нового способа секвенса РНК пред%
пех станет возможным только при выполнении
ставлялась мне чисто гипотетической, и я до кон%
сразу обоих условий: равномерность фрагмента%
ца не был уверен в ее реальности. Вскоре я по
ции цепи РНК в сочетании с надежным спосо%
приглашению отправился на полгода во Фран%
бом концевого анализа продуктов ее деграда%
цию, в Страсбургский институт молекулярной и
ции. Первоначально нами рассматривалось два
клеточной биологии. Там я познакомился с анг%
независимых способа секвенирования РНК.
лийским биохимиком Джоном Стэнли, кото%
Согласно первому варианту предполагалось
рый заканчивал стажировку и был относительно
ввести с помощью полинуклеотидкиназы радио%
свободен. Я поделился с ним своей идеей и
активный P32 фосфат в 5’%конец РНК и затем
предложил ему проверить ее на практике. После
провести ее частичный гидролиз 5’%эндорибо%
некоторых раздумий и колебаний он согласил%
нуклеазой совместно с ФДЭ змеиного яда таким
ся, за два дня составил детальный план, распи%
образом, чтобы распределение разрывов по це%
санный по дням, собрал все необходимые при%
пи было, по мере возможности, равномерным.
боры и реактивы, обсудил со мной неясные для
После этого гидролизат следовало обработать
него моменты и приступил к реализации наших
Т4РНК%лигазой, которая сшивает неспираль%
замыслов. Следует отметить, что в институте
ные фрагменты РНК внутримолекулярно, за%
уже в течение 10 лет занимались структурным
мыкая их в кольца. При кольцевой форме фраг%
анализом нуклеиновых кислот, и все необходи%
мента РНК 5’%концевой P32 фосфат переходит в
мые нам для работы приборы и реактивы уже
фосфодиэфирную связь и становится устойчи%
были в наличии, что очень облегчило нашу зада%
вым к фосфатазе. После удаления фосфатазой
чу. В то время я был плотно занят своей основ%
5’%Pi фосфатных остатков у не участвовавших в
ной работой и несколько отошел от наших за%
циклизации фрагментов РНК гидролизат нужно
мыслов. Каково же было мое удивление, когда
фракционировать электрофорезом в акрил%
ровно через две недели после начала работы по%
амидном геле. Положение на электрофореграм%
явился сияющий Джон с проявленной рентге%
ме радиоактивных полос будет соответствовать
новской пленкой, усыпанной черными пятна%
положению нуклеотида в цепи РНК, а природа
ми. Мы тут же начали читать по пятнам первич%
нуклеотида будет определяться по идентифика%
ную структуру тРНКPhe Bacillus steatermophilus,
ции радиоактивного нуклеотида в щелочном
взятую в работу, и сравнивать ее с уже известной
гидролизате элюированного из геля фрагмента.
структурой тРНКPhe Bacillus steatermophilus. Не%
Это происходит потому, что при циклизации
вероятно, но получилось полное совпадение
фрагмента РНК и последующем его щелочном
структур, и для этого понадобилось всего 5 мкг
гидролизе радиоактивный фосфат переходит на
тРНК, почти в миллион раз меньше, чем мы
3’%концевой нуклеотид исходного фрагмента.
предполагали в 1962 году! Наш успех сразу стал
Предложенная схема метода представлялась на%
известен всему институту. Джон в течение двух
БИОХИМИЯ том 84 вып. 11 2019
1532
ВАСИЛЕНКО
дней подробно объяснял всем, что к чему. Вско%
контакт с ФДЭ%связью. Известно, что стабиль%
ре он написал статью и улетел в Лондон догова%
ность комплекса находится в обратной корре%
риваться о ее публикации в журнале Nature. Там
ляции с его подвижностью. В нашем случае теп%
ему обещали опубликовать статью в ближайшее
ловая подвижность ФДЭ%связей напрямую свя%
время. Действительно, она вышла в июльском
зана с подвижностью полинуклеотидной цепи.
номере 1978 года, через четыре месяца после по%
В центре полинуклеотидной цепи разрыв вооб%
лучения нами первых результатов [20]. Метод
ще может стать невозможным. Поэтому на на%
был испробован в нескольких лабораториях и
чальных стадиях гидролиза происходит точеч%
получил полное подтверждение. Он нашел при%
ный гидролиз преимущественно исходных мо%
менение при анализе первичной структуры
лекул РНК. Свидетельством в пользу предло%
РНК, из%за третичной структуры которой бло%
женной гипотезы может служить феномен: на
кировалась транскрипция. К таким участкам
обоих концах молекулы РНК участки длиной в
РНК относятся, например, некоторые области
13 нуклеотидов имели только по одному пятну
РНК вирусов и вироидов. Метод появился неза%
на каждый нуклеотид. Из этого следует, что
долго до создания первых секвенаторов нуклеи%
тринадцатичленные фрагменты уже не способ%
новых кислот. Автоматы быстро обесценили
ны к повторному гидролизу в используемых ус%
практически все ручные методы. Это затронуло
ловиях. Ближайшие к концам молекулы разры%
также и наш метод, поскольку вскоре были най%
вы ФДЭ%связей, вероятнее всего, появились
дены условия перевода РНК со сложной третич%
при первых актах гидролиза нативных молекул
ной структурой в кДНК. Но метод все же имеет
РНК.
некоторые преимущества перед автоматичес%
ким анализом. О первом преимуществе было
упомянуто выше, кроме того, метод позволяет
МОЛЕКУЛЯРНО@ЭТИОЛОГИЧЕСКИЙ
фиксировать и идентифицировать минорные
АНАЛИЗ СОВРЕМЕННОГО РАЗНООБРАЗИЯ
основания в цепи РНК. Возможно, он найдет
ВИРУСА ГРИППА ЧЕЛОВЕКА
применение в будущем при диагностике тяже%
лых заболеваний, связанных с нарушением син%
Генотипирование эпидемических штаммов ви@
теза минорных оснований.
русов гриппа А, циркулировавших на территории
Наш метод содержит одну еще не решенную
СССР в 1968-1989 гг. и исследование случаев вы@
загадку: несмотря на то, что гидролиз РНК про%
хода вакцинных штаммов в эпидемическую цирку@
водится в формамиде в гарантированно денату%
ляцию. В 1985 году руководимый мною отдел пе%
рирующих условиях, при которых реакционная
реключился на анализ первичной структуры ге%
способность всех ФДЭ%связей должна быть
номов эпидемиологически актуальных вирусов.
одинаковой, порядок распределения мест их
С 1986 по 1990 гг. в лаборатории моего ученика
разрывов в цепи РНК существенно отличается
Н.А. Петрова было секвенировано более 100 000
от случайного. По правилам статистического
нуклеотидов в нескольких десятках генов гемаг%
распределения такого быть не может. Создается
глютинина и ~100 других генов вирусов гриппа А,
впечатление, что после первого разрыва цепь
а также некоторых других вирусов. Это стало
РНК становится устойчивой к дальнейшему
возможным благодаря применению новой схе%
гидролизу. Я могу предложить только свое объ%
мы прямого определения первичной структуры
яснение. Особенность проводимой реакции
вирусных РНК на основе комбинации фермен%
гидролиза состоит в том, что формально она
тативной достройки радиоактивного праймера
проходит в формамиде в безводной среде. Сво%
на матрице вирусного генома и химического
бодная вода, попавшая в реакционную смесь
секвенирования. Такая технология позволяет
случайно, должна при 100 °С быстро испарить%
использовать для анализа практически неочи%
ся. И в то же время мы наблюдаем, что разрыв
щенный суммарный нуклеотидный материал,
цепи РНК происходит путем обычного гидро%
выделяемый из концентрата осветленной ал%
лиза с участием воды. В противном случае оста%
лантоисной жидкости куриных эмбрионов, за%
нется не объяснимым образование 5’%гидрок%
раженных вирусом гриппа. С помощью сравни%
сила в месте разрыва цепи. Вероятнее всего в
тельного анализа первичных структур генов
реакции участвует связанная с РНК или с фор%
циркулирующих вирусных вариантов предстоя%
мамидом гидратационная вода. В контрольном
ло ответить на ряд вопросов, касающихся жиз%
опыте было показано, что гидролиз РНК в фор%
недеятельности и эпидемиологии вирусов грип%
мамиде проходит интенсивней, чем в деионизо%
па А, а именно, выяснить, насколько вероятна
ванной воде, следовательно, формамид должен
реверсия вакцинных штаммов вирусов гриппа А
выполнять роль катализатора гидролиза, а для
в процессе их естественной циркуляции. Кроме
этого надо обязательно войти в специфический
этого, предстояло исследовать специфику и за%
БИОХИМИЯ том 84 вып. 11 2019
МЕТОДОЛОГИЯ АНАЛИЗА СТРУКТУРЫ РНК И ЕЕ ПРИМЕНЕНИЕ
1533
кономерности антигенного дрейфа доминирую%
штамму - А/Ленинград/54/1, применявшемуся
щих вирусов гриппа подтипа А(H3N2).
в составе инактивированной вакцины в
Известно, что в межэпидемический период у
1979-1981 гг. Ген НА вируса А/Монголия/128/86
циркулирующих возбудителей возрастает раз%
содержал все уникальные замены, присущие ге%
нообразие в первичных структурах геномов и в
ну НА вакцинного штамма и отличался от него
антигенных характеристиках. Так в середине 80%х
лишь одной молчащей мутацией в позиции 536.
годов вирусы гриппа антигенного подтипа
Анализ первичных структур генов PB2, PB1, NP,
А(H3N2) были представлены не менее, чем тре%
NS и М показал, что все они, как и вакцинный
мя антигенными подгруппами. Различия в пер%
штамм происходили от лабораторного варианта
вичной структуре генов всех этих штаммов пол%
вируса А/PR/8/34(H1N1). В гене М, как и у ви%
ностью удовлетворяли закономерностям естест%
руса А/Москва/771/88, была замена Т%58%А, что
венной изменчивости вирусов гриппа А, выз%
говорит об общности их происхождения. Кроме
ванной антигенным дрейфом. Однако наряду с
этого, нами также были найдены доказательства
вирусами, доминирующими в данный момент в
родственной связи целого ряда выделенных в
эпидемическом процессе, отмечались случаи
1982 г. вирусов подтипа (H3N2) с применявшей%
изоляции так называемых «антигенных анахро%
ся в СССР в 1974-1982 гг. живой аттенюирован%
низмов», атипичных по отношению к процессу
ной вакциной А/1533/17(H3N2). Таким обра%
естественной изменчивости. Такие «атипичные
зом, при детальном исследовании первичной
анахронизмы» были обнаружены на территории
структуры геномов большинства атипичных ви%
СССР и в соседних странах. В проделанной на%
русных изолятов удается установить их прямую
ми работе приводятся данные сравнительного
связь с применяемыми ранее цельновирионны%
анализа геномов ряда вирусов гриппа антиген%
ми вакцинными препаратами, как инактивиро%
ного подтипа А(Н1N1), которые позволяют
ванными реасортантными, так и аттенюирован%
предположить их прямую связь с вакцинными
ными пассажными
[21-26]. Теоретически,
штаммами, созданными на основе вируса
появление отдельных генов вакцинных штам%
А/PR/8%34(H1N1).
мов в эпидемической циркуляции могло бы
Вирусы гриппа подтипа А/Монго%
происходить в результате их «захвата» вирулент%
лия/128/86(H1N1) были выделены в Монголии
ными вирусами путем реассортации, однако в
в 1985-1986 гг. у детей (5 штаммов). Изоляты
исследованных нами случаях признаков такой
подтипа А/Москва/771/88(H1N1) выделены в
реассортации не обнаружено - все гены вирус%
феврале 1988 г. у взрослых (3 штамма). Последо%
ных «анахронизмов» имели связь только с гена%
вательность оснований у вирусных геномов ус%
ми соответствующего вакцинного штамма.
танавливали путем элонгации 5’%меченных оли%
Трезвая оценка сложившейся ситуации с проти%
гонуклеотидных праймеров ревертазой на мат%
вогриппозными вакцинами заставляет выска%
рице суммарной вирионной РНК с последую%
зать опасение, что чисто технические усовершен%
щим секвенированием продуктов достройки хи%
ствования методов инактивации вирусных пре%
мическим методом. Секвенс генов вируса грип%
паратов не смогут гарантировать полное исклю%
па А/Москва/771/88(H1N1) выявил его родство
чение возможности контаминации биосферы
с реасортантным вакцинным штаммом А/Киев/
вакцинными штаммами. Поэтому представля%
59/79(H1N1), широко применявшимся в
ется целесообразным пересмотр общей страте%
1981-1985 гг. в качестве инактивированной вак%
гии вакцинопрофилактики гриппа и отказ от
цины. У вируса А/Москва/771/88 в гене гемаг%
широкого применения цельновирионных вак%
глютинина (НА) были сохранены все четыре
цин [26].
уникальные молчащие замены, отличающие ген
Динамика мутаций у вирусов антигенного под@
НА штамма А/Киев/59/79/P от всех остальных
типа А(H3N2) за время их циркуляции с 1968 по
изолятов подтипа А(H1N1). Кроме этого, были
1977 гг. Вирусы гриппа антигенного подтипа
выявлены две дополнительные мутации С%737%Т
А(H3N2) после продолжительного перерыва
и А%912%G. Частичное секвенирование генов
вновь появились в человеческой популяции в
NP, PB1, PB2, PA, M и NS вируса А/Москва/
1968 г., вызвав пандемию, и с тех пор сохраняют
771/88 показало полное их совпадение с соотве%
эпидемическую активность, подвергаясь при
тствующими генами вакцинного штамма. Един%
этом анигенному дрейфу. В первое десятилетие
ственным отличием можно считать замену
смена доминирующих вариантов проходила
Т%58%А в гене М, такую же, как у лабораторного ва%
достаточно быстро, через каждые 1-3 года, и
рианта А/PR/8/34 - родительского для приме%
приводила к необратимому изменению предше%
нявшегося в СССР варианта. Второй «антиген%
ствующей антигенной разновидности. Столь
ный анахронизм» - А/Монголия/128/86(H1N1)
длительное существование (более 20 лет) эпиде%
оказался родственным другому вакцинному
мического процесса с участием вирусов гриппа
БИОХИМИЯ том 84 вып. 11 2019
1534
ВАСИЛЕНКО
А(Н3N2) дает редкую возможность изучения
А/СССР/281/86, А/Рига/9977/86, А/Виктория/
быстрых микроэволюционных процессов в ди%
7/87, А/Сычуань/2/87, А/СССР/21/88/ [26-33].
намике природных популяций. Общеизвестно,
Анализ конкретных мутаций аминокислот
что определяющей молекулярной основой ан%
НА современных на тот момент вирусов гриппа
тигенного дрейфа служит накопление мутаций в
А(H3N2) обнаружил, что больше половины из
гене НА, сопровождаемое сменой доминирую%
них представляют собой повторные мутации в
щего варианта. Ведущей причиной закрепления
тех же положениях молекулы, по которым уже
новых мутаций оказывается непрерывное воз%
происходили замены в ходе антигенного дрейфа
растание коллективного иммунитета популяции
с 1968 г. Более того, основная часть таких пов%
хозяина. Отбор и закрепление дрейфовых мута%
торных мутаций оказались реверсиями, восста%
ций обеспечивается непрерывной циркуляцией
навливающими в данном участке структуру бел%
вируса от одной хозяйской особи к другой в час%
ка более раннего дрейф%варианта или прототипа
тично иммунной популяции.
А/Гонконг/1/68.
С целью выяснения характерных особеннос%
Вне зависимости от разнообразия первич%
тей современных антигенных подгрупп вирусов
ных структур и антигенных свойств вирусов
группа А(H3N2) и закономерностей антигенно%
гриппа А(H3N2) в различных подгруппах, все
го дрейфа за 20 лет нами определена первичная
они подчинялись общим закономерностям ан%
структура антигенного белка гемагглютинина
тигенного дрейфа, который представляет собой
(НА), наиболее типичного представителя этой
следствие саморазвития эпидемического про%
подгруппы, выделенного на территории СССР, а
цесса во взаимодействии популяций хозяина и
также ряда международных эталонов и вирусов
вируса. Мутации в генах вируса четко делятся на
прошлых лет: А/Гонконг/1/68, А/Виктория/
две принципиально разные группы. Одна из
36/72, А/Ленинград/538/4, А/Ленинград/337/
них - это «молчащие» мутации, которые из%за
76, А/Ленинград/385/80, А/Филиппины/2/82,
вырожденности генетического кода не изменя%
А/СССР /31/85, А/СССР/3/85, А/СССР/3/86,
ют структуру белка и не оказывают прямого
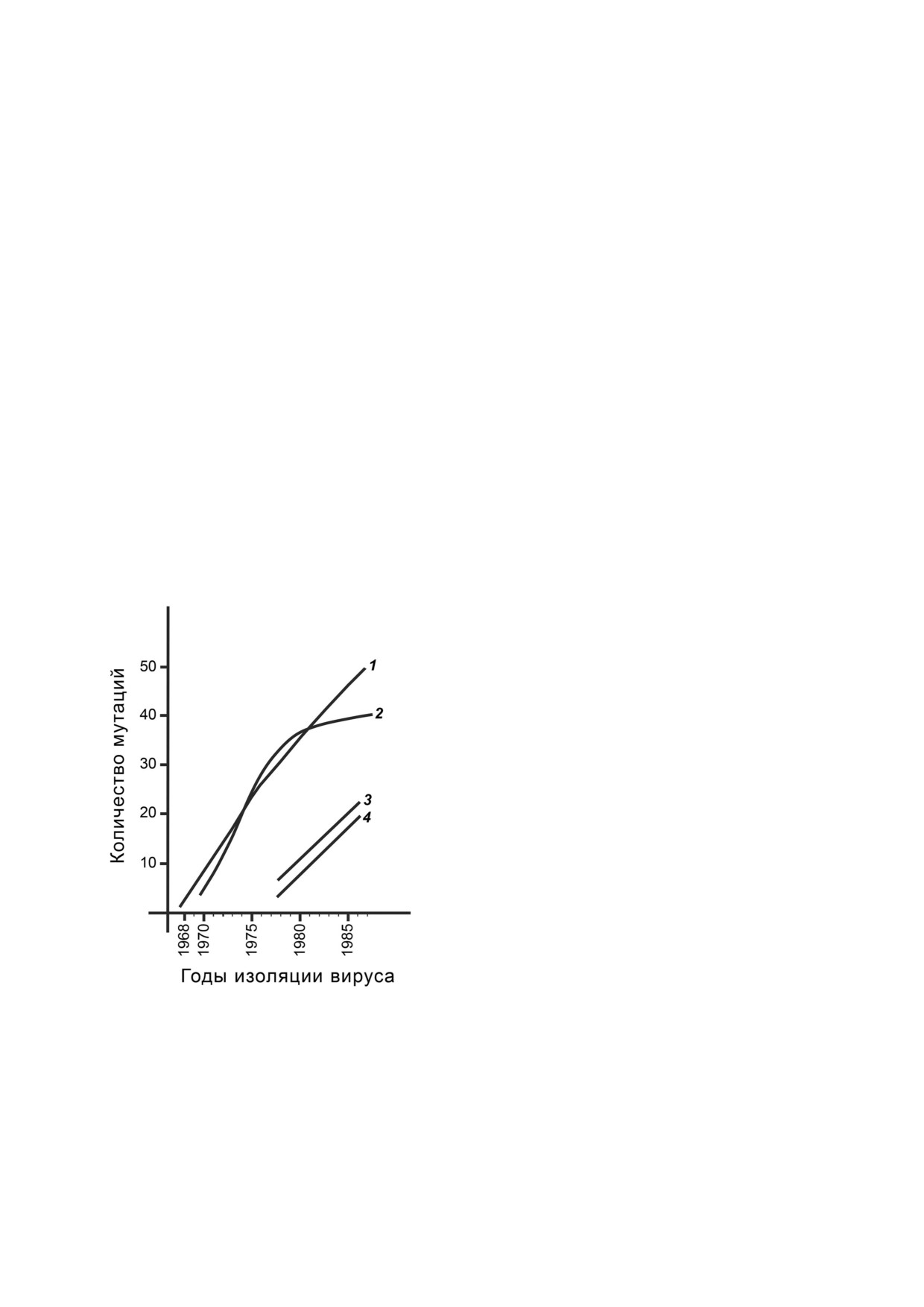
влияния на антигенный дрейф. На рис. 6 пока%
зана динамика накопления таких молчащих
нуклеотидных замен в гене НА вирусов гриппа
А(H3N2) за 20 лет непрерывного дрейфа (кри%
вая 1). Анализ сделан на материале более 50
структур генов в области, кодирующей самую
изменчивую тяжелую субъединицу белка НА.
Максимальный разброс значений в каждой точ%
ке кривой не превышал трех замен, т.е. величи%
ны их прироста за год. Вид кривой 1 говорит о
случайном характере нуклеотидных замен, их
практической нейтральности для функциони%
рования вируса и о постоянной скорости их на%
копления. На нейтралистскую функцию «мол%
чащих» замен может указывать и равномерность
их распределения по всей длине гена. В силу
постоянства скорости и случайности образова%
ния как прямых, так и обратных «молчащих»
мутаций весь эволюционный путь вирусной по%
пуляции за этот обозримый период времени
оказывается запечатленным в первичной струк%
туре его генов. Всю историю эволюционного пу%
ти любого изолята можно расшифровать рекон%
струкцией его филогенетических связей с дру%
Рис. 6. Нарастание числа отличий от гена и белка прото%
гими родственными изолятами.
типного штамма в процессе его антигенного дрейфа.
Аминокислотные замены в отличие от «мол%
1 - «Молчащие» нуклеотидные замены в гене НА вирусов
гриппа А(H3N2) прототипа А/Гонконг/1/68(H3N2);
чащих» мутаций различных штаммов непосред%
2 - аминокислотные отличия от прототипа А/Гонконг/
ственно отражаются в фенотипе вируса и под%
1/68(Р3Т2); 3 - «молчащие» замены нуклеотидов в гене НА
вергаются действию отбора.
вирусов гриппа А(H1N1) относительно гена прототипа
График числа отличий от прототипа А/Гон%
А/СССР/20/77(H1N1); 4 - отличия аминокислот в белке
НА1 вирусов гриппа А(H3N2) относительно гена прототи%
конг/1/68 в области НА1 (рис. 6, кривая 2) пост%
па А/СССР/20/77(H1N1)
роен также на материале более 50 структур, и
БИОХИМИЯ том 84 вып. 11 2019
МЕТОДОЛОГИЯ АНАЛИЗА СТРУКТУРЫ РНК И ЕЕ ПРИМЕНЕНИЕ
1535
разброс точек для каждого года не превышает
ме этих работ приходилось также заниматься и
двух замен. В первое десятилетие дрейфа амино%
не столь масштабными исследованиями, неко%
кислотные замены накапливались линейно, од%
торые из которых, по моему мнению, достойны
нако во втором десятилетии этот процесс значи%
упоминания в обзоре. Прежде всего, сюда мож%
тельно замедлился и в конце - практически оста%
но отнести секвенирование вирусных геномов,
новился. Это касается практически всей совре%
не относящихся к семейству ортомиксовирусов:
менной популяции вирусов А/(H3N2), независи%
главным образом пикорна% и поксвирусов. В се%
мо от их принадлежности к весьма различным
мействе пикорнавирусов (Picornaviridae) были
антигенным подгруппам. Линейность накопле%
установлены первичные структуры генов виру%
ния аминокислотных замен в начальной фазе
сов энцефаломиокардита и вируса ящура, а в се%
дрейфа говорит об их случайности и практичес%
мействе поксвирусов (Poxviridae) - ~10 000 нук%
кой нейтральности к выполнению молекулой НА
леотидных пар генов осповакцины и натураль%
своих многочисленных функций в жизненном
ной оспы. С 1982 г. началось сотрудничество на%
цикле вируса гриппа. В условиях растущего им%
шего центра с институтом ящура МСХ СССР во
мунного пресса со стороны хозяина многие но%
Владимире. Мы внедрили там, тогда еще новую,
вые варианты НА обеспечивают временное се%
технологию структурного анализа вирусных ге%
лективное преимущество. Однако, сам характер
номов и совместно установили первичные
замен и число положений в молекуле, допускаю%
структуры генов белка VP1 у нескольких штам%
щих такие квазисвободные изменения, очень ог%
мов вируса ящура, циркулировавшего на терри%
раничены. Можно предположить, что давление
тории СССР в конце 70%х гг. Некоторые из них
иммунного пресса хозяина постепенно искажает
оказались продуктами реактивации штаммов,
нативную структуру прототипного белка, и в ито%
применяемых в качестве инактивированных
ге накопление замен мешает белку функциони%
вакцин [34]. Результаты получили большой ре%
ровать. Поэтому отбор становится двунаправлен%
зонанс, и не только в научной среде. В результа%
ным и стабилизирует число отличий на уровне
те на предприятиях, производящих противо%
40-50. При этом замены продолжают закреп%
ящурную вакцину, была изменена методология
ляться, но происходят они, в основном, в одних и
вирусной инактивации и установлен более
тех же ограниченных участках антигенных детер%
жесткий контроль технологического процесса.
минант и часто приводят к реверсиям%восстанов%
Мы были среди первых, кто начал внедрять в
лениям структуры белка более ранних вариантов.
эпидемиологические исследования структурный
Переход вирусов А/(H3N2) к фазе стабилизиро%
анализ вирусных геномов. Методические разра%
ванного дрейфа говорит о том, что они практи%
ботки нашего центра ГНЦ ВБ «Вектор» активно
чески исчерпали потенциал изменчивости, кото%
внедрялись в другие вирусологические центры,
рый позволял им существовать в эпидемичеком
совместно с которыми (институтом гриппа АМН
режиме более 20 лет, по крайней мере в челове%
СССР, институтом вирусологии им. Ивановско%
ческой популящии. Из такой ограниченности
го АМН СССР и институтом ящура МСХ СССР)
дрейфа следует, что эпидемическая фаза сущест%
была проведена серия исследований в новой об%
вования вируса гриппа А человека также ограни%
ласти эпидемиологии, получившей позже назва%
чена. Неизбежный антигенный дрейф ведет в не%
ние «молекулярная эпидемиология». Начиная с
котором смысле в эволюционный тупик. Через
начала 80%х гг. и вплоть до внедрения в научную
определенные промежутки времени вирусы
практику автоматических секвенаторов Россия
гриппа человека должны обновлять свой гено%
лидировала в этой области науки.
фонд за счет генов НА из животных резервуаров,
где антигенный дрейф незначителен, либо путем
сохранения интактных вирусных геномов в чело%
Конфликт интересов. Автор заявляет об отсут%
веческой популяции в условиях отсутствия цир%
ствии конфликта интересов.
куляции и неизбежно связанного с ней дрейфа.
Соблюдение этических норм. Настоящая
статья не содержит каких%либо исследований с
Выше были рассмотрены более или менее
участием людей или использованием животных
завершенные комплексные исследования. Кро%
в качестве объектов исследований.
СПИСОК ЛИТЕРАТУРЫ
1.
Boutorin, A.S., Remy, P., Ebel, J.P., and Vasilenko, S.K.
2.
Favorova, O.O., Fasiolo, F., Keith, G., Ebel, J.P., and
(1982) Comparsion of the hydrolysis patterns of several
Vassilenko, S.K. (1981) Complexes of aminoacyl%tRNA
tRNAs by cobra venom ribonuclease in different steps of the
sintetases and tRNA. Studies by partial cobra venom
aminoacilation reaction, Eur. J. Biochem., 121, 587-595.
RNAse hydrolysis, Biochemistry, 20, 1006-1010.
БИОХИМИЯ том 84 вып. 11 2019
1536
ВАСИЛЕНКО
3.
Boutorin, A.S., Clark, B.F.C., Ebel, J.P., Kruse, T.A.,
довательности в олигонуклеотидах, ДАН СССР, 162,
Petersen, H.U., Remi, P., and Vasilenko, S.K. (1981) A
604-607.
study of the interaction of E. coli elongation factor - Tu
20.
Stanley, J., and Vasilenko, S.K. (1978) A different
with aminoacyl%tRNAs by partial digestion with cobra
approach to RNA sequencing, Nature, 274, 87-89.
venom RNAse, J. Mol. Biol., 152, 593-608.
21.
Петров Н.А., Нетесов С.В., Блинов В.М., Василенко С.К.
4.
Vasilenko, S.K., Carbon, F., Ebel, J.P., and Ehresman, Sh.
(1986) Эволюция гена гемагглютинина подтипа Н3
(1981) Topography of 16s RNA in 30s subunits and in 70s
вируса гриппа А человека, Мол. Генет., 11, 7-14.
subunits.Accessibility to cobra venom ribonuclease, J. Mol.
22.
Беклемишев А.Б., Блинов В.М., Петров Н.А., Васи%
Biol., 152, 699-721.
ленко С.К. (1986) Первичная структура полноразмер%
5.
Василенко С.К. (1985) Рибонуклеазы змеиных ядов;
ной ДНК%копии гена гемагглютинина вируса гриппа
ферментативные свойства и применение для исследова%
А/Киев 8/59/79(H1N1), Биоорган. Химия, 12, 375-383.
ния макроструктуры РНК и РНП. Дис. докт. биол. на%
23.
Петров Н.А., Гринев А.А., Василенко С.К., Жилинс%
ук, Новосибирск, с. 235-286.
кая И.Н., Парамонова М.С., Голубев Д.Б. (1988) Пер%
6.
Василенко С.К. (1963) Выделение фосфодиэстеразы и
вичная структура гемагглютинина вируса гриппа при
фосфомоноэстеразы из яда гюрзы Vipera lebetina мето%
серийных пассажах на куриных эмбрионах, Бюлл.
дом хроматографии на сульфоэтил%целлюлозе, Биохи%
Эксп. Биол., 11, 596-598.
мия, 28, 602-605.
24.
Петров Н.А., Киселев О.И., Гринбаум Е.Б., Лузянина Т.И.,
7.
Бабкина Г.Т., Василенко С.К. (1964) Нуклеазная ак%
Полежаев Ф.И., Василенко С.К. (1990) Возможность
тивность ядов среднеазиатских змей, Биохимия, 29,
циркуляции вакцинных штаммов вирусов гриппа А в
268-272.
биосфере, ДАН СССР, 315, 725-728.
8.
Василенко С.К., Бабкина Г.Т. (1965) Выделение и
25.
Петров Н.А., Василенко С.К., Гринев А.А., Киселев О.И.,
свойства рибонуклеазы из яда кобры Naja oxiana, Био%
Гринбаум Е.Б., Лузянина Т.И. (1988) Первичная
химия, 30, 705-712.
структура гена гемагглютинина вариантов вируса
9.
Василенко С.К., Райт В.К. (1975) Метод выделения
А/СССР/2/85(H3N2) В cб. науч. тр. Проблемы
высокоочищенной рибонуклеазы из яда среднеазиат%
конструирования гриппозных вакцин, (под ред.
ской кобры Naja oxiana, Биохимия, 40, 578-583.
Корнеевой Э.П.), ВНИИ гриппа, Санкт%Петербург,
10.
Василенко С.К., Сербо Н.А., Веньяминова А.Г., Бол%
с. 54-60.
дырева Л.Г., Будкер В.Г., Кобец Н.Д. (1976) Препара%
26.
Петров Н.А., Василенко С.К. (1990) Современное раз%
тивное получение 5’%оигонуклеотидов с помощью ри%
нообразие вирусов гриппа А человека на молекуляр%
бонуклеазы из яда кобры, Биохимия, 41, 260-263.
ном уровне, Мол. Генет., 12, 3-10.
11.
Василенко С.К. (1985) Рибонуклеазы змеиных ядов:
27.
Сандахчиев Л.С., Петров Н.А., Яхно М.А., Лузянина Т.И.,
ферментативные свойства и применение для исследова%
Гринев А.А., Василенко С.К., Гринбаум Е.Б., Голубев
ния макроструктур РНК и РНП, Дис. докт. биол. наук,
Д.Б., Говоркова Е.А., Жданов В.М. (1988) Первичная
Новосибирск, с. 56-71.
структура геномов современных гонконгоподобных
12.
Василенко С.К. (1985) Рибонуклеазы змеиных ядов:
штаммов вирусов гриппа А(H3N2), ДАН СССР, 302,
ферментативные свойства и применение для исследова%
1494-1497.
ния макроструктур РНК и РНП, Дис. докт. биол. наук,
28.
Жданов В.М., Петров, Н.А., Гринев А.А., Яхно М.А.,
Новосибирск, с. 73-91.
Исаченко В.А., Горбунов Ю.А., Вторушина Н.А., Не%
13.
Магарил С.А., Василенко С.К., Райт В.К., (1981) Осо%
тесов С.В., Василенко С.К., Сандахчиев Л.С. (1989)
бенности гидролиза синтетических полирибонуклео%
Первичная структура гемагглютинина вирусов гриппа
тидов эндорибонуклеазой из яда кобры Naja oxiana,
А(H3N2), изолированных в СССР в 1985 г., Вопр. Ви%
Биохимия, 45, 408-413.
русол., 2, 155-160.
14.
Nicholson, A. (2014) Ribonuclease III mechanisms of
29.
Сандахчиев Л.С., Петров Н.А., Василенко С.К., Лузя%
double%stranded RNA%clevage, Willey Interscip. REV.
нина Т.Я., Гринбаум Е.Б., Горбунов Ю.А., Вторушина И.А.,
RNA, 5, 31-48.
Голубев Д.Б. (1989) Первичная структура атипичных
15.
Ebel, J.P., Remy, P., Baltzinger, M., Ehrlich, R., Jefevre, J.F.,
вирусов гриппа А (H3N2) 1982-1985, ДАН СССР, 308,
Renaud, M., Fasiolo, F., Keith, G., Favorova, O.O., and
477-480.
Vasilenko S.K. (1980) Aminoacyl%tRNA synthetase, inter%
30.
Петров Н.А., Гринбаум Е.Б., Литвинова О.М., Лузяни%
action with their ligands, in Enzyme regulation and mecha%
на Т.Я., Василенко С.К., Киселев О.И., Сандахчиев Л.С.
nism of action, Proc. FEBS Special Meeting on Enzymes,
(1990) Структура генома вируса гриппа А/Ленин%
Cavtat, Dubrovnik, 1979 (Eildner, P., and Rien, B., eds.),
град/22/81/(H1N1), Мол. Генет., 7, 17-21.
Pergamon Press, N. Y., pp. 211%221.
31.
Петров Н.А., Василенко С.К., Горбунов Ю.А., Кисе%
16.
Ebel, J.P., Renaud, M., Dietrich, A., Fasiolo, F., Keith, F.,
лев О.И., Сандахчиев Л.С. (1990) Первичная структу%
Favorova, O.O., Vassilenko, S.K., Baltzinger, M., Remy, P.,
ра гена гемагглютинина штамма А/Рига/9977/86
Bonnet, J., and Giege, R. (1979) Interaction between
дрейфового варианта вируса гриппа А(H3N2), Вопр.
tRNA and aminoacyl%tRNA sintetase in the valine and
Вирусол., 5, 372-373.
phenylalanine system from yeast, in Transfer RNA,
32.
Медведева М.Н., Петров Н.А., Василенко С.К. (1990)
Structure, Properties, and Recognition (Shimmel, S., and
Характеристика гемагглютинина персистентных ва%
Soll, D., eds) Cold Spring Harbour Laboratory Press, N.Y.,
риантов вируса гриппа А/Виктория/35/72(H3N2),
pp. 325-343.
Вопр. Вирусол., 5, 374-376.
17.
Василенко С.К., Буторин А.С., Маев С.П., Витюгов Ф.И.,
33.
Петров Н.А. (1991) Молекулярно%этиологический ана%
Болдырева Л.Г., Райт В.К. (1983) Специфичность нук%
лиз современного разнообразия вирусов гриппа А челове%
леазы из яда кобры Naja naja oxiana к макроструктуре
ка. Дис. докт. биол. наук, Москва, с. 24-34.
полирибонуклеотидов, Мол. биол., 17, 818-823.
34.
Онищенко А.М., Петров Н.А., Блинов В.М., Василен%
18.
Василенко С.К. (1963) Информационный бюлл. Совета
ко С.К., Сандахчиев Л.С., Бурдов А.П., Иванющенков В.П.,
по молекулярной биологии АН СССР (Москва), № 2, с. 19.
Перевозчикова Н.А. (1986) Первичная структура
19.
Василенко С.К., Демушкин В.П., Будовский Э.И.,
ДНК%копии гена белка VP1 вируса ящура А22, Биоорг.
Кнорре Д.Г. (1965) Определение нуклеотидной после%
Химия, 12, 416-419.
БИОХИМИЯ том 84 вып. 11 2019
МЕТОДОЛОГИЯ АНАЛИЗА СТРУКТУРЫ РНК И ЕЕ ПРИМЕНЕНИЕ
1537
DEVELOPMENT OF METHODOLOGY FOR ANALYZING RNA STRUCTURE
AND ITS APPLICATION IN MOLECULAR BIOLOGY AND VIROLOGY
Review
S. K. Vasilenko*
State Research Center of Virology and Biotechnology Vector, 630559 Koltsovo,
Novosibirsk Region, Russia; E%mail: vasilen@vector.nsc.ru
Received June 20, 2019
Revised July 27, 2019
Accepted August 5, 2019
The review covers three independent blocks of research. The first block includes discovery, isolation, and investigation
of snake venom RNases (SVR) with emphasis on the study of RNA macrostructure. It has been established that SVR
are not specific toward the primary structure of RNA but specific toward the RNA helical conformation (double, sin%
gle, or hybrid helix). SVR hydrolyze RNA to short oligomers with 5’%terminal phosphate. Analysis of tRNA hydroly%
sis products and kinetic studies of the hydrolysis exemplify possibilities of using SVR for investigation of RNA
macrostructure. The second block is devoted to the realization of the formulated by the author principle for analyz%
ing the primary structure of nucleic acids and to the method of direct RNA sequencing in which establishing the
author was involved. The third block considers the results of genotyping and etiologic control of the epidemic influen%
za A viruses that circulated on the USSR territory since 1968 to 1992. The developed method for comparative analy%
sis of primary structures of genomes of viral isolates enabled detection and characterization of the epidemic influen%
za virus strains emerged in circulation as a consequence of reactivation of inactivated vaccines.
Keywords: snake venoms, ribonuclease, RNA, macrostructure, primary structure, molecular virology
2 БИОХИМИЯ том 84 вып. 11 2019