БИОХИМИЯ, 2019, том 84, вып. 11, с. 1553 - 1563
УДК 577.152.6
НОВЫЙ ВЗГЛЯД НА ПРОБЛЕМУ ОБРАТИМОСТИ СИНТЕЗА
И ГИДРОЛИЗА АТР Fo⋅F1 АТРазой (гидролазой)
Обзор
© 2019
А.Д. Виноградов*
Московский государственный университет им. М.В. Ломоносова, биологический факультет,
119234 Москва, Россия; электронная почта: adv@biochem.bio.msu.su
Поступила в редакцию 19.06.2019
После доработки 08.07.2019
Принята к публикации 08.07.2019
Fo⋅F1 АТРазы митохондрий, бактерий и хлоропластов трансформируют «протон движущую силу» (раз
ность электрохимических потенциалов ионов водорода по разные стороны сопрягающей мембраны) в сво
бодную энергию фосфорильного потенциала АТР. Почти общепринято рассматривать Fo⋅F1 АТРазы как
обратимые хемо механо электрические молекулярные машины, обеспечивающие в зависимости от физио
логических условий существования организмов либо синтез, либо гидролиз АТР, принимая как аксиому
принцип микрообратимости ферментативного катализа. В течение многих лет (1980-2000 гг.) автор при
держивался точки зрения, согласно которой механизмы реакций синтеза и гидролиза АТР, катализируемых
комплексом Fo⋅F1, различаются (Vinogradov, A.D. (2000) J. Exp. Biol., 203, 41-49). В этом обзоре собствен
ных работ автор предлагает новую модель, рассматривая существование в сопрягающих мембранах двух не
равновесных изоформ Fo⋅F1, однонаправленно катализирующих синтез и/или гидролиз АТР.
КЛЮЧЕВЫЕ СЛОВА: Fo⋅F1 АТРаза, обратимость ферментативного катализа.
DOI: 10.1134/S0320972519110034
Для решения множества проблем физиологии всегда можно найти животное
или животных, использование которых наиболее удобно для изучения той или
иной проблемы. Я не сомневаюсь, что существуют организмы, «специально
созданные» для анализа таких проблем, но опасаюсь, что они неизвестны
исследователям, для которых они были «созданы».
«Принцип Крога», выдающегося датского физиолога, Нобелевского лауреата 1921 г.
(Krogh, A. (1929) The progress of physiology, Am. J. Physiol., 90, 243-251)
Автор этой статьи проработал преподавате
химии, - посвящена изучению АТРазы мито
лем кафедры биохимии биологического факуль
хондрий - фермента, занимающего одно из
тета МГУ им. М.В. Ломоносова более 50 лет (с
центральных положений в процессе окислитель
1967 г.), будучи убежденным, что занятие науч
ного фосфорилирования. Окислительное фос
ной работой - почетная обязанность любого
форилирование открыто и количественно оха
преподавателя Московского университета. При
рактеризовано в 30 х гг. прошлого века В.А. Эн
мерно четверть всех работ, выполненных мною в
гельгардтом и В.А. Белицером в СССР. Для меня
разное время с разными соавторами - сотрудни
почетно сознавать себя одним из продолжателей
ками, аспирантами и студентами кафедры био
отечественной школы биоэнергетиков, в станов
лении которой роль кафедры биохимии общеиз
Принятые сокращения: Fo⋅F1 - Н+ АТРаза, Fo -
вестна. Время от времени, лучше чаще, чем ре
гидрофобная часть, F1 - гидрофильная часть, IF1
- белко
же, полезно оглянуться на пройденный путь,
вый ингибитор митохондриальной АТРазы, р - протон
чтобы, во первых, суммировать сделанное, а во
движущая сила, СМЧ - субмитохондриальные частицы,
вторых, наметить путь дальнейших исследова
Pd СБЧ - инвертированные плазматические мембраны
Paracoccus denitrificans.
ний. Настоящий обзор не является обзором в об
* Автор является выпускником кафедры биохимии биоло
щепринятом смысле этого слова. Этот очерк
гического факультета МГУ им. М.В. Ломоносова.
скорее соответствует понятию «progress report»,
3
1553
1554
ВИНОГРАДОВ
логического факультета МГУ, я буду ссылаться
только на публикации собственных работ, нача
тых в 1972 г., а ряд утверждений буду приводить
как хорошо установленные факты без ссылок на
первоисточники. В тексте совсем не обсуждают
ся данные о Fo⋅F1 хлоропластов - еще более
сложно регулируемой машине: ряд открытий,
сделанных при изучении этого объекта, внес су
щественный вклад в общее понимание ее меха
низма и регулирования.
Максимально упрощенная схема окисли
тельного фосфорилирования показана на рис. 1.
Окисление кислородом (или другими окислите
лями у некоторых организмов) продуктов (SH2),
низкомолекулярных соединений, образующих
ся в результате распада пищи, катализируется
комплексом оксидоредуктаз - так называемой
дыхательной цепью. Это окисление сопряжено с
векторным переносом протонов из одного отсе
ка (in) в другой (out), разделенных мембраной,
ограничивающей спонтанное перемешивание
содержимого обоих отсеков и, что особенно
важно, медленно, по сравнению со скоростью
векторной транслокации, проницаемой для
протонов (катионов гидроксония). В результате
Рис. 1. Схема процессов, происходящих при окислитель
возникает разность электрохимических потен
ном фосфорилировании. На рисунке изображен замкну
тый фрагмент внутренней мембраны митохондрий (СМЧ)
циалов ионов водорода по разные стороны
или цитоплазматической мембраны бактерии (Pd СБЧ).
мембраны (Δ~+ или «протон движущая сила», p;
Поверхность, свободно доступная для окружающего рас
последнее обозначение будет использоваться в
твора, обращена в матрикс митохондрий или цитоплазму
дальнейшем). Перемещение протонов по гради
бактерий. Генератор протон движущей силы (р) представ
ентам электрического поля и рН через Fo⋅F1
лен дыхательной цепью - комплексами I (NADH:убихи
нон ), III (убихинол::цитохром с ) и IV (цитохром с:кисло
АТРазный комплекс, встроенный в мембрану,
род ) оксидоредуктазами. Кроме указанных комплексов
сопряжено с синтезом АТР из ADP и Pi (реак
дыхательной цепи в митохондриях существуют и другие
ция, показанная в нижней части рис. 1) за счет
убихинон редуктазы, не показанные на рисунке (дегидро
энергии р. Обратная реакция - гидролиз АТР
геназа электронпереносящего флавопротеина, α глице
ролфосфатдегидрогеназа, дигидрооротатдегидрогеназа и
(показан в верхней части рис. 1) - происходит,
др.). Fo⋅F1 АТР синтезирующий (синий) или АТР гидро
когда дыхание по каким либо причинам отсут
лизующий (красный) комплексы состоят из гидрофильно
ствует, и сопровождается возникновением р.
, обеспечивающего «химическую» часть катализа, и
го F1
Поглощение кислорода, сопряженное с об
гидрофобного Fo - протонпроводящего устройства, меха
разованием АТР, в физиологических условиях
нического привода, обеспечивающего вращение γ субъе
диницы F1. В правой части фрагмента показаны спонтан
клеток и тканей регулируется многочисленными
ный перенос протонов через фосфолипидную мембрану и
факторами, среди которых простейший и хоро
их перенос через другие, не связанные непосредственно с
шо известный - так называемый дыхательный
окислительным фосфорилированием компоненты (транс
контроль. Это явление, впервые предсказанное
локаза АТР и ADP, так называемые «разобщающие»
(UCP) белки, катион транслоказы и др.).
и обнаруженное В.А. Белицером, продолжили
С цветным вариантом рис. 1 можно ознакомиться в элек
изучать десятилетие спустя две независимые
американские группы - Б. Чанса и Г. Ларди - с
journal/biokhsm/
использованием в качестве объекта препаратов
интактных изолированных митохондрий. Дыха
тельный контроль сводится к следующему. В
и, конечно, не хотелось бы, чтобы он стал окон
среде, не содержащей субстратов для синтеза
чательным отчетом о проделанной работе. Обзо
АТР (ADP и Pi), поглощение кислорода (окисле
ры со ссылками на оригинальные работы были
ние субстратов дыхания) происходит медленно и
опубликованы мною ранее [1-3]. В этой статье в
ограничивается скоростью «утечки» протонов за
специальном выпуске журнала «Биохимия»,
счет специфической и неспецифической прони
посвященном 80 летию кафедры биохимии био
цаемости мембраны. Добавление ADP и Pi силь
БИОХИМИЯ том 84 вып. 11 2019
Fo⋅F1 АТРаза
1555
но или слабо (в зависимости от конкретного
Общепринятая схема, описывающая собы
препарата митохондрий) активирует дыхание,
тия, которые происходят в нуклеотид связыва
которое продолжается до тех пор, пока добав
ющих центрах тримера, построенного из пар
ленные ADP и Pi не превратятся в АТР, и р не
α β субъединиц F1, в ходе р зависимого синтеза
«уравновесится» фосфорильным потенциалом
АТР показана на рис. 2. Еще раз подчеркну, что
АТР/ADP⋅Pi. Изучение параметров АТР синтаз
ной или гидролазной активностей Fo⋅F1 с ис
пользованием интактных митохондрий практи
чески невозможно. В синтезе, как и в гидролизе
АТР интактными митохондриями, участвуют
несколько ферментов: специфические перенос
чики Pi, адениновых нуклеотидов, субстратов
дыхания (интермедиатов цикла Кребса), каждый
из которых зависимо или независимо регулиру
ется р. Схема на рис. 1 упрощенно показывает
функционирование Fo⋅F1 в «вывернутых» (inside
out) субмитохондриальных частицах (СМЧ) -
замкнутых фрагментах внутренней (сопрягаю
щей) мембраны митохондрий или плазматичес
кой мембраны бактерий. Внешняя сторона
мембраны таких фрагментов соответствует мат
риксу интактных митохондрий, а внутренняя -
их межмембранному пространству. Активные
центры компонентов дыхательной цепи и нукле
отид связывающие центры F1 в этих фрагментах
доступны для субстратов и катализируют завися
щий от дыхания синтез АТР. К сожалению, ды
хание СМЧ и бактериальных препаратов плаз
матических мембран слабо или вовсе не контро
лируется активностью Fo⋅F1, и в таких препара
Рис. 2. Минимальная схема и последовательность собы
тах синтез АТР удается прослеживать только с
тий, в результате которых происходит р зависимый синтез
АТР из ADP и Pi «вращательным механизмом чередующе
использованием «ловушек» АТР (обычно ис
гося сродства» (rotational alternating binding site change
пользуют глюкозу и гексокиназу или люцифе
mechanism). F1 представлен тримером, построенным из
рин люциферазную систему детекции АТР).
α β субъединиц и единственной γ субъединицы (показана
Уместно подчеркнуть, что подавляющее боль
красным), расположенной внутри этого тримера. Суб
страт (ADP + Pi, обозначено как D) и продукт (Т) связы
шинство многочисленных работ, содержащих
вающие центры, локализованные на границах между α и
выводы о механизме энергозависимого синтеза
β субъединицами тримера, существуют в двух состояниях:
АТР, основаны на изучении АТР гидролазной
открытом (полукруг на поверхности плоского кольца) и
реакции (эту реакцию существенно проще изме
закрытом (D и Т прочно связаны в центрах, замкнутый
круг на поверхности). D связывается в единственном
рить), катализируемой либо растворимым F1,
субстратсвязывающем центре F1, уже содержащем D и Т.
либо Fo⋅F1 в составе мембран, либо, наконец, на
Выталкивание Т и освобождение субстратсвязывающего
отслеживании АТР зависимых параметров меха
центра для D происходит за счет подвижной внутри коль
нохимии индивидуальных молекул фермента.
ца γ субъединицы, приводимой во вращательное движение
Очевидно, что эти выводы вполне оправданы
током протонов через Fo. Тример F1 в составе Fo⋅F1 закреп
лен, так что его вращение исключено. Поворот γ субъеди
только при безусловном принятии принципа
ницы на 120° синхронизован с появлением АТР (Т) в окру
микрообратимости ферментативного катализа.
жающем растворе. Единичный акт появления продукта ре
И еще одно замечание: оправдано ли употребле
акции в растворе приводит к регенерации свободного фер
ние выражения «уравновешивается», использо
мента, отличающегося от его исходной формы только по
ванное выше при описании явления дыхатель
ложением γ субъединицы (поворот на 120° относительно
исходного). Два последующих поворота γ субъединицы
ного контроля? Нужно подчеркнуть, что все про
(каждое на 120°) сопровождаются последовательным выб
цессы, связанные с генерацией или использова
росом еще двух молекул продукта (АТР), и вся конструк
нием р и характеризующие их параметры, долж
ция возвращается в ее начальное состояние. Красным цве
ны рассматриваться как стационарные, а не как
том обозначены сегменты кольца димеров α β субъеди
ниц, в которых образованный АТР (Т) готов для выталки
равновесные. По моему мнению, биоэнергетики
вания в окружающую среду.
часто «злоупотребляют» термодинамическими
С цветным вариантом рис. 2 можно ознакомиться в элект
представлениями, которые применимы только
для действительно равновесных состояний.
journal/biokhsm/
БИОХИМИЯ том 84 вып. 11 2019
3*
1556
ВИНОГРАДОВ
эта и многочисленные аналогичные схемы раз
системы векторной транслокации протонов -
ной степени детализации в подавляющем боль
H
→+ на рис. 1. Скорость такой реакции легко ре
шинстве основаны на экспериментальных дан
гистрируется в слабо забуференных средах по
ных об АТР гидролазной реакции (кинетика,
кинетике закисления с помощью либо стеклян
изотопный обмен, структура изолированных
ного рН электрода, либо подходящего рН ин
препаратов, вообще не катализирующих синтез
дикатора (удобно использовать феноловый
АТР). Схема описывает (сокращенно) «меха
красный). При измерении АТРазной активнос
низм» последовательного образования трех мо
ти растворимыми частично очищенными пре
лекул АТР из трех молекул ADP и Pi, который
паратами F1, полученными из ацетоновых по
принято обозначать как «вращательный меха
рошков митохондрий, уже в самом начале на
низм чередующего сродства» (rotational alterna
ших исследований мы обнаружили несколько
tive binding site mechanism), предложенный
проявлений «аномальной» кинетики реакции
К. Репке и Р. Шоном в 1973 г. и ставший обще
[4], каждое из которых стало причиной нашего
принятым в результате детальных работ П. Бойе
дальнейшего разбирательства.
ра. Краткое описание последовательности собы
Перечисленные ниже наблюдения были сде
тий дано в подписи к рис. 2. Очевидны три прин
ланы нами и опубликованы в самом начале на
ципиально важных аспекта такого механизма:
шего интереса к изучению механизма F1 АТРазы.
1) собственно синтез (образование фосфоан
Тогда мы использовали в качестве объекта рас
гидридной связи между β и γ фосфорильными
творимый «фактор F1», солюбилизированный и
остатками АТР) происходит «спонтанно» (не
очищенный с использованием в качестве исход
требует энергии) за счет очень высокого срод
ного материала ацетонового порошка митохо
ства продукта реакции (АТР) к активному цент
ндрий сердца крупного рогатого скота [4, 5].
ру фермента;
Вскоре нам стало ясно, что изучение функцио
2) энергия р тратится на выталкивание проч
нирования F1 в процессе окислительного фос
но связанного АТР из активного центра в окру
форилирования целесообразно только на «пол
жающую среду механическим воздействием
ном» ферменте (Fo⋅F1) в составе мембран, спо
γ субъединицы F1, расположенной в сердцевине
собных к генерации или использованию р. Для
трехдольного «апельсина» (три α β пары) и вра
этого мы разработали способ получения сопря
щающейся током протонов через Fo;
женных СМЧ (рис. 1), катализирующих все ре
3) стехиометрия строго задана: три молекулы
акции, перечисленные в подписи к рис. 1, и, на
АТР на полный (360°) поворот γ субъединицы.
чиная с 1979 г., все наши работы были выполне
Очевидная трудность для такого механизма
ны с использованием СМЧ. Ряд наблюдений,
возникает в случаях, когда количество с субъе
обнаруженных при изучении растворимого F1,
диниц в кольце Fo (механический привод вра
был подтвержден и при использовании СМЧ.
щения) не кратно трем (10-15 для Fo разных ви
Наблюдения сводились к следующему:
дов). Система, оперирующая с переменной сте
1) реакция оказалась малоспецифичной для
хиометрией «АТР : векторно перенесенный про
Mg2+: фермент катализировал гидролиз в прису
тон», была бы физиологически целесообразной
тствии других двухвалентных катионов с наи
и служила бы важным элементом регулирования
большей активностью с Со2+;
энергетики клеток.
2) начальная скорость реакции быстро (в ми
нутной шкале времени) снижалась, и это сниже
ние не могло быть объяснено ни инактивацией
АТР ГИДРОЛАЗНАЯ АКТИВНОСТЬ Fo⋅F1
белка, ни изменением текущих концентраций
субстрата (АТР) и/или продукта (ADP и Pi);
Мембраносвязанный комплекс Fo⋅F1 СМЧ
3) активность фермента стимулировалась
или растворимая часть комплекса F1 катализи
стандартным протонофорным разобщителем -
рует гидролиз АТР и других пуриновых нуклео
2,4 динитрофенолом [5]. Это явление в начале
тидов. Суммарная реакция гидролиза АТР при
70 х гг. представлялось сильным аргументом
рН 8,0 в водном растворе соответствует уравне
против теории Митчелла об электроосмотиче
нию:
ском механизме сопряжения;
4) зависимость начальных скоростей реак
ции от концентрации АТР хорошо соответство
(1)
вала простой гиперболической зависимости.
Последнее заслуживает краткого обсужде
Нужно подчеркнуть, что протон в правой
ния в свете современных представлений о меха
части уравнения (так называемый стехиометри
низме функционирования Fo⋅F1 и многочислен
ческий протон) не относится к компонентам
ных опубликованных данных об аномальной
БИОХИМИЯ том 84 вып. 11 2019
Fo⋅F1 АТРаза
1557
(не Михаэлисовской) зависимости F1 и Fo⋅F1
АТРаз от концентрации АТР. Твердо установле
но, что все F1 АТРазы построены из тримеров
комплексов α β пар субъединиц и имеют три
быстро обмениваемых центра связывания нук
леотидов субстратов или продуктов реакции.
Потенциальная возможность заполнения этих
центров показана на рис. 3. Катализ по меха
низму чередующегося сродства, как любой ка
талитический процесс, должен начинаться с не
которой формы фермента, связывающей
субстрат, и заканчиваться после высвобождения
продукта реакции такой же формой. Исходной
и регенерируемой в результате последующих
превращений формой фермента при описании
либо гидролиза, либо синтеза АТР механизмом
чередующегося сродства служит F1, имеющий
единственный центр связывания нуклеотида
субстрата, который заполняется либо АТР для
«гидролазного» пути, либо ADP для «синтетаз
ного» пути, а два других постоянно содержат
АТР и ADP (ср. рис. 2 и 3). Существование
единственного центра связывания субстра
та/продукта соответствует простой гиперболи
ческой зависимости скорости реакции от кон
центрации субстрата. Полный гексамер - «сво
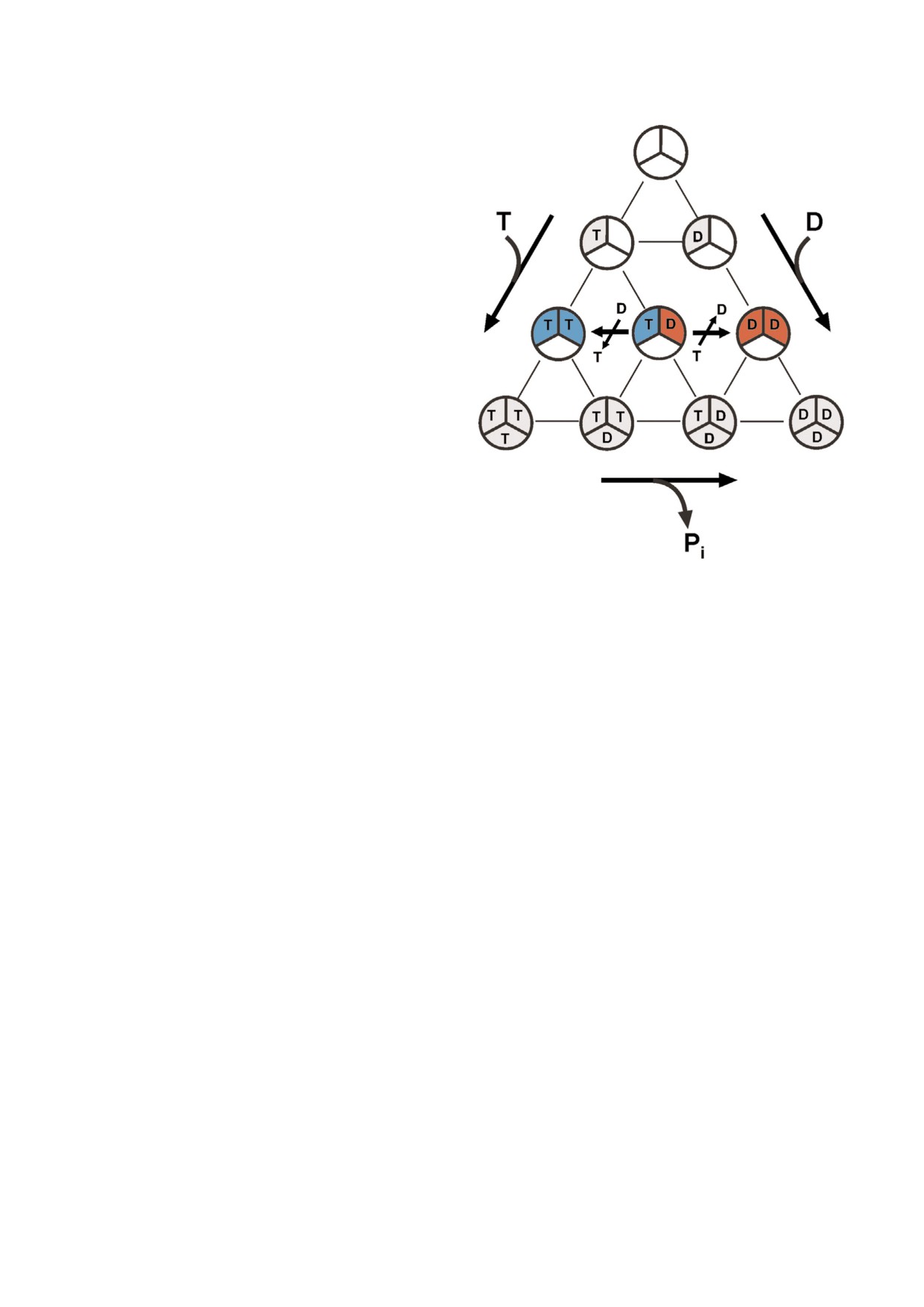
Рис. 3. Схема, иллюстрирующая множественность воз
бодный фермент» - может формироваться из
можных заполнений центров связывания двух лигандов:
Т (АТР) и D (ADP) тримером α β пар F1. Возможно сущест
свободных от нуклеотидов субъединиц или
вование десяти комплексов разного состава: одного «пус
субъединицы заполняются нуклеотидами еще
того» комплекса и девяти комплексов разной качествен
до формирования активного фермента. На
ной и количественной степени заполненности. Следует
рис. 3 показано количество возможных вариан
иметь в виду, что «пустой» и все ADP содержащие ком
плексы могут связывать по крайней мере 1-3 молекулы Pi,
тов заполнения потенциальных активных цент
так что число возможных вариантов существенно возрас
ров F1: оно равно 10 для симметричного триме
тает. Синим и красным цветами отмечены, соответствен
ра при связывании только АТР и ADP без учета
но, варианты «свободных регенерируемых форм» фермен
связывания Pi в центрах, заполненных ADP. Яс
та при катализе синтеза или гидролиза АТР посредством
но, что количество возможных форм F1 с учетом
механизма, представленного на рис. 2.
С цветным вариантом рис. 3 можно ознакомиться в элект
связывания только одной молекулы Pi в ADP
заполненных центрах или до трех в центрах, не
journal/biokhsm/
содержащих нуклеотидов, сильно возрастает.
Это оценочное рассмотрение показывает неиз
бежную многозначность приписывания «ката
ответственно). Другими словами, заполнение
литически интермедиатной» значимости той
нуклеотидами многих или всех центров их свя
или иной атомной структуре F1, расшифрован
зывания, не участвующих в катализе, не приво
ной рентгенографическим анализом кристал
дит к ингибированию высокими концентрация
лов белка, выращенных в присутствии различ
ми субстратов/продуктов (при условии доста
ных лигандов. Это замечание также относится и
точной концентрации Mg2+). С другой стороны,
к результатам криоэлектронной микроскопии -
для протекания стационарного гидролиза АТР
метода, лавинообразно распространяющегося
Fo⋅F1 мембраны Paracoccus denitrificans необхо
для визуализации биологических объектов на
димо, чтобы в среде присутствовало некоторое
молекулярном уровне. Интересно, что катали
количество ADP (~10-5 М) - увеличение актив
тические параметры Fo⋅F1 (во всяком случае,
ности АТР регенерирующей системы (фосфо
для мембран Paracoccus denitrificans) гидролиза и
енолпируват + пируваткиназа) сверх «необхо
синтеза АТР, измеренные при концентрациях
димого» приводит к торможению реакции [6].
нуклеотидов, многократно превышающих вели
Это наглядно показывает сложность кинетики
чины Km и близких к физиологическим, почти
АТРазной реакции и необходимость крайней
не отличаются от тех, что определены для обыч
осторожности при интерпретации результатов.
но измеряемых (~1 мМ АТР и ~0,1 мМ ADP со
Относительное сродство центров связывания
БИОХИМИЯ том 84 вып. 11 2019
1558
ВИНОГРАДОВ
нуклеотидов, заполнение которых необходимо
лиз, и это ингибирование зависит от АТР, т.е. от
для формирования исходной формы активного
состояния одного (или нескольких) интермеди
«свободного» фермента, по видимому, является
атов катализа. Скорость торможения АТРазной
видоспецифичным.
активности ингибитором сильно зависит от рН
и обусловлена протонированием гистидинового
остатка в составе IF1 [11, 12], ответственного за
ЗАВИСИМОСТЬ ГИДРОЛИЗА АТР от Mg2+
скорость его конформационной трансформа
ции в активную (ингибирующую) форму. Нужно
Подавляющее большинство известных
подчеркнуть, что IF1 не ингибирует АТР синте
АТРаз использует в качестве субстрата реакции
тазную активность Fo⋅F1 [13]. Физиологическое
комплекс «нуклеотид - ион двухвалентного ме
значение IF1 зависимого ингибирования
талла». Это справедливо и для F1 АТРаз из раз
АТРазной активности неизвестно. Одна из ин
ных источников. Однако Mg2+ выполняет до
тересных, на мой взгляд, возможностей заслу
полнительную, пока малопонятную роль в гид
живает обсуждения.
ролизе. Известно, что АТР связывает катион Mg
Высвобождение так называемого «стехио
с хорошо известными количественными пара
метрического» протона (см. уравнение (1)) при
метрами, и АТРазная активность F1 снижается
наличии АТР и любой АТР гидролазной актив
при большем увеличении концентрации АТР,
ности должно приводить к закислению среды.
чем это необходимо для образования комплекса
Физиологическая концентрация АТР в матрик
АТР4-⋅Mg2+, и это снижение количественно со
се митохондрий составляет 5-10 мМ. Гидролиз
ответствует уменьшению концентрации свобод
АТР (закисление матрикса) и его синтез (заще
ного катиона [4, 7]. Интересно, что кинетически
лачивание) можно рассматривать как динами
инертные комплексы АТР с катионами ланта
ческую контролируемую Fo⋅F1 рН буферную
нидов не гидролизуются F1 АТРазой при отсут
систему матрикса митохондрий. Сильная
ствии Mg2+, и ее АТРазная активность, хотя и
рН зависимость влияния IF1 в физиологичес
небольшая (~10% от максимальной активности,
кой области рН и сама рН зависимость АТР
наблюдаемой в оптимальных условиях), появля
гидролазной активности Fo⋅F1 (см. ниже) позво
ется при добавлении Mg2+ [7]. Существование
ляют думать о комбинации АТР/ADP, IF1 и Fo⋅F1
специфического центра связывания Mg2+ с за
в качестве высокочувствительного рН стата
висящим от рН сродством ~10-5 М выявляется
матрикса митохондрий.
также в ADP зависимой трансформации F1 в
неактивную форму [8-10]. Участие связывания
Mg специфическим центром F1 в механизме ка
ADP(Mg2+) БЛОКИРОВАННАЯ
тализа, а возможно, и в механизме АТР зависи
ФОРМА Fo⋅F1
мой транслокации протонов, представляется
важной, сегодня забытой проблемой энзимоло
При обсуждении кинетики и последующего
гии фермента.
построения моделей механизмов любой фер
ментативной реакции в энзимологии принято
пользоваться стационарным приближением
СПЕЦИФИЧЕСКИЙ БЕЛКОВЫЙ
оценок начальных скоростей процесса. «На
ИНГИБИТОР F1 АТРазы
чальные скорости» гидролиза Fo⋅F1, освобож
денного от IF1, зависят от «истории» мембра
Растворимый F1 или разные препараты СМЧ
носвязанных препаратов фермента. Убыль
в зависимости от способа препаративного полу
субстрата реакции (появление продукта) проис
чения содержат или не содержат небольшой во
ходит либо линейно во времени, либо наблюда
дорастворимый белок (IF1), достаточно прочно
ется лаг фаза, либо «вспышка» активности, сме
связанный с F1 и который фактически должен
няющаяся постоянной скоростью реакции.
рассматриваться в качестве субъединицы ком
Природа этого явления, в литературе обозначае
плекса Fo⋅F1. Наличие этого белка в IF1 содер
мого как «ADP(Mg2+) ингибирование», обус
жащих препаратах затрудняет, а зачастую и ис
ловлена специфическим связыванием ADP
кажает измеряемые каталитические характерис
(обязательно в присутствии Mg2+) в активном
тики гидролиза АТР. Белок IF1 получен в гомо
центре F1, локализованном на одной из пар α β
генном состоянии, а доступность СМЧ, осво
субъединиц тримера F1. Преинкубация раство
божденных от него, позволила достаточно под
римого F1 или Fo⋅F1 в составе мембран в присут
робно изучить параметры взаимодействия Fo⋅F1
ствии очень низких, почти равных концентра
и IF1 [11-13]. IF1 медленно по сравнению с ка
ции F1 количеств ADP или АТР в присутствии
талитическими оборотами F1 ингибирует гидро
Mg2+ приводит к полному исчезновению АТР
БИОХИМИЯ том 84 вып. 11 2019
Fo⋅F1 АТРаза
1559
гидролазной активности [8, 14]. Полная, но
лучаемых на заведомо неидеальных (см. рис. 1)
медленная (десятки минут) активация фермента
препаратах СМЧ.
достигается добавлением Pi [15], удалением
Mg2+ (ЭДТА) [9], обработкой фосфоенолпиру
ватом в присутствии пируваткиназы [16], анио
СМЕНА ОБЪЕКТА: Paracoccus denitrificans
ном сульфита [17] и, наконец, инициированием
гидролиза субстратных количеств АТР [18].
В 1970 г. П. Джон и У. Гамильтон сообщили об
Энергизация мембран приводит к быстрой ак
отчетливо регистрируемом в препаратах инвер
тивации АТРазы ADP(Mg2+) ингибированного
тированных плазматических мембран почвен
фермента [19]. Отсутствие АТРазной активнос
ной бактерии Paracoccus denitrificans (Pd СБЧ)
ти F1 у многих прокариот, по видимому, обус
явлении дыхательного контроля, качественно и
ловлено, по крайней мере частично, естествен
количественно аналогичного сопряженным ми
ной «преинкубацией» с ADP. Интересно, что
тохондриям. На рис. 4 представлена синхронная
препараты, преинкубированные с ADP в коли
запись дыхания и мембранного потенциала ци
честве (концентрации), большем, чем это необ
топлазматических мембран P. denitrificans (рис. 4
ходимо для полного блокирования АТРазы, ак
воспроизведен из нашей публикации [23]). Поз
тивируются быстрее, чем «стехиометрически»
ингибированные [20]. Многие проявления этого
ингибирования (активация АТРазной активнос
ти рядом анионов, специфическое ингибирова
ние азид анионом [17], уже упоминавшаяся
стимуляция активности 2,4 динитрофенолом
[5], различие в кинетике гидролиза АТР и других
пуриновых нуклеотидов [17], влияние Mg2+ [21],
специфическая активация АТРазы детергентом
LDAO и отсутствие или очень низкая актив
ность АТРазы в мембранах прокариот) доста
точно хорошо объясняются кинетическими схе
мами, опубликованными в серии наших работ.
Потенциально важную роль в регулировании
АТРазной активности, по видимому, играет
также ε субъединица фермента, хотя данные о
ее влиянии часто противоречивы. Анализ этого
явления (в частности, его отсутствие в реакции
синтеза АТР препаратами сопряженных СМЧ)
привел нас к гипотезе, сегодня принимаемой
большинством энзимологов: механизмы реакций
синтеза и гидролиза АТР Fo⋅F1CАТРазами различC
ны, и эти молекулярные машины не подчиняются
принципу микрообратимости (детального равноC
весия). В самом общем виде эта гипотеза была
сформулирована много лет назад: существует
контролируемое рядом параметров равновесие
между двумя формами Fo⋅F1, каждая из которых
Рис. 4. Синхронная регистрация изменений электрическо
катализирует либо гидролиз (FH), либо синтез
го Δψ компонента р (кривая 1, усл. ед), поглощения кисло
(FS) [21, 22]:
рода (кривая 2) и синтеза АТР (кривая 3) препаратом соп
ряженных Pd СБЧ, суспендированных в среде, содержав
FH FS.
(2)
шей 0,25 М сахарозу, 1 мМ Hepes (рН 7,0), 0,1 мМ ЭДТА,
5 мМ MgCl2, 5 мМ K Pi, 5 мМ семикарбазид, 5 мМ этанол,
450 ед алкогольдегидрогеназы и 60 мкМ NADH (30 °С).
Такая модель объясняла одностороннее
Электрический потенциал (1) регистрировали по элек
действие нескольких соединений, специфичес
трохромному сдвигу поглощения оксонола VI; дыхание (2)
ких эффекторов АТРазной активности: белко
измеряли амперометрически кислород чувствительным
вого ингибитора IF1, антибиотика ауровертина,
электродом; синтез АТР (3) оценивали по изменению рН
при синтезе АТР с использованием стеклянного рН элек
азида, Pi и др. К сожалению, напрямую доказать
трода. Реакции начинали добавлением Pd СБЧ (указано
или опровергнуть это положение оказалось
незаштрихованными стрелками).
чрезвычайно трудным ввиду многочисленных
Рисунок взят из нашей публикации [23], воспроизведен с
возможностей интерпретации результатов, по
любезного разрешения издательства Elsevier
БИОХИМИЯ том 84 вып. 11 2019
1560
ВИНОГРАДОВ
же оксфордская группа сообщила об удивитель
ние АТР/ADP в этом состоянии не зависит ни от
ном явлении: сопряженные Pd СБЧ катализи
концентрации Pi (полноправного компонента
ровали окислительное фосфорилирование, но
фосфорильного потенциала), ни от количества
не обладали АТРазной активностью! Ввиду на
предварительно образованного АТР! Такой ре
шего интереса к описанному выше поведению
зультат показывает, что контролируемое дыха
митохондриального Fo⋅F1 мы, следуя «принципу
ние определяется не термодинамическими, а
Крога» (см. эпиграф), обратились к изучению
кинетическими параметрами [23].
фермента в сопряженных мембранах этого мик
роорганизма. Мы убеждены, что несмотря на
хорошо документированные различия в струк
КИНЕТИКА р ЗАВИСИМОГО
туре и некоторых каталитических свойствах
СИНТЕЗА АТР
Fo⋅F1 у разных организмов, главные принципы
функционирования этого энергопреобразующе
Синтез АТР из ADP и Pi - классическая би
го комплекса одинаковы у всех АТРаз F1 типа.
или трисубстратная реакция (если генерацию р
Мы начали с проверки отсутствия АТР гидро
рассматривать как ферментативную реакцию), в
лазной активности Pd Fo⋅F1, подозревая, что это
которой субстратом служит векторно перенося
удивительное явление обусловлено ADP(Mg2+)
щийся протон. Существование легко регистри
индуцированным блокированием активности.
руемого синтеза АТР мембранами P. denitrificans
Действительно, оказалось, что активированный
позволило сформулировать, хотя и очень упро
мембранным потенциалом (энергизацией) Pd
щенно, кинетическую схему процесса:
Fo⋅F1 катализирует как синтез, так и гидролиз
АТР с соизмеримыми скоростями [24, 25]. Для
регистрации обеих активностей потребовалось
создать специальные условия: энергизовать
,
(3)
мембраны сопряженным окислением либо сук
цината, либо NADH и начать реакцию одновре
менным добавлением АТР и ингибитора дыха
ния. Начавшаяся АТРазная активность продол
где D и T - ADP и АТР соответственно.
жается до тех пор, пока р поддерживается транс
Анализ начальных скоростей синтеза пока
локацией протонов Fo⋅F1 комплексом. Такой
зал, что связывание ADP и Pi происходит неупо
гидролиз стимулируется разобщителями и, та
рядоченно, и стадии 1 и 2 в последовательности
ким образом, происходит в самоподдерживае
(3) разделены необратимыми превращениями
мом режиме: АТРаза активна до тех пор, пока
(механизм пинг понг): снижение величины р
сопряженный гидролиз АТР поддерживает
пропорционально уменьшает стационарную кон
энергизацию мембран. Другими словами, по
центрацию интермедиата, превращающего свя
крайней мере часть энергии, высвобождаемой
занные субстраты в продукт реакции [26]. Отме
при каталитической реакции, расходуется на
тим, что точно такое же кинетическое поведе
поддержание фермента в метастабильном ак
ние ожидается, если неупорядоченному связы
тивном состоянии. Очевидно, что такая кинети
ванию субстратов предшествует энергозависи
ка не может быть описана в стандартных терми
мая трансформация фермента в форму, способ
нах, и каталитический цикл должен рассматри
ную связывать (неупорядоченно) субстраты.
ваться как работа машины. Такое замечательное
устройство физиологически оправдано: фер
мент должен «знать», что АТР, образованный не
КИНЕТИКА ГИДРОЛИЗА АТР:
дыханием, а другими источниками (путь Энтне
ВЛИЯНИЕ Pi
ра-Дудорова анаэробного распада глюкозы у
P. denitrificans), расходуется для поддержания
Хорошо известно, что Pi - естественный
жизненно необходимого потенциала плазмати
субстрат окислительного фосфорилирования -
ческой мембраны, а не бесполезно превращает
не ингибирует гидролиз АТР растворимым F1
ся в тепло. АТРазная активность быстро исчеза
или мембраносвязанным Fo⋅F1 при концентра
ет, если мембранный потенциал падает ниже до
циях, многократно превышающих величины Km
пустимого уровня при увеличении концентра
в реакции синтеза АТР. Это явление - сильное,
ции разобщителя. Как уже обсуждалось при
неоднократно нами подчеркиваемое указание на
описании дыхательного контроля и показано на
различия путей энергозависимых синтеза и гид
рис. 4, в заторможенном состоянии р «уравнове
ролиза АТР. Располагая заведомо сопряженны
шивается» фосфорильным потенциалом. Одна
ми препаратами Pd Fo⋅F1, мы обратились к изу
ко прямое измерение показало, что соотноше
чению влияния продукта реакции (Pi) на АТР
БИОХИМИЯ том 84 вып. 11 2019
Fo⋅F1 АТРаза
1561
гидролазную реакцию. Оказалось, что Pi не толь
сильно и неконкурентно с АТР тормозит АТРаз
ко не ингибирует АТРазную активность, но и неC
ную активность, практически не влияя на син
обходим для упорядоченного р зависимого высво
тез АТР. Важно отметить, что снижение актив
бождения продуктов гидролиза, и описанное ра
ности гидролиза АТР при снижении рН не соп
нее ADP(Mg2+) зависимое блокирование АТР
ровождается пропорциональным возрастанием
гидролазной активности непосредственно связа
активности синтеза, как следовало бы ожидать
но с этим необычным явлением. Ниже приведе
вследствие рН зависимого сдвига равновесия
на суммарная кинетическая схема энерготранс
(см. схему (2)).
формирующего сопряженного гидролиза [27]:
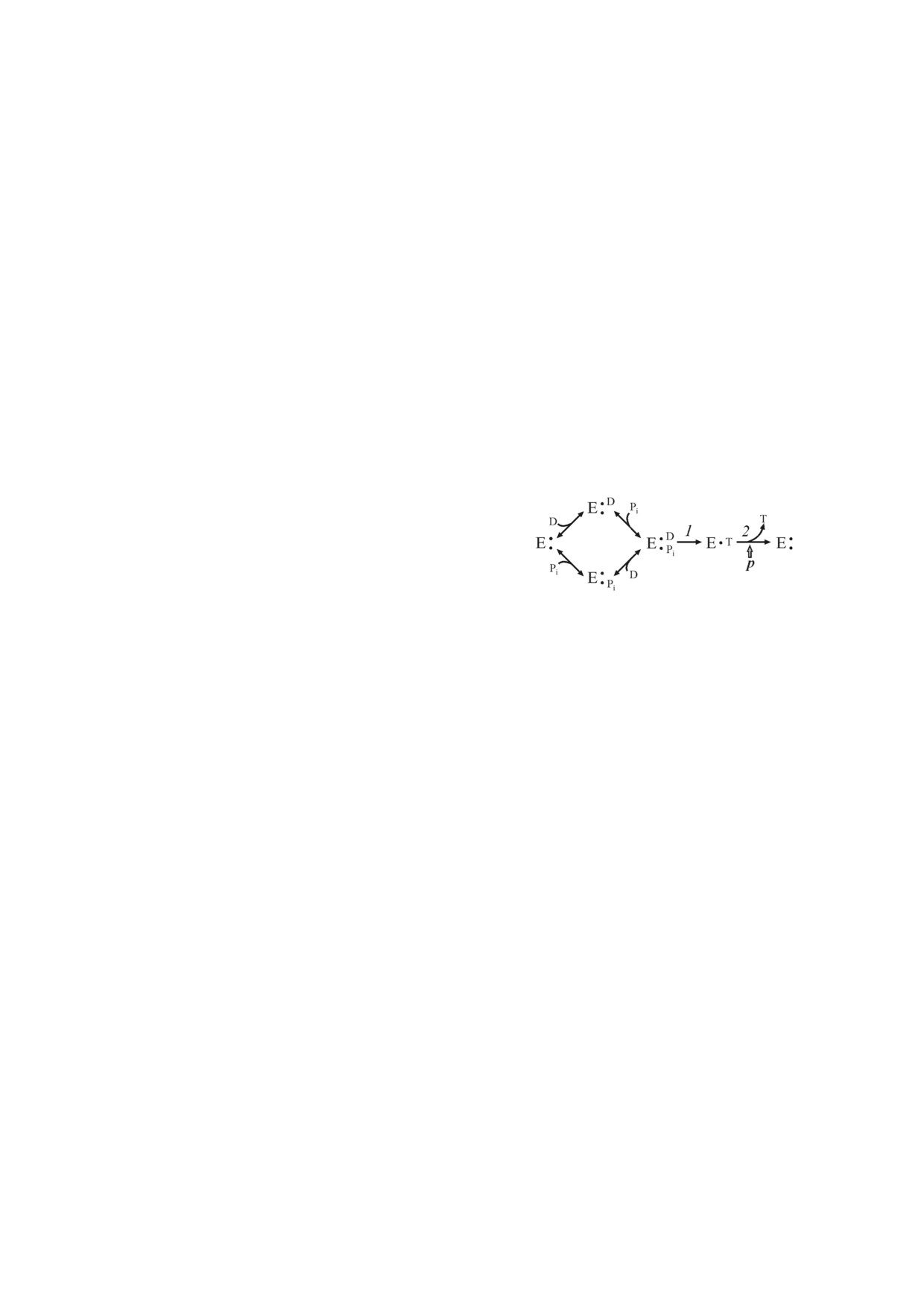
ГИПОТЕЗА И ЗАКЛЮЧЕНИЕ
Реакции синтеза и гидролиза АТР Fo⋅F1
АТРазами, по моему мнению, - одни из чрезвы
,
(4)
чайно сложных для изучения их кинетики, глав
ным образом потому, что «субстрат» и «продукт»
обеих реакций - векторно переносимый про
тон. Попытки разобраться в деталях работы
Fo⋅F1 привели нас к твердому убеждению о раз
личии механизмов синтеза и гидролиза АТР.
*
где E
•D - ADP(Mg2+), неактивная форма.
Нужно подчеркнуть, что все, что обсуждалось до
Высвобождение продуктов реакции проис
сих пор - упрощенная картина. Так, например,
ходит упорядоченно: р препятствует диссоциации
некоторые F1 АТРазы в дополнение к показан
Pi, и ADP должен высвобождаться первым. При
ным схемам с тремя активными центрами со
отсутствии р Pi имеет низкое сродство к актив
держат так называемые прочносвязанные, не
ному центру, и его диссоциация приводит к об
обмениваемые в ходе катализа нуклеотиды;
разованию интермедиата 3, быстро трансфор
ε субъединица фермента связывает АТР (ADP),
мирующемуся в ADP(Mg2+) неактивную форму
и изменение ее конформации влияет на АТР
F1 (4). При сравнении кинетических схем (3) и
гидролазную активность; Pd Fo⋅F1 содержит от
(4) стоит подчеркнуть, что в процессе синтеза
носительно недавно обнаруженную ζ субъеди
АТР субстраты фермента связываются неупоря
ницу, возможно, выполняющую функцию, ана
доченно, тогда как при гидролизе АТР путем
логичную митохондриальному IF1.
прямого обращения последовательности синте
Анализируя наши последние результаты и
за продукты реакции должны высвобождаться
опираясь на опыт современной энзимологии,
упорядоченно и включать стадию р зависимого
мы сочли целесообразным рассмотреть «прос
прочного связывания Pi.
той» вариант объяснения этих различий: сопря
гающие энергопреобразующие мембраны со
держат две неравновесные формы Fo⋅F1: одну
ДРУГИЕ ЭФФЕКТОРЫ КАТАЛИТИЧЕСКИХ
форму, кинетические свойства которой наилуч
АКТИВНОСТЕЙ Fo⋅F1
шим образом приспособлены для эффективно
регулируемого р зависимого синтеза АТР, и дру
Низкие концентрации антибиотика венту
гую форму, аналогичным образом приспособ
рицидина специфически блокируют Fo⋅F1, пре
ленную для АТР зависимой генерации р. Други
пятствуя транслокации протонов через Fo,
ми словами, формулируемая таким образом ги
действуя аналогично классическому ингибитору
потеза состоит в ликвидации двухсторонней
окислительного фосфорилирования - олигоми
стрелки в схеме (2). Здесь следует дать несколь
цину (олигомицин практически не ингибирует
ко пояснений, касающихся самих понятий равC
Fo⋅F1 прокариот). Чувствительности реакций
новесие и изоформы. Нет оснований полагать,
синтеза и гидролиза АТР препаратами Pd Fo⋅F1,
что существуют изоферменты (ферменты, коди
обработанными в идентичных условиях венту
руемые разными генами) Fo⋅F1, хотя нельзя ис
рицидином, существенно различаются: полу
ключить и такую возможность для отдельных
максимальное торможение синтеза и гидролиза
субъединиц комплекса. Под изоформами следу
происходит при концентрациях ~0,3 и 1,0 нмоль
ет понимать возможные варианты ковалентной
на 1 мг белка соответственно [28]. Ингибирова
посттрансляционной модификации, набора
ние неконкурентно с субстратами реакций. Дру
специфических аннулярных фосфолипидов,
гим односторонним эффектором оказывается
комплексы Fo⋅F1, содержащие или не содержа
значение рН: закисление среды от 8,0 до 7,0
щие дополнительные субъединицы. Мне кажет
БИОХИМИЯ том 84 вып. 11 2019
1562
ВИНОГРАДОВ
ся особенно привлекательной возможность су
эксперименты для ее проверки - всего лишь од
ществования комплексов с разноразмерными
но из направлений работы нашей группы.
наборами с субъединиц в протонопроводящем
кольце Fo, что должно привести к изменению
энергетики всего процесса.
Финансирование. Все цитированные работы
Теперь о равновесии или его отсутствии. Био
были выполнены при систематической финан
химики научились регистрировать внутримоле
совой поддержке Российского фонда фундамен
кулярные процессы, происходящие за времена
тальных исследований (проекты «Энзимология
порядка микросекунд (и быстрее). С другой сто
биоэнергетических систем» с момента основа
роны, перестройки (возникновение и исчезно
ния фонда, включая текущий грант № 17 04
вение) четвертичных структур белков фермен
00706/17).
тов могут происходить во временном промежут
Благодарности. Автор благодарит своих кол
ке порядка минут и даже часов. Здесь я подразу
лег (все они являются выпускниками кафедры
меваю под изоформами структуры, время жизни
биохимии биологического факультета МГУ
которых многократно превышает время, необ
им. М.В. Ломоносова), в разные годы участво
ходимое для акта катализа.
вавших в наших общих работах по изучению
Трудно удержаться от спекуляций примени
Fo⋅F1 АТРазы. Я особенно признателен В.Г. Гри
тельно ко все более популярным «биомедицин
венниковой за помощь в редактировании и под
ским» проектам (финансирование!). В послед
готовке рукописи, без которых эта публикация
нее время появилось несколько проектов по
была бы невозможна.
изучению новых Fo⋅F1 (например, микобактерий
Конфликт интересов. Автор заявляет об отсут
(туберкулез) или трипанасом), направленных на
ствии конфликта интересов.
поиск их специфических ингибиторов. Разные
Соблюдение этических норм. Настоящая
чувствительности синтетазной и гидролазной
статья не содержит описания каких либо иссле
активностей Pd Fo⋅F1 дают пищу для размышле
дований с участием людей и использованием
ний в этом направлении.
животных в качестве объектов. Митохондрии
Подчеркну, что предложенная гипотеза ни в
сердец крупного рогатого скота получали из ма
коем случае не может считаться доказанной, а териала коммерческих мясокомбинатов.
СПИСОК ЛИТЕРАТУРЫ
1.
Виноградов А.Д. (1984) Каталитические свойства
F1, Biochem. Biophys. Res. Commun., 89, 1300-1306,
АТР синтетазы митохондрий, Биохимия,
49,
doi: 10.1016/0006 291x(79)92150 8.
1220-1238.
9. Bulygin, V.V., and Vinogradov, A.D. (1991) Interaction of
2.
Виноградов А.Д. (1999) Митохондриальная АТР син
Mg2+ with Fо.F1 mitochondrial ATPase as related to its
тезирующая машина: пятнадцать лет спустя, БиохиC
slow active/inactive transition, Biochem. J., 276, 149-156,
мия, 64, 1443-1456.
doi: 10.1042/bj2760149.
3.
Vinogradov, A.D. (2000) Steady state and pre steady state
10. Bulygin, V.V., Syroeshkin, A.V., and Vinogradov, A.D.
kinetics of the mitochondrial Fo·F1 ATPase: is ATP syn
(1993) Nucleotide/H+ dependent change in Mg2+ affinity
thase a reversible molecular machine? J. Exp. Biol., 203,
at the ATPase inhibitory site of the mitochondrial F1 Fо
41-49.
ATP synthase, FEBS Lett., 328, 193-196, doi: 10.1016/
4.
Акименко В.К., Минков И.Б., Бакеева Л.Е., Виногра
0014 5793(93)80991 3.
дов А.Д. (1972) Выделение и свойства растворимой
11. Panchenko, M.V., and Vinogradov, A.D.
(1985)
АТФазы митохондрий сердца быка, Биохимия, 37,
Interaction between the mitochondrial ATP synthetase and
348-358.
ATPase inhibitor protein, FEBS Lett., 184, 226-230,
5.
Акименко В.К., Минков И.Б., Виноградов А.Д. (1971)
doi: 10.1016/0014 5793(85)80611 6.
О действии разобщителей на растворимую АТФазу
12. Панченко М.В., Виноградов А.Д. (1989) Кинетика взаи
митохондрий, Биохимия, 36, 655-658.
модействия АТФазы субмитохондриальных фрагментов
6.
Zharova, T.V., and Vinogradov, A.D. (2006) Requirement
и природного белка ингибитора, Биохимия, 54, 569-579.
of medium ADP for the steady state hydrolysis of ATP by
13. Васильева Е.А., Панченко М.В., Виноградов А.Д.
the proton translocating Paracoccus denitrificans Fo·F1
(1989) Взаимодействие АТФазы субмитохондриаль
ATP synthase, Biochim. Biophys. Acta, 1757, 304-310,
ных фрагментов и природного белка ингибитора в ус
doi: 10.1016/j.bbabio.2006.03.001.
ловиях генерации Δμ+ на мембране, Биохимия, 54,
7.
Сыроешкин А.В., Галкин М.А., Седлов А.В., Виногра
1490-1498.
дов А.Д. (1999) Кинетический механизм реакции гид
14. Fitin, A.F., Vasilyeva, E.A., and Vinogradov, A.D. (1979)
ролиза АТР митохондриальной Fо.F1 ATPазой: учас
An inhibitory high affinity binding site for ADP in the
тие ионов Mg2+ в гидролизе комплекса Mg.АТР, БиоC
oligomycin sensitive ATPase of beef heart submitochondri
химия, 64, 1337-1347.
al particles, Biochem. Biophys. Res. Commun., 86, 434-439,
8.
Minkov, I.B., Fitin, A.F., Vasilyeva, E.A., and Vinogradov, A.D.
doi: 10.1016/0006 291x(79)90884 2.
(1979) Mg2+ induced ADP dependent inhibition of the
15. Yalamova, M.V., Vasilyeva, E.A., and Vinogradov, A.D.
ATPase activity of beef heart mitochondrial coupling factor
(1982) Mutually dependent influence of ADP and Pi on the
БИОХИМИЯ том 84 вып. 11 2019
Fo⋅F1 АТРаза
1563
activity of mitochondrial adenosine triphosphatase,
22. Syroeshkin, A.V., Vasilyeva, E.A., and Vinogradov, A.D.
Biochem. Int., 4, 337-344.
(1995) ATP synthesis catalyzed by the mitochondrial F1 Fo
16.
Vasilyeva, E.A., Fitin, A.F., Minkov, I.B., and Vinogradov, A.D.
ATP synthase is not a reversal of its ATPase activity, FEBS
(1980) Kinetics of interaction of adenosine diphos
Lett., 366, 29-32, doi: 10.1016/0014 5793(95)00487 t.
phate and adenosine triphosphate with ATPase of bovine
23. Zharova, T.V., and Vinogradov, A.D. (2014) ATPase/syn
heart submitochondrial particles, Biochem. J.,
188,
thase activity of Paracoccus denitrificans Fo·F1 as related to
807-815, doi: 10.1042/bj1880807.
the respiratory control phenomenon, Biochim. Biophys.
17.
Vasilyeva, E.A., Minkov, I.B., Fitin, A.F., and Vinogradov, A.D.
Acta, 1837, 1322-1329, doi: 10.1016/j.bbabio.2014.04.002.
(1982) Kinetic mechanism of mitochondrial adenosine
24. Жарова Т.В., Виноградов А.Д. (2003) Протон трансло
triphosphatase. Inhibition by azide and activation by
цирующая ATP синтетаза Paracoccus denitrificans: ATP
sulphite, Biochem. J.,
202,
15-23, doi:
10.1042/
гидролазная активность, Биохимия, 68, 1370-1380.
bj2020015.
25. Zharova, T.V., and Vinogradov, A.D. (2004) Energy
18.
Vasilyeva, E.A., Minkov, I.B., Fitin, A.F., and Vinogradov, A.D.
dependent transformation of Fo·F1 ATPase in Paracoccus
(1982) Kinetic mechanism of mitochondrial adenosine
denitrificans plasma membranes, J. Biol. Chem., 279,
triphosphatase. ADP specific inhibition as revealed by the
12319-12324, doi: 10.1074/jbc.M311397200.
steady state kinetics, Biochem. J., 202, 9-14, doi: 10.1042/
26. Кегярикова К.А., Жарова Т.В., Виноградов А.Д. (2010)
bj2020009.
Протон транслоцирующая АТРаза Paracoccus denitrifiC
19.
Galkin, M.A., and Vinogradov, A.D. (1999) Energy
cans: кинетика окислительного фосфорилирования,
dependent transformation of the catalytic activities of the
Биохимия, 75, 1424-1434.
mitochondrial Fo.F1 ATP synthase, FEBS Lett., 448,
27. Zharova, T.V., and Vinogradov, A.D. (2006) Energy linked
123-126, doi: 10.1016/s0014 5793(99)00347 6.
binding of Pi is required for continuous steady state pro
20.
Булыгин В.В., Виноградов А.Д. (1989) Кинетические
ton translocating ATP hydrolysis catalyzed by Fo·F1 ATP
проявления взаимодействия трех нуклеотидсвязыва
synthase, Biochemistry, 45, 14552-14558, doi: 10.1021/
ющих центров митохондриальной АТФ синтетазы,
bi061520v.
Биохимия, 54, 1359-1367.
28. Zharova, T.V., and Vinogradov, A.D. (2017) Functional
21.
Minkov, I.B., Vasilyeva, E.A., Fitin, A.F., and Vinogradov, A.D.
heterogeneity of Fo·F1H+ ATPase/synthase in coupled
(1980) Differential effects of ADP on ATPase and oxidative
Paracoccus denitrificans plasma membranes, Biochim.
phosphorylation in submitochondrial particles, Biochem.
Biophys. Acta, 1858, 939-944, doi: 10.1016/j.bbabio.
Int., 1, 478-485.
2017.08.006.
NEW LOOK AT THE PROBLEM OF Fo⋅F1 ATPase REVERSIBILITY
Review
A. D. Vinogradov*
Lomonosov Moscow State University, Faculty of Biology, 119234 Moscow, Russia; ECmail: adv@biochem.bio.msu.su
Received June 19, 2019
Revised July 8, 2019
Accepted July 8, 2019
Fo⋅F1 ATPases of mitochondria, chloroplasts and bacteria transform an electrochemical gradient of protons across
energy conserving membrane to free energy of ATP phosphoryl potential. Fo⋅F1 ATPases are considered, almost con
ventionally, as the reversible molecular machines synthetizing or hydrolyzing ATP (depending on particular physio
logical conditions), taking as given the microreversibility principle of enzymatic catalysis. In his previous works the
author adhered to the position that the mechanisms of the Fo⋅F1 catalyzed ATP synthesis and hydrolysis differ
(Vinogradov, A. D. (2000) J. Exp. Biol., 203, 41 49). In this essay a new model is proposed which postulates the pres
ence of two nonCequilibrating isoforms of Fo⋅F1 unidirectionally catalyzing either synthesis or hydrolysis of ATP in the
coupling membranes.
Keywords: Fo⋅F1 ATPase, reversibility of enzymatic catalysis
БИОХИМИЯ том 84 вып. 11 2019