БИОХИМИЯ, 2019, том 84, вып. 11, с. 1564 - 1577
УДК 577.112.4
МАЛЫЕ БЕЛКИ ТЕПЛОВОГО ШОКА И НЕЙРОДЕГЕНЕРАТИВНЫЕ
ЗАБОЛЕВАНИЯ ЧЕЛОВЕКА
Обзор
© 2019
Л.К. Муранова*, А.С. Рыжавская*, М.В. Судницына*,
В.М. Шатов*, Н.Б. Гусев*,**
Московский государственный университет им. М.В. Ломоносова, биологический факультет,
119991 Москва, Россия; электронная почта: NBGusev@mail.ru
Поступила в редакцию 30.03.2019
После доработки 04.05.2019
Принята к публикации 27.06.2019
В обзоре представлены данные литературы и собственные экспериментальные результаты, касающиеся воз
можного участия малых белков теплового шока в развитии таких нейродегенеративных заболеваний, как
болезни Шарко-Мари-Тута, Паркинсона, Альцгеймера и таупатии. Проанализировано влияние точечных
мутаций, коррелирующих с развитием болезни Шарко-Мари-Тута, на стабильность, олигомерную струк
туру и шапероноподобную активность двух малых белков теплового шока HspB1 и HspB8. Показано, что то
чечные мутации влияют на равновесие между различными олигомерными формами HspB1, вследствие че
го могут меняться шапероноподобная активность и взаимодействие с белками партнерами, что приводит к
нарушению цитоскелета и гибели нейронов. Мутации HspB8 влияют на его взаимодействие с адаптерным
белком Bag3 и процесс аутофагии, что также может приводить к гибели нейронов. Представлены данные
литературы о влиянии малых белков теплового шока на развитие амилоидозов различной природы. Экспе
риментальные данные свидетельствуют о том, что малые белки теплового шока взаимодействуют с мономе
рами (или малыми олигомерами) амилоидогенных белков, стабилизируют их структуру, предотвращают аг
регацию и/или способствуют протеолитической деградации. Такой эффект оказывается возможным в силу
того, что β складки α кристаллинового домена малых белков теплового шока взаимодействуют с β склад
ками белка мишени и затрудняют его агрегацию. Помимо этого, малые белки теплового шока совместно с
другими белками теплового шока могут способствовать разборке олигомеров, образованных амилоидоген
ными белками. Несмотря на существенные достижения, потребуются значительные дополнительные ис
следования для детального понимания роли малых белков теплового шока в защите от различных нейроде
генеративных заболеваний.
КЛЮЧЕВЫЕ СЛОВА: малые белки теплового шока, шапероноподобная активность, аморфная агрегация,
β амилоиды, посттрансляционные модификации, нейродегенеративные заболевания.
DOI: 10.1134/S0320972519110046
Правильное сворачивание длинных поли
теплового шока: HspH (Hsp110), HspC (Hsp90),
пептидных цепей, синтезированных de novo, и
HspA (Hsp70), HspD/E (Hsp60/Hsp10), DNAJ
ренатурация белков, частично денатурирован
(Hsp40) и HspB (small heat shock proteins, sHsp)
ных под действием неблагоприятных условий,
(в старой номенклатуре цифра после обозначе
являются очень сложными процессами. В реа
ния Hsp соответствует молекулярной массе мо
лизации этих процессов участвует несколько се
номеров) [1, 2]. Для каждого из семейств белков
мейств так называемых белков теплового шока
теплового шока характерны свои особые свой
(heat shock proteins, Hsp), тесно взаимодейству
ства, функции и внутриклеточная локализация.
ющих между собой и обеспечивающих гомеос
Например, некоторые белки теплового шока
таз (протеостаз) белков в клетке. В клетках чело
(Hsp110, Hsp90, Hsp70, Hsp60) обладают АТРаз
века представлены следующие семейства белков
ной активностью, в то время как другие белки
теплового шока (DNAJ) участвуют в регуляции
АТРазной активности белков партнеров
Принятые сокращения: Hsp (heat shock proteins) -
(Hsp70) или вовсе не обладают АТРазной актив
белки теплового шока; sHsp (small heat shock proteins) - ма
лые белки теплового шока.
ностью (sHsp). Эффективное сворачивание по
* Автор является выпускником кафедры биохимии биоло
липептидных цепей становится возможным
гического факультета МГУ им. М.В. Ломоносова.
только при координированном участии всех
** Адресат для корреспонденции.
(или большей части) семейств белков теплового
1564
МАЛЫЕ БЕЛКИ ТЕПЛОВОГО ШОКА И ЗАБОЛЕВАНИЯ ЧЕЛОВЕКА
1565
шока. Каждое семейство включает в свой состав
Как уже отмечалось выше, главная функция
несколько белков, кодируемых несколькими ге
малых белков теплового шока состоит в поддер
нами, иногда даже десятками генов. Так, напри
жании белкового гомеостаза в клетке. Малые
мер, в геноме человека обнаружено 10 генов, ко
белки теплового шока могут осуществлять эту
дирующих малые белки теплового шока [3, 4].
функцию разными способами: 1) sHsp способны
Мономеры малых белков теплового шока чело
связывать частично денатурированные или не
века содержат 150-250 а.о. и имеют малую моле
правильно свернутые белки и препятствовать их
кулярную массу [5, 6]. Характерной чертой всех
агрегации [5, 6]. Образование такого комплекса
малых белков теплового шока является наличие
не только предотвращает агрегацию неправиль
высококонсервативного α кристаллиного доме
но свернутых белков, но и сохраняет их в состо
на (alpha crystallin domain, ACD), состоящего из
янии, наиболее приемлемом для дальнейшего
80-100 а.о. и образованного несколькими
взаимодействия с АТР зависимыми шаперона
(шестью семью) β складками (рис. 1, а) [7, 8].
ми, способными ренатурировать эти белки
Этот домен участвует в образовании димеров
субстраты [20]; 2) малые белки теплового шока
малых белков теплового шока, при этом в состав
могут способствовать удалению неправильно
таких димеров могут входить как одинаковые,
свернутых белков путем их деградации в протеа
так и разные мономеры малых белков теплового
сомах [6, 21] или аутофагосомах [22, 23]; 3) ма
шока [9-11]. В специальных условиях in vitro как
лые белки теплового шока совместно с белками
изолированные кристаллиновые домены, так и
Hsp110, Hsp70 и Hsp40 могут участвовать в дез
интактные малые белки теплового шока могут
агрегации (разборке) амилоидов [24]. Таким об
образовывать β амилоидные фибриллы [12, 13].
разом, малые белки теплового шока играют важ
Любопытно, что короткие фрагменты кристал
ную роль в защите клеток от накопления час
линового домена, способные препятствовать аг
тично денатурированных или неправильно
регации частично денатурированных белков
свернутых белков.
(т.е. проявляющие так называемую шапероно
Несмотря на многоступенчатую защиту
подобную активность), склонны к образованию
клетки от нарушений протеостаза, некоторые
амилоидных фибрилл [14]. Помимо консерва
нейродегенеративные заболевания оказываются
тивного α кристаллинового домена, малые бел
обусловленными повреждениями в системе пра
ки теплового шока содержат в своем составе
вильного сворачивания белка. Это может быть
различные по длине и структуре N концевой
связано либо с мутациями белков теплового шо
(NTD) и С концевой (СTD) домены (рис. 1, а).
ка, либо с накоплением чрезмерно большого ко
Те малые белки теплового шока, которые имеют
личества неправильно свернутых белков, рена
в составе своего С концевого домена консерва
турация или элиминация которых оказывается
тивный трипептид (I/V)X(I/V) (αА кристаллин
непосильной для системы контроля протеоста
(HspB4), αВ кристаллин (HspB5), а также
за.
HspB1), склонны к образованию очень крупных
В первой части обзора анализируются дан
олигомеров, содержащих более 20 мономеров.
ные о влиянии мутаций малых белков теплового
Это обусловлено тем, что указанный консерва
шока на развитие врожденной невропатии (бо
тивный гидрофобный трипептид может взаимо
лезни Шарко-Мари-Тута, Charcot-Marie-
действовать с гидрофобной канавкой, образо
Tooth disease) или дистальной врожденной нев
ванной β4-β8 складками кристаллинового до
ропатии (distal hereditary motor neuropathy,
мена, и тем самым обеспечивать формирование
dHMN). Во второй части обзора обобщаются
крупных олигомеров, собранных из нескольких
данные о возможном участии малых белков теп
димеров [15, 16]. Малые белки теплового шока
лового шока в защите клетки от накопления
отличаются по длине малоупорядоченного
амилоидов различный природы.
N концевого домена (NTD), который, по всей
видимости, играет важную роль в стабилизации
структуры крупных олигомеров и во взаимодей
МУТАЦИИ МАЛЫХ БЕЛКОВ
ствии с белками партнерами и белками мише
ТЕПЛОВОГО ШОКА И БОЛЕЗНЬ
нями [11]. Зачастую этот домен содержит один
ШАРКО-МАРИ-ТУТА II ТИПА
или несколько участков фосфорилирования [5,
6]. Фосфорилирование этих участков может
Врожденные невропатии являются широко
влиять на олигомерную структуру малых белков
распространенными гетерогенными заболева
теплового шока [17, 18] и на взаимодействие ма
ниями. Эти невропатии классифицируют как
лых белков теплового шока с белками партне
болезнь Шарко-Мари-Тута, если в качестве
рами, например, с универсальным белком адап
симптомов преобладает повреждение сенсор
тером 14 3 3 [19].
ных или моторных нейронов, и как дистальные
БИОХИМИЯ том 84 вып. 11 2019
1566
МУРАНОВА и др.
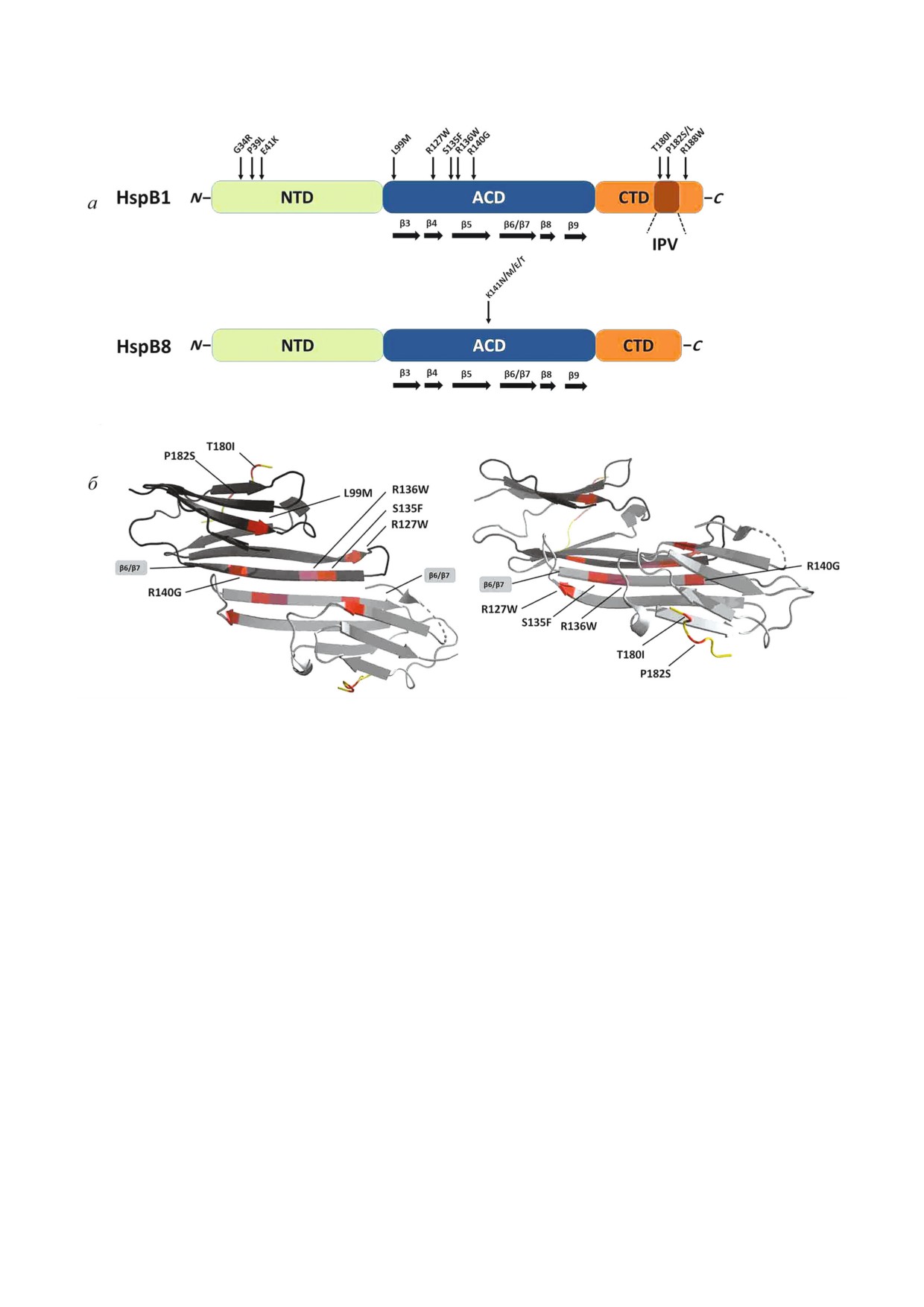
Рис. 1. а - Схема строения двух малых белков теплового шока HspB1 и HspB8. Зеленым цветом обозначен N концевой до
мен (NTD), синим цветом - α кристаллиновый домен (ACD) с указанием входящих в его состав β складок, оранжевым
цветом - C концевой домен (CTD), в котором отмечен консервативный трипептид IPV. Стрелками показано положение
точечных мутаций, сопряженных с развитием болезни Шарко-Мари-Тута; б - ленточная модель димера, образованного
фрагментом HspB1, включающего в свой состав кристаллиновый и С концевой домены. Указано положение β6/β7 склад
ки, обеспечивающей формирование димеров. Левый рисунок - вид сверху, правый рисунок - вид сбоку. Димеры повер
нуты друг относительно друга на 90°. Рисунок выполнен в программе PyMol на основе PDB файла 4MJH.
biokhsm/
моторные невропатии, - если преобладает пов
ния сигнала, но происходит повреждение аксо
реждение моторных нейронов [25]. Таким обра
нов. На долю болезни Шарко-Мари-Тута II ти
зом, дистальные моторные невропатии можно
па приходится ~40% пациентов, и среди них у
рассматривать как частный случай болезни
~10% больных выявляются мутации в генах трех
Шарко-Мари-Тута. Симптомы и причины воз
малых белков теплового шока: HspB1, HspB3 и
никновения болезни Шарко-Мари-Тута очень
HspB8 [27]. В настоящее время описано более 30
разнообразны, что затрудняет однозначную
мутаций в гене HspB1, одна мутация в гене HspB3
классификацию различных форм этого заболе
и 9 мутаций в гене HspB8 [28, 29]. Для понимания
вания [26]. В простейшей классификации выде
молекулярных механизмов, лежащих в основе
ляют болезнь Шарко-Мари-Тута I типа, при
возникновения патологий, желательно выяс
которой повреждается миелиновая оболочка и
нить, к каким изменениям структуры и свойств
уменьшается скорость проведения нервного сиг
белка приводят обнаруженные мутации.
нала, и болезнь Шарко-Мари-Тута II типа, при
В случае HspB1 оказалось, что мутации, свя
которой не наблюдается изменений в миелино
занные с болезнью Шарко-Мари-Тута, распо
вой оболочке и уменьшения скорости проведе
лагаются во всех трех доменах белка (рис. 1, а).
БИОХИМИЯ том 84 вып. 11 2019
МАЛЫЕ БЕЛКИ ТЕПЛОВОГО ШОКА И ЗАБОЛЕВАНИЯ ЧЕЛОВЕКА
1567
Три точечные мутации G34R, P39L и E41K, рас
возникшим вследствие мутации W136 соседнего
положенные в высококонсервативной области
мономера. Все анализируемые мутантные фор
N концевого домена HspB1, приводят к увели
мы HspB1 отличаются от белка дикого типа по
чению размера олигомеров, образованных этим
своей способности взаимодействовать с другим
белком, и уменьшению их термостабильности
малым белком теплового шока, HspB6, и, как
[18]. Как и белок дикого типа, эти мутантные
правило, обладают пониженной шаперонопо
формы подвергаются фосфорилированию под
добной активностью по сравнению с белком ди
действием МАРКАР киназы 2. Однако фосфо
кого типа при использовании большинства мо
рилирование белка дикого типа приводит к эф
дельных белков субстратов за исключением ин
фективной диссоциации крупных олигомеров, в
сулина [32-34]. Таким образом, мутации в
то время как фосфорилирование мутантных
α кристаллиновом домене сопровождаются су
форм лишь незначительно сказывается на изме
щественными изменениями в четвертичной
нении четвертичной структуры белка [18]. В ли
структуре, нарушениями в регуляции четвер
тературе утвердилось мнение, что индуцирован
тичной структуры под действием фосфорилиро
ная фосфорилированием диссоциация крупных
вания, а также изменением взаимодействия как
олигомеров HspB1 играет важную роль в шапе
с белками партнерами, так и с белками
роноподобной активности HspB1 [30], поэтому
субстратами.
мутации в N концевом домене могут нарушать
Мутации в С концевом домене HspB1 также
зависящую от фосфорилирования регуляцию
могут быть связаны с болезнью Шарко-Ма
шаперонной активности HspB1.
ри-Тута [29]. Точечные мутации T180I, P182S/L
Наибольшее количество мутаций HspB1,
и R188W располагаются в непосредственной
связанных с болезнью Шарко-Мари-Тута, рас
близости от консервативного пептида IPV, огра
положены в α кристаллиновом домене (рис. 1, а).
ниченного 181 и 183 а.о. Как уже отмечалось,
Этот домен (и особенно его β6/β7 складка)
этот пептид, расположенный в высокоподвиж
участвует в формировании межсубъединичных
ном С концевом домене, может взаимодейство
контактов в составе крупных олигомеров малых
вать с кристаллиновым доменом соседнего мо
белков теплового шока (рис. 1, б) [31], поэтому
номера и таким образом стабилизировать струк
можно предположить, что мутации в этом доме
туру крупных олигомеров HspB1 [15]. Действи
не будут приводить к изменению четвертичной
тельно, оказалось, что точечная мутация P182S
структуры HspB1. Действительно, оказалось,
приводит к понижению термостабильности и
что точечные мутации L99M, R127W, S135F и
образованию крупных полидисперсных агрега
R140G сопровождаются дестабилизацией чет
тов HspB1 [35]. Точечная мутация R188W также
вертичной структуры, приводящей при низкой
сопровождалась некоторым увеличением разме
концентрации белка к частичной диссоциации
ров олигомеров HspB1, хотя не оказывала замет
крупных олигомеров HspB1 [32-34]. Наоборот,
ного влияния на термостабильность белка. Ока
при высокой концентрации белка эти мутант
залось, что точечные мутации P182S и R188W
ные формы склонны образовывать олигомеры,
приводят к существенному уменьшению шапе
размеры которых существенно превосходят раз
роноподобной активности HspB1, измеренной
меры олигомеров HspB1 дикого типа. Этот эф
in vitro [35]. Это может быть обусловлено тем,
фект может быть обусловлен тем, что при непра
что С концевой домен играет важную роль во
вильной упаковке мономеров мутантных форм
взаимодействии малых белков теплового шока с
на поверхности олигомера оказываются экспо
белками субстратами [36].
нированными «липкие» участки, что приводит к
Итак, можно заключить, что каждая из то
повышенной склонности к ассоциации. Следует
чечных мутаций сопровождается различными
заметить, что из за общей дестабилизации
изменениями в свойствах HspB1 (рис. 2). Тем не
структуры фосфорилирование HspB1 с точеч
менее, несмотря на огромное разнообразие, то
ными мутациями L99M, R127W и S135F даже
чечные мутации, связанные с болезнью Шар
при низких степенях фосфорилирования при
ко-Мари-Тута, приводят к изменению одного
водит к диссоциации крупных олигомеров, что
или нескольких важных свойств HspB1: 1) изме
нехарактерно для белка дикого типа [32, 34]. То
нению олигомерного состояния или стабиль
чечная мутация R136W сопровождается образо
ности олигомеров, образуемых HspB1; 2) нару
ванием очень стабильных олигомеров, размер
шению регуляции олигомерного состояния,
которых существенно превышает размер олиго
контролируемой фосфорилированием; 3) изме
меров белка дикого типа. Это может быть связа
нению взаимодействия HspB1 с белками парт
но с общим изменением упаковки мономеров в
нерами и белками субстратами, что, как прави
составе олигомера и образованием гидрофоб
ло, сопровождается уменьшением шаперонопо
ных контактов между F138 одного мономера и
добной активности. Вероятно, ключевым мо
БИОХИМИЯ том 84 вып. 11 2019
1568
МУРАНОВА и др.
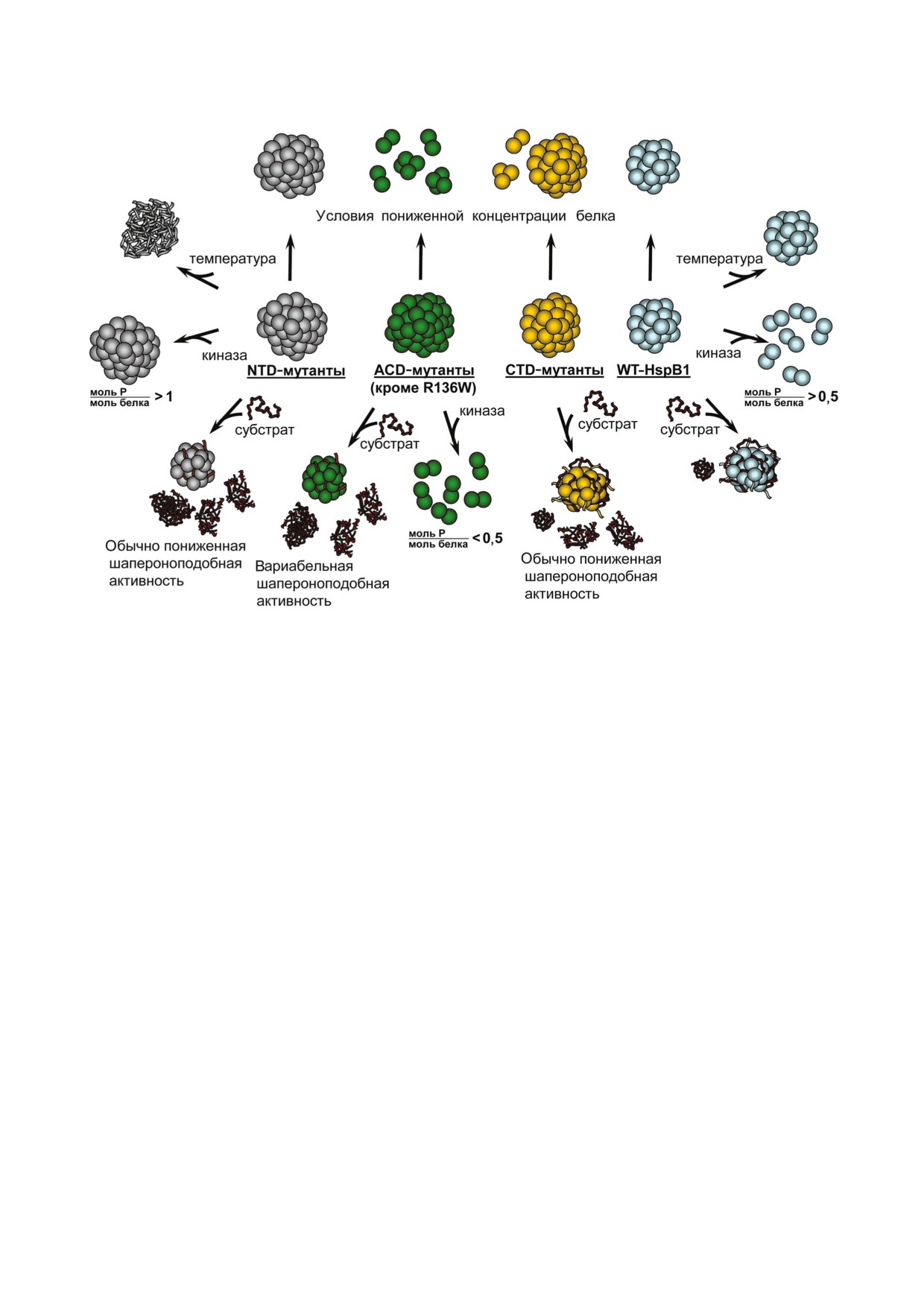
Рис. 2. Схематическое изображение изменений в структуре и свойствах мутантных форм HspB1, связанных с болезнью
Шарко-Мари-Тута. HspB1 дикого типа (WT HspB1) образует устойчивые к диссоциации крупные олигомерные ком
плексы, обладает высокой устойчивостью к нагреванию и высокой шапероноподобной активностью. Крупные олигоме
ры HspB1 дикого типа диссоциируют на малые олигомеры после включения > 0,5 моль фосфора на моль белка. Мутант
ные формы с точечными заменами в N концевом домене (NTD мутанты) образуют устойчивые к диссоциации крупные
олигомеры, обладающие низкой термической устойчивостью и, как правило, пониженной шапероноподобной актив
ностью. Олигомеры этих белков не диссоциируют после включения > 1 моль фосфора на моль белка. Мутантные формы
с точечными заменами в кристаллиновом домене (ACD мутанты) образуют крупные олигомеры, склонные к диссоциа
ции при низкой концентрации белка; они, как правило, обладают пониженной шапероноподобной активностью и, за
исключением мутантой формы R136W, диссоциируют на малые олигомеры после включения < 0,5 моль фосфора на моль
белка. Точечные мутантные формы с заменами в С концевом домене (СTD мутанты) образуют крупные олигомеры,
склонные к диссоциации при низкой концентрации белка и, как правило, обладающие пониженной шапероноподобной
активностью.
biokhsm/
ментом во всех этих процессах является наруше
мутациями HspB1 [38, 39]. Микротрубочки и
ние сборки олигомерных комплексов, потому
промежуточные филаменты (нейрофиламенты)
что считается, что обратимая ассоциация/дис
являются основными компонентами, участвую
социация субъединиц - необходимое условие
щими в формировании цитоскелета нейронов.
нормального функционирования HspB1 [37].
При этом оказалось, что HspB1 напрямую или
Очень важным представляется ответ на воп
опосредованно влияет на поддержание цитоске
рос о том, какие процессы оказываются нару
лета, образованного с участием микротрубочек
шенными вследствие мутаций HspB1. Как уже
и нейрофиламентов. Было установлено, что
отмечалось выше, мутации HspB1 ассоциирова
HspB1 способен взаимодействовать с тубулином
ны с аксональной формой болезни Шарко-Ма
и таким образом увеличивать стабильность мик
ри-Тута, при которой оказываются поврежден
ротрубочек [40]. Считается, что мутации в крис
ными длинные аксоны нейронов [27]. Поэтому
таллиновом домене повышают сродство HspB1
можно предположить, что именно повреждение
к тубулину, что способствует стабилизации мик
аксонов является одной из главных причин раз
ротрубочек [41, 42]. В нормальном состоянии
вития болезни Шарко-Мари-Тута, вызванной
микротрубочки являются высокодинамичными
БИОХИМИЯ том 84 вып. 11 2019
МАЛЫЕ БЕЛКИ ТЕПЛОВОГО ШОКА И ЗАБОЛЕВАНИЯ ЧЕЛОВЕКА
1569
структурами, подвергающимися постоянным
обеспечивает стабилизацию этих контактов за
процессам полимеризации и деполимеризации
счет образования солевого мостика с отрица
[43]. Борясь с недопустимо высокой стабиль
тельно заряженным остатком соседнего моно
ностью микротрубочек, вызванной связывани
мера [31]. HspB8, в отличие от HspB1, образует
ем мутантных форм HspB1 с тубулином, клетка
только малые олигомеры, по всей видимости,
повышает активность гистондеацетилаз (histone
находящиеся в равновесии с мономерами [50,
deacetylase 6, HDAC6), которые деацетилируют
51]. Вероятно, именно поэтому точечная мута
тубулин, приводя к разборке микротрубочек и
ция K141E не оказывает существенного влия
повреждению цитоскелета аксона [43]. В этой
ния на четвертичную структуру белка, однако
связи стоит отметить, что разработанные в пос
сопровождается дестабилизацией его структу
ледние годы избирательные ингибиторы гис
ры, что отражается в повышенной скорости ог
тондеацетилаз рассматриваются в качестве ле
раниченного протеолиза [52]. В зависимости от
карств, используемых при терапии болезни
природы модельного субстрата, точечный му
Шарко-Мари-Тута II типа [44].
тант K141E HspB8 обладает такой же или суще
Вторым важным компонентом цитоскелета,
ственно пониженной шапероноподобной ак
на который может влиять HspB1, являются про
тивностью по сравнению с белком дикого типа
межуточные филаменты (нейрофиламенты). Ус
[52]. По некоторым данным, точечная мутация
тановлено, что мутации S135F и P182L в HspB1
К141 приводит к ослаблению взаимодействия
сопровождаются повреждением сети нейрофи
HspB8 с адаптерным белком Bag3 [53, 54]. По
ламентов и могут приводить к гибели клеток [45,
другим данным, полученным на клеточном
46]. Точечные мутации R127W, S135F и P182L
уровне, мутация K141, напротив, сопровождает
коррелируют с увеличением фосфорилирования
ся усилением взаимодействия HspB8 с Bag3 [28].
нейрофиламентов, катализируемого протеин
Bag3 совместно с HspB8, белком Hsc70 и связан
киназой cdk5, что также приводит к поврежде
ной с шаперонами убиквитин лигазой CHIP об
нию цитоскелета [47].
разует гетероолигомерный комплекс, обеспечи
Результаты опытов, проведенных на транс
вающий убиквитирование денатурированных
генных мышах, экспрессирующих точечные му
белков и их последующую деградацию в аутофа
тантные формы HspB1 человека (S135F, R136W),
госомах [23, 29]. Индуцированное мутациями
в целом согласуются с результатами, получен
изменение взаимодействия HspB8 с Bag3 может
ными на клеточном уровне. У трансгенных жи
нарушать процесс протеолитической деграда
вотных были выявлены симптомы, характерные
ции денатурированных белков и таким образом
для болезни Шарко-Мари-Тута, такие как из
приводить к развитию различных нейродегене
менения локомоции, повреждения аксонов, по
ративных заболеваний. В последнее время поя
вышенный уровень фосфорилирования нейро
вились данные о том, что некоторые мутации
филаментов и пониженный уровень ацетилиро
HspB1 также могут препятствовать нормально
вания тубулина [48, 49]. Однако все эти симпто
му процессу аутофагии, оказывая влияние на
мы были выражены не столь ярко, как в случае
формирование фагофор [55].
болезни Шарко-Мари-Тута. Нет сомнения, что
Таким образом, мутации малых белков теп
потребуются дополнительные усилия как со
лового шока могут быть причиной развития ак
стороны врачей, так и со стороны ученых, рабо
сональной формы болезни Шарко-Мари-Тута.
тающих в области фундаментальной науки, для
В случае HspB1 мутации, как правило, сопро
полного понимания механизмов, лежащих в ос
вождаются изменением равновесия между раз
нове развития болезни Шарко-Мари-Тута,
личными олигомерными формами, следствием
вызванной мутациями HspB1.
чего является нарушение взаимодействия с бел
HspB8 (Hsp22) является другим малым бел
ками партнерами и белками мишенями, в част
ком теплового шока, мутации которого корре
ности с белками, участвующими в формирова
лируют с развитием болезни Шарко-Мари-Ту
нии цитоскелета (рис. 3). Повреждение цито
та [29]. Как и в случае HspB1, мутации могут на
скелета может приводить к гибели нейронов. В
ходиться как в N концевом, так и в α кристал
случае HspB8 мутации сопровождаются измене
линовом или С концевом доменах белка. Одна
нием взаимодействия с адаптерным белком
ко наиболее «горячей» точкой является остаток
Bag3, что в конечном итоге нарушает процессы
Lys141, который может быть заменен на остатки
шаперон зависимого убиквитирования и ауто
аспарагина, метионина, глутаминовой кислоты
фагии и приводит к накоплению в клетках дена
или треонина. Этот остаток гомологичен Arg140
турированных белков, следствием чего также
HspB1, Arg116 HspB4 и Arg120 HspB5, распола
становится гибель клетки (рис. 3). Таким обра
гается в области межсубъединичных контактов
зом, мутации малых белков теплового шока мо
двух мономеров малых белков теплового шока и
гут быть причиной нарушения протеостаза.
4 БИОХИМИЯ том 84 вып. 11 2019
1570
МУРАНОВА и др.
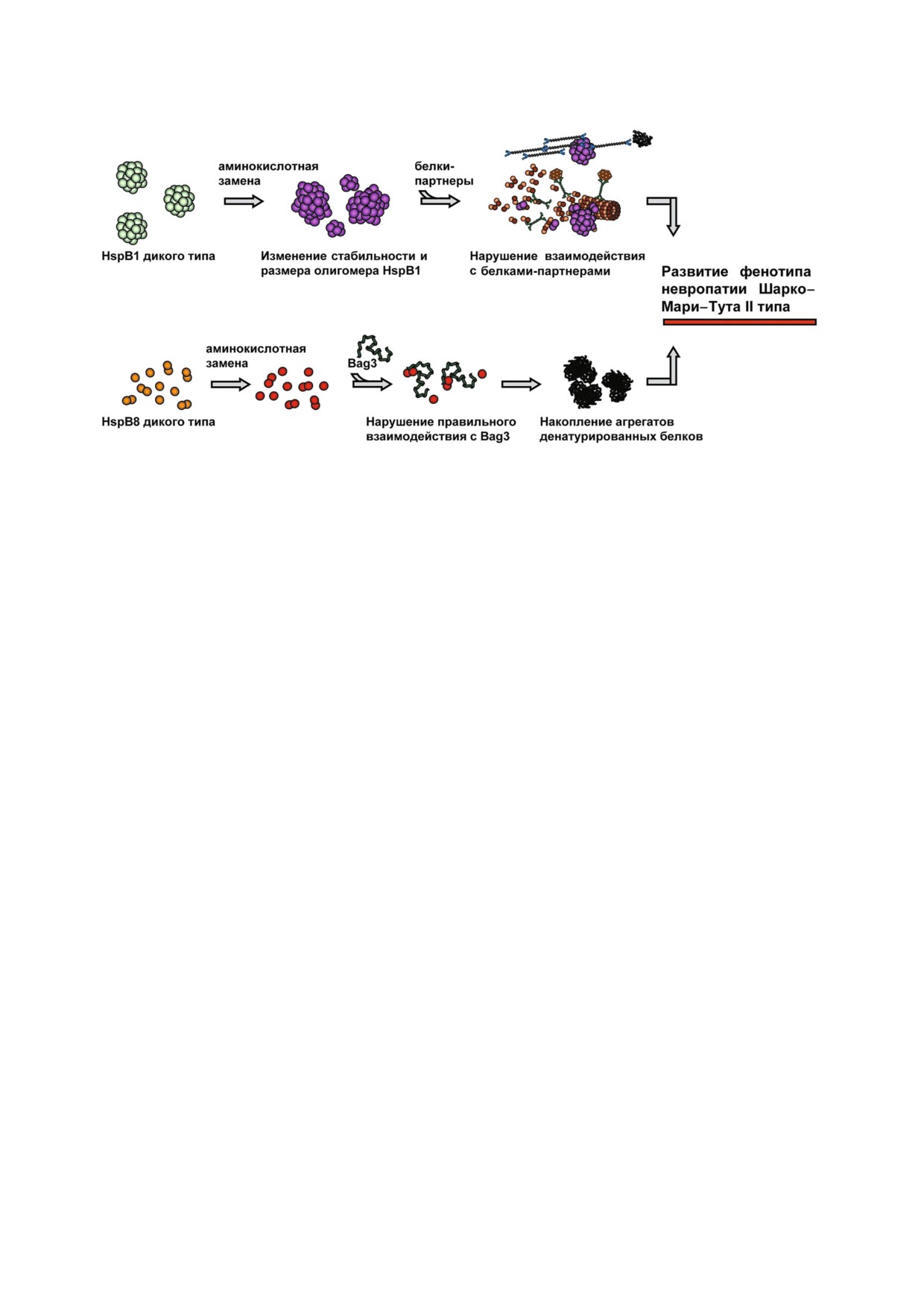
Рис. 3. Возможные механизмы влияния точечных мутаций малых белков теплового шока на развитие болезни Шар
ко-Мари-Тута. Точечные мутации HspB1 зачастую сопровождаются изменением стабильности олигомеров или регуля
ции олигомерного состояния, вследствие чего нарушается взаимодействие с белками мишенями или белками партнера
ми, что приводит к повреждению цитоскелета и/или иным нарушениям. Точечные мутации HspB8 нарушают его взаимо
действие с адаптерным белком Bag3, влияют на процессы аутофагии и приводят к накоплению агрегатов денатурирован
ных белков.
biokhsm/
Рассмотрим, каким образом малые белки
Литература, касающаяся влияния малых
теплового шока участвуют в предотвращении
белков теплового шока на агрегацию синуклеи
накопления агрегатов или амилоидных фиб
на, очень обширна. Считается, что синуклеин,
рилл, образуемых денатурированными белками
сравнительно короткий белок, содержащий
или белками, склонными к амилоидозу.
140 а.о., относится к группе внутренне разупо
рядоченных белков (intrinsically disordered pro
teins). При взаимодействии с мембраной или
УЧАСТИЕ МАЛЫХ БЕЛКОВ ТЕПЛОВОГО
при образовании тетрамеров значительная часть
ШОКА В ПРОЦЕССАХ АМИЛОИДОЗА
структуры синуклеина формирует упорядочен
ные α спиральные участки. Синуклеин может
Многие белки содержат в своей структуре
находиться в состоянии неупорядоченного мо
протяженные участки, склонные к образованию
номера или в состоянии неправильно свернуто
β структур. Кроме того, точечные мутации мо
го мономера, склонного к агрегации [56]. Веро
гут приводить к повышению вероятности обра
ятность перехода в состояние неправильно
зования β складчатых структур в тех участках
свернутого мономера возрастает при различных
полипептидной цепи, где ранее располагались
стрессорных воздействиях и в случае точечных
α спирали или участки неупорядоченной струк
мутаций A53T, A30P и E46K синуклеина [57].
туры. Если такие, склонные к образованию
Дестабилизированные неправильно упакован
β структур, участки оказываются в непосред
ные мономеры образуют β амилоидные пре
ственной близости друг от друга и в высокой
фибриллы, которые позднее формируют фиб
концентрации, то за счет латеральной агрегации
риллы и превращаются в тельца Леви, обнару
эти участки взаимодействуют между собой, сна
живаемые в нейронах пациентов с болезнью
чала образуя префибриллы, которые при даль
Паркинсона [57].
нейшем росте формируют фибриллы, склонные
Образование агрегатов синуклеина (телец
к дальнейшей агрегации и формированию телец
Леви) зачастую сопровождается повышением
включения. Среди белков, способных образо
уровня экспрессии HspB1 и HspB5 [58]. Подроб
вывать амилоиды, можно упомянуть α синукле
ное исследование влияния малых белков тепло
ин, амилоидный пептид Аβ1-40, прионы, тау
вого шока на агрегацию синуклеина привело к
белок и многие другие.
заключению, что HspB1 и HspB5 не способны
БИОХИМИЯ том 84 вып. 11 2019
МАЛЫЕ БЕЛКИ ТЕПЛОВОГО ШОКА И ЗАБОЛЕВАНИЯ ЧЕЛОВЕКА
1571
образовывать прочные комплексы с мономера
ный эффект может быть связан с тем, что при
ми синуклеина, но, по всей видимости, обеспе
сверхэкспрессии HspB5 начинает конкуриро
чивают стабилизацию структуры мономера и
вать с HspB8 за взаимодействие с Bag3 и таким
препятствуют переходу мономера синуклеина в
образом ингибирует нормальный процесс ауто
форму, склонную к олигомеризации. Такая ак
фагии.
тивность характерна как для интактных малых
Помимо синуклеина малые белки теплового
белков теплового шока, так и для их изолиро
шока (HspB1, HspB5, HspB6, HspB8) могут свя
ванного α кристаллинового домена [59]. Поми
зываться с Аβ амилоидными пептидами. Уста
мо этого, HspB1 и HspB5 могут связываться с
новлено, что различные малые белки теплового
малыми агрегатами синуклеина и даже с амило
шока накапливаются в сенильных бляшках
идными фибриллами, предотвращая их диссо
(senile plaque), обнаруживаемых в клетках паци
циацию и индуцированную таким образом вто
ентов с болезнью Альцгеймера и образованных
ричную нуклеацию [60]. Дальнейшие экспери
преимущественно фибриллами, сформирован
менты показали, что HspB1 может располагать
ными амилоидными пептидами [65, 66]. При
ся на поверхности фибрилл синуклеина, умень
этом малые белки теплового шока (HspB1,
шая их гидрофобность и предотвращая их агре
HspB5, HspB6, HspB8), находящиеся в этих аг
гацию и элонгацию [61].
регатах, могут быть ковалентно «сшиты» с ами
Следует отметить, что изолированный крис
лоидным пептидом под действием трансглута
таллиновый домен эффективно стабилизирует
миназы [65]. Малые белки теплового шока не
структуру мономерного синуклеина, однако не
только локализуются вместе с агрегатами, обра
способен связываться с фибриллами синуклеи
зованными амилоидными пептидами, но также
на и предотвращать их агрегацию и элонгацию
способны препятствовать их агрегации [67-69].
[61]. Высказывается предположение, что участ
Высказывается предположение, что в зависи
ки, обеспечивающие предотвращение аморф
мости от природы амилоидного пептида
ной агрегации модельных субстратов и ингиби
(Aβ1-42 или D Aβ1-40) малые белки теплового
рующие формирование амилоидов, располага
шока могут влиять на взаимодействие мономе
ются в разных частях молекулы малых белков
ров (или малых олигомеров пептида) с внешней
теплового шока. Участки, предотвращающие
мембраной клетки, а HspB5 способен предотв
аморфную агрегацию лизоцима, располагаются
ращать переход протофибрилл в зрелые фиб
в N концевом домене малых белков теплового
риллы [69]. Добавление амилоидного пептида к
шока, а участки, предотвращающие агрегацию
культуре кортикальных астроцитов крысы соп
амилоидного пептида Аβ1-40, - в центральном
ровождалось выходом HspB1 и связыванием до
кристаллиновом домене [62]. Такое взаимодей
бавленного пептида
[68]. Установлено, что
ствие становится возможным потому, что крис
HspB6 способен защищать клетки нейробласто
таллиновый домен содержит шесть или семь
мы SH SY5Y от последствий накопления
тесно упакованных между собой β складок, ко
Aβ амилоидного пептида [70]. При этом HspB6
торые, по всей видимости, способны взаимо
связывается именно с тем участком пептида, ко
действовать с β складками белков мишеней. В
торый участвует в полимеризации и агрегации.
этой связи следует отметить, что в определен
Фосфорилирование HspB6 усиливает его взаи
ных условиях in vitro кристаллин способен обра
модействие с низкомолекулярными формами
зовывать β амилоиды, которые при этом оказы
амилоидного пептида и повышает эффектив
ваются функционально активными и обладают
ность в предотвращении амилоидоза. Оказа
шапероноподобной активностью, сопостави
лось, что даже короткий 25 членный N конце
мой с таковой у интактного белка [12, 13]. Более
вой пептид HspB6, содержащий в своем составе
того, недавно опубликованные данные свиде
фосфорилируемый остаток серина, может быть
тельствуют о том, что при катаракте в глазу на
использован для предотвращения агрегации
капливаются β амилоидные структуры [63].
фибрилл, образованных амилоидным пептидом
Как следует из представленных данных, до
[70].
минирующим является заключение, что малые
Еще одним белком, склонным к агрегации и
белки теплового шока (в первую очередь HspB1
образующим нейрофибриллярные пучки (neu
и HspB5) тем или иным способом (стабилизируя
rofibrillary tangles), обнаруживаемые в клетках
мономеры синуклеина и/или предотвращая
пациентов с болезнью Альцгеймера, является
сборку фибрилл) препятствуют агрегации си
тау белок. Это небольшой многофункциональ
нуклеина. Тем не менее, оказалось, что сверхэкс
ный внутренне разупорядоченный белок, ос
прессия HspB5 в клетках глиобластомы челове
новной функцией которого долгое время счита
ка может способствовать накоплению агрегатов
лась стабилизация микротрубочек [71]. Тау бе
синуклеина в астроцитах [64]. Этот неожидан
лок может подвергаться гиперфосфорилирова
БИОХИМИЯ том 84 вып. 11 2019
4*
1572
МУРАНОВА и др.
нию под действием многочисленных и разнооб
разборку и появление особенно опасных малых
разных протеинкиназ, что сопровождается ос
олигомеров, являющихся новыми центрами
лаблением его взаимодействия с тубулином и
олигомеризации
[83]. Фосфорилированный
увеличением вероятности агрегации с образова
HspB6 образует прочные комплексы с белком
нием включений разного типа и развитием так
14 3 3 [84] и поэтому может эффективно конку
называемых таупатий [72, 73].
рировать с фосфорилированным тау белком за
Оказалось, что HspB1 лучше связывается с
связывание с белком 14 3 3. Таким образом,
гиперфосфорилированным тау белком и таким
фосфорилированный HspB6 может опосредо
образом уменьшает количество склонного к аг
ванно влиять на возможное участие белка 14 3 3
регации тау белка. Помимо этого, HspB1 увели
в регуляции агрегации тау белка.
чивает скорость дефосфорилирования парных
Экспериментальные данные, касающиеся
спиральных филаментов (paired helical filaments),
влияния малых белков теплового шока на агре
образованных гиперфосфорилированным тау
гацию прионов, достаточно противоречивы.
белком [74]. Высказывается предположение, что
При введении в мозг хомяков приона, вызываю
HspB1 каким то образом узнает участки фосфо
щего скрепи (скрепи агент 263), наблюдалось
рилирования в структуре тау белка и тем самым
существенное увеличение синтеза HspB5, одна
предотвращает агрегацию и способствует его
ко не было выявлено совместной локализации
протеолитической деградации [75]. Экспери
HspB5 и агрегатов, образованных прионом
ментальные данные свидетельствуют в пользу
PrPSc. Уровень HspB5 в головном мозге сущест
того, что гиперфосфорилирование приводит к
венно увеличивается при различных прионных
дальнейшей дестабилизации структуры тау бел
заболеваниях, однако высказывается сомнение,
ка. Такой сильно дестабилизированный белок
что такое повышение каким то образом влияет
склонен к агрегации, и HspB1 блокирует или
на патогенез прионных инфекций [85]. Однов
тормозит этот процесс. Параллельно с этим де
ременно с этим было установлено, что малые
стабилизированный тау белок может подвер
белки теплового шока дрожжей Hsp26 и Hsp42
гаться ренатурации или протеолитической дег
препятствуют прионогенезу прионного белка
радации, и HspB1 тем или иным образом спосо
Sup35 дрожжей. При этом Hsp42 ингибирует
бствует обоим этим процессам [76]. В работе,
рост фибрилл с концов, а Hsp26 тормозит са
выполненной на склонном к агрегации и обра
мосборку прионных фибрилл. Кроме того, ма
зованию фибрилл пептиде, содержащем 244-369
лые белки теплового шока дрожжей совместно с
а.о. тау белка, было показано, что HspB1 со
Hsp40, Hsp70 и Hsp104 дестабилизируют прион
сравнительно низким сродством кратковремен
ные фибриллы и способствуют их разборке [86].
но связывается с таким пептидом и при этом за
Таким образом, можно заключить, что ма
медляет процесс образования фибрилл [77].
лые белки теплового шока взаимодействуют
Высказывается предположение, что VQI три
преимущественно с мономерами (или малыми
пептиды, дважды повторяющиеся в структуре
олигомерами) внутренне разупорядоченных
пептида тау белка, ограниченного остатками
белков, склонных к образованию амилоидов.
244-369, взаимодействуют с гидрофобной ка
Взаимодействуя с такими белками, малые белки
навкой, образованной β4-β8 складками крис
теплового шока стабилизируют их структуру,
таллинового домена HspB1, т.е. взаимодейству
предотвращают агрегацию этих белков и/или
ют с теми участками, которые при отсутствии
способствуют их протеолитической деградации
субстрата заняты (I/V)X(I/V) пептидом, распо
(рис. 4). По всей видимости, такого рода взаи
ложенным в С концевом домене HspB1 [77, 78].
модействие осуществляется за счет склонных к
Помимо прямого воздействия на процессы
образованию амилоидогенных образований -
агрегации тау белка, малые белки теплового
β4-β8 складок α кристаллинового домена ма
шока могут оказывать опосредованное влияние
лых белков теплового шока [62]. В ходе такого
на эти процессы. Например, данные литературы
взаимодействия образуются смешанные струк
свидетельствуют о том, что универсальный
туры, в которых β складки малых белков тепло
адаптерный белок 14 3 3 способен непрочно
вого шока взаимодействуют с β складками мо
взаимодействовать с нефосфорилированным
номеров амилоидогенных белков. В пользу
тау белком и значительно прочнее - с несколь
сходства структур, образуемых амилоидогенны
кими участками фосфорилированного тау бел
ми белками и малыми белками теплового шока,
ка [79-82]. В зависимости от условий и места
свидетельствует тот факт, что как малые белки
связывания на тау белке белок 14 3 3 может
теплового шока (HspB5), так и амилоиды, обра
способствовать фосфорилированию и провоци
зованные тау белком, способны взаимодейство
ровать агрегацию и/или стабилизировать агре
вать с никотиновым ацетилхолиновым рецепто
гаты тау белка и тем самым предотвращать их
ром α7, индуцировать передачу сигнала через
БИОХИМИЯ том 84 вып. 11 2019
МАЛЫЕ БЕЛКИ ТЕПЛОВОГО ШОКА И ЗАБОЛЕВАНИЯ ЧЕЛОВЕКА
1573
Рис. 4. Малые олигомеры, образующиеся после фосфорилирования малых белков теплового шока (HspB), могут с исполь
зованием разных участков предотвращать аморфную агрегацию частично денатурированных белков и накопление амило
идных фибрилл посредством связывания мономеров или малых олигомеров амилоидогенных белков.
biokhsm/
белок Stat3, активировать аутофагию и подав
олигомерами. Точечные мутации, нарушающие
лять секрецию воспалительных интерлейкинов
равновесие между различными олигомерными
[87, 88]. Высказывается предположение, что в
формами HspB1, могут оказывать влияние на
том случае, когда малые белки теплового шока
стабильность, шапероноподобную активность и
представлены крупными олигомерами, β4-β8
способность взаимодействовать с белками
складка, ответственная за взаимодействие с
партнерами. Точечные мутации HspB8 могут
амилоидогенными белками, занята консерва
влиять на его взаимодействие с адаптерным бел
тивным (I/V)X(I/V) трипептидом, расположен
ком Bag3 и регуляцию процессов аутофагии,
ным в С концевом домене малых белков тепло
обеспечивающих избирательный протеолиз
вого шока. Вследствие этого крупные олигоме
неправильно свернутых белков. Вследствие это
ры малых белков теплового шока малоэффек
го мутации малых белков теплового шока могут
тивны во взаимодействии с амилоидогенными
приводить к развитию такого нейродегенера
белками. В ходе стресса и зачастую связанного с
тивного заболевания, как болезнь Шарко-Ма
ним фосфорилирования крупные олигомеры
ри-Тута. β Складки α кристаллинового домена
малых белков теплового шока диссоциируют на
в определенных условиях способны узнавать
мелкие олигомеры, гидрофобная β4-β8 склад
β складки амилоидогенных белков субстратов,
ка становится доступной для взаимодействия с
взаимодействовать с ними и таким образом ста
амилоидогенными белками, и после этого ма
билизировать их структуру, предотвращать агре
лые белки теплового шока оказываются способ
гацию и/или способствовать протеолитической
ными эффективно предотвращать агрегацию
деградации неправильно свернутых белков.
белков субстратов [89].
Вследствие этого малые белки теплового шока
могут предотвращать или замедлять развитие та
Малые белки теплового шока являются од
ких нейродегенеративных заболеваний, как бо
ним из важных компонентов сложной системы
лезнь Паркинсона, болезнь Альцгеймера, раз
шаперонов, которая контролирует правильное
личные виды таупатий и прионные болезни.
сворачивание белка и предотвращает накопле
ние частично денатурированных белков в клет
ке. Значительная часть малых белков теплового
Финансирование. Работа выполнена при под
шока склонна к образованию лабильных олиго
держке Российского фонда фундаментальных
меров, находящихся в равновесии с малыми
исследований (грант № 19 04 00038).
БИОХИМИЯ том 84 вып. 11 2019
1574
МУРАНОВА и др.
Благодарности. Все авторы этой работы яв
несмотря на возникающие проблемы и труднос
ляются выпускниками кафедры биохимии био
ти, наша кафедра будет продолжать готовить за
логического факультета МГУ. Наша работа была
интересованных и грамотных специалистов био
бы невозможной, если бы она не опиралась на
химиков.
знания и навыки, полученные во время обуче
Конфликт интересов. Авторы заявляют об от
ния на нашей кафедре, на традиции, заложен
сутствии конфликта интересов.
ные основателем кафедры биохимии академи
Соблюдение этических норм. Настоящая
ком С.Е. Севериным. В год восьмидесятилетия
статья не содержит описания выполненных ав
мы хотим пожелать кафедре биохимии больших
торами исследований с участием людей и ис
успехов и выразить надежду, что и в будущем, пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Vos, M.J., Hageman, J., Carra, S., and Kampinga, H.H.
12.
Carver, J.A., Ecroyd, H., Truscott, R.J.W., Thorn, D.C.,
(2008) Structural and functional diversities between mem
and Holt, C. (2018) Proteostasis and the regulation of
bers of the human HSPB, HSPH, HSPA, and DNAJ chap
intra and extracellular protein aggregation by ATP inde
erone families, Biochemistry, 47, 7001-7011, doi: 10.1021/
pendent molecular chaperones: lens α crystallins and milk
bi800639z.
caseins, Acc. Chem. Res., 51, 745-752, doi: 10.1021/
2.
Vilasi, S., Bulone, D., Caruso Bavisotto, C., Campanella, C.,
acs.accounts.7b00250.
Marino Gammazza, A., San Biagio, P.L., Cappello, F.,
13.
Garvey, M., Ecroyd, H., Ray, N.J., Gerrard, J.A., and
Conway de Macario, E., and Macario, A.J.L. (2017)
Carver, J.A. (2017) Functional amyloid protection in the
Chaperonin of group I: oligomeric spectrum and biochem
eye lens: retention of α crystallin molecular chaperone
ical and biological implications, Front. Mol. Biosci., 4, 99,
activity after modification into amyloid fibrils,
doi: 10.3389/fmolb.2017.00099.
Biomolecules, 7, E67, doi: 10.3390/biom7030067.
3.
Fontaine, J.M., Rest, J.S., Welsh, M.J., and Benndorf, R.
14.
Tanaka, N., Tanaka, R., Tokuhara, M., Kunugi, S.,
(2003) The sperm outer dense fiber protein is the 10th
Lee, Y.F., and Hamada, D. (2008) Amyloid fibril formation
member of the superfamily of mammalian small stress pro
and chaperone like activity of peptides from αA crystallin,
teins, Cell Stress Chaperones, 8, 62-69, doi: 10.1379/1466
Biochemistry, 47, 2961-2967, doi: 10.1021/bi701823g.
1268(2003)8<62:tsodfp>2.0.co;2.
15.
Delbecq, S.P., Jehle, S., and Klevit, R. (2012) Binding
4.
Kappe, G., Franck, E., Verschuure, P., Boelens, W.C.,
determinants of the small heat shock protein, αB crys
Leunissen, J.A., and de Jong, W.W. (2003) The human
tallin: recognition of the ‘IxI’ motif, EMBO J., 31,
genome encodes 10 α crystallin related small heat shock
4587-4594, doi: 10.1038/emboj.2012.318.
proteins: HspB1 10, Cell Stress Chaperones, 8, 53-61,
16.
Hochberg, G.K., and Benesch, J.L. (2014) Dynamical
doi: 10.1379/1466 1268(2003)8<53:thgecs>2.0.co;2.
structure of αB crystallin, Prog. Biophys. Mol. Biol., 115,
5.
Mymrikov, E.V., Seit Nebi, A.S., and Gusev, N.B. (2011)
11-20, doi: 10.1016/j.pbiomolbio.2014.03.003.
Large potentials of small heat shock proteins, Physiol. Rev.,
17.
Jovcevski, B., Kelly, M.A., Rote, A.P., Berg, T., Gastall, H.Y.,
91, 1123-1159, doi: 10.1152/physrev.00023.2010.
Benesch, J.L., Aquilina, J.A., and Ecroyd, H.
(2015)
6.
Bakthisaran, R., Tangirala, R., and Rao, C.M. (2015)
Phosphomimics destabilize Hsp27 oligomeric assemblies
Small heat shock proteins: role in cellular functions and
and enhance chaperone activity, Chem. Biol., 22, 186-195,
pathology, Biochim. Biophys. Acta,
1854,
291-319,
doi: 10.1016/j.chembiol. 2015.01.001.
doi: 10.1016/j.bbapap.2014.12.019.
18.
Muranova, L.K., Weeks, S.D., Strelkov, S.V., and Gusev, N.B.
7.
Bagneris, C., Bateman, O.A., Naylor, C.E., Cronin, N.,
(2015) Characterization of mutants of human small heat
Boelens, W.C., Keep, N.H., and Slingsby, C.
(2009)
shock protein HspB1 carrying replacements in the N ter
Crystal structures of α crystallin domain dimers of αB
minal domain and associated with hereditary motor neuron
crystallin and Hsp20, J. Mol. Biol., 392, 1242-1252,
diseases, PLoS One, 10, e0126248, doi: 10.1371/journal.
doi: 10.1016/j.jmb.2009.07.069.
pone.0126248.
8.
Baranova, E.V., Weeks, S.D., Beelen, S., Bukach, O.V.,
19.
Sluchanko, N.N., Beelen, S., Kulikova, A.A., Weeks, S.D.,
Gusev, N.B., and Strelkov, S.V. (2011) Three dimensional
Antson, A.A., Gusev, N.B., and Strelkov, S.V.
(2017)
structure of α crystallin domain dimers of human small
Structural basis for the interaction of a human small heat
heat shock proteins HSPB1 and HSPB6, J. Mol. Biol., 411,
shock protein with the 14 3 3 universal signaling regulator,
110-122, doi: 10.1016/j.jmb.2011.05.024.
Structure, 25, 305-316, doi: 10.1016/j.str.2016.12.005.
9.
Mymrikov, E.V., Seit Nebi, A.S., and Gusev, N.B. (2012)
20.
Zwirowski, S., Klosowska, A., Obuchowski, I.,
Heterooligomeric complexes of human small heat shock
Nillegoda, N.B., Pirog, A., Zietkiewicz, S., Bukau, B.,
proteins, Cell Stress Chaperones,
17,
157-169,
Mogk, A., and Liberek, K. (2017) Hsp70 displaces small
doi: 10.1007/s12192 011 0296 0.
heat shock proteins from aggregates to initiate protein
10.
Delbecq, S.P., Rosenbaum, J.C., and Klevit, R.E. (2015) A
refolding, EMBO J., 36, 783-796, doi: 10.15252/embj.
mechanism of subunit recruitment in human small heat
201593378.
shock protein oligomers, Biochemistry, 54, 4276-4284,
21.
Ahner, A., Gong, X., Schmidt, B.Z., Peters, K.W.,
doi: 10.1021/acs.biochem.5b00490.
Rabeh, W.M., Thibodeau, P.H., Lukacs, G.L., and
11.
Heirbaut, M., Lermyte, F., Martin, E.M., Beelen, S.,
Frizzell, R.A. (2013) Small heat shock proteins target
Sobott, F., Strelkov, S.V., and Weeks, S.D. (2017) Specific
mutant cystic fibrosis transmembrane conductance regula
sequences in the N terminal domain of human small
tor for degradation via a small ubiquitin like modifier
heat shock protein HSPB6 dictate preferential hete
dependent pathway, Mol. Biol. Cell,
24,
74-84,
ro oligomerization with the orthologue HSPB1,
doi: 10.1091/mbc.E12 09 0678.
J. Biol. Chem., 292, 9944-9957, doi: 10.1074/jbc.M116.
22.
Rusmini, P., Cristofani, R., Galbiati, M., Cicardi, M.E.,
773515.
Meroni, M., Ferrari, V., Vezzoli, G., Tedesco, B., Messi, E.,
БИОХИМИЯ том 84 вып. 11 2019
МАЛЫЕ БЕЛКИ ТЕПЛОВОГО ШОКА И ЗАБОЛЕВАНИЯ ЧЕЛОВЕКА
1575
Piccolella, M., Carra, S., Crippa, V., and Poletti, A. (2017)
35.
Chalova, A.S., Sudnitsyna, M.V., Strelkov, S.V., and
The role of the heat shock protein B8 (HSPB8) in
Gusev, N.B. (2014) Characterization of human small heat
motoneuron diseases, Front. Mol. Neurosci., 10, 176,
shock protein HspB1 that carries C terminal domain
doi: 10.3389/fnmol.2017.00176.
mutations associated with hereditary motor neuron dis
23.
Carra, S., Crippa, V., Rusmini, P., Boncoraglio, A.,
eases, Biochim. Biophys. Acta,
1844,
2116-2126,
Minoia, M., Giorgetti, E., Kampinga, H.H., and Poletti, A.
doi: 10.1016/j.bbapap.2014.09.005.
(2012) Alteration of protein folding and degradation in
36.
Carver, J.A., Grosas, A.B., Ecroyd, H., and Quinlan, R.A.
motor neuron diseases: implications and protective func
(2017) The functional roles of the unstructured N and C
tions of small heat shock proteins, Prog. Neurobiol., 97,
terminal regions in αB crystallin and other mammalian
83-100, doi: 10.1016/j.pneurobio.2011.09.009.
small heat shock proteins, Cell Stress Chaperones, 22,
24.
Torrente, M.P., and Shorter, J. (2013) The metazoan pro
627-638, doi: 10.1007/s12192 017 0789 6.
tein disaggregase and amyloid depolymerase system:
37.
Dahiya, V., and Buchner, J. (2019) Functional principles
Hsp110, Hsp70, Hsp40, and small heat shock proteins,
and regulation of molecular chaperones, Adv. Protein
Prion, 7, 457-463, doi: 10.4161/pri.27531.
Chem. Struct. Biol., 114, 1-60, doi: 10.1016/bs.apcsb.
25.
Weis, J., Claeys, K.G., Roos, A., Azzedine, H., Katona, I.,
2018.10.001.
Schroder, J.M., and Senderek, J. (2017) Towards a func
38.
Bucci, C., Bakke, O., and Progida, C.
(2012)
tional pathology of hereditary neuropathies, Acta
Charcot-Marie-Tooth disease and intracellular traffic,
Neuropathol., 133, 493-515, doi: 10.1007/s00401 016
Prog. Neurobiol., 99, 191-225, doi: 10.1016/j.pneuro
1645 y.
bio.2012.03.003.
26.
Saporta, A.S., Sottile, S.L., Miller, L.J., Feely, S.M.,
39.
Pareyson, D., Saveri, P., Sagnelli, A., and Piscosquito, G.
Siskind, C.E., and Shy, M.E. (2011) Charcot-Marie-
(2015) Mitochondrial dynamics and inherited peripheral
Tooth disease subtypes and genetic testing strategies, Ann.
nerve diseases, Neurosci. Lett., 596, 66-77, doi: 10.1016/
Neurol., 69, 22-33, doi: 10.1002/ ana.22166.
j.neulet.2015.04.001.
27.
Yoshimura, A., Yuan, J.H., Hashiguchi, A., Ando, M.,
40.
Almeida Souza, L., Asselbergh, B., d’Ydewalle, C.,
Higuchi, Y., Nakamura, T., Okamoto, Y., Nakagawa, M.,
Moonens, K., Goethals, S., de Winter, V., Azmi, A., Irobi, J.,
and Takashima, H. (2018) Genetic profile and onset fea
Timmermans, J.P., Gevaert, K., Remaut, H., Van Den
tures of 1005 patients with Charcot-Marie-Tooth disease
Bosch, L., Timmerman, V., and Janssens, S. (2011) Small
in Japan, J. Neurol. Neurosurg. Psychiatry, 90, 195-202,
heat shock protein HSPB1 mutants stabilize microtubules
doi: 10.1136/jnnp 2018 318839.
in Charcot-Marie-Tooth neuropathy, J. Neurosci., 31,
28.
Echaniz Laguna, A., Geuens, T., Petiot, P., Pereon, Y.,
15320-15328, doi: 10.1523/JNEUROSCI.3266 11.2011.
Adriaenssens, E., Haidar, M., Capponi, S., Maisonobe, T.,
41.
D’Ydewalle, C., Krishnan, J., Chiheb, D.M., Van Damme, P.,
Fournier, E., Dubourg, O., Degos, B., Salachas, F.,
Irobi, J., Kozikowski, A.P., Vanden Berghe, P.,
Lenglet, T., Eymard, B., Delmont, E., Pouget, J., Juntas
Timmerman, V., Robberecht, W., and Van Den Bosch, L.
Morales, R., Goizet, C., Latour, P., Timmerman, V., and
(2011) HDAC6 inhibitors reverse axonal loss in a mouse
Stojkovic, T. (2017) Axonal neuropathies due to mutations
model of mutant HSPB1 induced Charcot-Marie-Tooth
in small heat shock proteins: clinical, genetic, and func
disease, Nat. Med., 17, 968-974, doi: 10.1038/nm.2396.
tional insights into novel mutations, Hum. Mutat., 38,
42.
Benedetti, S., Previtali, S.C., Coviello, S., Scarlato, M.,
556-568, doi: 10.1002/humu.23189.
Cerri, F., Di Pierri, E., Piantoni, L., Spiga, I., Fazio, R.,
29.
Adriaenssens, E., Geuens, T., Baets, J., Echaniz Laguna,
Riva, N., Natali Sora, M.G., Dacci, P., Malaguti, M.C.,
A., and Timmerman, V. (2017) Novel insights in the disease
Munerati, E., Grimaldi, L.M., Marrosu, M.G., De
biology of mutant small heat shock proteins in neuromus
Pellegrin, M., Ferrari, M., Comi, G., Quattrini, A., and
cular diseases, Brain, 140, 2541-2549, doi: 10.1093/
Bolino, A. (2010) Analyzing histopathological features of
brain/awx187.
rare Charcot-Marie-Tooth neuropathies to unravel their
30.
Jovcevski, B., Kelly, M.A., Aquilina, J.A., Benesch, J.L.P.,
pathogenesis,
Arch.
Neurol.,
67,
1498-1505,
and Ecroyd, H. (2017) Evaluating the effect of phosphory
doi: 10.1001/archneurol.2010.303.
lation on the structure and dynamics of Hsp27 dimers by
43.
Almeida Souza, L., Timmerman, V., and Janssens, S.
means of ion mobility mass spectrometry, Anal. Chem., 89,
(2011) Microtubule dynamics in the peripheral nervous
13275-13282, doi: 10.1021/acs.analchem.7b03328.
system: a matter of balance, Bioarchitecture, 1, 267-270,
31.
Clark, A.R., Lubsen, N.H., and Slingsby, C. (2012) sHSP
doi: 10.4161/bioa.1.6.19198.
in the eye lens: crystallin mutations, cataract and pro
44.
Benoy, V., Vanden Berghe, P., Jarpe, M., Van Damme, P.,
teostasis, Int. J. Biochem. Cell Biol., 44, 1687-1697,
Robberecht, W., and Van Den Bosch, L.
(2017)
doi: 10.1016/j.biocel.2012.02.015.
Development of improved HDAC6 inhibitors as pharma
32.
Nefedova, V.V., Sudnitsyna, M.V., Strelkov, S.V., and
cological therapy for axonal Charcot-Marie-Tooth dis
Gusev, N.B. (2013) Structure and properties of G84R and
ease, Neurotherapeutics, 14, 417-428, doi: 10.1007/
L99M mutants of human small heat shock protein HspB1
s13311 016 0501 z.
correlating with motor neuropathy, Arch. Biochem.
45.
Zhai, J., Lin, H., Julien, J.P., and Schlaepfer, W.W. (2007)
Biophys., 538, 16-24, doi: 10.1016/j.abb.2013.07.028.
Disruption of neurofilament network with aggregation of
33.
Nefedova, V.V., Datskevich, P.N., Sudnitsyna, M.V.,
light neurofilament protein: a common pathway leading to
Strelkov, S.V., and Gusev, N.B. (2013) Physico chemical
motor neuron degeneration due to Charcot-Marie-Tooth
properties of R140G and K141Q mutants of human small
disease linked mutations in NFL and HSPB1, Hum. Mol.
heat shock protein HspB1 associated with hereditary
Genet., 16, 3103-3116, doi: 10.1093/hmg/ddm272.
peripheral neuropathies, Biochimie,
95,
1582-1592,
46.
Ackerley, S., James, P.A., Kalli, A., French, S., Davies, K.E.,
doi: 10.1016/j.biochi.2013.04.014.
and Talbot, K. (2006) A mutation in the small heat shock
34.
Weeks, S.D., Muranova, L.K., Heirbaut, M., Beelen, S.,
protein HSPB1 leading to distal hereditary motor neu
Strelkov, S.V., and Gusev, N.B. (2018) Characterization of
ronopathy disrupts neurofilament assembly and the axonal
human small heat shock protein HSPB1 α crystallin
transport of specific cellular cargoes, Hum. Mol. Genet., 15,
domain localized mutants associated with hereditary motor
347-354, doi: 10.1093/hmg/ddi452.
neuron diseases, Sci. Rep., 8, 688, doi: 10.1038/s41598
47.
Holmgren, A., Bouhy, D., De Winter, V., Asselbergh, B.,
017 18874 x.
Timmermans, J.P., Irobi, J., and Timmerman, V. (2013)
БИОХИМИЯ том 84 вып. 11 2019
1576
МУРАНОВА и др.
Charcot-Marie-Tooth causing HSPB1 mutations
cytotoxicity, J. Biol. Chem., 293, 4486-4497, doi: 10.1074/
increase Cdk5 mediated phosphorylation of neurofila
jbc.M117.813865.
ments, Acta Neuropathol., 126, 93-108, doi: 10.1007/
62.
Mainz, A., Peschek, J., Stavropoulou, M., Back, K.C.,
s00401 013 1133 6.
Bardiaux, B., Asami, S., Prade, E., Peters, C., Weinkauf, S.,
48.
Srivastava, A.K., Renusch, S.R., Naiman, N.E., Gu, S.,
Buchner, J., and Reif, B. (2015) The chaperone αB crys
Sneh, A., Arnold, W.D., Sahenk, Z., and Kolb, S.J. (2012)
tallin uses different interfaces to capture an amorphous and
Mutant HSPB1 overexpression in neurons is sufficient to
an amyloid client, Nat. Struct. Mol. Biol., 22, 898-905,
cause age related motor neuronopathy in mice, Neurobiol.
doi: 10.1038/nsmb.3108.
Dis., 47, 163-173, doi: 10.1016/j.nbd.2012.03.035.
63.
Alperstein, A.M., Ostrander, J.S., Zhang, T.O., and Zanni, M.T.
49.
Lee, J., Jung, S.C., Joo, J., Choi, Y.R., Moon, H.W.,
(2019) Amyloid found in human cataracts with two
Kwak, G., Yeo, H.K., Lee, J.S., Ahn, H.J., Jung, N.,
dimensional infrared spectroscopy, Proc. Natl. Acad. Sci.
Hwang, S., Rheey, J., Woo, S.Y., Kim, J.Y., Hong, Y.B.,
USA, 116, 6602-6607, doi: 10.1073/pnas.1821534116.
and Choi, B.O. (2015) Overexpression of mutant HSP27
64.
Lu, S.Z., Guo, Y.S., Liang, P.Z., Zhang, S.Z., Yin, S.,
causes axonal neuropathy in mice, J. Biomed. Sci., 22, 43,
Yin, Y.Q., Wang, X.M., Ding, F., Gu, X.S., and Zhou, J.W.
doi: 10.1186/s12929 015 0154 y.
(2019) Suppression of astrocytic autophagy by αB crystallin
50.
Kim, M.V., Seit Nebi, A.S., Marston, S.B., and Gusev, N.B.
contributes to α synuclein inclusion formation, Transl.
(2004) Some properties of human small heat shock protein
Neurodegener., 8, 3, doi: 10.1186/s40035 018 0143 7.
Hsp22 (H11 or HspB8), Biochem. Biophys. Res. Commun.,
65.
Boros, S., Kamps, B., Wunderink, L., de Bruijn, W., de
315, 796-801, doi: 10.1016/j.bbrc.2004.01.130.
Jong, W.W., and Boelens, W.C. (2004) Transglutaminase
51.
Chowdary, T.K., Raman, B., Ramakrishna, T., and Rao, C.M.
catalyzes differential crosslinking of small heat shock pro
(2004) Mammalian Hsp22 is a heat inducible small heat
teins and amyloid β, FEBS Lett.,
576,
57-62,
shock protein with chaperone like activity, Biochem. J.,
doi: 10.1016/j.febslet.2004.08.062.
381, 379-387, doi: 10.1042/BJ20031958.
66.
Wilhelmus, M.M., Otte Holler, I., Wesseling, P.,
52.
Kim, M.V., Kasakov, A.S., Seit Nebi, A.S., Marston, S.B.,
de Waal, R.M., Boelens, W.C., and Verbeek, M.M. (2006)
and Gusev, N.B. (2006) Structure and properties of K141E
Specific association of small heat shock proteins with the
mutant of small heat shock protein HSP22 (HspB8, H11)
pathological hallmarks of Alzheimer’s disease brains,
that is expressed in human neuromuscular disorders, Arch.
Neuropathol. Appl. Neurobiol., 32, 119-130, doi: 10.1111/
Biochem. Biophys., 454, 32-41, doi: 10.1016/j.abb.2006.
j.1365 2990.2006.00689.x.
07.014.
67.
Zerovnik, E. (2017) Co chaperoning by amyloid forming
53.
Shemetov, A.A., and Gusev, N.B. (2011) Biochemical
proteins: cystatins vs. crystallins, Eur. Biophys. J., 46,
characterization of small heat shock protein HspB8
789-793, doi: 10.1007/s00249 017 1214 x.
(Hsp22)-Bag3 interaction, Arch. Biochem. Biophys., 513,
68.
Nafar, F., Williams, J.B., and Mearow, K.M. (2016) Astro
1-9, doi: 10.1016/j.abb.2011.06.014.
cytes release HspB1 in response to amyloid β exposure in vitro,
54.
Carra, S., Boncoraglio, A., Kanon, B., Brunsting, J.F.,
J. Alzheimers Dis., 49, 251-263, doi: 10.3233/JAD 150317.
Minoia, M., Rana, A., Vos, M.J., Seidel, K., Sibon, O.C.,
69.
Wilhelmus, M.M., Boelens, W.C., Otte Holler, I.,
and Kampinga, H.H.
(2010) Identification of the
Kamps, B., de Waal, R.M., and Verbeek, M.M. (2006) Small
Drosophila ortholog of HSPB8: implication of HSPB8 loss
heat shock proteins inhibit amyloid beta protein aggregation
of function in protein folding diseases, J. Biol. Chem., 285,
and cerebrovascular amyloid β protein toxicity, Brain Res.,
37811-37822, doi: 10.1074/jbc.M110.127498.
1089, 67-78, doi: 10.1016/j.brainres.2006.03.058.
55.
Haidar, M., Asselbergh, B., Adriaenssens, E., De Winter, V.,
70.
Cameron, R.T., Quinn, S.D., Cairns, L.S., MacLeod, R.,
Timmermans, J.P., Auer Grumbach, M., Juneja, M., and
Samuel, I.D., Smith, B.O., Carlos Penedo, J., and
Timmerman, V. (2019) Neuropathy causing mutations in
Baillie, G.S. (2014) The phosphorylation of Hsp20
HSPB1 impair autophagy by disturbing the formation of
enhances its association with amyloid β to increase protec
SQSTM1/p62 bodies, Autophagy,
15,
1051-1068,
tion against neuronal cell death, Mol. Cell. Neurosci., 61,
doi: 10.1080/15548627.2019.1569930.
46-55, doi: 10.1016/j.mcn.2014.05.002.
56.
Sharma, S.K., and Priya, S. (2017) Expanding role of mol
71.
Sotiropoulos, I., Galas, M.C., Silva, J.M., Skoulakis, E.,
ecular chaperones in regulating alpha synuclein misfold
Wegmann, S., Maina, M.B., Blum, D., Sayas, C.L.,
ing; implications in Parkinson’s disease, Cell. Mol. Life
Mandelkow, E.M., Mandelkow, E., Spillantini, M.G.,
Sci., 74, 617-629, doi: 10.1007/s00018 016 2340 9.
Sousa, N., Avila, J., Medina, M., Mudher, A., and Buee, L.
57.
Cox, D., Carver, J.A., and Ecroyd, H. (2014) Preventing
(2017) Atypical, non standard functions of the micro
α synuclein aggregation: the role of the small heat shock
tubule associated Tau protein, Acta Neuropathol. Commun.,
molecular chaperone proteins, Biochim. Biophys. Acta,
5, 91, doi: 10.1186/s40478 017 0489 6.
1842, 1830-1843, doi: 10.1016/j.bbadis.2014.06.024.
72.
Sierra Fonseca, J.A., and Gosselink, K.L. (2018) Tauopathy
58.
Leak, R.K. (2014) Heat shock proteins in neurodegenera
and neurodegeneration: a role for stress, Neurobiol. Stress, 9,
tive disorders and aging, J. Cell Commun. Signal., 8,
105-112, doi: 10.1016/j.ynstr.2018.08.009.
293-310, doi: 10.1007/s12079 014 0243 9.
73.
Zabik, N.L., Imhof, M.M., and Martic Milne, S. (2017)
59.
Cox, D., Selig, E., Griffin, M.D., Carver, J.A., and
Structural evaluations of tau protein conformation:
Ecroyd, H. (2016) Small heat shock proteins prevent α
methodologies and approaches, Biochem. Cell Biol., 95,
synuclein aggregation via transient interactions and their
338-349, doi: 10.1139/bcb 2016 0227.
efficacy is affected by the rate of aggregation, J. Biol.
74.
Shimura, H., Miura Shimura, Y., and Kosik, K.S. (2004)
Chem., 291, 22618-22629, doi: 10.1074/jbc.M116.739250.
Binding of tau to heat shock protein 27 leads to decreased
60.
Cox, D., and Ecroyd, H. (2017) The small heat shock pro
concentration of hyperphosphorylated tau and enhanced
teins αB crystallin (HSPB5) and Hsp27 (HSPB1) inhibit
cell survival, J. Biol. Chem.,
279,
17957-17962,
the intracellular aggregation of α synuclein, Cell Stress
doi: 10.1074/jbc.M400351200.
Chaperones, 22, 589-600, doi: 10.1007/s12192 017 0785 x.
75.
Kumar, P., Jha, N.K., Jha, S.K., Ramani, K., and
61.
Cox, D., Whiten, D.R., Brown, J.W.P., Horrocks, M.H.,
Ambasta, R.K. (2015) Tau phosphorylation, molecular
San Gil, R., Dobson, C.M., Klenerman, D., van Oijen,
chaperones, and ubiquitin E3 ligase: clinical relevance in
A.M., and Ecroyd, H. (2018) The small heat shock protein
Alzheimer’s disease, J. Alzheimer’s Dis., 43, 341-361,
Hsp27 binds α synuclein fibrils, preventing elongation and
doi: 10.3233/JAD 140933.
БИОХИМИЯ том 84 вып. 11 2019
МАЛЫЕ БЕЛКИ ТЕПЛОВОГО ШОКА И ЗАБОЛЕВАНИЯ ЧЕЛОВЕКА
1577
76. Abisambra, J.F., Blair, L.J., Hill, S.E., Jones, J.R., Kraft, C.,
83. Sluchanko, N.N., and Gusev, N.B. (2011) Probable partic
Rogers, J., Koren, J., 3rd, Jinwal, U.K., Lawson, L.,
ipation of 14 3 3 in tau protein oligomerization and aggre
Johnson, A.G., Wilcock, D., O’Leary, J.C., Jansen West,
gation, J. Alzheimer’s Dis., 27, 467-476, doi: 10.3233/
K., Muschol, M., Golde, T.E., Weeber, E.J., Banko, J., and
JAD 2011 110692.
Dickey, C.A. (2010) Phosphorylation dynamics regulate
84. Sluchanko, N.N., Sudnitsyna, M.V., Chernik, I.S., Seit
Hsp27 mediated rescue of neuronal plasticity deficits in
Nebi, A.S., and Gusev, N.B. (2011) Phosphomimicking
tau transgenic mice, J. Neurosci., 30, 15374-15382,
mutations of human 14 3 3ζ affect its interaction with tau
doi: 10.1523/JNEUROSCI.3155 10.2010.
protein and small heat shock protein HspB6, Arch. Biochem.
77. Baughman, H.E.R., Clouser, A.F., Klevit, R.E., and Nath, A.
Biophys., 506, 24-34, doi: 10.1016/j.abb.2010.11.003.
(2018) HspB1 and Hsc70 chaperones engage distinct tau
85. Wang, K., Zhang, J., Xu, Y., Ren, K., Xie, W.L., Yan, Y.E.,
species and have different inhibitory effects on amyloid for
Zhang, B.Y., Shi, Q., Liu, Y., and Dong, X.P. (2013)
mation, J. Biol. Chem., 293, 2687-2700, doi: 10.1074/jbc.
Abnormally upregulated αB crystallin was highly coinci
M117.803411.
dental with the astrogliosis in the brains of scrapie infected
78. Janowska, M.K., Baughman, H.E.R., Woods, C.N., and
hamsters and human patients with prion diseases, J. Mol.
Klevit, R.E. (2019) Mechanisms of small heat shock pro
Neurosci., 51, 734-748, doi: 10.1007/s12031 013 0057 x.
teins, Cold Spring Harb. Perspect. Biol., a034025,
86. Duennwald, M.L., Echeverria, A., and Shorter, J. (2012)
doi: 10.1101/cshperspect.a034025.
Small heat shock proteins potentiate amyloid dissolution
79. Hashiguchi, M., Sobue, K., and Paudel, H.K. (2000) 14 3
by protein disaggregases from yeast and humans, PLoS
3ζ is an effector of tau protein phosphorylation, J. Biol.
Biol., 10, e1001346, doi: 10.1371/journal.pbio.1001346.
Chem., 275, 25247-25254, doi: 10.1074/jbc.M003738200.
87. Rothbard, J.B., Rothbard, J.J., Soares, L., Fathman, C.G.,
80. Sadik, G., Tanaka, T., Kato, K., Yamamori, H.,
and Steinman, L. (2018) Identification of a common
Nessa, B.N., Morihara, T., and Takeda, M.
(2009)
immune regulatory pathway induced by small heat shock
Phosphorylation of tau at Ser214 mediates its interaction
proteins, amyloid fibrils, and nicotine, Proc. Natl. Acad.
with 14 3 3 protein: implications for the mechanism of tau
Sci. USA, 115, 7081-7086, doi: 10.1073/pnas.1804599115.
aggregation, J. Neurochem., 108, 33-43, doi: 10.1111/
88. Rothbard, J.B., Kurnellas, M.P., Ousman, S.S., Brownell, S.,
j.1471 4159.2008.05716.x.
Rothbard, J.J., and Steinman, L. (2018) Small heat shock
81. Sluchanko, N.N., Seit Nebi, A.S., and Gusev, N.B. (2009)
proteins, amyloid fibrils, and nicotine stimulate a common
Effect of phosphorylation on interaction of human tau pro
immune suppressive pathway with implications for future
tein with 14 3 3ζ, Biochem. Biophys. Res. Commun., 379,
therapies, Cold Spring Harb. Perspect. Med.,
9,
990-994, doi: 10.1016/j.bbrc.2008.12.164.
doi: 10.1101/cshperspect.a034223.
82. Sluchanko, N.N., Seit Nebi, A.S., and Gusev, N.B. (2009)
89. Liu, Z., Wang, C., Li, Y., Zhao, C., Li, T., Li, D., Zhang, S.,
Phosphorylation of more than one site is required for tight
and Liu, C. (2018) Mechanistic insights into the switch of αB
interaction of human tau protein with 14 3 3ζ, FEBS Lett.,
crystallin chaperone activity and self multimerization, J. Biol.
583, 2739-2742, doi: 10.1016/j.febslet.2009.07.043.
Chem., 293, 14880-14890, doi: 10.1074/jbc.RA118.004034.
SMALL HEAT SHOCK PROTEINS AND HUMAN
NEURODEGENERATIVE DISEASES
Review
L. K. Muranova*, A. S. Ryzhavskaya*, M. V. Sudnitsyna*, V. M. Shatov*, and N. B. Gusev*,**
Lomonosov Moscow State University, Faculty of Biology, 119991 Moscow, Russia; E(mail: NBGusev@mail.ru
Received March 30, 2019
Revised May 4, 2019
Accepted June 27, 2019
Probable role of small heat shock proteins in different human neurodegenerative diseases like Charcot-Marie-Tooth,
Parkinson’s, Alzheimer’s diseases, and different forms of taupathies is considered. Effect of point mutations of two
small heat shock proteins HspB1 and HspB8, correlating with Charcot-Marie-Tooth disease, on the proteins’ sta
bility, oligomeric structure and their chaperone like activity is analyzed. The analyzed point mutations affect equilib
rium between different oligomeric forms of HspB1, thus leading to modification of its chaperone like activity and of
interaction with protein partners. This can induce cytoskeleton damage and neuron death. HspB8 mutations affect
its interaction with adapter protein Bag3 and the process of autophagy, thus also provoking neuron death. The data of
literature concerning effect of small heat shock proteins on amyloidoses are presented and discussed. Experimental
data indicate that the small heat shock proteins interact with monomers (or small oligomers) of amyloidogenic pro
teins, stabilize their structure, prevent their aggregation and/or promote their specific proteolytic degradation. This
effect seems to be due to the interaction of β strands of small heat shock proteins with β strands of target proteins that
hampers their aggregation. In addition, in cooperation with the other heat shock proteins the small heat shock pro
teins can promote disassembling of oligomers formed by amyloidogenic proteins. In spite of significant achievements,
further additional investigations are required for understanding the role of small heat shock proteins in protection
against different neurodegenerative diseases.
Keywords: small heat shock proteins, chaperone like activity, amorphous aggregation, β amyloids, posttranslational
modifications, neurodegenerative diseases
БИОХИМИЯ том 84 вып. 11 2019