БИОХИМИЯ, 2019, том 84, вып. 11, с. 1668 - 1682
УДК 577.151
НЕЙТРАЛЬНАЯ ЭНДОПЕПТИДАЗА (НЕПРИЛИЗИН)
В ТЕРАПИИ И ДИАГНОСТИКЕ: «ИНЬ И ЯН»
Обзор
© 2019
Е.Э. Фейгина1,2*,**, А.Г. Катруха1,3**, А.Г. Семенов1,2**
1 HyTest Ltd., Турку, Финляндия; электронная почта: Evgeniya.Feygina@hytest.fi
2 НИИ физико$химической биологии им. А.Н. Белозерского, Московский государственный
университет им. М.В. Ломоносова, 119991 Москва, Россия
3 Московский государственный университет им. М.В. Ломоносова,
биологический факультет, 119991 Москва, Россия
Поступила в редакцию 07.06.2019
После доработки 02.08.2019
Принята к публикации 19.08.2019
Неприлизин (neprilysin, NEP) - это цинк зависимая мембраносвязанная эндопептидаза, представленная в
организме в трансмембранной и растворимой формах. Фермент имеет широкий спектр субстратов, вовле
ченных в регуляцию сердечно сосудистой, нервной и других систем организма. В данном обзоре мы оста
навливаемся на некоторых биохимических функциях NEP и на его физиологической роли. В центре внима
ния данной работы находится использование NEP как терапевтической мишени: история и разнообразные
физиологические аспекты применения ингибиторов NEP для лечения сердечной недостаточности, попыт
ки увеличения активности NEP для лечения болезни Альцгеймера с использованием подходов генной и
клеточной терапии. Другим важным вопросом, который мы рассматриваем в данном обзоре, является роль
NEP как потенциального маркера для предсказания риска осложнений при сердечно сосудистых заболева
ниях. Приведены данные исследований предсказательной силы растворимой формы NEP при различных
типах сердечной недостаточности. Мы также обсуждаем измерение активности NEP для прогностических
и диагностических целей, методы и подходы, которые могут быть использованы для этого, а также возмож
ную новую роль натрийуретических пептидов - субстратов NEP - в области сердечно сосудистой диагнос
тики.
КЛЮЧЕВЫЕ СЛОВА: неприлизин, натрийуретические пептиды, АРНи, сердечная недостаточность, бо
лезнь Альцгеймера, биомаркеры, иммунохимический анализ.
DOI: 10.1134/S0320972519110101
ОБЩАЯ ХАРАКТЕРИСТИКА НЕПРИЛИЗИНА
препарата для лечения сердечной недостаточ
ности (СН) LCZ696 (Энтресто™, зарегистриро
В последние годы неприлизин (NEP, нейт
ван в РФ как Юперио™) [1]. Данный препарат
ральная эндопептидаза, EC 3.4.24.11) оказался
производства «Новартис Фарма» сочетает в себе
объектом пристального внимания исследовате
блокатор рецептора ангиотензина II первого ти
лей. Причиной этого стало появление в 2014 году
па - валсартан, и ингибитор NEP - сакубитрил.
Этот препарат открыл новую эру в сфере тера
Принятые сокращения: ANP - натрийуретический
пии сердечной недостаточности и с момента
пептид А типа; APP - предшественник амилоидного пеп
своего появления на рынке находится в центре
тида; BNP - натрийуретический пептид B типа; CNP - внимания исследователей вместе с NEP - одной
натрийуретический пептид С типа; NEP - неприлизин;
из своих мишеней. Однако исследования NEP, а
sAPP - растворимый фрагмент белка предшественника
амилоидного пептида; sNEP - растворимая форма непри
также попытки использовать фермент как тера
лизина; Аβ - бета амилоидный пептид; АПФ - ангиотен
певтическую мишень, начались гораздо раньше.
зин превращающий фермент; АРНи - ангиотензиновых
NEP был впервые обнаружен в 1973 г. при
рецепторов и неприлизина ингибитор; БА - болезнь Альц
исследовании функции и свойств почечной ще
геймера; НП - натрийуретические пептиды; РААС - ре
нин ангиотензин альдостероновая система; СН - сердеч
точной каемки: фермент был выделен из щеточ
ная недостаточность.
ной каемки проксимального почечного каналь
* Адресат для корреспонденции.
ца кролика вместе с несколькими другими гид
** Автор является выпускником кафедры биохимии биоло
ролазами [2]. Локализация фермента указывала
гического факультета МГУ им. М.В. Ломоносова.
на его участие в метаболизме пептидов почечно
1668
НЕПРИЛИЗИН В ТЕРАПИИ И ДИАГНОСТИКЕ
1669
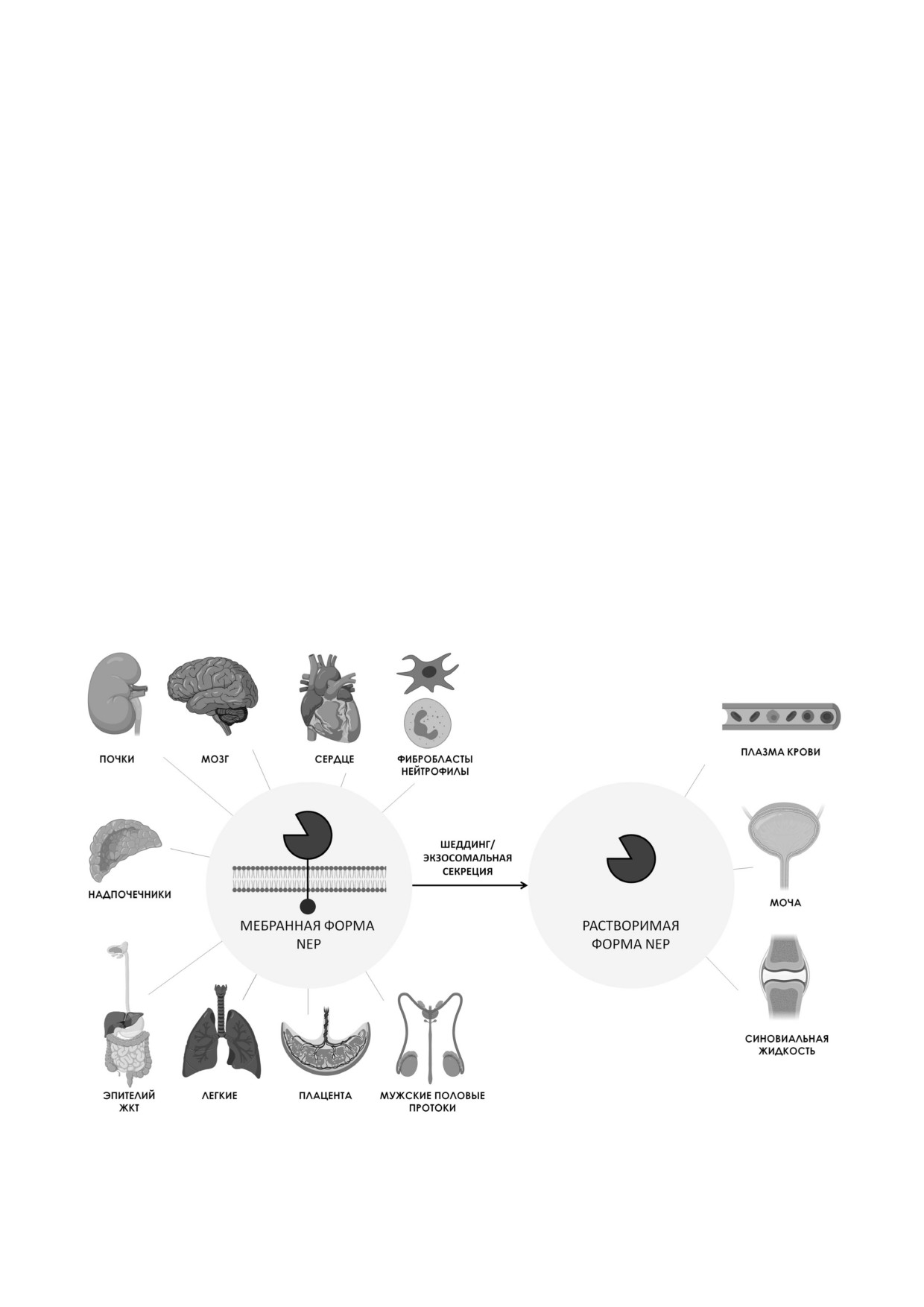
го фильтрата. Позднее было показано, что фер
во множестве тканей: в первую очередь в поч
мент идентичен обнаруженной ранее в мозге эн
ках, а также в мозге, сердце, легких, надпочеч
кефалиназе, метаболизирующей эндогенные
никах, эпителии желудочно кишечного тракта,
опиоиды [3, 4]. NEP также стал известен как об
щитовидной железе, мужских половых прото
щий антиген острого лимфобластного лейкоза
ках, плаценте, на поверхности фибробластов и
(CALLA) и дифференцировочный антиген
нейтрофилов (рис. 1) [9-13]. Существует также
нейтрофилов CD10 [5]. NEP млекопитающих
растворимая форма NEP (sNEP), образующая
высококонсервативен. Последовательности NEP
ся, предположительно, в результате шеддинга
человека и грызунов (мыши, крысы), а также че
эктодомена фермента или секреции фермента
ловека и кролика идентичны на 94%, последова
из клеток с участием экзосом [14]. Каталитичес
тельности NEP человека и свиньи - на 93%.
ки активный sNEP был обнаружен в кровотоке,
Учитывая синонимичность ряда замен, сходство
моче, а также в синовиальной жидкости (рис. 1)
последовательностей NEP человека и перечис
[15, 16]. Мембраносвязанный и растворимый
ленных животных достигает 97%. Для свиньи
NEP демонстрируют сходства в отношении аф
описано существование нековалентно ассоци
финности к ингибиторам, оптимальном pH ра
ированных гомодимеров NEP [6].
боты, а также Кm, однако максимальная ско
NEP относится к семейству цинк зависимых
рость (Vmax) sNEP значительно уступает таковой
металлопротеиназ. Он является мембраносвя
у мембраносвязанной формы [15, 16]. В связи с
занной эндопептидазой, включающей 749 а.о., и
этим предполагают, что ферментативная актив
относится к мембранным белкам второго типа
ность NEP в организме преимущественно связа
[7, 8]. Фермент состоит из C концевого катали
на с тканевой формой протеазы.
тически активного эктодомена, связывающего
Среди других протеаз, входящих вместе с
один ион цинка с участием типичного мотива
NEP в семейство цинк зависимых металлопро
His Glu X X His (на месте X может распола
теиназ, белок NEP2 демонстрирует высокую
гаться Thr или гидрофобный а.о.), трансмемб
степень гомологии с NEP. Этот фермент у чело
ранной спирали и небольшого N концевого
века имеет два варианта, образующихся в ре
внутриклеточного домена. NEP был обнаружен
зультате альтернативного сплайсинга. Один из
Рис. 1. Распространенность NEP в тканях организма. Создано с использованием BioRender
БИОХИМИЯ том 84 вып. 11 2019
1670
ФЕЙГИНА и др.
вариантов NEP2 может присутствовать на кле
НЕПРИЛИЗИН КАК
точной мембране в качестве трансмембранного
ТЕРАПЕВТИЧЕСКАЯ МИШЕНЬ
белка, а также, подобно NEP, присутствовать в
растворимой форме, ранее известной под назва
Сердечная недостаточность. NEP в регуляции
нием SEP (soluble secreted endopeptidase). NEP и
сердечно сосудистой системы. На протяжении
NEP2 демонстрируют во многих случаях сход
развития представлений о патологических ме
ную, но не одинаковую, субстратную специфич
ханизмах, лежащих в основе развития СН, не
ность [17, 18]. Присутствие в организме NEP2,
прилизин неоднократно привлекал внимание
близкого гомолога NEP, осложняет исследова
исследователей благодаря многогранности фи
ние функциональной роли последнего.
зиологических эффектов, опосредуемых его
Доступ к гидрофильной каталитической ще
субстратами. В развитии СН важную роль игра
ли NEP пространственно ограничен, что, как
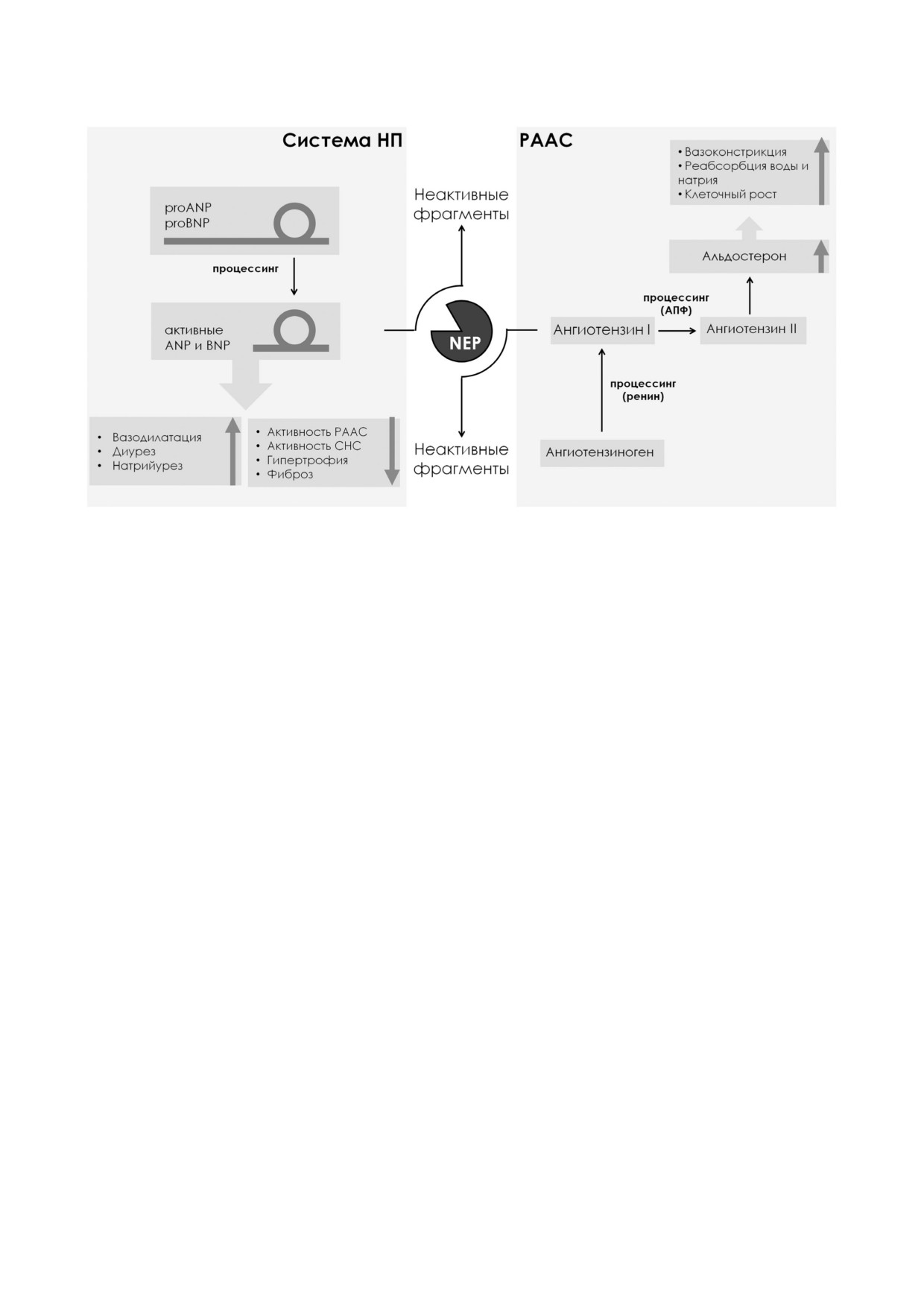
ют три регуляторные системы. Это вегетатив
считается, обусловливает субстратную специ
ная нервная система, ренин ангиотензин аль
фичность фермента: NEP способен расщеплять
достероновая система (РААС) и система нат
небольшие пептиды массой ~3000 Да [19]. Про
рийуретических пептидов (НП) [37, 38]. При
теаза расщепляет пептидную связь с N конца
этом РААС и система НП являются фактически
гидрофобных а.о., преимущественно Phe и Leu
антагонистами: ангиотензин II и альдостерон,
[20]. Субстраты NEP разнообразны; среди них
основные активные игроки РААС, стимулиру
вазоактивные пептиды: натрийуретические пеп
ют реабсорбцию натрия в почках, повышение
тиды А , B и С типа (ANP, BNP и CNP) [21, 22],
объема циркулирующей крови, а также сужение
брадикинин [23], субстанция P [24], ангиотен
сосудов, что в целом приводит к увеличению
зины I го и II го типов, адреномедуллин [25],
системного артериального давления (рис. 2).
эндотелин [26], соматостатин [27], также β ами
НП напротив способствуют повышению нат
лоид (Аβ), ассоциированный с развитием болез
рийуреза и диуреза, расширению сосудов и сни
ни Альцгеймера (БА) [28, 29].
жают системное артериальное давление, умень
Оптимальное для активности NEP значение
шая нагрузку на миокард и реализуя, таким об
pH находится в нейтральной области (~6,0), что
разом, благоприятные для сердца эффекты на
отражено в названии фермента [30]. Ингибито
фоне СН [39]. Входящие в состав РААС ангио
рами NEP являются соединения, способные хе
тензин I и ангиотензин II являются субстратами
латировать необходимый для каталитической
NEP [40]. В свою очередь, ANP и BNP также
активности протеазы ион цинка, в том числе
деградируют под действием NEP; делая протеа
ЭДТА [31, 32]. Это обстоятельство необходимо
зу своеобразным двуликим Янусом сердечно
учитывать при выборе матрикса для работы с
сосудистой регуляции. Помимо игроков РААС
ферментативно активным NEP.
и системы НП, другие субстраты NEP (эндоте
Первым специфическим синтетическим ин
лин, адреномедуллин, субстанция P, брадики
гибитором NEP стал тиорфан ([dl 3 mercapto 2
нин) также являются антагонистами относи
benzylpropanoyl] glycine) (Ki = 2,3 нM). Для ис
тельно эффектов сужения или расширения со
следовательских целей широко применяется
судов, увеличения или снижения объема цирку
другой ингибитор - фосфорамидон. Эндоген
лирующей крови, артериального давления, ре
ными ингибиторами NEP являются пептиды се
гуляции оттока жидкости в ткани из сосудисто
мейства опиорфинов [33, 34].
го русла [41].
Широкое распространение NEP в различ
NEP и натрийуретические пептиды. Картина
ных органах и тканях организма и разнообраз
вовлеченности NEP в регуляцию сердечно со
ная субстратная специфичность определяют
судистой системы дополнительно усложняется
вовлеченность фермента в самые разнообраз
различиями в сродстве NEP к своим субстратам.
ные метаболические пути и, как следствие,
По данным, полученным для реакций расщеп
участие в патологических механизмах, лежащих
ления ANP, BNP и CNP человека под действием
в основе ряда заболеваний. Среди них СН, БА,
очищенного NEP человека, kcat/Km составляют:
различные виды рака, в том числе рак предста
7,85 (для CNP), >5,12 (для ANP) и >0,53 (для
тельной железы и рак молочной железы [35, 36].
BNP) [22]. Как было упомянуто выше, другие
Благодаря этому разнообразными оказались
вазоактивные пептиды также являются субстра
также и варианты использования NEP в биоме
тами NEP. Среди них как сосудорасширяющие
дицинских исследованиях: за то время, что фер
(брадикинин, субстанция P, адреномедуллин),
мент известен, предпринимались попытки ис
так и обладающие сосудосуживающим действи
пользовать его как в роли терапевтической ми
ем (ангиотензин II, эндотелин I). Сродство к
шени, так и биомаркера. В исследованиях пато
данным субстратам также различается, что обус
генеза СН и БА NEP оказался особенно важен.
ловлено, как принято считать, доступностью ка
БИОХИМИЯ том 84 вып. 11 2019
НЕПРИЛИЗИН В ТЕРАПИИ И ДИАГНОСТИКЕ
1671
Рис. 2. Вовлеченность NEP в регуляцию системы НП и РААС. ProANP, ProBNP - предшественники натрийуретических
пептидов ANP и BNP. СНС - симпатическая нервная система
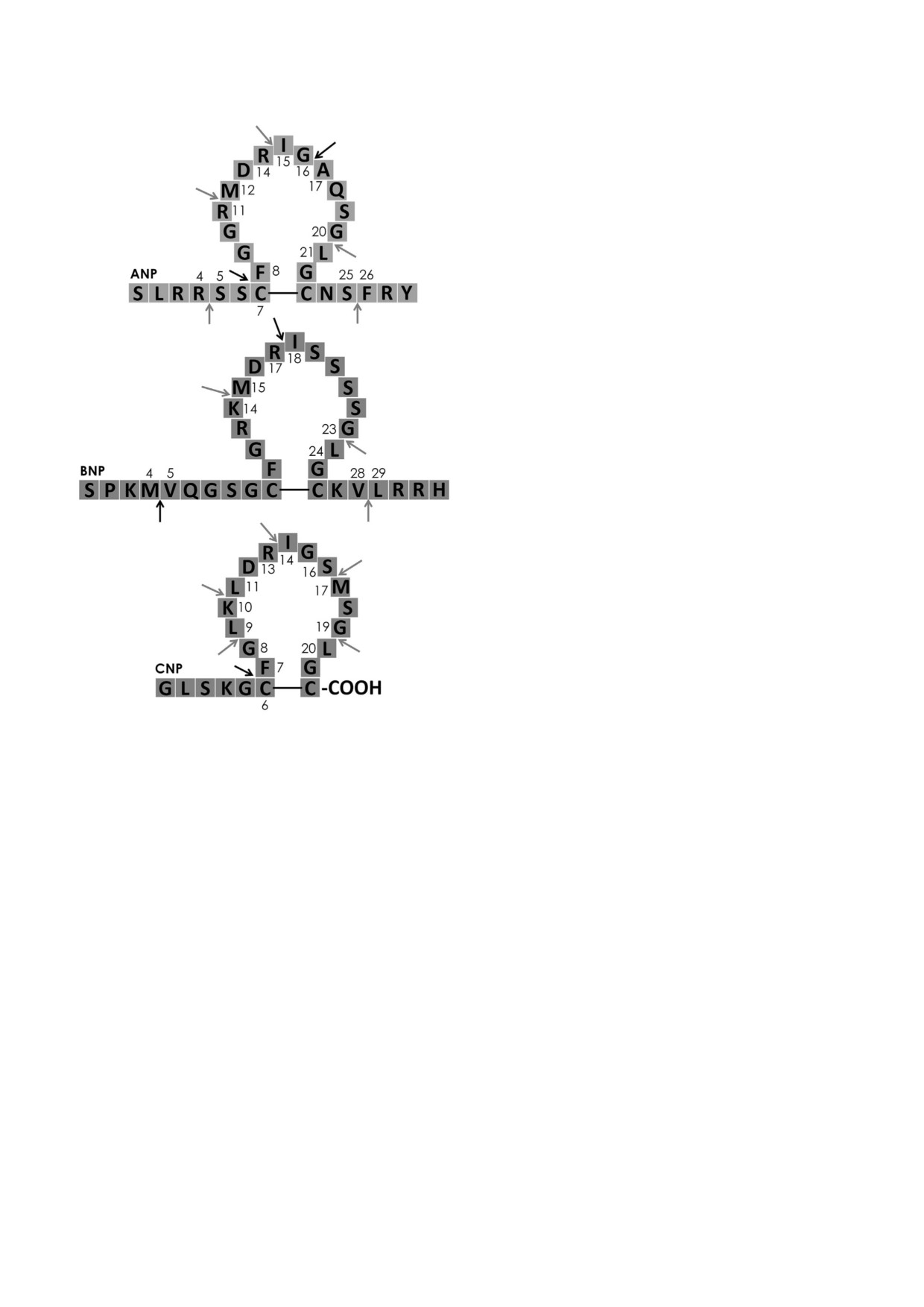
талитической щели NEP для пептидов различ
ствуют и более «медленные» сайты (рис. 3) [22,
ных размеров [21, 42].
49, 50].
Возвращаясь к натрийуретическим пепти
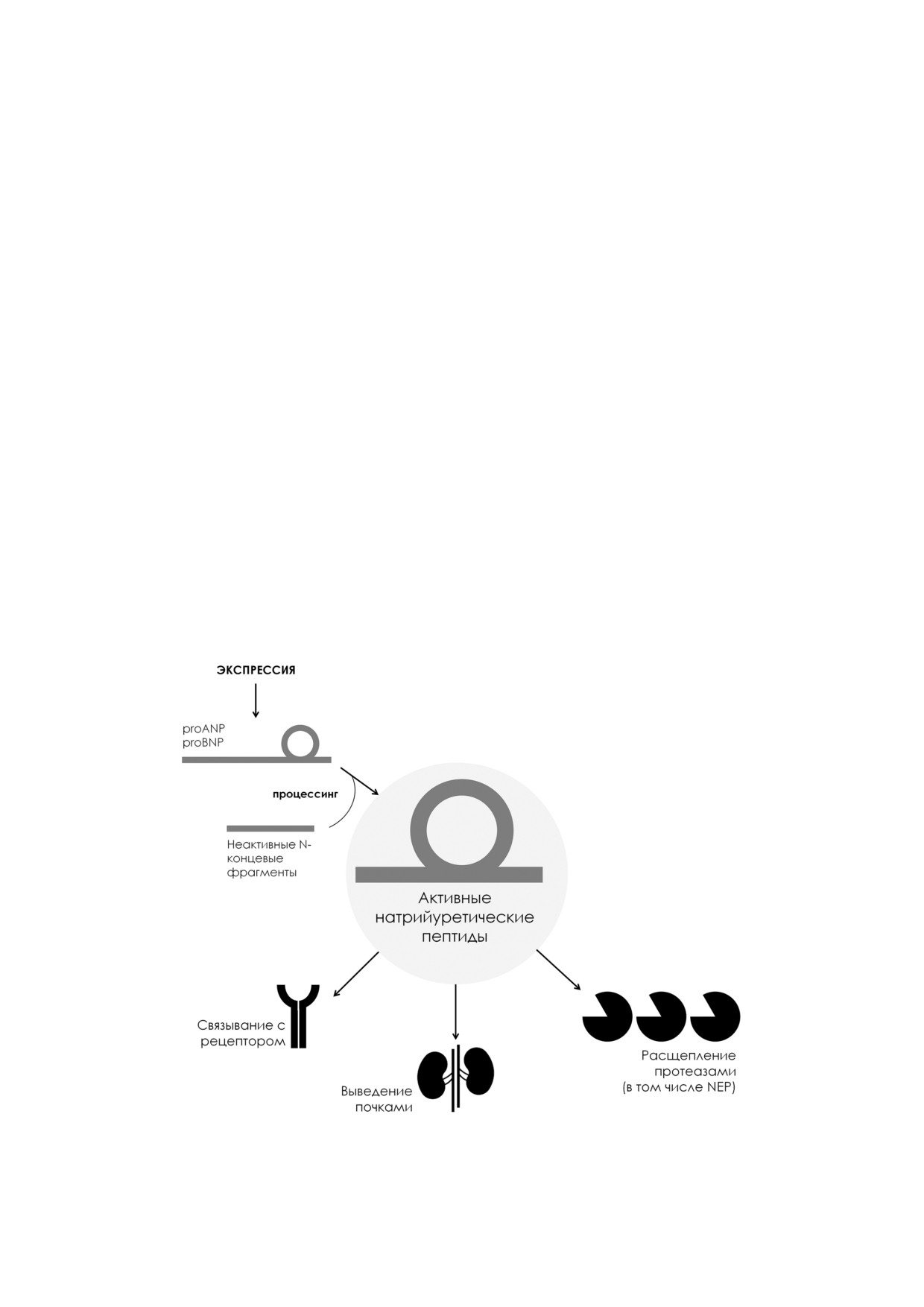
Необходимо отметить, что натрийуретичес
дам, важно отметить, что ANP считается одним
кие пептиды секретируются в кровь в виде неак
из «лучших» субстратов NEP, который вместе с
тивных предшественников, которые затем в ре
инсулин деградирующим ферментом является,
зультате процессинга и отщепления N концево
как принято считать, основной протеазой, от
го пептида превращаются в активную форму
вечающей за деградацию ANP в кровотоке
[39, 51, 52]. Так, например, нерасщепленный
[43-46]. С другой стороны, BNP долгое время
предшественник BNP (proBNP), а также отщеп
ошибочно считали не подверженным расщеп
ляемый при процессинге N концевой фрагмент
лению под действием NEP [47]. В настоящее
proBNP (NT proBNP) присутствуют в кровото
время установлено, что BNP эффективно рас
ке, наряду с активным BNP [53, 54]. Уровень
щепляется NEP, однако со значительно мень
proBNP в кровяном русле в несколько раз пре
шей скоростью, чем ANP или CNP [22, 48]. Из
вышает концентрацию BNP и, таким образом,
вестно несколько сайтов протеолитического
именно на долю неактивного предшественника
расщепления натрийуретических пептидов
приходится основная иммунореактивность
NEP [22]. Скорость расщепления сайтов неоди
BNP, определяемая в крови иммунохимически
наковая: для BNP сайт 4-5 а.о. считается наи
ми методами [55, 56]. NT proBNP и BNP явля
более подверженным протеолизу под действием
ются широко используемыми маркерами для
NEP, затем идут сайты 17-18 и 21-22 а.о. Для
диагностики СН, а также для предсказания рис
ANP и CNP наиболее подверженным расщеп
ка развития осложнений СН [57].
лению считаются сайты 7-8 и 6-7 а.о. соответ
Предшественники НП не способны расщеп
ственно, непосредственно примыкающие к ди
ляться NEP, который, таким образом, разлагает
сульфидной связи, ограничивающей кольцевую
исключительно активные ANP, BNP и CNP [49,
часть молекулы. Устойчивость аналогичной
50]. Физиологические эффекты ANP и BNP,
пептидной связи в составе молекулы BNP к
экспрессируемых в кардиомиоцитах, включают
протеолизу NEP считают одной из возможных
расширение сосудов, повышение натрийуреза и
причин большей стабильности BNP к опосре
следующего за ним диуреза, снижение гиперто
дуемой NEP деградации по сравнению с ANP и
нической нагрузки на миокард и регуляцию сер
CNP [22]. Помимо указанных выше основных
дечного ремоделинга. CNP, экспрессируемый в
участков протеолиза НП, в молекулах присут
мозге, хондроцитах и клетках эндотелия, реали
БИОХИМИЯ том 84 вып. 11 2019
1672
ФЕЙГИНА и др.
а
вовлечение РААС в развитие патологии. В ос
тальных случаях применение кандоксатрила не
приводило к устойчивому положительному ге
модинамическому эффекту: ингибирование
NEP влекло за собой повышение концентрации
ангиотензина II (см. выше) и усиление небла
гоприятного влияния РААС на сердечно сосу
дистую систему при СН [61-63].
Отсутствие положительного результата при
ингибировании NEP, как единичной мишени,
привели к пониманию необходимости одновре
б
менного воздействия на систему НП и РААС.
Для подавления неблагоприятных эффектов
РААС широко применяются препараты инги
биторы ангиотензин превращающего фермента
(АПФ), которые успешно снижают частоту пов
торной госпитализации и риск смерти у паци
ентов с СН [64, 65]. Таким образом, в начале
2000 х годов логичной стратегией стало созда
ние препарата с двойным ингибиторным эф
фектом. Им стал омапатрилат, включающий
единственное одноименное действующее веще
в
ство, способное блокировать одновременно ак
тивность NEP и АПФ [66-68]. Эффективность
нового препарата анализировали в ходе клини
ческого исследования, получившего название
OVERTURE (Omapatrilat Versus Enalapril
Randomized Trial of Utility in Reducing Events)
[69]. Однако несмотря на снижение частоты
неблагоприятных событий, связанных с ослож
нениями СН у больных, в группе пациентов,
получавших омапатрилат, наблюдалось значи
тельное повышение частоты развития ангио
невротического отека. Объяснением этого эф
Рис. 3. Сайты расщепления ANP (а), BNP (б) и CNP (в) под
фекта является способность как NEP, так и
действием NEP. Темными стрелками показаны участки,
которые NEP атакует в первую очередь. Светлыми стрел
АПФ расщеплять брадикинин; ингибирование
ками - более «медленные» сайты расщепления
обоих ферментов омапатрилатом приводило к
драматическому росту концентрации брадики
нина, что вызывало усиленный отток жидкости
зует преимущественно паракринный сосудорас
в ткани и приводило в конечном счете к разви
ширяющий эффект [39].
тию отека [69-71]. Таким образом, менее чем
Таким образом, попытки использовать NEP,
через десятилетие после проведения первых
как терапевтическую мишень для лечения СН, в
клинических исследований разработки препа
первую очередь направлены на снижение рас
ратов на основе двойного ингибирования NEP
щепления НП под действием NEP, потенциаль
и АПФ были прекращены.
но приводящего к усилению благоприятных эф
Однако поиски способа безопасного одно
фектов НП на состояние сердечно сосудистой
временного воздействия на РААС и систему НП
системы [58].
продолжались. Результатом этого стало появле
Ингибирование NEP. Первые попытки тера
ние в 2014 г. препарата Энтресто™ (в России за
певтического ингибирования NEP у людей,
регистрирован как Юперио™) - первого в но
предпринятые в 1990 х годах, с использованием
вом классе АРНи (Ангиотензиновых рецепто
специфических ингибиторов, таких как кандок
ров и Неприлизина ингибитор), выпущенного
сатрил и рацекадотрил, приводили к увеличе
компанией «Новартис». Препарат включает два
нию концентрации ANP и повышению нат
компонента: валсартан - блокатор ангиотези
рийуреза [59, 60]. Однако положительное воз
нового рецептора, и сакубитрил - специфичес
действие наблюдалось только для мягких экспе
кий ингибитор NEP. Таким образом, АРНи спо
риментальных форм СН, когда отсутствовало
собен одновременно подавлять РААС и активи
БИОХИМИЯ том 84 вып. 11 2019
НЕПРИЛИЗИН В ТЕРАПИИ И ДИАГНОСТИКЕ
1673
ровать систему НП, при этом отсутствует опас
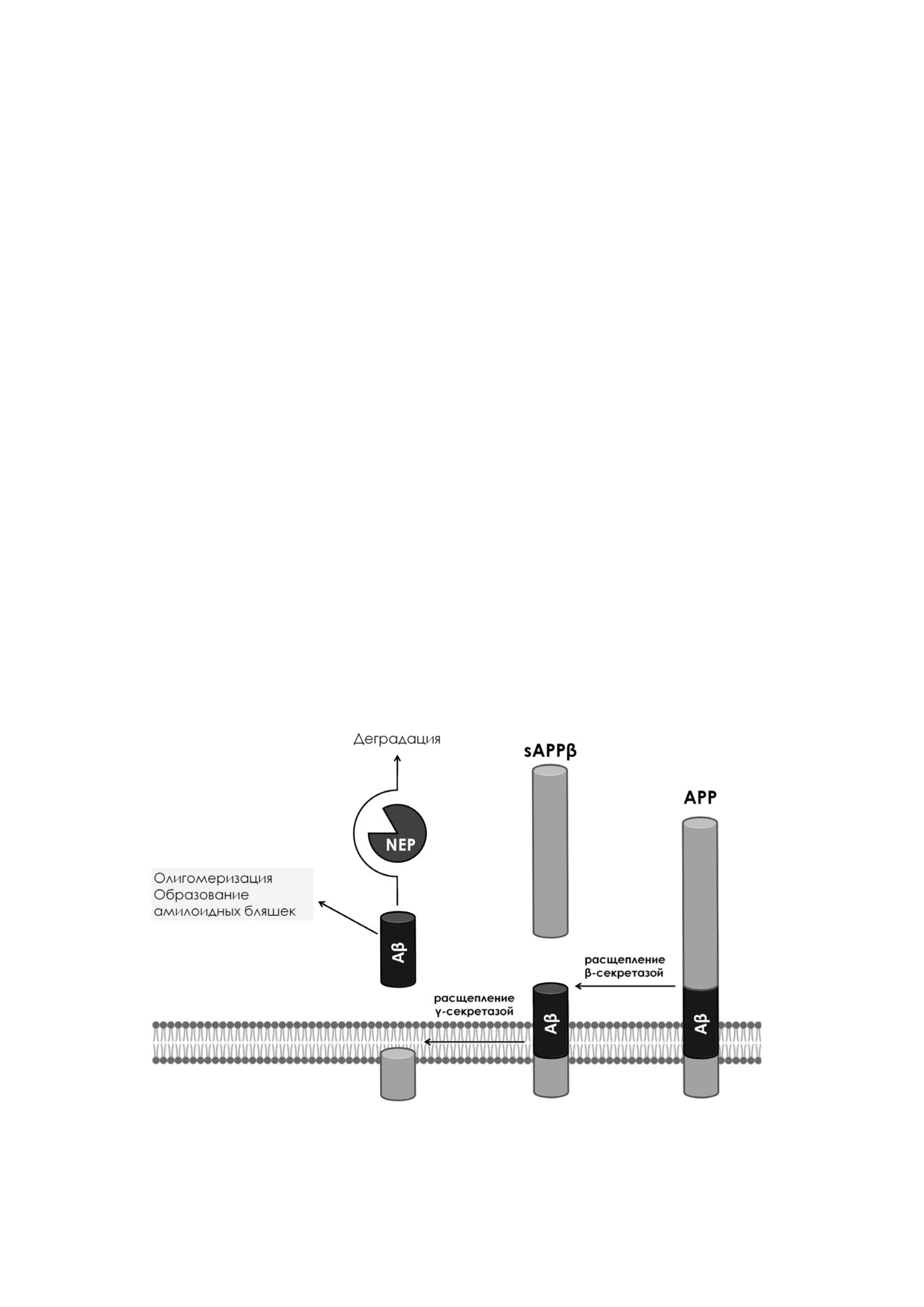
Болезнь Альцгеймера. Помимо вазоактивных
ное в случае омапатрилата повышение уровня
пептидов субстратом NEP также является ами
брадикинина и риск развития отека. Эффектив
лоид β - пептид, вовлеченный в патогенез бо
ность Энтресто™ в сравнении с ингибитором
лезни Альцгеймера [76-78]. Этот факт делает
АПФ эналаприлом анализировали в ходе кли
БА, наряду с СН, патологией, ассоциированной
нического исследования PARADIGM HF
с NEP и его функциональной активностью.
(Prospective comparison of ARNI with ACEI to
БА - это тяжелое нейродегенеративное забо
Determine Impact on Global Mortality and morbid
левание, приводящее к развитию серьезных по
ity in Heart Failure) [1, 72]. Применение препара
веденческих и когнитивных нарушений, а также
та позволило на 20% снизить частоту повторных
потере памяти [79]. Согласно амилоидной гипо
госпитализаций и смертей у больных хроничес
тезе патогенеза БА, в центре развития заболева
кой СН со сниженной фракцией выброса по
ния находятся продукция и накопление Аβ во
сравнению с ингибитором АПФ эналаприлом.
внутриклеточном и межклеточном простран
Эффективность Энтресто™ также была показа
стве [80]. При процессинге трансмембранного
на для пациентов, перенесших эпизод острой
белка предшественника Аβ (amyloid precursor
декомпенсации СН [73]; в настоящее время
protein, APP) его внеклеточная и внутримем
проводится исследование возможности приме
бранная части расщепляются, соответственно,
нения Энтресто™ для больных хронической СН
под действием β и γ секретаз (амилоидогенный
с сохранной фракцией выброса [74, 75].
путь) с образованием Аβ различной длины. Ос
Таким образом, стратегия одновременного
новные формы Аβ - Аβ40 и Аβ42 - благодаря на
ингибирования РААС и повышения уровня ак
личию гидрофобных а.о. способны к олигоме
тивных натрийуретических пептидов путем ин
ризации с образованием олигомеров и фибрил
гибирования NEP, как и ожидалось, оказалась
разного размера и в конечном счете амилоид
эффективной для терапии различных форм СН.
ных бляшек (рис. 4) [81]. В настоящее время
Учитывая успешность применения Энтресто™,
считается, что наибольшей токсичностью, вы
ставшего первым в своем классе лекарственным
зывающей клеточную гибель, обладают раство
препаратом, можно предполагать, что вслед за
римые олигомеры Аβ, а не амилоидные бляшки,
ним появятся и другие представители АРНи,
как предполагали ранее [82].
включающие помимо ингибиторов NEP допол
Важно подчеркнуть, что в норме Аβ также
нительные компоненты и способные воздей
образуется в организме и, возможно, обладает
ствовать на еще более широкий спектр мише
нормальными физиологическими функциями
ней.
[83]. Таким образом, считается, что с патогене
Рис. 4. Амилоидогенный путь расщепления APP и формирование амилоидных бляшек. sAPPβ - soluble APP, растворимый
фрагмент APP, образующийся при действии β секретазы. Создано с использованием BioRender
БИОХИМИЯ том 84 вып. 11 2019
1674
ФЕЙГИНА и др.
зом БА связано именно аномальное накопление
тивного подхода было предложено использовать
и агрегация Аβ. По оценкам, скорость образова
рекомбинантный растворимый NEP. При ис
ния Аβ в центральной нервной системе здорово
пользовании модели на мышах было показано,
го человека примерно равна скорости его выве
что введение рекомбинантного фермента сни
дения [84], что предотвращает накопление ами
жало уровень апоптотической гибели клеток
лоида. Тем не менее в случае БА с поздним нача
гиппокампа, опосредованной Аβ, повышало
лом (после 65 лет, в отсутствии наследственной
выживаемость клеток in vitro, а также улучшало
предрасположенности к накоплению Аβ) ско
память животных при проведении поведенчес
рость выведения Аβ снижается примерно в 1,4
ких тестов [96].
раза по сравнению с контрольной группой [85].
Несмотря на многочисленные разработки в
Помимо NEP за деградацию Аβ отвечают раз
области повышения активности NEP при БА,
личные ферменты, включая АПФ и инсулин
ни один из подходов пока не введен в клиничес
деградирующий фермент, но в ткани мозга ос
кую практику. На сегодняшний день не сущест
новным амилоид деградирующим ферментом
вует препаратов для терапии БА, использующих
является NEP [28]. Это, в частности, было подт
NEP как терапевтическую мишень, однако ис
верждено в исследованиях с использованием ра
следования такой возможности продолжаются
диоактивно меченного Аβ42, вводимого в гип
(для обзора см. [95]).
покамп крыс [77]. В исследованиях на мышах и
СН И БА: по разные стороны баррикад? Как
крысах применение ингибиторов NEP в значи
было сказано выше, в случае СН желаемый те
тельной степени повышало накопление амило
рапевтический эффект заключается в ингибиро
идных бляшек в мозге. Нокаут гена NEP при мо
вании NEP, тогда как в случае терапии БА стоит
делировании БА у мышей приводил к аналогич
противоположная задача - повышение актив
ному эффекту [86-88]. Важная роль NEP в ката
ности NEP. Из этого следует потенциальная
болизме Аβ дополнительно подтверждается дан
опасность использования ингибиторов NEP
ными о снижении уровня фермента в мозге
при СН [97]. В исследовании распределения
больных БА по сравнению со здоровыми инди
компонента Энтресто™ сакубитрила между
видами того же возраста [89].
плазмой крови и спинномозговой жидкостью у
В связи с этим, в случае БА, NEP также явля
здоровых волонтеров было показано, что саку
ется потенциальной терапевтической мишенью,
битрил присутствует в спинномозговой жидкос
однако, в отличие от СН, с противоположной
ти в концентрации, достаточной для ингибиро
целью: увеличение активности NEP может при
вания активности NEP [98]. Возрастная группа
водить к снижению содержания Аβ, уменьше
риска развития БА близка к таковой для боль
нию отложения амилоидных бляшек и, возмож
ных СН, в связи с чем нарушение скорости де
но, к замедлению прогресса заболевания. Повы
градации Аβ и, как следствие, накопление его в
шение уровня экспрессии NEP методами генной
токсических концентрациях в ткани мозга на
терапии потенциально является стратегией сни
фоне терапии Энтресто™ или его аналогов
жения уровня Аβ. В ряде доклинических иссле
представляется возможным сценарием.
дований было показано, что введение гена NEP
Необходимо отметить, что больные, страда
мышам, оверэкспрессирующим APP человека, с
ющие БА, не были включены в клинические ис
использованием лентивирусной и герпесвирус
следования Энтресто™ [72]. При анализе когни
ной инфекции, а также аденоассоциированного
тивных функций участников PARADIGM HF в
вируса приводило к снижению отложения ами
течение максимального срока 4,3 г. никаких дос
лоидных бляшек [90-92]. Аналогичного эффек
товерных ухудшений по сравнению с контроль
та, а также улучшения когнитивной функции у
ной группой не наблюдалось, однако в случае
мышей удавалось добиться с использованием
БА необходим анализ динамики в течение бо
сочетания клеточной и генной терапии: введе
лее продолжительного времени [99]. Также оза
нием фибробластов, трансдуцированных ленти
боченность вызывает тот факт, что доля больных
вирусом, экспрессирующим растворимую фор
СН младше 40 лет в настоящее время возрастает
му NEP [93]. Другим методом повышения уров
[100, 101]. Период приема препаратов на основе
ня экспрессии NEP стала доставка мРНК, коди
ингибиторов NEP для таких пациентов окажет
рующей NEP, в составе наномицелл [94, 95].
ся больше, чем для старших возрастных групп,
Ограничениями в случае использования ви
что потенциально повышает риск развития БА в
русной доставки гена NEP являются сложность
более раннем возрасте. Таким образом, при дли
контроля точного количества экспрессируемого
тельном использовании препаратов на основе
вирусного продукта и времени экспрессии, а
ингибиторов NEP необходимо пристальное
также возможная токсичность вируса и развитие
наблюдение за когнитивными функциями па
воспалительной реакции. В качестве альтерна
циентов и процессами амилоидогенеза.
БИОХИМИЯ том 84 вып. 11 2019
НЕПРИЛИЗИН В ТЕРАПИИ И ДИАГНОСТИКЕ
1675
NEP КАК МАРКЕР
зованы [107]. Таким образом, данные о предс
казательной силе уровня sNEP требуют осто
В силу вовлеченности NEP в такие важней
рожной интерпретации.
шие регуляторные системы, как РААС и система
Измерение активности NEP. Измерение ак
НП, предметом исследования стала потенци
тивности NEP, а не концентрации его раствори
альная возможность использовать NEP как мар
мой формы, выглядит более обоснованным с
кер для предсказания риска осложнений СН
той точки зрения, что именно ферментативная
[102].
функция NEP вовлечена в регуляцию метабо
Измерение уровня sNEP. Иммунохимическое
лизма и патогенез СН. Такие попытки также
измерение концентрации растворимой формы
предпринимались: в ряде работ авторы оценива
NEP с использованием пары антител в крови
ли активность sNEP в образцах плазмы крови
больных СН со сниженной фракцией выброса
больных СН с использованием флуорогенного
показало, что высокий уровень sNEP ассоции
субстрата [108, 109]. Серьезным ограничением
рован с повышенным риском развития небла
этих исследований стало использования в каче
гоприятных событий у пациентов. Отношение
стве матрикса для измерения активности sNEP
рисков составило 1,18 (p = 0,001) для риска пов
ЭДТА плазмы: так как NEP является цинк за
торной госпитализации из за осложнения СН и
висимой металлопротеиназой, присутствие
1,18 (p = 0,006) для риска смерти из за болезни
ЭДТА препятствует физиологическому функци
сердечно сосудистой системы [103]. Статисти
онированию фермента. Имеющиеся на данный
чески достоверную ассоциацию sNEP с госпита
момент флуорогенные субстраты NEP, в свою
лизациями и смертью из за осложнений СН
очередь, не могут обеспечивать достаточной
также наблюдали в мультипараметрическом ис
специфичности, что дополнительно затрудняет
следовании, включавшем оценку уровней ряда
измерения подобного рода.
прогностических маркеров [104]. Было показа
Попытки анализировать активность sNEP
но, что sNEP является независимым прогности
плазмы крови предпринимались не только в
ческим маркером, и его уровень не коррелирует
случае СН, но также в связи с БА. С использова
с концентрацией NT proBNP. Уровень sNEP
нием флуорогенного субстрата было показано,
оказался менее зависим от сопутствующих пато
что у больных удельная активность sNEP в плаз
логий, таких как ожирение и диабет, в отличие
ме в среднем на 42% ниже, чем у контрольной
от NT proBNP [104]. Указанное авторами отно
группы (1,028 ± 0,086 нмоль субстрата/мг бел
шение рисков составило 1,14 (p = 0,03) для со
ка × мин против 1,770 ± 0,124 нмоль субстра
ставной конечной точки и 1,15 (p = 0,04) в слу
та/мг белка × мин) [110].
чае риска смерти из за болезни сердечно сосу
Важным является тот факт, что при измере
дистой системы.
нии активности NEP в образце крови с исполь
В случае СН с сохранной фракцией выброса,
зованием искусственных субстратов исследова
однако, высокие уровни sNEP не демонстриро
тели имеют дело с активностью исключительно
вали корреляции с прогнозом риска осложне
присутствующего в образце sNEP [111, 112].
ний [105]. Исследование группы из 350 пациен
Можно предположить, что активность sNEP
тов, страдающих острой СН, как и в случае хро
составляет лишь малую часть общей активности
нической СН со сниженной фракцией выброса,
NEP организма. Это обстоятельство, а также от
показало прогностическую ценность sNEP (от
сутствие ясности в механизме шеддинга фер
ношение рисков в долгосрочном прогнозе со
мента указывают, что клинический интерес мо
ставило 1,21 (p = 0,01) для составных конечных
жет представлять измерение интегральной ак
точек) [106].
тивности тканевого NEP. Для этой цели воз
Таким образом, данные о возможности
можно использовать эндогенные субстраты
прогностического использования sNEP доста
NEP, проводя измерения специфических про
точно противоречивы. Важно отметить тот
дуктов, образующихся в результате расщепле
факт, что механизм появления sNEP в кровото
ния.
ке до сих пор не установлен. Шеддинг внекле
Возвращаясь к СН, помимо использования
точной части трансмембранных белков проис
активности NEP для предсказания риска разви
ходит неспецифически; в этом случае сложно
тия неблагоприятных событий на фоне СН, по
предполагать регулирование уровня sNEP в
явление АРНи ставит вопрос и о другом потен
кровотоке, связанное с патогенезом СН. Изме
циальном применении такого параметра: выбор
рение sNEP связано также с рядом аналитичес
пациентов, для которых применение АРНи ока
ких затруднений: имеющиеся на рынке систе
жется наиболее эффективным. Учитывая имею
мы иммунохимической детекции плохо корре
щиеся побочные эффекты АРНи, неизученное
лируют друг с другом, измерения не стандарти
до конца потенциальное влияние препарата на
БИОХИМИЯ том 84 вып. 11 2019
1676
ФЕЙГИНА и др.
когнитивные функции, а также высокая стои
Один из таких продуктов образуется в ре
мость препарата, возможность подбора терапии
зультате расщепления BNP по сайту 17-18 а.о.
индивидуально для каждого пациента представ
(см. выше). Протеолиз приводит к размыканию
ляется крайне важной.
кольцевой структуры BNP и образованию двух
Возможным механизмом благоприятного
эпитопов в составе пептида, отсутствовавших в
воздействия АРНи на гемодинамику пациентов
интактной молекуле - так называемых нео
с СН является повышение уровня активных
эпитопов neo17 (содержит С концевой остаток
форм ANP и BNP в кровотоке благодаря инги
Arg17) и neo18 (содержит N концевой остаток
бированию NEP, играющего важнейшую роль в
Ile18). Нео эпитопы могут быть использованы
их деградации. Можно предположить, что АРНи
для специфического определения содержащих
будет более эффективен для пациентов с высо
их пептидов иммунохимическими методами.
кой активностью NEP, то есть для тех, у кого
Формы BNP, содержащие neo17 эпитоп, полу
вклад NEP в истощение пула активных НП в
чили общее название BNP neo17. В нашем ис
кровотоке велик. С другой стороны, уровень
следовании в кровоток крыс вводили BNP че
продукции НП также должен быть достаточно
ловека, а затем проводили измерение содержа
высок, в противном случае ингибирование NEP
щихся в образцах плазмы животных форм BNP
не приведет к значительному изменению концен
через различные промежутки времени после
трации активных форм пептидов в кровотоке.
инъекции [113]. Эксперимент проводили у
Таким образом, при сочетании эффективной
крыс на фоне специфического ингибирования
продукции НП и высокой активности NEP ин
эндогенного NEP сакубитрилом, а также без та
гибирование фермента под действием АРНи мо
кового. Сравнение состава форм BNP у крысы
жет привести к смещению равновесия в сторону
до и после ингибирования NEP показало, что
активных форм ANP и BNP и усилению опосре
BNP neo17 образуется и накапливается в кро
дуемых ими положительных эффектов (см. схе
вотоке животных только в отсутствии сакубит
му на рис. 5). Для определения таких пациентов
рила; ингибирование NEP блокировало образо
было предложено измерять уровень циркулиру
вание BNP neo17. Данный результат доказыва
ющих продуктов расщепления натрийуретичес
ет, что BNP neo17 является продуктом специ
ких пептидов NEP [113].
фического расщепления BNP NEP. На следую
Рис. 5. Механизмы пополнения и истощения пула активных НП в кровотоке
БИОХИМИЯ том 84 вып. 11 2019
НЕПРИЛИЗИН В ТЕРАПИИ И ДИАГНОСТИКЕ
1677
щем этапе работы присутствие BNP neo17 было
терес представляют наметившиеся перспективы
продемонстрировано в плазме крови пациен
для персонализированной диагностики: воз
тов, больных СН. Так как уровень BNP neo17
можность подбирать терапию СН на основе из
очевидным образом зависит от уровня продук
мерения активности NEP по специфическим
ции активного BNP, субстрата реакции с NEP, а
продуктам расщепления. В современной клини
также от интегральной активности NEP орга
ческой практике, когда все больше внимания
низма, можно предположить, что BNP neo17
уделяется индивидуальному подходу к каждому
является потенциальным биомаркером, отра
пациенту и учету нюансов патологического ме
жающим возможную эффективность терапии
ханизма, важность подобной сопутствующей
СН с использованием ингибиторов NEP, в част
диагностики выходит на первый план.
ности АРНи.
Невольная аналогия, возникающая при раз
Помимо BNP, в роли субстрата для образова
мышлении об истории изучения и использова
ния продуктов маркеров может выступать и
ния NEP, - это концепция «инь и ян», берущая
ANP. Исследование сайтов специфического
начало в китайской философии. В основе дан
расщепления ANP NEP и образующихся в ре
ной концепции лежит представление о единстве
зультате такого протеолиза фрагментов ANP,
и неделимости противоположных начал, как
анализ их состава и присутствия в кровотоке мо
модели всего сущего. Так и в случае NEP, двой
жет пролить свет на новые потенциальные
ственность оказывается неотъемлемым свой
ANP зависимые биомаркеры для предсказания
ством фермента: вовлеченность в регуляцию как
эффективности терапии на основе ингибирова
РААС, так и системы НП; роль как маркера и
ния NEP.
как терапевтической мишени; необходимость
Наряду с НП в качестве источников для об
ингибирования при СН и активации при БА.
разования циркулирующих продуктов расщеп
Продолжая это философское построение, мож
ления NEP могут быть потенциально использо
но утверждать, что успешное практическое при
ваны и другие молекулы. Несмотря на то что
менение NEP возможно только при учете этой
предпочтительными субстратами NEP являются
двойственности.
короткие пептиды, существуют данные о спо
Вовлеченность NEP и продуктов его проте
собности NEP отщеплять от фибриногена N
олитической активности в самые разнообраз
концевой пептид из 18 а.о., а также расщеплять
ные регуляторные метаболические пути за счет
фактор роста фибробластов 2 (ФГФ 2) с отщеп
широкой субстратной специфичности и расп
лением от C конца белка фрагмента из 20 а.о.
ространенности в многочисленных тканях
[114]. Изучение возможности использования та
обусловили невероятную сложность изучения
ких фрагментов для оценки общей активности
роли этого фермента в функционировании жи
NEP организма и, как следствие, подбора инди
вого организма. Тем более выдающимися
видуальной терапии СН представляет большой
представляются успехи в прикладном примене
интерес.
нии NEP. И тем более обширными выглядят
Альтернативным подходом для измерения
перспективы для дальнейшей работы: поиск
интегральной активности NEP организма мо
новых субстратов фермента, анализ механизмов
жет стать внутривенное введение экзогенного
регуляции его активности и шеддинга, изуче
субстрата фермента с последующим измерением
ние биомаркерного и терапевтического потен
концентрации специфических продуктов рас
циала как самого NEP, так и его мишеней. Не
щепления. Несомненным преимуществом тако
будет преувеличением сказать, что находящий
го подхода является возможность использовать
ся на перекрестке важнейших метаболических
концентрации субстрата, значительно превы
путей NEP - это иллюстрация необходимости
шающие таковые для эндогенных субстратов,
комплексного подхода как в диагностике и те
что позволит решить аналитические сложности
рапии, так и в фундаментальных исследовани
измерения низких уровней продуктов протеоли
ях.
тической реакции.
Долгая история исследований, связанных с
Конфликт интересов. Авторы заявляют об от
NEP, является ярким примером того, как фунда
сутствии конфликта интересов.
ментальные научные изыскания оказались тес
Соблюдение этических норм. Настоящая
но сплетены с развитием прикладных направле
статья не содержит каких либо исследований с
ний, таких как терапия сердечной недостаточ
использованием животных в качестве объектов.
ности, разработка методов лечения болезни
Настоящая статья не содержит каких либо ис
Альцгеймера, изучение возможностей для диаг
следований с участием людей в качестве объек
ностического применения NEP. Особенный ин
тов.
БИОХИМИЯ том 84 вып. 11 2019
1678
ФЕЙГИНА и др.
СПИСОК ЛИТЕРАТУРЫ
1.
McMurray, J.J., Packer, M., Desai, A.S., Gong, J.,
16.
Yandle, T., Richards, M., Smith, M., Charles, C., Livesey,
Lefkowitz, M.P., Rizkala, A.R., Rouleau, J., Shi, V.C.,
J., and Espiner, E. (1992) Assay of endopeptidase 24.11
Solomon, S.D., Swedberg, K., Zile, M.R., and
activity in plasma applied to in vivo studies of endopepti
PARADIGM HF Committees and Investigators (2013)
dase inhibitors, Clin. Chem., 38, 1785-1791.
Dual angiotensin receptor and neprilysin inhibition as an
17.
Whyteside, A.R., and Turner, A.J.
(2008) Human
alternative to angiotensin converting enzyme inhibition in
neprilysin 2 (NEP2) and NEP display distinct subcellular
patients with chronic systolic heart failure: rationale for
localisations and substrate preferences, FEBS Lett., 582,
and design of the Prospective comparison of ARNI with
2382-2386.
ACEI to Determine Impact on Global Mortality and mor
18.
Raharjo, S.B., Emoto, N., Ikeda, K., Sato, R., Yokoyama, M.,
bidity in Heart Failure trial (PARADIGM HF), Eur. J.
and Matsuo, M. (2001) Alternative splicing regulates
Heart Fail., 15, 1062-1073.
the endoplasmic reticulum localization or secretion of sol
2.
George, S.G., and Kenny, J. (1973) Studies on the enzy
uble secreted endopeptidase, J. Biol. Chem.,
276,
mology of purified preparations of brush border from rab
25612-25620.
bit kidney, Biochem. J., 134, 43-57.
19.
Pankow, K., Schwiebs, A., Becker, M., Siems, W.E.,
3.
Malfroy, B., and Guyon, A. (1978) High affinity degrading
Krause, G., and Walther, T. (2009) Structural substrate con
peptidase in brain is increased after morphine, Nature, 276,
ditions required for neutral endopeptidase mediated natri
523-526.
uretic peptide degradation, J. Mol. Biol., 393, 496-503.
4.
Roques, B.P., Fournie Zaluski, M.C., Soroca, E.,
20.
Shipp, M.A., Tarr, G.E., Chen, C.Y., Switzer, S.N.,
Lecomte, J.M., Malfroy, B., Llorens, C., and
Hersh, L.B., Stein, H., Sunday, M.E., and Reinherz, E.L.
Schwartz, J.C. (1980) The enkephalinase inhibitor thior
(1991) CD10/neutral endopeptidase 24.11 hydrolyzes
phan shows antinociceptive activity in mice, Nature., 288,
bombesin like peptides and regulates the growth of small
286-288.
cell carcinomas of the lung, Proc. Natl. Acad. Sci. USA, 88,
5.
Letarte, M., Vera, S., Tran, R., Addis, J.B., Onizuka, R.J.,
10662-10666.
Quackenbush, E.J., Jongeneel, C.V., and McInnes, R.R.
21.
Kenny, A.J., Bourne, A., and Ingram, J. (1993) Hydrolysis
(1988) Common acute lymphocytic leukemia antigen is
of human and pig brain natriuretic peptides, urodilatin,
identical to neutral endopeptidase, J. Exp. Med., 168,
C type natriuretic peptide and some C receptor ligands by
1247-1253.
endopeptidase 24.11, Biochem. J., 291, 83-88.
6.
Fulcher, I.S., and Kenny, A.J. (1983) Proteins of the kid
22.
Watanabe, Y., Nakajima, K., Shimamori, Y., and
ney microvillar membrane. The amphipathic forms of
Fujimoto, Y. (1997) Comparison of the hydrolysis of the
endopeptidase purified from pig kidneys, Biochem. J., 211,
three types of natriuretic peptides by human kidney neutral
743-753.
endopeptidase 24.11, Biochem. Mol. Med., 61, 47-51.
7.
Oefner, C., D’Arcy, A., Hennig, M., Winkler, F.K., and
23.
Bhoola, K.D., Figueroa, C.D., and Worthy, K. (1992)
Dale, G.E. (2000) Structure of human neutral endopepti
Bioregulation of kinins: kallikreins, kininogens, and kini
dase (Neprilysin) complexed with phosphoramidon, J.
nases, Pharmacol. Rev., 44, 1-80.
Mol. Biol., 296, 341-349.
24.
Matsas, R., Rattray, M., Kenny, A.J., and Turner, A.J.
8.
Beaumont, A., Le Moual, H., Boileau, G., Crine, P., and
(1985) The metabolism of neuropeptides. Endopeptidase
Roques, B.P. (1991) Evidence that both arginine 102 and
24.11 in human synaptic membrane preparations hydroly
arginine 747 are involved in substrate binding to neutral
ses substance P, Biochem. J., 228, 487-492.
endopeptidase (EC 3.4.24.11), J. Biol. Chem., 266,
25.
Wilkinson, I.B., McEniery, C.M., Bongaerts, K.H.,
214-220.
MacCallum, H., Webb, D.J., and Cockcroft, J.R. (2001)
9.
Erdos, E.G., and Skidgel, R.A. (1989) Neutral endopepti
Adrenomedullin (ADM) in the human forearm vascular
dase 24.11 (enkephalinase) and related regulators of pep
bed: effect of neutral endopeptidase inhibition and com
tide hormones, FASEB J., 3, 145-151.
parison with proadrenomedullin NH2 terminal 20 peptide
10.
Ronco, P., Pollard, H., Galceran, M., Delauche, M.,
(PAMP), Br. J. Clin. Pharmacol., 52, 159-164.
Schwartz, J.C., and Verroust, P. (1988) Distribution of
26.
McDowell, G., Coutie, W., Shaw, C., Buchanan, K.D.,
enkephalinase (membrane metalloendopeptidase, E.C.
Struthers, A.D., and Nicholls, D.P. (1997) The effect of the
3.4.24.11) in rat organs. Detection using a monoclonal
neutral endopeptidase inhibitor drug, candoxatril, on cir
antibody, Lab. Invest., 58, 210-217.
culating levels of two of the most potent vasoactive pep
11.
Mapp, P.I., Walsh, D.A., Kidd, B.L., Cruwys, S.C., Polak,
tides, Br. J. Clin. Pharmacol., 43, 329-332.
J.M., and Blake, D.R. (1992) Localization of the enzyme
27.
Barnes, K., Doherty, S., and Turner, A.J.
(1995)
neutral endopeptidase to the human synovium, J.
Endopeptidase 24.11 is the integral membrane peptidase
Rheumatol., 19, 1838-1844.
initiating degradation of somatostatin in the hippocampus,
12.
Bowes, M.A., and Kenny, A.J. (1986) Endopeptidase
J. Neurochem., 64, 1826-1832.
24.11 in pig lymph nodes. Purification and immunocyto
28.
Nalivaeva, N.N., Belyaev, N.D., Zhuravin, I.A., and
chemical localization in reticular cells, Biochem. J., 236,
Turner, A.J. (2012) The Alzheimer’s amyloid degrading
801-810.
peptidase, neprilysin: can we control it? Int. J. Alzheimers
13.
Connelly, J.C., Skidgel, R.A., Schulz, W.W., Johnson, A.R.,
Dis., 2012, 383796.
and Erdos, E.G. (1985) Neutral endopeptidase 24.11 in
29.
Singh, J.S.S., Burrell, L.M., Cherif, M., Squire, I.B.,
human neutrophils: cleavage of chemotactic peptide, Proc.
Clark, A.L., and Lang, C.C. (2017) Sacubitril/valsartan:
Natl. Acad. Sci. USA, 82, 8737-8741.
beyond natriuretic peptides, Heart, 103, 1569-1577.
14.
Kuruppu, S., Rajapakse, N.W., Minond, D., and Smith, A.I.
30.
Schulz, R., Sakane, Y., Berry, C., and Ghai, R. (1991)
(2014) Production of soluble Neprilysin by endothelial
Characterisation of neutral endopeptidase
3.4.24.11
cells, Biochem. Biophys. Res. Commun., 446, 423-427.
(NEP) in the kidney: comparison between normotensive,
15.
Spillantini, M.G., Sicuteri, F., Salmon, S., and Malfroy, B.
genetically hypertensive and experimentally hypertensive
(1990) Characterization of endopeptidase
3.4.24.11
rats, J. Enzyme Inhib., 4, 347-358.
(“enkephalinase”) activity in human plasma and cere
31.
Koehn, J.A., Norman, J.A., Jones, B.N., LeSueur, L.,
brospinal fluid, Biochem. Pharmacol., 39, 1353-1356.
Sakane, Y., and Ghai, R.D. (1987) Degradation of atrial
БИОХИМИЯ том 84 вып. 11 2019
НЕПРИЛИЗИН В ТЕРАПИИ И ДИАГНОСТИКЕ
1679
natriuretic factor by kidney cortex membranes. Isolation
natriuretic peptide is not degraded by meprin A, Biochem.
and characterization of the primary proteolytic product,
Pharmacol., 80, 1007-1011.
J. Biol. Chem., 262, 11623-11627.
48.
Norman, J.A., Little, D., Bolgar, M., and Di Donato, G.
32.
Olins, G.M., Spear, K.L., Siegel, N.R., and Zurcher
(1991) Degradation of brain natriuretic peptide by neutral
Neely, H.A. (1987) Inactivation of atrial natriuretic factor
endopeptidase: species specific sites of proteolysis deter
by the renal brush border, Biochim. Biophys. Acta, 901,
mined by mass spectrometry, Biochem. Biophys. Res.
97-100.
Commun., 175, 22-30.
33.
Nawarskas, J., Rajan, V., and Frishman, W.H. (2001)
49.
Semenov, A.G., and Katrukha, A.G. (2016) Different sus
Vasopeptidase inhibitors, neutral endopeptidase inhibitors,
ceptibility of B Type Natriuretic Peptide (BNP) and BNP
and dual inhibitors of angiotensin converting enzyme and
Precursor (proBNP) to cleavage by neprilysin: the N ter
neutral endopeptidase, Heart Dis., 3, 378-385.
minal part does matter, Clin. Chem., 62, 617-622.
34.
Nishimura, K., and Hazato, T. (1993) Isolation and identi
50.
Semenov, A.G., Feygina, E.E., Tamm, N.N.,
fication of an endogenous inhibitor of enkephalin degrad
Serebryanaya, D.V., and Katrukha, A.G. (2017) Abstract
ing enzymes from bovine spinal cord, Biochem. Biophys.
15828: Pro Atrial Natriuretic Peptide (proANP) as a stable
Res. Commun., 194, 713-719.
circulating ANP form that is not affected by neprilysin
35.
Shen, R., Sumitomo, M., Dai, J., Harris, A., Kaminetzky, D.,
mediated cleavage, Circulation, 136, A15828.
Gao, M., Burnstein, K.L., and Nanus, D.M. (2000)
51.
Yan, W., Wu, F., Morser, J., and Wu, Q. (2000) Corin, a
Androgen induced growth inhibition of androgen receptor
transmembrane cardiac serine protease, acts as a pro atrial
expressing androgen independent prostate cancer cells is
natriuretic peptide converting enzyme, Proc. Natl. Acad.
mediated by increased levels of neutral endopeptidase,
Sci. USA, 97, 8525-8529.
Endocrinology, 141, 1699-1704.
52.
Yan, W., Sheng, N., Seto, M., Morser, J., and Wu, Q.
36.
Stephen, H.M., Khoury, R.J., Majmudar, P.R., Blaylock, T.,
(1999) Corin, a mosaic transmembrane serine protease
Hawkins, K., Salama, M.S., Scott, M.D., Cosminsky, B.,
encoded by a novel cDNA from human heart, J. Biol.
Utreja, N.K., Britt, J., and Conway, R.E.
(2016)
Chem., 274, 14926-14935.
Epigenetic suppression of neprilysin regulates breast cancer
53.
Semenov, A.G., Tamm, N.N., Seferian, K.R., Postnikov, A.B.,
invasion, Oncogenesis, 5, e207.
Karpova, N.S., Serebryanaya, D.V., Koshkina, E.V.,
37.
Jhund, P.S., and McMurray, J.J. (2016) The neprilysin
Krasnoselsky, M.I., and Katrukha, A.G. (2010) Processing
pathway in heart failure: a review and guide on the use of
of pro B type natriuretic peptide: furin and corin as candi
sacubitril/valsartan, Heart, 102, 1342-1347.
date convertases, Clin. Chem., 56, 1166-1176.
38.
Volpe, M., Carnovali, M., and Mastromarino, V. (2016)
54.
Semenov, A.G., Seferian, K.R., Tamm, N.N.,
The natriuretic peptides system in the pathophysiology of
Artem’eva, M.M., Postnikov, A.B., Bereznikova, A.V.,
heart failure: from molecular basis to treatment, Clin. Sci.
Kara, A.N., Medvedeva, N.A., and Katrukha, A.G. (2011)
(Lond.), 130, 57-77.
Human pro B type natriuretic peptide is processed in the
39.
Potter, L.R., Yoder, A.R., Flora, D.R., Antos, L.K., and
circulation in a rat model, Clin. Chem., 57, 883-890.
Dickey, D.M. (2009) Natriuretic peptides: their structures,
55.
Yandle, T.G., Richards, A.M., Gilbert, A., Fisher, S.,
receptors, physiologic functions and therapeutic applica
Holmes, S., and Espiner, E.A. (1993) Assay of brain
tions, Handb. Exp. Pharmacol., 191, 341-366.
natriuretic peptide (BNP) in human plasma: evidence for
40.
Yamamoto, K., Chappell, M.C., Brosnihan, K.B., and
high molecular weight BNP as a major plasma compo
Ferrario, C.M. (1992) In vivo metabolism of angiotensin I
nent in heart failure, J. Clin. Endocrinol. Metab., 76,
by neutral endopeptidase (EC 3.4.24.11) in spontaneously
832-838.
hypertensive rats, Hypertension, 19, 692-696.
56.
Seferian, K.R., Tamm, N.N., Semenov, A.G.,
41.
Rossi, F., Mascolo, A., and Mollace, V. (2017) The patho
Mukharyamova, K. S., Tolstaya, A.A., Koshkina, E.V.,
physiological role of natriuretic peptide RAAS cross talk in
Kara, A.N., Krasnoselsky, M.I., Apple, F.S., Esakova, T.V.,
heart failure, Int. J. Cardiol., 226, 121-125.
Filatov, V. L., and Katrukha, A.G. (2007) The brain natri
42.
D’Elia, E., Iacovoni, A., Vaduganathan, M., Lorini, F.L.,
uretic peptide (BNP) precursor is the major immunoreac
Perlini, S., and Senni, M. (2017) Neprilysin inhibition
tive form of BNP in patients with heart failure, Clin. Chem.,
in heart failure: mechanisms and substrates beyond
53, 866-873.
modulating natriuretic peptides, Eur. J. Heart Fail., 19,
57.
Semenov, A.G., and Feygina, E.E. (2018) Standardization
710-717.
of BNP and NT proBNP immunoassays in light of the
43.
Sonnenberg, J.L., Sakane, Y., Jeng, A.Y., Koehn, J.A.,
diverse and complex nature of circulating BNP related
Ansell, J.A., Wennogle, L.P., and Ghai, R.D.
(1988)
peptides, Adv. Clin. Chem., 85, 1-30.
Identification of protease 3.4.24.11 as the major atrial
58.
Yandrapalli, S., Aronow, W.S., Mondal, P., and Chabbott, D.R.
natriuretic factor degrading enzyme in the rat kidney,
(2017) The evolution of natriuretic peptide augmentation
Peptides, 9, 173-180.
in management of heart failure and the role of
44.
Vanneste, Y., Michel, A., Dimaline, R., Najdovski, T., and
sacubitril/valsartan, Arch. Med. Sci., 13, 1207-1216.
Deschodt Lanckman, M. (1988) Hydrolysis of alpha
59.
Northridge, D.B., Jardine, A.G., Alabaster, C.T.,
human atrial natriuretic peptide in vitro by human kidney
Barclay, P.L., Connell, J.M., Dargie, H.J., Dilly, S.G.,
membranes and purified endopeptidase 24.11. Evidence
Findlay, I.N., Lever, A.F., and Samuels, G.M. (1989)
for a novel cleavage site, Biochem. J., 254, 531-537.
Effects of UK 69 578: a novel atriopeptidase inhibitor,
45.
Ralat, L.A., Guo, Q., Ren, M., Funke, T., Dickey, D.M.,
Lancet, 2, 591-593.
Potter, L.R., and Tang, W.J. (2011) Insulin degrading
60.
Gros, C., Souque, A., Schwartz, J.C., Duchier, J.,
enzyme modulates the natriuretic peptide mediated sig
Cournot, A., Baumer, P., and Lecomte, J.M. (1989)
naling response, J. Biol. Chem., 286, 4670-4679.
Protection of atrial natriuretic factor against degradation:
46.
Muller, D., Schulze, C., Baumeister, H., Buck, F., and
diuretic and natriuretic responses after in vivo inhibition of
Richter, D. (1992) Rat insulin degrading enzyme: cleavage
enkephalinase (EC 3.4.24.11) by acetorphan, Proc. Natl.
pattern of the natriuretic peptide hormones ANP, BNP,
Acad. Sci. USA., 86, 7580-7584.
and CNP revealed by HPLC and mass spectrometry,
61.
Bevan, E.G., Connell, J.M., Doyle, J., Carmichael, H.A.,
Biochemistry, 31, 11138-11143.
Davies, D.L., Lorimer, A.R., and McInnes, G.T. (1992)
47.
Dickey, D.M., and Potter, L.R. (2010) Human B type
Candoxatril, a neutral endopeptidase inhibitor: efficacy
БИОХИМИЯ том 84 вып. 11 2019
1680
ФЕЙГИНА и др.
and tolerability in essential hypertension, J. Hypertens., 10,
Packer, M., Pfeffer, M.A., Pieske, B., Redfield, M.M.,
607-613.
Rouleau, J.L., Van Veldhuisen, D.J., Zannad, F., Zile, M.R.,
62.
Richards, A.M., Wittert, G.A., Espiner, E.A., Yandle, T.G.,
Desai, A.S., Shi, V.C., Lefkowitz, M.P., and McMurray,
Ikram, H., and Frampton, C. (1992) Effect of inhibition of
J.J. V. (2017) Angiotensin receptor neprilysin inhibition in
endopeptidase 24.11 on responses to angiotensin II in
heart failure with preserved ejection fraction: rationale and
human volunteers, Circ. Res., 71, 1501-1507.
design of the PARAGON HF trial, JACC Heart Fail., 5,
63.
Ferro, C.J., Spratt, J.C., Haynes, W.G., and Webb, D.J.
471-482.
(1998) Inhibition of neutral endopeptidase causes vasocon
75.
Solomon, S.D., Rizkala, A.R., Lefkowitz, M.P., Shi, V.C.,
striction of human resistance vessels in vivo, Circulation,
Gong, J., et al. (2018) Baseline characteristics of patients
97, 2323-2330.
with heart failure and preserved ejection fraction in the
64.
CONSENSUS Trial Study Group (1987) Effects of
PARAGON HF trial, Circ. Heart Fail., 11, e004962.
enalapril on mortality in severe congestive heart failure.
76.
Howell, S., Nalbantoglu, J., and Crine, P. (1995) Neutral
Results of the Cooperative North Scandinavian Enalapril
endopeptidase can hydrolyze beta amyloid(1 40) but
Survival Study (CONSENSUS), N. Engl. J. Med., 316,
shows no effect on beta amyloid precursor protein metab
1429-1435.
olism, Peptides, 16, 647-652.
65.
SOLVD Investigators, Yusuf, S., Pitt, B., Davis, C.E.,
77.
Iwata, N., Tsubuki, S., Takaki, Y., Watanabe, K.,
Hood, W.B., and Cohn, J.N. (1991) Effect of enalapril on
Sekiguchi, M., Hosoki, E., Kawashima Morishima, M.,
survival in patients with reduced left ventricular ejection
Lee, H.J., Hama, E., Sekine Aizawa, Y., and Saido, T.C.
fractions and congestive heart failure, N. Engl. J. Med.,
(2000) Identification of the major Abeta1 42 degrading
325, 293-302.
catabolic pathway in brain parenchyma: suppression leads
66.
Trippodo, N.C., Robl, J.A., Asaad, M.M., Bird, J.E.,
to biochemical and pathological deposition, Nat. Med., 6,
Panchal, B.C., Schaeffer, T.R., Fox, M., Giancarli, M.R.,
143-150.
and Cheung, H.S. (1995) Cardiovascular effects of the
78.
Takaki, Y., Iwata, N., Tsubuki, S., Taniguchi, S.,
novel dual inhibitor of neutral endopeptidase and
Toyoshima, S., Lu, B., Gerard, N.P., Gerard, C.,
angiotensin converting enzyme BMS 182657 in experi
Lee, H.J., Shirotani, K., and Saido, T.C.
(2000)
mental hypertension and heart failure, J. Pharmacol. Exp.
Biochemical identification of the neutral endopeptidase
Ther., 275, 745-752.
family member responsible for the catabolism of amyloid
67.
McClean, D.R., Ikram, H., Garlick, A.H., Richards, A.M.,
beta peptide in the brain, J. Biochem., 128, 897-902.
Nicholls, M.G., and Crozier, I.G. (2000) The clinical, car
79.
Selkoe, D.J., and Hardy, J. (2016) The amyloid hypothesis
diac, renal, arterial and neurohormonal effects of omapa
of Alzheimer’s disease at 25 years, EMBO Mol. Med., 8,
trilat, a vasopeptidase inhibitor, in patients with chronic
595-608.
heart failure, J. Am. Coll. Cardiol., 36, 479-486.
80.
Hardy, J.A., and Higgins, G.A. (1992) Alzheimer’s disease:
68.
Rouleau, J.L., Pfeffer, M.A., Stewart, D.J., Isaac, D.,
the amyloid cascade hypothesis, Science, 256, 184-185.
Sestier, F., Kerut, E.K., Porter, C.B., Proulx, G., Qian, C.,
81.
Hernandez Zimbron, L.F., and Rivas Arancibia, S. (2014)
and Block, A.J. (2000) Comparison of vasopeptidase
Deciphering an interplay of proteins associated with amy
inhibitor, omapatrilat, and lisinopril on exercise tolerance
loid beta 1 42 peptide and molecular mechanisms of
and morbidity in patients with heart failure: IMPRESS
Alzheimer’s disease, Rev. Neurosci., 25, 773-783.
randomised trial, Lancet, 356, 615-620.
82.
Lambert, M.P., Barlow, A.K., Chromy, B.A., Edwards, C.,
69.
Packer, M., Califf, R.M., Konstam, M.A., Krum, H.,
Freed, R., Liosatos, M., Morgan, T.E., Rozovsky, I.,
McMurray, J.J., Rouleau, J.L., and Swedberg, K. (2002)
Trommer, B., Viola, K.L., Wals, P., Zhang, C.,
Comparison of omapatrilat and enalapril in patients with
Finch, C.E., Krafft, G.A., and Klein, W.L.
(1998)
chronic heart failure: the Omapatrilat Versus Enalapril
Diffusible, nonfibrillar ligands derived from Abeta1 42 are
Randomized Trial of Utility in Reducing Events
potent central nervous system neurotoxins, Proc. Natl.
(OVERTURE), Circulation, 106, 920-926.
Acad. Sci. USA, 95, 6448-6453.
70.
Kostis, J.B., Packer, M., Black, H.R., Schmieder, R.,
83.
Yoon, S.S., and Jo, S.A. (2012) Mechanisms of amyloid
Henry, D., and Levy, E. (2004) Omapatrilat and enalapril
beta peptide clearance: potential therapeutic targets for
in patients with hypertension: the Omapatrilat
Alzheimer’s disease, Biomol. Ther. (Seoul.), 20, 245-255.
Cardiovascular Treatment vs. Enalapril (OCTAVE) trial,
84.
Bateman, R.J., Munsell, L.Y., Morris, J.C., Swarm, R.,
Am. J. Hypertens, 17, 103-111.
Yarasheski, K.E., and Holtzman, D.M. (2006) Human
71.
Fryer, R.M., Segreti, J., Banfor, P.N., Widomski, D.L.,
amyloid beta synthesis and clearance rates as measured in
Backes, B.J., Lin, C.W., Ballaron, S.J., Cox, B.F.,
cerebrospinal fluid in vivo, Nat. Med., 12, 856-861.
Trevillyan, J.M., Reinhart, G.A., and von Geldern, T.W.
85.
Mawuenyega, K.G., Sigurdson, W., Ovod, V., Munsell, L.,
(2008) Effect of bradykinin metabolism inhibitors on
Kasten, T., Morris, J.C., Yarasheski, K.E., and Bateman, R.J.
evoked hypotension in rats: rank efficacy of enzymes asso
(2010) Decreased clearance of CNS beta amyloid in
ciated with bradykinin mediated angioedema, Br. J.
Alzheimer’s disease, Science, 330, 1774.
Pharmacol., 153, 947-955.
86.
Grimm, M.O., Mett, J., Stahlmann, C.P., Haupenthal, V.J.,
72.
McMurray, J.J., Packer, M., Desai, A.S., Gong, J.,
Zimmer, V.C., and Hartmann, T. (2013) Neprilysin and
Lefkowitz, M.P., Rizkala, A.R., Rouleau, J.L., Shi, V.C.,
abeta clearance: impact of the APP intracellular domain in
Solomon, S.D., Swedberg, K., Zile, M.R., PARADIGM
NEP regulation and implications in Alzheimer’s disease,
HF Investigators, and Committees (2014) Angiotensin
Front. Aging Neurosci., 5, 98.
neprilysin inhibition versus enalapril in heart failure, N.
87.
Eckman, E.A., Adams, S.K., Troendle, F.J., Stodola, B.A.,
Engl. J. Med., 371, 993-1004.
Kahn, M.A., Fauq, A.H., Xiao, H.D., Bernstein, K.E.,
73.
Velazquez, E.J., Morrow, D.A., DeVore, A.D., Duffy, C.I.,
and Eckman, C.B. (2006) Regulation of steady state beta
Ambrosy, A.P., McCague, K., Rocha, R., Braunwald, E.,
amyloid levels in the brain by neprilysin and endothelin
and PIONEER HF Investigators (2019) Angiotensin
converting enzyme but not angiotensin converting
neprilysin inhibition in acute decompensated heart failure,
enzyme, J. Biol. Chem., 281, 30471-30478.
N. Engl. J. Med., 380, 539-548.
88.
Madani, R., Poirier, R., Wolfer, D.P., Welzl, H.,
74.
Solomon, S.D., Rizkala, A.R., Gong, J., Wang, W., Anand,
Groscurth, P., Lipp, H.P., Lu, B., El Mouedden, M.,
I.S., Ge, J., Lam, C.S.P., Maggioni, A.P., Martinez, F.,
Mercken, M., Nitsch, R.M., and Mohajeri, M.H. (2006)
БИОХИМИЯ том 84 вып. 11 2019
НЕПРИЛИЗИН В ТЕРАПИИ И ДИАГНОСТИКЕ
1681
Lack of neprilysin suffices to generate murine amyloid like
102. Seronde, M.F., and Mebazaa, A. (2015) Neprilysin: biotar
deposits in the brain and behavioral deficit in vivo,
get and biomarker in heart failure, JACC Heart Fail., 3,
J. Neurosci. Res., 84, 1871-1878.
645-646.
89.
Caccamo, A., Oddo, S., Sugarman, M.C., Akbari, Y., and
103. Bayes Genis, A., Barallat, J., Galan, A., de Antonio, M.,
LaFerla, F.M. (2005) Age and region dependent alter
Domingo, M., Zamora, E., Urrutia, A., and Lupon, J.
ations in Abeta degrading enzymes: implications
(2015) Soluble neprilysin is predictive of cardiovascular
for Abeta induced disorders, Neurobiol. Aging,
26,
death and heart failure hospitalization in heart failure
645-654.
patients, J. Am. Coll. Cardiol., 65, 657-665.
90. Iwata, N., Mizukami, H., Shirotani, K., Takaki, Y.,
104. Bayes Genis, A., Barallat, J., Galan, A., de Antonio, M.,
Muramatsu, S., Lu, B., Gerard, N.P., Gerard, C.,
Domingo, M., Zamora, E., Gastelurrutia, P., Vila, J.,
Ozawa, K., and Saido, T.C. (2004) Presynaptic localiza
Penafiel, J., Galvez Monton, C., and Lupon, J. (2015)
tion of neprilysin contributes to efficient clearance of amy
Multimarker strategy for heart failure prognostication.
loid beta peptide in mouse brain, J. Neurosci., 24,
Value of neurohormonal biomarkers: neprilysin vs NT
991-998.
proBNP, Rev. Esp. Cardiol. (Engl. Ed.), 68, 1075-1084.
91. Marr, R.A., Rockenstein, E., Mukherjee, A., Kindy, M.S.,
105. Goliasch, G., Pavo, N., Zotter Tufaro, C., Kammerlander, A.,
Hersh, L.B., Gage, F. H., Verma, I.M., and Masliah, E.
Duca, F., Mascherbauer, J., and Bonderman, D. (2016)
(2003) Neprilysin gene transfer reduces human amyloid
Soluble neprilysin does not correlate with outcome in heart
pathology in transgenic mice, J. Neurosci., 23, 1992-1996.
failure with preserved ejection fraction, Eur. J. Heart Fail.,
92. Hong, C.S., Goins, W.F., Goss, J.R., Burton, E.A., and
18, 89-93.
Glorioso, J.C. (2006) Herpes simplex virus RNAi and
106. Bayes Genis, A., Barallat, J., Pascual Figal, D., Nunez, J.,
neprilysin gene transfer vectors reduce accumulation of
Minana, G., Sanchez Mas, J., Galan, A., Sanchis, J.,
Alzheimer’s disease related amyloid beta peptide in vivo,
Zamora, E., Perez Martinez, M. T., and Lupon, J. (2015)
Gene Ther., 13, 1068-1079.
Prognostic value and kinetics of soluble neprilysin in
93. Hemming, M.L., Patterson, M., Reske Nielsen, C., Lin, L.,
acute heart failure: a pilot study, JACC Heart Fail., 3,
Isacson, O., and Selkoe, D.J. (2007) Reducing amyloid
641-644.
plaque burden via ex vivo gene delivery of an Abeta
107. Bayes Genis, A., Barallat, J., and Richards, A.M. (2016) A
degrading protease: a novel therapeutic approach to
test in context: neprilysin: function, inhibition, and bio
Alzheimer’s disease, PLoS Med., 4, e262.
marker, J. Am. Coll. Cardiol., 68, 639-653.
94. Lin, C.Y., Perche, F., Ikegami, M., Uchida, S., Kataoka, K.,
108. Vodovar, N., Seronde, M.F., Laribi, S., Gayat, E., Lassus, J.,
and Itaka, K. (2016) Messenger RNA based therapeutics
Januzzi, J.L., Jr., Boukef, R., Nouira, S., Manivet, P.,
for brain diseases: an animal study for augmenting clear
Samuel, J.L., Logeart, D., Cohen Solal, A., Richards,
ance of beta amyloid by intracerebral administration of
A.M., Launay, J.M., Mebazaa, A., and Network, G. (2015)
neprilysin mRNA loaded in polyplex nanomicelles,
Elevated plasma B type natriuretic peptide concentrations
J. Control. Release, 235, 268-275.
directly inhibit circulating neprilysin activity in heart fail
95. Nalivaeva, N.N., and Turner, A.J. (2019) Targeting amy
ure, JACC Heart Fail., 3, 629-636.
loid clearance in Alzheimer’s disease as a therapeutic strat
109. Emrich, I.E., Vodovar, N., Feuer, L., Untersteller, K.,
egy, Br. J. Pharmacol., 176, 3447-3463, doi: 10.1111/
Nougue, H., Seiler Mussler, S., Fliser, D., Launay, J.M.,
bph.14593.
and Heine, G.H. (2019) Do plasma neprilysin activity and
96. Park, M.H., Lee, J.K., Choi, S., Ahn, J., Jin, H. K.,
plasma neprilysin concentration predict cardiac events in
Park, J.S., and Bae, J.S. (2013) Recombinant soluble
chronic kidney disease patients? Nephrol. Dial. Transplant.,
neprilysin reduces amyloid beta accumulation and
34, 100-108.
improves memory impairment in Alzheimer’s disease
110. Zhuravin, I.А., Nalivaeva, N.N., Kozlova, D.I.,
mice, Brain. Res., 1529, 113-124.
Kochkina, E.G., Fedorova, Y.B., and Gavrilova, S.I.
97. Vodovar, N., Paquet, C., Mebazaa, A., Launay, J.M.,
(2015) The activity of blood serum cholinesterases and
Hugon, J., and Cohen Solal, A. (2015) Neprilysin, cardio
neprilysin as potential biomarkers of mild cognitive
vascular, and Alzheimer’s diseases: the therapeutic split?
impairment and Alzheimer’s disease, Zh. Nevrol. Psikhiatr.
Eur. Heart J., 36, 902-905.
Im. S. S. Korsakova, 115, 110-117, doi: 10.17116/
98. Langenickel, T.H., Tsubouchi, C., Ayalasomayajula, S.,
jnevro2015115112110 117.
Pal, P., Valentin, M.A., Hinder, M., Jhee, S., Gevorkyan, H.,
111.
Medeiros, M.A., Franca, M.S., Boileau, G., Juliano, L.,
and Rajman, I.
(2016) The effect of LCZ696
and Carvalho, K.M. (1997) Specific fluorogenic substrates
(sacubitril/valsartan) on amyloid beta concentrations in
for neprilysin (neutral endopeptidase, EC 3.4.24.11) which
cerebrospinal fluid in healthy subjects, Br. J. Clin.
are highly resistant to serine and metalloproteases, Braz. J.
Pharmacol., 81, 878-890.
Med. Biol. Res., 30, 1157-1162.
99. Cannon, J.A., Shen, L., Jhund, P.S., Kristensen, S.L.,
112. Takahashi, G., Tabata, M., Taguchi, K., and Chikuma, T.
Kober, L., Chen, F., Gong, J., Lefkowitz, M.P., Rouleau, J.L.,
(2015) Fluorimetric assay for measuring neprilysin activity
Shi, V.C., Swedberg, K., Zile, M.R., Solomon, S.D.,
using HPLC, Chromatographia, 78, 593-597.
Packer, M., McMurray, J.J., PARADIGM HF
113. Feygina, E.E., Artemieva, M., Postnikov, A.B.,
Investigators, and Committees (2017) Dementia related
Tamm, N.N., Bloshchitsyna, M.N., Medvedeva, N.A.,
adverse events in PARADIGM HF and other trials in heart
Katrukha, A.G., and Semenov, A.G. (2019) Detection of
failure with reduced ejection fraction, Eur. J. Heart Fail.,
neprilysin derived BNP fragments in the circulation: pos
19, 129-137.
sible insights for targeted neprilysin inhibition therapy for
100. Karnik, A.A., Gopal, D.M., Ko, D., Benjamin, E.J., and
heart failure, Clin. Chem., doi: 10.1373/clinchem.2019.
Helm, R.H. (2019) Epidemiology of atrial fibrillation and
303438.
heart failure: a growing and important problem, Cardiol.
114. Burrell, M., Henderson, S.J., Ravnefjord, A., Schweikart, F.,
Clin., 37, 119-129.
Fowler, S.B., Witt, S., Hansson, K.M., and Webster, C.I.
101. Savarese, G., and Lund, L.H. (2017) Global public health
(2016) Neprilysin inhibits coagulation through proteolytic
burden of heart failure, Card. Fail. Rev., 3, 7-11.
inactivation of fibrinogen, PLoS One, 11, e0158114.
11 БИОХИМИЯ том 84 вып. 11 2019
1682
ФЕЙГИНА и др.
NEUTRAL ENDOPEPTIDASE (NEPRILYSIN)
IN THERAPY AND DIAGNOSTICS: “YIN AND YANG”
Review
E. E. Feygina1,2*,**, A. G. Katrukha1,3**, and A. G. Semenov1,2**
1 HyTest Ltd., Turku, Finland; E$mail: Evgeniya.Feygina@hytest.fi
2 Belozersky Institute of Physico$Chemical Biology, Lomonosov Moscow State University, 119991 Moscow, Russia
3 Lomonosov Moscow State University, Faculty of Biology, 119991 Moscow, Russia
Received June 7, 2019
Revised August 2, 2019
Accepted August 19, 2019
Neprilysin (NEP) is a zinc dependent membrane bound endopeptidase, which is present in an organism in trans
membrane and soluble forms. The enzyme has a wide range of substrates involved in the cardiovascular and nervous
systems regulation. In this review, we discuss some biochemical characteristics of NEP and its physiological function.
The main focus of this work is the use of NEP as a therapeutic target: the history and various physiological aspects of
NEP inhibitors implementation for heart failure treatment, attempts to increase NEP activity for treatment of
Alzheimer’s disease using gene and cell therapy approaches.
Another important issue considered in this review is the role of NEP as a potential marker for predicting the risk of
cardiovascular disease complications. The results of analysis of the diagnostic and prognostic performance of the NEP
soluble form in various types of heart failure are presented. Measurement of NEP activity for prognostic and diag
nostic use, methods and approaches that can be used for this purpose, as well as the possible new role of natriuretic
peptides - the substrates of NEP - in the field of cardiovascular diagnostics, are also discussed.
Keywords: neprilysin, natriuretic peptides, ARNi, heart failure, Alzheimer’s disease, biomarkers, immunoanalysis
БИОХИМИЯ том 84 вып. 11 2019