БИОХИМИЯ, 2019, том 84, вып. 11, с. 1683 - 1700
УДК 543.51
УБИКВИТИНОВЫЙ СУБПРОТЕОМ МИТОХОНДРИЙ МОЗГА
И ЕГО ИЗМЕНЕНИЯ ПРИ ЭКСПЕРИМЕНТАЛЬНОМ
ПАРКИНСОНИЗМЕ И ДЕЙСТВИИ НЕЙРОПРОТЕКТОРОВ*
Обзор
© 2019
О.А. Бунеева1**, М.В. Медведева2**,***, А.Т. Копылов1, А.Е. Медведев1
1 НИИ биомедицинской химии им. В.Н. Ореховича, 119121 Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова,
биологический факультет, 119991 Москва, Россия;
электронная почта: marmed64@yandex.ru
Поступила в редакцию 23.05.2019
После доработки 02.07.2019
Принята к публикации 11.07.2019
Обобщены собственные и литературные данные об убиквитинировании митохондриальных белков мозга и
его изменении при развитии экспериментального паркинсонизма и введении нейропротектора изатина
(индол 2,3 дион). Рассмотрены компоненты убиквитин конъюгирующей системы митохондрий мозга и
локализация убиквитинированных белков в этих органеллах. При инкубации митохондриальной фракции
мозга in vitro обнаружено включение биотинилированного убиквитина как в собственно митохондриальные
белки, так и в белки, ассоциированные с этими органеллами. По данным интерактомного анализа, иденти
фицированные неубиквитиновые белки способны образовывать прочные комплексы с убиквитинирован
ными белками или их партнерами и компонентами митохондриальных мембран. Исследования эндогенно
го убиквитинирования в мозге мышей C57Bl, выполненные в разных лабораториях, показали, что доля
убиквитинированных белков митохондрий составляет ~30%. Однако субпротеомы убиквитинированных
белков митохондрий существенно различались как по своему составу, так и по вовлеченности в биологичес
кие процессы, фигурирующие в базе данных Gene Ontology (GO). Развитие паркинсонизма у мышей C57Bl,
индуцированного введением однократной дозы нейротоксина 1 метил 4 фенил 1,2,3,6 тетрагидропириди
на (МФТП), приводило к снижению общего числа убиквитинированных белков в митохондриальной фрак
ции мозга и увеличению окисленных белков, содержащих убиквитиновую метку (K ε GG). Поскольку ни
один из этих белков не был идентифицирован среди белков, связывающихся с убиквитиновым рецептором
протеасом, субъединицей Rpn10, можно считать, что убиквитинирование митохондриальных белков мозга,
по видимому, прямо не связано с их деградацией в протеасомах. Среди белков мозга, связывающихся с ней
ропротектором изатином, идентифицированы белки, участвующие в работе убиквитин конъюгирующей
системы. Картирование изатин связывающих белков на известные метаболические пути предполагает их
участие в пути, связанном с E3 убиквитинпротеинлигазой паркином (parkin associated pathway;
CH000000947). В контексте взаимодействия убиквитинированных белков митохондрий мозга функцио
нальные связи были обнаружены только в группе животных с МФТП индуцированным паркинсонизмом.
Это позволяет предположить, что нейропротекторный эффект изатина может быть связан с нарушением
взаимодействия белков, подлежащих последующей деградации.
КЛЮЧЕВЫЕ СЛОВА: убиквитинирование белков, митохондрии мозга, экспериментальный паркинсо
низм, нейропротектор изатин, субпротеом, интерактом.
DOI: 10.1134/S0320972519110113
Убиквитин - небольшой «вездесущий» (бук
убиквитинирование (называемое также убикви
вально от латинского «ubique» - «везде»), состоя
тинилированием) [1-4].
щий из 76 а.о. белок, с молекулярной массой
Убиквитин ковалентно присоединяется к
~8,5 кДа, который осуществляет посттрансля
белку мишени посредством образования пеп
ционную модификацию различных белков, их
тидной связи между карбоксильной группой
Принятые сокращения: МФТП - нейротоксин 1 метил 4 фенил 1,2,3,6 тетрагидропиридин, МАО - моноаминок
сидаза, GO - база данных Gene Ontology, PPI - белок-белковое взаимодействие.
* Приложение к статье на английском языке опубликовано на сайте журнала «Biochemistry» (Moscow) и на сайте изда
** Автор является выпускником кафедры биохимии биологического факультета МГУ им. М.В. Ломоносова.
*** Адресат для корреспонденции.
1683
11*
1684
БУНЕЕВА и др.
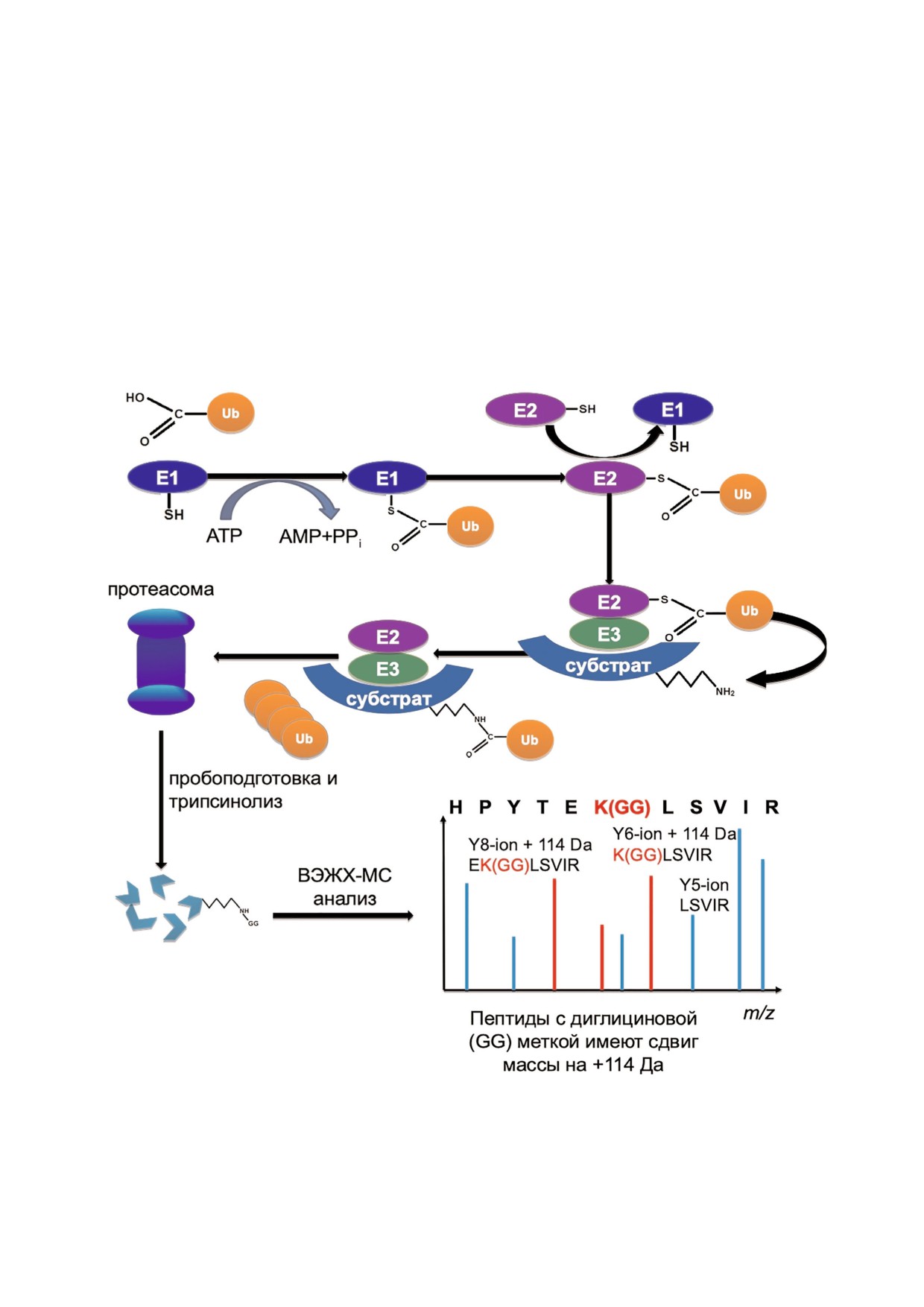
С концевого остатка убиквитина (Gly76) и ами
ние) или цепочка из нескольких (чаще всего че
ногруппой Lys боковой цепи модифицируемого
тырех) убиквитиновых остатков (полиубикви
белка. Этот процесс осуществляется в несколь
тинирование). Молекулы убиквитина в поли
ко стадий (рис. 1). Сначала убиквитин активи
убиквитиновой цепи могут быть соединены
рующий фермент (Е1) гидролизует АТР и обра
посредством одного из семи остатков лизина
зует тиоэфирную связь с убиквитином. Затем
(Lys6, Lys11, Lys27, Lys29, Lys33, Lys48, Lys63)
активированный убиквитин переносится на
или через N концевой остаток метионина
убиквитин конъюгирующий фермент (Е2), ко
(Met1) [4, 5].
торый, в свою очередь, переносит его на моле
Чаще всего молекулы убиквитина, присое
кулу субстрата, специфически узнаваемого од
диняющиеся к белку мишени в виде полиубик
ной из убиквитинлигаз (Е3) (рис. 1). При этом к
витиновой цепи, служат сигналом для протео
белковому субстрату может присоединяться од
литической деградации в протеасомах [1-4].
на молекула убиквитина (моноубиквитинирова
Однако помимо элиминации «ненужных» бел
Рис. 1. Схема, иллюстрирующая процесс убиквитинирования белков и образования убиквитиновой сигнатуры в ходе их
триптического расщепления для масс спектрометрического анализа.
biokhsm/
БИОХИМИЯ том 84 вып. 11 2019
УБИКВИТИНОВЫЙ СУБПРОТЕОМ МИТОХОНДРИЙ МОЗГА
1685
ков с участием протеасомы, модификация убик
рассматривать МАО митохондрий мозга в каче
витином различных белков мишеней играет
стве предполагаемой мишени для убиквитин
важную роль во многих других внутриклеточных
зависимой деградации.
процессах: в регуляции экспрессии генов, кле
Действительно, включение экзогенного
точного цикла и деления, в ответе на стресс, ре
убиквитина в митохондрии мозга in vitro, зави
парации ДНК, импорте белков в митохондрии,
севшее от присутствия в среде инкубации АТР и
сборке рибосом, апоптозе, эндоцитозе, борьбе с
АТР регенерирующей системы (креатинфос
вирусной инфекцией и др. [2, 4, 5].
фат креатинфосфокиназа), сопровождалось по
В контексте роли убиквитина в обмене мито
вышением чувствительности МАО к протеоли
хондриальных белков результаты первых иссле
тической инактивации [14, 15]. При этом проис
дований, посвященных этой проблеме, появи
ходило повышение чувствительности и МАО А,
лись примерно через 10 лет после первых работ
и МАО Б к специфическому механизм активи
по убиквитинированию белков цитозоля и кле
рованному ингибитору паргилину и увеличение
точных органелл [6, 7]. Одними из первых работ
включения [3H] паргилина в митохондрии, ко
в этом направлении были работы группы
торое было особенно заметно во фракции, полу
McCauley по встраиванию новосинтезирован
ченной в результате иммунопреципитации ми
ных молекул моноаминоксидаз (МАО) А и Б во
тохондриальных белков антисывороткой к
внешнюю мембрану митохондрий [8, 9].
убиквитину и протеин А сефарозой [16]. Одна
Используя лизат ретикулоцитов и РНК пече
ко включение убиквитина в митохондрии не вы
ни быка в качестве системы биосинтеза, авторы
зывало увеличения молекулярных масс мечен
обнаружили, что синтезированные молекулы
ных [3H] паргилином белков. Это свидетель
МАО встраиваются в добавленные в эту систему
ствовало об опосредованном влиянии убикви
очищенные внешние мембраны митохондрий
тина на чувствительность МАО А и МАО Б ми
[8, 9]. При этом процесс встраивания новосин
тохондрий мозга крыс к протеолизу и специфи
тезированных молекул МАО зависел от присут
ческому ингибированию и о вовлечении других
ствия эндогенного убиквитина [9]. Его истоще
белков в процесс убиквитинирования в мито
ние при помощи очищенных анти убиквитино
хондриях.
вых антител или реконструкция системы с ис
пользованием мутантного убиквитина, не спо
собного образовывать конъюгаты с белками, на
ИССЛЕДОВАНИЯ
рушали процесс встраивания МАО [8]. Еще од
УБИКВИТИНИРОВАНИЯ
ним фактором, нарушающим встраивание МАО
МИТОХОНДРИАЛЬНЫХ БЕЛКОВ
во внешнюю мембрану митохондрий, был дефи
цит АТР [8, 9]. Хотя используемая система со
Идентификация компонентов Е1-Е3 убикви;
держала много компонентов (включая матрицу
тин;конъюгирующей системы и конкретных уби;
для синтеза не только МАО, но и многих других
квитинированных белков. Пионерские исследова
белков), совокупность данных вполне уклады
ния процесса убиквитинирования в митохонд
валась в схему прямого убиквитинирования
риях мозга кроликов с использованием [125I]
МАО.
убиквитина [11] свидетельствовали в пользу ас
Поскольку МАО принадлежит ключевая
социации всех трех ферментов (рис. 1), необхо
роль в катаболизме важнейших медиаторных
димых для образования конъюгатов убикви
моноаминов центральной нервной системы, на
тин-белок, с митохондриями. Эксперименты по
рушения обмена которых обнаружены при мно
фракционированию митохондрий мозга с диги
гих нейродегенеративных заболеваниях, мы по
тонином выявили, что высвобождение [125I]
пытались оценить возможную роль убиквитина
убиквитин конъюгирующей активности проис
в адресной деградации МАО митохондрий мозга
ходило параллельно с высвобождением с NADH
крыс. К тому времени уже было известно, что:
цитохром с редуктазой - маркером внешней
(i) меченый убиквитин ([125I] убиквитин) обра
мембраны митохондрий [11]. По данным Вес
зует конъюгаты с белками не только пермеаби
терн блоттинга с использованием антител к ко
лизованных клеток гепатомы [10], но и мито
нъюгатам убиквитина и авторадиографии, моле
хондрий кролика [11]; (ii) патологические со
кулярные массы убиквитинированных белков
стояния, приводящие к активации окислитель
варьировали в широком диапазоне, однако сами
ных процессов и увеличению образования уби
белки идентифицированы не были. Позднее на
квитиновых конъюгатов в митохондриях [12],
личие убиквитин активирующего фермента Е1 в
вызывают окислительную модификацию МАО,
митохондриях было подтверждено в ходе элект
сопровождающуюся увеличением чувствитель
ронно микроскопического исследования клеток
ности к трипсинолизу [13]. Все это позволяло
HepG2 c использованием моноклональных ан
БИОХИМИЯ том 84 вып. 11 2019
1686
БУНЕЕВА и др.
тител к Е1 [17]. На долю митохондрий этих кле
о пуле убиквитинированных митохондриальных
ток приходилось 7% всего пула Е1 [17].
белков в конкретный момент времени не только
У человека обнаружено ~40 убиквитин ак
на уровне клеточных культур, но и в отдельных
тивирующих ферментов Е2 [4, 5, 18] и >700
органах животных.
убиквитин протеинлигаз Е3 [5]. Исследования,
В экспериментах на очищенных митохон
выполненные на различных типах клеток, пока
дриях дрожжей, подвергнутых лизису, трипси
зали существенную роль нескольких Е2 и Е3 в
нолизу и аффинному обогащению при помощи
убиквитинировании митохондриальных белков
иммобилизованных антител к убиквитиновой
(и белков, ассоциированных с этими органелла
сигнатуре (anti K ε GG) с последующим масс
ми). При помощи siRNA опосредованного нок
спектрометрическим анализом, было иденти
дауна было показано, что ферменты UBE2N,
фицировано 36 убиквитинированных белков
UBE2L3 и UBE2D2/3 играют важную роль в т.н.
(таблица) [21, 22]. Важно отметить, что убикви
паркин зависимой митофагии (селективной
тинирование ряда белков, характеризующихся
деградации митохондрий путем аутофагии).
исключительно митохондриальной локализаци
Совместное выключение UBE2N, UBE2L3 и
ей, было подтверждено несколькими методами.
UBE2D2/3 в клетках HeLa приводило к сниже
При этом в очищенных митохондриях Lehmann
нию убиквитинирования ряда белков, которое
et al. [21] обнаружили дрожжевую убиквитин
оценивали при помощи антител к полиубикви
протеинлигазу Dma1p (гомолог убиквитинпро
тину и антител к конкретным исследуемым бел
теинлигазы человека RNF8).
кам: митофузинам, субъединицам TOM20 и
Для оценки убиквитинирования белков
TOM70 транслоказного комплекса наружной
сердца Jeon et al. создали линию трансгенных
мембраны митохондрий (ТОМ), белку 1 потен
мышей, которые экспрессировали убиквитин,
циал зависимого анионного канала [19]. При
содержащий октагистидиновую метку (octahisti
этом локализация Е2 ферментов, выключенных
dine/Flag tagged ubiquitin; HisF Ub) [22]. Это
при помощи siRNA, специально не исследова
позволило выделить пул убиквитинированных
лась. В контексте убиквитинирования именно
белков сердца для масс спектрометрической
митохондриальных белков клеток мозга недав
идентификации. Из 121 го идентифицирован
но описана новая форма митохондриального
ного белка, несущего убиквитиновую сигнатуру
убиквитин конъюгирующего фермента Е2 -
(K ε GG), на долю убиквитинированных бел
E2I в клетках зрелого пигментного эпителия
ков митохондрий приходилось ~38%. По субми
сетчатки крыс [20]. Эксперименты по субкле
тохондриальной локализации идентифициро
точному фракционированию, ко иммунолока
ванные белки были локализованы как во внеш
лизации и иммуноаффинной очистке свиде
ней, так и во внутренней мембранах митохон
тельствуют в пользу специфической локализа
дрий и в матриксе (таблица). Интересно, что в
ции новой изоформы именно в митохондриаль
отличие от исследований, выполненных на
ном компартменте [20].
культурах клеток [19], среди идентифицирован
Использование аналогичного инструмента
ных белков был выявлен всего один белок
рия (адресного выключения определенных ге
(Mitochondrial fission 1 protein, таблица), имею
нов и использования различных антител) позво
щий отношение к процессам деления митохон
лило охарактеризовать роль нескольких убикви
дрий.
тин протеинлигаз Е3 в убиквитинировании ми
Сопоставление убиквитинированных белков
тохондриальных белков преимущественно в
матрикса митохондрий дрожжей и сердца мы
культурах клеток и роли конкретных ферментов
шей не выявило ни одного общего белка. В кон
(преимущественно Е2-Е3) в контексте митофа
тексте убиквитинирования именно митохон
гии, слиянии и делении митохондрий и др.
дриальных белков мозга все это, очевидно, сви
Хотя использование специфических антител
детельствует о том, что к экстраполяции дан
позволяет выяснить возможную роль опреде
ных, полученных на других объектах (например,
ленных белков в том или ином процессе, «за
на клеточных культурах, а также других биоло
бортом» таких исследований зачастую остаются
гических видах и органах), следует подходить с
другие (в контексте данного обзора убиквити
очень большой осторожностью. Это можно про
нированные) белки. В связи с этим особого вни
иллюстрировать результатами исследований,
мания заслуживают работы по профилирова
выполненных на клетках HeLa [23]. Обработка
нию определенных групп белков (субпротео
этих клеток ингибитором протеасом MG132
мов) как целой клетки (ткани), так и ее отдель
приводила к накоплению полиубиквитиниро
ных компартментов.
ванных белков во фракции митохондрий. Масс
Использование протеомных подходов поз
спектрометрический анализ цельного экстракта
волило существенно расширить представления
клеток позволил авторам идентифицировать 203
БИОХИМИЯ том 84 вып. 11 2019
УБИКВИТИНОВЫЙ СУБПРОТЕОМ МИТОХОНДРИЙ МОЗГА
1687
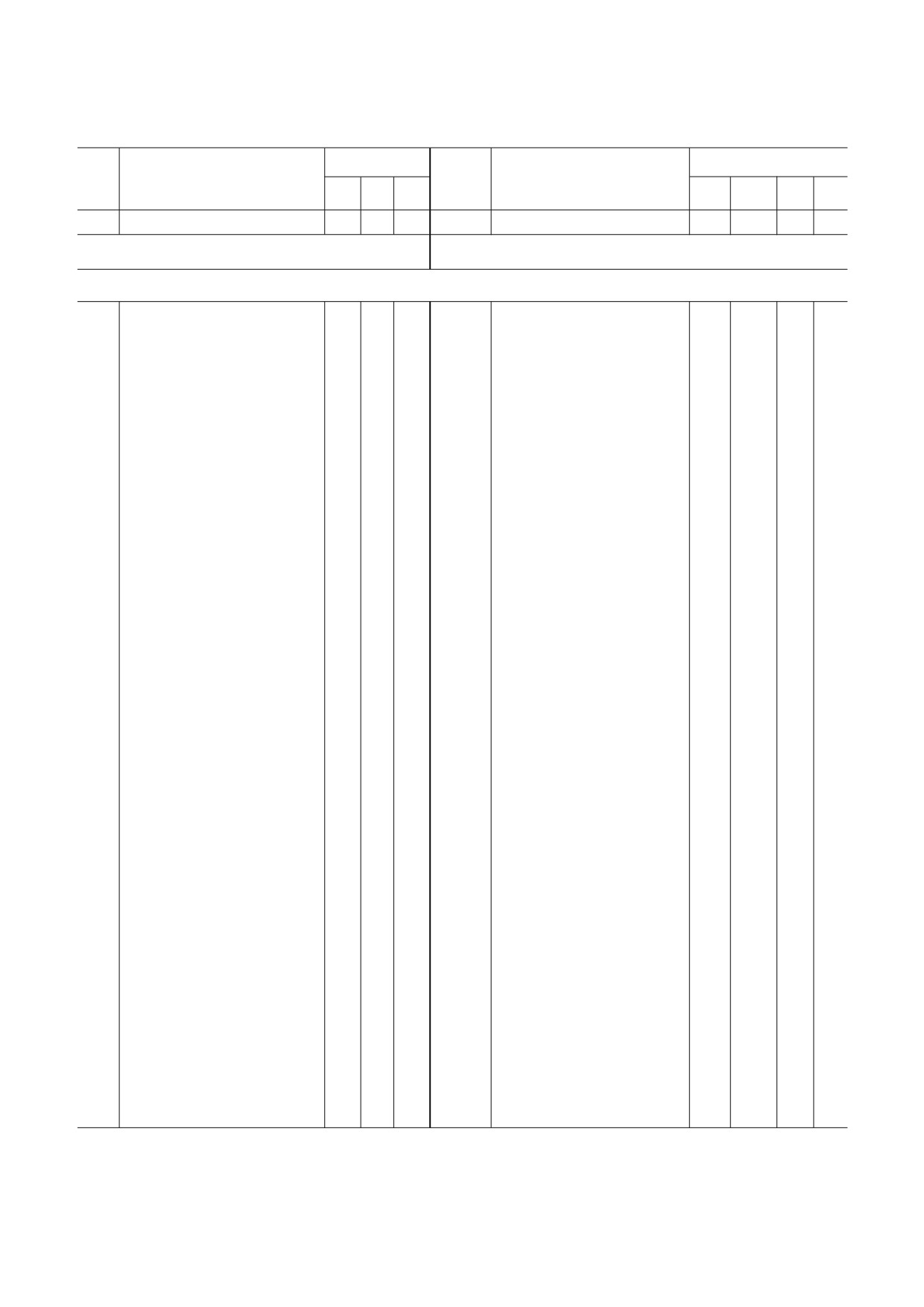
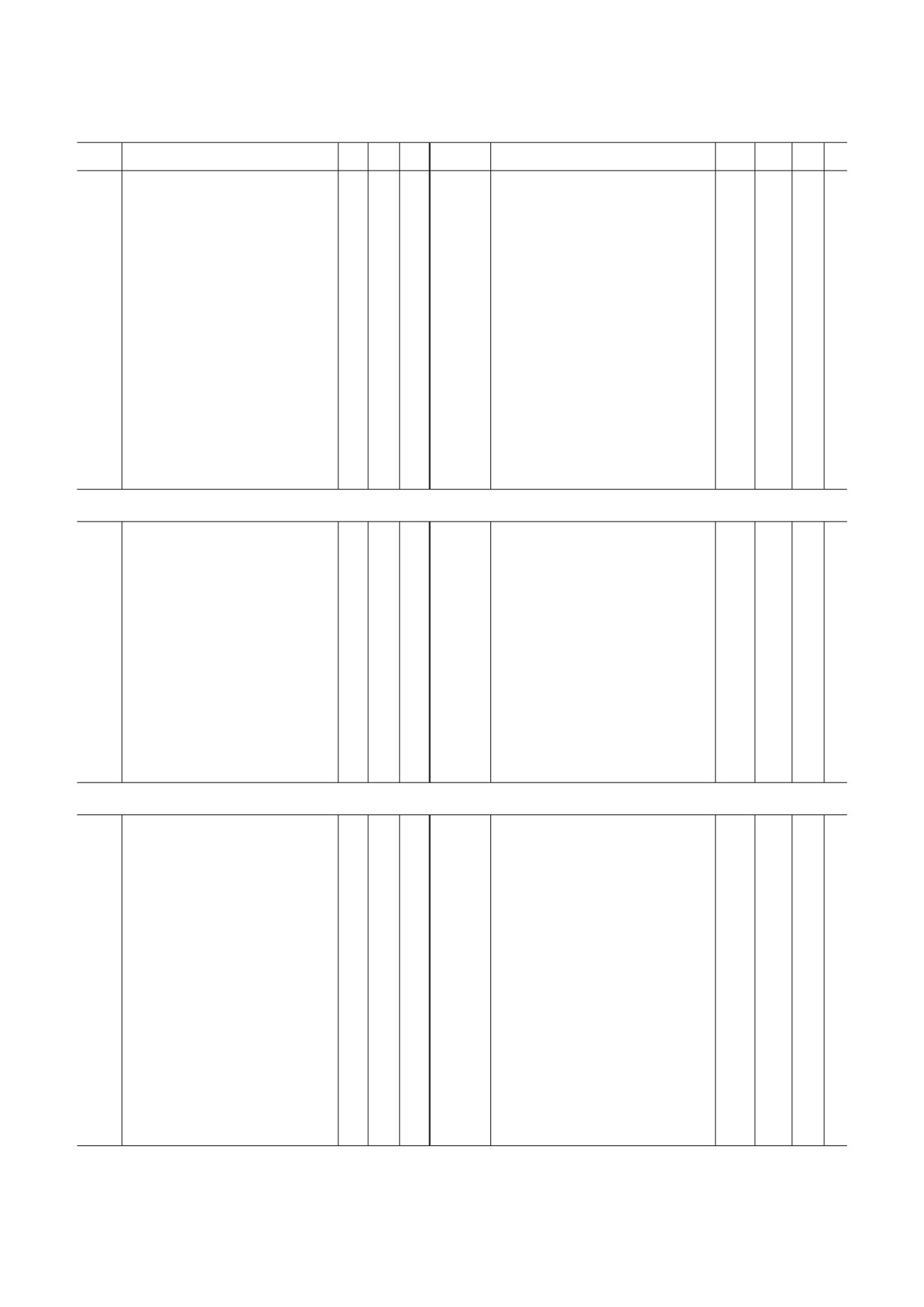
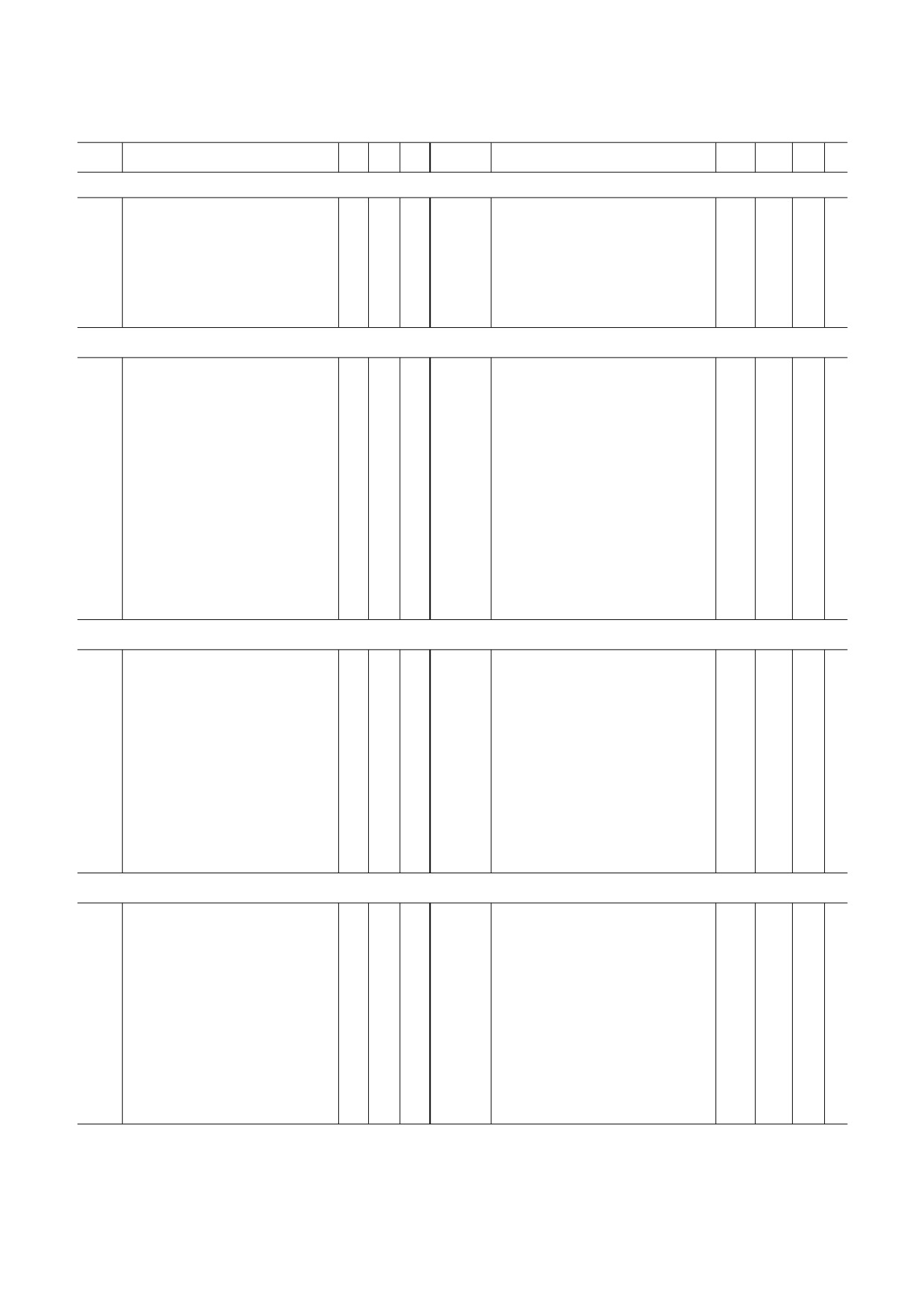
Убиквитинированные белки митохондрий дрожжей Saccharomyces cerevisiae и сердца мышей Mus musculus
Локализация*
Локализация*
Ген
Название белка
Ген
Название белка
MIS
MN
MM
MIM
MOM
MN
MM
1
2
3
4
5
6
7
8
9
10
11
Дрожжи (Saccharomyces cerevisiae)
Мышь (Mus musculus)
1 − генерация энергии и углеводный обмен
Lpd1
Dihydrolipoyl dehydrogenase,
•
•
Ndufc2
NADH dehydrogenase
•
mitochondrial
[ubiquinone] 1 subunit C2
Adh3
Alcohol dehydrogenase 3, mito
•
Atp5f1b
ATP synthase subunit beta,
•
chondrial
mitochondrial
Ald4
Potassium activated aldehyde
•
•
Atp5f1a
ATP synthase subunit alpha,
•
dehydrogenase, mitochondrial
mitochondrial
Mdh1
Malate dehydrogenase, mito
•
Atp5f1c
ATP synthase subunit gamma,
•
chondrial
mitochondrial
Cit1
Citrate synthase, mitochondrial
•
•
Atp5pb
ATP synthase F(0) complex
•
subunit B1, mitochondrial
Dld2
D 2 hydroxyglutarate pyruvate
•
transhydrogenase DLD2
Atp5f1d
ATP synthase subunit delta,
•
mitochondrial
Fum1
Fumarate hydratase, mitochon
•
drial
mt+Co3
cytochrome c oxidase subunit 3
•
Pda1
Pyruvate dehydrogenase E1
•
•
Cox6a2
cytochrome c oxidase subunit
•
component subunit alpha, mito
6A2, mitochondrial
chondrial
Ckmt2
creatine kinase S type, mito
•
Pdb1
Pyruvate dehydrogenase E1
•
•
chondrial
component subunit beta, mito
chondrial
Etfdh
electron transfer flavoprotein
•
ubiquinone oxidoreductase,
Idh1
Isocitrate dehydrogenase [NAD],
•
•
•
mitochondrial
subunit 1, mitochondrial
Etfa
electron transfer flavoprotein
•
Idh2
Isocitrate dehydrogenase [NAD],
•
subunit alpha, mitochondrial
subunit 2, mitochondriala
b
Idh2
isocitrate dehydrogenase
•
Kgd2
Dihydrolipoyllysine residue
•
•
[NADP] mitochondrial
succinyltransferase component
of 2 oxoglutarate dehydrogenase
Mdh2
malate dehydrogenase, mito
•
complex, mitochondrial
chondrial
Lat1
Dihydrolipoyllysine residue
•
Ndufa10
NADH dehydrogenase
•
acetyltransferase component
[ubiquinone] 1 alpha subcom
of pyruvate dehydrogenase
plex subunit 10, mitochondrial
complex, mitochondrial
Ndufa11
NADH dehydrogenase
•
[ubiquinone] 1 alpha subcom
plex subunit 11
Ndufa9
NADH dehydrogenase
•
•
[ubiquinone] 1 alpha subcom
plex subunit 9, mitochondrial
Ndufs3
NADH dehydrogenase
•
[ubiquinone] iron sulfur
protein 3, mitochondrial
БИОХИМИЯ том 84 вып. 11 2019
1688
БУНЕЕВА и др.
Продолжение таблицы
1
2
3
4
5
6
7
8
9
10
11
Sdha
succinate dehydrogenase
•
[ubiquinone] flavoprotein
subunit, mitochondrial
Suclg1
succinate CoA ligase [ADP/GDP
•
forming] subunit alpha, mitochon
drial
Uqcr10
cytochrome b+c1 complex subunit 9
•
Uqcrc2
cytochrome b+c1 complex subunit 2,
•
•
mitochondrial
Uqcrc1
cytochrome b+c1 complex subunit 1,
•
mitochondrial
Uqcrfs1
cytochrome b+c1 complex subunit
•
Rieske, mitochondrial
Uqcrq
cytochrome b+c1 complex subunit 8
•
2 − формирование цитоскелета и экзоцитоз/транспорт
Slc25a12
calcium binding mitochondrial
•
carrier protein Aralar1
Slc25a13
calcium binding mitochondrial car
•
rier protein Aralar2
Slc25a11
mitochondrial 2
•
oxoglutarate/malate carrier protein
Immt
MICOS complex subunit Mic60
•
Slc25a3
phosphate carrier protein, mito
•
chondrial
Vdac2
voltage dependent anion selective
•
•
•
channel protein 2
3 − регуляция экспрессии генов, клеточного деления и дифференцировки
Mrpl9
54S ribosomal protein L9, mito
•
Mrps2
28S ribosomal protein S2, mito
chondrial
chondrial
Mss116
ATP dependent RNA helicase
•
MSS116, mitochondrial
#Pfb1
Plasmid replication initiation protein
Rim1
Single stranded DNA binding
•
•
protein RIM1, mitochondrial
Rsm18
37S ribosomal protein RSM18,
•
mitochondrial
Rsm7
37S ribosomal protein S7, mito
•
chondrial
Img1
54S ribosomal protein IMG1,
•
mitochondrial
#Tuf1
Elongation factor Tu, mitochondria
БИОХИМИЯ том 84 вып. 11 2019
УБИКВИТИНОВЫЙ СУБПРОТЕОМ МИТОХОНДРИЙ МОЗГА
1689
Продолжение таблицы
1
2
3
4
5
6
7
8
9
10
11
4 − передача сигнала и регуляция активности ферментов
Slc25a4
ADP/ATP translocase 1
•
Fis1
mitochondrial fission 1 protein
•
Phb2
prohibitin 2
•
Rab11fip5
Rab11 family interacting protein 5
•
5 − антиоксидантные и протекторные свойства
Mcx1
ATP dependent clpX like chaper
•
Hsp90ab1
heat shock protein HSP 90 beta
•
one, mitochondrial
Sod1
superoxide dismutase [Cu Zn]
•
Mdj1
DnaJ homolog 1, mitochondrial
•
Sod2
superoxide dismutase [Mn], mito
•
•
Hsp10
10 kDa heat shock protein, mito
•
chondrial
chondrial
Hsp60
Heat shock protein 60, mitochondrial
•
•
•
Hsp78
Heat shock protein 78, mitochondrial
•
Ssc1
Heat shock protein SSC1, mito
•
•
chondrial
Yhb1
Frataxin homolog, mitochondrial
•
•
6 − метаболизм аминокислот и других азотистых соединений
Mae1
NAD dependent malic enzyme,
•
#Gatd3a
glutamine amidotransferase like
mitochondrial
class 1 domain containing protein
3A, mitochondrial
Alt1
Probable alanine aminotransferase,
•
mitochondrial
Bat1
Branched chain amino acid
•
aminotransferase, mitochondrial
Mmf1
Protein MMF1, mitochondrial
•
Ilv5
Ketol acid reductoisomerase,
•
•
mitochondrial
7 − метаболизм липидов
Etr1
Enoyl [acyl carrier protein]
•
Acadvl
very long chain specific acyl CoA
•
•
reductase, mitochondrial
dehydrogenase, mitochondrial
Cpt1b
carnitine O palmitoyltransferase 1,
•
muscle isoform
Acsl1
long chain fatty acid CoA ligase 1
•
Hadhb
trifunctional enzyme subunit beta,
•
•
•
mitochondrial
Hadha
Trifunctional enzyme subunit alpha,
•
•
mitochondrial
БИОХИМИЯ том 84 вып. 11 2019
1690
БУНЕЕВА и др.
Окончание таблицы
1
2
3
4
5
6
7
8
9
10
11
Смешанные группы: 1, 2, 3, 4, 5, 6
Aco1
Aconitate hydratase, mitochondrial
•
•
•
Aco2
aconitate hydratase, mitochondrial
•
(1,2,3)
(1,6)
Pim1
Lon protease homolog, mitochon
•
drial (4,5)
Примечание. *Локализация убиквитинированных белков митохондрий приведена в соответствии с терминологией Gene
Ontology: MM - матрикс митохондрий; MN - митохондриальный нуклеоид; MIS - межмембранное пространство;
MOM - внешняя мембрана митохондрий; MIM - внутренняя мембрана митохондрий. # Точная субмитохондриальная
локализация неизвестна. a У дрожжей ген Idh2 кодирует субъединицу 2 митохондриальной NAD зависимой изоцитратде
гидрогеназы (КФ 1.1.1.41). b У мыши ген Idh2 кодирует митохондриальную NADP зависимую изоцитратдегидрогеназу
(КФ 1.1.1.42). Анализ выполнен на основании данных, представленных в статьях Lehmann et al. [21] и Jeon et al. [22].
белка, содержащих убиквитиновую сигнатуру и
убиквитин конъюгирующей системой, включа
имеющих отношение к митохондриям. При пос
ющей компоненты Е1-Е3. Увеличение убикви
ледующем фракционировании митохондрий
тинирования белков митохондрий в ответ на
убиквитиновые конъюгаты белков были обнару
воздействие ингибиторов протеасом является
жены во внешней и внутренней мембранах ми
важным аргументом в пользу того, что эти бел
тохондрий, но не в матриксе. К сожалению, от
ки, очевидно, предназначены для протеасомной
сутствие полного списка идентифицированных
деградации.
белков не позволяет сопоставить эти данные с
Убиквитинирование белков митохондрий мозга
результатами других исследований, что особен
in vitro и in vivo. Используя систему инкубации
но важно в связи с сообщением авторов об отсут
митохондриальной фракции мозга крыс, в кото
ствии убиквитинированных белков в матриксе.
рой было обнаружено убиквитин зависимое
Тем не менее рассмотренные в данном разде
увеличение чувствительности МАО к протеоли
ле результаты исследований свидетельствуют о
тической инактивации [14-16], мы попытались
том, что митохондрии обладают собственной
выявить убиквитинирование белков митохон
а
б
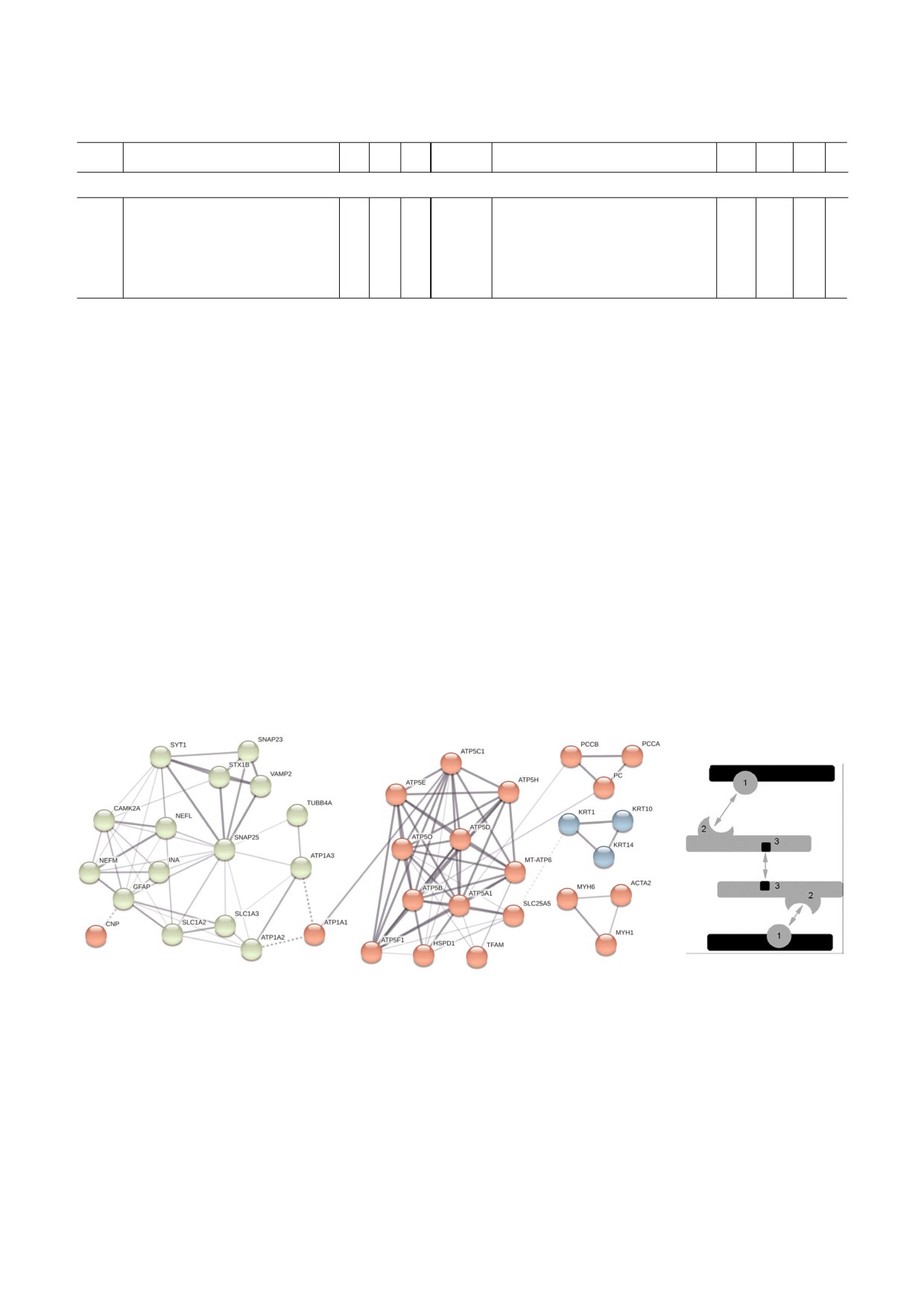
Рис. 2. Интерактом белков митохондриальной фракции мозга крыс, содержащих убиквитиновые сигнатуры (а) и возмож
ный механизм формирования убиквитинового интерактома (б). а - Жирными линиями обозначены прямые взаимодей
ствия между идентифицированными белками, аннотированные в String (версия 11.0 от 19 января 2019 года). Жирные
пунктирные линии показывают доказанные взаимодействия между внутримитохондриальными белками и кластером
внемитохондриальных белков, вовлеченных в формирование цитоскелета, углеводный обмен и др. Названия белков, фи
гурирующие в этом и др. рисунках, приведены в Приложении. Внутримитохондриальные белки показаны в виде красных
кружков. Внемитохондриальные белки, опосредованно взаимодействующие с компонентами митохондрий (при помощи
нескольких белков линкеров), представлены в виде несвязанных кружков. б - 1) Убиквитин, 2) убиквитин связывающий
домен, 3) домены олигомеризации (по данным, представленным в статье Бунеевой и соавт. [25]).
biokhsm/
БИОХИМИЯ том 84 вып. 11 2019
УБИКВИТИНОВЫЙ СУБПРОТЕОМ МИТОХОНДРИЙ МОЗГА
1691
дрий мозга in vitro. Для идентификации белков,
подвергающихся убиквитинированию в мито
хондриях мозга в этих условиях, был использо
ван биотинилированный убиквитин [24]. Инку
бация митохондриальной фракции мозга in vitro
с биотинилированным убиквитином и последу
ющие хроматография лизата митохондрий на
авидин агарозе и масс спектрометрический
анализ связавшихся с аффинным сорбентом
белков привели к идентификации не менее 50
белков локализующихся как в митохондриях,
так и вне этих органелл. При этом только у 20%
белков, связавшихся с авидин агарозой, была
обнаружена так называемая убиквитиновая сиг
натура K ε GG, свидетельствующая о прямом
убиквитинировании белка.
По данным интерактомного анализа [24],
идентифицированные неубиквитинированные
белки способны образовывать прочные комп
лексы с убиквитинированными белками или их
партнерами и компонентами митохондриаль
ных мембран, в которых, по видимому, важную
роль играют взаимодействия убиквитиновых
цепей с убиквитин связывающими доменами
белков [25] (рис. 2).
При исследовании эндогенного убиквити
нирования во фракции неочищенных митохон
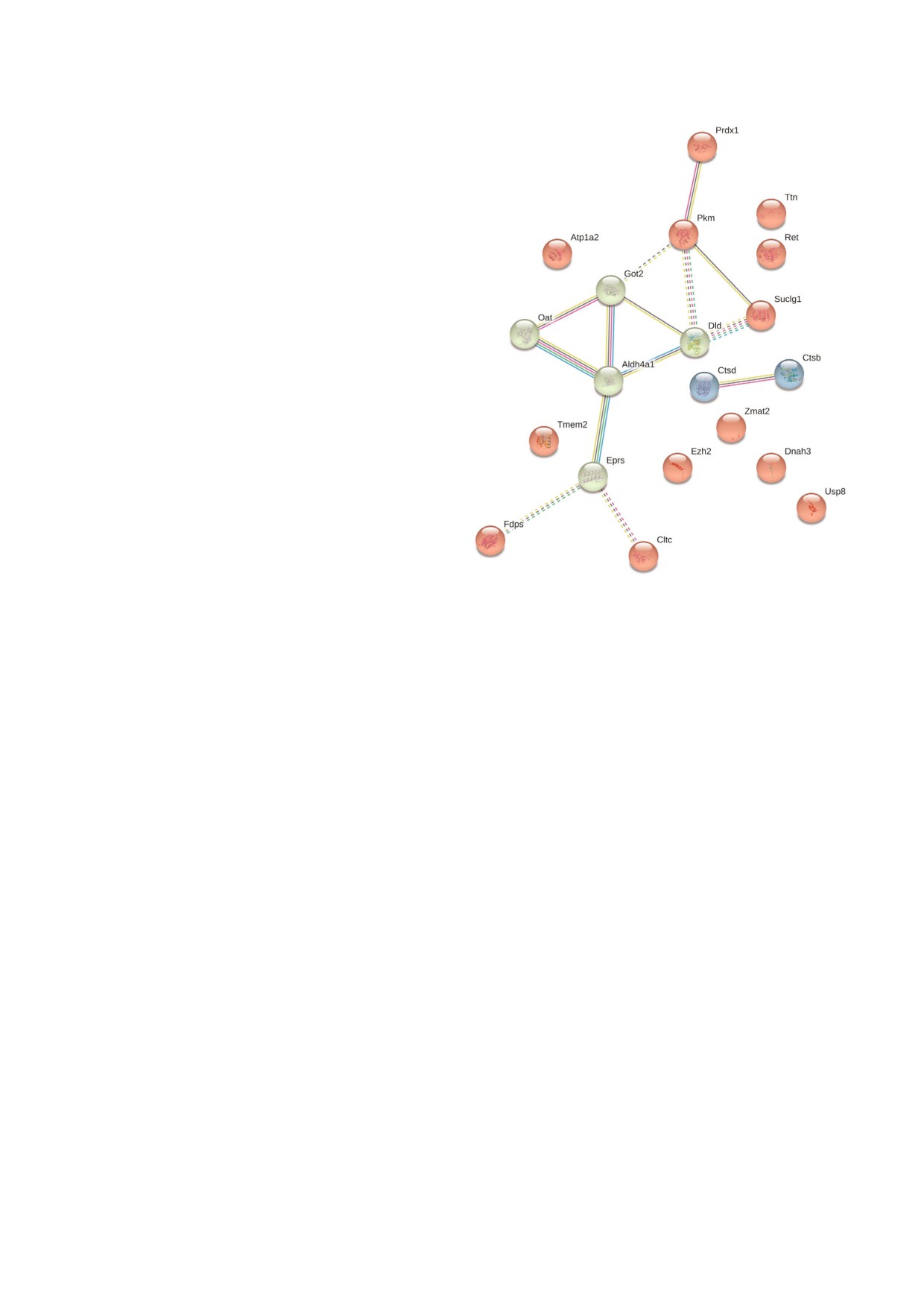
Рис. 3. Функциональные связи между убиквитинирован
дрий мозга мышей C57Bl было обнаружено не
ными белками митохондрий мозга мышей (созданы по
данным, представленным в статье Buneeva et al. [26]).
менее 75 ти индивидуальных белков, содержа
С цветным вариантом рис. 3 можно ознакомиться в элект
щих убиквитиновую сигнатуру K ε GG [26]
(формирование этой сигнатуры в ходе трипси
journal/biokhsm/
нолиза перед масс спектрометрическим анали
зом рассмотрено на рис. 1). Всего в этом иссле
довании было идентифицировано 565 белков, из
GO:0009064) и пролина (p
=
4,61e 05,
которых 301 относился в базе данных Gene
GO:0006560). Анализ межмолекулярных взаи
Ontology (GO) к группе митохондриальных бел
модействий показывает, что 10 белков из 22
ков. В соответствии с анализом внутриклеточ
формируют единую сеть белок-белковых взаи
ной локализации PANTHER (protein annotation
модействий (PPI, p = 0,000765), образованную
through evolutionary relationship) ~315 белков,
несколькими кластерами взаимодействий с об
выделенных из митохондрий клеток мозга мы
щими белками (рис. 3). Среди таких кластеров
шей, также были классифицированы как мито
наиболее представленными являются метабо
хондриальные. Из них 171 белок относится к так
лизм глиоксилата и деградация глицина
называемой митохондриальной оболочке (mito
(FDR = 0,00037; Got2, Aldh4a1, Dld), мета
chondrial envelope; в соответствии с определени
болизм аминокислот и их производных
ем GO - это двойной билипидный слой, охва
(FDR = 0,0035, Got2, Aldh4a1, Dld, Oat) и био
тывающий и отделяющий митохондрию от ци
синтез аминокислот (FDR = 0,0013, Pkm, Dld).
топлазмы клетки; этот отдел включает в себя
С учетом аннотированной специализации
также и межмембранное пространство).
этих белков в биологических процессах направ
Среди белков, относящихся к митохондри
ленное убиквитинирование может иметь отно
альной оболочке, убиквитиновая сигнатура бы
шение к функционированию ацетилхолинерги
ла идентифицирована у 22 белков. Распределе
ческой, ГАМК и глутаматергической систем,
ние этих белков по биологическим процессам
нарушение которых имеет важное значение в
показывает, что подавляющее большинство их
контексте развития и прогрессирования нейро
вовлечено в катаболизм глутамина (p = 1,84e 06,
дегенеративных заболеваний. Например, учас
GO:0009065), обмен глутаминовой кислоты (p =
тие таких белков, как Atp1a2, Ctsb и Ctsd и нару
= 3,17e 06, GO:0006536), а также метаболизм про
шение их молекулярных функций, обусловлен
изводных глутаминовой кислоты (p = 2,50e 05,
ное убиквитин опосредованной деградацией,
БИОХИМИЯ том 84 вып. 11 2019
1692
БУНЕЕВА и др.
было описано в работе на модельных мышах с
(ii) анализ убиквитинирования белков ткани
болезнью Альцгеймера [27].
мозга мышей без выделения фракции митохон
Один из наиболее интересных и многофунк
дрий в исследовании Wagner et al. [30] и выделе
циональных белков, идентифицированных при
ние суммарной фракции митохондрий мозга в
изучении субпротеома митохондрий мозга мы
наших исследованиях; (iii) различия в возрасте
шей C57Bl, оказался Aldh4a1 - фермент семей
экспериментальных животных и, очевидно,
ства альдегиддегидрогеназ. Данный фермент
условиях их содержания.
локализован в митохондриальном матриксе
Среди 56 убиквитинированных белков 17
[28]. Он является основным участником метабо
имеют митохондриальную локализацию. Хотя
лизма пролина и превращения пирролин 5 кар
количественно они сопоставимы с размером
боксилата в глутамат.
выборки митохондриальных убиквитинирован
Дефицит это фермента, который отмечен
ных белков, обнаруженных в нашей работе [26],
при гиперпролинемии 2 го типа, приводит к на
они существенно отличаются по вовлеченности
рушению целостности митохондрий [28]. Инте
в биологические процессы, фигурирующие в ба
ресно, что прямое убиквитинирование по а.о.
зе данных GO. Основная часть убиквитиниро
Lys495 было показано в другом широкомасш
ванных белков участвует в процессах элимина
табном протеомном исследовании, выполнен
ции и нейтрализации супероксидного радикала
ном на клетках HEK293 с использованием аф
(GO:0019430, p = 9,69e 03), ответной реакции на
финного обогащения перед масс спектрометри
токсины и токсические стимулы (GO:0097237 и
ческой детекцией убиквитиновой сигнатуры
GO:0051716, p = 1,20e 03, p = 3,58e 02 соответ
[29].
ственно), метаболизма активных форм кислоро
В контексте (немногочисленных) исследова
да (GO:0072593, p = 8,54e 04), ответной реакции
ний субпротеома убиквитинированных белков
на стресс (GO:0006950, p = 1,00e 03), а также в
митохондрий именно здорового мозга следует
процессах негативной регуляции клеточной
подробнее остановиться на работе, посвящен
смерти, индуцированной окислительным стрес
ной анализу сайтов убиквитинирования в мозге
сом (GO:1903202, p = 2,97e 03). Кроме того,
и периферических тканях мышей C57Bl [30].
идентифицированные убиквитинированные
Используя аффинное обогащение при помощи
белки участвуют в процессах трансмембранного
антител к убиквитиновой сигнатуре, Wagner et
переноса ионов, белкового и пептидного транс
al. охарактеризовали сайты убиквитинирования
порта.
белков в цельных препаратах мозга, печени, по
Сетевой анализ убиквитинированных бел
чек, сердца и мышц мышей C57Bl.
ков митохондрий показывает формирование
Проведенный нами анализ данных, доступ
единой сети из всех без исключения белков (PPI,
ных в «Дополнительных материалах» к этой
p = 1,17e 13) (рис. 4). Объяснение наблюдаемо
статье [30], показывает, что согласно информа
му феномену может заключаться в том, что не
ции, приведенной в базе данных GO, идентифи
которым из белков свойственны множествен
цированные белки митохондрий являются не
ные молекулярные функции, благодаря кото
посредственными участниками 61 го типа био
рым эти белки являются ключевыми переклю
логических процессов. Всего для этого пула бел
чателями (хабами) между различными биологи
ков было охарактеризовано 244 биологических
ческими процессами. Из данных, приведенных
процесса с величиной p < 0,05. При этом всего 4
на рис. 4, видно, что сетевое взаимодействие
процесса полностью совпадают с теми, что были
убиквитинированных белков формируется тре
охарактеризованы для выборки белков, иденти
мя функциональными горизонтальными слоя
фицированных нами в митохондриальной
ми, связь между которыми осуществляется че
фракции мозга без аффинного обогащения [26]:
рез три ключевых белка, кодируемых генами
метаболизм малых молекул (GO:0044281, p =
Park7
(Parkinsonism Associated Deglycase),
= 3,44e 05), клеточные метаболические процес
Hsp90aa1 (Heat Shock Protein 90 Alpha Family
сы (GO:0044237, p = 2,33e 03), метаболические
Class A Member 1) и Sod2 (Superoxide Dismutase
процессы (GO:0008152, p = 4,97e 03) и метабо
2). Взаимодействие между этими тремя белками
лизм органических субстанций (GO:0071704, p =
характеризуется максимальной величиной:
= 3,32e 02). Возможные различия в профилях
Park7 Hsp90aa1 PPI = 0,985, Park7 Sod2 PPI =
убиквитинированных белков митохондрий моз
= 0,987, Sod2 Park7 PPI = 0,879 и Sod2 Hsp90aa1
га могут быть обусловлены рядом причин, среди
PPI = 0,893. Каждый из этих трех белков являет
которых следует отметить: (i) отсутствие этапа
ся входной точкой в отдельный слой сетевого
аффинного обогащения убиквитиновой сигна
взаимодействия (на рис. 4 обозначены красным,
туры при подготовке проб для масс спектромет
синим и зеленым цветами), однако именно эти
рического анализа в наших исследованиях;
три белка выполняют общие функции в таких
БИОХИМИЯ том 84 вып. 11 2019
УБИКВИТИНОВЫЙ СУБПРОТЕОМ МИТОХОНДРИЙ МОЗГА
1693
процессах, как организация митохондрий
(GO:0007005, p = 1,50е 07), ответная реакция на
стресс (GO:0006950, p = 9,49е 06), регуляция ло
кализации (GO:0032879, p = 0,00014) и ответная
реакция на стимулирование (GO:0050896, p =
= 6,96е 07). В то же время, все эти белки, вклю
чая основные точки входа в сетевое взаимодей
ствие, объединяются ответными реакциями на
окислительный стресс, что согласуется с ранее
приведенными данными о распределении мито
хондриальных убиквитинированных белков
между биологическими процессами, направлен
ными на развитие и активизацию механизмов
нейтрализации активных форм кислорода. Ин
тересно отметить, что помимо мозга убиквити
нирование Sod2 было обнаружено также и в ми
тохондриях сердца мышей (таблица), что также
вписывается в контекст взаимосвязи убиквити
нирования митохондриальных белков и нейтра
лизации активных форм кислорода.
Особое место в этой группе белков занимает
Рис. 4. Сетевой анализ данных по идентифицированным
DJ 1 (кодируемый геном Park7), основная моле
убиквитинированным белкам мозга мышей [30], имеющих
заведомо митохондриальную локализацию (см. пояснения
кулярная функция которого состоит в каталити
в тексте).
ческой репарации гликозилированных белков
С цветным вариантом рис. 4 можно ознакомиться в элект
или нуклеотидов [31]. Этому белку, ассоцииро
ванному с некоторыми формами раковых забо
journal/biokhsm/
леваний и болезнью Паркинсона, свойственны
и другие функции, к числу которых относятся
регуляция транскрипции, антиоксидантных за
тивны результаты недавнего исследования
щитных механизмов, функций митохондрий, а
Scudamore и Ciossek [37], выполненного на
также шаперонная и протеазная активности
трансгенных мышах, экспрессирующих альфа
[32]. В интактных митохондриях содержание
синуклеин (Thy 1) h[A30P] α synuclein челове
DJ 1 невелико, однако в условиях окислитель
ка и характеризующихся дефицитом SOD2. Они
ного стресса его уровень существенно повыша
показали значительно более высокий уровень
ется за счет транслокации молекул этого белка
синуклеинопатий у 16 месячных трансгенных
из цитозоля [32].
животных и накопление альфа синуклеина в
Роль белка Hsp90α, кодируемого геном
нерастворимой фракции гомогената мозга.
Hsp90aa1, не менее многогранна. Одна из изо
Таким образом, единое сетевое взаимодей
форм этого белка (Trap1) преимущественно ло
ствие, выявляемое среди убиквитинированных
кализована в митохондриях [33]. Hsp90α специ
белков митохондрий мозга [30], обусловлено
ализируется на поддержании и регуляции функ
межмолекулярным взаимодействием, главным
циональной активности различных белков,
образом трех белков хабов, кодируемых генами
включая транскрипционные факторы, различ
Park7, Hsp90aa1, Sod2 и объединенных общими
ные киназы, а также Е3 лигазы, осуществляю
биологическими процессами, которые связаны
щие убиквитинирование белков для протеасом
с защитными механизмами от окислительного
ной деградации; по данным интерактомных ис
стресса, включающими процессы убиквитини
следований Hsp90α может взаимодействовать со
рования митохондриальных белков.
135 ю белками [34]. Hsp90aa1 представляет со
бой одну из основных мишеней в процессе ак
тивации убиквитин опосредованной деграда
ИЗМЕНЕНИЯ УБИКВИТИНОВОГО
ции белков [35].
СУБПРОТЕОМА МИТОХОНДРИЙ МОЗГА
Ген SOD2 кодирует митохондриальную мар
ПРИ ЭКСПЕРИМЕНТАЛЬНОМ
ганец зависимую супероксиддисмутазу, сниже
ПАРКИНСОНИЗМЕ И ДЕЙСТВИИ
ние уровня и активности которой имеет далеко
НЕЙРОПРОТЕКТОРОВ
идущие последствия при развитии митохондри
альной дисфункции и нейродегенеративной па
Болезнь Паркинсона - распространенное
тологии [36]. В этом плане особенно демонстра
нейродегенеративное заболевание, молекуляр
БИОХИМИЯ том 84 вып. 11 2019
1694
БУНЕЕВА и др.
ные механизмы которого до сих пор охарактери
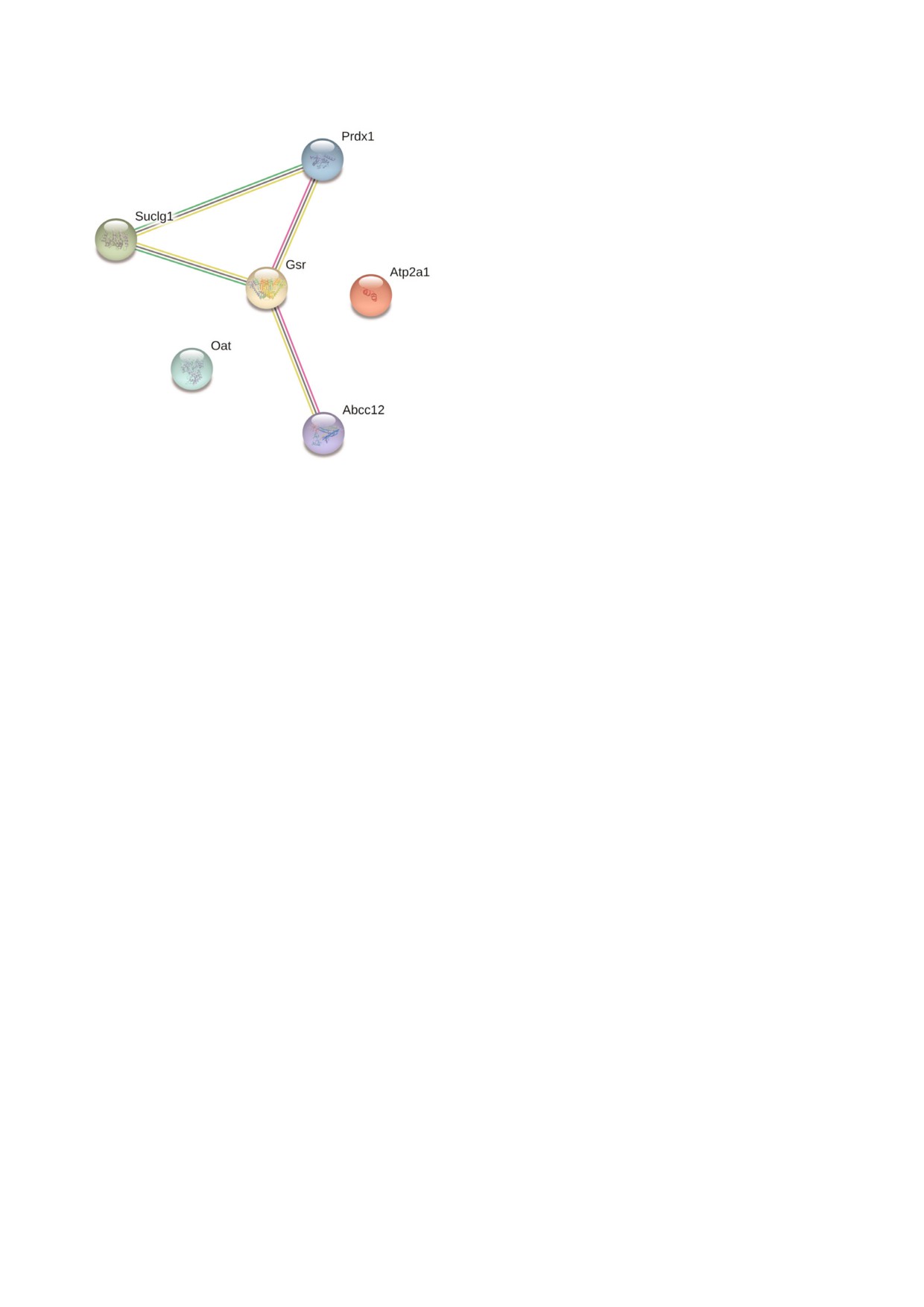
тинирования 114 ти белков, включая 21 извест
зованы недостаточно полно. Результаты много
ный субстрат паркина [46]. При этом среди бел
численных исследований, выполненных на раз
ков митохондриального облака были выявлены
личных экспериментальных моделях, а также
нарушения всего 7 ми белков, 4 из которых яв
данные клинических наблюдений свидетель
ляются собственно митохондриальными: субъ
ствуют о важной роли в развитии этого заболе
единица АТР синтазы (Atp5b; ATP synthase, H+
вания многочисленных нарушений в митохон
transporting mitochondrial F1 complex, beta sub
дриях, которые оказывают серьезное влияние на
unit), субъединица цитохромоксидазы (Cox7a2;
функционирование убиквитин протеасомной
cytochrome c oxidase subunit VIIa 2), митофузин 1
системы [32, 38-40].
(Mfn1; mitofusin 1) и белок потенциал зависи
Несмотря на то что изучению убиквитини
мого анионного канала (Vdac3; voltage dependent
рования митохондриальных белков при модели
anion channel 3). При этом 6 из 7 белков фор
ровании болезни Паркинсона посвящено нема
мируют функциональную регуляторную цепь
ло экспериментальных и обзорных работ
(рис. 5). Следует отметить, что в базе данных
[39-44], исследований по системному анализу
KEGG для 3 х белков (АТР5b, Cox7a2 и Vdac3)
убиквитинового субпротеома (т.н. убиквитило
показана строгая ассоциация с сигнальными пу
ма) именно в мозге выполнено не так много.
тями mmu05012 и mmu05010, имеющими отно
Животные с нокаутированным геном Е3
шение к патогенезу болезни Паркинсона и
убиквитинлигазы паркина привлекают внима
Альцгеймера соответственно.
ние исследователей в связи с описанными в ли
Другая часто используемая модель болезни
тературе мутациями в гене, кодирующим белок
Паркинсона - МФТП индуцированный пар
Е3, у пациентов с болезнью Паркинсона [45].
кинсонизм у мышей (рис. 6). Развитие экспери
Протеомное исследование всей совокупнос
ментальной модели болезни Паркинсона в этом
ти убиквитинированных белков (т.н. глобально
случае связано с превращением протоксина
го убиквитилома) мозга 18 месячных мышей с
МФТП в нейротоксин МФП+ (ион 1 метил 4
нокаутированным геном Parkin выявили суще
фенилпиридиния) под действием МАО Б. Обра
ственные (в два и более раз) нарушения убикви
зующийся нейротоксин МФП+ ингибирует
комплекс I дыхательной цепи, приводя в конеч
ном итоге к развитию симптомокомплекса, ха
рактерного для этого заболевания [43, 48]. Вве
дение ингибиторов МАО Б (например, депрени
ла или изатина [49, 50]) или конкурирующих за
активный центр этого фермента субстратов
(например, фенилэтиламина) [51], препятству
ющих метаболической активации МФТП, пре
дупреждает развитие дефицита нейромедиатора
дофамина и двигательных нарушений, свой
ственных болезни Паркинсона.
На высоте двигательных расстройств, выз
ванных введением однократной дозы МФТП
мышам C57Bl, в митохондриальной фракции
мозга выявлено снижение числа убиквитиниро
ванных белков (с 75 ти у контрольных мышей
до 49 ти у мышей с МФТП индуцированным
паркинсонизмом) [26]. Сравнение профилей
идентифицированных белков митохондриаль
ной фракции мозга мышей выявило всего 5 бел
ков, общих для этих двух групп животных. Это
свидетельствует в пользу того, что развитие
МФТП индуцированного паркинсонизма ока
зывало существенное влияние на убиквитини
Рис. 5. Сетевой анализ данных по идентифицированным
рование белков, ассоциированных с митохон
убиквитинированным белкам мозга 18 месячных крыс с
дриями.
выключенным геном паркина [46], имеющих заведомо ми
Поскольку митохондриальную фракцию
тохондриальную локализацию (см. пояснения в тексте).
мозга мышей выделяли через 2 ч после введения
С цветным вариантом рис. 5 можно ознакомиться в элект
МФТП животным, изменения убиквитинирова
journal/biokhsm/
ния митохондриальных белков, очевидно, отра
БИОХИМИЯ том 84 вып. 11 2019
УБИКВИТИНОВЫЙ СУБПРОТЕОМ МИТОХОНДРИЙ МОЗГА
1695
Рис. 6. Схема, иллюстрирующая МАО Б зависимое превращение протоксина МФТП в нейротоксин МФП+ и его
действие на дыхательную цепь митохондрий. OMM - внешняя мембрана митохондрий, IMM - внутренняя мембрана ми
тохондрий, Q - убихинон.
biokhsm/
жают наиболее ранние сдвиги, происходящие в
ческие эффекты реализуются изатин связываю
клетках мозга в ответ на нейротоксин. Примеча
щими белками, локализованными в различных
тельно, что процент убиквитинированных бел
внутриклеточных компартментах, включая ми
ков митохондрий, содержащих убиквитиновую
тохондрии [52-55]. Физиологические концен
метку и окисленный остаток метионина, при
трации изатина in vitro ингибируют МАО Б и
введении МФТП был в полтора раза выше (12%)
гуанилатциклазу рецепторов натрийуретичес
по сравнению с контролем (8%) [26]. Последнее
ких пептидов, более высокие (нейропротектор
можно было бы расценить как свидетельство в
ные) концентрации (50-400 мкМ) вызывают
пользу того, что убиквитинирование окислен
апоптоз различных (в том числе злокачествен
ных белков способствует их деградации в протеа
ных) опухолей клеточных линий и влияют на
сомах. Однако сравнение убиквитинированных
экспрессию генов, связанных с апоптозом. При
белков, ассоциированных с митохондриальной
введении in vivo изатин проявляет различные
фракцией мозга мышей, и белков митохондри
поведенческие эффекты: он ослабляет проявле
альной фракции мозга мышей, связывающихся
ния МФТП индуцированного паркинсонизма и
с убиквитиновым рецептором протеасом, субъ
роста опухолей на экспериментальных моделях
единицей Rpn10 [47], не выявили ни одного об
животных [44, 47], а также существенно ограни
щего белка. Это свидетельствует в пользу того,
чивает репертуар белков, связывающихся с
что убиквитинирование митохондриальных
убиквитиновым рецептором протеасом - субъ
белков прямо не связано с их деградацией в про
единицей Rpn10 [44].
теасомах. При введении нейропротектора иза
В контексте функциональных связей убикви
тина количество таких белков, содержащих
тинированных белков митохондрий мозга при
окисленный метионин и убиквитиновую сигна
МФТП индуцированном паркинсонизме и вве
туру, было значительно выше (22%), чем у жи
дении нейропротектора изатина следует отме
вотных других групп (контроль, МФТП и
тить, что такие связи были выявлены только в
МФТП + изатин).
группе животных с МФТП индуцированным
Изатин (индол 2,3 дион)
- эндогенный
паркинсонизмом (рис. 7). Такие взаимосвязи не
окисленный индол, присутствующий в тканях и
были выявлены среди убиквитинированных бел
биологических жидкостях млекопитающих [47].
ков митохондрий мозга других групп животных
Его многочисленные (дозозависимые) биологи
(введение МФТП и изатина или изатина) из за
БИОХИМИЯ том 84 вып. 11 2019
1696
БУНЕЕВА и др.
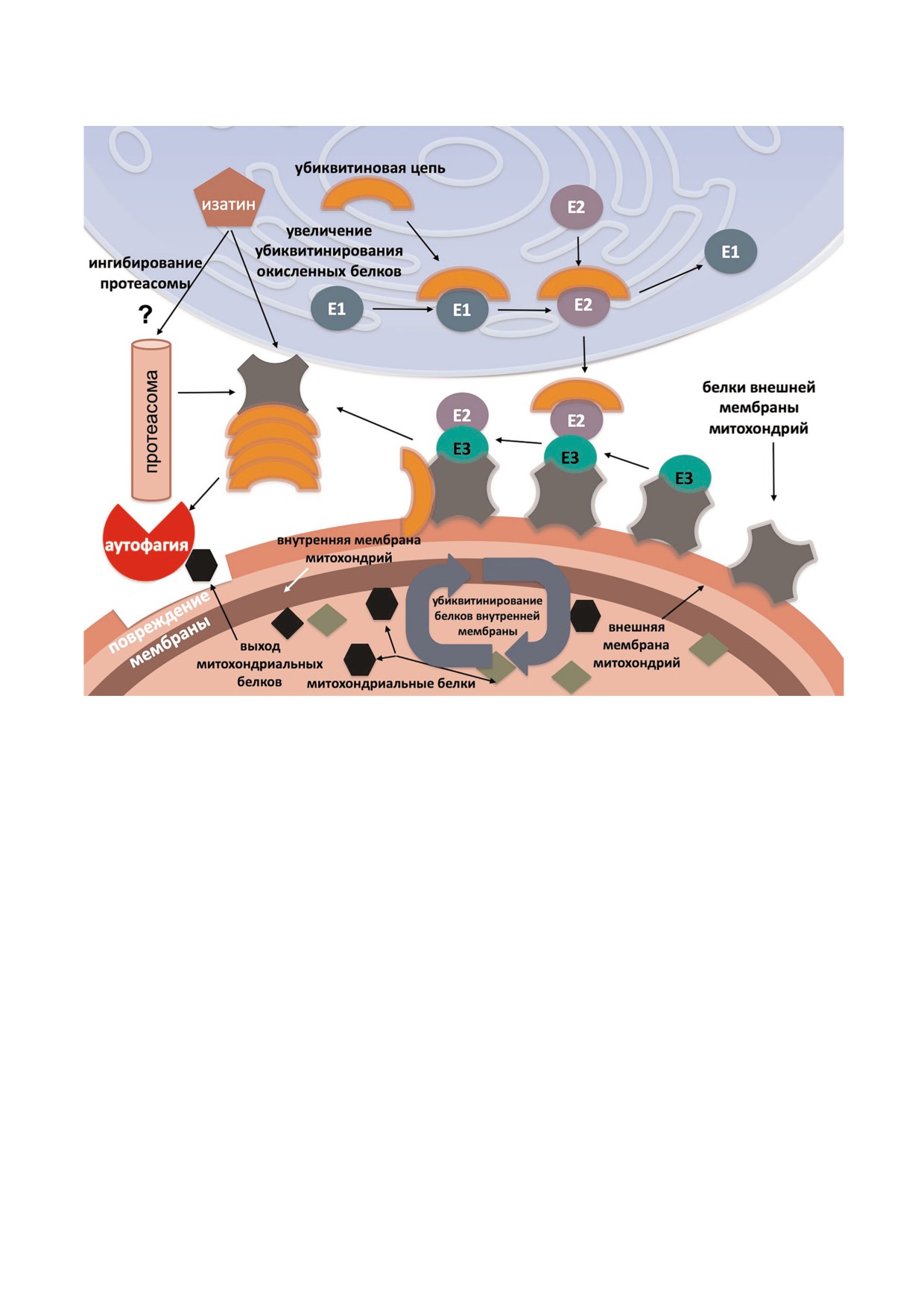
альных белков [26] и (ii) сужает репертуар мито
хондриальных белков, связывающихся с протеа
сомным рецептором убиквитина, Rpn10 [44],
нейропротекторный эффект этого вещества мо
жет быть обусловлен нарушением функцио
нальных связей, свойственных убиквитиниро
ванным белкам при паркинсонизме и переклю
чением протеасомной деградации на селектив
ную аутофагию (митофагию) (рис. 8), которая
включает другой маршрут убиквитинирован
ных белков, не связанный с протеасомами
[57, 58].
Убиквитинирование белков является важ
ным механизмом, который не только обеспечи
вает специфическое мечение для последующей
деградации, но и во многом определяет локали
зацию белков в клетке и регуляцию белок-бел
ковых взаимодействий. Накопленные на сегод
няшний день экспериментальные данные сви
Рис. 7. Функциональные связи между убиквитинирован
детельствуют в пользу того, что убиквитиновый
ными белками митохондрий мозга мышей с МФТП инду
субпротеом митохондрий представлен большим
цированным (созданы по данным, представленным в
числом белков, локализованных как в митохон
статье Buneeva et al. [26]).
дриальных мембранах (внешней и внутренней),
С цветным вариантом рис. 7 можно ознакомиться в элект
межмембранном пространстве, так и в матрик
journal/biokhsm/
се. По оценке Lehman et al. [59], у человека на
долю митохондрий приходится до 8% всего пула
убиквитинированных белков. При этом до сих
сильно различающихся паттернов убиквитини
пор остается неясным, где происходит их убик
рованных белков митохондрий. Это позволяет
витинирование [59]. Подавляющее большин
предположить, что нейропротекторный эффект
ство митохондриальных белков синтезируется в
изатина может быть обусловлен в том числе и на
цитозоле и затем поступает, собственно, в мито
рушением функциональных взаимосвязей бел
хондрии. Поэтому нельзя исключить, что убик
ков, подлежащих последующей деградации.
витинирование ряда белков может осуществ
Снижение проявлений токсического
ляться на этапе их импорта в митохондрии при
действия МФТП введением нейропротекторной
помощи внемитохондриальной убиквитин
дозы изатина, по видимому, обусловлено тор
конъюгирующей системы [60, 61]. Правда, био
можением МАО Б [44]. Кроме того, следует от
синтез митохондриальных белков прямо сопря
метить, что изатин может взаимодействовать с
жен с их импортом в эти органеллы, что снижа
компонентами убиквитиновой системы. В ходе
ет вероятность их убиквитинирования в цитозо
проведенного протеомного профилирования
ле [62]. К тому же в прямых экспериментах на
изатин связывающих белков мозга [56] были
клетках HeLa показано убиквитинирование ми
идентифицированы ферменты, участвующие в
тохондриальных белков именно под действием
работе убиквитин конъюгирующей системы
митохондриальной убиквитин конъюгирующей
мозга: E3 убиквитинпротеинлигаза MYCBP2
системы [23]. Однако такого рода исследования
(Q9TPH6), убиквитин карбоксиконцевая гид
до сих пор не проведены на клетках (митохон
ролаза 24 (B1AY13), E3 убиквитинпротеинлига
дриях) мозга.
за MIB2 (Q8R516), E3 убиквитинпротеинлигаза
Исследования роли ферментов убиквитин
HUWE1 (Q7TMY8), вариант 1 убиквитин конъ
конъюгирующей системы и убиквитинирован
югирующего фермента E2 (Q9CZY3) и поли
ных белков митохондрий идут по двум направ
убиквитин (P0CG49). Картирование идентифи
лениям. В контексте митохондрий мозга первое
цированных изатин связывающих белков на из
направление специализируется на выяснении
вестные метаболические пути предполагает их
возможной роли конкретных белков в развитии
участие в пути, связанном с E3 убиквитинпроте
нейродегенеративной патологии. Например,
инлигазой паркином (parkin associated pathway;
сверхэкспрессия митохондриальных Е3 убикви
CH000000947) [56].
тинлигаз (Mul1 и Park) у мушек Drosophila обра
С учетом того, что изатин (i) увеличивает
щала проявления экспериментального паркин
убиквитинирование окисленных митохондри
сонизма, индуцированного введением ротено
БИОХИМИЯ том 84 вып. 11 2019
УБИКВИТИНОВЫЙ СУБПРОТЕОМ МИТОХОНДРИЙ МОЗГА
1697
Рис. 8. Предполагаемый механизм нейропротекторного действия изатина на пути метаболической деградации убиквити
нированных белков митохондрий в условиях МФТП индуцированного паркинсонизма. Изатин способствует увеличе
нию убиквитинирования окисленных белков митохондрий, но ограничивает их связывание с убиквитиновым рецептором
26S (Rpn10). Это ограничивает доступ убиквитинированных белков в протеасому и сдвигает поток окисленных и убикви
тинированнх белков митохондрий по пути аутофагии.
biokhsm/
на, и способствовала нормализации дегенера
тем не менее, свидетельствуют об убиквитини
тивных нарушений в нейронах, вызванных этим
ровании большого числа белков митохондрий и
пестицидом; однако уровень убиквитинирова
физическом взаимодействии убиквитинирован
ния митохондриальных белков не был изучен
ных белков друг с другом. Это способствует об
[41]. Второе направление включает исследова
разованию различных белковых сетей (интерак
ния всей совокупности белков митохондрий
томов), некоторые из которых были рассмотре
мозга, подвергающихся убиквитинированию в
ны в данной работе. Важный момент, которому
норме и при моделировании нейродегенератив
до сих пор не уделено должное внимание, - осо
ной патологии, которые и были рассмотрены в
бенности структуры убиквитиновых цепей, ко
данном обзоре более предметно. Помимо разно
торые и определяют судьбу убиквитинирован
образных методов «мокрой» (т.е. эксперимен
ных белков [4] как в контексте деградации, так и
тальной) биологии, это направление активно
при формировании различных интерактомов.
использует также методы «сухой» биологии,
В последнее время становится все более оче
анализирующие накопленные к настоящему
видным, что подавляющее большинство про
времени массивы теоретических и эксперимен
цессов, протекающих в клетках, осуществляется
тальных данных [59]. Хотя результаты таких ис
(и регулируется) различными долго или корот
следований носят вероятностный характер, они,
коживущими белковыми комплексами, а сами
12 БИОХИМИЯ том 84 вып. 11 2019
1698
БУНЕЕВА и др.
внутриклеточные белки образуют белковые се
Финансирование. Анализ данных литературы
ти - интерактомы [63-65], изменяющиеся в от
выполнен при поддержке Российского фонда
вет на действие патологических факторов и фар
фундаментальных исследований (грант № 19
макологических препаратов. С учетом того, что
015 00073), анализ интерактома с использовани
в наших исследованиях новые функциональные
ем программного обеспечения открытого досту
связи убиквитинированных белков митохон
па STRING выполнен в рамках Программы фун
дрий были обнаружены только в группе живот
даментальных научных исследований государ
ных с МФТП индуцированным паркинсониз
ственных академий наук на 2013-2020 годы.
мом, но не при введении изатина [26], есть все
Конфликт интересов. Авторы заявляют об от
основания полагать, что действие нейропротек
сутствии конфликта интересов.
торов (изатина) способствует нарушению бе
Соблюдение этических норм. Эксперименты
лок-белковых взаимодействий, характерных
по анализу интерактома, выполненные при под
для паркинсонизма и сформировавшихся в моз
готовке данной работы, не предполагали ис
ге при участии убиквитинированных белков ми
пользования людей и животных в качестве объ
тохондрий.
ектов исследования.
СПИСОК ЛИТЕРАТУРЫ
1.
Hershko, A., and Ciechanover, A. (1998) The ubiquitin
dria is accompanied by increased proteolytic digestibility of
system, Annu. Rev. Biochem., 67, 425-479.
MAO, Neurobiology (Bp), 7, 257-261.
2.
Hershko, A., Ciechanover, A., and Varshavsky, A. (2000)
15.
Buneeva, O.A., Medvedeva, M.V., and Medvedev, A.E.
Basic Medical Research Award. The ubiquitin system, Nat.
(2008) Ubiquitin causes selective increase in the sensitivity
Med., 6, 1073-1081.
of rat brain mitochondrial monoamine oxidases to various
3.
Schwartz, A.L., and Ciechanover, A. (2009) Targeting pro
proteases, Biochemistry (Moscow) Supplement Series B:
teins for destruction by the ubiquitin system: implications
Biomedical Chemistry, 2, 101-104.
for human pathobiology, Annu. Rev. Pharmacol. Toxicol.,
16.
Buneeva, O.A., Medvedeva, M.V., and Medvedev, A.E.
49, 73-96, doi: 10.1146/annurev.pharmtox.051208.165340.
(2009) The study of ubiquitin dependent increase in
4.
Komander, D., and Rape, M. (2012) The ubiquitin code,
monoamine oxidase sensitivity to proteolysis and specific
Annu. Rev. Biochem., 81, 203-229.
inhibitor, pargyline, Biochemistry (Moscow), Suppl. Ser. B:
5.
Buneeva, O.A., and Medvedev, A.E. (2017) The role of
Biomed. Chem., 3, 145-148.
atypical ubiquitination in cell regulation, Biochemistry
17.
Schwartz, A.L., Trausch, J.S., Ciechanover, A., Slott, J.W.,
(Moscow), Suppl. Ser. B: Biomed. Chem., 11, 16-31.
and Geuze, H. (1992) Immunoelectron microscopic local
6.
Goldknopf, I.L., and Busch,H. (1977) Isopeptide linkage
ization of the ubiquitin activating enzyme El in HepG2
between nonhistone and histone 2A polypeptides of chro
cells, Proc. Natl. Acad. Sci. USA, 89, 5542-5546.
mosomal conjugate protein A24, Proc. Natl. Acad. Sci.
18.
Hormaechea Agulla, D., Kim, Y., Song, M.S., and
USA, 74, 864-868.
Song, S.J. (2018) New insights into the role of E2s in the
7.
Hershko, A., Ciechanover, A., Heller, H., Haas, A.L., and
pathogenesis of diseases: lessons learned from UBE2O, Mol.
Rose, I.A. (1980) Proposed role of ATP in protein break
Cells, 41, 168-178, doi: 10.14348/molcells.2018. 0008.
down: conjugation of proteins with multiple chains of the
19.
Geisler, S., Vollmer, S., Golombek, S., and Kahle, P.J.
polypeptide of ATP dependent proteolysis, Proc. Natl.
(2014) The ubiquitin conjugating enzymes UBE2N,
Acad. Sci. USA, 77, 1783-1786.
UBE2L3 and UBE2D2/3 are essential for Parkin depen
8.
Zhuang, Z., and McCauley, R. (1989) Ubiquitin is involved in
dent mitophagy, J. Cell Sci.,
127,
3280-3293,
the in vitro insertion of monoamine oxidase B into mitochon
doi: 10.1242/jcs.146035.
drial outer membranes, J. Biol. Chem., 264, 14594-14596.
20.
Patila, H., Yoon, D., Bhowmick, R., Cai, I., Cho, K.I.,
9.
Zhuang, Z., Marks, B., and McCauley, R. (1992) The
and Ferreira, P.A. (2019) Impairments in age dependent
insertion of monoamine oxidase A into the outer membrane
ubiquitin proteostasis and structural integrity of selective
of rat liver mitochondria, J. Biol. Chem., 267, 591-596.
neurons by uncoupling Ran GTPase from the Ran binding
10.
Raboy, B., Parag, H.A., and Kulka, R.G.
(1986)
domain 3 of Ranbp2 and identification of novel mitochon
Conjugation of [125I]ubiquitin to cellular proteins in per
drial isoforms of ubiquitin conjugating enzyme E2I (ubc9)
meabilized mammalian cells: comparison of mitotic and
and Ranbp2, Small GTPases, 10, 146-161.
interphase cells, EMBO J., 5, 863-869.
21.
Lehmann, G., Ziv, T., Braten, O., Admon, A., Udasin, R.G.,
11.
Magnani, M., Serafini, G., Antonelli, A., Malatesta, M.,
and Ciechanover, A. (2016) Ubiquitination of specific
and Gazzanelli, G. (1991) Evidence for a particulate loca
mitochondrial matrix proteins, Biochem. Biophys. Res.
tion of ubiquitin conjugates and ubiquitin cojugating
Commun., 475, 13-18, doi: 10.1016/j.bbrc.2016.04.150.
enzymes in rabbit brain, J. Biol. Chem., 266, 21018-21024.
22.
Jeon, H.B., Choi, E.S., Yoon, J.H., Hwang, J.H., Chang, J.W.,
12.
Hayashi, T., Takada, K., and Matsuda, M.
(1992)
Lee, E.K., Choi, H.W., Park, Z. Y., and Yoo, Y.J. (2007) A pro
Subcellular distribution of ubiquitin protein conjugates in
teomics approach to identify the ubiquitinated proteins in
the hippocampus following transient ischemia. J. Neurosci.
mouse heart, Biochem. Biophys. Res. Commun., 357, 731-736.
Res., 31, 561-564, doi: 10.1002/jnr.490310321.
23.
Lavie, J., De Belvalet, H., Sonon, S., Ion, A.M., Dumon,
13.
Medvedev, A.E., Kirkel, A.Z., Kamyshanskaya, N.S., and
E., Melser, S., Lacombe, D., Dupuy, J.W., Lalou, C., and
Gorkin, V.Z. (1993) Lipid peroxidation affects catalytic prop
Benard, G. (2018) Ubiquitin dependent degradation of
erties of rat liver mitochondrial monoamine oxidases and their
mitochondrial proteins regulates energy metabolism, Cell
sensitivity to proteolysis, Int. J. Biochem., 25, 1791-1799.
Rep., 23, 2852-2863, doi: 10.1016/j.celrep.2018.05.013.
14.
Buneeva, O.A., Medvedeva, M.V., and Medvedev, A.E.
24.
Buneeva, O., Medvedeva, M., Kopylov, A., Zgoda, V., and
(1999) Incorporation of ubiquitin into rat brain mitochon
Medvedev, A. (2012) Use of biotinylated ubiquitin for
БИОХИМИЯ том 84 вып. 11 2019
УБИКВИТИНОВЫЙ СУБПРОТЕОМ МИТОХОНДРИЙ МОЗГА
1699
analysis of rat brain mitochondrial proteome and interac
ease, Front. Cell Dev. Biol., 5, 110, doi: 10.3389/fcell.2017.
tome, Int. J. Mol. Sci., 3, 11593-11609, doi: 10.3390/
00110.
ijms130911593.
41.
Doktor, B., Damulewicz, M., and Pyza, E.
(2019)
25.
Бунеева О.А., Гнеденко О.В., Медведева М.В., Иванов А.С.,
Overexpression of mitochondrial ligases reverses rotenone
Медведев А.Е. (2014) Использование иммобилизован
induced effects in a Drosophila model of Parkinson’s disease,
ного убиквитина для биосенсорного анализа убикви
Front. Neurosci., 13, 94, doi: 10.3389/fnins.2019.00094.
тинового субинтерактома митохондрий, Биомедицин+
42.
Covill Cooke, C., Howden, J.H., Birsa, N., and Kittler, J.T.
ская химия, 60, 615-622.
(2018) Ubiquitination at the mitochondria in neuronal
26.
Buneeva, O., Kopylov, A., Kapitsa, I., Ivanova, E., Zgoda, V.,
health and disease, Neurochem. Int.,
117,
55-64,
and Medvedev, A. (2018) The effect of neurotoxin MPTP
doi: 10.1016/j.neuint.2017.07.003.
and neuroprotector isatin on the profile of ubiquitinated
43.
Buneeva, O.A., and Medvedev, A.E. (2011) Mitochondrial
brain
mitochondrial proteins, Cells,
7,
91,
disfunction in Parkinson’s disease, Biochemistry (Moscow),
doi: 10.3390/cells7080091.
Suppl. Ser. B: Biomed. Chem., 5, 313-336.
27.
Bouter, Y., Kacprowski, T., Weissmann, R., Dietrich, K.,
44.
Medvedev, A.E., Buneeva, O.A., Kopylov, A.T.,
Borgers, H., Brauß, A., Sperling, C., Wirths, O., Albrecht, M.,
Tikhonova, O.V., Medvedeva, M.V., Nerobkova, L.N.,
Jensen, L.R., Kuss, A.W., and Bayer, T.A.
(2014)
Kapitsa, I.G., and Zgoda, V.G. (2017) Brain mitochondri
Deciphering the molecular profile of plaques, memory
al subproteome of Rpn10 binding proteins and its changes
decline and neuron loss in two mouse models for
induced by the neurotoxin MPTP and the neuroprotector
Alzheimer’s disease by deep sequencing, Front. Aging
isatin, Biochemistry (Moscow), 82, 330-339.
Neurosci., 6, 75, doi: 10.3389/fnagi.2014.00075.
45.
Lucking, C.B., Durr, A., Bonifati, V., Vaughan, J., De
28.
He, F., and DiMario, P.J. (2011) Drosophila delta 1
Michele, G., Gasser, T., Harhangi, B.S., Meco, G.,
pyrroline 5 carboxylate dehydrogenase (P5CDh) is
Denefle, P., Wood, N.W., Agid, Y., and Brice, A.; French
required for proline breakdown and mitochondrial integri
Parkinson’s Disease Genetics Study Group; European
ty establishing a fly model for human type II hyperproline
Consortium on Genetic Susceptibility in Parkinson’s
mia, Mitochondrion, 11, 397-404.
Disease
(2000) Association between early onset
29.
Wagner, S.A., Beli, P., Weinert, B.T., Nielsen, M.L., Cox, J.,
Parkinson’s disease and mutations in the Parkin gene, N.
Mann, M., and Choudhary, C. (2011) A proteome wide,
Engl. J. Med., 342, 1560-1567.
quantitative survey of in vivo ubiquitylation sites reveals
46.
Key, J., Mueller, A.K., Gispert, S., Matschke, L., Wittig, I.,
widespread regulatory roles, Mol. Cell. Proteomics, 10,
Corti, O., Munch, C., Decher, N., and Auburger, G.
M111.013284, doi: 10.1074/mcp.M111.013284.
(2019) Ubiquitylome profiling of Parkin null brain reveals
30.
Wagner, S.A., Beli, P., Weinert, B.T., Scholz, C.,
dysregulation of calcium homeostasis factors ATP1A2,
Kelstrup, C.D., Young, C., Nielsen, M.L., Olsen, J.V.,
Hippocalcin and GNA11, reflected by altered firing of
Brakebusch, C., and Choudhary, C. (2012) Proteomic
noradrenergic neurons, Neurobiol. Dis., 127, 114-130.
analyses reveal divergent ubiquitylation site patterns in
47.
Medvedev, A., Buneeva, O., Gnedenko, O., Ershov, P., and
murine tissues, Mol. Cell. Proteomics, 11, 1578-1585.
Ivanov, A. (2018) Isatin, an endogenous non peptide bio
31.
Lee, J.Y., Song, J., Kwon, K., Jang, S., Kim, C., Baek, K.,
factor: a review of its molecular targets, mechanisms of
Kim, J., and Park, C. (2012) Human DJ 1 and its
actions and their biomedical implications, Biofactors, 44,
homologs are novel glyoxalases, Hum. Mol. Genet., 21,
95-108, doi: 10.1002/biof.1408.
3215-3225, doi: 10.1093/hmg/dds155.
48.
Maret, G., Testa, B., Jenner, P., el Tayar, N., and Carrupt, P.A.
32.
Ariga, H., Takahashi Niki, K., Kato, I., Maita, H., Niki, T.,
(1990) The MPTP story: MAO activates tetrahydropyri
and Iguchi Ariga, S.M.M. (2013) Neuroprotective func
dine derivatives to toxins causing parkinsonism, Drug
tion of DJ 1 in Parkinson’s disease, Oxid. Med. Cell.
Metab. Rev., 22, 291-332.
Longev., 2013, 683920, doi: 10.1155/2013/683920.
49.
Zhou, Y., Zhao, Z.Q., and Xie, J.X. (2001) Effect of isatin
33.
Felts, S.J., Owen, B.A.L., Nguyen, P.M., Trepel, J.,
on rotational behavior and DA levels in caudate putamen
Donner, D.B., and Toft, D.O. (2000) The HSP90 related
in Parkinsonian rats, Brain Res., 917, 127-132.
protein TRAP1 is a mitochondrial protein with distinct
50.
Hamaue, N., Minami, M., Terado, M., Hirafuji, M.,
functional properties, J. Biol. Chem., 275, 3305-3312.
Endo, T., Machida, M., Hiroshige, T., Ogata, A., Tashiro, K.,
34.
Zuehlke, A.D., Beebe, K., Neckers, L., and Prince, T.
Saito, H., and Parvez, S.H. (2004) Comparative study of
(2015) Regulation and function of the human HSP90AA1
the effects of isatin, an endogenous MAO inhibitor, and
gene, Gene, 570, 8-16.
selegiline on bradykinesia and dopamine levels in a rat
35.
Kundrat, L., and Regan, L. (2010) Identification of
model of Parkinson’s disease induced by the Japanese
residues on Hsp70 and Hsp90 ubiquitinated by the cochap
encephalitis virus, Neurotoxicology, 25, 205-213.
erone CHIP, J. Mol. Biol., 395, 587-594.
51.
Melamed, E., and Youdim, M.B.H. (1985) Prevention of
36.
Flynn, J.M., and Melov, S. (2013) SOD2 in mitochondrial
dopaminergic toxicity of MPTP in mice by phenylethyl
dysfunction and neurodegeneration, Free Radic. Biol.
amine, a specific substrate of type B monoamine oxidase,
Med.,
62,
4-12, doi:
10.1016/j.freeradbiomed.2013.
Br. J. Pharmacol., 86, 529-531.
05.027.
52.
Crumeyrolle Arias, M., Buneeva, O., Zgoda, V., Kopylov, A.,
37.
Scudamore, O., and Ciossek, T. (2018) Increased oxidative
Cardona, A., Tournaire, M.C., Pozdnev, V., Glover, V., and
stress exacerbates α synuclein aggregation in vivo, J.
Medvedev, A. (2009) Isatin binding proteins in rat brain: in
Neuropathol.
Exp.
Neurol.,
77,
443-453,
situ imaging, quantitative characterization of specific
doi: 10.1093/jnen/nly024.
[3H]isatin binding, and proteomic profiling, J. Neurosci.
38.
Cookson, M.R. (2005) The biochemistry of Parkinson’s
Res., 87, 2763-2772.
disease, Annu. Rev. Biochem., 74, 9-52.
53.
Buneeva, O., Gnedenko, O., Zgoda, V., Kopylov, A.,
39.
Haelterman, N.A., Yoon, W.H., Sandova, H., Jaiswa, M.,
Glover, V., Ivanov, A., Medvedev, A., and Archakov, A.
Shulman, J.M., and Bellen, H.J. (2014) A mitocentric view
(2010) Isatin binding proteins of rat and mouse brain: pro
of Parkinson’s disease, Annu. Rev. Neurosci., 37, 137-159,
teomic identification and optical biosensor validation,
doi: 10.1146/annurev neuro 071013 014317.
Proteomics, 10, 23-37.
40.
Plotegher, N., and Duchen, M.R. (2017) Crosstalk
54.
Иванов Ю.Д., Панова Н.Г., Гнеденко О.В., Бунеева
between lysosomes and mitochondria in Parkinson’s dis
О.А., Медведев А.Е., Арчаков А.И. (2002) Исследова
БИОХИМИЯ том 84 вып. 11 2019
12*
1700
БУНЕЕВА и др.
ние тканевого и субклеточного распределения иза
ubiquitin-proteasome system, Open Biol., 7, 170007,
тин связывающих белков при помощи оптического
doi: 10.1098/rsob.170007.
биосенсора, Вопросы медицинской химии, 48, 73-83.
61. Taylor, E.B., Rutter, J. (2011) Mitochondrial quality con
55.
Medvedev, A., Buneeva, O., Gnedenko, O., Fedchenko, V.,
trol by the ubiquitin-proteasome system, Biochem. Soc.
Medvedeva, M., Ivanov, Y., Glover, V., and Sandler, M. (2006)
Trans., 39, 1509-1513, doi: 10.1042/BST0391509.
Isatin interaction with glyceraldehyde 3 phosphate dehydro
62. Lesnik, C., Cohen, Y., Atir Lande, A., Schuldiner, M.,
genase, a putative target of neuroprotective drugs: partial ago
Arava, Y. (2014) OM14 is a mitochondrial receptor for
nism with deprenyl, J. Neural Transm. Suppl., 71, 97-103.
cytosolic ribosomes that supports co translational import
56.
Buneeva, O.A., Kopylov, A.T., Tikhonova, O.V., Zgoda, V.G.,
into mitochondria, Nat. Commun.,
5,
5711,
Medvedev, A.E., and Archakov, A.I. (2012) Effect of affini
doi: 10.1038/ncomms6711.
ty sorbent on proteomic profiling of isatin binding proteins
63. Ivanov, A.S., Zgoda, V.G., and Archakov, A.I.
(2011)
of mouse brain, Biochemistry (Moscow), 77, 1326-1338.
Technologies of protein interactomics: a review, Russ. J.
57.
Shaid, S., Brandts, C.H., Serve, H., and Dikic, I. (2013)
Bioorg. Chem., 37, 4-16.
Ubiquitination and selective autophagy, Cell Death Differ.,
64. Ivanov, A.S., Ershov, P.V., Molnar, A.A., Mezentsev, Y.V.,
20, 21-30, doi: 10.1038/cdd.2012.72.
Kaluzhskiy, L.A., Yablokov, E.O., Florinskaya, A.V.,
58.
Ji, C.H., and Kwon, Y.T. (2017) Crosstalk and interplay
Gnedenko, O.V., Medvedev A.E., Kozin, S.A.,
between the ubiquitin proteasome system and autophagy,
Mitkevichm, V.A., Makarov, A.A., Gilep, A.A.,
Mol. Cells,
40,
441-449, doi:
10.14348/mol
Lushchik, A.Ya., Gaidukevich, I.V., and Usanov, S.A.
cells.2017.0115.
(2016) Direct molecular fishing in molecular partners
59.
Lehmann, G., Udasin, R.G., and Ciechanover, A. (2016) On
investigation in protein-protein and protein-peptide
the linkage between the ubiquitin proteasome system and the
interactions, Russ. J. Bioorg. Chem., 42, 18-27.
mitochondria, Biochem. Biophys. Res. Commun., 473, 80-86.
65. Luck, K., Sheynkman, G.M., Zhang, I., and Vidal, M.
60.
Bragoszewski, P., Turek, M., and Chacinska, A. (2017)
(2017) Proteome scale human interactomics, Trends
Control of mitochondrial biogenesis and function by the
Biochem. Sci., 42, 342-354, doi: 10.1016/j.tibs.2017.02.006.
UBIQUITIN SUBPROTEOME OF BRAIN MITOCHONDRIA
AND ITS CHANGES INDUCED BY EXPERIMENTAL PARKINSONISM
AND THE NEUROPROTECTOR ACTION*
Review
O. A. Buneeva1**, M. V. Medvedeva2**,***, A. T. Kopylov1, and A. E. Medvedev1
1 Institute of Biomedical Chemistry, Department of Proteomic Research, 119121 Moscow, Russia
2 Lomonosov Moscow State University, Faculty of Biology, 119991 Moscow, Russia; E+mail: marmed64@yandex.ru
Received May 23, 2019
Revised July 2, 2019
Accepted July 11, 2019
Own and literature data on the ubiquitination of brain mitochondrial proteins and its changes during the development
of experimental parkinsonism and administration of the neuroprotector isatin (indole 2,3 dione) have been summa
rized. Special attention has been paid to the mitochondrial ubiquitin conjugating system and localization of ubiqui
tinated proteins in mitochondria. Incubation of brain mitochondrial fraction in vitro with biotinylated ubiquitin
resulted in incorporation of biotinylated ubiquitin both in mitochondrial and mitochondria associated proteins.
According to the interactome analysis, the identified non ubiquitinated proteins are able to form tight complexes with
ubiquitinated proteins or their partners and components of mitochondrial membranes. Studies of endogenous ubiq
uitination in the total brain mitochondrial fraction of C57Bl mice, performed in different laboratories, have shown
that mitochondrial ubiquitinated proteins represented about 30% of all ubiquitinated proteins in brain. However, sub
proteomes of brain mitochondrial ubiquitinated proteins significantly differed both in their composition and involve
ment of identified ubiquitinated proteins in the biological processes listed in the Gene Ontology database.
Development in C57Bl mice of experimental parkinsonism after single administration of 1 methyl 4 phenyl 1,2,3,6
tetrahydropyridine (MPTP) caused (i) a decrease in the total number of brain mitochondrial ubiquitinated proteins
and (ii) an increase in the number of oxidized mitochondrial proteins containing the ubiquitin signature (K ε GG).
A comparison of the ubiquitinated proteins associated with the mouse brain mitochondrial fraction and the mouse
brain mitochondrial proteins bound to the proteasome ubiquitin receptor, the Rpn10a subunit, did not reveal any
common proteins. This suggests that ubiquitination of brain mitochondrial proteins is not directly related to their
degradation in proteasomes. Proteomic profiling of brain isatin binding proteins revealed enzymes involved in the
ubiquitin conjugating system functioning. Mapping the identified isatin binding proteins to known metabolic path
ways indicates their participation in the parkin (E3 ubiquitin ligase) associated pathway (CH000000947). As for an
interaction of brain mitochondrial ubiquitinated proteins, functional links were found only in a group of animals with
MPTP induced parkinsonism, but not with the administration of MPTP and isatin or only isatin. This suggests that
the neuroprotective effect of isatin may be associated with impaired functional relationships of proteins that are tar
geted to subsequent degradation.
Keywords: protein ubiquitination, brain mitochondria, experimental Parkinsonism, isatin neuroprotector, subpro
teome, interactome
БИОХИМИЯ том 84 вып. 11 2019