БИОХИМИЯ, 2019, том 84, вып. 11, с. 1733 - 1742
УДК 577.151
Na+ ТРАНСЛОЦИРУЮЩАЯ
ФЕРРЕДОКСИН:NAD+ ОКСИДОРЕДУКТАЗА
ЯВЛЯЕТСЯ КОМПОНЕНТОМ ФОТОСИНТЕТИЧЕСКОЙ
ЭЛЕКТРОН ТРАНСПОРТНОЙ ЦЕПИ
ЗЕЛЕНЫХ СЕРНЫХ БАКТЕРИЙ
© 2019
Ю.В. Берцова*, М.Д. Мамедов, А.В. Богачев*,**
НИИ физико химической биологии имени А.Н. Белозерского,
Московский государственный университет им. М.В. Ломоносова,
119234 Москва, Россия; электронная почта: bogachev@belozersky.msu.ru
Поступила в редакцию 20.05.2019
После доработки 05.07.2019
Принята к публикации 07.07.2019
Проведен поиск rnf генов, кодирующих Na+ транслоцирующую ферредоксин:NAD+ оксидоредуктазу
(RNF), у фотоавтотрофных организмов с фотосинтетическими реакционными центрами типа I. Показано,
что эти гены отсутствуют у гелиобактерий, цианобактерий и растений, но присутствуют в геномах многих,
прежде всего морских, зеленых серных бактерий. Анализ экспрессии rnf генов выявил относительно высо
кий уровень содержания транскриптов этих генов в препаратах РНК, выделенных из морской зеленой сер
ной бактерии Chlorobium phaeovibrioides. Установлено, что в мембранной фракции из этой бактерии детекти
руется Na+ зависимая флаводоксин:NAD+ оксидоредуктазная активность, отсутствующая в мембранной
фракции близкородственной Chl. phaeovibrioides пресноводной зеленой серной бактерии Chlorobaculum lim
naeum, чей геном не содержит rnf генов. Также показано, что освещение мембран Chl. phaeovibrioides, но не
Cba. limnaeum, приводит к свето индуцированному восстановлению NAD+. Полученные данные позволяют
заключить, что RNF может принимать участие в процессе восстановления NAD+ у некоторых зеленых сер
ных бактерий, что должно повышать эффективность преобразования энергии света у этих микроорганиз
мов, и является первым примером использования Na+ энергетики в фотосинтетических электрон транс
портных цепях.
КЛЮЧЕВЫЕ СЛОВА: Na+ транслоцирующая ферредоксин:NAD+ оксидоредуктаза, трансмембранный
транспорт натрия, зеленые серные бактерии, нециклический фотосинтетический транспорт электронов.
DOI: 10.1134/S0320972519110149
Каталитическая активность многих комп
энергетической валюты для совершения различ
лексов дыхательных и фотосинтетических це
ных видов работы [1]. Однако активность бакте
пей, а также некоторых других энергопреобра
риальных мембранных декарбоксилаз
[2],
зующих мембранных ферментов сопряжена с
NADH:хинон оксидоредуктазы [3, 4], метил
трансмембранной транслокацией ионов H+. Об
трансферазного комплекса
[5], некоторых
разованный таким образом трансмембранный
ATPаз/ATP синтаз [6, 7], терминальных оксидаз
протонный потенциал используется в качестве
[8], мембранных пирофосфатаз [9] и родопси
нов [10] сопряжена с трансмембранным перено
Принятые сокращения: РВ ПЦР - количественная сом Na+, а не протона. Образованный с по
полимеразная цепная реакция в реальном времени; Fd, мощью этих ферментов трансмембранный нат
Fdox, Fdred - ферредоксин, его окисленная и восстановлен
риевый потенциал может затем использоваться
ная форма соответственно; Fld, Fldox, Fldsq, Fldred - флаво
доксин, его окисленная, семихинонная и полностью вос
для совершения основных видов работы - хи
становленная (хинольная) форма соответственно; FNO -
мической, осмотической и механической, обра
Fldred:NAD+ оксидоредуктаза; FNR - водорастворимая зуя натриевый цикл преобразования энергии
несопряженная ферредоксин NAD(P)+ редуктаза; PFOR -
[11]. Использование натриевого цикла может
пируват:ферредоксин(флаводоксин) оксидоредуктаза;
давать преимущества при росте бактерий в усло
RNF - Na+ транслоцирующая ферредоксин:NAD+ окси
доредуктаза.
виях, сопровождающихся пониженным уров
* Автор является выпускником кафедры биохимии биоло
нем трансмембранного протонного потенциала,
гического факультета МГУ им. М.В. Ломоносова.
например, при щелочных значениях pH [11].
** Адресат для корреспонденции.
Другим объяснением широкого распростране
1733
1734
БЕРЦОВА и др.
ния Na+ транслоцирующих ферментов может
типа I и показано, что этот белок принимает
быть представление о первичности использова
участие в процессе восстановления NAD+ у
ния натриевого цикла в ходе эволюции мем
морской зеленой серной бактерии Chlorobium
бранных энергопреобразующих белков [12].
phaeovibrioides, а также, по видимому, и у неко
На сегодняшний день фотосинтез хлоро
торых других представителей семейства Chloro
филл содержащих живых организмов является
biaceae.
единственным мембран ассоциированным пу
тем преобразования энергии, для которого не
показана возможность использования Na+ в ка
МЕТОДЫ ИССЛЕДОВАНИЯ
честве первичного сопрягающего иона. Фото
синтетические электрон транспортные цепи
Реактивы. В работе использовали следующие
фотоавтотрофных организмов состоят из раз
реактивы: глюкозооксидаза, каталаза, тиамин
личных комбинаций реакционных центров I го
пирофосфат, CoA, Tris («Sigma», США); MOPS
и II го типа, а также b6 f(bc1) комплекса. Все эти
(«Amresco», США). Использованные в работе
энергопреобразующие ферментативные комп
праймеры получали из компании «Евроген»
лексы генерируют трансмембранный протон
(Россия).
ный потенциал с использованием механизма ре
Бактериальные штаммы и условия выращива
докс петли (Митчеловой петли) [1], где замена
ния. Культура Chl. phaeovibrioides DSM 265 была
H+ на Na+ является невозможной. Тем не менее
получена из коллекции микроорганизмов и кле
в нециклических фотосинтетических электрон
точных культур института Лейбница (DSMZ).
транспортных цепях перепад значений окисли
Клетки Chlorobaculum limnaeum были получены
тельно восстановительного потенциала между
из коллекции микроорганизмов кафедры мик
ферредоксином (Fd) и NAD(P)+ теоретически
робиологии биологического факультета МГУ.
позволяет организовать еще один пункт сопря
Зеленые серные бактерии выращивали анаэроб
жения, и, таким образом, повысить эффектив
но при 28 °C и освещенности 1000 люкс, как бы
ность преобразования энергии света. Однако во
ло описано ранее [22]. Среда роста для Chl.
всех исследованных фотосинтетических орга
phaeovibrioides содержала 10 г/л NaCl, по 0,5 г/л
низмах с фотосинтетическими реакционными
MgSO4·7H2O, NH4Cl, KH2PO4 и ацетата аммо
центрами типа I перенос электронов от Fd на
ния, 0,05 г/л CaCl2·2H2O, 2 г/л NaHCO3, 2 г/л
NAD(P)+ осуществляется несопряженной водо
Na2S2O3, 1 г/л Na2S, 3 мкМ цитрата железа, смесь
растворимой ферредоксин NAD(P)+ редуктазой
микроэлементов SL 6 [22] (1 : 500), 20 мкг/л циа
(FNR) [13, 14], что приводит к рассеиванию
нокобаламина, 5 мг/л резазурина и 20 мМ MOPS
этой энергии в виде тепла.
(pH 6,9). В среде роста для Cba. limnaeum конце
В то же время у многих гетеротрофных про
нтрацию NaCl уменьшали до 1 г/л.
кариот присутствует Na+ транслоцирующая
Количественная полимеразная цепная реакция
ферредоксин:NAD+ оксидоредуктаза (RNF),
(РВ ПЦР). Экстракцию РНК из клеток Chl.
катализирующая перенос электронов между
phaeovibrioides и синтез кДНК проводили как
ферредоксином (флаводоксином (Fld)) и NAD+,
описано ранее [23]. РВ ПЦР проводили с ис
и, в зависимости от направления катализируе
пользованием набора qPCRmix HS SYBR kit
мой реакции, выступающая в качестве генерато
(«Евроген», Россия), полученной кДНК в каче
ра (прямая реакция) или потребителя (обратная
стве матрицы и пары праймеров rnfC_F/rnfC_R
реакция) трансмембранного натриевого потен
или rnfG_F/rnfG_R для Chl. phaeovibrioides rnfC
циала [15, 16]. RNF комплекс является мембран
и rnfG соответственно (табл. 1). Для нормализа
связанным ферментом и состоит из шести субъ
ции использовали 16S рРНК (пара праймеров
единиц (RnfABCDEG), кодируемых шестью ге
Cp16S_F/Cp16S_R (табл. 1)). Для калибровки
нами rnf оперона [17]. RNF широко распростра
РВ ПЦР применяли серию разведений геном
нена среди гетеротрофных микроорганизмов,
ной ДНК из Chl. phaeovibrioides, содержащей ге
где ее активность позволяет осуществлять запа
ны для RnfC, RnfG и 16S рРНК в соотношении
сание энергии при различных типах анаэробно
1 : 1 : 1.
го брожения [18, 19] либо (за счет обратной ре
Фракционирование клеток Chl. phaeovibrioides
акции) участвовать в энергозависимом восста
и Cba. limnaeum. Выращенные клетки осаждали
новлении низкопотенциального ферредоксина
центрифугированием (10 000 g, 10 мин для Chl.
(флаводоксина), необходимого для фиксации
phaeovibrioides; 14 000 g, 30 мин для Cba. lim
N2, синтеза FeS кластеров и других процессов
naeum) и промывали анаэробным буфером A
[15, 20, 21]. В ходе данной работы был проведен
(170 мМ KCl, 5 мМ MgSO4, 10 мМ β меркапто
поиск RNF у фотоавтотрофных организмов с
этанол и 30 мМ MOPS-Tris, pH 7,0). Клеточный
фотосинтетическими реакционными центрами
осадок суспендировали в буфере A и пропускали
БИОХИМИЯ том 84 вып. 11 2019
Na+ ТРАНСЛОЦИРУЮЩАЯ ФЕРРЕДОКСИН:NAD+ ОКСИДОРЕДУКТАЗА
1735
2× через пресс Френча (16 000 psi) («Aminco»,
Таблица 1. Последовательности праймеров, использован
ных в работе
США). Неразрушенные клетки отделяли цент
рифугированием при 22 500 g (5 мин), получен
Название
5'-3' последовательность
ный супернатант далее центрифугировали при
праймера
150 000 g в течение 75 мин. Полученный осадок
ресуспендировали в буфере A и далее использо
rnfC_F
5' ACTTCCGGCATTCTCTTCA 3'
вали в качестве тотальной мембранной фрак
rnfC_R
5' CTCCCGCATTCAGTACAGTT 3'
ции, а супернатант использовали в качестве ци
rnfG_F
5' TCTGGCACTGGTTGACGAC 3'
топлазматической фракции.
rnfG_R
5' CCTTTCAGTCTGCCTTCATT 3'
Обедненные по хлоросомам мембранные
фракции Chl. phaeovibrioides и Cba. limnaeum по
Cp16S_F
5' CAGCCACATTGGAACTGAGA 3'
лучали согласно описанному ранее протоколу
Cp16S_R
5' GCTTATTCGCAGAGTACCGT 3'
[24] с небольшими изменениями. Промытые
клетки Chl. phaeovibrioides или Cba. limnaeum сус
пендировали в анаэробном буфере, содержащем
20 мМ MOPS Tris (pH 7,0) и 10 мМ β меркапто
помощью пламенного фотометра ПФМ 4
этанол, пропускали 2× через пресс Френча
(СССР).
(16 000 psi) и центрифугировали при 120 000 g в
Для определения фотовосстановления NAD+
течение 30 мин. Полученный осадок состоял из
среда измерения содержала 50 мкM Fld, обед
плотной фракции, содержащей основное коли
ненную по хлоросомам мембранную фракцию из
чество хлоросом, и верхней рыхлой фракции.
Chl. phaeovibrioides или Cba. limnaeum (110 мкг/мл
Рыхлую фракцию отбирали, разводили анаэроб
белка), 5 U/мл глюкозооксидазы, 5 U/мл катала
ным буфером A и центрифугировали при
зы, 10 мМ глюкозу, 10 мМ β меркаптоэтанол,
150 000 g в течение 75 мин. Полученный осадок
1 мМ Tris NAD+, 10 мМ NaCl и 100 мМ MOPS
ресуспендировали в буфере A и использовали
Tris (pH 7,0). Реакцию инициировали светом га
далее в качестве обедненной по хлоросомам
логенной лампы мощностью 100 Вт, пропущен
мембранной фракции.
ным через инфракрасный фильтр.
Определение ферментативных активностей.
Выделение рекомбинантного 6×His Fld из
Пируват:Fldsq оксидоредуктазную (PFOR) ак
Chl. phaeovibrioides проводили, как описано ра
тивность определяли, как описано ранее [23].
нее [23]. Концентрацию белка определяли би
Среда для определения активности содержала
цинхониновым методом [25], используя бычий
50 мкM Fldsq,
0,1 мМ тиаминпирофосфат,
сывороточный альбумин в качестве стандарта.
0,2 мМ CoA, 5 U/мл глюкозооксидазы, 5 U/мл
каталазы, 10 мМ глюкозу, 2 мМ MgSO4, цито
плазматическую фракцию Chl. phaeovibrioides
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
или Cba. limnaeum (100 мкг/мл белка) и 100 мМ
MOPS Tris (pH 7,0). Реакцию инициировали до
Анализ распространенности rnf оперонов сре
бавлением 5 мМ пирувата. Скорость реакции
ди различных фотоавтотрофных организмов.
определяли при 25 °C с помощью спектрофото
BLAST анализ геномов фотоавтотрофных орга
метра Hitachi 557 («Hitachi», Япония) по изме
низмов с фотосинтетическими реакционными
нению концентрации Fldsq (ε577 = 4,4 мМ-1 см-1
центрами I го типа показывает, что гелиобакте
[23]).
рии, цианобактерии и растения не содержат в
При определении Fldred:NAD+ оксидоредук
своих геномах генов rnf оперона. В то же время
тазной (FNO) активности среда измерения со
геномы таких зеленых серных бактерий как Chl.
держала 50 мкM Fldsq, 0,1 мМ тиаминпирофос
phaeovibrioides, Chlorobium limicola, Chlorobium
фат, 5 мМ пируват Tris, 0,2 мМ CoA, 5 U/мл
phaeobacteroides BS1, Chlorobium sp. N1,
глюкозооксидазы, 5 U/мл каталазы, 10 мМ глю
Pelodictyon luteolum, Chloroherpeton thalassium и
козу, 2 мМ MgSO4, цитоплазматическую фрак
различные виды рода Prosthecochloris (CIB 2401,
цию Chl. phaeovibrioides или Cba. limnaeum
ZM_2, V1, GSB1 и HL 130 GSB) содержат пол
(100 мкг/мл белка) и 100 мМ MOPS Tris (pH 7,0).
ный rnf оперон. Продукты генов rnf оперона зе
Эту смесь инкубировали в течение 20 мин,
леных серных бактерий демонстрируют высокое
после чего реакцию инициировали добавлением
сходство с субъединицами RNF комплекса из
1 мМ Tris NAD+. Скорость реакции определяли
Acetobacterium woodii (GenBank: ACR23742-
спектрофотометрически (ε340 = 6,22 мМ-1 см-1)
ACR23747), варьирующее (46-81%) в зависи
при 25 °C. Примесная концентрация Na+ в ко
мости от субъединицы. Оперон rnf зеленых сер
нечной реакционной смеси составляла
ных бактерий (рис. 1, а) в основном характери
~90 мкM. Концентрацию Na+ определяли с
зуется последовательностью генов rnfBCDGEA
БИОХИМИЯ том 84 вып. 11 2019
1736
БЕРЦОВА и др.
[17]. В непосредственной близости от этого опе
продуктов на дорожках 1 и 3 не может быть объ
рона обычно находится ген apbE, продукт кото
яснено амплификацией примесной геномной
рого осуществляет ковалентное присоединение
ДНК и доказывает транскрипцию rnf генов в
FMN к субъединицам RNF [26, 27], т.е. созрева
клетках Chl. phaeovibrioides.
ние этого ферментативного комплекса [28]. Од
Для количественной оценки уровня тран
нако далеко не все представители семейства
скрипции rnf генов была проведена РВ ПЦР с
Chlorobiaceae содержат rnf гены. Так, rnf оперон
использованием 16S рРНК в качестве стандарта.
отсутствует у Chlorobaculum tepidum, Cba. lim
Показано, что в полученных препаратах кДНК
naeum, Chlorobium chlorochromatii и многих дру
Chl. phaeovibrioides соотношение мРНК rnfC/16S
гих зеленых серных бактерий. Интересно отме
рРНК составляет (0,9 ± 0,1) × 10-4. Это значение
тить, что rnf гены в основном присутствуют у
по порядку величины сходно с таковым, полу
морских и отсутствуют у пресноводных зеленых
ченным ранее при исследовании транскрипции
серных бактерий.
гена флаводоксина этой бактерии [23]. Таким
Транскрипция rnf генов в клетках зеленой сер
образом, полученные данные указывают на до
ной бактерии. Для проверки возможности учас
вольно высокий уровень транскрипции rnf ге
тия RNF комплекса в нециклической фотосин
нов в клетках Chl. phaeovibrioides, достаточный
тетической электрон транспортной цепи в ка
для детекции активности RNF комплекса био
честве объекта исследования нами была выбра
химическими методами.
на морская зеленая серная бактерия Chl.
Исследование компартментализации Fldred:
phaeovibrioides DSM 265. Из активно растущих
NAD+ оксидоредуктазной активности в клетках
клеток этой бактерии были выделены препара
Chl. phaeovibrioides. Ранее нами было показано,
ты РНК, на основе которых с помощью обрат
что Fld из Chl. phaeovibrioides может быть гетеро
ной транскрипции и случайных декануклеотид
логически продуцирован в Escherichia coli и вы
ных праймеров были синтезированы препараты
делен в больших количествах из клеток этого
кДНК. Как видно на рис. 1, б, ПЦР анализ пре
микроорганизма [23]. Поэтому мы использова
паратов с использованием специфичных к rnfC
ли именно Fld в качестве субстрата для опреде
и rnfG праймеров показал наличие транскрип
ления активности RNF комплекса и других
тов этих генов в кДНК Chl. phaeovibrioides. Ис
ферредоксин(флаводоксин):NAD+ оксидоре
пользование контрольных образцов, не содер
дуктаз:
жащих ревертазы на этапе синтеза кДНК, не
приводило к наработке ПЦР продуктов (рис. 1, б,
2Fldred- + NAD+ + H+ → 2Fldsq + NADH.
дорожки 2 и 4). Таким образом, наличие ПЦР
Fld выделяется из клеток E. coli в одноэлек
тронно восстановленной (семихинонной) фор
ме (Fldsq) [23], однако мы ранее показали, что
Fldsq может быть частично восстановлен до хи
нольной формы (Fldred) при протекании пиру
ват:ферредоксин(флаводоксин) оксидоредук
тазной (PFOR) реакции:
пируват + CoA + 2Fldsq ↔
↔ ацетил CoA + CO2 + 2Fldred,
катализируемой цитоплазматической фракци
ей, выделенной из клеток Chl. phaeovibrioides
[23]. Как видно из данных, представленных в
табл. 2, значение специфической PFOR актив
Рис. 1. Расположение rnf генов на хромосоме Chl. phaeovib
rioides DSM 265 (а). Показаны гены rnfBCDGEA (GenBank:
ности в этой фракции составляло 5 нмоль пот
ABP36813-ABP36808) и apbE (ABP36807). б - Агарозный
ребленного пирувата × мин-1 × мг белка-1, и это
гель, показывающий амплификацию с кДНК Chl. phaeovib
значение практически не изменялось при до
rioides фрагмента гена rnfC (теоретическая длина 191 п.н.,
дорожка 1) и rnfG (171 п.н., дорожка 3). Дорожки 2 и 4 -
бавлении в среду измерения 10 мМ KCl или
амплификация фрагментов rnfC и rnfG соответственно с
NaCl.
контрольных образцов, не содержащих ревертазы на этапе
Добавление 1 мМ NAD+ в реакционную сре
синтеза кДНК. Дорожка M - ДНК маркер (pUC19/MspI;
ду для измерения PFOR активности цитоплаз
СибЭнзим, Россия). Расположение использованных прай
меров для амплификации rnfC и rnfG показано на рис. 1, a
матической фракции Chl. phaeovibrioides приво
стрелками
дило к его восстановлению до NADH с величи
БИОХИМИЯ том 84 вып. 11 2019
Na+ ТРАНСЛОЦИРУЮЩАЯ ФЕРРЕДОКСИН:NAD+ ОКСИДОРЕДУКТАЗА
1737
Таблица 2. Значения пируват:Fldsq оксидоредуктазной (PFOR) и Fldred:NAD+ оксидоредуктазной (FNO) активностей в
различных препаратах из клеток Chl. phaeovibrioides и Cba. limnaeum1
Активность (нмоль × мин-1 × мг белка-1)
Препарат
PFOR
FNO
без добавок
+ 10 мМ KCl
+ 10 мМ NaCl
без добавок
+ 10 мМ KCl
+ 10 мМ NaCl
Цитоплазмати
5,0
4,8
4,8
0,75
0,6
0,6
ческая фракция
Chl. phaeo
vibrioides
Обедненная
ND2
ND
ND
0,69
0,70
1,7
мембранная
фракция Chl.
phaeovibrioides
Цитоплазмати
2,1
2,0
2,0
0,35
0,27
0,27
ческая фракция
Cba. limnaeum
Обедненная
ND
ND
ND
ND
ND
ND
мембранная
фракция
Cba. limnaeum
1 Представлены результаты типичного эксперимента из трех независимых измерений.
2 Активность не детектировалась.
ной удельной активности 0,75 нмоль образован
деления FNO активности в мембранах этого
ного NADH × мин-1 × мг белка-1 (табл. 2). Эта
микроорганизма.
активность не наблюдалась при исключении из
Добавление обедненной по хлоросомам
реакционной среды пирувата, цитоплазмати
мембранной фракции из Chl. phaeovibrioides к
ческой фракции Chl. phaeovibrioides, NAD+ или
среде измерения PFOR активности, содержа
Fld. Таким образом, можно заключить, что на
щей цитоплазматическую фракцию Chl.
блюдаемое восстановление NAD+ осуществля
phaeovibrioides и 1 мМ NAD+, приводило к уско
лось за счет Fldred:NAD+ оксидоредуктазной ак
рению образования NADH. Также, как и в слу
тивности. Эта активность слегка ингибирова
чае с цитоплазматической фракцией, не на
лась в присутствии 10 мМ NaCl. Данный эффект
блюдалось образования NADH в отсутствии
не был специфичен к Na+, так как наблюдался и
пирувата, NAD+ или Fld. Таким образом, раз
при добавлении такой же концентрации KCl.
ницу между скоростями образования NADH в
Таким образом, наблюдаемое ингибирование
присутствии и при отсутствии мембран прини
FNO активности в цитоплазматической фрак
мали как FNO активность мембранной фрак
ции можно приписать к неспецифическому ос
ции. Как видно из табл. 2, в отличие от цитоп
лаблению электростатического взаимодействия
лазматической фракции, добавление 10 мМ
FNR с Fld при увеличении ионной силы в среде
NaCl приводило к существенному (~2,5×) уве
измерения.
личению активности мембранной фракции.
Исследование FNO активности в тотальной
Эта активация была специфичной по отноше
мембранной фракции Chl. phaeovibrioides спект
нию к Na+, так как она не наблюдалась в при
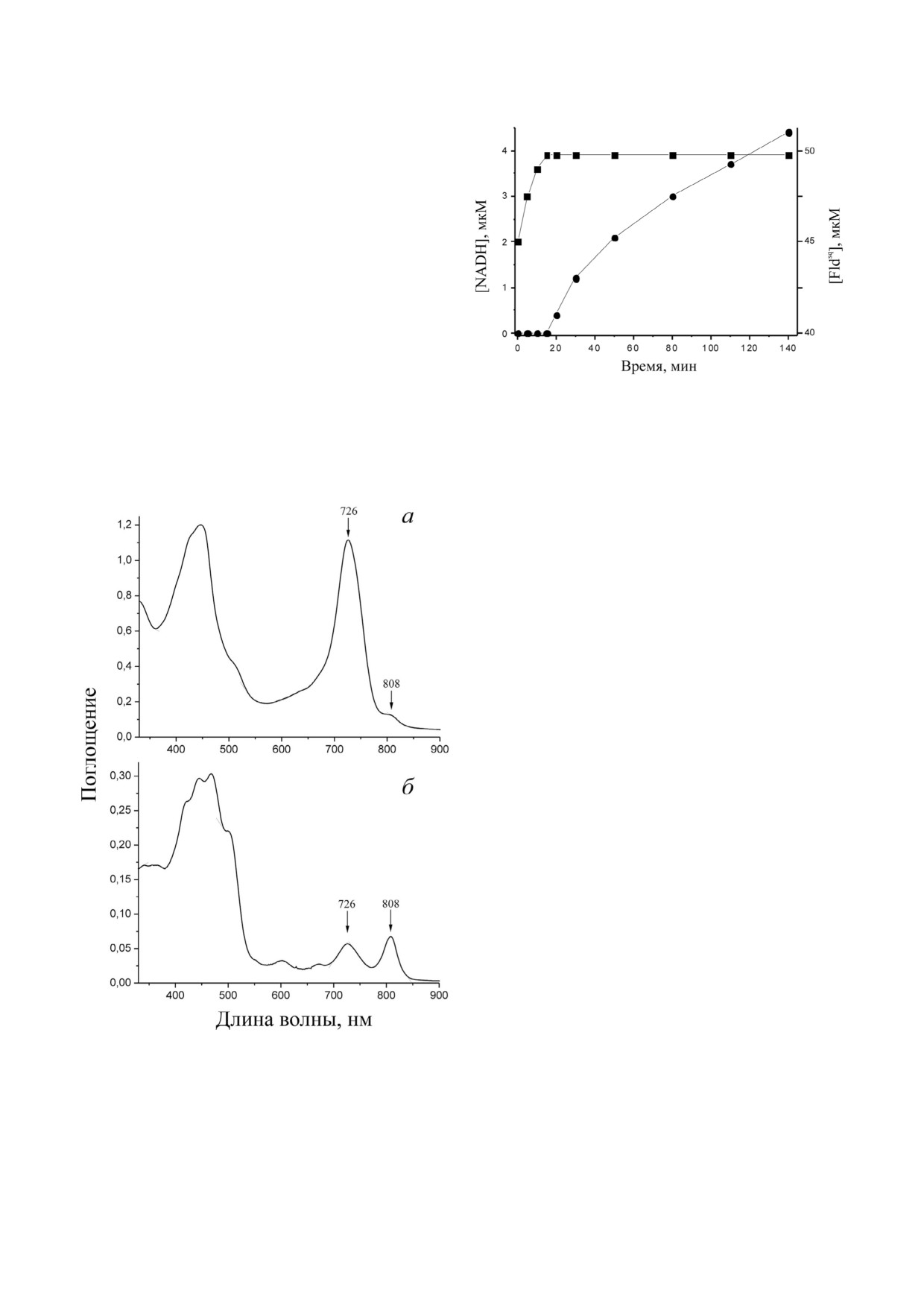
ральными методами оказалось затруднено из за
сутствии 10 мМ KCl. Таким образом, можно
наличия в этой фракции хлоросом, содержащих
предположить, что наблюдаемая FNO актив
гигантское количество бактериохлорофилла
ность в мембранной фракции Chl. phaeovibrio
[29], закрывающего весь оптический диапазон
ides осуществляется за счет Na+ зависимой ак
(рис. 2, а). Поэтому с помощью дифференци
тивности RNF комплекса. Важно отметить,
ального центрифугирования из клеток Chl.
что величина FNO активности в мембранной
phaeovibrioides была выделена обедненная по со
фракции была сопоставима с таковой в цито
держанию хлоросом мембранная фракция
плазматической фракции, что позволяет зак
(рис. 2, б), которая и была использована для опре
лючить, что активность RNF составляет сущест
БИОХИМИЯ том 84 вып. 11 2019
1738
БЕРЦОВА и др.
венную часть тотальной FNO активности в
клетках Chl. phaeovibrioides.
Исследование Fldred:NAD+ оксидоредуктазной
активности в клетках Cba. limnaeum. Утвержде
ние о том, что восстановление NAD+ в мембра
нах Chl. phaeovibrioides осуществляется за счет
активности RNF комплекса, было бы важно
проверить с помощью сайт направленного му
тагенеза. Однако для Chl. phaeovibrioides еще не
разработаны методики генных манипуляций.
Поэтому для проверки участия RNF в восста
новлении NAD+ мы в качестве контроля ис
пользовали близкородственную Chl. phaeovibri
oides зеленую серную бактерию Cba. limnaeum,
геном которой не содержит rnf генов (см. вы
Рис. 3. Фотовосстановление NAD+ (кружки, левая ось) и
ше). Как видно из табл. 2, цитоплазматическая
флаводоксина (квадраты, правая ось) обедненной по хло
фракция Cba. limnaeum демонстрировала спо
росомам мембранной фракцией из Chl. phaeovibrioides
собность к катализу FNO реакции, что под
тверждает вывод о том, что эта активность осу
ществляется за счет отличной от RNF водораст
воримой ферредоксин NAD(P)+ редуктазы. В то
же время, обедненная по хлоросомам мембран
ная фракция Cba. limnaeum не демонстрировала
FNO активности, что, хоть и косвенно, указыва
ет на участие RNF в катализе этой реакции в
случае мембранной фракции Chl. phaeovibrioides.
Фотовосстановление NAD+ мембранной фрак
цией клеток Chl. phaeovibrioides. Основной функ
цией RNF в клетках Chl. phaeovibrioides, по ви
димому, является восстановление NAD+ при
функционировании фотосинтетической элек
трон транспортной цепи. Для проверки этого
предположения была исследована возможность
светозависимого восстановления NAD+ обед
ненной по хлоросомам мембранной фракцией
из этой бактерии в присутствии Fld. Как показа
но ранее [23], выделенный из клеток E. coli Fld
находится в основном в семихинонной форме
(Fldsq) с небольшой примесью (8-10%) окислен
ной формы (Fldox). Освещение анаэробной сус
пензии мембранной фракции Chl. phaeovibrioides
в присутствии Fld, NAD+ и высокопотенциаль
ного донора электронов (β меркаптоэтанола) в
течение первых 15 мин приводило к фотовосста
новлению примесного Fldox до Fldsq (рис. 3). Эта
реакция не сопровождалась восстановлением
NAD+. После полного восстановления Fld
до Fldsq дальнейшего восстановления Fld
(Fldsq → Fldred) не наблюдалось. Однако после
дующее освещение приводило к восстановле
нию NAD+ с начальной скоростью ~0,7 нмоль
Рис. 2. Оптические спектры тотальной (а) и обедненной по
образованного NADH × мин-1 × мг белка-1. Об
хлоросомам (б) мембранных фракций Chl. phaeovibrioides
разования NADH не наблюдали в контрольных
при концентрации белка 0,19 и 0,25 мг/мл соответственно.
опытах при отсутствии света или Fld. Также све
Цифрами указаны максимумы поглощения бактериохло
тозависимого восстановления NAD+ не наблю
рофилла хлоросом (726 нм), а также белка Фенна-
Мэтьюс-Олсона (FMO белка) и антенны реакционного
дали в случае использования обедненной по
комплекса (808 нм)
хлоросомам мембранной фракции из клеток не
БИОХИМИЯ том 84 вып. 11 2019
Na+ ТРАНСЛОЦИРУЮЩАЯ ФЕРРЕДОКСИН:NAD+ ОКСИДОРЕДУКТАЗА
1739
содержащей RNF бактерии Cba. limnaeum (дан
за счет функционирования Na+ транслоцирую
ные не представлены). Таким образом, получен
щей ферредоксин:NAD+ оксидоредуктазы.
ные данные позволяют заключить, что RNF мо
У зеленых серных бактерий функционирова
жет участвовать в образовании NADH при
ние нециклической фотосинтетической элек
функционировании фотосинтетической элект
трон транспортной цепи приводит к свето инду
рон транспортной цепи Chl. phaeovibrioides.
цируемому переносу электронов от восстанов
ленных соединений серы к Fd (Fld) [31]. Ассими
ляция CO2
у этих микроорганизмов осуществля
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ется посредством восстановительного цикла три
карбоновых кислот, где низкопотенциальный Fd
В ходе данной работы проведен поиск генов
(Fld) непосредственно выступает в качестве вос
rnf оперона, кодирующего Na+ транслоцирую
становителя в пируват синтазной и α кетоглута
щую ферредоксин:NAD+ оксидоредуктазу, сре
рат синтазной реакциях [32]. Однако в малатде
ди фотоавтотрофных организмов с фотосинте
гидрогеназной и изоцитратдегидрогеназной ре
тическими реакционными центрами типа I.
акциях этого цикла в качестве восстановителя
Проведенный поиск показал, что rnf гены отсут
используется NADH. Поэтому в клетках зеленых
ствуют у гелиобактерий, цианобактерий и рас
серных бактерий часть Fdred (Fldred) должна быть
тений. В то же время rnf оперон присутствует в
направлена на восстановление NAD+, что может
геномах многих, но не всех, зеленых серных
быть осуществлено, по крайней мере частично,
бактерий. Присутствие rnf оперона наблюдает
за счет активности RNF (рис. 4). В соответствии
ся, прежде всего, у морских представителей
с этим показано, что освещение мембран Chl.
Chlorobiaceae, то есть коррелирует с повышен
phaeovibrioides приводит к свето индуцированно
ной концентрацией Na+ в среде обитания. Ана
му образованию NADH (рис. 3).
лиз экспрессии выявил относительно высокий
Таким образом, в условиях in vivo поток
уровень содержания транскриптов этих генов в
электронов по фотосинтетической электрон
препаратах РНК, выделенных из морской зеле
транспортной цепи зеленых серных бактерий
ной серной бактерии Chl. phaeovibrioides, что
должен частично проходить через RNF, что бу
указывает на то, что rnf гены у этого микроорга
дет приводить к дополнительному запасанию
низма не являются «молчащими» или псевдоге
энергии в форме трансмембранного Na+ потен
нами.
циала (рис. 4). Fd и Fld зеленых серных бакте
Исследование FNO активности в различных
рий характеризуются очень низкими значения
фракциях клеток Chl. phaeovibrioides показало,
что у этой бактерии детектируются по крайней
мере две различные Fldred:NAD+ оксидоредук
тазы. Одна из них обнаруживается в цитоплаз
матической фракции, и ее активность не стиму
лируется при увеличении концентрации Na+.
Вторая Fldred:NAD+ оксидоредуктаза ассоции
рована с мембранами, и ее активность специфи
чески активируется под действием Na+. В клет
ках близкородственной Chl. phaeovibrioides прес
новодной зеленой серной бактерии Cba. lim
naeum, чей геном не содержит rnf оперона, об
наруживается лишь Na+ независимая цитоплаз
матическая Fldred:NAD+ оксидоредуктаза.
В соответствии с полученными ранее данны
ми [14, 30] можно предположить, что Na+ неза
висимая цитоплазматическая FNO активность
осуществляется FNR, ген которой присутствует
в геномах Chl. phaeovibrioides (GenBank:
ABP37348.1) и Cba. limnaeum (AOS83202.1). Так
как вторая FNO активность, обнаруживаемая в
мембранной фракции Chl. phaeovibrioides,
(i) специфически стимулируется ионами Na+,
Рис. 4. Схема фотовосстановления NAD(P)+. PRC - фото
(ii) осуществляется мембрансвязанным фермен
синтетический реакционный центр, RNF - Na+ трансло
том и (iii) отсутствует у Cba. limnaeum, можно
цирующая ферредоксин:NAD+ оксидоредуктаза, FNR -
заключить, что эта активность осуществляется
водорастворимая ферредоксин NAD(P)+ редуктаза
БИОХИМИЯ том 84 вып. 11 2019
1740
БЕРЦОВА и др.
ми их среднеточечных окислительно восстано
перенос электронов с Fd (Fld) на NADP+ осущест
вительных потенциалов (-514 и -584 мВ для
вляется исключительно несопряженной FNR.
ферредоксинов I и II из Cba. tepidum соответ
По видимому, это может быть связано с окси
ственно [33]; -530 мВ для перехода Fldsq/Fldred в
генным характером фотосинтеза цианобактерий
Fld из Chl. phaeovibrioides [23]). Таким образом,
и растений, что приводит к насыщению кисло
перепад окислительно восстановительного по
родом цитоплазмы и стромы хлоропластов этих
тенциала при катализируемом RNF переносе
организмов соответственно. Функционирова
электронов от этих низкопотенциальных пере
ние RNF требует, чтобы существенная часть Fd
носчиков к паре NAD+/NADH (-320 мВ) доста
(Fld) находилась в восстановленном состоянии
точен для трансмембранной транслокации Na+
(так как только в этом случае будет достаточный
со стехиометрией
1 Na+/e-. Стехиометрия
перепад окислительно восстановительного по
трансмембранного переноса Na+ для RNF неиз
тенциала для трансмембранной транслокации
вестна, однако сходная по строению с RNF Na+
Na+), что в условиях высокой концентрации O2
транслоцирующая NADH:хинон оксидоредук
должно приводить к интенсивной продукции
таза [4] обладает именно такой эффективностью
активных форм кислорода и повреждению клет
сопряжения (1 Na+/e-) [34].
ки. В то же время использование несопряжен
Интересно отметить, что RNF, по видимому,
ной FNR, по видимому, позволяет цианобакте
не является единственным Na+ транслоцирую
риям и растениям поддерживать очень низкий
щим ферментом в цитоплазматической мембра
стационарный уровень восстановленности Fd
не Chl. phaeovibrioides. Анализ генома этого мик
(Fld) и таким образом минимизировать образо
роорганизма показывает, что он содержит гены
вание активных форм кислорода [35]. Поэтому,
еще трех Na+ помп: Na+ транслоцирующей ок
возможно, именно облигатно анаэробный образ
салоацетат
декарбоксилазы
(GenBank:
жизни зеленых серных бактерий позволяет им
ABP37031-ABP37033), Na+ транслоцирующей
использовать RNF при функционировании фо
метилмалонил CoA(глютаконил CoA) декар
тосинтетической электрон транспортной цепи.
боксилазы (ABP37260-ABP37263) и Na+ пиро
Альтернативным объяснением применения
фосфатазы (ABP36773). Однако ATP синтаза
RNF именно у зеленых серных бактерий может
Chl. phaeovibrioides, исходя из аминокислотной
быть необычная для фотоавтотрофных организ
последовательности ее c субъединицы, по ви
мов среда обитания этих бактерий, характеризу
димому, является потребителем протонного, а
ющаяся очень низкой интенсивностью света
не натриевого потенциала. Поэтому трансмем
[29, 36]. В связи с этим, т.е. с существенным ли
бранный натриевый потенциал, сформиро
митированием роста источником энергии, зада
ванный RNF и другими Na+ помпами Chl.
ча повышения эффективности преобразования
phaeovibrioides, скорее всего, используется не для
энергии света стоит перед зелеными серными
синтеза ATP, а для совершения осмотической
бактериями наиболее остро, что, возможно, и
работы, т.е. для трансмембранного транспорта
привело к использованию некоторыми из них
веществ против градиента их концентрации. В
Na+ транслоцирующей ферредоксин:NAD+ ок
соответствии с этим геном Chl. phaeovibrioides
сидоредуктазы. Отсутствие RNF у гелиобакте
содержит большое количество Na+:субстрат
рий, обладающих аноксигенным фотосинтезом,
симпортеров (например, GenBank: ABP37286,
но способных к фототрофному росту лишь при
ABP37377, ABP36564, ABP36752, ABP36793,
высокой интенсивности света [37], может вы
ABP36820 и ABP37661). Возможно, образован
ступать в поддержку именно этого объяснения.
ный RNF натриевый потенциал может быть
опосредованно использован и для синтеза ATP,
В ходе данной работы показано, что RNF
так как геном Chl. phaeovibrioides содержит гены
может принимать участие в процессе синтеза
Na+/H+ антипортера (ABP37269-ABP37275),
NADH у некоторых зеленых серных бактерий,
позволяющего преобразовывать натриевый
что должно повышать эффективность преобра
трансмембранный потенциал в протонный.
зования энергии света и является первым при
Остается непонятным, почему возмож
мером использования Na+ энергетики в фото
ностью повысить эффективность преобразова
синтетических электрон транспортных цепях.
ния энергии света за счет функционирования
RNF воспользовалась лишь небольшая часть
фототрофных организмов с фотосинтетически
Финансирование. Работа выполнена при фи
ми реакционными центрами I го типа (некото
нансовой поддержке Российского научного
рые представители зеленых серных бактерий),
фонда (грант № 19 14 00063).
тогда как у подавляющего большинства из них
Благодарности. Авторы выражают призна
(прежде всего - у цианобактерий и растений)
тельность О.И. Кеппен и Р.Н. Ивановскому за
БИОХИМИЯ том 84 вып. 11 2019
Na+ ТРАНСЛОЦИРУЮЩАЯ ФЕРРЕДОКСИН:NAD+ ОКСИДОРЕДУКТАЗА
1741
обсуждение и за предоставление культуры Cba.
Соблюдение этических норм. Настоящая
limnaeum. Мы также благодарны В.А. Костырко
статья не содержит каких либо исследований с
за ценные замечания.
участием животных или людей в качестве объек
Конфликт интересов. Авторы заявляют, что у
тов исследований.
них нет конфликта интересов.
СПИСОК ЛИТЕРАТУРЫ
1.
Skulachev, V.P., Bogachev, A.V., and Kasparinsky, F.O.
of nitrogen fixation genes in Rhodobacter capsulatus: a
(2013) Principles of Bioenergetics, Springer, doi: 10.1007/
putative membrane complex involved in electron transport
978 3 642 33430 6.
to nitrogenase, Mol. Gen. Genet.,
241,
602-615,
2.
Dimroth, P., Jockel, P., and Schmid, M. (2001) Coupling
doi: 10.1007/BF00279903.
mechanism of the oxaloacetate decarboxylase Na+ pump,
16.
Westphal, L., Wiechmann, A., Baker, J., Minton, N.P., and
Biochim. Biophys. Acta, 1505, 1-14, doi: 10.1016/S0005
Muller, V. (2018) The Rnf complex is an energy coupled
2728(00)00272 3.
transhydrogenase essential to reversibly link cellular
3.
Unemoto, T., and Hayashi, M. (1979) NADH:quinone
NADH and ferredoxin pools in the acetogen
oxidoreductase as a site of Na+ dependent activation in the
Acetobacterium woodii, J. Bacteriol., 200, e00357 18,
respiratory chain of marine Vibrio alginolyticus,
doi: 10.1128/JB.00357 18.
J. Biochem., 85, 1461-1467.
17.
Biegel, E., Schmidt, S., Gonzalez, J.M., and Muller, V.
4.
Verkhovsky, M.I., and Bogachev, A.V. (2010) Sodium
(2011) Biochemistry, evolution and physiological function
translocating NADH:quinone oxidoreductase as a redox
of the Rnf complex, a novel ion motive electron transport
driven ion pump, Biochim. Biophys. Acta, 1797, 738-746,
complex in prokaryotes, Cell. Mol. Life Sci., 68, 613-634,
doi: 10.1016/j.bbabio.2009.12.020.
doi: 10.1007/s00018 010 0555 8.
5.
Gottschalk, G., and Thauer, R.K. (2001) The Na+ translo
18.
Muller, V., Imkamp, F., Biegel, E., Schmidt, S., and
cating methyltransferase complex from methanogenic
Dilling, S. (2008) Discovery of a ferredoxin:NAD+ oxi
archaea, Biochim. Biophys. Acta,
1505,
28-36,
doreductase (Rnf) in Acetobacterium woodii. A novel poten
doi: 10.1016/S0005 2728(00)00274 7.
tial coupling site in acetogens, Ann. N. Y. Acad. Sci., 1125,
6.
Heefner, D.L., and Harold, F.M. (1982) ATP driven sodi
137-146, doi: 10.1196/annals.1419.011.
um pump in Streptococcus faecalis, Proc. Natl. Acad. Sci.
19.
Chowdhury, N.P., Klomann, K., Seubert, A., and Buckel, W.
USA, 79, 2798-2802, doi: 10.1073/pnas.79.9.2798.
(2016) Reduction of flavodoxin by electron bifurcation and
7.
Kluge, C., Laubinger, W., and Dimroth, P. (1992) The
sodium ion dependent reoxidation by NAD+ catalyzed by
Na+ translocating ATPase of Propionigenium modestum,
ferredoxin NAD+ reductase (Rnf), J. Biol. Chem., 291,
Biochem.
Soc.
Trans.,
20,
572-577,
11993-12002, doi: 10.1074/jbc.M116.726299.
doi: 10.1042/bst0200572.
20.
Curatti, L., Brown, C.S., Ludden, P.W., and Rubio, L.M.
8.
Muntyan, M.S., Cherepanov, D.A., Malinen, A.M.,
(2005) Genes required for rapid expression of nitrogenase
Bloch, D.A., Sorokin, D.Y., Severina, I.I., Ivashina, T.V.,
activity in Azotobacter vinelandii, Proc. Natl. Acad. Sci.
Lahti, R., Muyzer, G., and Skulachev, V.P.
(2015)
USA, 102, 6291-6296, doi: 10.1073/pnas.0501216102.
Cytochrome cbb3 of Thioalkalivibrio is a Na+ pumping
21.
Koo, M.S., Lee, J.H., Rah, S.Y., Yeo, W.S., Lee, J.W.,
cytochrome oxidase, Proc. Natl. Acad. Sci. USA, 112,
Lee, K.L., Koh, Y.S., Kang, S.O., and Roe, J.H. (2003) A
7695-7700, doi: 10.1073/pnas.1417071112.
reducing system of the superoxide sensor SoxR in
9.
Malinen, A.M., Belogurov, G.A., Baykov, A.A., and Lahti, R.
Escherichia coli, EMBO J., 22, 2614-2622, doi: 10.1093/
(2007) Na+ pyrophosphatase: a novel primary sodium
emboj/cdg252.
pump, Biochemistry,
46,
8872-8878, doi:
10.1021/
22.
Malik, K.A. (1983) A modified method for the cultivation
bi700564b.
of phototrophic bacteria, J. Microbiol. Methods, l,
10.
Inoue, K., Ono, H., Abe Yoshizumi, R., Yoshizawa, S.,
343-352, doi: 10.1016/S0167 7012(96)00941 4.
Ito, H., Kogure, K., and Kandori, H. (2013) A light driven
23.
Bertsova, Y.V., Kulik, L.V., Mamedov, M.D., Baykov, A.A.,
sodium ion pump in marine bacteria, Nat. Commun., 4,
and Bogachev, A.V. (2019) Flavodoxin with an air stable
1678, doi: 10.1038/ncomms2689.
flavin semiquinone in a green sulfur bacterium, Photosynth.
11.
Skulachev, V.P. (1989) The sodium cycle: a novel type of
Res., in press, doi: 10.1007/s11120 019 00658 1.
bacterial energetics, J. Bioenerg. Biomembr., 21, 635-647,
24.
Klughammer, C., Hager, C., Padan, E., Schütz, M.,
doi: 10.1007/BF00762683.
Schreiber, U., Shahak, Y., and Hauska, G.
(1995)
12.
Mulkidjanian, A.Y., Dibrov, P., and Galperin, M.Y. (2008)
Reduction of cytochromes with menaquinol and sulfide in
The past and present of the sodium energetics: May the
membranes from green sulfur bacteria, Photosynth. Res.,
sodium motive force be with you, Biochim. Biophys. Acta,
43, 27-34, doi: 10.1007/BF00029459.
1777, 985-992, doi: 10.1016/j.bbabio.2008.04.028.
25.
Smith, P.K., Krohn, R.I., Hermanson, G.T., Mallia, A.K.,
13.
Carrillo, N., and Ceccarelli, E.A. (2003) Open questions in
Gartner, F.H., Provenzano, M.D., Fujimoto, E.K., Goeke,
ferredoxin NADP+ reductase catalytic mechanism, Eur. J.
N.M., Olson, B.J., and Klenk, D.C. (1985) Measurement
Biochem., 270, 1900-1915, doi: 10.1046/j.1432 1033.
of protein using bicinchoninic acid, Anal. Biochem., 150,
2003.03566.x.
76-85, doi: 10.1016/0003 2697(85)90442 7.
14.
Seo, D., and Sakurai, H. (2002) Purification and charac
26.
Bertsova, Y.V., Fadeeva, M.S., Kostyrko, V.A.,
terization of ferredoxin NAD(P)+ reductase from the
Serebryakova, M.V., Baykov, A.A., and Bogachev, A.V.
green sulfur bacterium Chlorobium tepidum, Biochim.
(2013) Alternative pyrimidine biosynthesis protein ApbE is
Biophys. Acta, 1597, 123-132, doi: 10.1016/S0167
a flavin transferase catalyzing covalent attachment of FMN
4838(02)00269 8.
to a threonine residue in bacterial flavoproteins, J. Biol.
15.
Schmehl, M., Jahn, A., Meyer zu Vilsendorf, A.,
Chem., 288, 14276-14286, doi: 10.1074/jbc.M113.455402.
Hennecke, S., Masepohl, B., Schuppler, M., Marxer, M.,
27.
Deka, R.K., Brautigam, C.A., Liu, W.Z., Tomchick, D.R.,
Oelze, J., and Klipp, W. (1993) Identification of a new class
and Norgard, M.V. (2016) Molecular insights into the
БИОХИМИЯ том 84 вып. 11 2019
1742
БЕРЦОВА и др.
enzymatic diversity of flavin trafficking protein (Ftp; for
33. Yoon, K.S., Bobst, C., Hemann, C.F., Hille, R., and
merly ApbE) in flavoprotein biogenesis in the bacterial
Tabita, F.R. (2001) Spectroscopic and functional proper
periplasm, Microbiologyopen, 5, 21-38, doi: 10.1002/
ties of novel 2[4Fe 4S] cluster containing ferredoxins from
mbo3.306.
the green sulfur bacterium Chlorobium tepidum, J. Biol.
28.
Bogachev, A.V., Baykov, A.A., and Bertsova, Y.V. (2018)
Chem., 276, 44027-44036, doi: 10.1074/jbc.M107852200.
Flavin transferase: the maturation factor of flavin contain
34. Bogachev, A.V., Murtasina, R.A., and Skulachev, V.P. (1997)
ing oxidoreductases, Biochem. Soc. Trans., 46, 1161-1169,
The Na+/e- stoichiometry of the Na+ motive NADH:
doi: 10.1042/BST20180524.
quinone oxidoreductase in Vibrio alginolyticus, FEBS Lett.,
29.
Saer, R.G., and Blankenship, R.E. (2017) Light harvesting
409, 475-477, doi: 10.1016/S0014 5793(97)00536 X.
in phototrophic bacteria: structure and function, Biochem.
35. Kozuleva, M.A., and Ivanov, B.N. (2016) The mechanisms
J., 474, 2107-2131, doi: 10.1042/BCJ20160753.
of oxygen reduction in the terminal reducing segment of
30.
Frigaard, N.U., Chew, A.G., Li, H., Maresca, J.A., and
the chloroplast photosynthetic electron transport chain,
Bryant, D.A. (2003) Chlorobium tepidum: insights into the
Plant Cell Physiol., 57, 1397-1404, doi: 10.1093/pcp/
structure, physiology, and metabolism of a green sulfur
pcw035.
bacterium derived from the complete genome sequence,
36. Manske, A.K., Glaeser, J., Kuypers, M.M., and
Photosynth. Res., 78, 93-117, doi: 10.1023/B:PRES.
Overmann, J. (2005) Physiology and phylogeny of green
0000004310.96189.b4.
sulfur bacteria forming a monospecific phototrophic
31.
Hauska, G., Schoedl, T., Remigy, H., and Tsiotis, G.
assemblage at a depth of 100 meters in the Black Sea, Appl.
(2001) The reaction center of green sulfur bacteria,
Environ. Microbiol., 71, 8049-8060, doi: 10.1128/AEM.
Biochim. Biophys. Acta, 1507, 260-277, doi: 10.1016/
71.12.8049 8060.2005.
S0005 2728(01)00200 6.
37. Gest, H., and Favinger, J.L. (1983) Heliobacterium chlo
32.
Buchanan, B.B., and Arnon, D.I. (1990) A reverse KREBS
rum, an anoxygenic brownish green photosynthetic bac
cycle in photosynthesis: consensus at last, Photosynth. Res.,
terium containing a “new” form of bacteriochlorophyll,
24, 47-53, doi: 10.1007/BF00032643.
Arch. Microbiol., 136, 11-16, doi: 10.1007/BF00415602.
Na+ TRANSLOCATING FERREDOXIN:NAD+ OXIDOREDUCTASE
IS A COMPONENT OF PHOTOSYNTHETIC ELECTRON
TRANSPORT CHAIN IN GREEN SULFUR BACTERIA
Y. V. Bertsova*, M. D. Mamedov, and A. V. Bogachev*,**
Belozersky Institute of Physico Chemical Biology, Lomonosov Moscow State University,
119234 Moscow, Russia; E mail: bogachev@belozersky.msu.ru
Received May 20, 2019
Revised July 5, 2019
Accepted July 7, 2019
Photoautotrophic organisms containing type I photosynthetic reaction centers have been screened for the presence of
the rnf genes encoding Na+ translocating ferredoxin:NAD+ oxidoreductase (RNF). Heliobacteria, cyanobacteria,
algae, and plants were shown to lack these genes, but genomes of many, especially marine, green sulfur bacteria con
tain the full rnf operon. The analysis of RNA isolated from the marine green sulfur bacterium Chlorobium phaeovibri
oides revealed rather high level of rnf expression. It has been found that Na+ dependent flavodoxin:NAD+ oxidore
ductase activity detected in the membrane fraction from this bacterium is absent in the membrane fraction isolated
from the closely related freshwater green sulfur bacterium Chlorobaculum limnaeum, which does not contain the rnf
gene. Illumination of the Chl. phaeovibrioides (but not Cba. limnaeum) membrane fraction leads to the light induced
NAD+ reduction. Based on the data obtained, we conclude that RNF can be involved in NAD+ reduction in some
green sulfur bacteria, thus promoting the efficiency of light energy conversion in these microorganisms. This is the
first example of using Na+ energetics in photosynthetic electron transport chains.
Keywords: Na+ translocating ferredoxin:NAD+ oxidoreductase, transmembrane sodium transport, green sulfur bac
teria, non cyclic photosynthetic electron transport
БИОХИМИЯ том 84 вып. 11 2019