БИОХИМИЯ, 2019, том 84, вып. 12, с. 1839 - 1853
УДК 576.36; 576.32.36
ФЕНОМЕН ФРАГМЕНТАЦИИ АППАРАТА ГОЛЬДЖИ:
ПОЧЕМУ СТРУКТУРА ЭТОЙ ОРГАНЕЛЛЫ ТАК ВАЖНА?
Обзор
© 2019
A. Петросян1,2,3
1 Department of Biochemistry and Molecular Biology, College of Medicine,
University of Nebraska Medical Center, Omaha, NE, USA; E mail: apetrosyan@unmc.edu
2 The Nebraska Center for Integrated Biomolecular Communication, Lincoln, NE, USA
3 The Fred and Pamela Buffett Cancer Center, Omaha, NE, USA
Поступила в редакцию 26.05.2019
После доработки 10.07.2019
Принята к публикации 16.08.2019
Аппарат Гольджи является динамичной органеллой, которая расположена в перинуклеарной области и иг
рает ключевую роль в регуляции клеточного гомеостаза. В то время как посттрансляционная модификация
белков обеспечивается резидентными ферментами Гольджи (гликозилтрансферазы, гликозидазы и кина
зы), лентообразная структура Гольджи и его способность образовывать стопку дискообразных цистерн во
многом определяются матриксными белками гольджинами. Среди них джиантин, GM130 и GRASP65 явля
ются уникальными, поскольку формируют тройной комплекс, обеспечивающий стыковку на поверхности
Гольджи везикул, движущихся из эндоплазматического ретикулума (ЭР). Гольджи подвергается структур
ной дезорганизации при ряде патологий, которые объединяет нарушение транспортного сообщения между
ЭР и Гольджи: рак, различные неврологические заболевания, включая болезни Альцгеймера, Паркинсона и
эпилепсию, алкогольные заболевания печени, ишемический стресс и вирусные инфекции. Гольджи также
дезорганизуется во время митоза и апоптоза. В данном обзоре мы анализируем результаты работ, которые
демонстрируют, что фрагментация Гольджи приводит не только к избирательной потере резидентных фер
ментов, но также и к переходу некоторых белков из цитоплазмы в Гольджи. Мы предлагаем новую концеп
цию, постулирующую, что стрессы ЭР и Гольджи разрушают стыковочный сайт джиантина, но не оказыва
ют существенного влияния на комплекс GM130-GRASP65, тем самым вызывая переход джиантин зависи
мых ферментов из Гольджи в цитоплазму. Это приводит к значительным изменениям в постсинтетической
модификации белков: отныне процессинг карго во многом определяется вкладом GM130-GRASP65 зави
симых ферментов, которые остаются в Гольджи, несмотря на его дезорганизацию. Немалую роль играют и
«гостевые» ферменты, которых в норме нет в Гольджи, но из за отсутствия джиантина они оказываются
способны к стыковке на мембранах Гольджи. Индуцированное нарушение цитоскелета также вызывает
фрагментацию Гольджи, но не приводит ни к нарушению структуры гольджинов, ни к блокировке внутри
клеточной транспортировки.
КЛЮЧЕВЫЕ СЛОВА: морфология Гольджи, гольджины, джиантин, GM130, GRASP65, резидентные энзи
мы Гольджи, ЭР стресс.
DOI: 10.1134/S032097251912008X
За последние три десятилетия структура и
и киназ. В нормальных физиологических усло
функции аппарата Гольджи стали объектом
виях Гольджи расположен в околоядерной об
пристального внимания в биомедицинских ис
ласти и образует витиеватую лентообразную
следованиях. Гольджи - это центральная сорти
структуру, состоящую из стопок нескольких
ровочная и транспортная станция, отвечающая
цистерн и связанных с ними везикул. В Гольджи
за посттрансляционную модификацию молекул
выделяют четыре отдела: прилежащую к эндо
карго, которая обеспечивается резидентными
плазматическому ретикулуму (ЭР) сеть цис
ферментами Гольджи: различными представите
Гольджи, именуемую также пре Гольджи, затем
лями семейств гликозилтрансфераз, гликозидаз
непосредственно цис отдел, срединный (меди
альный) Гольджи, завершающийся самыми от
даленными от ядра цистернами транс Гольджи
Принятые сокращения: ЭР - эндоплазматический
и мембранами его сети. Впоследствии стало яс
ретикулум; ЭР стресс - стресс эндоплазматического рети
кулума; COPI - коатомерный белковый комплекс; БФА -
но, что помимо обработки белков Гольджи так
брефелдин А.
же участвует в различных интегрированных кле
1839
1840
ПЕТРОСЯН
точных процессах, таких как митоз, апоптоз,
имущественно освещаем многочисленные сви
стресс, аутофагия и канцерогенез [1-5]. Многие
детельства атипического расположения цито
из этих внутриклеточных явлений ассоцииру
плазматических и резидентных белков Гольджи,
ются с перестройкой морфологии Гольджи - от
вызванного периферической фрагментацией
ее умеренного расширения до существенного
Гольджи.
раскрытия и фрагментации. Например, как мы
описали ранее [6], обработка этанолом клеток
VA 13 (клетки HepG2, экспрессирующие алко
ГОЛЬДЖИНЫ: БОЛЬШЕ, ЧЕМ ПРОСТО
гольдегидрогеназу) приводит к расширению
«ПОДМОСТКИ» ГОЛЬДЖИ
мембран Гольджи уже после первых 24 ч, а по
истечении 72 ч эта органелла принимает фраг
Матриксные белки Гольджи, называемые
ментированный фенотип (рис. 1). Определение
гольджинами, формируют морфологические
степени фрагментации Гольджи основано на
«подмостки» этой органеллы, тем самым под
расчетах, которые мы использовали как ранее
держивая ее архитектуру. Большинство этих
[7], так и в данном обзоре для анализа результа
белков образуют димеры, чьи структурные мо
тов, представленных другими лабораториями.
тивы представлены спиральными катушками, в
Вкратце, клетку разделяют на три овальные об
которых альфа спирали намотаны вместе, как
ласти: ядерную (A), околоядерную (перинукле
пряди веревок. Они прикрепляются к мембра
арную, B) и цитоплазматическую (C). За цито
нам Гольджи через свои С концевые домены, а
плазматическую область принимается две трети
N концевые остатки могут простираться
той части клетки, которая остается после вычи
внутрь цитоплазмы до 400 нм [10]. Функция
тания ядерной области (2/3 (В + С)), в то время
гольджинов координируется с помощью белков
как одна треть этой суммы (1/3 (В + С)) обозна
семейства GRASP (Golgi reassembly stacking
чается как перинуклеарная область, где и распо
proteins), отвечающих за связь цистерн в стоп
лагается Гольджи. Таким образом, мы считаем
ках Гольджи [11]. Среди гольджинов и GRASP
Гольджи фрагментированным, если его отделив
наиболее изученными являются джиантин,
шиеся мембраны обнаружены за пределами пе
GM130 и GRASP65. Джиантин - это димерный
ринуклеарной области. Подобный тип дезорга
гольджин с наибольшим молекулярным весом
низации некоторые авторы называют перифе
(376 кДа), чей N концевой цитоплазматичес
рической фрагментацией Гольджи, в отличие от
кий домен (≥ 350 кДа) занимает почти весь объ
ее центральной формы, при которой стопки
ем белка [12]. Джиантин распределен на всем
цистерн Гольджи теряют свою складчатость, но
протяжении цистерн Гольджи, однако преиму
все же располагаются в пределах околоядерного
щественно расположен в его срединных отде
пространства [8, 9]. В данном обзоре мы пре
лах [13, 14]. GM130 - это расположенный в
Рис. 1. Степень изменений морфологии комплекса Гольджи в клетках VA 13 - компактная структура в контрольных клет
ках принимает форму расширенной и фрагментированной после 24 и 72 часовой обработки 35 мМ этанолом соответ
ственно. Обращает на себя внимание то, что расширенный Гольджи, в отличие от фрагментированного, по прежнему со
храняет связанность своих мембран.
biokhsm/
БИОХИМИЯ том 84 вып. 12 2019
СТРЕСС И ФРАГМЕНТАЦИЯ АППАРАТА ГОЛЬДЖИ
1841
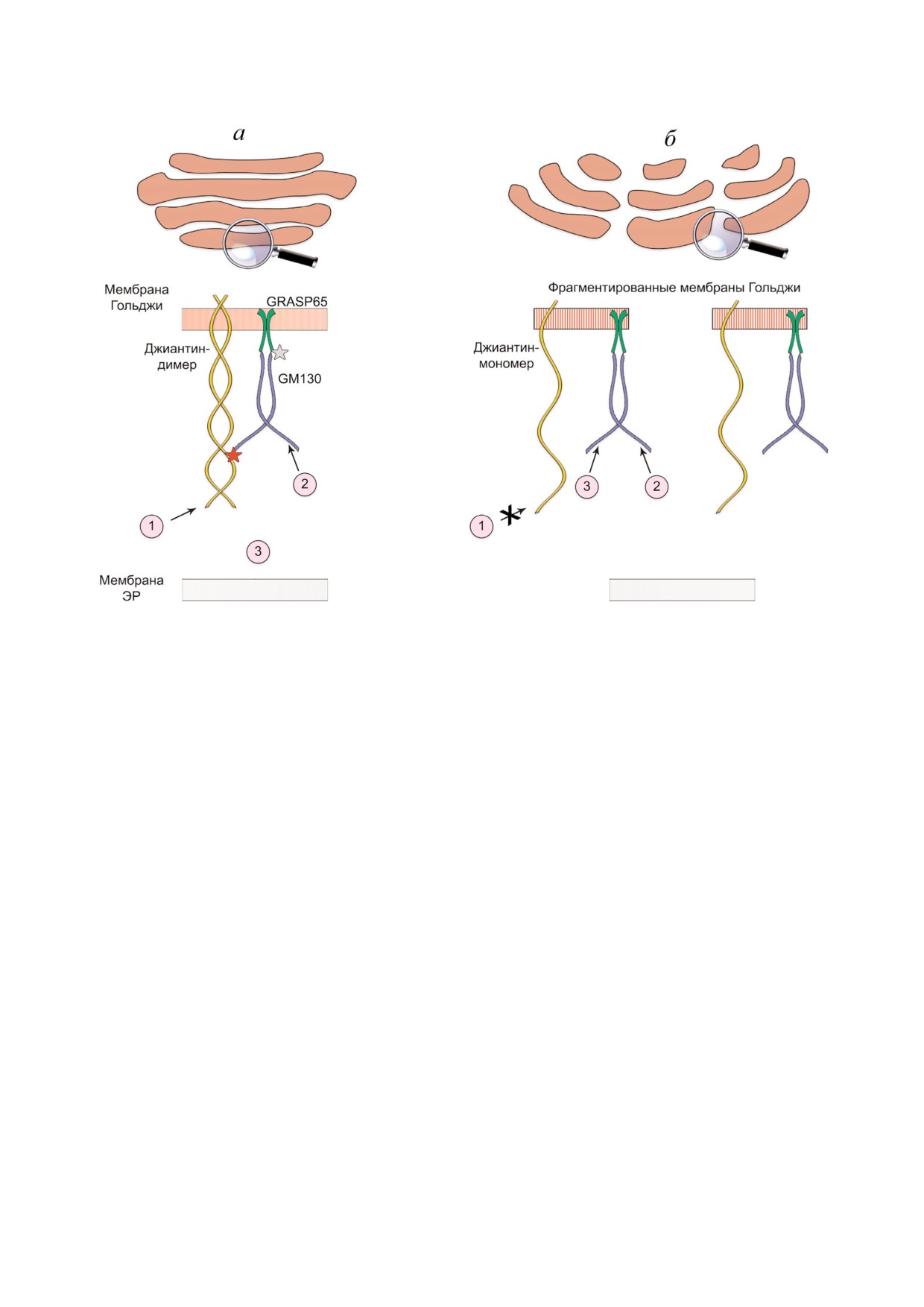
Рис. 2. Дифференциальные механизмы доставки ферментов на поверхность мембран Гольджи. а - При обычных услови
ях комплекс Гольджи имеет компактную лентовидную структуру, и димеры джиантина, GM130 и GRASP65 формируют
тройной комплекс, который отвечает за стыковку различных везикул, несущих к Гольджи резидентные белки (круг № 1 -
джиантин зависимые, круг № 2 - GM130 зависимые). Круг № 3 представляет группу цитоплазматических белков, у ко
торых GM130 специфические сайты недоступны в силу того, что они, возможно, вовлечены во взаимодействие с джиан
тином (звездочка). Соответственно, эти белки в норме не могут достичь Гольджи; б - в фрагментированных мембранах
Гольджи джиантин преимущественно представлен в мономерной форме, и связь джиантин-GM130 нарушена, что вы
свобождает стыковочный сайт GM130 для белков из группы № 3. Обращает на себя внимание то, что при этом стыковка
джиантин зависимых белков прерывается (круг № 1), в то время как доставка к Гольджи GM130 зависимых ферментов
остается неизменной (круг № 2).
biokhsm/
цис Гольджи димерный белок, чей С концевой
ми. Эта концепция стала набирать обороты
домен связан с мембранами Гольджи главным
после ранних наблюдений, полученных в лабо
образом посредством взаимодействия с
ратории Грэхема Уоррена [25], указывавших на
GRASP65 [15, 16] (рис. 2, а). И гольджины, и
то, что матрикс с остатками цистерн Гольджи,
белки GRASP тесно связаны с точностью про
выделенными из печени крыс, содержал фер
цессов гликозилирования в Гольджи [16-20],
менты α маннозидазу II (Man II) и маннозил
однако детали молекулярных механизмов этой
(α 1,3) гликопротеин β 1,2 N ацетилглюкоза
регуляции по прежнему остаются неизвестны.
минилтрансферазу (MGAT1), которые, однако,
Ключом к разгадке могут послужить данные
покидали мембраны Гольджи после обработки
различных лабораторий, недвусмысленно ука
NaCl в низкой концентрации. Вымывание соли
зывающие на то, что гольджины служат стыко
восстанавливало связывание этих ферментов с
вочным сайтом для множества везикул, на
мембранами, но этого невозможно было дос
правляющихся из ЭР в Гольджи [21-24]. Это, в
тичь в присутствии протеиназы K. Данные ре
свою очередь, позволяет предположить, что
зультаты свидетельствуют о том, что белковые
транспортировка резидентных белков Гольджи
комплексы, расположенные между цистернами
к местам постоянной локализации также на
Гольджи, являются своеобразными мишенями
прямую зависит от их кооперации с гольджина
для ферментов Гольджи.
БИОХИМИЯ том 84 вып. 12 2019
1842
ПЕТРОСЯН
ДЖИАНТИН И GM130-GRASP65:
цитоскелета [38-41]. В наших наблюдениях [42]
ВМЕСТЕ ИЛИ ВРОЗЬ?
кодеплеции джиантина и GM130 было доста
точно для индукции периферической фрагмен
Несмотря на очевидную важность гольджи
тации Гольджи.
нов для архитектуры Гольджи, индивидуальное
Ранее в научном сообществе был принят
замолкание их генов не приводит к визуальным
постулат: кооперация джиантина с GM130 про
различиям в локализации этой органеллы.
исходит посредством их общего взаимодействия
Действительно, деплеция белков цис Гольджи
с везикулярным стыковочным белком p115;
(GPP130, GRASP65, GM130 или гольджин 160
предполагалось, что подобный белковый «три
[16, 18, 26, 27]), срединного Гольджи (гольджин
умвират» отвечает за внутриклеточный трафик
84 и джиантин [16, 28]) и транс Гольджи (гольд
везикулярного коатомерного белкового комп
жин 97, p230, GCC185 или TMF [29-32]) может
лекса I (COPI) [43]. Однако эта модель не в сос
вызвать нарушение укладки стопок цистерн и
тоянии объяснить транспортировку COPI меж
центральную фрагментацию Гольджи, однако не
ду цистернами срединного и транс Гольджи,
оказывает влияния на перинуклеарное располо
поскольку, в отличие от джиантина, распределе
жение Гольджи. Тот же феномен обнаружен и у
ние комплекса GM130-GRASP65 ограничива
мышей с нокаутом генов, кодирующих
ется сугубо пределами цис Гольджи [44]. Это на
GRASP65 или джиантин: околоядерная локали
водит на мысль, что джиантин способен вклю
зация Гольджи не нарушена, и существенные
чаться в трафик внутри Гольджи независимо от
изменения в развитии этих животных не выяв
GM130-GRASP65. Действительно, дальнейшие
лены [33, 34]. Наиболее вероятным объяснени
исследования показали, что реакция джиантина
ем этого феномена является взаимозаменяе
на нарушения различных внутриклеточных про
мость гольджинов, когда отсутствие одного мат
цессов отличается от GM130 и GRASP65. Извест
риксного белка Гольджи может быть скомпен
но, что дисфункция ферментов ГТФаз, вовле
сировано сверхэкспрессией другого. Например,
ченных в трафик от ЭР до Гольджи и внутри
нокдаун гена, кодирующего GRASP65, индуци
Гольджи, приводит к ЭР стрессу, потере Гольд
рует увеличение уровня GM130 и джиантина
жи своей целостности и коллапсу его мембран в
[16]. В то же время в клетках, испытывающих
цистерны ЭР [45]. К примеру, в клетках с инду
дефицит GRASP65, расположение GM130 в
цированной сверхэкспрессией мутированного
Гольджи остается неизменным, поскольку
Sarlp (H79G), ограниченного в своей ГТФазной
GM130 может быть притянут к мембране Гольд
активности, большинство матриксных белков
жи посредством связи с джиантином [16]. При
Гольджи, включая гольджин 45, GRASP55 и
мечательно, что в клетках прогрессивного рака
джиантин, перемещается в ЭР. Однако GM130 и
простаты Гольджи подвергается фрагментации,
GRASP65 почти полностью остаются в точеч
что ассоциируется с уменьшением уровня джи
ных цитоплазматических структурах, называе
антина и потерей его димерной формы [20]
мых остатками Гольджи [46, 47]. Такой же эф
(рис. 2, б). Неудивительно, что в этих клетках
фект наблюдается в клетках после обработки
деплеция GRASP65 вызывает снижение как об
различными ингибиторами ARF1, брефелдином А
щего уровня GM130, так и его присутствия в
(БФА) и AMF 26, а также ингибитором GBF1
Гольджи [20], поскольку резервный джиантин
(специфичный фактор нуклеотидного обмена
опосредованный механизм связи GM130 с
гуанозина) гольджицидом А [45]. В клетках, об
мембранами Гольджи нарушен.
работанных БФА, наблюдается также слияние
Очевидно, что поляризация Гольджи во мно
мембран Гольджи с цистернами ЭР [48]. Однако
гом предопределяется клеточным цитоскелетом
одновременная обработка клеток БФА и 50 мкM
[35]. Действительно, обработка клеток цитоха
H 89, ингибитора протеинкиназ, приводит к
лазином D, дестабилизатором актина [36], или
несколько иному результату: вместо коллапса
нокодазолом [37], деполимеризатором микро
мембраны Гольджи образуют тубулярные струк
трубочек, может привести к масштабной фраг
туры, направленные навстречу ЭР, в которых
ментации Гольджи. Однако одновременная по
GM130 , GRASP65 , GRASP55 и p115 пози
теря функции нескольких гольджинов сама по
тивные элементы оказываются отделены от
себе может также существенно нарушить струк
джиантин содержащих трубочек [49]. Любо
туру Гольджи. К примеру, во время апоптоза
пытно, что деплеция GM130 приводит к разры
Гольджи претерпевает дезорганизацию, но де
ву ассоциации GRASP65 с мембранами Гольджи
градация сразу нескольких гольджинов и
и снижению его экспрессии, однако не оказыва
GRASP65, опосредованная каспазами, предше
ет влияния на локализацию джиантина в Гольд
ствует каким либо видимым изменениям в
жи и не блокирует транспортировку карго через
структуре как актинового, так и тубулинового
цистерны [16, 18, 50]. Наконец, в нашей лабора
БИОХИМИЯ том 84 вып. 12 2019
СТРЕСС И ФРАГМЕНТАЦИЯ АППАРАТА ГОЛЬДЖИ
1843
Рис. 3. Последовательность аминокислот в цитоплазматическом домене резидентных ферментов Гольджи. Жирным под
черкиванием выделены дипептидные основные мотивы в джиантин зависимых энзимах и гидрофобные участки в
GM130 зависимых ферментах
тории было показано, что специфические вези
участок, так и один RR мотив; однако в клетках,
кулярные комплексы, несущие к Гольджи его
лишенных джиантина, Man I существенно не
резидентные энзимы, являются COPI и COPII
меняет своей локализации в Гольджи [42]. Инте
независимыми и используют два различных
ресно, что для некоторых представителей се
стыковочных сайта: джиантин и комплекс
мейства белков p24 стыковка на мембране
GM130-GRASP65 [16] (рис. 2).
Гольджи осуществляется через непосредствен
Большинство резидентных ферментов
ное взаимодействие их гидрофобного участка на
Гольджи являются мембранными белками 2 го
С конце как с GRASP65, так и с GRASP55 [66].
типа, имеющими короткий цитоплазматичес
Этот пример наводит на мысль о том, что опи
кий хвост на N конце, небольшую стержневую
санный феномен не ограничивается только
часть, трансмембранный домен и широкую ка
ферментами гликозилирования в Гольджи и мо
талитическую область, расположенную в про
жет иметь прикладное значение для других ре
свете Гольджи [51]. Цитоплазматический хвост
зидентных белков, расположенных в этой орга
гликозилтрансфераз вовлечен почти в каждую
нелле.
ступень внутриклеточного трафика: выход из
ЭР [52], стыковку на Гольджи [16], фиксацию на
его мембранах [53-58] и рециркуляцию [59].
АТИПИЧНАЯ ЛОКАЛИЗАЦИЯ КЛЕТОЧНЫХ
Различные лаборатории, включая нашу, нагляд
ФЕРМЕНТОВ, ИЛИ «ТУДА И ОБРАТНО»
но продемонстрировали, что локализация цело
го ряда гликозилтрансфераз и гликозидаз в
Итак, гомеостаз Гольджи поддерживается
Гольджи напрямую зависит от джиантина [16,
тремя основными белками: джиантином,
20, 34, 60, 61]. Напротив, доставка других рези
GM130 и GRASP65, и дисфункция любого из
дентных ферментов в Гольджи напрямую зави
них неизбежно приводит к потере обычной ло
сит от функции GM130-GRASP65 [16, 42,
кализации ключевых ферментов в Гольджи. В
62-65]. Мы провели скрининг известных джи
клетках печени, обработанных этанолом, джи
антин зависимых белков и обнаружили в их ци
антин лишается способности к димеризации;
топлазматическом домене дипептидный основ
как следствие, MGAT1 теряет свою позицию в
ной мотив, представленный комбинациями ли
Гольджи и переходит в цитоплазму [42]. По той
зина и аргинина: KK, RR или KR (рис. 3, левая
же причине отсутствия димера джиантина в
панель, жирный шрифт и подчеркивание). Тем
клетках агрессивного рака простаты один из
временем в N концевой части GM130-
ключевых ферментов O гликозилирования, 2 я
GRASP65 зависимых ферментов четко про
стержневая N ацетилглюкозаминилтрансфера
сматриваются только различные комбинации
за L (C2GnT L), была обнаружена не в своем
гидрофобных мотивов (рис. 3, правая панель,
привычном месте, срединном Гольджи, а в ци
жирный шрифт и подчеркивание). Лишь одно
топлазме. Подобная транслокация приводит к
исключение было обнаружено в α 1,2 маннози
кардинальному изменению цепочки O гликози
дазе (Man I), цитоплазматический домен кото
лирования, поскольку при отсутствии C2GnT L
рой включает в себя как строгий гидрофобный
в Гольджи в действие вступает конкурирующий
БИОХИМИЯ том 84 вып. 12 2019
1844
ПЕТРОСЯН
с ней фермент β галактозид α 2,3 сиалотранс
опухолевых клеток простаты. Аналогично, при
фераза 1 (ST3Gal1), которая использует GM130-
нормальных физиологических условиях цАМФ
GRASP65 в качестве стыковочного сайта Гольд
зависимая протеинкиназа (cAMP dPK II) явля
жи; как следствие, активность ST3Gal1 приво
ется резидентным ферментом Гольджи, но после
дит к образованию прометастатических глика
стимуляции аденилатциклазы форсколином
нов [20]. Более того, данные, полученные как in
Гольджи расщепляется на фрагменты, а cAMP
vitro, так и in vivo, указывают на то, что индуци
dPK II переходит в ядро. Любопытно, что вымы
рованная этанолом фрагментация Гольджи со
вание форсколина восстанавливает компактную
провождается транслокацией антиметастати
структуру Гольджи и возвращает фермент в эту
ческого фермента Гольджи, N ацетилглюкоза
органеллу [73]. Подобная зависимость от струк
минилтрансферазы III (MGAT3), в цитоплазму.
туры Гольджи обнаружена и у SOK1, протеинки
Подобное перемещение приводит к активации
назы из семейства киназ зародышевого центра.
альтернативного N гликозилирования по пути,
SOK1 размещен в Гольджи, где принимает учас
катализируемому проонкогенным ферментом
тие в сигнальных цепочках, отвечающих за кле
Гольджи N ацетилглюкозаминилтрансферазой V
точную миграцию и поляризацию. В то же время
(MGAT5), которая остается в мембранах
SOK1 запускает апоптоз в клетках, подвергших
Гольджи, несмотря на их фрагментацию [67].
ся химической аноксии, модели ишемии, харак
Множество недавних наблюдений описывают
теризующейся обилием свободных радикалов,
случаи перераспределения ферментов Гольджи в
истощением запасов АТФ и структурной дезор
различные внутриклеточные структуры (см. ни
ганизацией Гольджи. Примечательно, что SOK1
же). Тем не менее детали этого феномена еще не
при этом перемещается в ядро [74]. Обработка
до конца ясны, и стыковочные сайты для боль
клеток рака толстого кишечника компонентом
шого числа резидентных белков Гольджи по
желчи, дезоксихолевой кислотой, разрушает
прежнему нуждаются в расшифровке. Вот лишь
компактность Гольджи, индуцируя переход про
некоторые яркие примеры подобного измене
теинкиназы Cη (PKCη) из Гольджи в цитоплаз
ния местоположения ключевых игроков пост
му и уменьшая секрецию белков [75]. Внекле
трансляционной модификации белков. Нейтра
точная сигнал регулируемая киназа 8 (ERK8)
лизация pH в Гольджи приводит лишь к расши
также находится в Гольджи, но под воздействием
рению его стопок, однако это уже влечет за со
факторов роста сегрегируется от расширенных
бой перераспределение различных гликозилтранс
цистерн Гольджи [76]. В том же наблюдении ав
фераз в ЭР [68, 69]. Синтаза дисиалоганглиози
торы указывают, что деплеция фосфатидилино
да 3 (GD3) конвертирует церамид в ганглиозид в
зитол 4 киназы (PI4KA) приводит к появлению
Гольджи. Тем не менее этот фермент перемеща
отделенных мембран Гольджи на периферии
ется в митохондрии во время апоптоза, где он
клеток и переходу фермента Гольджи GalNAc
запускает их набухание, а также экспрессию ци
трансферазы в ЭР. Интерес вызывает также ра
тохрома c, апоптоз индуцирующего фактора и
бота, демонстрирующая, что серин треониновая
каспазы 9 [70]. Trip230, коактиватор рецептора
протеинкиназа 16 (STK16) расположена в преде
тиреоидного гормона, в норме расположен в
лах Гольджи и регулирует динамику актиновых
пределах мембран Гольджи, но во время деления
фибрилл, однако деплеция этого фермента или
клеток он переходит в ядро [71]. Напротив, не
его ингибирование могут стать причиной серь
которые ферменты движутся в обратном направ
езной дезорганизации Гольджи [77].
лении, переходя с ЭР в Гольджи. CerS1, один из
Таким образом, киназы способны напрямую
представителей энзимов, ответственных за син
вмешиваться во внутриклеточное позициониро
тез церамида de novo, является классическим ре
вание Гольджи и локализацию других белков,
зидентом ЭР, но он может переходить в фрагмен
которые могут как терять свою локализацию в
тированные мембраны Гольджи после стресса,
Гольджи, так и, наоборот, оказываются способ
вызванного воздействием ультрафиолетовых лу
ны переходить из других внутриклеточных
чей или обработкой дитиотреитолом (DTT) [72].
структур в Гольджи. Так, например, транслока
Похожее поведение обнаружено и для киназ,
ция βγ субъединиц рецепторов G белков от
расположенных в Гольджи. В клетках рака прос
плазматической мембраны в Гольджи сопряжена
таты после обработки этанолом фермент киназа
с фрагментацией последнего, стимулируемого
гликогенсинтазы
3β (GSK3β) переходит из
протеинкиназой D (PKD) [78]. В некоторых слу
Гольджи в цитоплазму [61], тем самым запуская
чаях потеря белком своего местоположения свя
фосфорилирование и нисходящую активацию
зана с фосфорилированием киназами. Так, в от
деацетилазы гистонов 6 (HDAC6). Это, в свою
вет на воздействие бутанолом Гольджи фрагмен
очередь, приводит к трансактивации андроген
тируется, а расположенный в транс Гольджи
ного рецептора (AR), драйвера пролиферации
βIII спектрин переходит в цитоплазму после
БИОХИМИЯ том 84 вып. 12 2019
СТРЕСС И ФРАГМЕНТАЦИЯ АППАРАТА ГОЛЬДЖИ
1845
фосфорилирования, катализируемого киназой
клеток человека [87], но, насколько нам извест
c Src [79, 80]. Похожий сценарий наблюдается и
но, только Rab1, Rab6a, Rab18 и Rab41 необходи
в клетках после окислительного стресса: дезор
мы для компактного и перинуклеарного Гольджи
ганизация Гольджи [1] и последующее фосфори
[20, 88, 89]. Тем не менее немалое количество
лирование кальций зависимого фосфолипид
публикаций указывает на то, что деплеция раз
связывающего белка аннексина II, происходя
личных ассоциированных с Гольджи белков ра
щее при помощи Lyn, одного и представителей
дикально меняет морфологию Гольджи, вызывая
семейства Src киназ, приводит в конце концов к
потерю им классической ленточной структуры и
транслокации аннексина II из Гольджи в ЭР [81].
рассеивание его расщепленных мембран по всей
Сама по себе активация киназ класса Src оказы
клетке [90-92]. Однако эти данные необходимо
вает ощутимое влияние на морфологию Гольд
интерпретировать с осторожностью, поскольку
жи, а их ингибирование в клетках рака поджелу
не каждый случай дезорганизации Гольджи, воз
дочной железы способно трансформировать
никший после индивидуальной деплеции како
фрагментированный Гольджи этих клеток в бо
го либо его белка, может быть приписан непос
лее компактный [82]. Впрочем, некоторые кина
редственному вкладу этого конкретного белка в
зы, напротив, появляются в Гольджи при обсто
поддержание архитектуры Гольджи. К примеру,
ятельствах, которые нарушают гомеостаз Гольд
нокдаун генов консервативных олигомерных
жи и целостность его мембран. Известно, что во
белков Гольджи (COGs), Cog 2, 4, 6 или 8, нару
время митоза Гольджи также фрагментируется, а
шает целостность структуры Гольджи, но клетки,
циклин зависимая киназа 1 (Cdk1-cyclin B)
испытывающие дефицит COG, способны к вос
фосфорилирует GRASP65, который, в свою оче
становлению компактной структуры Гольджи
редь, служит стыковочным сайтом для Plk1
после вымывания БФА [93].
(polo подобная киназа 1) [83]. Однако GRASP65
Во многих случаях блокировка генов, коди
может подвергаться альтернативному фосфори
рующих белки Гольджи, приводит к застою тра
лированию посредством киназы ERK, что при
фика внутри Гольджи и значительной задержке
водит к потере способности GRASP65 к олиго
выхода белков из Гольджи, что неизбежно замед
меризации, последующему нарушению органи
ляет транспортировку карго из ЭР в Гольджи.
зации стопок Гольджи и их разделению [84]. Лю
Как следствие, в клетках развиваются ЭР стресс
бопытно, что появление активной киназы мито
и реакция несвернутых белков (unfolded protein
ген активируемой протеинкиназы 1 (MEK1) в
response, UPR) [94, 95]. В конечном итоге субле
Гольджи также совпадает с началом митотичес
тальный ЭР стресс неминуемо приводит к дезор
кой фрагментации его мембран [85]. Обработка
ганизации Гольджи, прежде всего из за наруше
клеток эпителия сетчатки с помощью фактора
ний в доставке гольджинов в мембраны Гольджи
активации тромбоцитов стимулирует переход
и в их постсинтетической модификации [6, 96,
протеинкиназы Cα (PKCα) в Гольджи; однако
97]. В качестве альтернативы ЭР стресс также
такой эффект отсутствует, если те же клетки
может быть инициирован мутациями белков, что
предварительно обработать БФА, вызвав кол
блокирует процесс их нормального созревания,
лапс мембран Гольджи [86]. Последний пример
включая пространственную укладку и сворачи
служит ярким свидетельством тому, что потеря
вание, и вызывает накопление этих белков в ЭР.
компактности Гольджи и раскрытие его структу
Все это замедляет сообщение между ЭР и Гольд
ры, а не его диссолюция, как в случае с БФА, яв
жи и приводит вновь к фрагментированию
ляются ключевыми факторами, предрасполага
Гольджи [98]. Например, деплеция MGAT1 не
ющими к появлению некоторых ферментов на
оказывает существенного влияния на внутрикле
поверхности его мембран.
точную позицию Гольджи и морфологию [93]; но
мутированный MGAT1, который не может поки
нуть пределы ЭР, вызывает его стресс, последую
РЕЗИДЕНТНЫЕ БЕЛКИ ГОЛЬДЖИ:
щую фрагментацию Гольджи и перераспределе
ЯВЛЯЮТСЯ ЛИ ОНИ
ние некоторых ферментов из Гольджи в цито
«ТЕНЕВЫМИ ЛИДЕРАМИ»?
плазму, в т.ч. таких ключевых игроков N глико
зилирования, как Man II и β 1,4 галактозилтранс
Исходя из вышеуказанного, возникает есте
фераза 1 (GalT) [99]. Резюмируя, можно за
ственный вопрос о том, каково же влияние рези
ключить, что не существует ЭР стресса без
дентных ферментов Гольджи на его морфоло
стресса Гольджи, и наоборот, нарушения транс
гию. Во многих случаях замолкание генов этих
порта внутри Гольджи неизменно приводят к за
белков имеет не очень большое воздействие на
держке выхода карго из ЭР.
архитектуру Гольджи. Например, всего 20 из из
Таким образом, теперь можно постулиро
вестных 70 Rab ГТФаз обнаружены в Гольджи
вать, что именно стресс индуцированная фраг
БИОХИМИЯ том 84 вып. 12 2019
1846
ПЕТРОСЯН
ментация Гольджи является причиной потери
антин, которые к тому же теряют свою димер
этой органеллой части своих резидентных фер
ную структуру; однако комплекс GM130-
ментов, что приводит к аномальному гликози
GRASP65 по прежнему остается в мембранах
лированию как N , так и O гликанов [4, 100].
Гольджи [6, 46, 47]. Более того, индуцированная
Теперь становится понятно, почему ни нокода
этанолом фрагментация Гольджи сопровождает
зол, ни цитохалазин D, несмотря на дестабили
ся мономеризацией джиантина, но не оказывает
зацию микротрубочек или актиновых фибрилл
существенного влияния на кооперацию между
и очевидную дезорганизацию Гольджи, не ока
GM130 и GRASP65 [6, 61]. Исследования нашей
зывают ощутимого влияния на процессы глико
лаборатории, недавно проведенные на клетках
зилирования [7, 101, 102]. Действительно, в
печени, показали, что именно джиантин, а не
клетках, обработанных этими реагентами,
комплекс GM130-GRASP65, ответственен за
транспорт внутри Гольджи не нарушен (см.
посталкогольное воссоединение мембран
обзор Mironov и Beznoussenko [8]). Но, как мы
Гольджи и восстановление его компактной и пе
обнаружили ранее, в таких клетках джиантин
ринуклеарной структуры; последнее, кстати, яв
зависимые ферменты, например, 2 я стержне
ляется важнейшей предпосылкой для успешно
вая N ацетилглюкозаминилтрансфераза M
го процессинга секретируемых белков и их дос
(C2GnT M), по прежнему располагаются в пре
тавки на поверхность клетки [107]. Также недав
делах Гольджи [7]. Этот факт позволяет предпо
но мы обнаружили киназу AKT1 в расщеплен
ложить, что дестабилизация цитоскелета не на
ных мембранах Гольджи раковых клеток проста
рушает трафика из ЭР в Гольджи, а значит, не
ты, обработанных этанолом, что, однако, невоз
препятствует доставке гольджинов в мембраны
можно было воспроизвести в тех же клетках, ли
Гольджи и не нарушает их структуру. Примеча
шенных GM130 после деплеции его гена (рабо
тельно, что Гольджи может подвергаться вре
та готовится к печати). Логично предположить,
менной физиологической децентрализации,
что фрагментация Гольджи, отсутствие димер
схожей с той, которая происходит после деполи
ной формы джиантина и потеря кооперации
меризации микротрубочек. В частности, это об
между джиантином и GM130 могут стимулиро
наружено во время дифференцировки миоблас
вать раскрытие новых GM130 специфических
тов в миотрубки и мышечные волокна [103, 104]
стыковочных сайтов, которые ранее были экра
или при доставке уроплакина к апикальной
нированы джиантином (рис. 2, б).
мембране поверхностного эпителия мочевого
Таким образом, мы предлагаем новую пара
пузыря [104]. Но опять же, подобный тип пере
дигму, постулирующую, что для клеток, испы
стройки структуры Гольджи не ассоциируется с
тывающих ЭР стресс, GM130 является основ
повреждением его стыковочных сайтов, а ско
ным гольджином, работающим на притягива
рее сопряжен с нарушением целостности мик
ние к мембранам Гольджи везикул, несущих
ротрубочек и другого важного компонента ци
белки карго. Действительно, клетки, инфици
тоскелета клеток - промежуточных филамен
рованные вирусом коксаки B3 (CVB3), возбуди
тов. С точностью до наоборот, БФА индуциро
телем миокардита, панкреатита и менингита у
ванный коллапс Гольджи и сопутствующий ЭР
людей, демонстрируют дезорганизованный
стресс [105] сопровождаются частичной дегра
Гольджи и стойкий комплекс между CVB3 и
дацией большинства матриксных белков Гольд
GM130 [108]. Гольджи также подвергается фраг
жи, включая джиантин [106], мономеризацией
ментации в кортикальных нейронах животных,
джиантина (собственное наблюдение, работа
впадающих в спячку, что ассоциируется с увели
готовится к печати), переходом резидентных
чением экспрессии GM130 [109]. Другой клини
белков Гольджи в ЭР и последующим аномаль
чески важный пример зависимости функции
ным гликозилированием [7, 8].
Гольджи от GM130 обнаружен при раке. Строго
говоря, сегодня мало у кого вызывает сомнение
наличие связи между канцерогенезом и дезорга
КОМПЛЕКС GM130-GRASP65
низацией структуры Гольджи: в различных рако
КАК «КРИЗИСНЫЙ МЕНЕДЖЕР»
вых клеточных линиях и тканевых срезах опухо
лей Гольджи демонстрирует фрагментирован
Как было указано выше, при внутриклеточ
ный фенотип, что тесно сопряжено с перемеще
ных стрессовых состояниях фрагменты Гольджи
нием различных энзимов из Гольджи в цито
разбросаны по всему объему клетки, и множест
плазму, аномальным гликозилированием и повы
во гольджинов оказываются в непосредствен
шенным метастатическим потенциалом клеток
ной близости от мембран ЭР [22]. Некоторые из
[110-114]. Более того, у мышей в модели рака
них даже могут быть обнаружены в пределах
легких показано, что индуцированное падение
этих мембран, как, например, GRASP55 и джи
активности GM130 приводит к снижению ангио
БИОХИМИЯ том 84 вып. 12 2019
СТРЕСС И ФРАГМЕНТАЦИЯ АППАРАТА ГОЛЬДЖИ
1847
генеза и клеточной инвазии, а также стимулиру
«онко Гольджи». В самом деле, в отличие от
ет аутофагию, тем самым содействуя клеточной
андроген зависимых клеток LNCaP раннего
смерти [115]. В андроген независимых клетках
пассажа, клетки LNCaP позднего пассажа и
рака простаты, представляющих его агрессив
клетки PC 3, представляющие андроген неза
ную форму, Гольджи также подвержен фрагмен
висимый рак простаты, имеют не просто фраг
тированию, и активность GM130 напрямую свя
ментированный Гольджи, но и показывают сни
зана с процессом синтеза прометастатических
жение уровня димерного джиантина, что хоро
гликановых эпитопов [20]. Любопытно, что в
шо соотносится с данными, полученными ранее
этих клетках Гольджи, несмотря на дезорганиза
[20] (рис. 4, а и б, верхняя панель). Любопытно,
цию, по прежнему сохраняет способность к
что уровень тетрамера GRASP65 был снижен в
удержанию стопок, что недвусмысленно наме
клетках LNCaP позднего пассажа и PC 3, а уро
кает на то, что белки GRASP крайне важны для
вень димера GRASP65, напротив, был увеличен
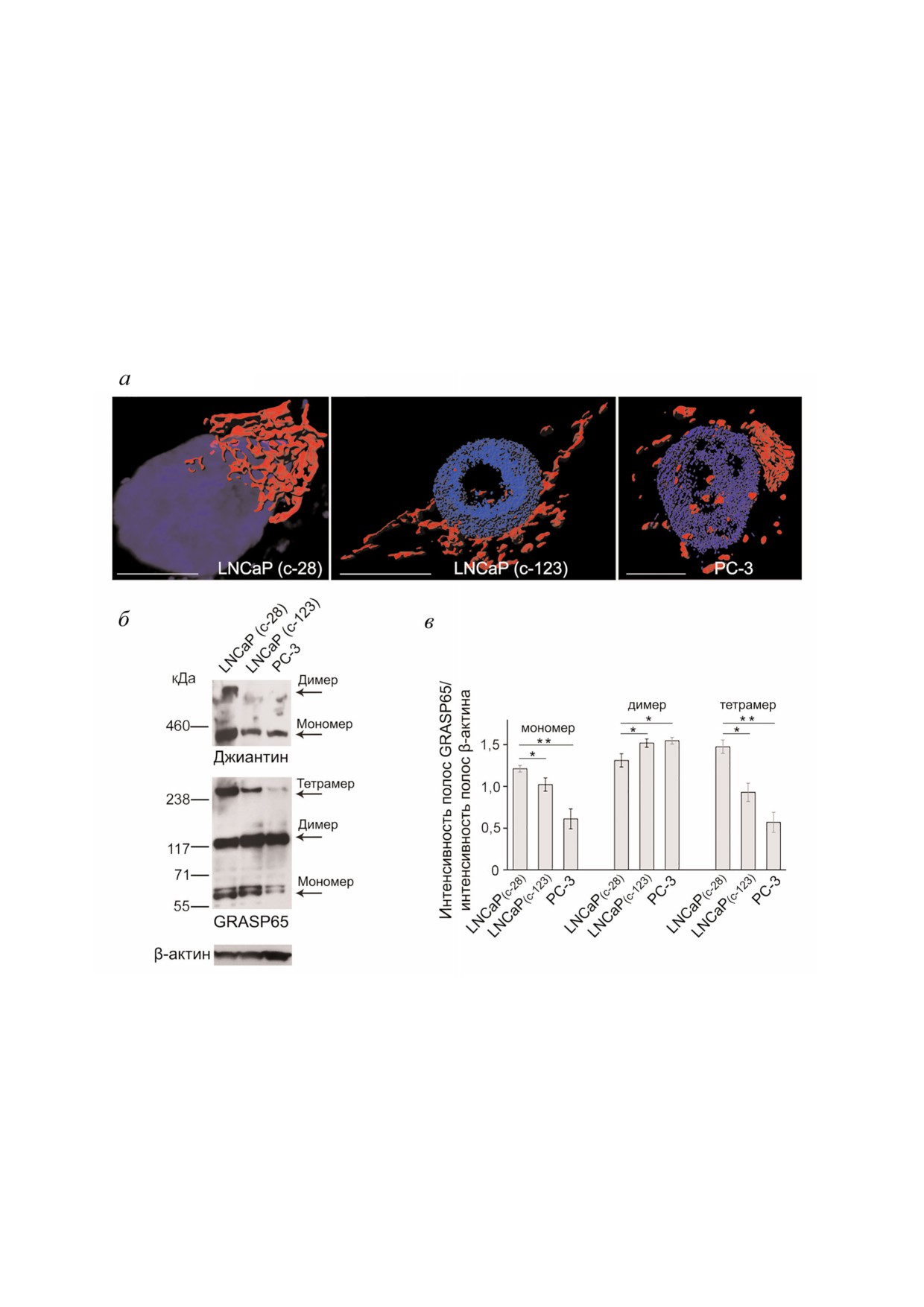
Рис. 4. а - Микрофотографии 3D реконструкций Гольджи в андроген зависимых клетках раннего пассажа (c 28), андро
ген независимых клетках Гольджи позднего пассажа (с 123) и клетках PC 3, полученные с помощью структурной иллю
минационной микроскопии (SIM) высокого разрешения. Масштабный отрезок - 10 мкм; б - вестерн блоттинг лизатов
клеток, представленных на фрагменте а, для идентификации джиантина и GRASP65; для нормализации уровня белка ис
пользовали β актин. Олигомеризация GRASP65 и джиантина была подтверждена методом седиментационного анализа в
градиенте сахарозы; в - количественное определение интенсивности полос, соответствующих мономеру, димеру и тетра
меру GRASP65, представленное в виде денситометрического отношения к β актину. Расчет проведен в пределах одной и
той же экспозиции, данные представлены в виде средних значений ± SD, полученных при расчетах от трех эксперимен
тальных повторов; * p < 0,01; ** p < 0,001.
biokhsm/
БИОХИМИЯ том 84 вып. 12 2019
1848
ПЕТРОСЯН
(рис. 4, б, нижняя панель). Данные результаты
Гольджи, которая происходит при непосред
свидетельствуют о том, что в этих клетках нару
ственном участии кальмодулинзависимой про
шена именно олигомеризация, а не димериза
теинкиназы (CaMK) [118]. Еще один удиви
ция GRASP65 (рис. 4, б и в). Точный механизм
тельный факт - это секреция самих гольджинов
этих конформационных изменений нуждается в
на внешнюю поверхность клеток. Клетки гепа
детализации, и будущие исследования в различ
тоцеллюлярного рака печени также демонстри
ных раковых клетках призваны ответить еще на
руют расщепление структуры Гольджи [113], а в
один важный вопрос, какой вклад вносят
крови этих пациентов обнаруживается белок
GRASP55 и другие гольджины в поддержание
Гольджи 73 (GOLPH2, GP73) [119]. Любопыт
фрагментированного фенотипа Гольджи.
но, что уровень GP73 снижается после удаления
опухоли, но вновь повышается после рецидива
заболевания. Некоторые аутоимунные заболе
«ПОРОЧНЫЙ КРУГ»
вания, в особенности синдром Шегрена, сис
ПОСТ+ЭР+СТРЕССОВОГО ТРАФИКА
темная красная волчанка, ревматоидный арт
рит и гепатит B, характеризуются секрецией
Следующий важный вопрос касается влия
различных аутоантигенов Гольджи в кровь
ния дезорганизации Гольджи на секрецию бел
[120]. К их числу относятся джиантин, p230,
ков. Было обнаружено, что индивидуальный
гольджин 160, GM130, p115, гольджин 97 и
нокдаун генов, кодирующих белки GRASP
гольджин 67 (обзор Hong et al. [120]). Природа
(GRAS55 и GRASP65 по отдельности), или их
этого феномена не до конца ясна, и ее расшиф
совместная деплеция в состоянии привести к
ровка необходима для того, чтобы выявить воз
ускорению трафика белков и их доставки на по
можный вклад гольджинов во внеклеточные
верхность клеток, даже если это сопряжено с
сигнальные механизмы.
дефектами их гликозилирования и сортировки
Фрагментация Гольджи также наблюдается
[102]. Аналогично клетки, обработанные гольд
при других нейродегенеративных заболеваниях,
жицидом А, индуктором стресса Гольджи, де
которые, напротив, отличаются нарушением ак
монстрируют преумножение трафика карго,
сонального транспорта и агрегацией белков в
несмотря на фрагментирование мембран Гольд
клетках [121, 122]. Эти данные перекликаются с
жи [45]. Еще один яркий пример - это протеи
публикациями других лабораторий, демонстри
назы драйверы метастаза опухолевых клеток,
рующих, что нарушение целостности Гольджи
матриптаза и различные классы интегринов,
может замедлять внутриклеточный трафик [91].
повышенная секреция которых обнаружена
Таким образом, можно предположить два аль
при опухолях множества органов; Гольджи этих
тернативных сценария транспортировки белков
клеток также отличается интенсивной дезорга
во время стресса: 1) некоторые белки быстро
низацией [116, 117]. В дополнение показано,
секретируются, обходя Гольджи и не пройдя
что тау белки высвобождаются нейронами, тем
полный этап своей постсинтетической модифи
самым внося вклад в развитие болезни Альц
кации [123]; 2) трафик других карго через фраг
геймера; оказалось, что подобное ускорение
ментированные мембраны Гольджи ускоряется
секреции тау белков коррелирует с повышен
за счет тесных контактов между мембранами ЭР
ной активностью нейронов и фрагментацией
и Гольджи, что было бы невозможно в нормаль
ных клетках в силу естественной сегрегации
мембран этих органелл. С логической точки зре
ния второй вариант развития событий выглядит
вполне целесообразно, поскольку слияние
мембран ЭР и Гольджи может разгрузить внут
риклеточный трафик агрегированных в ЭР бел
ков. Однако стремительный транспорт от ЭР к
Гольджи не гарантирует скорой последующей
транспортировки и секреции этих белков. Бе
зусловно, из за отсутствия соответствующего
созревания и процессинга некоторые белки, в
особенности большие карго, такие как колла
ген, застревают во фрагментированных мембра
нах Гольджи, тем самым еще более усугубляя
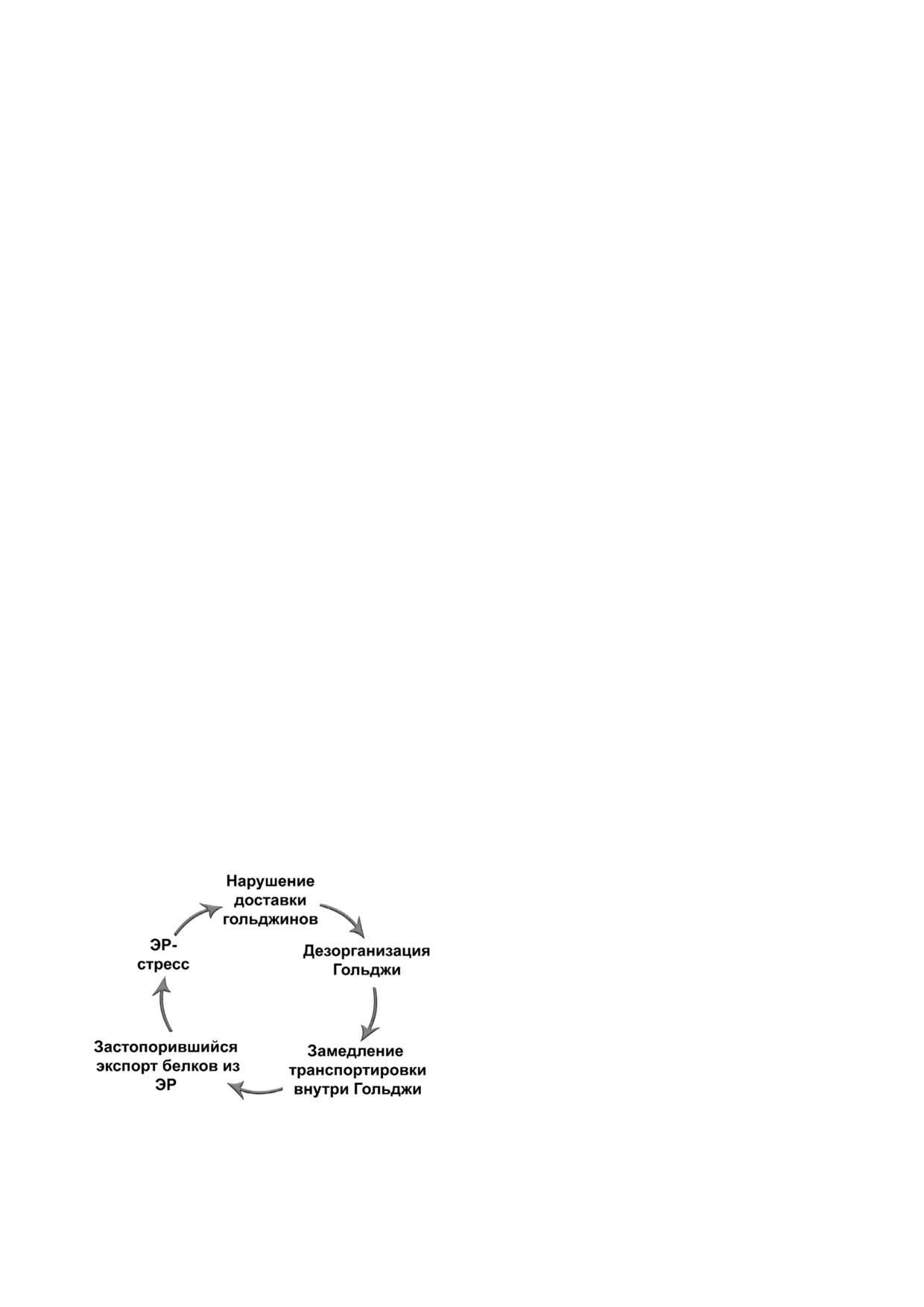
ЭР стресс по механизму обратной связи [6, 124,
Рис. 5. «Порочный круг» ЭР стресса и дезорганизации
125] (рис. 5). Подобная ситуация может быть
Гольджи
описана шахматной терминологией «цугцванг»,
БИОХИМИЯ том 84 вып. 12 2019
СТРЕСС И ФРАГМЕНТАЦИЯ АППАРАТА ГОЛЬДЖИ
1849
когда следующий ход игрока только осложняет
во фрагментированных структурах Гольджи, а
его позицию, но пропустить этот ход он никак
также трафик между отдельными мини Гольджи
не может.
по прежнему требуют пристального внимания
исследователей. Хотя мы далеки от мысли, что
Таким образом, и выключение трафика от
«все дороги ведут к Гольджи», тем не менее, мы
ЭР к Гольджи, и его ускорение могут быть вос
уверены, что раскрытие парадигм Гольджи и
приняты лишь как временные адаптивные меха
разрешение сложности его разнообразных сиг
низмы, поскольку непрекращающийся тяжелый
налов поможет открыть возможности для новых
ЭР стресс неизбежно приводит к апоптотичес
терапевтических подходов при многих серьез
кой гибели клеток [126]. Но оказывается, что
ных патологиях.
это никак не относится к раковым клеткам, для
которых ЭР стресс и последующий UPR явля
ются механизмами выживания [127]. И действи
Финансирование. Работы автора, цитируе
тельно, в наших предварительных исследовани
мые в данном обзоре, поддержаны грантами
ях мы наблюдали тесные контакты между ЭР и
National Institute of Health (США): K01AA022979
Гольджи в клетках агрессивного рака простаты.
05, P20 GM113126 и 1R01AA027242 01A1.
Тем не менее остается тайной, каким образом
Конфликт интересов. Автор заявляет, что дан
раковым клеткам удается поддерживать ЭР
ное исследование проводилось в отсутствие ка
стресс на сублетальном уровне. Возможно, ответ
ких либо коммерческих или финансовых отно
на этот вопрос придет с исследованиями анти
шений, которые могли бы быть истолкованы
апоптотических механизмов, связанных с фраг
как потенциальный конфликт интересов.
ментацией Гольджи. Точно так же, несмотря на
Соблюдение этических норм. Настоящая
значительный прогресс в понимании механиз
статья не содержит описания выполненных ав
мов, управляющих дезорганизацией Гольджи [7,
тором исследований с участием людей и исполь
20, 82, 128-130], изменение локализации белков
зованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Hicks, S.W., and Machamer, C.E. (2005) Golgi structure
10. Munro, S. (2011) The golgin coiled coil proteins of the
in stress sensing and apoptosis, Biochim. Biophys. Acta,
Golgi apparatus, Cold Spring Harb. Perspect. Biol., 3,
1744, 406-414.
a005256.
2.
Geng, J., and Klionsky, D.J. (2010) The Golgi as a poten
11. Lin, C.Y., Madsen, M.L., Yarm, F.R., Jang, Y.J., Liu, X.,
tial membrane source for autophagy, Autophagy, 6,
and Erikson, R.L. (2000) Peripheral Golgi protein
950-951.
GRASP65 is a target of mitotic polo like kinase (Plk) and
3.
Micaroni, M., Stanley, A.C., Khromykh, T., Venturato, J.,
Cdc2, Proc. Natl. Acad. Sci. USA, 97, 12589-12594.
Wong, C.X., Lim, J.P., Marsh, B.J., Storrie, B., Gleeson, P.A.,
12. Linstedt, A.D., and Hauri, H.P. (1993) Giantin, a novel
and Stow, J.L. (2013) Rab6a/a′ are important Golgi regu
conserved Golgi membrane protein containing a cytoplas
lators of pro inflammatory TNF secretion in macrophages,
mic domain of at least 350 kDa, Mol. Biol. Cell, 4,
PLoS One, 8, e57034.
679-693.
4.
Petrosyan, A. (2015) Onco Golgi: is fragmentation a gate
13. Martinez Menarguez, J.A., Prekeris, R., Oorschot, V.M.,
to cancer progression? Biochem. Mol. Biol. J., 1, 16.
Scheller, R., Slot, J.W., Geuze, H.J., and Klumperman, J.
5.
Petrosyan, A., and Cheng, P.W. (2014) Golgi fragmenta
(2001) Peri Golgi vesicles contain retrograde but not antero
tion induced by heat shock or inhibition of heat shock pro
grade proteins consistent with the cisternal progression
teins is mediated by non muscle myosin IIA via its interac
model of intra Golgi transport, J. Cell Biol., 155, 1213-1224.
tion with glycosyltransferases, Cell Stress Chaperones, 19,
14. Szul, T., and Sztul, E. (2011) COPII and COPI traffic at
241-254.
the ER Golgi interface, Physiology (Bethesda),
26,
6.
Petrosyan, A., Cheng, P.W., Clemens, D.L., and Casey, C.A.
348-364.
(2015) Downregulation of the small GTPase SAR1A: a key
15. Nakamura, N., Lowe, M., Levine, T.P., Rabouille, C., and
event underlying alcohol induced Golgi fragmentation in
Warren, G. (1997) The vesicle docking protein p115 binds
hepatocytes, Sci. Rep., 5, 17127.
GM130, a cis Golgi matrix protein, in a mitotically regu
7.
Petrosyan, A., and Cheng, P.W. (2013) A non enzymatic
lated manner, Cell, 89, 445-455.
function of Golgi glycosyltransferases: mediation of Golgi
16. Petrosyan, A., Ali, M.F., and Cheng, P.W.
(2012)
fragmentation by interaction with non muscle myosin IIA,
Glycosyltransferase specific Golgi targeting mechanisms,
Glycobiology, 23, 690-708.
J. Biol. Chem., 287, 37621-37627.
8.
Mironov, A.A., and Beznoussenko, G.V. (2011) Molecular
17. Joshi, G., Chi, Y., Huang, Z., and Wang, Y. (2014) Aβ
mechanisms responsible for formation of Golgi ribbon,
induced Golgi fragmentation in Alzheimer’s disease
Histol. Histopathol., 26, 117-133.
enhances Aβ production, Proc. Natl. Acad. Sci. USA, 111,
9.
Mironov, A.A., Sesorova, I.S., Seliverstova, E.V., and
E1230-Е1239.
Beznoussenko, G.V. (2017) Different Golgi ultrastructure
18. Puthenveedu, M.A., Bachert, C., Puri, S., Lanni, F., and
across species and tissues: implications under functional
Linstedt, A.D. (2006) GM130 and GRASP65 dependent
and pathological conditions, and an attempt at classifica
lateral cisternal fusion allows uniform Golgi enzyme dis
tion, Tissue Cell, 49, 186-201.
tribution, Nat. Cell Biol., 8, 238-248.
6 БИОХИМИЯ том 84 вып. 12 2019
1850
ПЕТРОСЯН
19.
Jarvela, T., and Linstedt, A.D. (2014) Isoform specific
37.
Turner, J.R., and Tartakoff, A.M. (1989) The response of
tethering links the Golgi ribbon to maintain compartmen
the Golgi complex to microtubule alterations: the roles of
talization, Mol. Biol. Cell, 25, 133-144.
metabolic energy and membrane traffic in Golgi complex
20.
Petrosyan, A., Holzapfel, M.S., Muirhead, D.E., and
organization, J. Cell Biol., 109, 2081-2088.
Cheng, P.W. (2014) Restoration of compact Golgi mor
38.
Mukherjee, S., Chiu, R., Leung, S.M., and Shields, D.
phology in advanced prostate cancer enhances susceptibil
(2007) Fragmentation of the Golgi apparatus: an early
ity to galectin 1 induced apoptosis by modifying mucin O
apoptotic event independent of the cytoskeleton, Traffic, 8,
glycan synthesis, Mol. Cancer Res., 12, 1704-1716.
369-378.
21.
Pfeffer, S.R. (2001) Constructing a Golgi complex, J. Cell
39.
Lowe, M., Lane, J.D., Woodman, P.G., and Allan, V.J.
Biol., 155, 873-875.
(2004) Caspase mediated cleavage of syntaxin 5 and
22.
Ward, T.H., Polishchuk, R.S., Caplan, S., Hirschberg, K.,
giantin accompanies inhibition of secretory traffic during
and Lippincott Schwartz, J. (2001) Maintenance of Golgi
apoptosis, J. Cell Sci., 117, 1139-1150.
structure and function depends on the integrity of ER
40.
Cheng, J.P., Betin, V.M., Weir, H., Shelmani, G.M., Moss, D.K.,
export, J. Cell Biol., 155, 557-570.
and Lane, J.D. (2010) Caspase cleavage of the Golgi stack
23.
Barr, F.A., and Short, B. (2003) Golgins in the structure
ing factor GRASP65 is required for Fas/CD95 mediated
and dynamics of the Golgi apparatus, Curr. Opin. Cell Biol.,
apoptosis, Cell Death Dis., 1, e82.
15, 405-413.
41.
Walker, A., Ward, C., Sheldrake, T.A., Dransfield, I.,
24.
Appenzeller Herzog, C., and Hauri, H.P. (2006) The ER
Rossi, A.G., Pryde, J.G., and Haslett, C. (2004) Golgi
Golgi intermediate compartment (ERGIC): in search of its
fragmentation during Fas mediated apoptosis is associated
identity and function, J. Cell Sci., 119, 2173-2183.
with the rapid loss of GM130, Biochem. Biophys. Res.
25.
Slusarewicz, P., Nilsson, T., Hui, N., Watson, R., and
Commun., 316, 6-11.
Warren, G. (1994) Isolation of a matrix that binds medial
42.
Casey, C.A., Bhat, G., Holzapfel, M.S., and Petrosyan, A.
Golgi enzymes, J. Cell Biol., 124, 405-413.
(2016) Study of ethanol induced Golgi disorganization
26.
Hicks, S.W., Horn, T.A., McCaffery, J.M., Zuckerman, D.M.,
reveals the potential mechanism of alcohol impaired N
and Machamer, C.E. (2006) Golgin 160 promotes cell sur
glycosylation, Alcohol Clin. Exp. Res., 40, 2573-2590.
face expression of the beta 1 adrenergic receptor, Traffic, 7,
43.
Sonnichsen, B., Lowe, M., Levine, T., Jamsa, E., Dirac
1666-1677.
Svejstrup, B., and Warren, G. (1998) A role for giantin in
27.
Natarajan, R., and Linstedt, A.D. (2004) A cycling cis
docking COPI vesicles to Golgi membranes, J. Cell Biol.,
Golgi protein mediates endosome to Golgi traffic, Mol.
140, 1013-1021.
Biol. Cell, 15, 4798-4806.
44.
Nakamura, N. (2010) Emerging new roles of GM130, a
28.
Sohda, M., Misumi, Y., Yamamoto, A., Nakamura, N.,
cis Golgi matrix protein, in higher order cell functions, J.
Ogata, S., Sakisaka, S., Hirose, S., Ikehara, Y., and Oda, K.
Pharmacol. Sci., 112, 255-264.
(2010) Interaction of Golgin 84 with the COG complex
45.
Ignashkova, T.I., Gendarme, M., Peschk, K., Eggenweiler, H.M.,
mediates the intra Golgi retrograde transport, Traffic, 11,
Lindemann, R.K., and Reiling, J.H. (2017) Cell survival
1552-1566.
and protein secretion associated with Golgi integrity in
29.
Lieu, Z.Z., Lock, J.G., Hammond, L.A., La Gruta, N.L.,
response to Golgi stress inducing agents, Traffic, 18,
Stow, J.L., and Gleeson, P.A. (2008) A trans Golgi network
530-544.
golgin is required for the regulated secretion of TNF in
46.
Yoshimura, S., Yamamoto, A., Misumi, Y., Sohda, M.,
activated macrophages in vivo, Proc. Natl. Acad. Sci. USA,
Barr, F.A., Fujii, G., Shakoori, A., Ohno, H., Mihara, K.,
105, 3351-3356.
and Nakamura, N. (2004) Dynamics of Golgi matrix pro
30.
Taneja, T.K., Ma, D., Kim, B.Y., and Welling, P.A. (2018)
teins after the blockage of ER to Golgi transport, J.
Golgin 97 targets ectopically expressed inward rectifying
Biochem., 135, 201-216.
potassium channel, Kir2.1, to the trans Golgi network in
47.
Kim, J., Noh, S.H., Piao, H., Kim, D.H., Kim, K., Cha, J.S.,
COS 7 cells, Front. Physiol., 9, 1070.
Chung, W.Y., Cho, H.S., Kim, J.Y., and Lee, M.G. (2016)
31.
Reddy, J.V., Burguete, A.S., Sridevi, K., Ganley, I.G.,
Monomerization and ER relocalization of GRASP is a
Nottingham, R.M., and Pfeffer, S.R. (2006) A functional
requisite for unconventional secretion of CFTR, Traffic,
role for the GCC185 golgin in mannose 6 phosphate
17, 733-753.
receptor recycling, Mol. Biol. Cell, 17, 4353-4363.
48.
Klausner, R.D., Donaldson, J.G., and Lippincott
32.
Yamane, J., Kubo, A., Nakayama, K., Yuba Kubo, A.,
Schwartz, J. (1992) Brefeldin A: insights into the control of
Katsuno, T., Tsukita, S., and Tsukita, S. (2007) Functional
membrane traffic and organelle structure, J. Cell Biol., 116,
involvement of TMF/ARA160 in Rab6 dependent retro
1071-1080.
grade membrane traffic, Exp. Cell Res., 313, 3472-3485.
49.
Tenorio, M.J., Luchsinger, C., and Mardones, G.A. (2015)
33.
Veenendaal, T., Jarvela, T., Grieve, A.G., van Es, J.H.,
Protein kinase A activity is necessary for fission and fusion
Linstedt, A.D., and Rabouille, C. (2014) GRASP65
of Golgi to endoplasmic reticulum retrograde tubules,
controls the cis Golgi integrity in vivo, Biol. Open, 3,
PLoS One, 10, e0135260.
431-443.
50.
Kodani, A., and Sutterlin, C. (2008) The Golgi protein
34.
Lan, Y., Zhang, N., Liu, H., Xu, J., and Jiang, R. (2016)
GM130 regulates centrosome morphology and function,
Golgb1 regulates protein glycosylation and is crucial for
Mol. Biol. Cell, 19, 745-753.
mammalian palate development, Development,
143,
51.
Colley, K.J. (1997) Golgi localization of glycosyltransferas
2344-2355.
es: more questions than answers, Glycobiology, 7, 1-13.
35.
Thyberg, J., and Moskalewski, S. (1999) Role of micro
52.
Giraudo, C.G., and Maccioni, H.J. (2003) Endoplasmic
tubules in the organization of the Golgi complex, Exp. Cell
reticulum export of glycosyltransferases depends on inter
Res., 246, 263-279.
action of a cytoplasmic dibasic motif with Sar1, Mol. Biol.
36.
May, J.A., Ratan, H., Glenn, J.R., Losche, W.,
Cell, 14, 3753-3766.
Spangenberg, P., and Heptinstall, S. (1998) GPIIb IIIa
53.
Osman, N., McKenzie, I.F., Mouhtouris, E., and Sandrin, M.S.
antagonists cause rapid disaggregation of platelets pre
(1996) Switching amino terminal cytoplasmic domains of
treated with cytochalasin D. Evidence that the stability of
α(1,2)fucosyltransferase and α(1,3)galactosyltransferase
platelet aggregates depends on normal cytoskeletal assem
alters the expression of H substance and Galα(1,3)Gal, J.
bly, Platelets, 9, 227-232.
Biol. Chem., 271, 33105-33109.
БИОХИМИЯ том 84 вып. 12 2019
СТРЕСС И ФРАГМЕНТАЦИЯ АППАРАТА ГОЛЬДЖИ
1851
54.
Quintero, C.A., Valdez Taubas, J., Ferrari, M.L., Haedo, S.D.,
69.
Rivinoja, A., Hassinen, A., Kokkonen, N., Kauppila, A.,
and Maccioni, H.J. (2008) Calsenilin and CALP interact
and Kellokumpu, S. (2009) Elevated Golgi pH impairs ter
with the cytoplasmic tail of UDP Gal:GA2/GM2/GD2 β
minal N glycosylation by inducing mislocalization of
1,3 galactosyltransferase, Biochem. J., 412, 19-26.
Golgi glycosyltransferases, J. Cell Physiol., 220, 144-154.
55.
Wassler, M.J., Foote, C.I., Gelman, I.H., and Shur, B.D.
70.
Rippo, M.R., Malisan, F., Ravagnan, L., Tomassini, B.,
(2001) Functional interaction between the SSeCKS scaf
Condo, I., Costantini, P., Susin, S.A., Rufini, A., Todaro, M.,
folding protein and the cytoplasmic domain of β1,4 galac
Kroemer, G., and Testi, R. (2000) GD3 ganglioside direct
tosyltransferase, J. Cell Sci., 114, 2291-2300.
ly targets mitochondria in a bcl 2 controlled fashion,
56.
Schmitz, K.R., Liu, J., Li, S., Setty, T.G., Wood, C.S.,
FASEB J., 14, 2047-2054.
Burd, C.G., and Ferguson, K.M. (2008) Golgi localization
71.
Chen, Y., Chen, P.L., Chen, C.F., Sharp, Z.D., and
of glycosyltransferases requires a Vps74p oligomer, Dev.
Lee, W.H. (1999) Thyroid hormone, T3 dependent phos
Cell, 14, 523-534.
phorylation and translocation of Trip230 from the Golgi
57.
Ali, M.F., Chachadi, V.B., Petrosyan, A., and Cheng, P.W.
complex to the nucleus, Proc. Natl. Acad. Sci. USA, 96,
(2012) Golgi phosphoprotein 3 determines cell binding
4443-4448.
properties under dynamic flow by controlling Golgi local
72.
Sridevi, P., Alexander, H., Laviad, E.L., Min, J., Mesika, A.,
ization of core 2 N acetylglucosaminyltransferase 1, J.
Hannink, M., Futerman, A.H., and Alexander, S. (2010)
Biol. Chem., 287, 39564-39577.
Stress induced ER to Golgi translocation of ceramide syn
58.
Petrosyan, A., Ali, M.F., and Cheng, P.W. (2015) Keratin 1
thase 1 is dependent on proteasomal processing, Exp. Cell
plays a critical role in Golgi localization of core 2 N acetyl
Res., 316, 78-91.
glucosaminyltransferase M via interaction with its cyto
73.
Nigg, E.A., Hilz, H., Eppenberger, H.M., and Dutly, F.
plasmic tail, J. Biol. Chem., 290, 6256-6269.
(1985) Rapid and reversible translocation of the catalytic
59.
Okamoto, M., Yoko o, T., Miyakawa, T., and Jigami, Y.
subunit of cAMP dependent protein kinase type II from
(2008) The cytoplasmic region of α 1,6 mannosyltrans
the Golgi complex to the nucleus, EMBO J., 4, 2801-2806.
ferase Mnn9p is crucial for retrograde transport from the
74.
Nogueira, E., Fidalgo, M., Molnar, A., Kyriakis, J., Force, T.,
Golgi apparatus to the endoplasmic reticulum in
Zalvide, J., and Pombo, C.M. (2008) SOK1 translocates
Saccharomyces cerevisiae, Eukaryot. Cell, 7, 310-318.
from the Golgi to the nucleus upon chemical anoxia and
60.
Stevenson, N.L., Bergen, D.J.M., Skinner, R.E.H.,
induces apoptotic cell death, J. Biol. Chem.,
283,
Kague, E., Martin Silverstone, E., Robson Brown, K.A.,
16248-16258.
Hammond, C.L., and Stephens, D.J. (2017) Giantin
75.
Byrne, A.M., Foran, E., Sharma, R., Davies, A., Mahon, C.,
knockout models reveal a feedback loop between Golgi
O’Sullivan, J., O’Donoghue, D., Kelleher, D., and Long, A.
function and glycosyltransferase expression, J. Cell Sci.,
(2010) Bile acids modulate the Golgi membrane fission
130, 4132-4143.
process via a protein kinase Ceta and protein kinase D
61.
Manca, S., Frisbie, C.P., LaGrange, C.A., Casey, C.A.,
dependent pathway in colonic epithelial cells,
Riethoven, J.M., and Petrosyan, A. (2019) The role of
Carcinogenesis, 31, 737-744.
alcohol induced Golgi fragmentation for androgen recep
76.
Chia, J., Tham, K.M., Gill, D.J., Bard Chapeau, E.A.,
tor signaling in prostate cancer, Mol. Cancer Res., 17,
and Bard, F.A. (2014) ERK8 is a negative regulator of O
225-237.
GalNAc glycosylation and cell migration, Elife, 3, e01828.
62.
Preisinger, C., Short, B., De Corte, V., Bruyneel, E., Haas, A.,
77.
Liu, J., Yang, X., Li, B., Wang, J., Wang, W., Liu, J., Liu, Q.,
Kopajtich, R., Gettemans, J., and Barr, F.A. (2004) YSK1
and Zhang, X. (2017) STK16 regulates actin dynamics to
is activated by the Golgi matrix protein GM130 and plays a
control Golgi organization and cell cycle, Sci. Rep., 7,
role in cell migration through its substrate 14 3 3ζ, J. Cell
44607.
Biol., 164, 1009-1020.
78.
Saini, D.K., Karunarathne, W.K., Angaswamy, N., Saini, D.,
63.
Rivero, S., Cardenas, J., Bornens, M., and Rios, R.M.
Cho, J.H., Kalyanaraman, V., and Gautam, N. (2010)
(2009) Microtubule nucleation at the cis side of the Golgi
Regulation of Golgi structure and secretion by receptor
apparatus requires AKAP450 and GM130, EMBO J., 28,
induced G protein βγ complex translocation, Proc. Natl.
1016-1028.
Acad. Sci. USA, 107, 11417-11422.
64.
Song, K., Gras, C., Capin, G., Gimber, N., Lehmann, M.,
79.
Siddhanta, A., Radulescu, A., Stankewich, M.C.,
Mohd, S., Puchkov, D., Rodiger, M., Wilhelmi, I.,
Morrow, J.S., and Shields, D. (2003) Fragmentation of the
Daumke, O., Schmoranzer, J., Schurmann, A., and
Golgi apparatus. A role for βIII spectrin and synthesis of
Krauss, M. (2019) A SEPT1 based scaffold is required for
phosphatidylinositol 4,5 bisphosphate, J. Biol. Chem., 278,
Golgi integrity and function, J. Cell Sci., 132,
1957-1965.
65.
Baschieri, F., Confalonieri, S., Bertalot, G., Di Fiore, P.P.,
80.
Nedrelow, J.H., Cianci, C.D., and Morrow, J.S. (2003) c
Dietmaier, W., Leist, M., Crespo, P., Macara, I.G., and
Src binds αII spectrin’s Src homology 3 (SH3) domain and
Farhan, H. (2014) Spatial control of Cdc42 signalling by a
blocks calpain susceptibility by phosphorylating Tyr1176,
GM130-RasGRF complex regulates polarity and tumori
J. Biol. Chem., 278, 7735-7741.
genesis, Nat. Commun., 5, 4839.
81.
Matsuda, D., Nakayama, Y., Horimoto, S., Kuga, T.,
66.
Barr, F.A., Preisinger, C., Kopajtich, R., and Korner, R.
Ikeda, K., Kasahara, K., and Yamaguchi, N. (2006)
(2001) Golgi matrix proteins interact with p24 cargo recep
Involvement of Golgi associated Lyn tyrosine kinase in the
tors and aid their efficient retention in the Golgi apparatus,
translocation of annexin II to the endoplasmic reticulum
J. Cell Biol., 155, 885-891.
under oxidative stress, Exp. Cell Res., 312, 1205-1217.
67.
Kubyshkin, A.V., Fomochkina, I.I., and Petrosyan, A.M.
82.
Weller, S.G., Capitani, M., Cao, H., Micaroni, M., Luini, A.,
(2018) The impact of alcohol on pro metastatic N glyco
Sallese, M., and McNiven, M. A. (2010) Src kinase regu
sylation in prostate cancer, Crim. J. Exper. Clin. Med., 8,
lates the integrity and function of the Golgi apparatus via
11-20.
activation of dynamin 2, Proc. Natl. Acad. Sci. USA, 107,
68.
Axelsson, M.A., Karlsson, N.G., Steel, D.M., Ouwendijk, J.,
5863-5868.
Nilsson, T., and Hansson, G.C. (2001) Neutralization of
83.
Preisinger, C., Korner, R., Wind, M., Lehmann, W.D.,
pH in the Golgi apparatus causes redistribution of glycosyl
Kopajtich, R., and Barr, F.A. (2005) Plk1 docking to
transferases and changes in the O glycosylation of mucins,
GRASP65 phosphorylated by Cdk1 suggests a mechanism
Glycobiology, 11, 633-644.
for Golgi checkpoint signalling, EMBO J., 24, 753-765.
БИОХИМИЯ том 84 вып. 12 2019
6*
1852
ПЕТРОСЯН
84.
Wei, J.H., and Seemann, J. (2009) Remodeling of the
the Golgi apparatus and disrupts endoplasmic reticulum
Golgi structure by ERK signaling, Commun. Integr. Biol., 2,
to Golgi traffic, J. Cell Sci., 114, 3685-3694.
35-36.
99. Nilsson, T., Hoe, M.H., Slusarewicz, P., Rabouille, C.,
85.
Colanzi, A., Sutterlin, C., and Malhotra, V. (2003) RAF1
Watson, R., Hunte, F., Watzele, G., Berger, E.G., and
activated MEK1 is found on the Golgi apparatus in late
Warren, G. (1994) Kin recognition between medial Golgi
prophase and is required for Golgi complex fragmentation
enzymes in HeLa cells, EMBO J., 13, 562-574.
in mitosis, J. Cell Biol., 161, 27-32.
100. Zhang, X., and Wang, Y. (2016) Glycosylation quality con
86.
Faghiri, Z., and Bazan, N.G. (2006) Selective relocaliza
trol by the Golgi structure, J. Mol. Biol., 428, 3183-3193.
tion and proteasomal downregulation of PKCα induced by
101. Stallcup, K.C., Raine, C.S., and Fields, B.N.
(1983)
platelet activating factor in retinal pigment epithelium,
Cytochalasin B inhibits the maturation of measles virus,
Invest. Ophthalmol. Vis. Sci., 47, 397-404.
Virology, 124, 59-74.
87.
Liu, S., and Storrie, B. (2012) Are Rab proteins the link
102. Xiang, Y., Zhang, X., Nix, D.B., Katoh, T., Aoki, K.,
between Golgi organization and membrane trafficking?
Tiemeyer, M., and Wang, Y. (2013) Regulation of protein
Cell Mol. Life Sci., 69, 4093-4106.
glycosylation and sorting by the Golgi matrix proteins
88.
Bard, F., Casano, L., Mallabiabarrena, A., Wallace, E.,
GRASP55/65, Nat. Commun., 4, 1659.
Saito, K., Kitayama, H., Guizzunti, G., Hu, Y., Wendler, F.,
103. Lu, Z., Joseph, D., Bugnard, E., Zaal, K.J., and Ralston, E.
Dasgupta, R., Perrimon, N., and Malhotra, V. (2006)
(2001) Golgi complex reorganization during muscle differ
Functional genomics reveals genes involved in protein
entiation: visualization in living cells and mechanism, Mol.
secretion and Golgi organization, Nature,
439,
Biol. Cell, 12, 795-808.
604-607.
104. Kreft, M.E., Di Giandomenico, D., Beznoussenko, G.V.,
89.
Dejgaard, S.Y., Murshid, A., Erman, A., Kizilay, O.,
Resnik, N., Mironov, A.A., and Jezernik, K. (2010) Golgi
Verbich, D., Lodge, R., Dejgaard, K., Ly Hartig, T.B.,
apparatus fragmentation as a mechanism responsible for
Pepperkok, R., Simpson, J.C., and Presley, J.F. (2008)
uniform delivery of uroplakins to the apical plasma mem
Rab18 and Rab43 have key roles in ER Golgi trafficking, J.
brane of uroepithelial cells, Biol. Cell, 102, 593-607.
Cell Sci., 121, 2768-2781.
105. Moon, J.L., Kim, S.Y., Shin, S.W., and Park, J.W. (2012)
90.
Rybakin, V., Gounko, N.V., Spate, K., Honing, S.,
Regulation of brefeldin A induced ER stress and apoptosis
Majoul, I.V., Duden, R., and Noegel, A.A. (2006) Crn7
by mitochondrial NADP+ dependent isocitrate dehydro
interacts with AP 1 and is required for the maintenance of
genase, Biochem. Biophys. Res. Commun., 417, 760-764.
Golgi morphology and protein export from the Golgi, J.
106. Puri, S., Telfer, H., Velliste, M., Murphy, R.F., and
Biol. Chem., 281, 31070-31078.
Linstedt, A.D. (2004) Dispersal of Golgi matrix proteins
91.
Lee, J.E., Yang, Y.M., Liang, F.X., Gough, D.J., Levy, D.E.,
during mitotic Golgi disassembly, J. Cell Sci., 117, 451-456.
and Sehgal, P.B. (2012) Nongenomic STAT5 dependent
107. Casey, C.A., Thomes, P., Manca, S., and Petrosyan, A.
effects on Golgi apparatus and endoplasmic reticulum
(2018) Giantin is required for post alcohol recovery of
structure and function, Am. J. Physiol. Cell Physiol., 302,
Golgi in liver cells, Biomolecules, 8, 150.
C804-С820.
108. Hawley, D.A., Schaefer, J.F., Schulz, D.M., and Muller, J.
92.
Aksnes, H., Van Damme, P., Goris, M., Starheim, K.K.,
(1983) Cytomegalovirus encephalitis in acquired immun
Marie, M., Stove, S.I., Hoel, C., Kalvik, T.V., Hole, K.,
odeficiency syndrome, Am. J. Clin. Pathol., 80, 874-877.
Glomnes, N., Furnes, C., Ljostveit, S., Ziegler, M., Niere, M.,
109. Anton Fernandez, A., Leon Espinosa, G., DeFelipe, J.,
Gevaert, K., and Arnesen, T. (2015) An organellar Nα
and Munoz, A. (2015) Changes in the Golgi apparatus of
acetyltransferase, Naa60, acetylates cytosolic N termini of
neocortical and hippocampal neurons in the hibernating
transmembrane proteins and maintains Golgi integrity, Cell
hamster, Front. Neuroanat., 9, 157.
Rep., 10, 1362-1374.
110. Kellokumpu, S., Sormunen, R., and Kellokumpu, I.
93.
Pokrovskaya, I.D., Willett, R., Smith, R.D., Morelle, W.,
(2002) Abnormal glycosylation and altered Golgi structure
Kudlyk, T., and Lupashin, V.V.
(2011) Conserved
in colorectal cancer: dependence on intra Golgi pH, FEBS
oligomeric Golgi complex specifically regulates the main
Lett., 516, 217-224.
tenance of Golgi glycosylation machinery, Glycobiology,
111.
Halberg, N., Sengelaub, C.A., Navrazhina, K., Molina, H.,
21, 1554-1569.
Uryu, K., and Tavazoie, S.F. (2016) PITPNC1 recruits
94.
Xu, Y.X., Liu, L., Caffaro, C.E., and Hirschberg, C.B.
RAB1B to the Golgi network to drive malignant secretion,
(2010) Inhibition of Golgi apparatus glycosylation causes
Cancer Cell, 29, 339-353.
endoplasmic reticulum stress and decreased protein syn
112. Mao, P., Nakao, K., and Angrist, A. (1966) Human prosta
thesis, J. Biol. Chem., 285, 24600-24608.
tic carcinoma: an electron microscope study, Cancer Res.,
95.
Hong, S.H., Chang, S.H., Cho, K.C., Kim, S., Park, S.,
26, 955-973.
Lee, A.Y., Jiang, H.L., Kim, H.J., Lee, S., Yu, K.N.,
113. Ghadially, F.N., and Parry, E.W. (1966) Ultrastructure of a
Seo, H.W., Chae, C., Kim, K.P., Park, J., and Cho, M.H.
human hepatocellular carcinoma and surrounding non
(2016) Endoplasmic reticulum Golgi intermediate com
neoplastic liver, Cancer, 19, 1989-2004.
partment protein 3 knockdown suppresses lung cancer
114. Egea, G., Franci, C., Gambus, G., Lesuffleur, T.,
through endoplasmic reticulum stress induced autophagy,
Zweibaum, A., and Real, F.X. (1993) cis Golgi resident
Oncotarget, 7, 65335-65347.
proteins and O glycans are abnormally compartmentalized
96.
Hu, W., Xu, R., Zhang, G., Jin, J., Szulc, Z.M., Bielawski, J.,
in the RER of colon cancer cells, J. Cell Sci., 105, 819-830.
Hannun, Y.A., Obeid, L.M., and Mao, C. (2005) Golgi
115. Chang, S.H., Hong, S.H., Jiang, H.L., Minai Tehrani, A.,
fragmentation is associated with ceramide induced cellular
Yu, K.N., Lee, J.H., Kim, J.E., Shin, J.Y., Kang, B., Park, S.,
effects, Mol. Biol. Cell, 16, 1555-1567.
Han, K., Chae, C., and Cho, M.H. (2012) GOLGA2/
97.
Stieber, A., Chen, Y., Wei, S., Mourelatos, Z., Gonatas, J.,
GM130, cis Golgi matrix protein, is a novel target of anti
Okamoto, K., and Gonatas, N.K. (1998) The fragmented
cancer gene therapy, Mol. Ther., 20, 2052-2063.
neuronal Golgi apparatus in amyotrophic lateral sclerosis
116. Cooper, C.R., Chay, C.H., and Pienta, K.J. (2002) The
includes the trans Golgi network: functional implications,
role of αvβ3 in prostate cancer progression, Neoplasia, 4,
Acta Neuropathol., 95, 245-253.
191-194.
98.
Graves, T.K., Patel, S., Dannies, P.S., and Hinkle, P.M.
117. List, K., Szabo, R., Molinolo, A., Sriuranpong, V.,
(2001) Misfolded growth hormone causes fragmentation of
Redeye, V., Murdock, T., Burke, B., Nielsen, B.S.,
БИОХИМИЯ том 84 вып. 12 2019
СТРЕСС И ФРАГМЕНТАЦИЯ АППАРАТА ГОЛЬДЖИ
1853
Gutkind, J.S., and Bugge, T.H. (2005) Deregulated
124. Wolins, N., Bosshart, H., Kuster, H., and Bonifacino, J.S.
matriptase causes ras independent multistage carcinogen
(1997) Aggregation as a determinant of protein fate in post
esis and promotes ras mediated malignant transformation,
Golgi compartments: role of the luminal domain of furin in
Genes Dev., 19, 1934-1950.
lysosomal targeting, J. Cell Biol., 139, 1735-1745.
118. Thayer, D.A., Jan, Y.N., and Jan, L.Y. (2013) Increased
125. Mala, J.G., and Rose, C. (2010) Interactions of heat shock
neuronal activity fragments the Golgi complex, Proc. Natl.
protein 47 with collagen and the stress response: an uncon
Acad. Sci. USA, 110, 1482-1487.
ventional chaperone model? Life Sci., 87, 579-586.
119. Mao, Y., Yang, H., Xu, H., Lu, X., Sang, X., Du, S., Zhao, H.,
126. Rao, R.V., Castro Obregon, S., Frankowski, H., Schuler, M.,
Chen, W., Xu, Y., Chi, T., Yang, Z., Cai, J., Li, H., Chen, J.,
Stoka, V., del Rio, G., Bredesen, D.E., and Ellerby, H.M.
Zhong, S., Mohanti, S.R., Lopez Soler, R., Millis, J.M.,
(2002) Coupling endoplasmic reticulum stress to the cell
Huang, J., and Zhang, H. (2010) Golgi protein
73
death program. An Apaf 1 independent intrinsic pathway,
(GOLPH2) is a valuable serum marker for hepatocellular
J. Biol. Chem., 277, 21836-21842.
carcinoma, Gut, 59, 1687-1693.
127. Madden, E., Logue, S.E., Healy, S.J., Manie, S., and
120. Hong, H.S., Chung, W.H., Hung, S.I., Chen, M.J., Lee, S.H.,
Samali, A. (2019) The role of the unfolded protein
and Yang, L.C. (2004) Clinical association of anti Golgi
response in cancer progression: from oncogenesis to
autoantibodies and their autoantigens, Scand. J. Immunol.,
chemoresistance, Biol. Cell, 111, 1-17.
59, 79-87.
128. Petrosyan, A., Casey, C.A., and Cheng, P.W. (2016) The
121. Fan, J., Hu, Z., Zeng, L., Lu, W., Tang, X., Zhang, J., and
role of Rab6a and phosphorylation of non muscle myosin
Li, T. (2008) Golgi apparatus and neurodegenerative dis
IIA tailpiece in alcohol induced Golgi disorganization,
eases, Int. J. Dev. Neurosci., 26, 523-534.
Sci. Rep., 6, 31962.
122. Gosavi, N., Lee, H.J., Lee, J.S., Patel, S., and Lee, S.J.
129. Allan, V.J., Thompson, H.M., and McNiven, M.A. (2002)
(2002) Golgi fragmentation occurs in the cells with prefib
Motoring around the Golgi, Nat. Cell Biol., 4, E236-Е242.
rillar α synuclein aggregates and precedes the formation of
130. Petrosyan, A., Ali, M.F., Verma, S.K., Cheng, H., and
fibrillar inclusion, J. Biol. Chem., 277, 48984-48992.
Cheng, P.W. (2012) Non muscle myosin IIA transports a
123. Grieve, A.G., and Rabouille, C. (2011) Golgi bypass: skirt
Golgi glycosyltransferase to the endoplasmic reticulum by
ing around the heart of classical secretion, Cold Spring
binding to its cytoplasmic tail, Int. J. Biochem. Cell Biol.,
Harb. Perspect. Biol., 3, a005298.
44, 1153-1165.
UNLOCKING GOLGI: WHY DOES MORPHOLOGY MATTER?
Review
A. Petrosyan1,2,3
1 Department of Biochemistry and Molecular Biology, College of Medicine,
University of Nebraska Medical Center, Omaha, NE, USA; E mail: apetrosyan@unmc.edu
2 The Nebraska Center for Integrated Biomolecular Communication, Lincoln, NE, USA
3 The Fred and Pamela Buffett Cancer Center, Omaha, NE, USA
Received May 26, 2019
Revised July 10, 2019
Accepted August 16, 2019
The mammalian Golgi apparatus is a highly dynamic organelle, which is normally localized in the juxtanuclear space
and plays a grand role in regulation of cellular homeostasis. While posttranslational modification of cargo is mediat
ed by the resident enzymes (glycosyltransferases, glycosidases, and kinases), the ribbon structure of Golgi and its cis
ternal stacking mostly rely on the cooperation of coiled coil matrix golgins. Among golgins, giantin, GM130, and
GRASPs are unique, because they form a tripartite complex and serve as the Golgi docking sites for cargo delivered
from the endoplasmic reticulum (ER). Golgi undergoes significant disorganization in many pathologies that are asso
ciated with a block of the ER to Golgi or intra Golgi transport, including cancer, different neurological diseases,
alcoholic liver damage, ischemic stress, viral infections, etc. In addition, Golgi fragments during apoptosis and mito
sis. Here, we summarize and analyze clinically relevant observations indicating that Golgi fragmentation is associat
ed with the loss of Golgi residency for the selective enzymes and, conversely, with the relocation of some cytoplasmic
proteins to the Golgi. The central concept is that ER and Golgi stresses impair giantin docking site but have no impact
of GM130-GRASP65 complex, thus inducing mislocalization of giantin sensitive enzymes only. As a result, the
pathways that were controlled by the missing enzymes are eliminated and the processes that are now driven by the
GM130-GRASP65 dependent proteins are activated, thus cardinally changing the processing of proteins. This type
of Golgi disorganization is different from the one induced by alteration of cytoskeleton, which (despite Golgi de cen
tralization) neither impairs function of golgins nor alters trafficking.
Keywords: Golgi morphology, golgins, giantin, GM130, GRASP65, Golgi resident enzymes, ER stress
БИОХИМИЯ том 84 вып. 12 2019