БИОХИМИЯ, 2019, том 84, вып. 12, с. 1876 - 1885
УДК 577.11
ДНК АПТАМЕРЫ К ЭКЗОСАЙТУ I ТРОМБИНА.
СТРУКТУРНО ФУНКЦИОНАЛЬНЫЕ ВЗАИМОСВЯЗИ
И АНТИТРОМБОТИЧЕСКИЕ ЭФФЕКТЫ
© 2019
В.А. Спиридонова1, Т.М. Новикова1, В.А. Сизов1, В.С. Шашковская1,
Е.В. Титаева2, А.Б. Добровольский2, Е.Б. Жарикова2, А.В. Мазуров2*
1 НИИ физико химической биологии им. А.Н. Белозерского,
Московский государственный университет им. М.В. Ломоносова, 119991 Москва, Россия
2 Национальный медицинский исследовательский центр кардиологии,
Министерство здравоохранения Российской Федерации,
121552 Москва, Россия; электронная почта: avmazurov@list.ru
Поступила в редакцию 18.04.2019
После доработки 11.07.2019
Принята к публикации 11.07.2019
ДНК аптамеры (олигонуклеотиды), взаимодействующие с экзосайтом I тромбина, имеют в своем составе
структуру G квадруплекса, две Т Т и одну T G T петли. Они препятствуют связыванию экзосайта I с фиб
риногеном и рецепторами тромбина на поверхности тромбоцитов и благодаря этому подавляют стимулируе
мые тромбином образование фибрина из фибриногена и агрегацию тромбоцитов. Ранее мы синтезировали
оригинальный антитромбиновый аптамер RE31 (5′ GTGACGTAGGTTGGTGTGGTTGGGGCGTCAC 3′),
содержащий (кроме G квадруплекса) шарнирную область, соединенную с шестью парами комплементар
ных оснований (дуплексная область). В настоящей работе сравнивали свойства аптамера RE31 c его анало
гами, содержащими разное количество оснований в дуплексной области и вставки нуклеотидов в шарнир
ной области. Уменьшение количества нуклеотидов в дуплексной области на 1-4 пары (по сравнению с ап
тамером RE31) приводило к снижению стабильности структуры аптамеров (более низкие температуры плав
ления) и снижению их способности ингибировать стимулированное тромбином образование фибрина в
плазме крови человека в тестах тромбинового, протромбинового и активированного частичного тромбо
пластинового времени. В то же время увеличение количества оснований на 1-2 пары не вызывало сущест
венных изменений стабильности и антитромбиновой активности аптамеров. Вставки в шарнирной области
аптамера RЕ31 приводили к снижению антитромбиновой активности. Исследование антитромботических
свойств RE31 показало, что он: 1) замедляет образование тромбина в плазме крови человека (тест генерации
тромбина), 2) ускоряет растворение фибринового сгустка тканевым активатором плазминогена в модели in
vitro, и 3) подавляет артериальное тромбообразование в модели in vivo. На основании полученных данных ап
тамер RE31 может рассматриваться как потенциально эффективное антитромботическое соединение.
КЛЮЧЕВЫЕ СЛОВА: аптамеры, тромбин, тромбообразование, фибриноген, фибринолиз.
DOI: 10.1134/S032097251912011X
Аптамеры представляют собой однотяжевые
они могут быть усовершенствованы с помощью
ДНК или РНК олигонуклеотиды длиной до
методов компьютерного моделирования и при
нескольких десятков оснований, которые, бла
необходимости химически модифицированы
годаря способности образовывать сложные
(например, для повышения стабильности и уве
пространственные конформации, могут специ
личения времени жизни в кровотоке человека и
фически взаимодействовать с различными мо
животных). Аптамеры являются функциональ
лекулами. Некоторые аптамеры могут также ин
ными химическими аналогами моноклональ
гибировать функциональную активность своих
ных антител. Однако (в отличие от антител) они
мишеней. Первичные аптамеры получают мето
мало иммуногенны и могут быть синтезированы
дом SELEX (системная эволюция лигандов с по
химически без использования для их селекции и
мощью экспоненциального обогащения) путем
производства клеточных и/или бактериальных
их отбора из библиотеки случайно синтезиро
систем и экспериментальных животных. Апта
ванных последовательностей по способности к
меры являются перспективными соединениями
связыванию с исследуемой молекулой. Затем
для разработки новых лекарственных препара
тов, в экспериментальных исследованиях их ис
* Адресат для корреспонденции.
пользуют в качестве молекулярных инструмен
1876
АНТИТРОМБИНОВЫЕ АПТАМЕРЫ
1877
тов для изучения функционирования различных
молекул [1-3].
Тромбин, главная протеаза системы сверты
вания крови [4], является одной из мишеней для
аптамеров. Первый аптамер против тромбина -
15TBA (тромбин связывающий аптамер, другие
названия HD1, 15 mer) - был получен Bock et al.
[5]. Этот аптамер представляет собой однотяже
вой ДНК олигонуклеотид из 15 оснований
(5′ GGTTGGTGTGGTTGG 3′) со структурой
G квадруплекса, двумя Т Т петлями и одной
T G T петлей, который связывается с экзосай
том I тромбина с помощью двух малых T T пе
тель [5-8]. Аптамер 15TBA ингибирует взаимо
действие экзосайта I с субстратами тромбина -
фибриногеном и PAR (рецепторы, активируе
мые протеазами) рецепторами тромбоцитов.
Благодаря этому он подавляет две ключевые
протромботические реакции тромбина - обра
зование фибрина из фибриногена и индуцируе
мую тромбином агрегацию тромбоцитов, не
влияя непосредственно на активный (каталити
ческий) центр фермента [5, 9].
Ранее нами был синтезирован ДНК аптамер
с условным названием RE31 (5′ GTGACGTAG
GTTGGTGTGGTTGGGGCGTCAC 3′) [10].
Этот аптамер состоит из 31 нуклеотида и, кроме
G квадруплексной структуры, содержит шар
нирную область, соединенную с шестью парами
комплементарных оснований (дуплексная об
ласть), симметрично расположенными относи
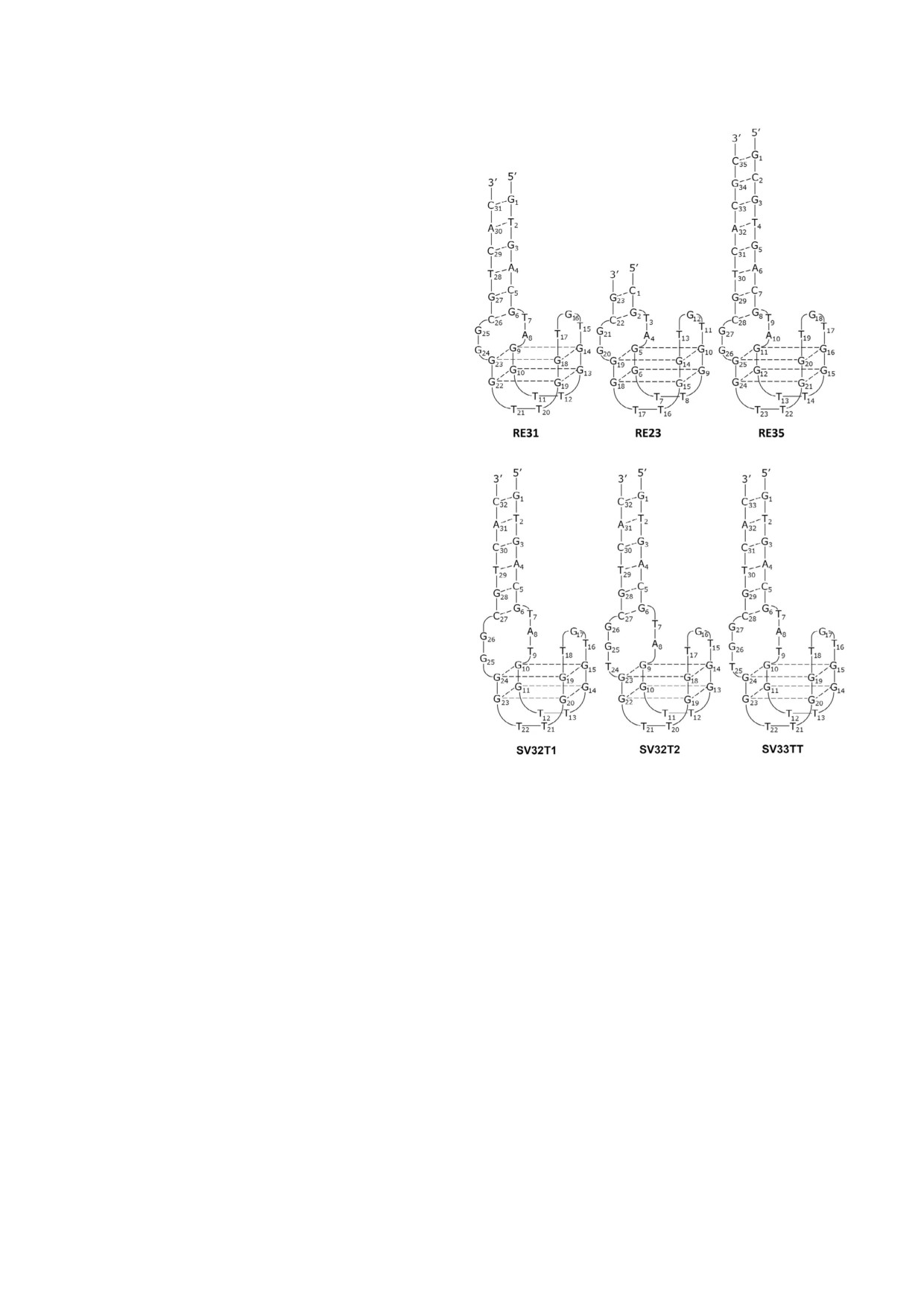
тельно центрального квадруплекса (рис. 1). Изу
чение структуры комплекса RE31 с тромбином
показало, что его связывание с белком идет по
тому же механизму, что и 15TBA, - через малые
Т Т петли и с участием тех же аминокислотных
остатков тромбина [8]. Однако RE31 более ста
Рис. 1. Вторичные структуры аптамеров RE31, RE23 (ми
билен, чем 15TBA [11], и существенно эффек
нимальная длина дуплексной области), RE35 (максималь
ная длина дуплексной области), SV32T1 (вставка тимиди
тивнее, чем 15TBA, ингибирует индуцированное
на (Т9) в шарнирную область), SV32T2 (вставка тимидина
тромбином образование фибрина из фибриноге
(Т24) в шарнирную область), SV33TT (вставка двух тими
на в тестах тромбиновое время, протромбиновое
динов (Т9 и Т25) в шарнирную область)
время и активированное частичное тромбоплас
тиновое время (АЧТВ) и индуцированную тром
бином агрегацию тромбоцитов [9, 10, 12]. Таким
МЕТОДЫ ИССЛЕДОВАНИЯ
образом, наличие шарнирного и дуплексного
участка в RE31, очевидно, повышает эффектив
Аптамеры. В работе использовали следую
ность связывания аптамера с тромбином и его
щие антитромбиновые аптамеры:
способность ингибировать опосредованные
тромбином протромботические реакции.
RE31 5′ GTGACGTAGGTTGGTGTGGTTGGGGCGTCAC 3′
RE35 5′ GCGTGACGTAGGTTGGTGTGGTTGGGGCGTCACGC 3′
В настоящей работе мы сравнивали свойства
RE33 5′ CGTGACGTAGGTTGGTGTGGTTGGGGCGTCACG 3′
аптамера RE31 c его аналогами, содержащими
RE29 5′ TGACGTAGGTTGGTGTGGTTGGGGCGTCA 3′
разное количество оснований в дуплексной об
RE27 5′ GACGTAGGTTGGTGTGGTTGGGGCGTC 3′
ласти и вставки нуклеотидов в шарнирной об
RE25 5′ ACGTAGGTTGGTGTGGTTGGGGCGT 3′
ласти. Также мы исследовали антитромботичес
RE23 5′ CGTAGGTTGGTGTGGTTGGGGCG 3′
кие свойства RE31 в тесте генерации тромбина,
SV32T1 5′ GTGACGTATGGTTGGTGTGGTTGGGGCGTCAC 3′
в модели фибринолиза in vitro и в модели арте
SV32T2 5′ GTGACGTAGGTTGGTGTGGTTGGТGGCGTCAC 3′
риального тромбообразования in vivo.
SV33TT 5′ GTGACGTAТGGTTGGTGTGGTTGGТGGCGTCAC 3′.
БИОХИМИЯ том 84 вып. 12 2019
1878
СПИРИДОНОВА и др.
Структуры аптамера сравнения RE31 и его
Stago», Франция). Во всех тестах объем плазмы
аналогов - аптамеров RE23 (минимальная дли
составлял 1/3 от объема реакционной смеси, к
на дуплексной области), RE35 (максимальная
которой были добавлены разные аптамеры в
длина дуплексной области), SV32T1, SV32T2 и
указанных концентрациях. Эффекты аптамеров
SV33TT (вставки тимидина в шарнирную об
оценивали по отношению времени свертывания
ласть) представлены на рис. 1. При исследова
образцов, содержащих аптамеры, ко времени
нии эффектов аптамера RE31 в модели артери
свертывания контрольных образцах без апта
ального тромбоза in vivo использовали его моди
меров.
фицированный вариант - NH2 RE31 PEG, со
Тест генерации тромбина. Влияние аптамера
держащий NH2 группу и низкомолекулярный
RE31 на динамику образования и инактивации
(300 Д) полиэтиленгликоль (PEG) на 3′ и 5′
тромбина в пуле плазм здоровых доноров иссле
концах олигонуклеотида соответственно. Такая
довали с помощью теста генерации тромбина c
модификация защищает концевые нуклеотиды
использованием набора реактивов
«PPP
от действия нуклеаз и удлиняет время жизни ап
Reagent» производства «Thrombinoscope» (Ни
тамера в кровотоке без существенного измене
дерланды). В ячейки 96 луночной плашки вно
ния его антитромбиновой активности [13]. Все
сили по 80 мкл плазмы, содержащей аптамер в
аптамеры были синтезированы и очищены в
диапазоне концентрации до 5 мкМ, добавляли
ЗАО «Синтол». Аптамеры стандартно растворя
по 20 мкл «триггерного» реактива, содержащего
ли в буфере, содержащем 140 мМ NaCl, 5 мМ
рекомбинантный человеческий тканевой фак
KCl, 20 мМ HEPES, pH 7,4. Наличие G квад
тор и фосфолипиды (конечные концентрации
руплексной структуры в синтезированных апта
5 пкМ и 4 мкМ соответственно). Для калибров
мерах подтверждали спектрами кругового ди
ки флуоресцентного сигнала в контрольные
хроизма, которые регистрировали в спектромет
ячейки вместо «триггерного» раствора вносили
ре Chirascan («Applied Photophysics Ltd», Вели
по 20 мкл калибратора, содержащего комплекс
кобритания). Спектры имели характерный для
тромбин α2 макроглобулин (730 нМ). Плашку
антипараллельных G квадруплексов максимум
помещали в планшетный флюориметр «Fluoro
при 294 нм [14] (данные не представлены).
scan Ascent» производства «Thermolabsystems
Температура плавления аптамеров. Стабиль
OY» (Финляндия) и после инкубации (10 мин
ность структуры G квадруплексов в аптамерах
при 37 °С) реакцию инициировали добавлением
изучали, измеряя температуру плавления олиго
20 мкл HEPES буфера (рН 7,35), содержащего
нуклеотидных образцов [15]. Измерения прово
субстрат тромбина Z Gly Gly Arg AMC и СаCl2.
дили на двулучевом спектрофотометре Hitachi
Реакцию регистрировали в течение 30 мин. Ана
U 2900 UV/Visible Spectrophotometer (Япония) в
лиз результатов проводили с помощью програм
термостатируемом кюветном отделении, снаб
мы Thrombinoscope (версия 3.0.0.29).
женном термоконтроллером Temperature Con
Модель фибринолиза in vitro. Для исследова
troller SPR 10. Конформационные переходы ре
ния профибринолитического действия аптамера
гистрировали при 294 нм (характеристическая
RE31 использовали модификацию предложен
длина волны для G квадруплексных структур,
ного ранее турбидиметрического метода регист
при которой процесс денатурации сопровожда
рации образования и лизиса сгустков плазмы in
ется гипохромным эффектом); скорость нагре
vitro [16]. В ячейки 96 луночного планшета вно
вания составляла 0,5 °С в мин. УФ поглощение
сили 60 мкл раствора аптамера (конечная конце
аптамерных образцов при 260 нм варьировало от
нтрация от 0 до 1 мкМ) или ингибитор карбокси
0,6 до 0,7. Температура плавления образца соот
пептидазы из картофеля (PCI) («Sigma», США)
ветствовала температуре, при которой 50% G
(конечная концентрация - 20 мкг/мл), и 70 мкл
квадруплекса находится в денатурированном
тромбопластина («Вade Behring», Германия),
состоянии (точка перегиба на кооперативной
разбавленного 1 : 500 раствором 25 мМ CaCl2,
кривой плавления).
содержащим 5 мМ КCl. Плашку инкубировали
Коагуляционные тесты. Влияние аптамеров
10 мин при 37 °C в планшетном термостате
на активацию системы свертывания крови и об
шейкере «Elmi» (Латвия). Реакцию иницииро
разование фибрина исследовали, измеряя
вали добавлением 70 мкл пула плазм здоровых
тромбиновое время, протромбиновое время и
доноров, к которому был добавлен тканевой ак
АЧТВ в пуле плазм здоровых доноров, как по
тиватор плазминогена (тАП)
(«Boehringer
дробно описано ранее [9]. Измерения выполня
Ingelheim», Германия) в конечной концентра
ли на анализаторе «STA Сompact» с использо
ции 25 нг/мл. Плашку помещали в термостати
ванием наборов реактивов «STA Neoplastin
руемый при
37
°C планшетный фотометр
Plus», «STA APTT», «STA Thrombin» и «Pool
Multiscan Go «Thermo Scientific» (Финляндия) и
Norm» (анализатор и реактивы «Diagnostica
с интервалом в 1 мин регистрировали измене
БИОХИМИЯ том 84 вып. 12 2019
АНТИТРОМБИНОВЫЕ АПТАМЕРЫ
1879
ния оптической плотности (А450) в течение
60 мин.
Активация TAFI (активируемый тромбином
ингибитор фибринолиза). Активацию TAFI из
плазм доноров экзогенным комплексом тром
бин тромбомодулин исследовали, оценивая
уменьшение поглощения при 405 нм пептидно
го хромогенного субстрата (CBS 02.98) с исполь
зованием набора реактивов
«STA Stachrom
TAFI» («Diagnostica Stago», Франция) в соответ
ствии с рекомендациями производителя. Эф
фекты аптамера RE31 на эту реакцию изучали,
добавляя его в инкубационную смесь в различ
ных концентрациях.
Модель тромбообразования in vivo. Исследо
вание действия аптамера NH2 RE31 PEG на ар
териальное тромбообразование in vivo проводи
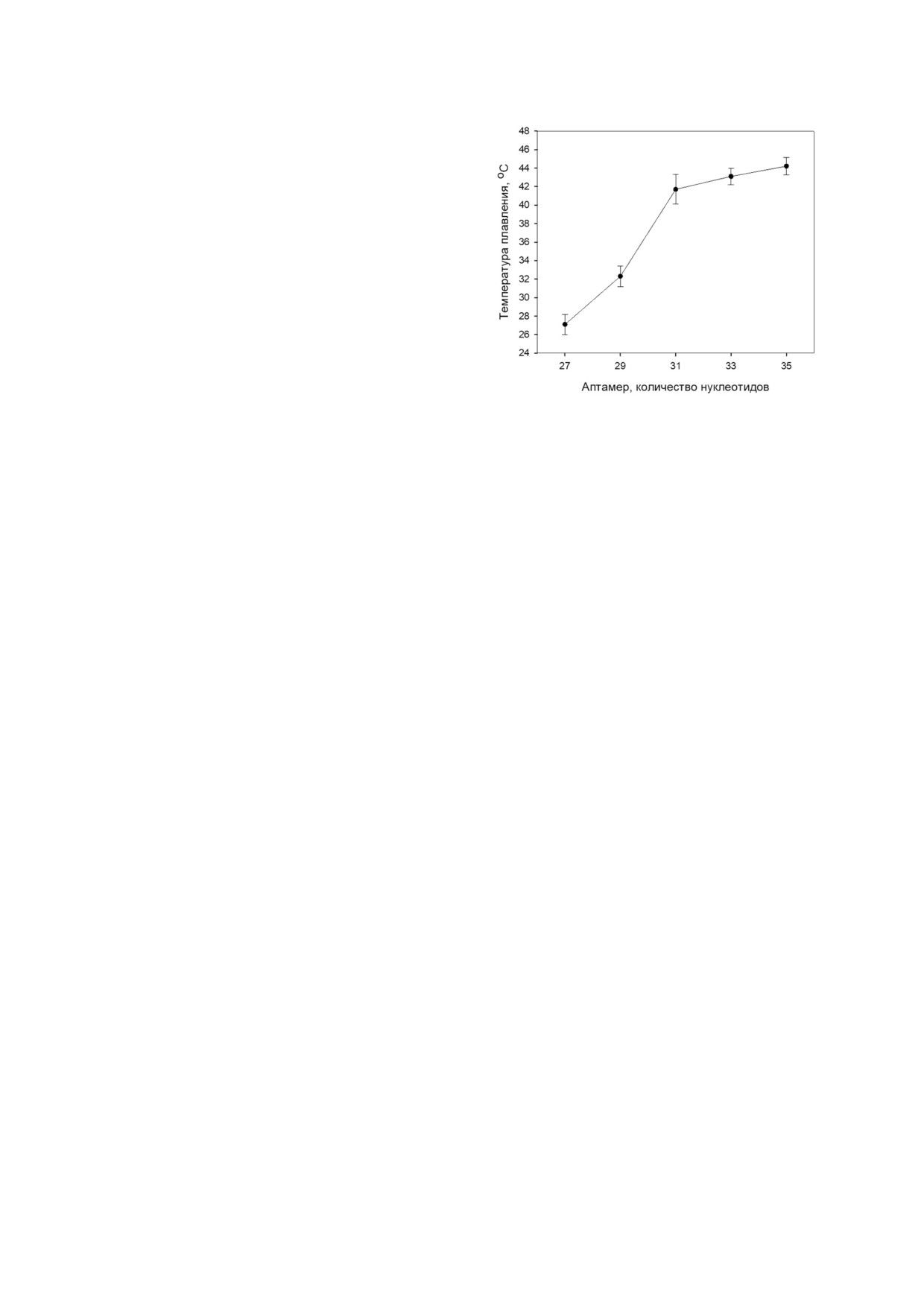
Рис. 2. Температура плавления аптамеров с измененной
длиной дуплексной области. Тестируемые аптамеры RЕ27,
ли на крысах, используя FeCl3 модель [17], как
RE29, RE31, RE33 и RE35 состоят из 27, 29, 31, 33 и 35 нук
подробно описано ранее [18]. У анестезирован
леотидов и содержат в дуплексной области 4, 5, 6, 7 и 8 п.о.
ных с помощью препарата «Золетил» крыс сам
соответственно (примеры структуры см. рис. 1). По оси
цов линии Sprague Dawley (из питомника лабо
абсцисс - количество нуклеотидов в аптамерах. Представ
лены средние ± стандартные отклонения (n = 4)
раторных животных, г. Пущино, Московская
обл.) весом 400-500 г изолировали каротидную
артерию и повреждали сосуд наложением на
генно добавляемым тромбином, а в тестах про
15 мин сегмента фильтровальной бумаги, смо
тромбиновое время и АЧТВ - эндогенным тром
ченной раствором FeCl3. FeCl3 использовали в
бином, образующимся при активации свертыва
двух концентрациях - 20 и 40%. Аптамер NH2
ния по внешнему и внутреннему пути соответ
RE31 PEG в различных концентрациях вводили
ственно. Антикоагуляционная активность апта
внутривенно в виде однократного болюса через
меров в этих тестах проявляется в удлинении
5 мин после наложения FeCl3. Кровоток регист
времени коагуляции, которое соотносили со
рировали с помощью датчика Холла, наложен
временем коагуляции в контрольных образцах
ного выше места повреждения сосуда. В каждом
без аптамеров. Наиболее короткие аптамеры
эксперименте измеряли время полной останов
RE23 и RE25, содержащие в дуплексной облас
ки кровотока, проводя эксперимент в течение
ти 2 и 3 п.о. соответственно, обладают наиболее
60 мин после начала воздействия FeCl3.
низкой и приблизительно одинаковой антикоа
гуляционной активностью во всех тестах
(рис. 3). Удлинение дуплексной области в апта
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
мере RE27 до 4 п.о., а в аптамере RE29 до 5 п.о.
последовательно приводит к существенному
Свойства антитромбиновых аптамеров с раз
усилению антикоагуляцонной активности, ко
ной длиной дуплексной области. Стабильность
торая сохраняется на приблизительно таком же
структуры G квадруплекса в серии антитромби
уровне в аптамерах RE31, RE33 и RE35, содер
новых аптамеров, родственных RE31 с разной
жащих 6, 7 и 8 п.о. соответственно (рис. 3).
длиной дуплексной области (примеры - рис. 1)
Свойства антитромбиновых аптамеров, содер
оценивали, измеряя температуру их плавления
жащих вставки в шарнирной области. Аптамеры
(50% снижение УФ поглощения при 294 нм) в
SV32T1, SV32T2 и SV33TT по сравнению с апта
диапазоне от 25 до 45 °С. Уменьшение длины
мером RE31 содержали один (SV32T1 и SV32T2)
дуплексной области c 6 п.о. (RE31) до 5 (RE29) и
или два (SV33TT) дополнительных тимидина
4 (RE27) п.о. приводило к резкому снижению, а
(Т), вставленных в шарнирную область слева,
увеличение до 7 (RE33) и 8 (RE35) п.о. сущест
справа и с обеих сторон G квадруплекса соответ
венно не изменяло температуру плавления апта
ственно (рис. 1). Изменения шарнирной облас
меров (рис. 2).
ти приводили к снижению антикоагуляционной
Антитромбиновую активность аптамеров
активности аптамеров по сравнению с аптаме
изучали, используя коагуляционные тесты,
ром RE31 в тестах тромбиновое время, протром
тромбиновое время, протромбиновое время и
биновое время и АЧТВ (рис. 4).
АЧТВ. Образование фибрина в плазме крови в
Ингибирование генерации тромбина аптаме
тесте тромбиновое время стимулируется экзо
ром RE31. Для изучения влияния RE31 на дина
БИОХИМИЯ том 84 вып. 12 2019
1880
СПИРИДОНОВА и др.
только с активным центром фермента, на состо
a
яние которого аптамеры не влияют [5, 9, 12].
Как можно видеть из данных, представленных
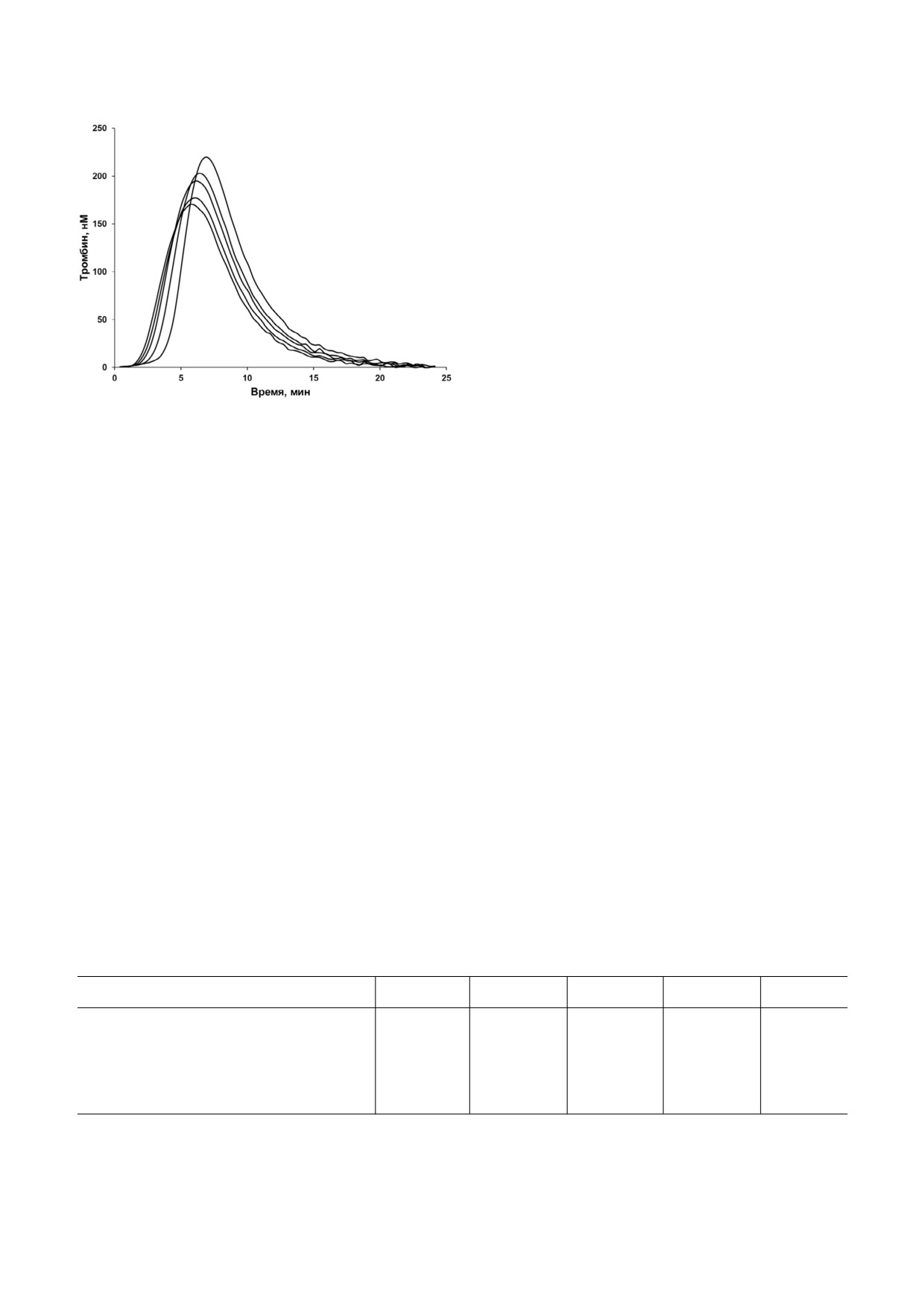
на рис. 5 и в таблице, с увеличением концентра
ции RE31 увеличивается продолжительность
лаг фазы и времени достижения пика активнос
ти тромбина. При этом наблюдается также и не
которое увеличение пиковой активности тром
бина и эндогенного тромбинового потенциала,
определяемого по площади под кривой, отража
ющей изменение активности тромбина во вре
мени.
Потенцирование фибринолиза in vitro аптаме
ром RE31. Для исследования профибринолити
б
в
Рис. 3. Антикоагуляционные эффекты аптамеров с изме
ненной длиной дуплексной области. Тестируемые аптаме
ры RE23, RE25, RЕ27, RE29, RE31, RE33 и RE35 состоят из
23, 25, 27, 29, 31, 33 и 35 нуклеотидов и содержат в дупле
ксной области 2, 3, 4, 5, 6, 7 и 8 п.о. соответственно (при
меры структуры см. рис. 1). По оси абсцисс - количество
нуклеотидов в аптамерах. а - Тест тромбиновое время; б -
тест протромбиновое время; в - тест АЧТВ. Эффекты апта
меров оценивали по отношению времени коагуляции (лаг
Рис. 4. Антикоаглуяционные эффекты аптамеров с изме
фазы) в образцах с аптамерами ко времени коагуляции в
ненной шарнирной областью. RE31 - аптамер сравнения,
контрольных образцах (без аптамеров). Кривые: 1 - кон
SV32T1, SV32T2 и SV32TT - аптамеры, содержащие в шар
центрация аптамеров 0,8 мкМ, кривые 2 - концентрация
нирной области по одному дополнительному тимидину
аптамеров 0,4 мкМ. Представлены средние ± стандартные
(справа и слева от G квадруплекса) и два дополнительных
отклонения (n = 3)
тимидина соответственно (структуры - см. рис. 1). А1,
А2 - тест тромбиновое время, Б1, Б2 - тест протромбино
вое время, В1, В2 - тест АЧТВ. Эффекты аптамеров оцени
мику образования и инактивации тромбина ис
вали по отношению времени коагуляции (лаг фазы) в об
разцах с аптамерами ко времени коагуляции в контроль
пользовали тест генерации тромбина. В этом
ных образцах (без аптамеров). А1, Б1, В1 - концентрация
тесте активность тромбина в плазме крови опре
аптамеров 0,8 мкМ; А2, Б2, В2 - концентрация аптамеров
деляется по расщеплению флуорогенного низ
0,4 мкМ. Представлены средние ± стандартные отклоне
комолекулярного субстрата, связывающегося
ния (n = 3)
БИОХИМИЯ том 84 вып. 12 2019
АНТИТРОМБИНОВЫЕ АПТАМЕРЫ
1881
50% от максимального значения, t полулизиса)
(рис. 6). Это свидетельствует о том, что аптамер
не только замедляет образование фибрина, но и
ускоряет лизис фибринового сгустка тАП. Про
фибринолитический эффект, близкий к макси
мальному, наблюдаемому в присутствии избыт
ка PCI, достигается при концентрациях RE31
0,6-1,0 мкМ (рис. 6, б). В отдельном экспери
менте с использованием хромогенного субстра
та было показано, что аптамер RE31 способен
ингибировать активацию TAFI комплексом
тромбин-тромбомодулин (рис. 6, в).
Ингибирование тромбообразования аптамером
NH2 RE31 PEG в модели in vivo. Для изучения
эффектов аптамера RE31 в модели тромбообра
зования in vivo использовали его модифициро
Рис. 5. Влияние аптамера RE31 на динамику образования и
ванный вариант NH2 RE31 PEG, в котором для
инактивации тромбина в тесте генерации тромбина. С уве
удлинения времени жизни в кровотоке 3′ и
личением концентрации RE31 (0, 0,625, 1,25, 2,5 и
5′ концы олигонуклеотида были защищены
5,0 мкМ) кривые смещаются вправо и вверх. Кривые
представляют собой средние трех параллельных измере
введением NH2 группы и PEG соответственно.
ний в одном из трех воспроизводимых экспериментов, вы
Исследование антитромботических эффектов
полненных с использованием одного пула плазм доноров.
аптамера проводили на крысах, используя
Количественный анализ кривых генерации тромбина
FeCl3 модель артериального тромбоза. Как вид
представлен в таблице
но из рис. 7, у контрольных животных тромбо
тическая окклюзия поврежденной FeCl3 изоли
ческого действия аптамера RE31 использовали
рованной каротидной артерии наступала при
модификацию предложенного ранее турбиди
близительно через 12 и 18 мин при использова
метрического метода регистрации образования
нии 20% и 40% ного раствора FeCl3 соответ
и лизиса сгустков плазмы in vitro [16]. Образова
ственно. При использовании FeCl3 в обеих кон
ние фибрина стимулировали тромбопластином,
центрациях NH2 RE31 PEG дозозависимо уд
а его растворение тАП. В качестве положитель
линял время тромботической окклюзии, а при
ного контроля использовали пептидный инги
максимальных дозировках полностью предотв
битор карбоксипептидаз (PCI), который подав
ращал остановку кровотока в течение времени
ляет активность TAFI [19] и благодаря этому ус
эксперимента (60 мин). При повышении конце
коряет растворение фибрина. Изменения пог
нтрации FeCl3, т.е. при более выраженном пов
лощения (А450) в ходе реакции характеризуется
реждении артерии, увеличивались и дозировки
наличием двух фаз - быстрого повышения,
NH2 RE31 PEG, необходимые для подавления
обусловленного образованием рассеивающего
тромбообразования.
свет фибрина, и снижения, обусловленного его
лизисом (рис. 6, а). С увеличением концентра
ции аптамера скорость образования фибрина
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
уменьшается (увеличение времени достижения
максимального значения А450, tA450 макс), а
ДНК аптамеры, содержащие в своем составе
скорость его лизиса повышается (укорочение
G квадруплексную структуру, две Т Т петли и
времени, в течение которого А450 снижается до
одну T G T петлю, связываются с экзосайтом I
Действие аптамера RE31 на образование тромбина. Тест генерации тромбина
RE31, мкМ
0
0,625
1,25
2,5
5
Лаг фаза, мин
2,4 ± 0,1
2,4 ± 0,1
2,7 ± 0,1
3,1 ± 0,1
4,1 ± 0,1
Время достижения пика тромбина, мин
5,8 ± 0,1
6,1 ± 0,33
6,3 ± 0,17
6,4 ± 0,1
7,1 ± 0,1
Пик тромбина (нМ)
170,0 ± 2,64
176,9 ± 9,94
194,7 ± 1,23
202,7 ± 4,88
218,8 ± 3,22
Эндогенный потенциал тромбина (нМ × мин)
1085,6 ± 10,3
1138,17 ± 73,7
1241,56 ± 19,0
1249,7 ± 40,14
1311,0 ± 13,3
Примечание. Представлены средние ± стандартные отклонения трех параллельных измерений в одном из трех
воспроизводимых экспериментов.
8 БИОХИМИЯ том 84 вып. 12 2019
1882
СПИРИДОНОВА и др.
FeCl3 20%
FeCl3 40%
Рис. 7. Действие аптамера NH2 RE31 PEG на артериаль
ное тромбообразование in vivo. Крысы, FeCl3 модель. Ре
гистрировали время тромботической окклюзии повреж
денной FeCl3 каротидной артерии крыс. Аптамер NH2
RE31 PEG вводили внутривенно в виде болюса в указан
ных концентрациях. FeCl3 использовали в двух концентра
циях - 20% (черный кружок) и 40% (бесцветный кружок).
Представлены средние двух-трех экспериментов (для
каждой концентрации FeCl3 и аптамера)
тромбина. Они препятствуют взаимодействию с
экзосайтом I субcтратов тромбина - фибрино
гена и PAR рецепторов и благодаря этому по
давляют стимулированные тромбином образо
вание фибрина и агрегацию тромбоцитов [5-9].
Ранее нами был синтезирован аптамер с услов
ным названием RE31 (5′ GTGACGTAGGTTG
GTGTGGTTGGGGCGTCAC 3′), в котором к
G квадруплексу были последовательно присое
динены шарнирная структура, содержащая че
Рис. 6. Влияние аптамера RE31 на образование и лизис фиб
тыре непарных нуклеотида, и дуплексная струк
рина плазмы здоровых доноров in vitro и активацию TAFI.
тура, содержащая 6 пар комплементарных осно
а - Графики изменения поглощения при 450 нм (А450). Во
избежание перегрузки рисунка приведены только три кри
ваний [10]. Этот аптамер обладал большей анти
вые, демонстрирующие динамику образования и лизиса
коагуляционной активностью по сравнению как
фибрина: 1 - контрольный образец; 2 - в присутствии
с базовым аптамером 15TBA, в состав которого
0,6 мкМ аптамера RE31; 3 - в присутствии 20 мкг/мл PCI,
входит только G квадруплекс, Т Т и T G T
ингибитора карбоксипептидазной активности TAFI, в на
петли (5′ GGTTGGTGTGGTTGG 3′), так и по
сыщающей концентрации. Представлены кривые, получен
ные в одном из трех воспроизводимых экспериментов; б -
сравнению с еще одним 31 звенным аптамером
два основных количественных показателя, характеризую
(5′ CACTGGTAGGTTGGTGTGGTTGGGGC
щих динамику образования фибрина, - tA450 макс (время
CAGTG 3′), одним из наиболее активных из
от запуска свертывания до достижения наибольшего значе
описанных в литературе антитромбиновых ап
ния А450, темные столбцы) и его лизис - t полулизиса (вре
мя от достижения A450 макс до снижения амплитуды на
тамеров [9, 10, 12].
50% от максимальной величины, светлые столбцы) в зави
В настоящей работе сравнивали свойства ап
симости от концентрации RE31 (мкМ). Показаны также
тамера RE31 и его аналогов, в которых: 1) была
значения, полученные в присутствии 20 мкг/мл PCI. Предс
изменена длина дуплексной области, и 2) были
тавлены средние ± стандартные отклонения трех парал
введены вставки в шарнирную область (рис. 1).
лельных измерений в одном из трех воспроизводимых экс
периментов; в - влияние аптамера RE31 на активацию TAFI
Сравнительный анализ показал, что аптамер
из плазмы доноров комплексом тромбин-тромбомодулин.
RE31 имеет оптимальную структуру с точки зре
По оси ординат - уменьшение поглощения при 405 нм
ния сохранения стабильности (температура
( dА405 = А405 исходное - А405 10 мин), происходящее в
плавления) и проявления антитромбиновой
результате расщепления пептидного хромогенного субстра
та, по оси абсцисс - концентрация RE31. Представлены
(антикоагуляционной) активности в тестах
средние из двух-трех экспериментов
тромбиновое время, протромбиновое время и
БИОХИМИЯ том 84 вып. 12 2019
АНТИТРОМБИНОВЫЕ АПТАМЕРЫ
1883
АЧТВ. Уменьшение длины дуплексной области
ких концентраций аптамера 15TBA и С конце
с 6 п.о. (RE31) до 5 и 4 приводили к резкому сни
вого фрагмента гирудина (Hir 54-65(SO3-)), ко
жению температуры плавления, а до 4, 3 и 2 п.о. -
торые связываются только с экзосайтом I [21].
к существенной потере антикоагуляционной ак
Объяснением этих эффектов может быть аллос
тивности. Эти данные соответствуют результа
терическое влияние связывания низкомолеку
там работы Spiridonova et al. [20], в которой ме
лярных лигандов (аптамеров и фрагмента гиру
тодом поверхностного плазмонного резонанса
дина) с экзосайтом I тромбина на структуру ак
было показано, что укорочение дуплексной об
тивного центра, в результате которых может из
ласти в аналогах RE31 вызывает снижение их
меняться скорость расщепления тромбином
сродства к тромбину и протромбину. В то же
синтетических субстратов, что было показано в
время удлинение дуплексной области с 6 (RE31)
ряде исследований [24, 25].
до 7 и 8 п.о. не приводили к существенному из
Исследование эффектов аптамера RE31 на
менению стабильности и активности аптамеров.
лизис фибрина в модели in vitro показали, что он
В аптамере RE31 переход от G квадруплексного
не только замедляет образование фибрина (за
к дуплексному участку включает четыре непар
счет подавления активности тромбина), но и ус
ных нуклеотида, образующих шарнирную об
коряет его расщепление тАП. Одним из возмож
ласть. Введение дополнительных нуклеотидов
ных объяснений этого эффекта может быть про
(тимидинов) в шарнирную область слева (апта
демонстрированное в работе ингибирование ап
мер SV32T1), справа (аптамер SV32T2) и по обе
тамером активации TAFI. В пользу этого пред
им сторонам (аптамер SV33TT) G квадруплекса
положения также свидетельствует то, что с уве
(рис. 1) приводило к снижению антитромбино
личением концентрации RE31 время полулизи
вой активности аптамеров. Эти результаты ука
са сокращается до значения, наблюдаемого в
зывают на то, что размер шарнирной области
присутствии избытка PCI, ингибитора карбокси
(изменяющийся при введении дополнительных
пептидазной активности TAFI [19], который не
оснований) влияет на взаимодействие аптамера
влияет на образование фибрина (восходящие
с тромбином. Они также согласуются с данными
части кривых 1 и 3 на рис. 6, а, характеризиру
рентгеноструктурного анализа комплекса RE31
ющие образование фибринового сгустка в отсут
тромбин, показавшими, что три нуклеотида в
ствии и присутствии PCI, практически совпада
шарнирной области G24 A8 G25 образуют лест
ют).
ницу перехода от квадруплекса к дуплексу, т.е.
Антитромботическую активность аптамера
жестко структурируют данный район с по
RE31 (модифицированный вариант с защищен
мощью стэкинг взаимодействия [8].
ными 3′ и 5′ концами) в условиях in vivo изучали,
В следующей части работы мы более подроб
используя модель тромбообразования у крыс.
но изучали антитромботические эффекты апта
Изолированную артерию повреждали FeCl3, что
мера RE31, используя тест генерации тромбина,
приводило ее к полной окклюзии образовав
модель фибринолиза in vitro и модель тромбооб
шимся тромбом. Внутривенное введение апта
разования in vivo.
мера удлиняло время тромботической окклю
Аптамер RE31 замедлял образование тром
зии, а при использовании высоких дозировок
бина (удлинение лаг фазы и времени достиже
полностью предотвращало тромбообразование.
ния пика активности), что согласуется с данны
Аптамер RE31 (по сравнению со своими ана
ми, полученными Kretz et al. [21, 22] при изуче
логами) обладает оптимальной структурой с
нии базового антитромбинового аптамера
точки зрения стабильности и проявления анти
15TBA. Удлинение временных показателей ге
коагуляционной активности. Этот аптамер за
нерации тромбина может быть обусловлено дву
медляет образование тромбина в тесте генера
мя причинами: 1) снижением скорости актива
ции тромбина, ускоряет фибринолиз в модели in
ции протромбина и/или 2) снижением скорости
vitro и подавляет тромбообразование в модели in
активации факторов V и VIII, посредством кото
vivo. Аптамер RE31 может рассматриваться как
рых тромбин усиливает свое образование
кандидат для создания на его основе эффектив
[21-23]. Другой проявившейся в тесте генера
ного антитромботического препарата.
ции тромбина особенностью механизма
действия RE31 является повышение пика актив
ности тромбина и эндогенного тромбинового
Конфликт интересов. Авторы заявляют об от
потенциала. Эти показатели определяются по
сутствии конфликта интересов.
расщеплению синтетического флуорогенного
Соблюдение этических норм. Настоящая ра
субстрата, который связывается только с актив
бота не содержит каких либо исследований, в
ным центром тромбина. Похожие эффекты бы
которых в качестве объектов были использова
ли зарегистрированы при использовании низ
ны люди. Работу с лабораторными животными
БИОХИМИЯ том 84 вып. 12 2019
8*
1884
СПИРИДОНОВА и др.
проводили в соответствии с требованиями Ко
ции выполняли в соответствии с руководством
миссии по биоэтике НИИ физико химической
Федерации европейских научных ассоциаций
биологии им. А.Н. Белозерского. Все манипуля по лабораторным животным.
СПИСОК ЛИТЕРАТУРЫ
1.
Keefe, A.D., Pai, S., and Ellington, A. (2010) Aptamers as
14.
Nagatoishi, S., Tanaka, Y., and Tsumoto, K.
(2007)
therapeutics, Nat. Rev. Drug Discov.,
9,
537-550,
Circular dichroism spectra demonstrate formation of the
doi: 10.1038/nrd3141.
thrombin binding DNA aptamer G quadruplex under sta
2.
Ni, X., Castanres, M., Mukherjee, A., and Lupoid, S.E.
bilizing cation deficient conditions, Biochem. Biophys.
(2011) Nucleic acid aptamers: clinical application and
Res. Commun.,
352,
812-817, doi:
10.1016/j.bbrc.
promising new horizons, Curr. Med. Chem.,
18,
2006.11.088.
4206-4214.
15.
Dolinnaya, N.G., Ogloblina, A.M., and Yakubovskaya, M.G.
3.
Li, W., Wang, K., Zhao, M., Yang, X., Chen, M., and
(2016) Structure, properties, and biological relevance of
Lan, X. (2014) Development of aptamer oligonucleotides
the DNA and RNA G quadruplexes: Overview 50 years
as anticoagulants and antithrombotics for cardiovascular
after their discovery, Biochemistry (Moscow),
81,
diseases: current status, Thromb. Res., 134, 769-773,
1602-1649, doi: 10.1134/S0006297916130034.
doi: 10.1016/j.thromres.2014.05.021.
16.
Mutch, N.J., Thomas, L., Moore, N.R., Lisiak, K.M., and
4.
Crawley, J.T., Zanardelli, S., Chion, C.K., and Lane, D.A.
Booth, N.A. (2007) TAFIa, PAI 1 and a2 antiplasmin:
(2007) The central role of thrombin in hemostasis, J.
complementary roles in regulating lysis of thrombi and
Thromb. Haemost., 5, 95-101, doi: 10.1111/j.1538
plasma clots, J. Thromb. Haemost.,
5,
812-817,
7836.2007.02500.x.
doi: 10.1111/j.1538 7836.2007.02430.x.
5.
Bock, L.C., Griffin, L.C., Latham, J.A., Vermaas, E.H.,
17.
Kurz, K.D., Main, B.W., and Sandunsky, G.E. (1990) Rat
and Toole, J.J. (1992) Selection of single stranded DNA
model of arterial thrombosis by ferric chloride, Thromb.
molecules that bind and inhibit human thrombin, Nature,
Res., 15, 269-280.
355, 564-566, doi: 10.1038/355564a0.
18.
Maksimenko, A.V., Golubykh, V.L., and Tischenko, E.G.
6.
Macaya, R.F., Schultze, P., Smith, F.W., Roe, J.A., and
(2003) Catalase and chondroitin sulfate derivatives against
Feigon, J. (1993) Thrombin binding DNA aptamer forms
thrombotic effect induced by reactive oxygen species in a
a unimolecular quadruplex structure in solution, Proc.
rat artery. Metab. Eng., 5, 177-182.
Natl. Acad. Sci. USA, 90, 3745-3749, doi: 10.1073/pnas.
19.
Bouma, B.N., and Meijers, J.C.M. (2003) Thrombin acti
90.8.3745.
vatable fibrinolysis inhibitor (TAFI, plasma procar
7.
Padmanabhan, K.P., Ferrara, J.D., Sadker, J.E., and
boxypeptidase B, procarboxypeptidase R, procarboxypep
Tulinsky, A. (1993) The structure of α thrombin inhibited
tidase U), J. Thromb. Haemost., 1, 1566-1574.
by a 15 mer single stranded DNA aptamer, J. Biol. Chem.,
20.
Spiridonova, V.A., Barinova, K.V., Glinkina, K.A.,
268, 17651-17654, doi: 10.2210/pdb1hut/pdb.
Melnichuk, A.V., Gainutdynov, A.A., Safenkova, I.V., and
8.
Russo Krauss, I.R., Spiridonova, V., Pica, A., Napolitano, V.,
Dzantiev, B.B. (2015) A family of DNA aptamers with varied
and Sica, F. (2016) Different duplex/quadruplex junctions
duplex region length that forms complexes with thrombin
determine the properties of anti thrombin aptamers with
and prothrombin, FEBS Lett.,
589,
2043-2049,
mixed folding, Nucleic Acids Res.,
44,
983-991,
doi: 10.1016/j.febslet.2015.06.020.
doi: 10.1093/nar/gkv1384.
21.
Kretz, C.A., Cuddy, K.K., Stafford, A.R., Fredenburgh, J.C.,
9.
Добровольский А.Б., Титаева Е.В., Хаспекова С.Г.,
Roberts, R., and Weitz, J.I. (2010) HD1, a thrombin and
Спиридонова В.А., Копылов А.М., Мазуров А.В.
prothrombin binding DNA aptamer, inhibits thrombin
(2009) Ингибирование активности тромбина ДНК ап
generation by attenuating prothrombin activation and
тамерами, Бюлл. Эксп. Биол. Мед., 148, 41-45.
thrombin feedback reactions, Thromb. Haemost., 103,
10.
Cпиридонова В.А., Головин А.В., Копылов А.М., Доб
83-93, doi: 10.1160/TH09 04 0237.
ровольский А.Б., Мазуров А.В. (2010) Аптамерный
22.
Kretz, C.A., Stafford, A.R., Fredenburgh, J.C., and Weitz, J.I.
олигонуклеотид - прямой ингибитор тромбина. Па
(2006) HD1, a thrombin directed aptamer, binds exosite 1
тент РФ № 2401306, Бюлл. изобретений, 28.
on prothrombin with high affinity and inhibits its activation
11.
Russo Krauss, I., Napolitano, V., Petraccone, L., Troisi, R.,
by prothrombinase, J. Biol. Chem., 281, 37477-37485,
Spiridonova, V., Mattia, C.A., and Sica, F.
(2018)
doi: 10.1074/jbc.M607359200.
Duplex/quadruplex oligonucleotides: role of the duplex
23.
Bukys, M.A., Orban, T., Kim, P.Y., Beck, D.O., Nesheim, M.E.,
domain in the stabilization of a new generation of highly
and Kalafatis, M. (2006) The structural integrity of anion
effective anti thrombin aptamers, Int. J. Biol. Macromol.,
binding exosite I of thrombin is required and sufficient for
107 (Pt B), 1697-1705, doi: 10.1016/j.ijbiomac.2017.
timely cleavage and activation of factor V and factor VIII,
10.033.
J. Biol. Chem., 281, 18569-18580, doi: 10.1074/jbc.
12.
Мазуров А.В., Титаева Е.В., Хаспекова С.Г., Сторожи
M600752200.
лова А.Н., Спиридонова В.А., Копылов А.М., Добро
24.
Petrera, N.S., Stafford, A.R., Leslie, B.A, Kretz, C.A.,
вольский А.Б. (2010) Свойства нового ДНК аптаме
Fredenburgh, J.C., and Weitz, J.I. (2009) Long range com
ра - прямого ингибитора тромбина, Бюлл. Эксп. Биол.
munication between exosites 1 and 2 modulates thrombin
Мед., 150, 394-397.
function, J. Biol. Chem., 284, 25620-25629, doi: 10.1074/
13.
Спиридонова В.А., Головин А.В., Копылов А.М.,
jbc.M109.000042.
Добровольский А.Б., Мазуров А.В. (2011) Модифи
25.
Tan, X., Dey, S.K., Telmer, C, Zhang, X., Armitage, B.A.,
цированные ДНК аптамеры, ингибирующие актив
and Bruchez, M.P. (2014) Aptamers act as activators for
ность тромбина. Патент РФ № 2410432, Бюлл. изобре
the thrombin mediated hydrolysis of peptide substrates,
тений, 3.
Chembiochem, 15, 205-208, doi: 10.1002/cbic.201300693.
БИОХИМИЯ том 84 вып. 12 2019
АНТИТРОМБИНОВЫЕ АПТАМЕРЫ
1885
DNA APTAMERS TO THROMBIN EXOSITE I. STRUCTURE FUNCTION
RELATIONSHIPS AND ANTITHROMBOTIC EFFECTS
V. A. Spiridonova1, T. M. Novikova1, V. A. Sizov1, V. S. Shashkovskaya1,
E. V. Titaeva2, A. B. Dobrovolsky2, E. B. Zharikova2, and A. V. Mazurov2*
1 Belozersky Institute of Physico Chemical Biology, Lomonosov Moscow State University, 119992 Moscow, Russia
2 National Medical Research Center for Cardiology, Russian Ministry of Health,
121552 Moscow, Russia; E mail: avmazurov@list.ru
Received April 18, 2019
Revised July 11, 2019
Accepted July 11, 2019
DNA aptamers (oligonucleotides) interacting with thrombin exosite I have in their structure G quadruplex, two Т Т
and one T G T loops. They prevent exosite I binding with fibrinogen and thrombin receptors on platelet surface, thus
suppressing thrombin stimulated fibrin formation and platelet aggregation. Earlier we synthesized original antithrom
bin aptamer RE31 (5′ GTGACGTAGGTTGGTGTGGTTGGGGCGTCAC 3′), which besides G quadruplex,
contained a hinge region connected with six pairs of complementary nucleotide bases (a duplex region). In the pre
sent study we compared properties of aptamer RE31 and its analogues having various numbers of base pairs in the
duplex region or nucleotide insertions in the hinge region. Reduction of a number of nucleotides in the duplex region
by 1 4 pairs (in comparison with RE31) decreased stability of aptamers’ structure (lowering melting temperature) as
well as decreased their ability to inhibit thrombin stimulated fibrin formation in human blood plasma in the tests of
thrombin time, prothrombin time, and activated partial thromboplastin time. However, an increase in a number of
bases by 1 2 pairs did not cause significant changes of stability and antithrombin activity of aptamers. Insertions into
the hinge region of RE31 aptamer resulted in a decrease in its antithrombin activity. Studies of RE31 antithrombotic
properties have shown that it (i) slowed thrombin formation in human blood plasma (a thrombin generation test),
(ii) accelerated lysis of fibrin clot in an in vitro model, and (iii) suppressed arterial thrombosis in an in vivo model.
Based on presented data aptamer RE31 could be considered as a potentially effective antithrombotic compound.
Keywords: aptamers, thrombin, thrombosis, fibrinogen, fibrinolysis
БИОХИМИЯ том 84 вып. 12 2019