БИОХИМИЯ, 2019, том 84, вып. 12, с. 1886 - 1894
УДК 577.214
ИДЕНТИФИКАЦИЯ E2F8 В КАЧЕСТВЕ РЕГУЛЯТОРА
ТРАНСКРИПЦИИ ФЕРМЕНТОВ ГЛЮКОНЕОГЕНЕЗА
В ПЕРВИЧНЫХ ГЕПАТОЦИТАХ МЫШИ
© 2019
И. Чэнь1#, Д. Юй1#, Л. Ван1*, Ш. Ду1*
Emergency and Clinical Care Medicine Center, the Second Affiliated Hospital of Dalian Medical University,
Dalian 116023, China; E mail: wanglingui77@aliyun.com, dushouzhi80@163.com
Поступила в редакцию 29.04.2019
После доработки 02.07.2019
Принята к публикации 17.07.2019
Нарушение регуляции процесса глюконеогенеза в клетках печени является основным фактором патогенеза
сахарного диабета 2 го типа (T2DM). Известно, что глюконеогенез в клетках печени строго регулируется на
уровне транскрипции. Целью настоящей работы была оценка роли транскрипционного фактора E2F8 в ме
таболизме глюкозы. Обнаружено, что уровни экспрессии E2F8 повышаются в клетках печени мышей линии
db/db и мышей, страдающих от ожирения (DIO) в результате потребления обогащенной жирами пищи
(HFD). Опосредованная аденовирусом повышенная экспрессия E2F8 в первичных гепатоцитах мыши вы
зывала экспрессию генов глюконеогенеза, включая PGC 1α, PEPCK и G6Рase, и увеличивала синтез глю
козы в клетках. Также показано, что повышенная экспрессия E2F8 вызывает нарушение чувствительности
клеток к действию инсулина in vitro. Кроме того, нокдаун E2F8 приводил к повышению чувствительности
первичных гепатоцитов к действию инсулина. Полученные результаты указывают на то, что E2F8 участву
ет в процессе глюконеогенеза и имеет отношение к возникновению устойчивости клеток к действию инсу
лина. Это может представлять новую стратегию лечения и профилактики возникновения сахарного диабе
та 2 го типа.
КЛЮЧЕВЫЕ СЛОВА: диабет 2 го типа, глюконеогенез, E2F8, инсулиновая резистентность.
DOI: 10.1134/S0320972519120121
Поддержание гомеостаза глюкозы зависит от
неогенеза первично ответственна за повышен
поглощения глюкозы жировой тканью и катабо
ный уровень синтеза глюкозы в печени (HGP)
лизма гликогена в клетках печени [1]. У млекопи
при голодании у индивидов с сахарным диабетом
тающих печень играет важную роль в поддержа
2 го типа (T2DM) [5, 6]. При базовых физиоло
нии гомеостаза во время продолжительного голо
гических условиях у индивидов с T2DM увеличи
дания, в основном, через координацию метабо
вается синтез глюкозы в печени, но в то же время
лизма углеводов и липидов. Во время потребле
ингибируется инсулин зависимая функция ос
ния пищи в печени происходит запасание глюко
лабленного процесса HGP [1, 7]. Уровень глюко
зы в виде гликогена, при голодании происходит
неогенеза в клетках печени контролируется клю
высвобождение глюкозы в результате гликогено
чевыми ферментами, такими как пируваткарбок
лиза и глюконеогенеза [2]. Около 90% эндоген
силаза (PC), фосфоенолпируваткарбоксикиназа
ной глюкозы синтезируется в печени [3, 4]. В то
(PEPCK), фруктозо 1,6 бисфосфатаза (FBP1),
же время необычная активация в печени глюко
глюкозо 6 фосфатаза (G6Pase) [8, 9]. Уровни
экспрессии ключевых ферментов глюконеогене
Принятые сокращения: DEX - дексаметазон; DIO - за регулируются на уровне транскрипции гор
ожирение, вызванное пищей; FBP1 - фруктозо 1,6 бис
мон опосредованными сигналами [1, 10]. PGC
фосфатаза; FOXO1 - белок О1 бокса forkhead; FSK - форс
колин; G6Pase - глюкозо 6 фосфатаза; GSK3β - киназа
1α способствует экспрессии генов глюконеогене
гликогенсинтазы 3 β; GR - глюкокортикоидов; HFD -
за путем взаимодействия с некоторыми фактора
пища, обогащенная жирами; HNF4α - печеночный ядер
ми транскрипции, включая HNF4α, FOXO1, ре
ный фактор 4α; HGP - продукция глюкозы в печени; PC -
цептор глюкокортикоидов (GR) и CREB [11], та
пируваткарбоксилаза; PEPCK - фосфоенолпируваткар
боксикиназа; PGC 1α - коактиватор 1α рецептора γ акти
кими как PEPCK и G6Pase [12].
вированного пролифератором пероксисом; T2DM - са
E2F8 является членом семейства факторов
харный диабет 2 го типа.
транскрипции E2F. Члены этого семейства вов
* Адресат для корреспонденции.
лечены во многие физиологические процессы,
# Авторы внесли равный вклад в работу.
включая прогрессирование клеточного цикла,
1886
РОЛЬ E2F8 В ИНСУЛИНОВОЙ РЕЗИСТЕНТНОСТИ
1887
репарацию поврежденной ДНК, апоптоз и диф
США) в течение 12 недель без свободного досту
ференцировку клеток [13, 14]. В настоящее время
па к воде.
уже идентифицировано восемь членов этого се
Выделение и культивирование первичных гепа?
мейства. Показано, что ДНК связывающий до
тоцитов мыши. Первичные гепатоциты получали
мен фактора транскрипции E2F является очень
от 8 недельных самцов мышей линии C57BL/ 6J,
консервативным. На основе способности акти
как было описано ранее [20]. Мышей подвергали
вировать или ингибировать ген мишень члены
анестезии и их печень перфузировали с 0,5 мг/мл
этого семейства подразделяют на две группы.
коллагеназы II типа («Sigma Aldrich», США) че
Показано, что белки E2F1, E2F2 и E2F3 являют
рез нижнюю полую вену. Для проведения даль
ся активаторами транскрипции, а факторы тран
нейших экспериментов гепатоциты культивиро
скрипции E2F4, E2F5, E2F6, E2F7 и E2F8 пер
вали в среде RPMI 1640, содержащей 10% ную
вично функционируют в репрессорных комплек
фетальную бычью сыворотку (FBS), 100 ед/мл
сах [15]. Показана роль E2F8 при различных фор
пенициллина и 0,1 мг/мл стрептомицина.
мах рака [16, 17]. Недавно в одной работе было
Конструирование аденовирусов, экспрессирую?
обнаружено, что E2F8 необходим для роста опу
щих E2F8 и E2F8 shRNA. Полноцепочечные
холевых клеток простаты и аномально экспрес
кДНК для E2F8 мыши с прикрепленным Flag
сируется при метастазировании рака простаты
были получены с помощью ПЦР с использова
[18]. В предыдущей работе было показано, что
нием кДНК печени и проверены секвенирова
E2F8 играет важную роль при репарации повреж
нием ДНК. Полноцепочечная кДНК E2F8 была
денной ДНК [19]. В то же время функция E2F8 в
использована для получения рекомбинантных
регуляции метаболизма до сих пор не изучена.
E2F8 аденовирусов с помощью набора pAdEasy
В настоящей работе была исследована мета
(«Invitrogen», США). Рекомбинантные аденови
болическая функция E2F8 в первичных гепато
русы амплифицировали в клетках HEK 293A.
цитах. Получены результаты, которые свидетель
Последовательность коротких шпильчатых
ствуют о том, что E2F8 усиливает процесс синте
РНК (shRNA), специфичных против E2F8 мы
за глюкозы в клетках печени. Согласно нашим
ши, была следующей: 5′ TGTTTGCACGAA
данным, во время голодания здоровых мышей, а
CACTTAT 3′ (Ad shE2F8). shRNA против взби
также у мышей с диабетом или мышей с DIO
той (scrambled) (Ad shScram) получали, как опи
(вызванным длительным принятием жирной пи
сано ранее [21].
щи ожирением) в печени повышаются уровни
Методы определения продукции глюкозы в
экспрессии E2F8 в сравнении с контрольными
клетках печени (HGP). Для определения концен
группами. Было показано, что in vitro E2F8 спо
трации глюкозы в образцах первичные гепато
собен повышать уровни экспрессии генов глюко
циты мыши культивировали в 6 ячеечных план
неогенеза. Повышенная экспрессия E2F8 способ
шетах. Клетки инфицировали GFP (green fluo
ствует синтезу глюкозы в первичных гепатоци
rescent protein) или E2F8 аденовирусами. Через
тах с повышенной экспрессией генов глюконео
24 ч клетки трижды промывали PBS и инкуби
генеза, в то время как нокдаун гена E2F8 в клет
ровали в 2 мл/ячейка буфера HGP, содержащего
ках печени смягчает уровень гипергликемии,
1 ммоль/л дексаметазона (DEX), 2 ммоль/л пи
снижая синтез глюкозы в печени за счет умень
рувата, 10 ммоль/л лактата и 10 ммоль/л форс
шения экспрессии генов глюконеогенеза. Эти
колина (FSK). Через 3 ч собирали культураль
результаты позволяют предположить, что E2F8
ную среду. Для определения концентрации глю
критически регулирует гомеостаз глюкозы в пе
козы в культуральной среде с помощью наборов
чени, контролируя программу глюконеогенеза.
для определения глюкозы («Applygen Techno
logies», США) отбирали по 0,5 мл среды. Клетки
собирали, лизировали и определяли концентра
МЕТОДЫ ИССЛЕДОВАНИЯ
цию общего белка («Bio Rad», США), чтобы
уточнить количество клеток.
Эксперименты с лабораторными животными.
Вестерн?блоттинг. Клетки промывали фос
Восьмимесячные самцы мышей линий db/db,
фатным буфером (PBS), собирали, лизировали
db/m и C57BL/6J были получены от Beijing Vital
буфером для лизиса (50 мМ Tris HCl, рH 6,8,
River Laboratory Animal Technology Company
10% ный глицерин и 2% ный SDS) и дополнен
(Китай); животных содержали в световом режи
ный ингибитором протеаз фирмы «Roche». Затем
ме: 12 ч на свету и 12 ч в темноте. Модель мышей
измеряли концентрацию белка с помощью соот
DIO получали путем кормления особей линии
ветствующего набора с реагентом BCA («Pierce»).
C57BL/6J в возрасте 5 недель либо стандартным
Белки разделяли с помощью электрофореза в
пищевым рационом, либо обогащенной жирами
10% ном полиакриламидном геле в присутствии
пищей (HFD) (45% жиров; Research Diets, NB,
SDS и затем их переносили на поливинилиден
БИОХИМИЯ том 84 вып. 12 2019
1888
ЧЭНЬ и др.
фторидную мембрану (PVDF membrane) («GE
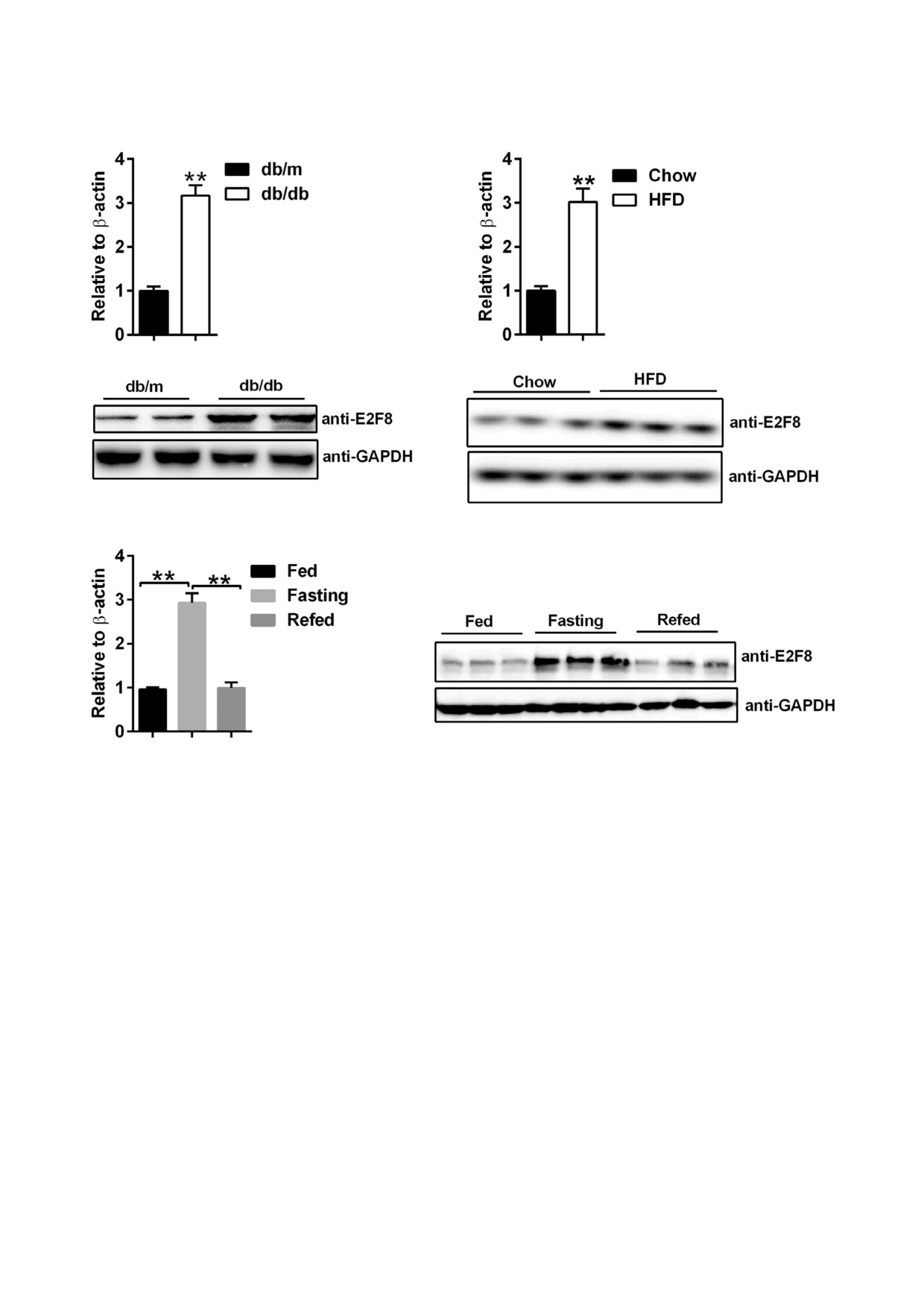
кую функцию E2F8 в метаболизме глюкозы и
Healthcare») для проведения Вестерн блоттинга.
жиров в печени, были проведены измерения
Мембрану блокировали 5% ным обезжиренным
уровня экспрессии E2F8 в печени мышей линии
сухим молоком в течение 1 ч и затем инкубиро
db/db с развившимся диабетом и у мышей DIO с
вали в течение ночи при 4 °C со следующими
ожирением, вызванным обогащенным жирами
первыми антителами, специфичными к E2F8
пищевым рационом. Показано, что уровни
(«Abclonal»), PGC 1α («Millipore»), инсулино
экспрессии мРНК и белка E2F8 в значительной
вый рецептор (Thr1160)
(«Boster Biological
степени повышались в печени мышей линии
Technology»), Akt, p Akt (Ser 473), GSK 3β, p
db/db по сравнению с мышами линии db/m
GSK 3β (Ser 9) («Cell Signaling Technology»), Flag
(рис. 1, a). Сходные результаты были получены в
(«Sigma Aldrich») и ГАФДГ (GAPDH, глицер
отношении мышей DIO в сравнении с нормаль
альдегидфосфатдегидрогеназа) («Abcam»).
ными мышами, потреблявшими обычную еду
Экстракция общей РНК и ПЦР в реальном
(рис. 1, b). Кроме того, обнаружено, что E2F8
времени. Препарат общей РНК получали из пе
может регулироваться в печени мыши в ответ на
чени первичных гепатоцитов мышей с по
прием пищи. Показано, что уровень экспрессии
мощью реагента TRIzol («Invitrogen»). Первона
E2F8 возрастает в условиях голодания. При этом
чально проводили синтез кДНК с использова
уровень экспрессии E2F8 возвращался в норму
нием набора Roche Transcriptor First Strand
после возобновления питания (рис. 1, c). Карти
cDNA Synthesis Kit («Roche») в соответствии с
на экспрессии E2F8 соответствовала картине
инструкциями производителя. ПЦР в реальном
экспрессии ключевых ферментов глюконеоге
времени проводили на приборе Bio Rad CFX96
неза, включая PGC 1α, PEPCK и G6Pase [22,
system с использованием SYBR Green PCR
23]. Эти результаты подразумевают возможное
Master Mix согласно инструкциям производите
участие E2F8 в глюконеогенезе, происходящем
ля. В качестве внутреннего контроля использо
в клетках печени.
вали уровни мРНК β актина. Использовали
Печеночный E2F8 улучшает течение процесса
следующую последовательность праймеров:
глюконеогенеза и синтеза глюкозы в первичных
E2F8 - прямой: 5′ GAGAAATCCCAGCCGA
гепатоцитах мыши. Чтобы определить регулиру
GTC 3′,
ет ли E2F8 метаболизм глюкозы в первичных
обратный: 5′ CATAAATCCGCCGACGTT 3′;
гепатоцитах, первоначально был создан
PGC?1α - прямой: 5′ TATGGAGTGACATAGA
экспрессируемый аденовирусом E2F8 с при
GTGTGCT 3′,
крепленным тэгом Flag (Ad E2F8). Далее пер
обратный: 5′ GGAGGACTCTCGTAGCTCGAA 3′;
вичные гепатоциты мыши инфицировали аде
PEPCK - прямой: 5′ GAGGCCTCCCAACATT
новирусом, экспрессирующим E2F8 или GFP
CAT 3′,
(контроль). Инфицирование E2F8 аденовиру
обратный: 5′ CGCTGAGCGCCTTGCCGGA 3′;
сом может эффективно повышать экспрессию
G6Pase - прямой: 5′ GTCAAGCAGTGTGCC
белка E2F8 в первичных гепатоцитах (рис. 2, b).
CAAGTTA 3′,
Полученные нами результаты подтвердили, что
обратный: 5′ TGTGCCTTGCCCCTGTTTTATA
повышенная экспрессия E2F8 вызвает значи
TG 3′;
тельное повышение уровня экспрессии мРНК
β?актин - прямой: 5′ AAATCGTGCGTGACAT
важных генов глюконеогенеза, включая PGC 1α,
CAAA 3′,
PEPCK и G6Pase в первичных гепатоцитах в
обратный: 5′ AAGGAAGGCTGGAAAAGAGC 3′.
сравнении с контрольной группой, обработан
Статистическая обработка полученных дан?
ной Ad GFP. В то же время повышенная
ных. Полученные данные представлены в виде
экспрессия E2F8 приводила к повышению
среднего значения ± SEM. Для проведения
уровня белка PGC 1α (рис. 2, a-c). В соответ
сравнения между двумя группами использовали
ствии с этими результатами также было показа
двухвыборочный непарный критерий Стьюден
но, что повышенная экспрессия E2F8 способ
та. Значение * p < 0,05 рассматривали как ста
ствует синтезу глюкозы в первичных гепатоци
тистически достоверное.
тах (рис. 2, d).
Аденовирус?опосредованный нокдаун E2F8
приводил к ингибированию синтеза глюкозы в
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
первичных гепатоцитах мыши. Чтобы далее уточ
нить роль E2F8 в глюконеогенезе в печени, пер
Уровень E2F8 в печени мышей линии db/db и
вичные гепатоциты были трансфицированы ви
мышей с ожирением, вызванным обогащенной жи?
русами Ad shScram или Ad shE2F8. С помощью
рами пищей, повышается и регулируется их пище?
методов количественной ПЦР и Вестерн блот
вым статусом. Чтобы определить физиологичес
тинга показано, что эти аденовирусы эффек
БИОХИМИЯ том 84 вып. 12 2019
РОЛЬ E2F8 В ИНСУЛИНОВОЙ РЕЗИСТЕНТНОСТИ
1889
a
b
c
Рис. 1. Регуляция экспрессии E2F8 нарушается в печени мышей с диабетом и ожирением и регулируется пищевым стату
сом. a - Результаты количественной ПЦР (вверху) и Bестерн блоттинга (внизу) экспрессии E2F8 в печени мышей линии
db/db (n = 4/группа); b - результаты количественной ПЦР (вверху) и Вестерн блоттинга (внизу) экспрессии E2F8 в пече
ни ожиревших (DIO) мышей в результате потребления обогащенного жирами пищевого рациона (n = 4/группа); c - ре
зультаты количественной ПЦР (слева) и Вестерн блоттинга (справа) экспрессии E2F8 в печени восьминедельных самцов
мышей линии C57BL/6J в условиях кормления ad libitum, 24 ч голодания и условиях 24 ч голодания/12 ч откармливания
(n = 4/группа). Результаты представлены в виде среднего значения ± SEM; ** p < 0,01
тивно ингибируют экспрессию E2F8 на уровне
жение продукции глюкозы в первичных гепато
мРНК и белка (рис. 3, a и b). Как ожидалось,
цитах (рис. 3, c). На основании этих результатов
нами было обнаружено, что снижение уровня
можно предположить, что E2F8 регулирует
экспрессии E2F8 оказывало значительное вли
экспрессию генов глюконеогенеза и про
яние на транскрипцию ключевых генов глюко
цесс синтеза глюкозы в клетке в автономном
неогенеза. Уровни экспрессии генов глюконео
режиме.
генеза, таких как PGC 1α, PEPCK и G6Pase, в
Повышение экспрессии печеночного E2F8 по?
Ad shE2F8 инфицированных первичных гепа
нижает инсулин?зависимый сигналинг в первич?
тоцитах в отсутствии или в присутствии DEX и
ных гепатоцитах мыши. В связи с тем, что повы
FSK снижались (рис. 3, a и b). В соответствии с
шение уровня глюкозы в печени часто было ас
тем, что снижение экспрессии E2F8 приводит к
социировано с повышением чувствительности
ингибированию программы глюконеогенеза в
клеток печени к действию инсулина [24], нами
гепатоцитах, нокдаун эндогенного E2F8 с по
была изучена возможность того, что повышен
мощью Ad shE2F8 вызывал значительное сни
ная экспрессия E2F8 способствует возникнове
БИОХИМИЯ том 84 вып. 12 2019
1890
ЧЭНЬ и др.
a
b
c
d
Рис. 2. E2F8 способствует экспрессии генов глюконеогенеза и синтезу глюкозы в первичных гепатоцитах. а - Уровни
экспрессии мРНК для PGC 1α, PEPCK и G6Рase в первичных гепатоцитах мышей, инфицированных аденовирусами Ad
GFP или Ad E2F8, определенные с помощью метода количественной ПЦР; b - уровни фузионного белка E2F8 Flag и
PGC 1α в первичных гепатоцитах мышей, инфицированных аденовирусами Ad GFP или Ad E2F8, определенные с по
мощью метода вестерн блоттинга; c - уровни экспрессии белка PGC α были рассчитаны после нормализации относи
тельно ГАФДГ (GAPDH); d - результаты измерений продукции глюкозы первичными гепатоцитами мыши, инфициро
ванными указанным аденовирусом. Результаты представлены в виде среднего значения ± SEM; * p < 0,05; ** p < 0,01
нию инсулинорезистентности в первичных ге
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
патоцитах. Мы проводили вестерн блоттинг
экстрактов печени после инфицирования аде
Глюконеогенез является основным источ
новирусом Ad E2F8 с или без инсулина. Уровни
ником глюкозы, и этот процесс жизненно не
фосфорилирования инсулинового рецептора по
обходим для выживания млекопитающих. Пе
остатку треонина Thr1160 и белка Akt по остатку
чень является основным местом, где протекает
серина Ser473 понижались после повышения
этот процесс [25]. Скорость потока глюконео
экспрессии E2F8 (рис. 4, a и b). Уровни фосфо
генеза контролируется активностью ключевых
рилирования киназы гликогенсинтазы 3 β по
ферментов глюконеогенеза: PEPCK, FBP1 и
остатку серина Ser9 (GSK3β) также снижались
G6Pase [26]. В то же время нарушение регуля
(рис. 4, a и b). Однако результаты Вестерн блот
ции глюконеогенеза является одним из ос
тинга показали, что нокдаун E2F8 приводит к
новных факторов возникновения некоторых
увеличению стимулируемого инсулином фос
метаболических заболеваний, таких как сахар
форилирования инсулинового рецептора, Akt и
ный диабет 2 го типа. Молекулярные механиз
GSK3β (рис. 4, c и d). Эти результаты предпола
мы, лежащие в основе возникновения сахарно
гают, что экспрессия E2F8 в значительной сте
го диабета 2 го типа, пока недостаточно вы
пени коррелирует с инсулиновой резистент
яснены. Пониженный синтез глюкозы в клет
ностью.
ках печени может смягчить симптомы гипер
БИОХИМИЯ том 84 вып. 12 2019
РОЛЬ E2F8 В ИНСУЛИНОВОЙ РЕЗИСТЕНТНОСТИ
1891
a
b
c
d
Рис. 3. Нокдаун E2F8 вызывает ингибирование глюконеогенеза в первичных гепатоцитах. a - Оценка с помощью метода
количественной ПЦР уровня экспрессии мРНК для E2F8, PGC 1α, PEPCK и G6Рase в первичных гепатоцитах из живот
ных, инфицированных Ad shScram или Ad shE2F8 с DEX и FSK; b - результаты Вестерн блоттинга, показывающие уров
ни белков E2F8 и PGC 1α в первичных гепатоцитах мышей, инфицированных аденовирусом Ad shScram или Ad shE2F8
с DEX и FSK; c - уровни экспрессии белка PGC α были рассчитаны после нормализации с использованием GAPDH;
d - анализ выхода глюкозы в первичных гепатоцитах, обработанных как описано на рис. a. Результаты представлены в ви
де среднего значения ± SEM; * p < 0,05; ** p < 0,01
гликемии, т.е. снизить уровень глюкозы в кро
лось, полученные данные свидетельствуют о
ви [27].
том, что индуцированное аденовирусом повы
В настоящей работе было показано, что
шение экспрессии E2F8 может вызвать повы
уровни экспрессии E2F8 регулируются голода
шение уровня экспрессии ключевых генов глю
нием и пищевым статусом. В частности, уровень
конеогенеза, включая PEPCK и G6Pase. В соот
экспрессии E2F8 в печени был значительно по
ветствии с этим наблюдением повышение уров
вышен в состоянии голодания, и уровень глю
ня экспрессии E2F8 также приводило к повы
конеогенеза в печени также был повышен. Поэ
шению способности первичных гепатоцитов
тому мы предположили, что E2F8 может быть
мыши увеличивать производство глюкозы. Нап
вовлечен в процессы метаболизма глюкозы в
ротив, нокдаун E2F8 существенно ингибировал
клетках печени. Как и другие члены семейства
экспрессию генов глюконеогенеза и продукцию
белков E2F, E2F8 принимает участие в регуля
глюкозы в первичных гепатоцитах мыши в при
ции различных физиологических функций
сутствии FSK и DEX. E2F8 может действовать
вместе с E2F7 в качестве фактора транскрипции
как активатор и как репрессор в зависимости от
[28, 29]. Например, фактор роста эндотелиаль
типа ткани и вида мутации [31]. До сих пор не
ных клеток сосудов А (VEGFA), являющийся
ясно является ли E2F8 репрессором транскрип
ключевым фактором процесса ангиогенеза, мо
ции или же ее активатором [18, 32]. Нами впер
жет быть активирован E2F7/8 [30]. Как и ожида
вые представлены доказательства того, что в ус
БИОХИМИЯ том 84 вып. 12 2019
1892
ЧЭНЬ и др.
a
b
c
d
Рис. 4. Повышенная экспрессия E2F8 нарушает чувствительность к инсулину первичных гепатоцитов. a - Вестерн блот
тинг фосфорилированных в результате индукции инсулином IR, AKT и GSK 3β в первичных гепатоцитах мышей, инфи
цированных Ad GFP или Ad E2F8 в течение 24 ч и затем обработанных 100 нмоль инсулина (Ins) в течение 5 мин; b - ден
ситометрия фосфорилированных белков AKT и GSK 3β на рис. а; c - Вестерн блоттинг фосфорилированных в результате
индукции инсулином IR, AKT и GSK 3β в первичных гепатоцитах мышей, инфицированных Ad shScram или Ad shE2F8 в
течение 48 ч и затем обработанных 100 нмоль инсулина (Ins) в течение 5 мин; d - картина денситометрии фосфорилиро
ванных AKT и GSK 3β на рис. а. Результаты представлены в виде среднего значения ± SEM; * p < 0,05; ** p < 0,01
ловиях in vitro повышение экспрессии E2F8
усиливает экспрессию генов глюконеогенеза:
приводит к улучшению экспрессии генов глю
прямо или опосредованно.
конеогенеза в первичных гепатоцитах, и затем в
Печеночная инсулинорезистентность пред
печени происходит усиление образования глю
ставляет собой основной фактор риска развития
козы. Необходимо провести дальнейшие иссле
сахарного диабета 2 го типа и метаболического
дования, чтобы выяснить каким образом E2F8
синдрома [1]. Инсулин повышает поглощение
БИОХИМИЯ том 84 вып. 12 2019
РОЛЬ E2F8 В ИНСУЛИНОВОЙ РЕЗИСТЕНТНОСТИ
1893
глюкозы в мышцах и жировой ткани и ингиби
влияния E2F8 на процесс глюконеогенеза и ре
рует образование глюкозы и ее использование в
зистентность к инсулину in vivo необходимо по
клетках печени [33]. В настоящей работе было
лучить линию мышей со специфически нокау
подтверждено, что в первичных гепатоцитах
тированным в клетках печени фактором тран
после их обработки Ad E2F8 происходит нару
скрипции E2F8.
шение чувствительности к действию инсулина,
и этот феномен может быть связан с повышени
ем уровня глюконеогенеза в клетках печени. От
Финансирование. Данная работа выполнена
сюда можно предположить, что повышенная
при
финансовой
поддержке
гранта
экспрессия E2F8 вносит вклад в развитие инсу
(20170540252) от Фонда естественных наук про
линрезистентности клеток печени, которая наб
винции Ляонин (Liaoning Provincial Natural
людается у мышей db/db и мышей HFD.
Science Foundation).
Таким образом, полученные результаты по
Конфликт интересов. Авторы заявляют об от
казали, что E2F8 повышает уровни экспрессии
сутствии конфликта интересов.
генов глюконеогенеза и синтеза глюкозы in vitro;
Соблюдение этических норм. Все экспери
также были получены подтверждения того, что
менты с лабораторными животными были вы
повышенная экспрессия E2F8 приводит к ин
полнены с одобрения Комитета по изучению
дукции инсулиновой резистентности в первич
животных Института лабораторных животных
ных гепатоцитах. Для дальнейшего изучения
Даляньского медицинского университета.
СПИСОК ЛИТЕРАТУРЫ
1.
Petersen, M.C., Vatner, D.F., and Shulman, G.I. (2017)
13. Polager, S., and Ginsberg, D. (2008) E2F - at the cross
Regulation of hepatic glucose metabolism in health and
roads of life and death, Trends Cell. Biol., 18, 528-535.
disease, Nat. Rev. Endocrinol., 13, 572-587.
14. Aquinta, P.J., and Lees, J.A. (2007) Life and death deci
2.
Lin, H.V., and Accili, D. (2011) Hormonal regulation of
sions by the E2F transcription factors, Curr. Opin. Cell.
hepatic glucose production in health and disease, Cell.
Biol., 19, 649-657.
Metab., 14, 9-19.
15. DeGregori, J., and Johnson, D.G. (2006) Distinct and
3.
Ekberg, K., Landau, B.R., Wajngot, A., Chandramouli, V.,
overlapping roles for E2F family members in transcription,
Efendic, S., Brunengraber, H., and Wahren, J. (1999)
proliferation and apoptosis, Curr. Mol. Med., 6, 739-748.
Contributions by kidney and liver to glucose production in
16. Deng, Q., Wang, Q., Zong, W.Y., Zheng, D.L., Wen, Y.X.,
the postabsorptive state and after 60 h of fasting, Diabetes,
Wang, K.S., Teng, X.M., Zhang, X., Huang, J., and Han, Z.G.
48, 292-298.
(2010) E2F8 contributes to human hepatocellular carcino
4.
Moore, M.C., Coate, K.C., Winnick, J.J., An, Z., and
ma via regulating cell proliferation, Cancer Res., 70,
Cherrington, A.D. (2012) Regulation of hepatic glucose
782-791.
uptake and storage in vivo, Adv. Nutr., 3, 286-294.
17. Maiti, B., Li, J., de Bruin, A., Gordon, F., Timmers, C.,
5.
Chen, X., Iqbal, N., and Boden, G. (1999) The effects of
Opavsky, R., Patil, K., Tuttle, J., Cleghorn, W., and Leone, G.
free fatty acids on gluconeogenesis and glycogenolysis in
(2005) Cloning and characterization of mouse E2F8, a
normal subjects, J. Clin. Invest., 103, 365-372.
novel mammalian E2F family member capable of blocking
6.
Landau, B.R., Wahren, J., Chandramouli, V., Schumann, W.C.,
cellular proliferation, J. Biol. Chem., 280, 18211-18220.
Ekberg, K., and Kalhan, S.C. (1996) Contributions of glu
18. Lee, S., Park, Y.R., Kim, S.H., Park, E.J., Kang, M.J., So, I.,
coneogenesis to glucose production in the fasted state, J.
Chun, J.N., and Jeon, J.H. (2016) Geraniol suppresses
Clin. Invest., 98, 378-385.
prostate cancer growth through down regulation of E2F8,
7.
Perry, R.J., Samuel, V.T., Petersen, K.F., and Shulman, G.I.
Cancer Med., 5, 2899-2908.
(2014) The role of hepatic lipids in hepatic insulin resis
19. Zalmas, L.P., Zhao, X., Graham, A.L., Fisher, R., Reilly, C.,
tance and type 2 diabetes, Nature, 510, 84-91.
Coutts, A.S., and La Thangue, N.B. (2008) DNA damage
8.
He, L., Sabet, A., Djedjos, S., Miller, R., Sun, X., Hussain,
response control of E2F7 and E2F8, EMBO Rep., 9,
M.A., Radovick, S., and Wondisford, F.E.
(2009)
252-259.
Metformin and insulin suppress hepatic gluconeogenesis
20. Luo, P., Wang, P.X., Li, Z.Z., Zhang, X.J., Jiang, X.,
through phosphorylation of CREB binding protein, Cell,
Gong, J., Qin, J.J., Guo, J., Zhu, X., Yang, S., and Li, H.
137, 635-646.
(2016) Hepatic oncostatin M receptor beta regulates obesi
9.
Wu, C., Khan, S.A., Peng, L.J., Li, H., Carmella, S.G.,
ty induced steatosis and insulin resistance, Am. J. Pathol.,
and Lange, A.J. (2006) Perturbation of glucose flux in the
186, 1278-1292.
liver by decreasing F26P2 levels causes hepatic insulin
21. Shen, L., Cui, A., Xue, Y., Cui, Y., Dong, X., Gao, Y.,
resistance and hyperglycemia, Am. J. Physiol. Endocrinol.
Yang, H., Fang, F., and Chang, Y. (2014) Hepatic differen
Metab., 291, 536-543.
tiated embryo chondrocyte expressed gene 1 (Dec1)
10.
Pilkis, S.J., and Granner, D.K. (1992) Molecular physiol
inhibits sterol regulatory element binding protein 1c
ogy of the regulation of hepatic gluconeogenesis and gly
(Srebp 1c) expression and alleviates fatty liver phenotype,
colysis, Annu. Rev. Physiol., 54, 885-909.
J. Biol. Chem., 289, 23332-23342.
11.
Canto, C., and Auwerx, J. (2010) Clking on PGC 1alpha
22. Xue, Y., Shen, L., Cui, Y., Zhang, H., Chen, Q., Cui, A.,
to inhibit gluconeogenesis, Cell Metab., 11, 6-7.
Fang, F., and Chang, Y. (2013) Tff3, as a novel peptide,
12.
Liang, H., and Ward, W.F. (2006) PGC 1alpha: a key regula
regulates hepatic glucose metabolism, PLoS One, 8,
tor of energy metabolism, Adv. Physiol. Educ., 30, 145-151.
e75240.
БИОХИМИЯ том 84 вып. 12 2019
1894
ЧЭНЬ и др.
23. Luo, A., Yan, H., Liang, J., Du, C., Zhao, X., Sun, L., and
E2F7 and E2F8 is essential for cell survival and embryonic
Chen, Y. (2017) MicroRNA 21 regulates hepatic glucose
development, Dev. Cell, 14, 62-75.
metabolism by targeting FOXO1, Gene, 627, 194-201.
30. Weijts, B.G., Bakker, W.J., Cornelissen, P.W., Liang, K.H.,
24. Neschen, S., Morino, K., Hammond, L.E., Zhang, D.,
Schaftenaar, F.H., Westendorp, B., de Wolf, C.A.,
Liu, Z.X., Romanelli, A.J., Cline, G.W., Pongratz, R.L.,
Paciejewska, M., Scheele, C.L., Kent, L., Leone, G.,
Zhang, X.M., Choi, C.S., Coleman, R.A., and Shulman, G.I.
Schulte Merker, S., and de Bruin, A. (2012) E2F7 and
(2005) Prevention of hepatic steatosis and hepatic insulin
E2F8 promote angiogenesis through transcriptional activa
resistance in mitochondrial acyl CoA:glycerol sn 3 phos
tion of VEGFA in cooperation with HIF1, EMBO J., 31,
phate acyltransferase 1 knockout mice, Cell. Metab., 2,
3871-3884.
55-65.
31. Thurlings, I., Martinez Lopez, L.M., Westendorp, B.,
25. Cahill, G.F., Jr. (2006) Fuel metabolism in starvation,
Zijp, M., Kuiper, R., Tooten, P., Kent, L.N., Leone, G.,
Annu. Rev. Nutr., 26, 1-22.
Vos, H.J., Burgering, B., and de Bruin, A.
(2017)
26. Granner, D., and Pilkis, S. (1990) The genes of hepatic
Synergistic functions of E2F7 and E2F8 are critical to sup
glucose metabolism, J. Biol. Chem., 265, 10173-10176.
press stress induced skin cancer, Oncogene, 36, 829-839.
27. Bjorntorp, P., and Rosmond, R. (1999) Visceral obesity
32. Park, S.A., Platt, J., Lee, J.W., Lopez Giraldez, F., Herbst, R.S.,
and diabetes, Drugs, 58, 13-18, discussion 75-82.
and Koo, J.S. (2015) E2F8 as a novel therapeutic target for
28. Lammens, T., Li, J., Leone, G., and De Veylder, L. (2009)
lung cancer, J. Natl. Cancer Inst., 107.
Atypical E2Fs: new players in the E2F transcription factor
33. O Sullivan, I., Zhang, W., Wasserman, D.H., Liew, C.W.,
family, Trends Cell Biol., 19, 111-118.
Liu, J., Paik, J., DePinho, R.A., Stolz, D.B., Kahn, C.R.,
29. Li, J., Ran, C., Li, E., Gordon, F., Comstock, G.,
Schwartz, M.W., and Unterman, T.G. (2015) FoxO1 inte
Siddiqui, H., Cleghorn, W., Chen, H.Z., Kornacker, K.,
grates direct and indirect effects of insulin on hepatic glu
Liu, C.G., Pandit, S.K., Khanizadeh, M., Weinstein, M.,
cose production and glucose utilization, Nat. Commun., 6,
Leone, G., and de Bruin, A. (2008) Synergistic function of
7079.
IDENTIFICATION OF E2F8 AS A TRANSCRIPTIONAL REGULATOR
OF GLUCONEOGENESIS IN PRIMARY MOUSE HEPATOCYTES
Y. Chen1#, D. Yu1#, L. Wang1*, and S. Du1*
Emergency and Clinical Care Medicine Center, The Second Affiliated Hospital of Dalian Medical University,
Dalian 116023, China; E mail: wanglingui77@aliyun.com, dushouzhi80@163.com
Received April 29, 2019
Revised July 2, 2019
Accepted July 17, 2019
Dysregulation of hepatic gluconeogenesis is a major factor in the pathogenesis of type 2 diabetes mellitus (T2DM).
As known, hepatic gluconeogenesis is heavily regulated at the transcription/expression level. The aim of this study was
to evaluate the role of E2F8 transcription factor in the glucose metabolism using primary mouse hepatocytes. Here
we found that hepatic E2F8 expression levels were increased in db/db and high fat diet (HFD) induced obese (DIO)
mice. Adenovirus mediated overexpression of E2F8 in hepatocytes increased the expression of gluconeogenic genes,
including PGC 1α, PEPCK and G6Pase, with subsequent increase in glucose synthesis. Overexpression of E2F8
impaired insulin sensitivity of hepatocytes in vitro as well. On the contrary, a knockdown of E2F8 expression increased
insulin sensitivity in primary hepatocytes. In summary, these findings indicate that E2F8 is involved in a gluconeoge
nesis and insulin resistance mechanisms and may represent a novel treatment strategy to prevent T2DM.
Keywords: type 2 diabetes, gluconeogenesis, E2F8, insulin resistance
БИОХИМИЯ том 84 вып. 12 2019