БИОХИМИЯ, 2019, том 84, вып. 12, с. 1895 - 1906
УДК 577.214
Notch1 ЗАВИСИМЫЙ СИГНАЛЬНЫЙ ПУТЬ
КОНТРОЛИРУЕТСЯ Akt1 ОПОСРЕДОВАННЫМ
ФОСФОРИЛИРОВАНИЕМ БЕЛКА RBP Jk
© 2019
М. Е. Ким*, Ц.И. Парк, Х. С. Парк*
School of Biological Sciences and Technology, Chonnam National University, 61186 Gwangju,
Republic of Korea; E mail: mykim31002@gmail.com, proteome@jnu.ac.kr
Поступила в редакцию 31.05.2019
После доработки 17.07.2019
Принята к публикации 17.07.2019
Notch1 зависимый сигнальный путь играет ключевую роль в определении судьбы клеток, включая их рост
и дифференцировку. В настоящей работе показано антагонистическое действие RTK зависимого сигналь
ного пути в отношении Notch1 зависимого пути передачи сигнала, осуществляемое с участием Ras PI3K
Akt1. Обнаружено, что PI3K Akt1 опосредованный сигнальный путь ингибирует Notch1 зависимый сиг
нальный путь в результате фосфорилирования белка RBP Jk. Показано не только снижение уровня ассоциа
ции Notch1 и RBP Jk, но и подавление транскрипционной активности Notch1. Полученные результаты сви
детельствуют в пользу того, что Akt1 функционирует как естественный ингибитор Notch1 зависимого сиг
нального пути, осуществляя фосфорилирование белка RBP Jk.
КЛЮЧЕВЫЕ СЛОВА: Notch1 зависимый сигнальный путь, Akt1, фосфорилирование.
DOI: 10.1134/S0320972519120133
Белки Notch1 являются высоко консерва
связывающий белок) и CtIP (взаимодействую
тивными трансмембранными рецепторами I ти
щий с CtBP белок) [7].
па, которые регулируют процессы, определяю
Рецепторные тирозинкиназы (RTKs) явля
щие судьбу клетки, включая дифференцировку,
ются основными регуляторами PI3K/Akt опос
пролиферацию и гибель клеток [1-3]. Белок
редованного пути передачи сигнала, регулирую
Notch1 подвергается серии расщеплений, в ре
щего многие естественные процессы внутри
зультате которых высвобождается его внутрик
клетки, включая рост, выживание, гибель и ме
леточный домен (Notch IC). Этот домен далее
таболизм клеток. Нарушение регуляции этого
транслоцируется в клеточное ядро, где взаимо
сигнального пути ассоциировано с развитием и
действует с различными комплексами актива
прогрессированием канцерогенеза [8]. На N кон
ции процесса транскрипции, включая ДНК
цевом участке белка Akt1 находится домен гомо
связывающий белок RBP Jk/CBF 1, гомолог (в
логии с плекстрином, который, как предполага
клетках млекопитающих) белка дрозофилы, на
ется, непосредственно связывает фосфолипид
зываемого Drosophila melanogaster Suppressor of
ные продукты PI3K [9]. В результате такого свя
Hairless [Su(H)], белка коактиватора MAML 1
зывания Akt1 появляется на мембране и претер
(mastermind like 1) и p300/CREB связывающе
певает конформационные изменения, которые
го белка. В результате этих белок белковых взаи
позволяют киназам PDK1 и PDK2 фосфорили
модействий происходит активация процесса
ровать этот белок по аминокислотным остаткам
транскрипции нижележащих генов мишеней,
(а.о.) Thr308 и Ser473 соответственно [9-11].
кодирующих Hes1 и Hes5 [4-6]. В отсутствии
Фосфорилирование этих остатков приводит к
Notch RBP Jk действует как репрессор тран
полной активации киназы Akt1, которая целе
скрипции некоторых генов, кодирующих, в том
направленно действует на компоненты клетки,
числе, SHARP (SMRT и HDAC ассоциирован
в том числе, на BAD, каспазу 9, IKK, GSK3 β,
ный репрессорный белок), CtBP (C концевой
Raf, FKHR, eNOS, p21 и mdm2 [12-15]. Пост
трансляционная модификация этих белков ми
шеней с помощью Akt1 может как отрицатель
Принятые сокращения: Notch1 IC - внутриклеточ
ный домен Notch1; RTK -рецепторная тирозинкиназа;
но, так и положительно влиять на активность
PI3K - фосфатидилинозитол 3 киназа.
этих белков и таким образом оказывать регули
* Адресат для корреспонденции.
рующее воздействие на многочисленные кле
1895
1896
КИМ и др.
точные процессы, включая рост, выживание и
минометра (Berthold). Активность люцифераз
гибель клеток, а также влиять на развитие забо
ного репортера в каждом образце нормализова
леваний человека, таких как рак и сахарный диа
ли относительно активности β галактозидазы,
бет 2 го типа [15-18].
которую также измеряли в каждом образце.
Существование перекрестных связей между
Иммуноблоттинг и ко иммунопреципитация.
PI3K/Akt и Notch1 зависимыми сигнальными
Клетки NIH3T3 трансфицировали вышеуказан
путями было ранее продемонстрировано в нес
ными векторами экспрессии в течение 48 ч и за
кольких работах [19-22]. Notch1 и RTK зави
тем промывали ледяным натрий фосфатным
симые сигнальные пути взаимодействуют гене
буфером (PBS). Клетки лизировали в буфере
тически в многочисленных системах. Как анта
RIPA (50 мМ Тris HCl (pH 7,5), 150 мМ NaCl,
гонистические, так и агонистические взаимо
1% ный Nonidet P 40, 0,5% ный дезоксихолат
действия между этими сигнальными путями бы
натрия,
0,1% ный додецилсульфат натрия
ли показаны в процессах развития и неоплазии
(SDS), 1 мМ фенилметилсульфонилфлюорид
[23-26]. Однако не была выявлена возможность
(PMSF),
1 мМ дитиотрейтол (DTT) и по
того, что RTK опосредованные сигналы могут
2 мкг/мл лейпептина и апротинина). Лизаты
оказывать прямое влияние на Notch1. В настоя
клеток центрифугировали при 12 000 g и 4 °C в
щей работе представлены доказательства того,
течение 20 мин. Полученный супернатант инку
что автономное взаимодействие в клетке между
бировали с вышеуказанными антителами и за
RTK и Notch1 зависимыми сигнальными путя
тем с 20 мкл гранул белок A агарозы. Гранулы
ми опосредуется прямой модификацией белков
промывали трижды ледяным PBS и кипятили в
Notch1 или RBP Jk.
буфере Лэммли. Полученные осадки кипятили
при 95 °C 5 мин и белки разделяли с помощью
гель электрофореза в полиакриламидном геле в
МЕТОДЫ ИССЛЕДОВАНИЯ
присутствии SDS. После завершения электро
фореза разделенные белки с помощью элект
Клеточные культуры, плазмиды и трансфекция.
роблоттинга переносили на поливинилиден
Фибробласты линии NIH3T3 культивировали
дифлуоридные мембраны («Millipore», США).
при 37 °C в модифицированной Дульбекко среде
Затем мембраны блокировали солевым раство
Игла (DMEM), дополненной 10% ной фетальной
ром (TBS, pH 7,4), содержащим 0,1% ный Tween 20
бычьей сывороткой (FBS) и 1% ным пеницил
и 5% ное обезжиренное молоко. Перенесенные
лином/стрептомицином в увлажненном инкуба
на нитроцеллюлозную мембрану белки обраба
торе в атмосфере 95% ного воздуха и 5% ной
тывали специфичными антителами против Myc
CO2. Полноцепочечные ДНК генов Akt1, RBP Jk
(9E10), HA (12CA5) и Flag («Sigma», США) или
и Notch1 получали с помощью ПЦР, затем их
антителами против SMRT («Santa Cruz», США)
вставляли в векторы экспрессии в клетках мле
и инкубировали со вторыми антимышиными
копитающих: pcDNA3, pCMV и pCS2. Все тэги
антителами, конъюгированными с пероксида
плазмид размещались на N конце. Для транс
зой хрена («Amersham Biosciences», США). Ви
фекции плазмидной ДНК плотность клеток в
зуализация блотов происходила за счет усилен
планшетах доводили до 50-60% конфлуентности
ной хемилюминесценции.
и трансфицировали соответствующими вектора
Иммунофлуоресцентное окрашивание клеток
ми экспрессии в присутствии обозначенных
проводили, как было описано для клеток
комбинаций плазмидных ДНК (2 мкг на ячейку)
NIH3T3, нанесенных в количестве 1×105 клеток
с использованием реагента для трансфекции
на ячейку на покровное стекло («Fisher», Вели
Lipofectamine®2000 («Invitrogen», США).
кобритания)
[28]. Всего трансфицировали
Определение с использованием люциферазы
0,5 мкг соответствующей ДНК на каждую ячей
проводили как было описано ранее [27]. Люци
ку с использованием реагента Lipofectamine
феразная репортерная плазмида контролирова
PLUS. Трансфицированные клетки фиксирова
лась структурой 4 × CSL Luc (4 раза повторяю
ли с использованием 4% ного параформальде
щийся участок таргетной последовательности
гида в PBS и затем их пермиализировали с по
для RBP Jk, CGTGGGAA, с геном люцифера
мощью 0,1% ного Triton X 100 в PBS. В качест
зы). Клетки (12 ячеечные планшеты) были
ве первых антител были использованы мыши
трансфицированы Myc Notch1 IC и репортер
ные антитела против Flag и Myc в разведении
ной системой Notch1 зависимой транскрипции
1 : 100. Затем добавляли вторые антимышиные
(4 × CSL Luc) вместе с β галактозидазой. После
антитела, конъюгированные с Alexa Fluor 488
48 ч трансфекции клетки лизировали с исполь
(1:100) («Invitrogene»), и локализацию белков
зованием хемилюминесцентного лизисного бу
выявляли с помощью конфокального микро
фера и затем проводили анализ с помощью лю
скопа («Leica TCS SPE», США).
БИОХИМИЯ том 84 вып. 12 2019
Akt1 РЕГУЛИРУЕТ ФОСФОРИЛИРОВАНИЕ RBP Jk
1897
Определение киназной активности Akt1. Клет
Мутации были подтверждены с помощью
ки NIH3T3 инкубировали с культуральной сре
автоматизированного секвенирования ДНК.
дой, не содержащей сыворотку, в течение 24 ч
Мечение изотопом фосфора в ходе реакции.
при 37 °C. Культивируемые клетки собирали и
Клетки NIH3T3 выдерживали без сыворотки
лизировали в буфере A, содержащем 50 мМ Tris
16 ч, промывали дважды ледяным TBS и затем
HCl (pH 7,5), 150 мМ NaCl, 1 мМ PMSF,
инкубировали 3 ч при 37 °C в не содержащей
2 мкг/мл лейпептина и апротинина, 25 мМ гли
фосфат DMEM («Gibco BRL», США) и содер
церофосфата, 0,1 мМ ортованадата натрия, 1 мМ
жащей 0,5 mCi/мл 32P ортофосфата («Amersham
фторида натрия, 1% ный NP 40, 0,5% ный де
Pharmacia»). Затем клетки инкубировали с
зоксихолата и 0,1% ный SDS в течение 30 мин
100 нМ вортманнина («Sigma») или 0,1 мМ
при 4 °C (все реагенты были приобретены в
LY294002 («Sigma») в течение 30 мин и далее с
«VWR Life Science», США). Лизаты клеток затем
100 нМ PDGF («Sigma») 20 мин. Клетки дважды
были центрифугированы при 12 000 g 20 мин при
промывали TBS, собирали и помещали в буфер
4 °C. Полученный супернатант инкубировали с
для лизиса. Клеточные лизаты центрифугирова
антителами против Akt1 (1 мкг) («Cell signaling»,
ли при 12 000 g 20 мин. Осветленные экстракты
США) 1 ч при 4 °C. Полученные иммунные
подвергали иммунопреципитации с использо
комплексы затем связывали с белок A агарозой
ванием антител против Flag (1 мкг) («Sigma»).
при дополнительной инкубации в течение 1 ч
Полученные осадки промывали три раза лизис
при 4 °C, после чего их осаждали путем центри
ным буфером и два раза промывочным буфером.
фугирования. Осажденные иммунные комплек
Образцы разделяли путем электрофореза в по
сы перемешивали три раза лизисным буфером и
лиакриламидном геле в присутствии SDS, белки
затем два раза 20 мМ HEPES (pH 7,4). Определе
визуализировали с помощью анализатора («Bio
ние киназной активности иммунных комплек
Rad», США).
сов проводили путем инкубации полученных
осадков, содержащих иммунные комплексы, в
течение 30 мин при 30 °C с 2 мкг гистона H2B в
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
качестве субстрата в 20 мкл реакционного буфе
ра, который содержал 0,2 мМ ортованадата нат
RTK Ras PI3K Akt1 опосредованный сиг
рия, 10 мМ MgCl2, 2 μCi [γ32P]АТФ и 20 мМ
нальный путь ингибирует Notch1 зависимый путь
HEPES (pH 7,4). Фосфорилированные субстра
передачи сигнала. Чтобы выяснить роль RTK Ras
ты разделяли с помощью гель электрофореза в
в Notch1 зависимой передаче сигнала, была изу
полиакриламидном геле в присутствии SDS и
чена способность эндогенного лиганда RTK взаи
определяли их количество на приборе Fuji BAS
модействовать с активированными конструкци
2500. Для фузионных с GST белков в качестве
ями Notch1. Для исследования возможности то
субстратов их экспрессировали в клетках
го, что PDGF (фактор роста тромбоцитов), ко
Escherichia coli с использованием pGEX 4T и
торый хорошо известен как активатор Ras
очищали на GSH сефарозе («GE Healthcare»,
PI3K Akt1 и MAPK зависимых сигнальных пу
США), как было описано ранее [27]. Концентра
тей, модулирует Notch1 зависимый сигнальный
цию белка определяли по методу Брэдфорд
путь, было изучено влияние PDGF на Notch1
(«Shimadzu», Япония).
зависимый сигналинг в клетках NIH3T3 с ис
Сайт направленный мутагенез кДНК RBP Jk
пользованием люциферазной репортерной сис
был выполнен с помощью набора QuickChange™
темы. Показано, что PDGF ингибирует Notch1
(«Stratagene», США) с использованием ДНК
IC индуцированную активность 4 × CSL люци
полимеразы PfuTurbo и температурного цикле
феразной репортерной системы (рис. 1, a). Од
ра. После осуществления температурных циклов
нако PDGF не ингибировал транскрипционную
образовавшийся продукт обрабатывали Dpn I.
активность Notch1 IC в том случае, если
Полученную векторную ДНК, содержащую не
Notch1 IC был совместно экспрессирован с до
обходимые мутации, затем трансформировали
минантно негативной мутантной формой Ras -
в суперкомпетентные клетки XL1 Blue. Для
RasN17 (рис. 1, a). Сходные результаты были по
получения мутаций использовали олигонуклео
лучены с использованием Hes1 Luc и репортер
тиды:
ной системы Hes5 Luc (данные не приведены).
T223A - 5’ CAATCGCCTTCGGTCCCAGGCA
На основании полученных результатов мож
GTTAGTACCAGGTACCTG 3’;
но предположить, что активация белка Ras не
T223D - 5’ CAATCGCCTTCGGTCCCAGGA
обходима для подавления транскрипционной
TCTTAGTACCAGGTACCTG 3’;
активности Notch1 с помощью PDGF. Обработ
T223E - 5’ CAATCGCCTTCGGTCCCAGGAA
ка клеток NIH3T3 с помощью FGF приводила к
GTTAGTACCAGGTACCTG 3’.
активации Ras, но не вызывала существенного
9 БИОХИМИЯ том 84 вып. 12 2019
1898
КИМ и др.
a
b
c
d
Рис. 1. Ингибирование Notch1 зависимого сигнального пути с помощью Ras PI3K Akt1 зависимого пути передачи сиг
нала. а - Клетки NIH3T3 cбыли кратковременно трансфицированы Notch1 IC, RasN17, 4×CSL Luc и β галактозидазой
и затем были обработаны PDGF (10 нг/мл) в течение 8 ч; b - клетки NIH3T3 были кратковременно трансфицированы
Notch1 IC, RasN17, 4×CSL Luc и β галактозидазой и затем были обработаны PDGF 8 ч и вортманнином (1 мкМ) или
LY294002 (10 мкМ) 30 мин; c - клетки NIH3T3 были кратковременно трансфицированы Notch1 IC, Akt1 DN, 4×CSL Luc
и β галактозидазой и затем были обработаны PDGF в течение 8 ч; d - клетки NIH3T3 были кратковременно трансфици
рованы Notch1 IC, Akt1 CA, 4×CSL Luc и β галактозидазой. Клетки лизировали и определяли их люциферазную актив
ность (a-d). Результаты представлены в виде среднего значения ± стандартное отклонение (SD) трех независимых экспе
риментов. R.L.U - это relative luciferase units (относительные единицы активности люциферазы)
ингибирования процесса активации Notch1 IC.
онную активность генов мишеней Notch1 IC
В нескольких работах было показано, что в от
(рис. 1, d, показан только 4 × CSL). Результаты
вет на действие PDGF Ras зависимый путь мо
этих экспериментов согласуются с предположе
жет стимулировать активность PI3K и, тем са
нием о том, что рецепторы PDGF активируют
мым, повышать активность Akt1 через PDK1 и
Akt1 (через Ras и PI3K), и что активный Akt1 не
PDK2 [29-31]. Была исследована возможность
обходим для ингибирования транскрипционной
того, что активация PI3K вносит вклад в инги
активности Notch1. Кроме того, так как промо
бирование активности Notch1 IC. Обнаружено,
тор 4 × CSL не содержит какие либо сайты для
что обработка ингибиторами PI3K (LY294002 и
дополнительных факторов транскрипции, а
вортманнин) приводит к восстановлению тран
Hes 1 и Hes 5 люциферазы ведут себя сходным
скрипционной активности генов мишеней
образом, полученные результаты свидетельству
Notch1 IC в присутствии PDGF (рис. 1, b). Akt1
ют в пользу того, что Akt1 оказывает прямое
является одним из белков мишеней PI3K, и до
влияние на Notch1 IC, RBP Jk или требуемый
минантно негативная форма Akt1 (Akt1 DN)
кофактор, например. MAML 1.
предотвращает ингибирование транскрипцион
Akt1 нарушает физическое взаимодействие
ной активности Notch1 IC с помощью PDGF
между Notch1 IC и RBP Jk и изменяет внутрикле
(рис. 1, c). Наконец, конститутивно активная
точную локализацию RBP Jk. Чтобы определить
форма Akt1 (Akt1 CA) подавляет транскрипци
белок, на который направлено PDGF опосре
БИОХИМИЯ том 84 вып. 12 2019
Akt1 РЕГУЛИРУЕТ ФОСФОРИЛИРОВАНИЕ RBP Jk
1899
дованное PI3K зависимое ингибирование ге
Akt1 ингибирует физическое связывание
нов мишеней Notch1 IC, было проведено изу
Notch1 IC и RBP Jk.
чение образования комплекса между Notch1 IC
Чтобы уточнить какой белок является ми
и RBP Jk в присутствии или отсутствии PDGF
шенью Akt1, было изучено образование комп
(рис. 2, a). Notch1 IC и RBP Jk совместно осаж
лекса SMRT/RBP Jk. В отсутствии Notch1 IC
дались антителами, однако в присутствии
RBP Jk взаимодействует со SKIP и SMRT, и это
PDGF исчезала полоса Notch1 IC, которая взаи
есть то взаимодействие, которое позволяет
модействовала с RBP Jk (рис. 2, a, дорожки 1
RBP Jk располагаться в ядре и действовать в ка
и 2). Образование комплекса Notch1 IC RBP Jk
честве репрессора транскрипции [32]. Физичес
восстанавливалось в присутствии ингибиторов
кая ассоциация между SMRT и RBP Jk также
PI3K (вортманнин и LY294002) (рис. 2, a, до
снижалась в присутствии Akt1 CA (рис. 2, c),
рожки 3 и 4 соответственно). Далее была изуче
указывая на то, что Akt1 может вызвать модифи
на ассоциация между Notch1 IC и RBP Jk в
кацию RBP Jk. Если Akt1 вызывал диссоциа
присутствии или отсутствии Akt1. Взаимодей
цию комплекса SMRT/RBP Jk, то результат
ствие между Notch1 IC и RBP Jk строго подав
должен быть сходен с данными, полученными в
лялось в присутствии активированного Akt1
случае мутаций RBP Jk, которые нарушали его
(рис. 2, b). Эти результаты указывают на то, что
взаимодействие с SMRT и локализацию внутри
a
b
c
d
Рис. 2. Akt1 нарушает ассоциацию между RBP Jk и Notch1 IC. а - Клетки NIH3T3 трансфицировали Myc Notch1 IC и
Flag RBP Jk, затем обрабатывали PDGF (10 нг/мл) 8 ч и вортманнином (1 мкМ) или LY294002 (10 мкМ) 30 мин; b - клет
ки NIH3T3 трансфицировали Myc Notch1 IC, Flag RBP Jk и HA Akt1 CA. Клеточные лизаты подвергали иммунопреци
питации с использованием антител против Flag, и проводили иммуноблоттинг иммунопреципитатов с использованием
антител против Myc (a, b); c - клетки NIH3T3 трансфицировали Flag RBP Jk и HA Akt1 CA. Клеточные лизаты подвер
гали иммунопреципитации с использованием антител против Flag, и проводили иммуноблоттинг иммунопреципитатов с
использованием антител против SMRT; d - клетки NIH3T3 трансфицировали HA Akt1 CA и Myc Notch1 IC или Flag
RBP Jk как указано на рисунке. После 48 ч трансфекции клетки фиксировали, белки Notch1 IC и RBP Jk окрашивали
Alexa Fluor 488 и изучали с помощью метода конфокальной микроскопии.
biokhsm/
БИОХИМИЯ том 84 вып. 12 2019
9*
1900
КИМ и др.
a
b
c
d
e
f
g
h
Рис. 3. Akt1 взаимодействует с RBP Jk в интактных клетках. a - Клетки NIH3T3 обрабатывали PDGF (10 нг/мл) 8 ч и
вортманнином (1 мкМ) или LY294002 (10 мкМ) 30 мин. Клеточные лизаты подвергали иммунопреципитации с использо
ванием антител против RBP Jk и осуществляли иммуноблоттинг иммунопреципитатов с помощью антител против Akt1;
b - клетки NIH3T3 обрабатывали PDGF в течение 8 ч и вортманнином или LY294002 30 мин. Активность Akt1 определя
ли с помощью гистона H2B в качестве субстрата после иммунопреципитации антителами против RBP Jk через определе
ние киназной активности иммунного комплекса; c - лизаты клеток NIH3T3, обработанных PDGF, вортманнином и/или
LY294002, инкубировали с GST RBP Jk и осаждали с использованием GSH агарозы. Комплексы ресуспендировали и оп
ределяли активность RBP Jk киназы в 50 мМ Tris (pH7,5), 10 мМ MgCl2, 1 мМ DTT и 2 μCi [γ32P] AТФ; d - консенсусная
последовательность субстратов Akt1 и различных форм RBP Jk; e - клетки NIH3T3 обрабатывали PDGF 8 ч и вортман
нином или LY294002 30 мин. Активность Akt1 измеряли с использованием GST RBP Jk или GST RBP Jk T223A после им
мунопреципитации антителами против Akt1 при определении киназной активности иммунного комплекса; f - клетки
NIH3T3 трансфицировали HA Akt1 CA и HA Akt1 DN. Активность Akt1 измеряли с использованием GST mRBP Jk или
GST mRBP Jk T223A после их иммунопреципитации с помощью антител против Akt1при определении киназной актив
ности иммунного комплекса; g - метаболическое мечение in vivo с использованием клеток NIH3T3, обработанных PDGF,
вортманнином и/или LY294002, после их трансфекции Flag RBP Jk и Flag RBP Jk T223A и иммунопреципитации с ис
пользованием антител против Flag; h - метаболическое мечение in vivo было проведено с участием Akt1 CA и/или Akt1
DN наряду с клетками, трансфицированными Flag RBP Jk или Flag RBP Jk T223A, иммунопреципитацию осуществля
ли с помощью антител против Flag
БИОХИМИЯ том 84 вып. 12 2019
Akt1 РЕГУЛИРУЕТ ФОСФОРИЛИРОВАНИЕ RBP Jk
1901
ядра. С помощью метода иммунофлуоресцент
3, e, дорожки 3-6). GST RBP Jk T223A не фос
ного окрашивания было изучено влияние Akt1
форилировался иммунным комплексом Akt1 ни
на локализацию Notch1 IC и RBP Jk. Как и
при каких условиях (рис. 3, e, дорожки 7-12).
ожидалось, Akt1 CA вызывал переход RBP Jk с
Наконец, иммунопреципитаты Akt1 из клеток,
прикрепленным Flag из ядра в цитоплазму (как
трансфицированных Akt1 CA, но не из клеток,
небольшие кластеры). При этом локализация
трансфицированных Akt1 DN, может фосфори
Notch1 IC не изменялась (рис. 2, d). Таким об
лировать рекомбинантный RBP Jk in vitro
разом, полученные результаты указывают на то,
(рис. 3, f). Akt1 повышал уровень фосфорилиро
что Akt1 непосредственно предотвращает обра
вания RBP Jk из клеток мыши и Drosophila (дан
зование комплекса белка RBP Jk и Notch1 IC,
ные не показаны). Однако в наших эксперимен
что приводит к потере Notch1 опосредованной
тах фосфорилирование Notch1 с помощью Akt1
трансактивации генов мишеней.
обнаружено не было (данные не показаны).
Физическая ассоциация между RBP Jk и Akt1
Akt1 является наилучшим кандидатом для
в клетках, обработанных PDGF. Изучена воз
участия в PDGF опосредованном фосфорили
можность образования комплекса между RBP
ровании белка RBP Jk по а.о. треонина T223.
Jk и Akt1 в присутствии и в отсутствии PDGF. В
Чтобы проверить возможность такого фосфори
присутствии PDGF RBP Jk физически взаимо
лирования в интактных клетках, клетки NIH
действовал с Akt1 в клетках (рис. 3, a, дорожки 1
3T3 были обработаны PDGF и/или ингибитора
и 2). Однако совместная обработка ингибитора
ми PI3K. В присутствии PDGF уровень метабо
ми PI3K (вортманнин и LY294002) приводила к
лического мечения RBP Jk повышался, хотя
ингибированию образования комплекса RBP
при этом не было обнаружено фосфорилирова
Jk Akt1 (рис. 3, a, дорожки 3 и 4). Чтобы опреде
ние белка RBP Jk T223A (рис. 3, g). Совместная
лить играет ли Ras PI3K Akt1 сигнальный путь
трансфекция клеток Akt1 CA вместе с RBP Jk и
роль в регуляции Akt1 зависимого сигнального
мутантным белком RBP Jk T223A показала, что
пути, был проведен анализ активности киназ в
Akt1 нуждается в а.о. треонина T223 in vivo
условиях in vitro. PDGF стимулированная фер
(рис. 3, h), как это наблюдается in vitro. Чтобы
ментативная активность Akt1 в значительной
подтвердить предположение, что Akt1 опосреду
степени подавлялась в клетках, обработанных
ет ответ на действие PDGF в интактных клетках,
вортманнином и LY294002 (рис. 3, b). Те же ре
клетки NIH 3T3 были трансфицированы Akt1
зультаты были получены с использованием
DN и затем добавляли PDGF. В этих условиях
RBP Jk, обработанным GST (рис. 3, c). Был про
метаболическое мечение RBP Jk не наблюда
веден поиск сайта фосфорилирования в RBP Jk
лось. Таким образом, в этих экспериментах бы
путем идентификации консервативных консен
ло показано, что Akt1 необходим и достаточен
сусных сайтов фосфорилирования Аkt1
для того, чтобы опосредовать PDGF индуциро
(RxRxxS/T) в RBP Jk. Анализ последователь
ванное фосфорилирование RBP Jk.
ностей выявил, что RBP Jk содержит консен
Неподдающийся фосфорилированию мутант
сусный мотив фосфорилирования Akt1 в виде
ный белок RBP Jk T223A не ингибируется активи
остатка треонина T223, который является кон
рованным Akt1. Необходимость проведения ана
сервативным остатком в ортологах RBP Jk (рис.
лиза фосфорилирования RBP Jk была вызвана
3, d). Чтобы подтвердить тот факт, что Akt1 мо
наблюдениями, которые свидетельствовали о
жет прямо фосфорилировать RBP Jk по остатку
способности PDGF блокировать транскрипци
треонина T223, проверили действие киназы на
онную активность генов мишеней Notch1 IC.
очищенном белке GST RBP Jk, содержащем
Была проанализирована транскрипционная ак
сайт дикого типа, или на рекомбинантном белке
тивность Notch1 в присутствии RBP Jk T223A.
RBP Jk, в котором аминокислотный остаток
Показано, что Notch1 IC в отдельности активи
T223 был заменен на остаток аланина. Akt1 был
ровал репортерный ген, а совместная экспрес
иммунопреципитирован из экстрактов необра
сия с RBP Jk только незначительно повышала
ботанных клеток или клеток, обработанных
активность люциферазы. В присутствии Akt1
PDGF и/или ингибиторами PI3K. Только GST
CA активность Notch1 IC/RBP Jk в значитель
RBP Jk, который содержал сайт фосфорилиро
ной степени подавлялась (рис. 4, a). Однако в
вания Akt1, был фосфорилирован в результате
тех условиях, когда Notch1 IC был совместно
стимуляции с помощью PDGF (рис. 3, e, дорож
экспрессирован с RBP Jk T223A, Akt1 CA не
ки 1 и 2). Следует отметить, что Akt1, выделен
был способен подавлять его активность
ный из экстрактов нестимулированных PDGF
(рис. 4, a), что позволяет предположить, что ос
клеток или из стимулированных PDGF, но и об
таток треонина T223 в белке RBP Jk играет клю
работанных ингибитором PI3K клеток, не был
чевую роль в Akt1 опосредованном подавлении
способен фосфорилировать GST RBP Jk (рис.
Notch1 зависимого сигнального пути. Получен
БИОХИМИЯ том 84 вып. 12 2019
1902
КИМ и др.
a
b
c
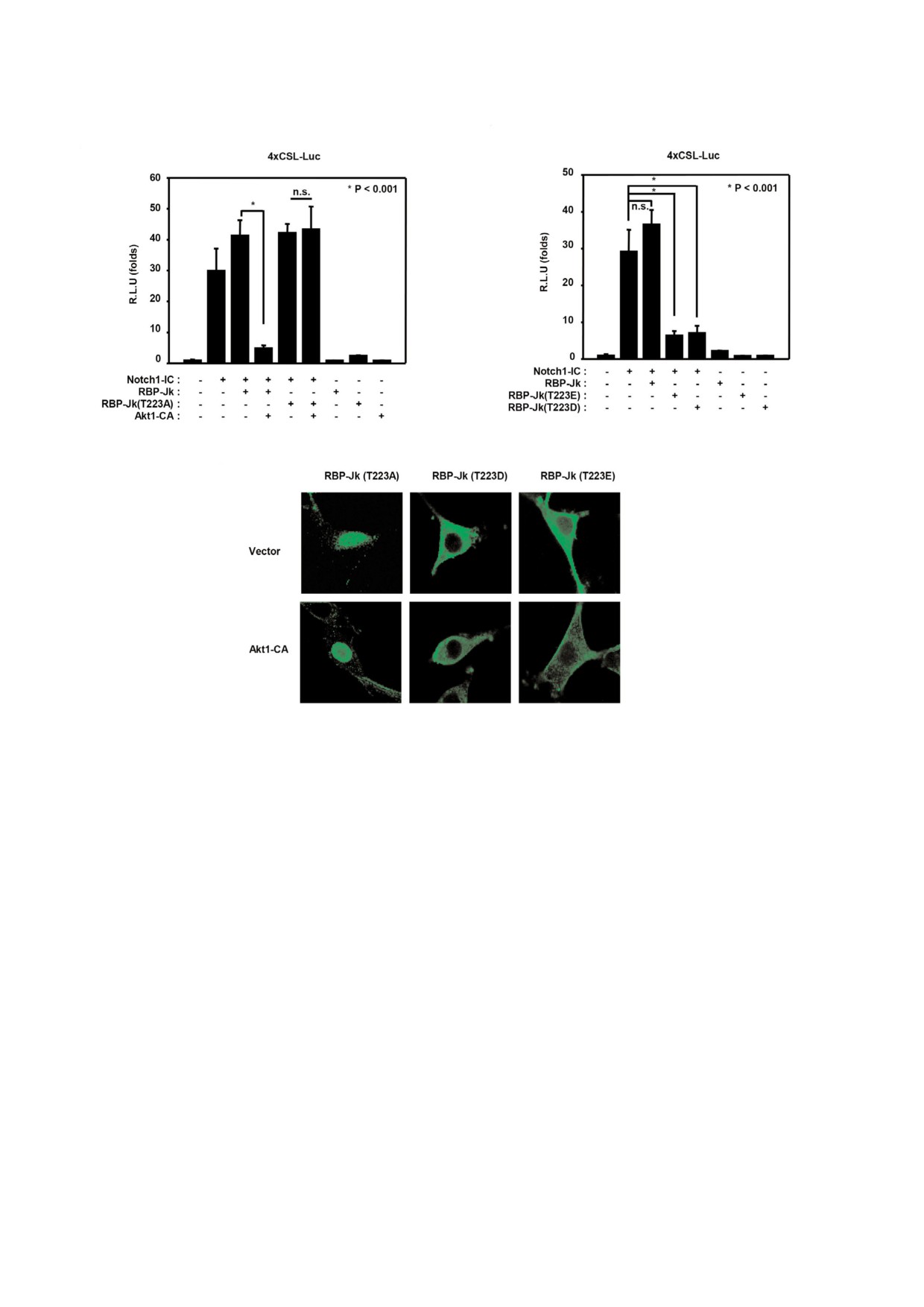
Рис. 4. Мутантный неподдающийся фосфорилированию белок (RBP Jk T223A) устойчив к действию Akt1. a- Клетки
NIH3T3 были кратковременно трансфицированы Notch1 IC, RBP Jk, RBP Jk T223A, Akt1 CA, 4×CSL Luc и β галактозида
зой; b - клетки NIH3T3 были кратковременно трансфицированы Notch1 IC, RBP Jk, T223E, T223D, 4×CSL Luc и β галак
тозидазой. Клетки лизировали и определяли в лизатах их люциферазную активность (a, b); c - клетки NIH3T3 трансфици
ровали HA Akt1 CA и Flag RBP Jk T223A, T223D или мутантной формой T223E как указано на рисунке. После 48 ч транс
фекции клетки фиксировали белок RBP Jk окрашивали Alexa Fluor 488 и изучали с помощью конфокального микроскопа.
biokhsm/
ные результаты свидетельствуют в пользу того,
феразной репортерной системы была подавлена
что нефосфорилируемая форма RBP Jk устой
(рис. 4, b). Кроме того, мутантные белки RBP Jk
чива к действию Akt1.
T223D и RBP Jk T223E были локализованы в
Чтобы далее изучать роль а.о. треонина
цитоплазме. Как ожидалось, все мутантные по
pT223, были получены мутантные по сайту
остатку T223 белки RBP Jk были устойчивы к
фосфорилирования формы белка, T223D и
действию активированного Akt1. Мутантный
T223E, сходные с фосфорилируемым белком
белок RBP Jk T233A всегда был локализован в
RBP Jk. Чтобы определить роль мутантных
ядре, а мутантные белки с аминокислотными
белков RBP Jk T223D и RBP Jk T223E в регу
заменами T223D и T223E были выявлены иск
ляции транскрипционной активности генов
лючительно в цитоплазме (рис. 4, c). Удивитель
мишеней Notch1 IC, была использована люци
но, но локализованные в цитоплазме белки
феразная репортерная система. При повышен
RBP Jk с аминокислотными заменами T223D и
ной экспрессии мутантных белков RBP Jk
T223E были способны доминантно репрессиро
T223D или RBP Jk T223E активность Notch1
вать эндогенную экспрессию RBP Jk внутри яд
IC индуцированной активности 4 × CSL люци
ра (рис. 4, c).
БИОХИМИЯ том 84 вып. 12 2019
Akt1 РЕГУЛИРУЕТ ФОСФОРИЛИРОВАНИЕ RBP Jk
1903
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
SMRT. Akt1 консенсусный сайт белка RBP Jk
локализуется вблизи мест, подверженных мута
Notch1 и RTK Ras зависимые сигнальные
циям, которые нарушают связывание SMRT
пути во время развития клеток действуют синер
(EEF233AAA), и первый а.о. аргинина в этом
гично или антагонистично. Согласно послед
сайте играет важную роль связывании ДНК с
ним исследованиям, Notch1 подавляет RTK
RBP JK (аминокислотная замена R218H, кото
Ras зависимый сигнальный путь во время раз
рая снижает способность белка связываться с
вития вульвы C. elegance через индукцию фосфа
ДНК) [35-38].
тазы Lip 1 [33]. Во время принятия второго ре
Чтобы подтвердить прямое фосфорилирова
шения по судьбе клеток Notch1 является основ
ние белка RBP Jk по остатку треонина T223 бел
ным сигналом, однако при принятии первого
ком Akt1, определена киназная активность очи
решения основным сигналом в определении
щенного белка GST RBP Jk, содержащего сайт
судьбы клеток C. elegance является Ras. В то же
дикого типа, или рекомбинантного белка RBP
время не определена точная связь между этими
Jk, в котором остаток T223 был заменен на оста
двумя путями не только в процессе развития, но
ток аланина (рис. 3). Только белок GST RBP Jk,
и у взрослых организмов. Чтобы ответить на эти
содержащий интактный сайт фосфорилирова
вопросы, было изучено влияние PDGF на
ния для Akt1, подвергался фосфорилированию
Notch1 зависисмый сигнальный путь с исполь
после стимуляции с помощью PDGF. Обработка
зованием систем репортерной люциферазы.
клеток PDGF или повышение экспрессии Akt1
PDGF эффективно ингибировал Notch1 IC за
приводили к фосфорилированию белка RBP Jk
висимую транскрипционную активность. В то
по остатку треонина T223. Обработка PDGF ин
же время PDGF не ингибировал Notch1 IC
дуцировала фосфорилирование RBP Jk WT, но в
опосредованную транскрипционную актив
клетках с DN формой Akt1 наблюдалось значи
ность в том случае, когда Notch1 IC совместно
тельное ингибирование PDGF индуцированно
экспрессировался с доминантно негативной му
го фосфорилирования (рис. 3, h). Эти данные
тантной формой Ras (RasN17) и при обработке
подтвердили, что PDGF индуцированная акти
ингибиторами PI3K (LY294002 и вортманнин)
вация Akt1 ингибирует Notch зависимый сиг
(рис. 1, a, b). Также было показано, что PDGF
нальный путь в результате фосфорилирования
ингибирует Notch1 IC зависимую транскрип
остатка T223 в белке RBP Jk.
ционную активность, но он не ингибирует эту
Также в настоящей работе было показано,
транскрипционную активность Notch1 IC в том
что Akt1 подавляет локализацию RBP Jk в ядре.
случае, когда Notch1 IC был совместно экспрес
Недавно в работах было показано, что измене
сирован с доминантно негативной мутантной
ние внутриклеточной локализации RBP Jk под
формой Akt1 (рис. 1, c). Наши данные говорят о
действием Akt1 происходит в результате фосфо
том, что транскрипционная активность Notch1
рилирования [39]. Особо следует отметить, что
может быть подавлена PDGF через Ras PI3K
(как нами было обнаружено) фосфорилирова
Akt зависимый сигнальный путь.
ние RBP Jk происходит как в интактных клет
В связи с тем, что Akt модулирует белки ми
ках, так и дефицитных по фосфорилированию
шени путем их фосфорилирования, нами была
мутантах, устойчивых к действию Akt1. Также
изучена возможность прямого фосфорилирова
подтверждено снижение уровня комплексов
ния этим белком компонентов Notch зависи
Notch1 IC RBP Jk и активности Notch1 и ус
мого сигнального пути. В предыдущих работах
тойчивость мутантов с дефицитом фосфорили
был идентифицирован консенсусный мотив
рования. Это первая работа, в которой говорит
(RxRxx(S/T)), который фосфорилируется Akt
ся о зависимой от фосфорилирования регуля
[34]. Изоформа Akt1 более широко распростра
ции активности RBP Jk и существовании пере
нена, чем другие изоформы белка Akt. В RBP Jk
крестных связей с RTK Ras зависимым сиг
выявлен консервативный консенсусный мотив,
нальным путем.
который фосфорилируется Akt в клетках челове
Неканоническая функция Akt в основных
ка, мыши, лягушки, дрозофилы и C. elegans.
клеточных процессах, таких как пролиферация,
Анализ аминокислотной последовательности
инвазия, апоптоз, уже была описана в несколь
RBP Jk показал, что в этом белке есть один сайт,
ких работах [40-43]. Результаты нашей работы
который соответствует мотиву фосфорилирова
могут объяснить другую неканоническую функ
ния белком Akt: T223 (RLRSQT). Интересно,
цию Akt1, так как было показано, что он участ
что участок, который в RBP Jk окружает кон
вует в механизме контроля активности Notch
сенсусный для Akt1 сайт (RLRSQT), играет важ
зависимого сигнального пути.
ную роль во взаимодействии с Notch1-RAM и в
Таким образом, нами было показано, что
связывании ДНК, а также во взаимодействии с
RTK Ras Akt1 зависимый сигнальный путь не
БИОХИМИЯ том 84 вып. 12 2019
1904
КИМ и др.
Рис. 5. Подавление активности Notch1 во время дифференцировки мышечных клеток. Графическая модель Notch1 зави
симого сигнального пути в клетках. Akt1 подавляет Notch1 зависимый сигнальный путь, фосфорилируя остаток треонина
T223 белка RBP Jk, который, в свою очередь, диссоциирует в ядре комплекс Notch1 IC-RBP Jk.
biokhsm/
гативно регулирует Notch1 зависимый сигналь
Research Foundation of Korea (NRF), финансируе
ный путь. В частности, Akt1 фосфорилирует ос
мого Министерством науки, ICT и планирова
таток треонина T223 в белке RBP Jk и, тем са
ния будущего (грант NRF 2014R1A4A1003642).
мым, подавляет транскрипционную активность
Благодарности. Авторы выражают благодар
Notch1 путем ингибирования внутриядерной
ность R. Kopan (медицинский факультет Вашинг
локализации RBP Jk (рис. 5).
тонского университета, Washington university
school of medicine) за приготовление конструк
ций Notch1.
Финансирование. Выполнение работы прохо
Конфликт интересов. Авторы заявляют об от
дило при финансовой поддержке Программы
сутствии конфликта интересов.
базовых научных исследований (Basic Science
Соблюдение этических норм. Данная работа
Research Program) Государственного фонда под
не содержит исследований, использующих в ка
держки науки Республики Корея (National честве объектов людей или животных.
СПИСОК ЛИТЕРАТУРЫ
1.
Artavanis Tsakonas, S., Rand, M.D., and Lake, R.J.
6.
Kopan, R., and Ilagan, M.X. (2009) The canonical Notch
(1999) Notch signaling: cell fate control and signal integra
signaling pathway: unfolding the activation mechanism,
tion in development, Science, 284, 770-776.
Cell, 137, 216-233.
2.
Schweisguth, F. (2004) Regulation of notch signaling activ
7.
Oswald, F., Winkler, M., Cao, Y., Astrahantseff, K.,
ity, Curr. Biol., CB 14, 129-138.
Bourteele, S., Knochel, W., and Borggrefe, T. (2005) RBP
3.
Artavanis Tsakonas, S., Matsuno, K., and Fortini, M.E.
Jkappa/SHARP recruits CtIP/CtBP corepressors to silence
(1995) Notch signaling, Science, 268, 225-232.
Notch target genes, Mol. Cell. Biol., 25, 10379-10390.
4.
Ohtsuka, T., Ishibashi, M., Gradwohl, G., Nakanishi, S.,
8.
Luo, J., Manning, B.D., and Cantley, L.C.
(2003)
Guillemot, F., and Kageyama, R. (1999) Hes1 and Hes5 as
Targeting the PI3K Akt pathway in human cancer: ratio
notch effectors in mammalian neuronal differentiation,
nale and promise, Cancer Cell, 4, 257-262.
EMBO J., 18, 2196-2207.
9.
Vanhaesebroeck, B., and Alessi, D.R. (2000) The PI3K
5.
Bray, S.J. (2016) Notch signalling in context. Nat. Rev.
PDK1 connection: more than just a road to PKB, Biochem.
Mol. Cell Biol., 17, 722-735.
J., 346, 561-576.
БИОХИМИЯ том 84 вып. 12 2019
Akt1 РЕГУЛИРУЕТ ФОСФОРИЛИРОВАНИЕ RBP Jk
1905
10.
Chan, T.O., Rittenhouse, S.E., and Tsichlis, P.N. (1999)
28.
Yoon, J.H., Mo, J.S., Ann, E.J., Ahn, J.S., Jo, E.H., Lee, H.J.,
AKT/PKB and other D3 phosphoinositide regulated
Hong, S.H., Kim, M.Y., Kim, E.G., Lee, K., and Park, H.S.
kinases: kinase activation by phosphoinositide de
(2016) Notch1 intracellular domain negatively regulates
pendent phosphorylation, Ann. Rev. Biochem., 68,
PAK1 signaling pathway through direct interaction,
965-1014.
Biochim. Biophys. Acta, 1863, 179-188.
11.
Toker, A., and Newton, A.C. (2000) Cellular signaling: piv
29.
Fan, H., Ma, L., Fan, B., Wu, J., Yang, Z., and Wang, L.
oting around PDK 1, Cell, 103, 185-188.
(2014) Role of PDGFR beta/PI3K/AKT signaling path
12.
Burgering, B.M., and Medema, R.H. (2003) Decisions on
way in PDGF BB induced myocardial fibrosis in rats, Am.
life and death: FOXO Forkhead transcription factors are in
J. Transl. Res., 6, 714-723.
command when PKB/Akt is off duty, J. Leukocyte Biol.,
30.
Kim, E.K., Tucker, D.F., Yun, S.J., Do, K.H., Kim, M.S.,
73, 689-701.
Kim, J.H., Kim, C.D., Birnbaum, M.J., and Bae, S.S.
13.
Ozes, O.N., Mayo, L.D., Gustin, J.A., Pfeffer, S.R.,
(2008) Linker region of Akt1/protein kinase Balpha medi
Pfeffer, L.M., and Donner, D.B. (1999) NF kappa B acti
ates platelet derived growth factor induced translocation
vation by tumour necrosis factor requires the Akt serine
and cell migration, Cell. Signal., 20, 2030-2037.
threonine kinase, Nature, 401, 82-85.
31.
Nurminskaya, M., Beazley, K.E., Smith, E.P., and Belkin,
14.
Diehl, J.A., Cheng, M., Roussel, M.F., and Sherr, C.J.
A.M. (2014) Transglutaminase 2 promotes PDGF mediat
(1998) Glycogen synthase kinase 3beta regulates cyclin D1
ed activation of PDGFR/Akt1 and beta catenin signaling
proteolysis and subcellular localization, Genes Dev., 12,
in vascular smooth muscle cells and supports neointima
3499-3511.
formation, J. Vasc. Res., 51, 418-428.
15.
Zimmermann, S., and Moelling, K. (1999) Phosphorylation
32.
Miele, L. (2011) Transcription factor RBPJ/CSL: a
and regulation of Raf by Akt (protein kinase B), Science,
genome wide look at transcriptional regulation, Proc. Natl.
286, 1741-1744.
Acad. Sci. USA, 108, 14715-14716.
16.
Rommel, C., Clarke, B.A., Zimmermann, S., Nunez, L.,
33.
Berset, T., Hoier, E.F., Battu, G., Canevascini, S., and
Rossman, R., Reid, K., Moelling, K., Yancopoulos, G.D.,
Hajnal, A. (2001) Notch inhibition of RAS signaling
and Glass, D.J. (1999) Differentiation stage specific inhi
through MAP kinase phosphatase LIP 1 during C. elegans
bition of the Raf MEK ERK pathway by Akt, Science,
vulval development, Science, 291, 1055-1058.
286, 1738-1741.
34.
Alessi, D.R., Caudwell, F.B., Andjelkovic, M., Hemmings, B.A.,
17.
Manning, B.D., and Cantley, L.C. (2007) AKT/PKB sig
and Cohen, P. (1996) Molecular basis for the substrate
naling: navigating downstream, Cell, 129, 1261-1274.
specificity of protein kinase B; comparison with MAPKAP
18.
Lawlor, M.A., and Alessi, D.R. (2001) PKB/Akt: a key
kinase 1 and p70 S6 kinase, FEBS Lett., 399, 333-338.
mediator of cell proliferation, survival and insulin respons
35.
Ann, E.J., Kim, H.Y., Choi, Y.H., Kim, M.Y., Mo, J.S.,
es? J. Cell Sci., 114, 2903-2910.
Jung, J., Yoon, J.H., Kim, S.M., Moon, J.S., Seo, M.S.,
19.
Palomero, T., Sulis, M.L., Cortina, M., Real, P.J., Barnes, K.,
Hong, J.A., Jang, W.G., Shore, P., Komori, T., Koh, J.T., and
Ciofani, M., Caparros, E., Buteau, J., Brown, K., Perkins, S.L.,
Park, H.S. (2011) Inhibition of Notch1 signaling by Runx2 dur
Bhagat, G., Agarwal, A.M., Basso, G., Castillo, M.,
ing osteoblast differentiation, J. Bone Miner. Res., 26, 317-330.
Nagase, S., Cordon Cardo, C., Parsons, R., Zuniga
36.
Tani, S., Kurooka, H., Aoki, T., Hashimoto, N., and
Pflucker, J.C., Dominguez, M., and Ferrando, A.A. (2007)
Honjo, T. (2001) The N and C terminal regions of RBP J
Mutational loss of PTEN induces resistance to NOTCH1
interact with the ankyrin repeats of Notch1 RAMIC to
inhibition in T cell leukemia, Nature Med., 13, 1203-1210.
activate transcription, Nucleic Acids Res., 29, 1373-1380.
20.
Wang, H., Cheng, H., Shao, Q., Dong, Z., Xie, Q., Zhao, L.,
37.
Privalsky, M.L. (2001) Regulation of SMRT and N CoR
Wang, Q., Kong, B., and Qu, X. (2014) Leptin promoted
corepressor function, Curr. Top. Microbiol. Immunol., 254,
human extravillous trophoblast invasion is MMP14 depen
117-136.
dent and requires the cross talk between Notch1 and
38.
Brou, C., Logeat, F., Lecourtois, M., Vandekerckhove, J.,
PI3K/Akt signaling, Biol. Reprod., 90, 78.
Kourilsky, P., Schweisguth, F., and Israel, A.
(1994)
21.
Bansal, K., and Balaji, K.N. (2011) Intracellular pathogen
Inhibition of the DNA binding activity of Drosophila sup
sensor NOD2 programs macrophages to trigger Notch1
pressor of hairless and of its human homolog, KBF2/RBP J
activation, J. Biol. Chem., 286, 5823-5835.
kappa, by direct protein protein interaction with
22.
Maliekal, T.T., Bajaj, J., Giri, V., Subramanyam, D., and
Drosophila hairless, Genes Dev., 8, 2491-2503.
Krishna, S. (2008) The role of Notch signaling in human
39.
Gao, D., Inuzuka, H., Tseng, A., Chin, R.Y., Toker, A.,
cervical cancer: implications for solid tumors, Oncogene,
and Wei, W. (2009) Phosphorylation by Akt1 promotes
27, 5110-5114.
cytoplasmic localization of Skp2 and impairs APCCdh1
23.
Hurlbut, G.D., Kankel, M.W., and Artavanis Tsakonas, S.
mediated Skp2 destruction, Nature Cell Biol., 11, 397-408.
(2009) Nodal points and complexity of Notch Ras signal
40.
Safdari, Y., Khalili, M., Ebrahimzadeh, M.A., Yazdani, Y.,
integration, Proc. Nat. Acad. Sci. USA, 106, 2218-2223.
and Farajnia, S. (2015) Natural inhibitors of PI3K/AKT sig
24.
Hurlbut, G.D., Kankel, M.W., Lake, R.J., and Artavanis
naling in breast cancer: emphasis on newly discovered mole
Tsakonas, S. (2007) Crossing paths with Notch in the
cular mechanisms of action, Pharmacol. Res., 93, 1-10.
hyper network, Curr. Opin. Cell. Biol., 19, 166-175.
41.
Toker, A., and Yoeli Lerner, M. (2006) Akt signaling and
25.
Sundaram, M.V.
(2005) The love hate relationship
cancer: surviving but not moving on, Cancer Res., 66,
between Ras and Notch, Genes Dev., 19, 1825-1839.
3963-3966.
26.
Doroquez, D.B., and Rebay, I. (2006) Signal integration
42.
Riggio, M., Perrone, M.C., Polo, M.L., Rodriguez, M.J.,
during development: mechanisms of EGFR and Notch
May, M., Abba, M., Lanari, C., and Novaro, V. (2017)
pathway function and cross talk, Crit. Rev. Biochem. Mol.
AKT1 and AKT2 isoforms play distinct roles during breast
Biol., 41, 339-385.
cancer progression through the regulation of specific
27.
Kim, M.Y., Ann, E.J., Mo, J.S., Dajas Bailador, F., Seo, M.S.,
downstream proteins, Sci. Rep., 7, 44244.
Hong, J.A., Jung, J., Choi, Y.H., Yoon, J.H., Kim, S.M.,
43.
Kozlova, N.I., Morozevich, G.E., Ushakova, N.A., and
Choi, E.J., Hoe, H.S., Whitmarsh, A.J., and Park, H.S.
Berman, A.E. (2018) Implication of integrin alpha2beta1
(2010) JIP1 binding to RBP Jk mediates cross talk
in proliferation and invasion of human breast carcinoma
between the Notch1 and JIP1 JNK signaling pathway, Cell
and melanoma cells: noncanonical function of Akt protein
Death Differ., 17, 1728-1738.
kinase, Biochemistry (Moscow), 83, 738-745.
БИОХИМИЯ том 84 вып. 12 2019
1906
КИМ и др.
Akt1 MEDIATED PHOSPHORYLATION
OF RBP Jk CONTROLS Notch1 SIGNALING
M. Y. Kim*, J. Y. Park, and H. S. Park*
School of Biological Sciences and Technology, Chonnam National University, Gwangju 61186,
Republic of Korea; E mail: mykim31002@gmail.com, proteome@jnu.ac.kr
Received May 31, 2019
Revised July 17, 2019
Accepted July 17, 2019
Notch1 signaling pathway plays a crucial role in determination of cell fate, including cell growth and differentiation.
In this study, we demonstrated that the antagonistic action of RTK signaling pathway on Notch1 signaling pathway
was mediated via Ras PI3K Akt1. The PI3K Akt1 signaling pathway was shown to inhibit the Notch1 signaling path
way via phosphorylation of RBP Jk protein. Reduced association between Notch1 and RBP Jk and suppressed
Notch1 transcriptional activity were observed as well. Our results demonstrate that Akt1 functions as a natural
inhibitor of the Notch1 signaling pathway via phosphorylation of RBP Jk.
Keywords: Notch1 signaling pathway, Akt1, phosphorylation
БИОХИМИЯ том 84 вып. 12 2019