БИОХИМИЯ, 2019, том 84, вып. 3, с. 297 - 313
УДК 616
РАЗВИТИЕ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ
КЛЕТОК В РАННЕМ ЭМБРИОНЕ МЛЕКОПИТАЮЩИХ
Обзор
© 2019 С.А. Рыбцов1*, М.А. Лагарькова2
1 MRC Centre for Regenerative Medicine, University of Edinburgh,
EH16 4U, Edinburgh, United Kingdom; E mail: srybtsov@ed.ac.uk
2 Федеральный научно клинический центр физико химической
медицины ФМБА России, 119435 Москва, Россия;
электронная почта: lagar@rcpcm.org
Поступила в редакцию 20.11.2018
После доработки 04.12.2018
Принята к публикации 04.12.2018
Гемопоэтические стволовые клетки (ГСК) - первый тип стволовых клеток, обнаруженных в организме че"
ловека. Их существование было предсказано А.А. Максимовым и экспериментально доказано Тиллом и
Мак"Каллоком. ГСК - первые стволовые клетки, которые были успешно применены в терапии и до сих пор
активно используются. Даже единственная ГСК способна дать начало всем типам клеток крови при внут"
ривенной трансплантации. Множество исследований последних десятилетий было посвящено изучению
происхождения и иерархии ГСК, определению их молекулярного фенотипа в организме человека и живот"
ных, а также особенностям их функционирования и развития. В связи с постоянной потребностью в донор"
ской крови и ГСК, пригодных для терапевтических трансплантаций, в последние годы рассматривается
экспериментальная возможность получения ГСК in vitro путем направленной дифференцировки плюрипо"
тентных стволовых клеток (ПСК). Однако, несмотря на все усилия, пока не удается воспроизвести in vitro
онтогенез ГСК и получить клетки, способные к долговременному поддержанию кроветворения. Изучение
гемопоэза и его становления в эмбриональном развитии не только облегчает создание и усовершенствова"
ние протоколов получения клеток крови из ПСК, но и позволяет лучше понять патогенез различных видов
пролиферативных заболеваний крови, анемий и иммунодефицитов. Данный обзор посвящен развитию
кроветворения в онтогенезе млекопитающих.
КЛЮЧЕВЫЕ СЛОВА: гемопоэтические стволовые клетки (ГСК), предшественники клеток крови, иерар"
хия кроветворения, развитие мыши, гемопоэз человека, АГМ, эмбрион.
DOI: 10.1134/S0320972519030023
Число постоянно появляющихся и гибну"
щих процессы кроветворения. Все линии гемо"
щих клеток крови в организме млекопитающих
поэтической дифференцировки (миелоидные
очень велико. За жизнь человека продуцируется
клетки - эритроциты, нейтрофилы, гранулоци"
~5 тонн клеток крови. Подсчитано, что каждую
ты, моноциты, мегакариоциты; лимфоидные
минуту в костном мозге производится ~300 млн
клетки - лимфоциты, естественные киллеры)
клеток [1-3]. Подобная клеточная продукция
происходят из стволовых клеток крови, или ге"
должна строго регулироваться, т.к. необходимо
мопоэтических стволовых клеток (ГСК). Мно"
поддержание баланса между пролиферацией
гочисленный пул ГСК и мультипотентных пред"
клеток и их гибелью, нужны системы стимули"
шественников хранится в костном мозге. Одна"
рующих и ингибирующих сигналов, регулирую"
ко только ГСК через сложную иерархическую
Принятые сокращения: АГМ - регион аорты гонад и мезонефроса в раннем эмбрионе; ГСК - гемопоэтические
стволовые клетки; ГЭ - гемогенный эндотелий; д.п.ф. - количество дней после фертилизации; E9 - 9"й день эмбриональ"
ного развития мышей; ИПСК - индуцированные плюрипотентные стволовые клетки; МЛП - мезодерма латеральной
пластинки; ЭГП - эндотелиально"гематопоэтический переход; ЭСК - эмбриональные стволовые клетки; ЭЧМ - эмбрио"
нальный материал человека; про"ГСК - первый предшественник ГСК (E9); пре"ГСК"I - предшественник ГСК I типа (E10),
пре"ГСК"II - предшественник ГСК II типа (E11); CS - стадии развития эмбрионов человека по Карнеги; NSG - имму"
нодефицитные мыши без Т", В" и НК"клеток (NOD/LtSz"scid IL2R gamma null); TGFβ - трансформирующий фактор
роста бета.
* Адресат для корреспонденции.
297
298
РЫБЦОВ, ЛАГАРЬКОВА
систему дифференцировки клеток"предшест"
ких ГСК, была проведена более полная характе"
венников обеспечивают самообновление кро"
ристика их свойств. ГСК у млекопитающих, в
ветворной системы в организме млекопитаю"
т.ч. у человека, образуются в период эмбрио"
щих [3, 4].
нального развития [15-18].
Иерархия клеток"предшественников в кро"
Онтогенез кроветворной системы позвоноч"
ветворной системе представлена несколькими
ных характеризуется двумя отдельными процес"
отделами, которые были определены физиоло"
сами: 1) эмбриональным кроветворением, при
гическими методами [5-8].
котором образуются транзиторные популяции
Отдел стволовых клеток включает клетки,
кроветворных клеток, такие как примитивные
способные к мультипотентной дифференциров"
эритроциты и некоторые миелоидные клетки;
ке во все линии кроветворных клеток и облада"
2) постоянным, или дефинитивным, кроветво"
ющие высоким пролиферативным потенциа"
рением, которое происходит позже в развитии
лом. Они могут полностью восстановить кро"
из дефинитивных ГСК и приводит к возникно"
ветворение в облученном организме (их поло"
вению всех зрелых (эритроидных, миелоидных
жение в иерархии зависит от способности осу"
и лимфоидных) клеток крови во взрослом орга"
ществлять длительную или кратковременную
низме. Понимание процессов, приводящих к
репопуляцию костного мозга).
образованию ГСК в онтогенезе, может сущест"
Олигопотентные клетки"предшественники -
венно облегчить экспериментальные усилия по
родоначальники только нескольких линий кро"
созданию технологий получения клеток крови
ви, таких как общие миелоидные предшествен"
in vitro для задач регенеративной медицины и
ники (дающие моноциты, мегакариоциты, эри"
онкологии.
троциты) и общие лимфоидные предшествен"
В данном обзоре обсуждаются современные
ники (дающие В", Т" и НК"клетки). Более низ"
гипотезы развития гемопоэтической системы и
кую ступень в иерархии занимает отдел уни" и
ГСК в процессе эмбриогенеза, разбирается кон"
бипотентных клеток"предшественников, спо"
цепция происхождения кроветворных и эндоте"
собных к одной или двум дифференцировкам.
лиальных клеток, а также приводится сравнение
Стволовые клетки крови являются, пожалуй,
становления кроветворной системы у мыши и
самыми первыми стволовыми клетками взрос"
человека.
лого организма, известными науке. Еще в 1903 г.
русский ученый А.А. Максимов, наблюдая за
поведением клеток крови, ввел понятие «ство"
СПЕЦИАЛИЗАЦИЯ КЛЕТОК КРОВИ
ловая клетка» [9-11].
ИЗ РАННЕЙ МЕЗОДЕРМЫ
Позднее эксперименты, проведенные канад"
скими учеными Тиллом и Мак"Каллоком, пока"
После открытия ЭСК - плюрипотентных
зали, что при трансплантации клеток селезенки
клеток, способных к дифференцировке во все
или костного мозга облученным эксперимен"
типы клеток, - научным сообществом рассмат"
тальным животным обнаруживаются кластеры
ривается вопрос о возможности получения кле"
делящихся клеток в селезенке реципиентов.
ток крови из этого практически неограниченно"
Клетки, образующие такие кластеры, назвали
го источника. Ранние работы по направленной
колониеобразующими единицами селезенки -
дифференцировке клеток крови встретились с
КОЕ"С (colony"forming units in spleen, CFU"S).
серьезным препятствием - невозможностью
КОЕ"С были позже охарактеризованы как по"
получения полностью зрелых клеток крови. Так,
липотентные предшественники крови. Обнару"
большинство эритроцитов, полученных из ЭСК
жение этих клеток считается первым экспери"
человека, содержало ядро и синтезировало фе"
ментальным подтверждением существования
тальный гемоглобин, не способный к эффек"
стволовых клеток крови [12, 13].
тивному переносу кислорода во взрослом орга"
Истоки кроветворения начали искать в эмб"
низме [19]. Значительная часть моноцитов де"
риональном развитии. Изучая кроветворение
монстрировала незрелый фенотип, макрофаги
птиц, профессор Дитерлин"Ливр показала в
не могли осуществлять эффективный фагоцитоз
экспериментах по пересадке желточного мешка
и воспалительные реакции [20, 21]. Воспроизвод"
и эмбрионального зачатка на химерных эмбрио"
ство развития ГСК в пробирке оказалось чрез"
нах курицы и перепела, что основной вклад в
вычайно трудной экспериментальной задачей.
кроветворение, происходящее во взрослом ор"
Попытка вызвать увеличение количества ГСК"
ганизме, вносят клетки тела эмбриона, но не
подобных клеток путем экспрессии гена HoxB4
экстраэмбриональных тканей желточного меш"
выявила их неполную функциональность. Было
ка [14]. Однако лишь позднее, с разработкой ме"
показано, что такие клетки у мышей склонны к
тодики анализа вклада в кроветворение донорс"
дифференцировке преимущественно в миелоид"
БИОХИМИЯ том 84 вып. 3 2019
ИЕРАРХИЯ ЭМБРИОНАЛЬНОГО ГЕМОПОЭЗА
299
ные предшественники и вносят лишь незначи"
между эктодермой и эндодермой, формируя ме"
тельный вклад в развитие других типов клеток
зодерму (рис. 1, а, г). Дальнейшая специализа"
крови [22-24]. Более того, получение ГСК из
ция приводит к образованию мезодермы лате"
ЭСК человека требует принудительной экспрес"
ральной пластинки (МЛП) (рис. 1, б). Именно
сии нескольких транскрипционных факторов
эту полипотентную ткань считают основой все"
одновременно [25, 26].
го гемопоэза в эмбрионе млекопитающих [27].
Таким образом, получение ГСК в культуре in
МЛП характеризуется экспрессией специфичес"
vitro без генетических манипуляций до сих пор
кого набора генов - Brachyury (Т/TBXT), MIXL1,
остается нерешенной задачей.
FOXF1, APLNR, HAND1 [26, 28-30], а также
Сравнение гемопоэза in vitro c развитием
PDGFRa и Flk1 (KDR/VEGFR2) [30, 31]. Форми"
клеток крови в эмбриогенезе навело на мысль,
рование мезодермы идет под воздействием фак"
что протоколы получения ГСК взрослого типа
торов, секретирующихся эндодермой, таких как
in vitro, к сожалению, имитируют лишь прими"
активин, BMP, bFGF и Wnt/β"катенин. Для
тивную стадию гемопоэза в эмбрионе. Таким об"
дальнейшей дифференцировки в ранний эндо"
разом, исследователи, работающие над создани"
телий и клетки крови критически необходимы
ем эффективной технологии дифференцировки
Flk1 и его лиганд VEGF [32]. Делеция Flk1 в ге"
клеток крови из плюрипотентных стволовых
номе мыши (Flk1-/-) блокирует образование эн"
клеток были вынуждены обратиться к подроб"
дотелия и клеток крови [33]. Клетки МЛП миг"
ному исследованию эмбрионального развития.
рируют в желточный мешок, где образуют пояс
Известно, что сразу после гаструляции клет"
кровяных островков. Эта самая ранняя зона
ки эпибласта мыши мигрируют в пространство кроветворения состоит из Flk1+VE"кадгерин+"
Рис. 1. Развитие эмбриона млекопитающих на примере мыши. а-в - Поперечный срез эмбриона, демонстрирующий
трансформацию тканей во время развития; г, д - рисунки эмбрионов мыши с указанием названий тканей и органов. В се"
рых кругах буквами «Д» и «В» обозначены дорзальная и вентральная ориентации эмбриона. Жирными черными линиями
показаны места и направление среза ткани; черной и серыми стрелками - дифференцировка и миграция эпибласта в ме"
зодерму (а), дающую эндотелий и примитивную кровь; черными незакрашенными кружочками - расположение прими"
тивной крови (г). Справа указан возраст эмбрионов в днях после фертилизации (7 и 8 дней). МЛП - мезодерма латераль"
ной пластинки
БИОХИМИЯ том 84 вып. 3 2019
300
РЫБЦОВ, ЛАГАРЬКОВА
эндотелия и CD41+"клеток крови (рис. 1, г, д)
мыши и в то же время у основания аллантоиса в
[34, 35]. За счет дифференцировки и миграции
каудальной части эмбриона. Опыты по диффе"
МЛП также идет образование эндотелия дор"
ренцировке ЭСК в гемопоэтические клетки и
зальной аорты внутри эмбриона (рис. 1, б, в).
прослеживанию их судьбы на уровне отдельных
Однако было показано, что эндотелиальные
клеток показали образование CD41+"клеток из
клетки и клетки крови происходят их разных
VE"кадгерин+CD41-CD45-"клеток эндотелия [44].
популяций клеток эпибласта, а значит, возмож"
Кроме того, реактивация Runx1 только в эндо"
но, и из разных типов МЛП [36], что может сви"
телиальных клетках эмбриона (под управлением
детельствовать о разном происхождении струк"
тканеспецифических промоторов VE"кадгерин"
турного эндотелия и клеток примитивной кро"
CRE или Tie2"CRE) позволяла восстановить ге"
ви. Следующий важный фактор в каскаде разви"
мопоэз и продукцию ГСК у эмбрионов Runx1-/-
тия клеток крови - SCL (Tal1). Он критически
[45-47]. Авторы предположили, что Runx1
необходим для превращения Flk1+"клеток в
экспрессируется в «гемогенном эндотелии» и
CD41+"клетки крови. Если эмбрионы с нокау"
необходим для эндотелиально"гематопоэтичес"
том Flk1 не образуют ни крови, ни эндотелия и
кого перехода (ЭГП) [42]. Однако широко изве"
погибают на 8-9"й день эмбрионального разви"
стно, что и в желточном мешке, и в эмбрионах
тия мышей [33], то эмбрионы SCL-/- не образу"
почти все предшественники крови экспрессиру"
ют только клетки крови и умирают на 10"й день
ют VE"кадгерин на протяжении их развития
эмбрионального развития [37, 38]. Анализ транс"
(экспрессия начинается со стадии E8,5 и про"
криптома каждой отдельной клетки химерного
должается еще несколько дней после миграции
эмбриона (в котором присутствовали клетки ди"
в фетальную печень на 12"й день развития), что
кого типа и клетки SCL-/-) показал, что клетки
не позволяет однозначно сделать вывод о том,
с нокаутом (SCL-/-), в отличие от клеток дикого
на какой стадии развития произошла реактива"
типа, не развиваются в клетки крови, но форми"
ция Runx1 и восстановление гемопоэза [23, 35,
руют нормальный эндотелий [39]. Эти данные
48-52].
свидетельствуют о том, что Flk1 индуцирует
Один из самых ранних гемопоэтических
дифференцировку общего предшественника эн"
маркеров у мышей - это CD41 (GPII/ITGA2B),
дотелия и клеток крови, однако именно экспрес"
отвечающий за адгезию клетки к фибриногену.
сия SCL критически важна для развития крови
Присутствие CD41 на поверхности клетки
[39]. В целом, дифференцировка крови из МЛП
обычно свидетельствует о том, что эта клетка яв"
находится в динамическом балансе: если Flk1 и
ляется кроветворной даже в отсутствии других
SCL ускоряют это развитие, то TGFβ"сигналы
известных гемопоэтических маркеров, таких
играют блокирующую роль [32, 40]. Поэтому
как CD45 [23, 44, 35, 51-55]. Поверхностный
часто для направленной дифференцировки кро"
маркер CD41 экспрессируется на дефинитив"
ветворных предшественников на стадии перехо"
ных гемопоэтических клетках, которые уже
да из «мезодермальной» культуры в культуру
прошли ЭГП (рис. 2, а-е). Интересно, что реак"
клеток крови используют химические ингибито"
тивация Runx1 под промотором CD41"CRE
ры TGFβ"сигнального пути (например, SB431542,
привела к полному восстановлению гемопоэза,
Alk5i) [25, 41].
т.е. Runx1 необходим уже после ЭГП. Судя по
представленным в этой работе данным, Runx1-/-"
клетки крови останавливаются на стадии CD41low
КОНЦЕПЦИЯ ГЕМОГЕННОГО
и не способны преодолеть этот блок развития и
ЭНДОТЕЛИЯ
стать CD45+"циркулирующими клетками кро"
ви. Также среди этих клеток CD41low (Runx1-/-)
На сегодняшний день не вполне ясно, явля"
оказалось меньше апоптотических клеток, чем в
ется ли дефинитивный гемопоэз отдельно обра"
аналогичных клетках дикого типа. Это, возмож"
зующейся линией крови или продолжением
но, свидетельствует об условной «иммортализа"
примитивного гемопоэза [19, 21, 25, 27]. Так,
ции» CD41+"клеток при делеции Runx1. Задерж"
развитие клеток дефинитивной волны гемопоэза
ка клеток в иммортализованном состоянии на
связывают с гемогенным эндотелием (ГЭ). В хо"
стадии CD41+ и блок дальнейшего развития по"
де дифференцировки, по"видимому, в мезодер"
вышают риск вторичных мутаций, а значит, и
ме, формируется специальный вид пока не
вероятность канцерогенеза, что, возможно, объ"
идентифицированных эндотелиальных клеток,
ясняет присутствие мутаций Runx1 при детских
которые способны производить дефинитивные
лейкозах [56, 57]. В настоящий момент гемоген"
гематопоэтические клетки (рис. 1, а, г) [42, 43].
ный эндотелий определяют как промежуточную
Такие клетки, скорее всего, присутствуют в жел"
стадию между мезодермой и клетками крови.
точном мешке на 8"й день развития эмбриона
Также, возможно, ГЭ способен дифференциро"
БИОХИМИЯ том 84 вып. 3 2019
ИЕРАРХИЯ ЭМБРИОНАЛЬНОГО ГЕМОПОЭЗА
301
ваться как в клетки крови, так и в структурный
ГСК*НЕЗАВИСИМОЕ
эндотелий. Такие клетки были описаны при
КРОВЕТВОРЕНИЕ В ЭМБРИОНЕ
дифференцировке ЭСК и в ранних эмбриональ"
И ЭКСТРАЭМБРИОНАЛЬНЫХ ТКАНЯХ
ных клетках [44, 58]. В настоящий момент счи"
тается, что «гемогенный эндотелий» - это клет"
В развитии раннего эмбриона принято выде"
ки эндотелия с фенотипом Flk1+CD31+VE"кад"
лять три волны гемопоэза [19, 26, 60-64]. Как
герин+CD45-CD41-CD43-, возможно, cKit+SCL+.
обсуждалось выше, пока неизвестно, являются
Вероятно также, что гемогенный эндотелий спо"
ли эти волны независимыми или последова"
собен дифференцироваться напрямую в линию
тельно переходят одна в другую. Первая волна
предшественников ГСК [53, 59]. Однако ввиду
не дает вклад в кроветворение взрослого орга"
отсутствия прямых методов, позволяющих сор"
низма и лишь временно обеспечивает перенос
тировать клетки гемогенного эндотелия и вос"
кислорода примитивными эритроцитами, снаб"
производить процесс ЭГП в линию предшест"
жает тромбоцитами, а также осуществляет конт"
венников ГСК и в эндотелий in vitro, понятие
роль за развитием тканей эмбриона и первич"
«гемогенный эндотелий» остается гипотетичес"
ную иммунную защиту примитивными макро"
ким.
фагами. Вторая волна гемопоэза в желточном
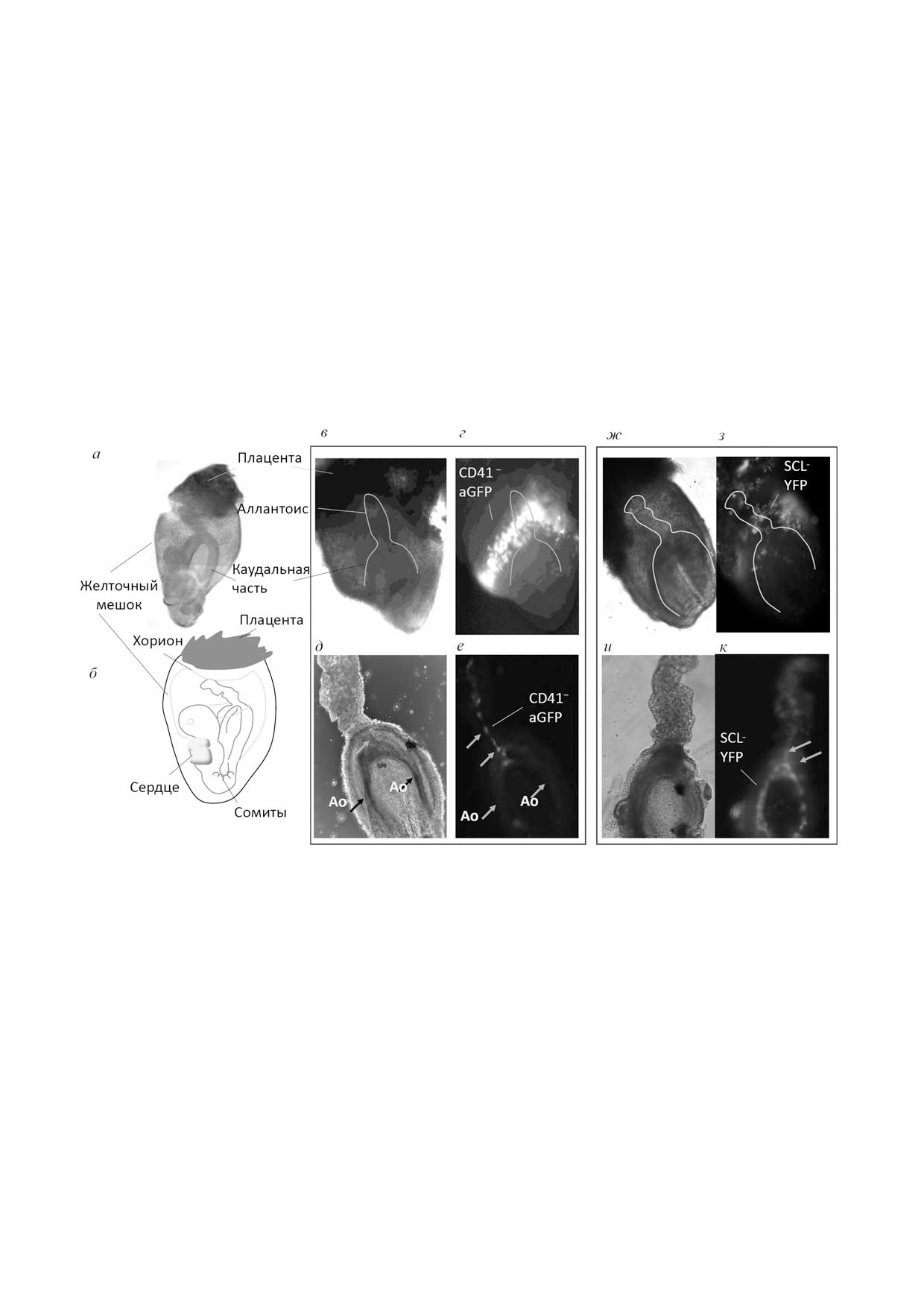
Рис. 2. Образование кроветворных клеток у эмбриона мыши. Мыши, содержащие ген CRE"рекомбиназы под CD41"про"
мотором, были скрещены с мышами, содержащими конструкцию с геном, кодирующим молчащий зеленый белок GFP,
под постоянно работающим промотором (мGFP). После начала экспрессии CD41 в ранних кроветворных клетках проис"
ходило LoxP/CRE"зависимое вырезание стоп"кассеты, что приводило к активации зеленого белка (аGFP) у этих клеток
и их потомков (CD41-aGFP; см. также [54]). а - Микрофотография фиксированного и осветленного эмбриона (Е8), видна
задняя (каудальная) часть эмбриона и аллантоис (для пояснения см. фотографию б); б - расположение эмбриона в жел"
точном мешке; в - фотография целого эмбриона внутри желточного мешка, 8"й день (до начала циркуляции); г - микро"
фотография, демонстрирующая флуоресценцию активированного зеленого белка CD41-аGFP в ранних кроветворных
клетках того же эмбриона (светлые клетки - пояс кровяных островков); в, г - белая линия указывает на расположение
каудальной части под желточным мешком; д - фотография каудальной части 8"дневного эмбриона; е - флуоресцентная
фотография CD41-aGFP"клеток. Стрелками показана локализация рекомбинировавших кроветворных клеток в районе
соединения парной дорзальной аорты (Ао) и сосуда аллантоиса; ж-к - 8"дневный эмбрион, экспрессирующий SCL"YFP"
репортер. Белым цветом и стрелками показаны клетки, экспрессирующие SCL в районе соединения аорты и сосудов ал"
лантоиса. На целом эмбрионе, находящемся в желточном мешке (ж), белой линией показано расположение каудальной
части, видна нервная бороздка; з - флуоресцентная фотография кроветворных клеток, экспрессирующих SCL"YFP в жел"
точном мешке в районе пояса кровяных островков. В каудальной части эмбриона мыши стрелки указывают на клетки,
экспрессирующие SCL"YFP"репортер в дорзальной аорте и аллантоисе. До начала циркуляции кроветворные клетки,
экспрессирующие SCL (SCL"YFP) и прошедшие стадию CD41 (CD41-aGFP), находятся в одном и том же районе у осно"
вания аллантоиса (е, к) и отдельно от клеток пояса кровяных островков (г, з)
БИОХИМИЯ том 84 вып. 3 2019
302
РЫБЦОВ, ЛАГАРЬКОВА
мешке также производит транзиторные клетки,
чительная часть этих клеток дает вклад во взрос"
служащие для нужд эмбриона. Однако некото"
лую популяцию Т" и В"клеток. Предшественники
рые клеточные популяции второй (дефинитив"
B1"клеток (AA4.1+CD19+B220-/lo) детектируются
ной) волны остаются в тканях эмбриона и даже
как в желточном мешке, так и в дорзальной аорте
продолжают служить во взрослом организме,
на 9"й день развития эмбриона мышей. Эти клет"
как предполагается, всю жизнь. Такие клетки
ки способны к репопуляции маргинальных зон
заменяются на клетки, происходящие из взрос"
лимфатических узлов и селезенки при транс"
лых ГСК, только в случае восстановления ткани
плантации в новорожденных мышей [73, 74].
после повреждения. Используемые в литературе
В 9"дневном желточном мешке были найдены
понятия «примитивный» и «дефинитивный» ге"
эритромиелоидные предшественики - ЭМП
мопоэз во многом условны и четко определены
(cKithighCD41+CD16/32+), способные развивать"
только для развития эритроцитов, т.к. их можно
ся в резидентные макрофаги и другие миелоид"
отличить по смене форм гемоглобина [19].
ные клетки. Часть ЭМП (Myb-) развивается в
Клетки крови, производящиеся до начала цир"
тканевые макрофаги мозга (клетки микроглии).
куляции, обычно рассматриваются как прими"
Другая часть ЭМП (Myb+) мигрирует в эмбрио"
тивные и относятся к клеткам первой волны [63].
нальную печень, проходя через стадию моноци"
На стадии Е8,25 (4-6 пар сомитов) в эмбрионе
тов, и развивается в резидентные макрофаги
мыши запускается сердцебиение, однако цирку"
внутри тканей эмбриона (клетки Купффера в
ляция крови начинается только через несколько
фетальной печени и клетки Лангерганса в пок"
часов, после окончательного формирования про"
ровных тканях) [75]. Эти клетки также могут
света сосудов [65]. Приблизительно в то же вре"
функционировать не только в эмбрионе, но и во
мя в желточном мешке появляется cKit+CD41+"
взрослом организме [76-78]. ЭМП производят
популяция клеток второй волны гемопоэза
тучные клетки (мастоциты), находящиеся в сое"
(рис. 1, д; рис. 2, г; рис. 3) [66]. Интересно, что од"
динительных тканях. Однако только в жировой
новременно с этим процессом, до начала серд"
ткани и серозной оболочке плевральных полос"
цебиения и циркуляции, в месте соединения со"
тей тучные клетки эмбрионального происхож"
судистых структур аллантоиса с парной дорзаль"
дения остаются на всю жизнь. В тканях слизис"
ной аортой эмбриона тоже появляются CD41+
тых оболочек они заменяются на клетки, проис"
клетки (рис. 2, е, стрелки), экспрессирующие cKit,
ходящие из ГСК [79, 80]. Тучные клетки кожных
VE"кадгерин, Flk1, Runx1 и SCL (см. репортер
покровов также имеют двойное происхождение.
SCL"YFP, рис. 2, к) [54]. Там же на стадии Е8,5
Часть из них происходит из взрослого костного
были обнаружены первые клетки, обладающие
мозга, а часть имеет эмбриональное происхож"
лимфоидным потенциалом (Tie2+RAG1-CD34lo/-
дение, причем вторые отличаются по экспрес"
Kit+CD41-) (рис. 3) [50]. Непонятно, дифферен"
сии генов и могут поддерживать свою популя"
цируются ли эти внутриэмбриональные клетки
цию независимо от ГСК [81]. Тем не менее зна"
в клетки"предшественники дефинитивных ГСК
чительность вклада отдельных кроветворных
(относящихся к третьей волне гемопоэза) или
клеток, происходящих из эмбриональных пред"
это отдельные популяции, служащие для нужд
шественников, и особенности их распределения
эмбриона и относящиеся ко второй дефинитив"
по тканям и органам позвоночных животных
ной волне гемопоэза. Прямые эксперименты с
требуют дальнейших исследований.
прослеживанием судьбы отдельных меченых
Данные, полученные в лаборатории профес"
клеток, возможно, смогут ответить на этот важ"
сора Йодера на моделях мышей с инактивацией
ный вопрос. Транзиторный гемопоэз у эмбрио"
гена Ncx1 (Ncx1-/-), показали отсутствие индук"
нов развивается с нарастанием сложности. Так,
ции сердцебиения и циркуляции крови (8"й день
у мышей на 9"й день в желточном мешке появ"
развития мышей). Такие эмбрионы умирают в
ляются лимфо"миелоидные предшественники
течение следующих 24-48 ч. Однако у них обна"
(ЛМПП), которые способны при транспланта"
ружили наличие ЭМП, в основном в желточном
ции в новорожденных мышей дифференциро"
мешке и в небольшом количестве в плаценте [82].
ваться в В" и Т"клетки, моноциты и гранулоциты
Примечательно, что в обоих местах ЭМП возни"
[35, 67-70]. В то же время в желточном мешке
кали автономно. Лишь небольшое количество
были фенотипически выявлены первые бипотент"
ЭМП было обнаружено внутри тела эмбриона.
ные лимфоидные предшественники (Lin-Kit+
Авторы предположили, что в норме появление
Rag1GFP+IL7Rα+/-), которые после миграции в
внутриэмбриональных клеток крови связано с
эмбриональную печень дифференцируются в
миграцией из желточного мешка через циркуля"
клетки"предшественники Т"клеток (Lin-Kit+
цию. С учетом факта, что внутриэмбриональ"
Flt3+IL7Rα+PIR+) и В"клеток (Lin-Kit+Flt3+
ный гемопоэз (клетки CD41+ и Runx1+) возни"
IL7Rα+PIR-) [71, 72]. Возможно, только незна"
кает in situ также до начала циркуляции крови и
БИОХИМИЯ том 84 вып. 3 2019
ИЕРАРХИЯ ЭМБРИОНАЛЬНОГО ГЕМОПОЭЗА
303
в месте соединения аллантоиса с дорзальной
влияние факторов, секретируемых экстраэмб"
аортой внутри эмбриона (рис. 2, е), и в основа"
риональными тканями (ткани желточного меш"
нии аллантоиса [50, 54, 58], можно предполо"
ка и плаценты), на развитие внутриэмбриональ"
жить, что формирование просвета сосудов и ме"
ных кроветворных предшественников.
ханический стресс от циркуляции крови явля"
Как было сказано выше, эмбриональный ге"
ются важными факторами для дальнейшего эф"
мопоэз развивается с нарастанием полипотент"
фективного развития внутриэмбрионального
ности. Так, клетки первой волны кроветворения
кроветворения [83, 84]. Нельзя также исключить
в основном являются уни" или бипотентными,
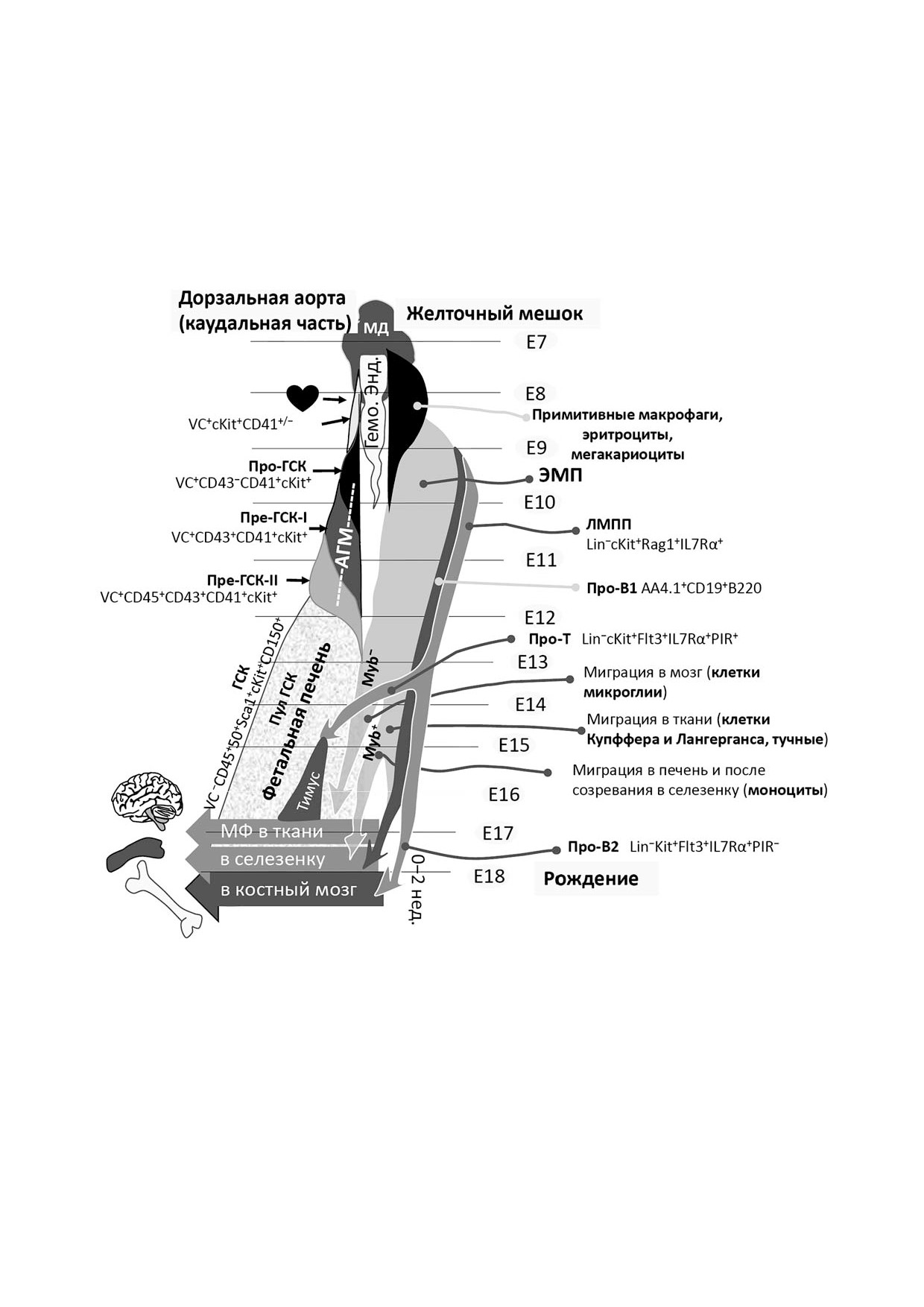
Рис. 3. Вклад эмбрионального гемопоэза в гемопоэтическую систему взрослого организма, клеточная динамика развития
гемопоэза (пояснения даны в тексте). Горизонтальными линиями показаны стадии развития эмбрионов, сроки миграций
и продолжительность существования тканей (на примере мыши). Посередине - последовательное развитие мезодермы
(МД) и гемогенного эндотелия; слева - развитие дефинитивных предшественников ГСК в тканях эмбриона. Гемопоэз в
теле эмбриона (слева сверху вниз) - обозначено появление у основания аллантоиса на 8"й день развития, до начала цир"
куляции крови, клеток сKit+VE"кадгерин+CD41+/- с лимфоидным и миелоидным потенциалами. Знаком сердца изобра"
жено начало сердцебиения. Показано последовательное развитие трех предшественников ГСК в АГМ"регионе в 9-11"й
дни эмбриогенеза. На 12"й день (слева) отмечена миграция в фетальную печень созревающих ГСК с последующим размно"
жением и миграцией всего пула ГСК в костный мозг. Также обозначено формирование пула ГСК в костном мозге между
16"м днем эмбрионального развития и в течение двух первых недель после рождения (слева внизу). Во внутриэмбриональ"
ном кроветворении (слева) отражена только линия ГСК. Желточный мешок (справа сверху вниз). Волны гемопоэза: при"
митивная (черный цвет) и дефинитивная, дающие вклад во взрослые ткани (серый цвет). Стрелками указано направле"
ние миграции различных дефинитивных популяций желточного мешка во взрослые ткани
БИОХИМИЯ том 84 вып. 3 2019
304
РЫБЦОВ, ЛАГАРЬКОВА
клетки второй волны, такие как ЛМПП, могут
день эмбрионального развития [88-90]. Учиты"
производить лимфоидные и миелоидные линии
вая, что на 9"й день развития эмбрионов уже по"
крови, и только для специального типа предшест"
являются первые Runx1+"предшественники
венников третьей волны гемопоэза (про"ГСК),
ГСК в дорзальной аорте, то, по"видимому, ини"
локализованных в районе дорзальной аорты на
циация развития взрослого пула ГСК происхо"
9"й день развития эмбриона мыши, была пока"
дит между 8"м и 9"м днями эмбрионального раз"
зана способность созревать в ГСК взрослого ти"
вития [53, 85]. Интересно, что начиная с 8"го
па, которые впоследствии формируют резерв"
дня, реактивированные клетки, меченные зеле"
ный пул стволовых клеток крови в костном моз"
ным белком под промотором Runx1, не образо"
ге взрослых млекопитающих (рис. 3) [35, 53, 85].
вывали эндотелий сосудов, что ясно свидетель"
ствует о раннем размежевании клеток крови от
предшественников структурного эндотелия [88].
ДИФФЕРЕНЦИРОВКА ГСК
Активация GFP под гемопоэтическим промото"
В ОНТОГЕНЕЗЕ de novo
ром (CD41"CRE) позволила проследить появле"
ние кроветворных клеток с самого раннего этапа
Стволовые клетки взрослого организма под"
развития. Оказалось, что первые CD41-GFP+"
держивают свой пул в результате редкого сим"
клетки появляются на 8"й день в районе соеди"
метричного деления (самоподдержания) для
нения парной дорзальной аорты (Ао) с цепью
компенсации физиологических процессов ге"
эндотелиальных клеток в аллантоисе до начала
мопоэтической системы [86]. ГСК также входят
сердцебиения и, значит, до начала миграции
в клеточный цикл при кровопотерях и повреж"
клеток крови через циркуляцию (рис. 2, е,
дениях. Однако образование ГСК de novo проис"
стрелки). Нужно отметить, что этот процесс
ходит только в результате эмбрионального раз"
происходит независимо от появления в 7"й и 8"й
вития. Поэтому единственным источником зна"
дни GFP+"клеток в районе пояса кровяных ост"
ний, позволяющим понять механизмы процесса
ровков в желточном мешке (рис. 2, г, з) [54]. Ин"
возникновения ГСК, остается изучение эмбри"
тересно, что клетки как внутри эмбриона, так и
онального развития гемопоэтической системы.
в поясе кровяных островков в желточном мешке
Предшественники ГСК относятся к третьей, де"
также экспрессируют SCL (рис. 2, ж-к). Это,
финитивной волне эмбрионального гемопоэза,
возможно, говорит о длительности процесса
однако до сих пор непонятно, специализируют"
первичного кроветворения. Дальнейшие иссле"
ся ли предшественники ГСК отдельно от обще"
дования показали, что меченые GFP+"клетки
го эмбрионального гемопоэза в районе ранней
под промотором CD41 из E11 АГМ"региона яв"
дорзальной аорты из гипотетического гемоген"
ляются предшественниками ГСК и могут произ"
ного эндотелия (E8-10) или напрямую из мезо"
водить полностью функциональные ГСК ex vivo.
дермы. Также возможно, что предшественники
Напротив, клетки из желточного мешка не спо"
ГСК являются естественным продолжением не"
собны образовывать ГСК [54]. Аналогичные ре"
ких кроветворных клеток эмбриона, дифферен"
зультаты были получены на клетках дикого ти"
цировавшихся в раннем гемопоэзе (E7, Е8) [60,
па. Показано, что на 9"й и 10"й дни развития
87]. Образование предшественников ГСК также
дорзальной аорты АГМ"регион после культиви"
связано с транскрипционным фактором Runx1
рования способен произвести ГСК, а клетки из
[55]. Первые клетки, экспрессирующие гемато"
желточного мешка или плаценты в это же время
поэтический транскрипционный фактор Runx1,
не обладают таким потенциалом [53, 85, 91, 92].
появляются одновременно в основании аллан"
Эти данные с высокой вероятностью свиде"
тоиса и в желточном мешке [58]. Как было ска"
тельствуют о раннем размежевании клеток"
зано выше, эмбрионы Runx1-/- не способны
предшественников крови и эндотелиальных
производить ГСК. Однако остается непонят"
клеток, а также о независимом происхождении
ным, на какой стадии развития Runx1 необхо"
предшественников ГСК внутри эмбриона, от"
дим для спецификации предшественников
дельно от гемопоэза желточного мешка.
ГСК. Индуцированная реактивация Runx1 c ме"
чением кроветворных клеток показала, что ге"
мопоэз со значительным вкладом во взрослое
РАЗВИТИЕ ПРЕДШЕСТВЕННИКОВ ГСК
кроветворение может быть восстановлен. При"
В РАННЕМ ЭМБРИОНЕ: КЛЕТОЧНАЯ
мечательно, что участие в образовании взрослых
ДИНАМИКА И МИГРАЦИЯ
клеток крови прогрессивно нарастало, если ре"
активацию Runx1 вызывали, начиная c 7"го по
ГСК взрослого типа способны к репопуля"
9"й день развития эмбриона мыши, и резко сни"
ции кроветворной системы взрослых мышей и
жалось только в случае реактивации на 10"й
образуют все линии гемопоэза. Для проверки
БИОХИМИЯ том 84 вып. 3 2019
ИЕРАРХИЯ ЭМБРИОНАЛЬНОГО ГЕМОПОЭЗА
305
этих свойств ГСК человека используют NSG"
В то же время количество ГСК взрослого типа
мышей, у которых отсутствуют лимфоциты, от"
последовательно нарастает в плаценте и затем в
вечающие за адаптивный иммунный ответ, а так"
фетальной печени, что свидетельствует о быст"
же часть врожденного иммунитета (НК"клетки)
рой миграции и созревании в течение последую"
[18, 93]. Однако незрелые эмбриональные пред"
щих 12-24 ч эмбрионального развития [85,
шественники ГСК не способны к восстановле"
97-99]. Для эмбрионального материала челове"
нию кроветворения у облученных мышей [17].
ка (ЭЧМ) не разработано эффективных методик
Эти клетки становятся ГСК взрослого типа
дозревания предшественников ГСК ex vivo, так
только после дозревания ex vivo или трансплан"
же как и не показано их созревание в фетальной
тации в кровяное русло новорожденных мышей,
печени новорожденных NSG"мышей. Однако,
у которых фетальная печень еще некоторое вре"
исходя из оценки набора CD-"фенотипов клеток
мя после рождения способна поддерживать за"
в ЭЧМ и при дифференцировке ЭСК in vitro, было
селение и созревание предшественников ГСК.
показано присутствие VE"кадгерин+CD43+CD45-"
Однако процесс хоуминга (возвращения в ни"
клеток, похожих на таковые у мышей и дающих
шу) и дозревания у новорожденных мышей не"
начало клоногенным предшественникам CD45+
достаточно эффективен [61, 85, 94]. Именно
[18, 26, 100-104]. Первые ГСК появляются в
дозревание ex vivo используют для анализа кле"
ЭЧМ в регионе CS13 (32 д.п.ф) дорзальной аор"
точных популяций, способных к производству
ты (VE"кадгерин+CD43+CD45+). Эти ГСК обла"
ГСК взрослого типа. Так, только после дозрева"
дают экстраординарным пролиферативным по"
ния эксплантатов E10 АГМ"региона мышей (не
тенциалом и способностью к репопуляции: так,
содержащего ГСК) были получены полностью
одна ГСК, трансплантированная в NSG"мышь"
функциональные ГСК взрослого типа [17]. Ав"
реципиента, дает более 600 ГСК через пять ме"
торы сделали вывод о производстве ГСК de novo
сяцев после трансплантации [100, 101, 104].
внутри АГМ"региона из неизвестных предшест"
Изучение точного фенотипа предшествен"
венников. В дальнейшем определение набора
ников ГСК позволяет прослеживать их развитие
поверхностных маркеров предшественников
во время эмбриогенеза без дорогостоящих экс"
ГСК позволило выстроить их иерархию (после"
периментальных трансплантаций, а также осу"
довательность развития) и определить количе"
ществлять мониторинг развития ГСК во время
ство на каждой стадии до миграции в фетальную
разработки протоколов для получения ГСК in
печень. Так, с использованием дозревания с
vitro при направленной дифференцировке ПСК.
последующей прямой трансплантацией или, в дру"
В ходе эмбрионального развития предшест"
гих экспериментах, только прямой трансплан"
венники ГСК вступают в периоды деления и по"
тации в новорожденных мышей был выявлен
шаговой дифференцировки. Так, было показа"
фенотип предшественников ГСК [35, 48, 53, 54,
но, что про"ГСК делятся медленно и находятся
67, 69, 95, 96]. Первый известный на сегодняш"
в фазе G1/G0 клеточного цикла, в то время как
ний день предшественник ГСК - про"ГСК
большинство пре"ГСК I типа на 10"й день эмб"
(Lin-VЕ"кадгерин+cKit+CD41+CD43-) - впер"
риогенеза мыши пролиферируют (фаза S/G2/M).
вые детектируется на 9"й день в дорзальной аор"
Далее на 11"й день, дифференцируясь в пре"ГСК
те между сердцем и выходом аорты в сторону
II типа, они продолжают активную пролифера"
желточного мешка; пре"ГСК I типа (Lin-VЕ"
цию, причем небольшая часть пре"ГСК I типа
кадгерин+cKit+CD41+CD43+) появляются на 10"й
остается недифференцированной, и их проли"
день эмбрионального развития, и число таких
ферация снижается. После переселения в фе"
клеток нарастает от 3-5 до 30-40 клеток за 24 ч.
тальную печень ГСК взрослого типа постепенно
Далее пре"ГСК I типа, увеличивая экспрессию
сокращают скорость деления, пока не мигриру"
маркера CD45, дифференцируются в пре"ГСК
ют в костный мозг, оставаясь там всю жизнь
II типа (Lin-VЕ"кадгерин+cKit+CD41+CD43+CD45+;
[105]. Взрослые ГСК переходят в состояние по"
Lin (lineage) - это термин, означающий отсут"
коя и размножаются медленно (1 раз в 145 дней
ствие целого ряда специфических маркеров спе"
или ~5 раз в течение жизни мышей) [86]. Посте"
циализированных клеток крови: CD3, CD4, Gr1,
пенно они заполняют все ниши костного мозга,
B220, Ter119) (рис. 3). Общее количество пред"
редко мигрируя через кровяное русло в освобо"
шественников ГСК на 11"й день в АГМ"регионе
дившуюся новую нишу. Так, в среднем у мышей
нарастает за счет дифференцировки пре"ГСК I
во всей крови присутствует как минимум одна
типа, а также собственного размножения пре"ГСК
ГСК, циркулирующая в течение нескольких се"
II типа. Число пре"ГСК достигает ~65 клеток к
кунд до того, как она начинает «роллинг» (ин"
середине 11"го дня и затем резко снижается. Та"
тегрин"зависимый процесс замедляющегося пе"
ким образом, через 24 ч в Е12 АГМ"регионе мож"
рекатывания вдоль эндотелия сосудов с потоком
но детектировать только 5-10 пре"ГСК II типа.
крови), адгезию и проползание через стенки со"
2 БИОХИМИЯ том 84 вып. 3 2019
306
РЫБЦОВ, ЛАГАРЬКОВА
судов в новую нишу [106] (под нишей понимает"
ГСК. Немного позднее (Е11, АГМ) образуются
ся совокупность клеток, межклеточных взаимо"
первые ГСК, которые могут дифференциро"
действий, внеклеточного матрикса, сигналов и
ваться во все типы клеток кроветворной систе"
факторов в гемопоэтических органах, поддер"
мы взрослого организма [16-18, 48, 53, 54, 108,
живающих дифференцировку, гомеостаз, миг"
117]. Интересно, что даже отдельные стромаль"
рацию и/или покой пула ГСК). Изучение меха"
ные клетки, выделенные из АГМ"региона, мо"
низмов мобилизации ГСК из ниши, их мигра"
гут поддерживать кроветворение [118-122]. Од"
ции и «хоуминга» является исключительно важ"
нако только отдельные факторы, секретируемые
ным для медицинских исследований в области
в АГМ, участвуют в размножении ГСК и их
опухолевого метастазирования и патологий ге"
предшественников. Например, даже слабая экс"
мопоэза.
прессия IL"3 в АГМ"регионе Е11 оказывает зна"
чительное влияние на размножение поздних
предшественников (пре"ГСК II типа) [48, 54, 91,
УЧАСТИЕ КЛЕТОК НИШИ
108, 123]. Делеция IL"3 у мышей приводит к не"
В РАЗВИТИИ И ПОДДЕРЖАНИИ ГСК
большому снижению количества ГСК в АГМ"
регионе, возможно, в связи с ожидаемой взаи"
Можно условно выделить три типа ниш, в ко"
мозаменяемостью некоторых интерлейкинов
торых происходит развитие ГСК в эмбриогене"
[123]. Однако в отсутствие SCF (KitL) происхо"
зе. Первый тип ниши отвечает за de novo диффе"
дит драматическое снижение количества ГСК в
ренцировку предшественников ГСК и их пер"
фетальной печени [124]. Показано, что SCF не"
вичное размножение [85, 105, 107]. Первый тип
обходим для ранней дифференцировки про"
ниши локализован в вентральной части дорзаль"
ГСК и размножения пре"ГСК I типа [53, 109].
ной аорты ориентировочно между 8"м и 10"м дня"
Разрезание дорзальной аорты на части и проверка
ми эмбрионального развития мышей [53, 107-109]
способности этих частей производить ГСК по"
и у человека на стадии CS12-17 (26-47 д.п.ф.) в
казали, что именно в вентральной ее части со"
АГМ"регионе [104, 110]. Второй тип ниши ГСК
держатся ГСК и их предшественники у эмбриона
в ходе эмбрионального развития формируется в
мыши [108, 109] и человека [104]. Секреция клет"
фетальной печени на 12-16"й дни развития мы"
ками вентральной части аорты на 9"й и 10"й дни
шей и отвечает за дальнейшее размножение пол"
эмбрионального развития как SCF, так и инги"
ностью функциональных ГСК [111]. Третий тип
биторов сигнального пути BMP4 (Noggin, Chor"
ниши в костном мозге позвоночных эволюцион"
din, BMPER) оказалась также необходимой для
но образовался в связи с выходом животных на
развития и размножения предшественников
сушу, по"видимому, для защиты от повреждаю"
ГСК на самой ранней стадии [53, 85, 107, 109].
щего излучения (жесткого ультрафиолета) и от
Продемонстрировано, что для дифференциров"
механических повреждений, связанных с грави"
ки предшественников ГСК необходимо сниже"
тацией [112]. Гипоксия во взрослой костномоз"
ние Notch"сигналов в вентральных нишах 10"днев"
говой нише также, вероятно, служит для защиты
ной аорты [125]. Более того, в этот момент фак"
от кислородного стресса, с которым встретились
торы, секретируемые дорзальной частью (SHH,
позвоночные при выходе на сушу [113-115]. Ниша
VEGF), также важны для размножения и разви"
костного мозга служит для защиты ГСК от пов"
тия предшественников ГСК [109]. В вентраль"
реждений, содержания в «спящем» состоянии,
ной части АГМ"региона расположены клетки
тонкой регуляции миграции, их дифференци"
симпатической нервной системы, производящие
ровки в клетки крови и медленного размноже"
катехоламины, в синтезе которых в клетках ни"
ния в случае их расходования [116].
ши участвует GATA3. Добавление в культуру α"
В данном обзоре подробно рассматриваются
и β"адреногенных агонистов (катехоламинов)
эмбриональные ниши, которые способствуют
позволяло поддержать дифференцировку ГСК да"
образованию и первичному размножению ГСК.
же при дефекте гена Gata3 в АГМ"регионе [126].
По нашему убеждению, эти знания наиболее
После накопления пула предшественников
важны для разработки биотехнологических про"
ГСК в АГМ на 11"й день развития эмбриона мы"
цессов получения и размножения ГСК in vitro.
ши начинается процесс миграции в фетальную
Также в обзоре не обсуждаются ниши желточно"
печень. Этот процесс, по"видимому, зависит от
го мешка, т.к. не было показано, что они под"
секреции лейкотриена (leukotriene"B4) и интегри"
держивают дифференцировку и экспансию пред"
нов (α4β1, α4β7) [127-131].
шественников ГСК [26, 60].
Эмбриональная миграция не исследована в
Как уже было сказано выше, в дорзальной
достаточной мере, в отличие от взрослого орга"
аорте АГМ"региона (E9) детектируются первые
низма, для которого известно, что мобилизация
предшественники, способные к созреванию в
производится путем прерывания взаимодей"
БИОХИМИЯ том 84 вып. 3 2019
ИЕРАРХИЯ ЭМБРИОНАЛЬНОГО ГЕМОПОЭЗА
307
ствия ГСК с молекулами, представленными в
регуляции дифференцировки в физиологичес"
нише. В современной терапии пролифератив"
ких условиях, а также в случае повреждений.
ных заболеваний принято использовать моби"
Выделяют два типа ниш - сосудистые и остео"
лизованные с помощью Г"КСФ (гранулоцитар"
бластные [140]. Циркуляция крови через капил"
ного колониестимулирующего фактора) ГСК
ляры и синусы поддерживает гомеостаз ГСК и
донора или собственные ГСК пациента. Их за"
ниш. Наибольшее количество ГСК локализова"
пасают, мобилизуя ГСК в циркуляцию из ниши,
но в красном костном мозге губчатых костей и
с последующим их отбором из периферической
эпифизов конечностей. Однако затруднительно
крови. Г"КСФ активирует нейтрофилы, кото"
четко разделить сосудистые синусы и остеобласт"
рые, в свою очередь, выделяют протеазы, разру"
ную нишу, которые расположены в непосред"
шающие межклеточные контакты ГСК и клеток
ственной близости друг от друга. Современные
ниши. Для мобилизации также используются
представления о взрослой нише для ГСК связа"
блокаторы молекул, отвечающих за взаимодей"
ны с несколькими типами клеток, тесно ассоци"
ствие ГСК с клетками ниши, такие как ингибитор
ированных друг с другом. Они включают в себя
CXCR4 (AMD3100) и блокатор VLA4"VCAM1"
эндотелиальные клетки CD31+ и/или VE"кадге"
зависимой адгезии (BIO4860) [132]. Роль Г"КСФ
рин+, перициты нестин+NG2+, периваскулярные
и данных ингибиторов в миграции из эмбрио"
стромальные клетки CD146+Sca1-LepR+, несу"
нальных ниш не изучалась. Исследование миг"
щие на поверхности мембраносвязанный SCF,
рации ГСК из ранней эмбриональной ниши
CXCL12 и VCAM1 [124, 141]. Эти клетки, извест"
(АГМ) в фетальную печень приведет к более
ные также как CAR"клетки (CXCL12"abundant
глубокому пониманию этого процесса и, без
reticular), являются бипотентными предшест"
сомнения, внесет значительный вклад в пони"
венниками остеобластов и адипоцитов [142].
мание механизмов патологий кроветворной
По"видимому, макрофаги могут индуциро"
системы [132].
вать дифференцировку ГСК в одну или другую
До сих пор остается невыясненным, где
линию клеток крови.
окончательно созревают клетки ГСК в ходе эмб"
Скорее всего, весь процесс покоя, размно"
рионального развития. Так, на 11"й день в АГМ"
жения, миграции и дифференцировки ГСК ре"
регионе содержится
~60 предшественников
гулируется нервной системой. В частности, эти
ГСК и лишь одна ГСК взрослого типа. Однако
процессы управляются через секрецию катехо"
уже на следующий день появляется заметное ко"
ламинов (дофамина, адреналина и норадрена"
личество ГСК в циркуляции, в плаценте и затем
лина), которые производятся симпатической
в фетальной печени обнаруживается 50-100 ГСК
нервной системой в ответ на световой цикл или
[85, 133, 134]. По"видимому, предшественники,
стресс [143-146]. Показано, что шванновские
начиная миграцию с током крови, задержива"
клетки, секретируя TGFβ в ответ на специфи"
ются в экстраэмбриональных сосудах, лабирин"
ческие нервные импульсы, также способны
тах плаценты и созревают во время продвиже"
напрямую регулировать деление ГСК. Наруше"
ния к фетальной печени. Предполагается, что
ние нормального метаболизма этих факторов
лабиринты сосудов плаценты являются проме"
влияет на старение клеток ниши и расход пула
жуточной нишей на пути к месту размножения
ГСК [147].
ГСК в фетальной печени. Далее, располагаясь в
Дальнейшее изучение роли клеток ниши в
районе крупных сосудов фетальной печени в не"
образовании ГСК de novo, их размножении, ре"
посредственной близости от нестин+NG2+"пе"
гуляции покоя, мобилизации, хоуминга и само"
рицитов, ГСК получают как циркулирующие
обновления позволит найти подходы к реше"
факторы роста, так и факторы от стромальных
нию научных и медицинских проблем, связан"
клеток [135]. В соответствии с этим наблюдени"
ных с пролиферативными заболеваниями кро"
ем было показано, что SCF+DLK+"предшест"
ви, и поможет выявить значение белковых фак"
венники клеток печени и клетки эндотелия так"
торов ниши в регенерации ГСК, а также в старе"
же составляют нишу для ГСК [111, 136]. Даль"
нии кроветворной и иммунной систем человека.
нейшие исследования клеток ниши в фетальной
печени выявили ряд факторов (IGF"2, AТА4,
Данный обзор литературы представляется
VEGF, ANGPTL3, ANGPTL5, IGFBP2 и др.),
полезным для понимания особенностей разви"
значительно ускоряющих размножение как ГСК
тия гемопоэза в раннем эмбриогенезе млекопи"
мыши, так и ГСК из пуповинной крови челове"
тающих. В обзоре акцентировано внимание на
ка in vitro [137-139].
различиях в развитии примитивного, транзи"
Ниши третьего типа расположены во взрос"
торного кроветворения эмбриона (происходя"
лом костном мозге, и их функции заключаются
щего в желточном мешке) и гемопоэза, направ"
в поддержании пула ГСК в «спящем» режиме и
ленного на формирование зачатка кроветвор"
БИОХИМИЯ том 84 вып. 3 2019
2*
308
РЫБЦОВ, ЛАГАРЬКОВА
ной системы взрослого организма. Для этого
гомеостаза. Дальнейшее изучение процесса
описано многообразие путей кроветворения в
дифференцировки ГСК de novo, возможно, поз"
эмбрионе и проанализированы три волны гемо"
волит приблизиться к разработке методов реге"
поэза - примитивная, дефинитивная и волна
нерации гемопоэтической системы взрослого
предшественников ГСК, дающих основной
организма для восстановления после инфекци"
вклад в формирование пула ГСК во взрослом
онных, токсических или лучевых повреждений,
костном мозге.
а также для коррекции возрастных изменений.
При описании второй дефинитивной волны
Сравнение этапов развития ГСК с лейкемичес"
кроветворения, происходящей преимуществен"
кими стволовыми клетками дает возможность
но в желточном мешке, уделено внимание тран"
лучше понять основы канцерогенеза педиатри"
зиторному кроветворению и образованию кле"
ческих пролиферативных заболеваний.
ток"предшественников, участвующих в образо"
вании тканевых макрофагов нервных, соедини"
тельных и покровных тканей взрослого организ"
Финансирование
ма. Точная идентификация кроветворных кле"
ток эмбриона позволяет понять, как можно
Работа выполнена при поддержке РНФ
прослеживать развитие линий клеток крови в
(грант № 14"15"00930; Лагарькова М.А.).
ходе направленной дифференцировки ГСК из
ПСК. Определение регулирования клеточных
Благодарности
процессов происхождения и размножения пред"
шественников ГСК дает основу для исследова"
Авторы выражают искреннюю благодар"
ний пролиферативных заболеваний крови и раз"
ность профессору Нине Иосифовне Дризе за
работки биотехнологических методик по увели"
ценные замечания и советы, данные при подго"
чению количества ГСК в донорских образцах,
товке обзора, и Наталье Рыбцовой за помощь в
используемых для трансплантаций. Описание
оформлении.
происхождения, циклов развития, ниш для
размножения, покоя, миграции позволяет выде"
Конфликт интересов
лить специфические клеточные компоненты и
их белковые факторы, участвующие в образова"
Авторы заявляют об отсутствии конфликта
нии ГСК de novo, экспансии и поддержании их интересов.
СПИСОК ЛИТЕРАТУРЫ
1.
Чертков И.Л., Гуревич О.А. (1984) Стволовая кровет
9. Maksimov, A. (1909) Der Lymphozyt als gemeinsame Stam"
ворная клетка и ее микроокружение, Медицина, Моск"
mzelle der verschiedenen Blutelemente in der embryonalen
ва, 238 c.
Entwicklung und im postfetalen Leben der Saugetiere,
2.
Чертков И.Л., Фриденштейн А.Я. (1977) Клеточные
Folia Haematologica, Leipzig, Klinghardt, 8, 125-134.
основы кроветворения (кроветворные клетки предшест
10. Максимов А. (2009) Лимфоцит как общая стволовая
венники), Медицина, Москва, 272 c.
клетка различных элементов крови в эмбриональном
3.
Воробьев А.И., Бриллиант М.Д., Чертков И.Л. (1981)
развитии и постфетальной жизни млекопитающих,
Современная схема кроветворения и возможные ми"
Клеточная терапия и трансплантация, 1, 3, doi: 10.3205/
шени гемобластозов, Тер. архив, 53, 9, 3-14.
ctt"2009"en"000032.02.
4.
Majeti, R., Park, C.Y., and Weissman, I.L.
(2007)
11. Деев Р.В. (2005) Научное наследие Александра Макси"
Identification of a hierarchy of multipotent hematopoietic
мова и современность, Клеточная трансплантология и
progenitors in human cord blood, Cell Stem Cell, 1, 6,
тканевая инженерия, 1, 4-11.
635-645, doi: 10.1016/j.stem.2007.10.001.
12. Siminovitch, L., McCulloch, E.A., and Till, J.E. (1963)
5.
Воробьев А.И., Дризе Н.И., Чертков И.Л. (2006) Схе"
The distribution of colony"forming cells among spleen
ма кроветворения: 2005, Тер. архив, 7, 5-12.
colonies, J. Cell Comp. Physiol., 62, 327-336.
6.
Луговская С.А., Почтарь М.Е. (2011) Гематологичес
13. Becker, A.J., McCulloch, E.A., and Till, J.E.
(1963)
кий атлас, 3"е издание, Москва-Тверь, Триада, 368 c.
Cytological demonstration of the clonal nature of spleen
7.
Yamamoto, R., Morita, Y., Ooehara, J., Hamanaka, S.,
colonies derived from transplanted mouse marrow cells,
Onodera, M., Rudolph, K.L., Ema, H., and Nakauchi, H.
Nature, 197, 452-454.
(2013) Clonal analysis unveils self"renewing lineage"
14. Dieterlen"Lievre, F. (1975) On the origin of haemopoietic
restricted progenitors generated directly from hematopoietic
stem cells in the avian embryo: an experimental approach,
stem cells, Cell, 154, 1112-1126, doi: 10.1016/j.cell.2013.08.007.
J. Embryol. Exp. Morphol., 33, 607-619.
8.
Notta, F., Zandi, S., Takayama, N., Dobson, S., Gan, O.I.,
15. Medvinsky, A.L., Samoylina, N.L., Muller, A.M., and
Wilson, G., Kaufmann, K.B., McLeod, J., Laurenti, E.,
Dzierzak, E.A. (1993) An early pre"liver intraembryonic
Dunant, C.F., McPherson, J.D., Stein, L.D., Dror, Y., and
source of CFU"S in the developing mouse, Nature, 364,
Dick, J.E. (2016) Distinct routes of lineage development
64-67, doi: 10.1038/364064a0.
reshape the human blood hierarchy across ontogeny,
16. Muller, A.M., Medvinsky, A., Strouboulis, J., Grosveld, F.,
Science, 351, aab2116, doi: 10.1126/science.aab2116.
and Dzierzak, E. (1994) Development of hematopoietic
БИОХИМИЯ том 84 вып. 3 2019
ИЕРАРХИЯ ЭМБРИОНАЛЬНОГО ГЕМОПОЭЗА
309
stem cell activity in the mouse embryo, Immunity, 1,
tions, Exp. Hematol., 33, 1041-1047, doi: 10.1016/
291-301.
j.exphem.2005.06.006.
17.
Medvinsky, A., and Dzierzak, E. (1996) Definitive
35.
Ferkowicz, M.J., Starr, M., Xie, X., Li, W., Johnson, S.A.,
hematopoiesis is autonomously initiated by the AGM
Shelley, W.C., Morrison, P.R., and Yoder, M.C. (2003)
region, Cell, 86, 897-906.
CD41 expression defines the onset of primitive and defini"
18.
Ivanovs, A., Rybtsov, S., Welch, L., Anderson, R.A.,
tive hematopoiesis in the murine embryo, Development,
Turner, M.L., and Medvinsky, A. (2011) Highly potent
130, 4393-4403.
human hematopoietic stem cells first emerge in the
36.
Padron"Barthe, L., Temino, S., Villa del Campo, C.,
intraembryonic aorta"gonad"mesonephros region, J. Exp.
Carramolino, L., Isern, J., and Torres, M. (2014) Clonal
Med., 208, 2417-2427, doi: 10.1084/jem.20111688.
analysis identifies hemogenic endothelium as the source of
19.
Baron, M.H. (2013) Concise review: early embryonic ery"
the blood"endothelial common lineage in the mouse embryo,
thropoiesis: not so primitive after all, Stem Cells, 31,
Blood, 124, 2523-2532, doi: 10.1182/blood"2013"12"545939.
849-856, doi: 10.1002/stem.1342.
37.
Shivdasani, R.A., Mayer, E.L,, and Orkin, S.H. (1995)
20.
Zhang, H., and Reilly, M.P. (2017) Human induced
Absence of blood formation in mice lacking the T"cell
pluripotent stem cell"derived macrophages for unraveling
leukaemia oncoprotein tal"1/SCL, Nature, 373, 432-434,
human macrophage biology, Arterioscler. Thromb. Vasc.
doi: 10.1038/373432a0.
Biol., 37, 2000-2006, doi: 10.1161/atvbaha.117.309195.
38.
Robb, L., Lyons, I., Li, R., Hartley, L., Kontgen, F.,
21.
Yamane, T. (2018) Mouse yolk sac hematopoiesis, Front.
Harvey, R.P., Metcalf, D., and Begley, C.G.
(1995)
Cell Dev. Biol., 6, 80, doi: 10.3389/fcell.2018.00080.
Absence of yolk sac hematopoiesis from mice with a targe"
22.
Antonchuk, J., Sauvageau, G., and Humphries, R.K.
ted disruption of the scl gene, Proc. Natl. Acad. Sci. USA,
(2002) HOXB4"induced expansion of adult hematopoietic
92, 7075-7079.
stem cells ex vivo, Cell, 109, 39-45.
39.
Scialdone, A., Tanaka, Y., Jawaid, W., Moignard, V.,
23.
McKinney"Freeman, S.L., Naveiras, O., Yates, F., Loewer, S.,
Wilson, N.K., Macaulay, I.C., Marioni, J.C., and
Philitas, M., Curran, M., Park, P.J., and Daley, G.Q. (2009)
Gottgens, B. (2016) Resolving early mesoderm diversifica"
Surface antigen phenotypes of hematopoietic stem cells
tion through single"cell expression profiling, Nature, 535,
from embryos and murine embryonic stem cells, Blood,
289-293, doi:10.1038/nature18633.
114, 268-278, doi: 10.1182/blood"2008"12"193888.
40.
Ng, E.S., Azzola, L., Bruveris, F.F., Calvanese, V.,
24.
Kyba, M., Perlingeiro, R.C., and Daley, G.Q. (2002)
Phipson, B., Vlahos, K., Hirst, C., Jokubaitis, V.J., Yu, Q.C.,
HoxB4 confers definitive lymphoid"myeloid engraftment
Maksimovic, J., Liebscher, S., Januar, V., Zhang, Z.,
potential on embryonic stem cell and yolk sac hematopoietic
Williams, B., Conscience, A., Durnall, J., Jackson, S.,
progenitors, Cell, 109, 29-37.
Costa, M., Elliott, D., Haylock, D.N., Nilsson, S.K.,
25.
Blaser, B.W., and Zon, L.I. (2018) Making HSCs in vitro:
Saffery, R., Schenke"Layland, K., Oshlack, A., Mikkola, H.K.,
don’t forget the hemogenic endothelium, Blood, 132,
Stanley, E.G., and Elefanty, A.G. (2016) Differentiation of
1372-1378, doi: 10.1182/blood"2018"04"784140.
human embryonic stem cells to HOXA+ hemogenic vascu"
26.
Ivanovs, A., Rybtsov, S., Ng, E.S., Stanley, E.G., Elefanty, A.G.,
lature that resembles the aorta"gonad"mesonephros, Nat.
and Medvinsky, A. (2017) Human haematopoietic stem cell
Biotechnol., 34, 1168-1179, doi: 10.1038/nbt.3702.
development: from the embryo to the dish, Development,
41.
Kennedy, M., Awong, G., Sturgeon, C.M., Ditadi, A.,
144, 2323-2337, doi: 10.1242/dev.134866.
LaMotte"Mohs, R., Zuniga"Pflucker, J.C., and Keller, G.
27.
Lugus, J.J., Park, C., Ma, Y.D., and Choi, K. (2009) Both
(2012) T lymphocyte potential marks the emergence of
primitive and definitive blood cells are derived from Flk"1+
definitive hematopoietic progenitors in human pluripotent
mesoderm, Blood, 113, 563-566, doi: 10.1182/blood"
stem cell differentiation cultures, Cell Rep., 2, 1722-1735,
2008"06"162750.
doi: 10.1016/j.celrep.2012.11.003.
28.
Nostro, M.C., Cheng, X., Keller, G.M., and Gadue, P.
42.
Gao, L., Tober, J., Gao, P., Chen, C., Zhu, Q., Tan, K.,
(2008) Wnt, activin, and BMP signaling regulate distinct
and Speck, N.A. (2018) RUNX1 and the endothelial origin
stages in the developmental pathway from embryonic stem
of blood, Exp. Hematol., 68, 2-9, doi: 10.1016/j.exphem.
cells to blood, Cell Stem Cell, 2, 60-71, doi: 10.1016/
2018.10.009.
j.stem.2007.10.011.
43.
Hirai, H., Ogawa, M., Suzuki, N., Yamamoto, M., Breier, G.,
29.
Ditadi, A., Sturgeon, C.M., and Keller, G. (2017) A view
Mazda, O., Imanishi, J., and Nishikawa, S.
(2003)
of human haematopoietic development from the Petri dish,
Hemogenic and nonhemogenic endothelium can be distin"
Nat. Rev. Mol. Cell Biol., 18, 56-67, doi: 10.1038/nrm.2016.127.
guished by the activity of fetal liver kinase (Flk)"1 promoter/
30.
Slukvin, I.I., and Kumar, A. (2018) The mesenchymoan"
enhancer during mouse embryogenesis, Blood, 101,
gioblast, mesodermal precursor for mesenchymal and
886-893, doi: 10.1182/blood"2002"02"0655.
endothelial cells, Cell Mol. Life Sci., doi: 10.1007/s00018"
44.
Eilken, H.M., Nishikawa, S., and Schroeder, T. (2009)
018"2871"3.
Continuous single"cell imaging of blood generation from
31.
Sakurai, H., Era, T., Jakt, L.M., Okada, M., Nakai, S., and
haemogenic endothelium, Nature, 457, 896-900, doi: 10.1038/
Nishikawa, S. (2006) In vitro modeling of paraxial and lateral
nature07760.
mesoderm differentiation reveals early reversibility, Stem
45.
Chen, M.J., Yokomizo, T., Zeigler, B.M., Dzierzak, E.,
Cells, 24, 575-586, doi: 10.1634/stemcells.2005"0256.
and Speck, N.A. (2009) Runx1 is required for the endothe"
32.
Park, C., Afrikanova, I., Chung, Y.S., Zhang, W.J.,
lial to haematopoietic cell transition but not thereafter,
Arentson, E., Fong, G.G., Rosendahl, A., and Choi, K.
Nature, 457, 887-891, doi: 10.1038/nature07619.
(2004) A hierarchical order of factors in the generation of
46.
Liakhovitskaia, A., Gribi, R., Stamateris, E., Villain, G.,
FLK1" and SCL"expressing hematopoietic and endothe"
Jaffredo, T., Wilkie, R., Gilchrist, D., Yang, J., Ure, J., and
lial progenitors from embryonic stem cells, Development,
Medvinsky, A. (2009) Restoration of Runx1 expression in
131, 2749-2762, doi: 10.1242/dev.01130.
the Tie2 cell compartment rescues definitive hematopoietic
33.
Shalaby, F., Ho, J., Stanford, W.L., Fischer, K.D., Schuh, A.C.,
stem cells and extends life of Runx1 knockout animals until
Schwartz, L., Bernstein, A., and Rossant, J. (1997) A re"
birth, Stem Cells, 27, 1616-1624, doi: 10.1002/stem.71.
quirement for Flk1 in primitive and definitive hema"
47.
Li, Z., Chen, M.J., Stacy, T., and Speck, N.A. (2006)
topoiesis and vasculogenesis, Cell, 89, 981-990.
Runx1 function in hematopoiesis is required in cells that
34.
Ferkowicz, M.J., and Yoder, M.C. (2005) Blood island for"
express Tek, Blood, 107, 106-110, doi: 10.1182/blood"
mation: longstanding observations and modern interpreta"
2005"05"1955.
БИОХИМИЯ том 84 вып. 3 2019
310
РЫБЦОВ, ЛАГАРЬКОВА
48.
Taoudi, S., Gonneau, C., Moore, K., Sheridan, J.M.,
Robin, C. (2015) Progressive maturation toward hemato"
Blackburn, C.C., Taylor, E., and Medvinsky, A. (2008)
poietic stem cells in the mouse embryo aorta, Blood, 125,
Extensive hematopoietic stem cell generation in the AGM
465-469, doi: 10.1182/blood"2014"07"588954.
region via maturation of VE"cadherin+CD45+ pre"defini"
62.
Baron, M.H., Isern, J., and Fraser, S.T. (2012) The embryo"
tive HSCs, Cell Stem Cell, 3, 99-108, doi: 10.1016/j.stem.
nic origins of erythropoiesis in mammals, Blood, 119,
2008.06.004.
4828-4837, doi: 10.1182/blood"2012"01"153486.
49.
Taoudi, S., Morrison, A.M., Inoue, H., Gribi, R., Ure, J.,
63.
Lacaud, G., and Kouskoff, V. (2017) Hemangioblast,
and Medvinsky, A. (2005) Progressive divergence of defini"
hemogenic endothelium, and primitive versus definitive
tive haematopoietic stem cells from the endothelial com"
hematopoiesis, Exp. Hematol., 49, 19-24, doi: 10.1016/
partment does not depend on contact with the foetal liver,
j.exphem.2016.12.009.
Development, 132, 4179-4191.
64.
Palis, J. (2016) Hematopoietic stem cell"independent
50.
Yokota, T., Huang, J., Tavian, M., Nagai, Y., Hirose, J.,
hematopoiesis: emergence of erythroid, megakaryocyte,
Zuniga"Pflucker, J.C., Peault, B., and Kincade, P.W.
and myeloid potential in the mammalian embryo, FEBS
(2006) Tracing the first waves of lymphopoiesis in mice,
Lett., 590, 3965-3974, doi: 10.1002/1873-3468.12459.
Development, 133, 2041-2051, doi: 10.1242/dev.02349.
65.
McGrath, K.E., Koniski, A.D., Malik, J., and Palis, J.
51.
Boisset, J.C., Clapes, T., Van Der Linden, R., Dzierzak, E.,
(2003) Circulation is established in a stepwise pattern in the
and Robin, C. (2013) Integrin alphaIIb (CD41) plays a role
mammalian embryo, Blood, 101, 1669-1676, doi: 10.1182/
in the maintenance of hematopoietic stem cell activity in the
blood"2002"08"2531.
mouse embryonic aorta, Biol. Open, 2, 525-532, doi: 10.1242/
66.
Palis, J., Robertson, S., Kennedy, M., Wall, C., and Keller, G.
bio.20133715.
(1999) Development of erythroid and myeloid progenitors
52.
Bertrand, J.Y., Giroux, S., Golub, R., Klaine, M., Jalil, A.,
in the yolk sac and embryo proper of the mouse,
Boucontet, L., Godin, I., and Cumano, A.
(2005)
Development, 126, 5073-5084.
Characterization of purified intraembryonic hematopoietic
67.
Yoder, M.C., Hiatt, K., Dutt, P., Mukherjee, P., Bodine, D.M.,
stem cells as a tool to define their site of origin, PNAS, 102,
and Orlic, D. (1997) Characterization of definitive lym"
134-139, doi: 10.1073/pnas.0402270102.
phohematopoietic stem cells in the day 9 murine yolk sac,
53.
Rybtsov, S., Batsivari, A., Bilotkach, K., Paruzina, D., Sen"
Immunity, 7, 335-344.
serrich, J., Nerushev, O., and Medvinsky, A. (2014) Tracing
68.
Lin, Y., Yoder, M.C., and Yoshimoto, M. (2014) Lymphoid
the origin of the HSC hierarchy reveals an SCF"depen"
progenitor emergence in the murine embryo and yolk sac
dent, IL"3"independent CD43- embryonic precursor, Stem
precedes stem cell detection, Stem Cells Dev.,
23,
Cell Reports, 3, 489-501, doi: 10.1016/j.stemcr.2014.07.009.
1168-1177, doi: 10.1089/scd.2013.0536.
54.
Rybtsov, S., Sobiesiak, M., Taoudi, S., Souilhol, C.,
69.
Fraser, S.T., Ogawa, M., Yu, R.T., Nishikawa, S., Yoder, M.C.,
Senserrich, J., Liakhovitskaia, A., Ivanovs, A., Frampton, J.,
and Nishikawa, S. (2002) Definitive hematopoietic com"
Zhao, S., and Medvinsky, A. (2011) Hierarchical organiza"
mitment within the embryonic vascular endothelial"cad"
tion and early hematopoietic specification of the developing
herin+ population, Exp. Hematol., 30, 1070-1078.
HSC lineage in the AGM region, J. Exp. Med., 208,
70.
Yoshimoto, M., Porayette, P., Glosson, N.L., Conway, S.J.,
1305-1315, doi: 10.1084/jem.20102419.
Carlesso, N., Cardoso, A.A., Kaplan, M.H., and Yoder, M.C.
55.
Liakhovitskaia, A., Rybtsov, S., Smith, T., Batsivari, A.,
(2012) Autonomous murine T"cell progenitor production
Rybtsova, N., Rode, C., De Bruijn, M., Buchholz, F.,
in the extra"embryonic yolk sac before HSC emergence,
Gordon"Keylock, S., Zhao, S., and Medvinsky, A. (2014)
Blood, 119, 5706-5714, doi: 10.1182/blood"2011"12"
Runx1 is required for progression of CD41+ embryonic
397489.
precursors into HSCs but not prior to this, Development,
71.
Masuda, K., Kubagawa, H., Ikawa, T., Chen, C.C.,
141, 3319-3323, doi: 10.1242/dev.110841.
Kakugawa, K., Hattori, M., Kageyama, R., Cooper, M.D.,
56.
Nakamura, Y., Ichikawa, M., Oda, H., Yamazaki, I.,
Minato, N., Katsura, Y., and Kawamoto, H. (2005)
Sasaki, K., and Mitani, K. (2018) RUNX1"EVI1 induces
Prethymic T"cell development defined by the expression of
dysplastic hematopoiesis and acute leukemia of the
paired immunoglobulin"like receptors, EMBO J., 24,
megakaryocytic lineage in mice, Leuk. Res., 74, 14-20,
4052-4060, doi: 10.1038/sj.emboj.7600878.
doi: 10.1016/j.leukres.2018.09.015.
72.
Boiers, C., Carrelha, J., Lutteropp, M., Luc, S., Green, J.C.,
57.
Antony"Debre, I., Manchev, V.T., Balayn, N., Bluteau, D.,
Azzoni, E., Woll, P.S., Mead, A.J., Hultquist, A., Swiers, G.,
Tomowiak, C., Legrand, C., Langlois, T., Bawa, O., Tosca, L,,
Perdiguero, E.G., Macaulay, I.C., Melchiori, L., Luis, T.C.,
Tachdjian, G., Leheup, B., Debili, N., Plo, I., Mills, J.A.,
Kharazi, S., Bouriez"Jones, T., Deng, Q., Ponten, A.,
French, D.L., Weiss, M.J., Solary, E., Favier, R., Vain"
Atkinson, D., Jensen, C.T., Sitnicka, E., Geissmann, F.,
chenker, W., and Raslova, H. (2015) Level of RUNX1
Godin, I., Sandberg, R., de Bruijn, M.F., and Jacobsen, S.E.
activity is critical for leukemic predisposition but not for
(2013) Lymphomyeloid contribution of an immune"
thrombocytopenia, Blood, 125, 930-940, doi: 10.1182/
restricted progenitor emerging prior to definitive hema"
blood"2014"06"585513.
topoietic stem cells, Cell Stem Cell, 13, 535-548, doi: 10.1016/
58.
Zeigler, B.M., Sugiyama, D., Chen, M., Guo, Y., Downs, K.M.,
j.stem.2013.08.012.
and Speck, N.A. (2006) The allantois and chorion, when
73.
Yoshimoto, M., Montecino"Rodriguez, E., Ferkowicz, M.J.,
isolated before circulation or chorio"allantoic fusion, have
Porayette, P., Shelley, W.C., Conway, S.J., Dorshkind, K.,
hematopoietic potential, Development, 133, 4183-4192,
and Yoder, M.C. (2011) Embryonic day 9 yolk sac and
doi: 10.1242/dev.02596.
intra"embryonic hemogenic endothelium independently
59.
Nishikawa, S.I., Nishikawa, S., Kawamoto, H., Yoshida, H.,
generate a B"1 and marginal zone progenitor lacking B"2
Kizumoto, M., Kataoka, H., and Katsura, Y. (1998) In vitro
potential, PNAS, 108, 1468-1473, doi: 10.1073/pnas.
generation of lymphohematopoietic cells from endothelial
1015841108.
cells purified from murine embryos, Immunity, 8, 761-769.
74.
Montecino"Rodriguez, E., and Dorshkind, K. (2012) B"1
60.
Medvinsky, A., Rybtsov, S., and Taoudi, S.
(2011)
B"cell development in the fetus and adult, Immunity, 36,
Embryonic origin of the adult hematopoietic system:
13-21, doi: 10.1016/j.immuni.2011.11.017.
advances and questions, Development, 138, 1017-1031,
75.
Hoeffel, G., Chen, J., Lavin, Y., Low, D., Almeida, F.F.,
doi: 10.1242/dev.040998.
See, P., Beaudin, A.E., Lum, J., Low, I., Forsberg, E.C.,
61.
Boisset, J.C., Clapes, T., Klaus, A., Papazian, N., Onder"
Poidinger, M., Zolezzi, F., Larbi, A., Ng, L.G., Chan, J.K.,
water, J., Mommaas"Kienhuis, M., Cupedo, T., and
Greter, M., Becher, B., Samokhvalov, I.M., Merad, M.,
БИОХИМИЯ том 84 вып. 3 2019
ИЕРАРХИЯ ЭМБРИОНАЛЬНОГО ГЕМОПОЭЗА
311
and Ginhoux, F. (2015) C"Myb+ erythro"myeloid progeni"
Natl. Acad. Sci. USA, 109, 4515-4520, doi: 10.1073/pnas.
tor"derived fetal monocytes give rise to adult tissue"resi"
1115828109.
dent macrophages, Immunity, 42, 665-678, doi: 10.1016/
91. Gordon"Keylock, S., Sobiesiak, M., Rybtsov, S., Moore, K.,
j.immuni.2015.03.011.
and Medvinsky, A. (2013) Mouse extraembryonic arterial
76.
Schulz, C., Gomez, P.E., Chorro, L., Szabo"Rogers, H.,
vessels harbor precursors capable of maturing into defini"
Cagnard, N., Kierdorf, K., Prinz, M., Wu, B., Jacobsen, S.E.,
tive HSCs, Blood, 122, 2338-2345, doi: 10.1182/blood"
Pollard, J.W., Frampton, J., Liu, K.J., and Geissmann, F.
2012"12"470971.
(2012) A lineage of myeloid cells independent of Myb and
92. Cumano, A., Ferraz, J.C., Klaine, M., Di Santo, J.P., and
hematopoietic stem cells, Science, 336, 86-90, doi: 10.1126/
Godin, I. (2001) Intraembryonic, but not yolk sac
science.1219179.
hematopoietic precursors, isolated before circulation, pro"
77.
Hoeffel, G., and Ginhoux, F. (2018) Fetal monocytes and
vide long"term multilineage reconstitution, Immunity, 15,
the origins of tissue"resident macrophages, Cell Immunol.,
477-485.
330, 5-15, doi: 10.1016/j.cellimm.2018.01.001.
93. Shultz, L.D., Lyons, B.L., Burzenski, L.M., Gott, B.,
78.
Ginhoux, F., and Guilliams, M. (2016) Tissue"resident
Chen, X., Chaleff, S., Kotb, M., Gillies, S.D., King, M.,
macrophage ontogeny and homeostasis, Immunity, 44,
Mangada, J., Greiner, D.L., and Handgretinger, R. (2005)
439-449, doi: 10.1016/j.immuni.2016.02.024.
Human lymphoid and myeloid cell development in
79.
Li, Z., Liu, S., Xu, J., Zhang, X., Han, D., Liu, J., Xia, M.,
NOD/LtSz"scid IL2Rгnull mice engrafted with mobilized
Yi, L., Shen, Q., Xu, S., Lu, L., and Cao, X. (2018) Adult
human hemopoietic stem cells, J. Immunol.,
174,
connective tissue"resident mast cells originate from late
6477-6489.
erythro"myeloid progenitors, Immunity, 49, 640-653,
94. Arora, N., Wenzel, P.L., McKinney"Freeman, S.L., Ross, S.J.,
doi: 10.1016/j.immuni.2018.09.023.
Kim, P.G., Chou, S.S., Yoshimoto, M., Yoder, M.C., and
80.
Dahlin, J.S., and Hallgren, J. (2015) Mast cell progenitors:
Daley, G.Q. (2014) Effect of developmental stage of HSC
origin, development and migration to tissues, Mol.
and recipient on transplant outcomes, Dev. Cell, 29,
Immunol., 63, 9-17, doi: 10.1016/j.molimm.2014.01.018.
621-628, doi: 10.1016/j.devcel.2014.04.013.
81.
Gentek, R., Ghigo, C., Hoeffel, G., Bulle, M.J., Msallam, R.,
95. Baumann, C.I., Bailey A.S., Li, W., Ferkowicz, M.J.,
Gautier, G., Launay, P., Chen, J., Ginhoux, F., and
Yoder, M.C., and Fleming, W.H. (2004) PECAM"1 is
Bajenoff, M. (2018) Hemogenic endothelial fate mapping
expressed on hematopoietic stem cells throughout ontoge"
reveals dual developmental origin of mast cells, Immunity,
ny and identifies a population of erythroid progenitors,
48, 1160-1171, doi: 10.1016/j.immuni.2018.04.025.
Blood, 104, 1010-1016, doi: 10.1182/blood"2004"03"0989
82.
Lux, C.T., Yoshimoto, M., McGrath, K., Conway, S.J.,
2004"03"0989.
Palis, J., and Yoder, M.C. (2008) All primitive and defini"
96. Rybtsov, S., Bilotkach, K., Velasco, J.S., and Medvinsky, A.
tive hematopoietic progenitor cells emerging before E10 in
(2013) Identification of a novel type of immature hae"
the mouse embryo are products of the yolk sac, Blood, 111,
matopoietic stem cell (HSC) precursor in mouse develop"
3435-3438, doi: 10.1182/blood"2007"08"107086.
ment, FEBS J., 280, 442-443.
83.
Wolfe, R.P., and Ahsan, T. (2013) Shear stress during early
97. Gekas, C., Rhodes, K.E., Van Handel, B., Chhabra, A.,
embryonic stem cell differentiation promotes hematopoietic
Ueno, M., and Mikkola, H.K. (2010) Hematopoietic stem
and endothelial phenotypes, Biotechnol. Bioeng., 110,
cell development in the placenta, Int. J. Dev. Biol., 54,
1231-1242, doi: 10.1002/bit.24782.
1089-1098, doi: 10.1387/ijdb.103070cg.
84.
Adamo, L., Naveiras, O., Wenzel, P.L., McKinney"
98. Gekas, C., Dieterlen"Lievre, F., Orkin, S.H., and
Freeman, S., Mack, P.J., Gracia"Sancho, J., Suchy"Dicey, A.,
Mikkola, H.K. (2005) The placenta is a niche for hema"
Yoshimoto, M., Lensch, M.W., Yoder, M.C., Garcia"
topoietic stem cells, Dev. Cell, 8, 365-375, doi: 10.1016/
Cardena, G., and Daley, G.Q. (2009) Biomechanical
j.devcel.2004.12.016.
forces promote embryonic haematopoiesis, Nature, 459,
99. Ottersbach, K., and Dzierzak, E. (2005) The murine pla"
1131-1135, doi: 10.1038/nature08073.
centa contains hematopoietic stem cells within the vascular
85.
Rybtsov, S., Ivanovs, A., Zhao, S., and Medvinsky, A.
labyrinth region, Dev. Cell, 8, 377-387, 10.1016/j.devcel.
(2016) Concealed expansion of immature precursors
2005.02.001.
underpins acute burst of adult HSC activity in foetal liver,
100. Ivanovs, A., Rybtsov, S., Anderson, R.A., and Medvinsky, A.
Development, 143, 1284-1289, doi: 10.1242/dev.131193.
(2014) CD43 but not CD41 marks the first hematopoietic
86.
Wilson, A., Laurenti, E., Oser, G., van der Wath, R.C.,
stem cells in the human embryo, Blood, 124, 4330.
Blanco"Bose, W., Jaworski, M., Offner, S., Dunant, C.F.,
101. Ivanovs, A., Rybtsov, S., Welch, L., Anderson, R.A.,
Eshkind, L., Bockamp, E., Lio, P., Macdonald, H.R., and
Turner, M.L,, and Medvinsky, A. (2013) Highly potent
Trumpp, A. (2008) Hematopoietic stem cells reversibly
human haemopoietic stem cells first emerge in the
switch from dormancy to self"renewal during homeostasis
intraembryonic aorta"gonad"mesonephros region, Lancet,
and repair, Cell, 135, 1118-1129.
381, 11-12.
87.
Dzierzak, E., and Bigas, A. (2018) Blood development: hema"
102. Vodyanik, M.A., Thomson, J.A., and Slukvin, I.I. (2006)
topoietic stem cell dependence and independence, Cell
Leukosialin (CD43) defines hematopoietic progenitors in
Stem Cell, 22, 639-651, doi: 10.1016/j.stem.2018.04.015.
human embryonic stem cell differentiation cultures, Blood,
88.
Samokhvalov, I.M., Samokhvalova, N.I., and Nishikawa, S.
108, 2095-2105, doi: 10.1182/blood"2006"02"003327.
(2007) Cell tracing shows the contribution of the yolk sac
103. Kessel, K.U., Bluemke, A., Scholer, H.R., Zaehres, H.,
to adult haematopoiesis, Nature, 446, 1056-1061, doi: 10.1038/
Schlenke, P., and Dorn, I. (2017) Emergence of CD43"
nature05725.
expressing hematopoietic progenitors from human induced
89.
Samokhvalov, I.M., Thomson, A.M., Lalancette, C.,
pluripotent stem cells, Transfus. Med. Hemother., 44,
Liakhovitskaia, A., Ure, J., and Medvinsky, A. (2006)
143-150, doi: 10.1159/000477357.
Multifunctional reversible knockout/reporter system
104. Ivanovs, A., Rybtsov, S., Anderson, R.A., Turner, M.L.,
enabling fully functional reconstitution of the AML1/
and Medvinsky, A. (2014) Identification of the niche and
Runx1 locus and rescue of hematopoiesis, Genesis, 44,
phenotype of the first human hematopoietic stem cells,
115-121, doi: 10.1002/gene.20190.
Stem Cell Reports, 2, 449-456, doi: 10.1016/j.stemcr.
90.
Tanaka, Y., Hayashi, M., Kubota, Y., Nagai, H., Sheng, G.,
2014.02.004.
Nishikawa, S., and Samokhvalov, I.M. (2012) Early onto"
105. Batsivari, A., Rybtsov, S., Souilhol, C., Binagui"Casas, A.,
genic origin of the hematopoietic stem cell lineage, Proc.
Hills, D., Zhao, S., Travers, P., and Medvinsky, A. (2017)
БИОХИМИЯ том 84 вып. 3 2019
312
РЫБЦОВ, ЛАГАРЬКОВА
Understanding hematopoietic stem cell development
(2005) Long"term maintenance of hematopoietic stem
through functional correlation of their proliferative status
cells does not require contact with embryo"derived stromal
with the intra"aortic cluster architecture, Stem Cell Reports,
cells in cocultures, Stem Cells, 23, 842-851, doi: 10.1634/
8, 1549-1562, doi: 10.1016/j.stemcr.2017.04.003.
stemcells.2004"0120.
106. Wright, D.E., Wagers, A.J., Gulati, A.P., Johnson, F.L.,
121. Oostendorp, R.A., Harvey, K.N., Kusadasi, N., de Bruijn, M.F.,
and Weissman, I.L. (2001) Physiological migration of
Saris, C., Ploemacher, R.E., Medvinsky, A.L., and
hematopoietic stem and progenitor cells, Science, 294,
Dzierzak, E.A. (2002) Stromal cell lines from mouse aorta"
1933-1936, doi: 10.1126/science.1064081.
gonads"mesonephros subregions are potent supporters of
107. McGarvey, A.C., Rybtsov, S., Souilhol, C., Tamagno, S.,
hematopoietic stem cell activity, Blood, 99, 1183-1189.
Rice, R., Hills, D., Godwin, D., Rice, D., Tomlinson, S.R.,
122. Buckley, S.M., Ulloa"Montoya, F., Abts, D., Oostendorp, R.A.,
and Medvinsky, A. (2017) A molecular roadmap of the
Dzierzak, E., Ekker, S.C., and Verfaillie, C.M. (2011)
AGM region reveals BMPER as a novel regulator of HSC
Maintenance of HSC by Wnt5a secreting AGM"derived
maturation, J. Exp. Med., 214, 3731-3751, doi: 10.1084/
stromal cell line, Exp. Hematol., 39, 114-123, doi: 10.1016/
jem.20162012.
j.exphem.2010.09.010.
108. Taoudi, S., and Medvinsky, A. (2007) Functional identifi"
123. Robin, C., Ottersbach, K., Durand, C., Peeters, M., Vanes, L.,
cation of the hematopoietic stem cell niche in the ventral
Tybulewicz, V., and Dzierzak, E. (2006) An unexpected role
domain of the embryonic dorsal aorta, Proc. Natl. Acad.
for IL"3 in the embryonic development of hematopoietic
Sci. USA, 104, 9399-9403, doi: 10.1073/pnas.0700984104.
stem cells, Dev. Cell, 11, 171-180, doi: 10.1016/j.devcel.
109. Souilhol, C., Gonneau, C., Lendinez, J.G., Batsivari, A.,
2006.07.002.
Rybtsov, S., Wilson, H., Morgado"Palacin, L., Hills, D.,
124. Ding, L., Saunders, T.L., Enikolopov, G., and Morrison, S.J.
Taoudi, S., Antonchuk, J., Zhao, S., and Medvinsky, A.
(2012) Endothelial and perivascular cells maintain haemato"
(2016) Inductive interactions mediated by interplay of
poietic stem cells, Nature, 481, 457-462, doi: 10.1038/
asymmetric signalling underlie development of adult
nature10783.
haematopoietic stem cells, Nat. Commun., 7, 10784,
125. Souilhol, C., Lendinez, J.G., Rybtsov, S., Murphy, F., Wil"
doi: 10.1038/ncomms10784.
son, H., Hills, D., Batsivari, A., Binagui"Casas, A., McGar"
110. Gao, X., Xu, C., Asada, N., and Frenette, P.S. (2018) The
vey, A.C., MacDonald, H.R., Kageyama, R., Siebel, C.,
hematopoietic stem cell niche: from embryo to adult,
Zhao, S., and Medvinsky, A. (2016) Developing HSCs
Development, 145, dev139691, doi: 10.1242/dev.139691.
become Notch independent by the end of maturation in the
111.
Chou, S., and Lodish, H.F. (2010) Fetal liver hepatic proge"
AGM region, Blood, 128, 1567-1577, doi: 10.1182/blood"
nitors are supportive stromal cells for hematopoietic stem cells,
2016"03"708164.
Proc. Natl. Acad. Sci. USA, 107, 7799-7804, doi: 10.1073/
126. Fitch, S.R., Kimber, G.M., Wilson, N.K., Parker, A.,
pnas.1003586107.
Mirshekar"Syahkal, B., Gottgens, B., Medvinsky, A.,
112. Kapp, F.G., Perlin, J.R., Hagedorn, E.J., Gansner, J.M.,
Dzierzak, E., and Ottersbach, K. (2012) Signaling from the
Schwarz, D.E., O’Connell, L.A., Johnson, N.S.,
sympathetic nervous system regulates hematopoietic stem
Amemiya, C., Fisher, D.E., Wolfle, U., Trompouki, E.,
cell emergence during embryogenesis, Cell Stem Cell, 11,
Niemeyer, C.M., Driever, W., and Zon, L.I.
(2018)
554-566, doi: 10.1016/j.stem.2012.07.002.
Protection from UV light is an evolutionarily conserved
127. Gribi, R., Hook, L., Ure, J., and Medvinsky, A. (2006) The
feature of the haematopoietic niche, Nature,
558,
differentiation programme of embryonic definitive
445-448, doi: 10.1038/s41586"018"0213"0.
hematopoietic stem cells is largely α4 integrin indepen"
113. Testa, U., Labbaye, C., Castelli, G., and Pelosi, E. (2016)
dent, Blood, 108, 501-509.
Oxidative stress and hypoxia in normal and leukemic stem
128. Kim, A.G., Vrecenak, J.D., Boelig, M.M., Eissenberg, L.,
cells, Exp. Hematol., 44, 540-560, doi: 10.1016/j.exphem.
Rettig, M.P., Riley, J.S., Holt, M.S., Conner, M.A.,
2016.04.012.
Loukogeorgakis, S.P., Li, H., DiPersio, J.F., Flake, A.W.,
114. Suda, T., Takubo, K., and Semenza, G.L.
(2011)
and Peranteau, W.H. (2016) Enhanced in utero allogeneic
Metabolic regulation of hematopoietic stem cells in the
engraftment in mice after mobilizing fetal HSCs by α4β1/7
hypoxic niche, Cell Stem Cell, 9, 298-310, doi: 10.1016/
inhibition, Blood, 128, 2457-2461, doi: 10.1182/blood"
j.stem.2011.09.010.
2016"06"723981.
115. Miharada, K., Karlsson, G., Rehn, M., Rorby, E., Siva, K.,
129. Hirsch, E., Iglesias, A., Potocnik, A.J., Hartmann, U., and
Cammenga, J., and Karlsson, S. (2012) Hematopoietic
Fassler, R. (1996) Impaired migration but not differentia"
stem cells are regulated by Cripto, as an intermediary of
tion of haematopoietic stem cells in the absence of β1 inte"
HIF"1α in the hypoxic bone marrow niche, Ann. N.Y. Acad.
grins, Nature, 380, 171-175, doi: 10.1038/380171a0.
Sci., 1266, 55-62, doi: 10.1111/j.1749"6632.2012.06564.x.
130. Potocnik, A.J., Brakebusch, C., and Fassler, R. (2000) Fetal
116. Wei, Q., and Frenette, P.S. (2018) Niches for hematopoietic
and adult hematopoietic stem cells require β1 integrin function
stem cells and their progeny, Immunity, 48, 632-648,
for colonizing fetal liver, spleen, and bone marrow, Immunity,
doi: 10.1016/j.immuni.2018.03.024.
12,
117. Medvinsky, A.L., Gan, O.I., Semenova, M.L., and
7613(00)80216"2.
Samoylina, N.L. (1996) Development of day"8 colony"
131. Jiang, X., Hawkins, J.S., Lee, J., Lizama, C.O., Bos, F.L.,
forming unit"spleen hematopoietic progenitors during
Zape, J.P., Ghatpande, P., Peng, Y., Louie, J., Lagna, G.,
early murine embryogenesis: spatial and temporal map"
Zovein, A.C., and Hata, A. (2017) Let"7 microRNA"
ping, Blood, 87, 557-566.
dependent control of leukotriene signaling regulates the
118. Durand, C., Robin, C., Bollerot, K., Baron, M.H.,
transition of hematopoietic niche in mice, Nat. Commun.,
Ottersbach, K., and Dzierzak, E. (2007) Embryonic stro"
8, 128, doi: 10.1038/s41467"017"00137"y.
mal clones reveal developmental regulators of definitive
132. Ratajczak, M.Z. (2010) Spotlight series on stem cell mobi"
hematopoietic stem cells, Proc. Natl. Acad. Sci. USA, 104,
lization: many hands on the ball, but who is the quarterback?
20838-20843, doi: 10.1073/pnas.0706923105.
Leukemia, 24, 10, 1665-1666, doi: 10.1038/leu.2010.181.
119. Durand, C., Robin, C., and Dzierzak, E. (2006) Mesen"
133. Kumaravelu, P., Hook, L., Morrison, A.M., Ure, J., Zhao, S.,
chymal lineage potentials of aorta"gonad"mesonephros
Zuyev, S., Ansell, J., and Medvinsky, A. (2002) Quantita"
stromal clones, Haematologica, 91, 1172-1179.
tive developmental anatomy of definitive haematopoietic
120. Oostendorp, R.A., Robin, C,. Steinhoff, C., Marz, S.,
stem cells/long"term repopulating units (HSC/RUs): role
Brauer, R., Nuber, U.A., Dzierzak, E.A., and Peschel, C.
of the aorta"gonad"mesonephros (AGM) region and the
БИОХИМИЯ том 84 вып. 3 2019
ИЕРАРХИЯ ЭМБРИОНАЛЬНОГО ГЕМОПОЭЗА
313
yolk sac in colonisation of the mouse embryonic liver,
142. Omatsu, Y., Sugiyama, T., Kohara, H., Kondoh, G., Fujii, N.,
Development, 129, 4891-4899.
Kohno, K., and Nagasawa, T. (2010) The essential func"
134. Ema, H., and Nakauchi, H.
(2000) Expansion of
tions of adipo"osteogenic progenitors as the hematopoietic
hematopoietic stem cells in the developing liver of a mouse
stem and progenitor cell niche, Immunity, 33, 387-399,
embryo, Blood, 95, 2284-2288.
doi: 10.1016/j.immuni.2010.08.017.
135. Khan, J.A., Mendelson, A., Kunisaki, Y., Birbrair, A.,
143. Spiegel, A., Shivtiel, S., Kalinkovich, A., Ludin, A.,
Kou, Y., Arnal"Estape, A., Pinho, S., Ciero, P., Nakahara, F.,
Netzer, N., Goichberg, P., Azaria, Y., Resnick, I., Hardan, I.,
Ma’ayan, A., Bergman, A., Merad, M., and Frenette, P.S.
Ben"Hur, H., Nagler, A., Rubinstein, M., and Lapidot, T.
(2016) Fetal liver hematopoietic stem cell niches associate
(2007) Catecholaminergic neurotransmitters regulate
with portal vessels, Science, 351, 176-180, doi: 10.1126/
migration and repopulation of immature human CD34+
science.aad0084.
cells through Wnt signaling, Nat. Immunol., 8, 1123-1131,
136. Chou, S., Flygare, J., and Lodish, H.F. (2013) Fetal hepatic
doi: 10.1038/ni1509.
progenitors support long"term expansion of hematopoietic
144. Garcia"Garcia, A., Korn, C., Garcia"Fernandez, M.,
stem cells, Exp. Hematol., 41, 479-490, doi: 10.1016/
Domingues, O., Villadiego, J., Martin"Perez, D., Isern, J.,
j.exphem.2013.02.003.
Bejarano"Garcia, J.A., Zimmer, J., Perez"Simon, J.A.,
137. Zhang, C.C., and Lodish, H.F. (2004) Insulin"like growth
Toledo"Aral, J.J., Michel, T., Airaksinen, M.S., and
factor 2 expressed in a novel fetal liver cell population is a
Mendez"Ferrer, S. (2018) Dual cholinergic signals regulate
growth factor for hematopoietic stem cells, Blood, 103,
daily migration of hematopoietic stem cells and leukocytes,
2513-2521, doi: 10.1182/blood"2003"08"2955.
Blood, doi: 10.1182/blood"2018"08"867648.
138. Zhang, C.C., Kaba, M., Ge, G., Xie, K., Tong, W., Hug, C.,
145. Pierce, H., Zhang, D., Magnon, C., Lucas, D., Christin, J.R.,
and Lodish, H.F. (2006) Angiopoietin"like proteins stimu"
Huggins, M., Schwartz, G.J., and Frenette, P.S. (2017)
late ex vivo expansion of hematopoietic stem cells, Nat.
Cholinergic signals from the CNS regulate G"CSF"mediated
Med., 12, 240-245, doi: 10.1038/nm1342.
HSC mobilization from bone marrow via a glucocorticoid
139. Zhao, Y., Zhou, J., Liu, D., Dong, F., Cheng, H., Wang, W.,
signaling relay, Cell Stem Cell, 20, 648-658, doi: 10.1016/
Pang, Y., Wang, Y., Mu, X., Ni, Y., Li, Z., Xu, H., Hao, S.,
j.stem.2017.01.002.
Wang, X., Ma, S., Wang, Q.F., Xiao, G., Yuan, W., Liu, B.,
146. Mendez"Ferrer, S., Lucas, D., Battista, M., and Frenette, P.S.
and Cheng, T. (2015) ATF4 plays a pivotal role in the
(2008) Haematopoietic stem cell release is regulated by cir"
development of functional hematopoietic stem cells in
cadian oscillations, Nature, 452, 442-447, doi: 10.1038/
mouse fetal liver, Blood, 126, 2383-2391, doi: 10.1182/
nature06685.
blood"2015"03"633354.
147. Maryanovich, M., Zahalka, A.H., Pierce, H., Pinho, S.,
140. Taichman, R.S. (2005) Blood and bone: two tissues whose
Nakahara, F., Asada, N., Wei, Q., Wang, X., Ciero, P., Xu, J.,
fates are intertwined to create the hematopoietic stem"cell
Leftin, A., and Frenette, P.S. (2018) Adrenergic nerve
niche, Blood, 105, 2631-2639, doi: 10.1182/blood"2004"06"2480.
degeneration in bone marrow drives aging of the
141. Boulais, P.E., and Frenette, P.S. (2015) Making sense of
hematopoietic stem cell niche, Nat. Med., 24, 782-791,
hematopoietic stem cell niches, Blood, 125, 2621-2629,
doi: 10.1038/s41591"018"0030"x.
doi: 10.1182/blood"2014"09"570192.
DEVELOPMENT OF HEMATOPOIETIC STEM
CELLS IN THE EARLY MAMMALIAN EMBRYO
S. A. Rybtsov1* and M. A. Lagarkova2
1 MRC Centre for Regenerative Medicine, University of Edinburgh,
EH16 4U, Edinburgh, United Kingdom; E mail: srybtsov@ed.ac.uk
2 Federal Research and Clinical Centre of Physical Chemical Medicine,
Federal Medical Biological Agency, 119435 Moscow, Russia;
E mail: lagar@rcpcm.org
Received November 20, 2018
Revised December 4, 2018
Accepted December 4, 2018
Hematopoietic stem cells (HSCs) were first stem cells discovered in human. A.A. Maximov proposed an idea of blood
stem cell which was confirmed later by McCulloch and Till experimentally. HSCs were the first type of stem cells to
be used in clinic and ever since are being continually used. Indeed, single HSC transplanted intravenously is capable
to give rise to all types of blood cells. Last decades, human and animal HSC origin, development, hierarchy and gene
signature have been extensively investigated. Due to the constant need for donor blood and HSCs suitable for thera"
peutic transplants, the experimental possibility of obtaining HSCs in vitro by directed differentiation of pluripotent
stem cells (PSCs) has been considered in recent years. However, despite all efforts, it is not yet possible to reproduce
in vitro the ontogenesis of HSCs and obtain cells capable of long"term maintenance of hematopoiesis. The study of
hematopoiesis in embryonic development facilitates the establishment and improvement of protocols for deriving
blood cells from the PCSs and allows a better understanding of the pathogenesis of various types of proliferative blood
diseases, anemia and immunodeficiency. The review is focused on the development of hematopoiesis in mammalian
ontogenesis.
Keywords: hematopoietic stem cells (HSC), hematopoietic progenitors, hematopoietic hierarchy, mouse develop"
ment, human haematopoiesis, AGM, embryo
БИОХИМИЯ том 84 вып. 3 2019