БИОХИМИЯ, 2019, том 84, вып. 3, с. 314 - 329
УДК 577.218
KH ДОМЕННЫЕ ПОЛИ(С) СВЯЗЫВАЮЩИЕ БЕЛКИ
КАК МНОГОСТОРОННИЕ РЕГУЛЯТОРЫ РАЗЛИЧНЫХ
БИОЛОГИЧЕСКИХ ПРОЦЕССОВ
Обзор
© 2019 И.Б. Назаров*, Е.И. Бахмет, А.Н. Томилин
Институт цитологии РАН, 194064 Санкт Петербург, Россия;
электронная почта: i.nazarov@incras.ru
Поступила в редакцию 16.10.2018
После доработки 10.11.2018
Принята к публикации 21.11.2018
Пять известных членов семейства KH доменных поли(С) связывающих белков (Pcbp1-4, hnRNP K) име
ют необычайно широкий спектр клеточных функций, включая регуляцию транскрипции генов, процессинг
пре мРНК, сплайсинг, стабильность мРНК, регуляцию на уровне трансляции белков, контроль обмена же
леза и многие другие. Механистически эти белки функционируют посредством связывания с нуклеиновы
ми кислотами и через белок белковые взаимодействия. Вследствие способности выполнять многочислен
ные функции, члены семейства KH доменных поли(C) связывающих белков вовлечены в широкий спектр
биологических процессов, таких как эмбриональное развитие, дифференцировка клеток и рак. Нарушения
нормальной экспрессии KH доменного белка часто связаны с серьезными дефектами развития и неоплази
ей. В данном обзоре обобщен прогресс в исследованиях KH доменных белков, проведенных за последние
два десятилетия. Также сообщается о нашей недавней работе, предполагающей участие KH фактора Pcbp1
в контроле перехода от наивного к праймированному плюрипотентному состоянию.
КЛЮЧЕВЫЕ СЛОВА: Pcbp1-4, hnRNP K, экспрессия гена, клеточный цикл, рак, эмбриональное разви
тие, плюрипотентные стволовые клетки.
DOI: 10.1134/S0320972519030035
Домен гомологии hnRNP K (KH) был впер
ными многофункциональными белками: Pcbp1,
вые идентифицирован в гетерогенном ядерном
Pcbp2, Pcbp3, Pcbp4 (Poly(C) binding proteins) и
рибонуклеопротеине K (hnRNP K) ~25 лет на
hnRNP K. Pcbp1-4 альтернативно называют
зад [1]. Мотив KH домена состоит из ~70 ами
αCP1-4 (α complex proteins), а Pcbp1 и Pcbp2
нокислот и обнаруживается в разнообразных
также известны как hnRNP E1 и hnRNP E2 со
белках архей, бактерий и эукариот [2]. У эукари
ответственно. Кроме того, мРНК этого семей
от он распространен среди нескольких семейств
ства подвержена альтернативному сплайсингу, а
белков, связывающих нуклеиновые кислоты,
белки - посттрансляционным модификациям,
включая семейство поли(С) связывающих бел
что увеличивает разнообразие этой белковой
ков. Семейство KH доменных поли(C) связы
группы. Три члена KH семейства: Pcbp1, Pcbp2
вающих белков представлено пятью родствен
и hnRNP K - экспрессируются в клетках разных
Принятые сокращения: hnRNP K - гетерогенный ядерный рибонуклеопротеин K; Pcbp1, Pcbp2, Pcbp3, Pcbp4 -
поли(С) связывающие белки (Poly(C) binding proteins); КН белки или КН доменные белки - KH доменные поли(С)
связывающие белки; MOR - μ опиоидный рецептор; CD43 -кластер дифференцировки 43 или лейкосиалин (cluster of
differentiation 43); CD44 - CD44 антиген или гликопротеин клеточной поверхности CD44; snRNP - малый ядерный ри
бонуклеопротеин; THAP11 - THAP домен содержащий белок 11; 3' UTR - 3' нетранслируемая область; POLH - ДНК
полимераза H; GPR56 - ассоциированный с G белком рецептор 56; DICE - CU богатый мотив (differentiation control ele
ment); EMT - эпителиально мезенхимальный переход (epithelial mesenchymal transition); IRES - сайт входа рибосомы;
PRF - запрограммированный рибосомальный сдвиг рамки считывания (programmed ribosomal frameshifting); siРНК - ма
лыe интерферирующие РНК; HIF1α - индуцируемый при гипоксии фактор α; ESC - эмбриональные стволовые клетки
(embryonic stem cells); mESC -эмбриональные стволовые клетки мыши; hESC - эмбриональные стволовые клетки чело
века; ChIP - иммунопреципитация хроматина; PLK1 - полоподобные киназы; p21 - белок ингибитор циклин зависимой
киназы 1А (CDKN1A); p53 - опухолевый антиген p53; CDC27 - гомолог белка цикла клеточного деления 27; CDK2 -
циклинзависимая киназа 2; miR -микроРНК; CRISPR/Cas9 - методика для направленного редактирования геномов
(CRISPR - clustered regularly interspaced short palindromic repeats); PU.1 - гемопоэтический фактор транскрипции PU.1.
* Адресат для корреспонденции.
314
KH ДОМЕННЫЕ ПОЛИ(С) СВЯЗЫВАЮЩИЕ БЕЛКИ
315
типов во время эмбрионального развития и у
предшествовало привлечению транс действую
взрослых, тогда как экспрессия Pcbp3 и Pcbp4
щих партнеров, таких, например, как TATA свя
значительно слабее, и эти белки менее изучены.
зывающий белок (TBP).
Каждый белок содержит три KH домена, кото
Недавние исследования значительно расши
рые совместно обеспечивают высокое сродство
рили список генов, регулируемых с участием
и специфичность взаимодействия с полипири
hnRNP K. Например, этот белок может действо
мидиновыми или C богатыми областями РНК,
вать в ответ на повреждение ДНК как транскрип
а также одноцепочечной и двуцепочечной ДНК.
ционный коактиватор гена р53 [20]. hnRNP K
Для этих белков имеется большое количество
активирует промоторные элементы генов KRAS
связывающих мишеней, как в геномах, так и в
[21], тирозингидроксилазы (Th) [22], белка за
РНК транскриптах. Кроме того, существует
щиты теломер 1 (pot1) [23], Pregnane and xenobi
множество белковых партнеров, специфично
otic receptor (PXR) [24] и гена фактора роста эн
взаимодействующих с KH доменными белками.
дотелия (VEGF) [25], но ингибирует активность
В результате эти белки обладают способностью
промотора гена Nrf2 [26]. Также были выявлены
влиять на большое количество событий в клетке
новые общие черты механизма регуляции тран
на транскрипционном, посттранскрипционном
скрипции с помощью hnRNP K. GC богатые
и трансляционном уровнях. Эволюционные,
области промотора формируют вторичные струк
структурные и функциональные аспекты пре
туры: либо G квадруплексы, либо i мотивы, что
дыдущих исследований были рассмотрены ра
обычно приводит к замедлению транскрипции
нее в других обзорах [3-7]. Здесь мы обсудили
генов. hnRNP K совместно с другими фактора
последние и наиболее важные достижения в ис
ми связывается с неспаренными цитозиновыми
следовании функциональных особенностей
элементами в частично развернутой структуре
этих белков, вовлеченных в процессы раннего
i мотива и после этого рекрутирует белки ини
развития, дифференцировки и пролиферации
циации транскрипции и РНК полимеразного
клеток.
комплекса [21, 23, 25, 27]. hnRNP K может также
стимулировать транскрипционную активность,
связываясь с двуцепочечной ДНК [22], при этом
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ
было показано, что как минимум три соседних
ДЕЙСТВИЯ КН ДОМЕННЫХ
цитозиновых прогона в двуцепочечной ДНК яв
ПОЛИ(С) СВЯЗЫВАЮЩИХ БЕЛКОВ
ляются полезными для такой стимуляции [25, 27].
В нашей лаборатории обнаружено, что hnRNP K,
KH доменные поли(C) связывающие белки
Pcbp1 и Pcbp2 связывают сайт 2A хорошо оха
как транскрипционные факторы. Способность
рактеризованных дистальных и проксимальных
KH доменных поли(С) связывающих белков
энхансеров гена Pou5f1 [28], который кодирует
взаимодействовать с C богатыми областями од
транскрипционный фактор Oct4, имеющий ре
ноцепочечной и двуцепочечной ДНК лежит в
шающее значение для индукции и поддержания
основе их активности в качестве регуляторов
состояния плюрипотентных клеток (рис. 1, не
транскрипции. Одними из наиболее изученных
опубликованные данные).
генов мишеней, регулируемых этими белками,
Альтернативный сплайсинг. Хорошо извест
являются c MYC [8, 9] и MOR (ген μ опиоидного
но, что расположение сайтов сплайсинга конт
рецептора) [10-12]. hnRNP K и Pcbp1 активиру
ролируется взаимодействием определенных по
ют гены c MYC и MOR, тогда как Pcbp3 действует
следовательностей на транскрипте со специфи
как репрессор гена MOR [13]. Кроме того,
ческими РНК связывающими белками. KH до
hnRNP K активирует транскрипцию гена ней
менные поли(С) связывающие белки с высокой
ронального никотинового рецептора ацетилхо
аффинностью и специфичностью взаимодейству
лина (nAChR) [14], нерецепторной тирозинки
ют с C богатыми полипиримидиновыми мотива
назы (SRC) [15], белка восприимчивости к раку
ми интронов, расположенными на 5' последо
молочной железы первого типа (BRCA1) [16] и
вательности сайтов сплайсинга, и способны сти
эукариотического фактора инициации трансля
мулировать сплайсинг некоторых экзонов. Уси
ции 4E (eIF4E) [17]. hnRNP K участвует в реп
ление акцепторной активности сайтов сплай
рессии генов лейкосиалина или CD43 (SPN) [18]
синга часто связано с взаимодействием этих бел
и тимидинкиназы (tk) человека посредством
ков с комплексом малого ядерного рибонуклео
связывания с их промоторами [19]. В большин
протеина U2 (U2 snRNP), который опосредован
стве перечисленных случаев, похоже, действо
каноническим белком U2AF65, связывающим
вали аналогичные механизмы: связывание KH
полипиримидиновые участки ДНК [29].
белка с одноцепочечной ДНК в кооперации с
Специфическое связывание Pcbp1 с U1
цис связанными партнерами (Sp1 или другими)
snRNP в пресплайсесомальном комплексе обес
БИОХИМИЯ том 84 вып. 3 2019
316
НАЗАРОВ и др.
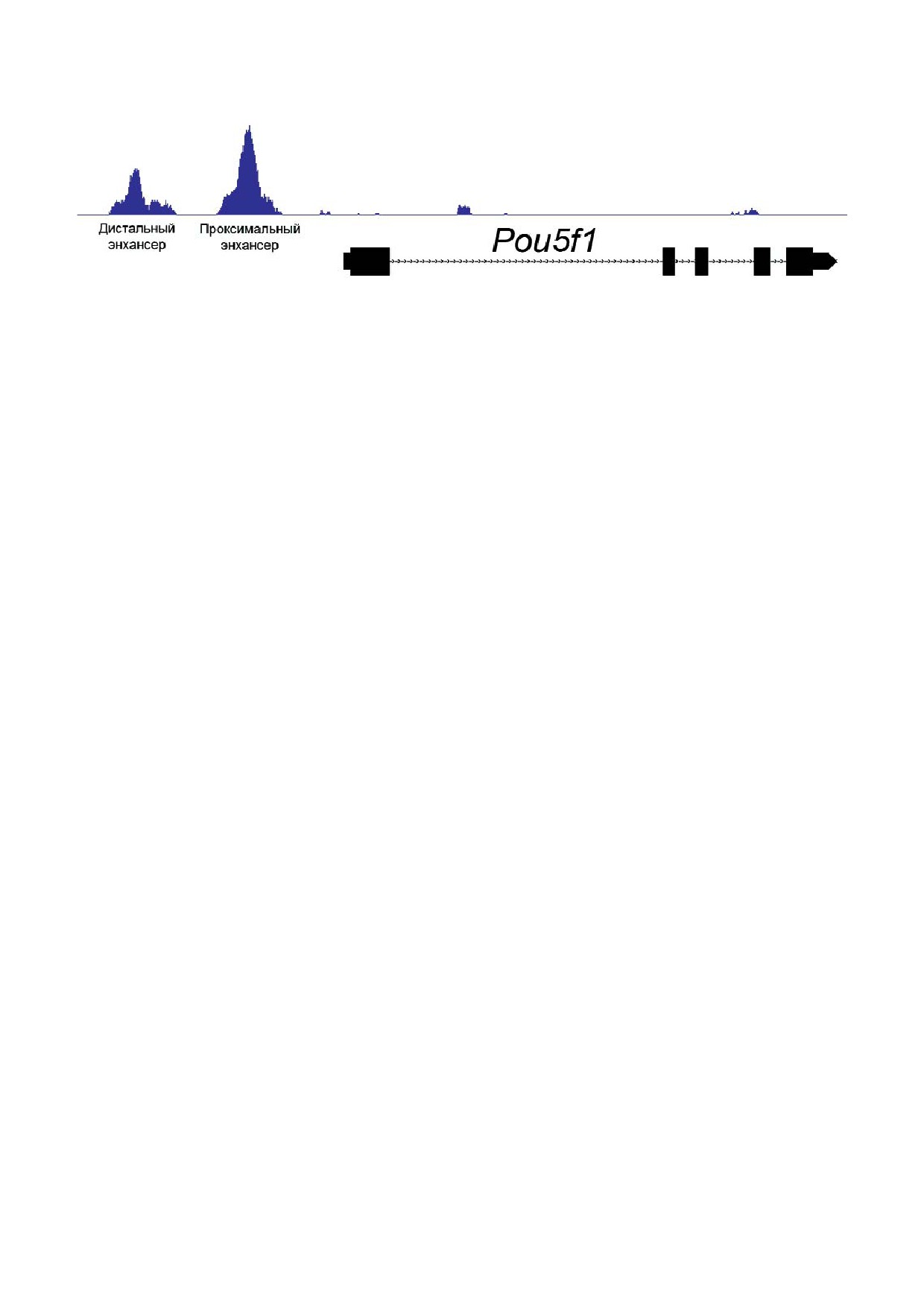
Рис. 1. Анализ последовательности ДНК методом секвенирования после иммунопреципитации хроматина (ChIP seq), де
монстрирующий присутствие белка hnRNP K в дистальном и проксимальном энхансерах гена Pou5f1 в ESC мыши
печивает остановку сплайсинга псевдоэкзона в
расположены выше 6 го экзона гена Runx1. Они
рецепторе гормона роста человека, активация
связывают hnRNP K, который необходим для
которого, в свою очередь, вызывает синдром
репрессии экзона. Этот экзон кодирует пептид
Ларона [30]. Когда Pcbp1 фосфорилируется ки
ный домен, отвечающий за переключение ак
назой Pak1, он аккумулируется в ядре клетки,
тивности транскрипционного репрессора/акти
что приводит к альтернативному сплайсингу и
ватора Runx1 и имеющий решающее значение
включению экзона из CD44 репортерного ми
для спецификации линий нейронов
[37].
нигена. Альтернативные виды сплайсинга, в
Venables et al. исследовали последствия нокдауна
свою очередь, опосредованы взаимодействием
14 основных белков hnRNP (включая hnRNP K)
Pcbp1 с Caper α, вспомогательным белком U2
на 56 альтернативных событиях сплайсинга в
snRNP [31]. Усиленная экспрессия Pcbp1 инги
апоптотических генах в нескольких линиях кле
бировала варианты сплайсинга гена CD44, вклю
ток человека: HeLa, PC 3 и BJT. Наиболее зна
чая v3, v5, v6, v8 и v10 в клетках HepG2 гепатомы
чительные эффекты наблюдались при нокдау
человека, тогда как нокдаун эндогенного Pcbp1
нах hnRNP K и C. Кроме того, было отмечено
индуцировал экспрессию этих вариантов [32].
двунаправленное влияние hnRNP K на аль
Pcbp1 контролирует альтернативный сплайсинг
тернативный сплайсинг, заключающееся как во
гена CD44 путем образования комплексов с
включении, так и в исключении экзонов. На
THAP домен содержащим белком 11 (THAP11,
пример, уменьшение экспрессии hnRNP K
белок Ronin у мышей), важным фактором для
приводило к включению 44 аминокислот в C кон
поддержания плюрипотентности и роста кле
цевой домен каспазы семейства NLR (NALP1),
ток. В клетках HepG2 избыточная экспрессия
к потере 43 аминокислотных остатков в активи
THAP11 ингибировала сплайсинг CD44, вклю
рующем пептидазу факторе апоптоза 1 (APAF1)
чая вариант v6. Однако после удаления связыва
и исключению 126 нуклеотидного экзона, ко
ющего домена Pcbp1 или нокдауна эндогенного
дирующего 42 аминокислоты тирозинкиназы 2
Pcbp1 THAP11 не ингибировал экспрессию v6
(PTK2B) [38].
CD44, что указывает на то, что THAP11 действи
Стабилизация и транспорт мРНК. Регуляция
тельно регулирует экспрессию v6 CD44 посред
на уровне трансляции. Первый пример КН до
ством взаимодействия с Pcbp1 [33].
менного поли(C) связывающего белка, функ
Белок hnRNP K также может взаимодей
ционирующего на посттранскрипционном
ствовать с факторами сплайсинга, такими как
уровне, показан в исследованиях мРНК α гло
hnRNP A1, A2, G, L, D и U, Sam68, TAF15,
бина человека [39]. KH белки могут связывать
SRp20, YB 1 и 9G8 [34, 35]. Кроме того, hnRNP K
богатую пиримидином 3' нетранслируемую об
является компонентом интронного энхансерного
ласть (3' UTR) α глобиновой мРНК с образова
комплекса сплайсинга, который активирует сплай
нием «α комплекса». Были идентифицированы
синг альтернативного экзона 6A в пре мРНК
три C богатые области, которые необходимы
β тропомиозина цыплят [36]. РНК элемент на
для стабильности мРНК α2 глобина, и наруше
3' сайте сплайсинга гена синаптосомального
ние любого из трех C насыщенных элементов в
белка 25 (Snap25) специфически связывается с
этой области разрушает сборку α комплекса in
hnRNP K, который непосредственно конкури
vitro и снижает стабильность мРНК α глобина in
рует с фактором U2AF65 - важным компонен
vivo [39, 40]. Сообщалось также, что и другие
том ранних сплайсосом. Этот элемент имеет
мРНК связывают KH белки, которые подробно
большое значение для осуществления альтерна
рассмотрены в обзоре Makeyev et al. [6].
тивного сплайсинга при дифференцировке ней
За последние десятилетия список таких при
ронов. Также было показано, что такие мотивы
меров продолжает расти. Экспрессия ДНК по
БИОХИМИЯ том 84 вып. 3 2019
KH ДОМЕННЫЕ ПОЛИ(С) СВЯЗЫВАЮЩИЕ БЕЛКИ
317
лимеразы Н (POLH) регулируется посредством
Благодаря способности КН белков связы
стабилизации мРНК с помощью Pcbp1, которая
ваться с мРНК, в некоторых случаях их регуля
непосредственно связывается с 3' UTR мРНК
торная активность наблюдается на уровне
POLH. POLH принадлежит к Y семейству ДНК
трансляции. Торможение трансляции мРНК
полимераз и необходима для восстановления
15 липоксигеназы (LOX) тесно связано с образо
повреждений ДНК, вызванных ультрафиолето
ванием комплекса с эволюционно консерватив
вым облучением и канцерогенами посредством
ным многократно повторяющимся CU богатым
синтеза поврежденной ДНК [41]. C богатый
мотивом (DICE, differentiation control element) в
элемент в 3' UTR мРНК MOR образует комп
3' UTR. Этот DICE элемент связывает hnRNP K
лекс с Pcbp1, что приводит к стабилизации этой
и Pcbp1, что приводит к образованию трансля
мРНК. Нокдаун Pcbp1 уменьшает период полу
ционно неактивной мРНК в эритроидных клет
жизни мРНК MOR, что приводит к снижению
ках предшественниках и в трансфицированных
экспрессии белка [42]. Кроме того, в клетках
клетках [52]. Исследования механизмов показа
нейробластомы человека hnRNP K и Pcbp1 ин
ли, что белки hnRNP K и Pcbp1 ингибируют
дуцируют транслокацию мРНК MOR к трансля
DICE содержащую мРНК, препятствуя соеди
ционно активной полисомной фракции [43].
нению субъединицы 60S с комплексом 40S на
Связывание Pcbp1 с 3' UTR мРНК ингибитора
инициаторном кодоне AUG [53]. Частично очи
клеточного цикла p27Kip1 (p27) через домен KH1
щенные рекомбинантные hnRNP K, Pcbp1 и
стабилизирует мРНК и активирует экспрессию
Pcbp2 могут специфично связывать мРНК папил
р27 [44]. Белок Mena - регулятор актина - сти
ломавируса (HPV 16). Такое связывание, кото
мулирует образование рибонуклеопротеинового
рое происходило на 3' конце мРНК, эффектив
комплекса, который включает hnRNP K и Pcbp1,
но ингибировало трансляцию мРНК HPV 16 in
а также регулирует локальную трансляцию со
vitro [54]. Фосфорилирование Pcbp1, опосредо
тен специфических мРНК при развитии аксо
ванное трансформирующим фактором роста β
нов [45]. Систематическая оценка аксональных
(TGF β), приводит к активации эпителиально
мРНК, взаимодействующих с hnRNP K, пока
мезенхимального перехода (EMT) при участии
зала наличие hnRNP K в РНК регулонах, свя
факторов disabled 2 (Dab2) и интерлейкинпо
занных с ростом аксонов [46]. Белок hnRNP K
добного индуктора ЕМТ (ILEI). Нефосфорили
также обеспечивает стабилизацию и перенос
рованный Pcbp1 связывает 33 нуклеотидный
транскриптов в дендритах нейронов [47].
структурный элемент (BAT) в 3' UTR транс
Pcbp1 взаимодействует с проксимальным
криптов Dab2 и ILEI, подавляя их трансляцию.
цис элементом и стабилизирует мРНК фактора
Активация TGF β приводит к фосфорилирова
ингибирования лейкемии (lif), мощным плейот
нию Ser 43 Pcbp1 и к освобождению этого белка
ропным цитокином, вовлеченным в различные
из элемента BAT с последующей трансляцион
биологические процессы [48]. Недавно был
ной активацией мРНК Dab2 и ILEI [55].
описан интересный пример положительной об
В противоположность ингибированию
ратной связи для Pcbp1 в клетках плаценты че
трансляции можно привести несколько приме
ловека. Высокоаффинное взаимодействие меж
ров участия этих белков в трансляционной ак
ду Pcbp1 и 25 нуклеотидным цис элементом в
тивации. Evans et al. показали, что hnRNP K,
5' UTR мРНК Pcbp1 приводило к увеличению
Pcbp1 и Pcbp2 специфически взаимодействуют и
этих РНК белковых комплексов и трансляции
связываются с сайтом входа рибосомы (IRES)
Pcbp1 [49]. В отличие от подавляющего большин
мРНК c Myc. Кроме того, добавление кДНК
ства данных о позитивной регуляции экспрес
этих белков увеличивало активность IRES in vivo
сии генов КН белками, Pcbp2 отрицательно
[56]. Pcbp2 специфически взаимодействует с ос
влияет на уровень мРНК G белок ассоцииро
новным доменом IV в IRES полиовируса и явля
ванного рецептора 56 (GPR56). Pcbp2 ингибиру
ется важным фактором эффективной трансля
ет экспрессию GPR56 - регулятора индуциро
ции полиовирусной РНК в клетках HeLa [57].
ванной гипертрофии мышц при механической
Показано также, что 5' концевая структура
перегрузке. Также Pcbp2 способствует дегенера
(«клеверный лист», (5'CL) Pcbp комплекс) не
ции мРНК GPR56 в кардиомиоцитах, действуя
обходима для оптимальной трансляции поливи
как фактор, препятствующий гипертрофии в
русной РНК, причем домен KH3 Pcbp2 был
этих клетках [50].
идентифицирован как наиболее важная функ
Таким образом, вывод о роли KH белков в ка
циональная область [58]. Рcbp1 и Pcbp2 стиму
честве детерминант стабильности эукариотичес
лируют трансляцию путем взаимодействия со
кой мРНК, сделанный примерно два десятиле
структурой IRES в мРНК мишенях, как видно
тия назад [51], до сих пор поддерживается расту
на примерах полиовируса [59] и мРНК Bag1 [60].
щим числом экспериментальных доказательств.
Таким образом, взаимодействие поли(С) связы
БИОХИМИЯ том 84 вып. 3 2019
318
НАЗАРОВ и др.
вающих белков с мРНК может способствовать
гема в эритропоэтических тканях и развитию
как сайленсингу, так и стимуляции трансляции
микроцитарной анемии [7]. Снижение уровня
и, по видимому, зависит от молекул партнеров
Pcbp1 или Pcbp2 в клетках с помощью малых ин
и типа клеток.
терферирующих РНК (siРНК) приводило к по
Описание необычной роли КН белков в
тере активности железозависимых пролилгид
сдвиге рамки считывания дополняет список
роксилаз (PHD), что проявлялось в уменьшении
функций этих белков. Трансляционный конт
пролилгидроксилирования, индуцируемого при
роль посредством запрограммированного рибо
гипоксии фактора α (HIF1α), в нарушении де
сомального сдвига рамки считывания (PRF, pro
градации HIF1α по VHL/протеасомному пути и
grammed ribosomal frameshifting), широко ис
накоплению активного транскрипционного фак
пользуемого вирусами, также был задокументи
тора HIF1. В свою очередь, этот фактор спосо
рован и для клеточных генов. Например, было
бен активировать экспрессию >100 генов, участ
показано, что транс активация сдвига рамки
вующих в адаптации к пониженному уровню
считывания выполняется белковым комплек
кислорода [65]. Pcbp1 и Pcbp2 необходимы для
сом, состоящим из субъединицы вирусной реп
того, чтобы обеспечивать двухвалентным железом
ликации nsp1β и клеточных КН белков. Комп
дезоксигидрогеназу гидроксилазу (DOHH) [66],
лекс Pcbp/nsp1β связывается с C богатой после
которая катализирует вторую стадию превраще
довательностью ниже «скользкой» последова
ния лизинового остатка в гипузин. Эта реакция
тельности и, тем самым, имитирует активность
жизненно важна и характерна для всех эукариот.
стимулятора PRF. Не все КН белки способны
В клетках со сниженным уровнем Pcbp1 или
стимулировать PRF. Отсутствие такой активнос
Pcbp2 накапливается деоксигипузин, а содержа
ти для Pcbp4 и hnRNP K может быть следствием
ние гипузина уменьшается, что указывает на по
отличий в их структурной организации [61].
терю активности DOHH из за недостатка железа
Обмен железа. Железо необходимо для жиз
в качестве кофактора [66]. Pcbp2 образует функ
ни, но оно также может привести и к гибели
циональную единицу с гемоксидазой 1 (HO1) и
клеток [62, 63]. Железо участвует во многих важ
NADPH цитохромредуктазой P450 (CPR), ко
ных биологических процессах, включая перенос
торая интегрирует катаболизм гема со связыва
кислорода (гемоглобин), биосинтез ДНК (ко
нием и переносом железа с помощью Pcbp2.
фактор рибонуклеотидредуктазы) и образова
Именно KH3 домен Pcbp2 является значимым
ние АТP (кофактор для многих белков в цикле
для взаимодействия HO1/Pcbp2 [67]. Накопле
лимонной кислоты и цепях переноса электро
ние железа может стимулировать аутоиммунные
нов). Эукариотические клетки содержат сотни
заболевания путем ускорения синтеза провоспа
металлопротеинов, поддерживаемых внутрикле
лительных цитокинов. Wang et al. показали, что
точными системами, которые координируют
железо активирует экспрессию провоспалитель
поглощение и распределение ионов металлов и
ных цитокинов в Т клетках путем регуляции
металлосодержащих кофакторов. Известно, что
уровня белка Pcbp1. Недостаток Pcbp1 или бло
раковые клетки накапливают внутриклеточное
када поглощения железа в аутореактивных Т клет
железо в результате изменения регуляции его
ках препятствуют индукции экспериментально
метаболизма, частично путем стимуляции ак
го аутоиммунного энцефаломиелита [68]. Pcbp2
тивности генов, участвующих в поглощении же
представлен на относительно высоком уровне
леза [62, 64]. Pcbp1 и Pcbp2 являются важными
по сравнению с таковым Pcbp1 в клетках линии
шаперонами железа в цитозоле и ядре клетки:
G1E ER4, являющихся эмбриональными ство
они связывают железо, доставляя его фермен
ловыми клетками мыши (mESC), однако он не
там, на хранение к ферритину или на экспорт
обнаруживается в комплексе с ферритином в
через ферропортин. Pcbp3 и Pcbp4 экспрессиру
этих клетках. Pcbp2 обладает активностью ша
ются на более низком уровне, что может быть
перона железа, но его функция часто отличается
причиной их невысокой эффективности в каче
от таковой Pcbp1 в большинстве клеток. В отли
стве шаперонов. Доставка железа к ферритину,
чие от Pcbp1, Pcbp2 связывается и активирует
регулируемая с помощью Pcbp1, является важ
мембранные транспортеры, участвующие в им
ным звеном в обмене железа в эритроцитах. При
порте и оттоке железа [69, 70].
нарушении этого процесса возникают дефекты
Следует отметить, что Pcbp1 и Pcbp2 играют
синтеза гема. Процесс доставки железа, вероят
заметную роль в метаболизме железа, что важно
но, играет важную роль при дифференцировке
учитывать при интерпретации результатов экс
клеток, поскольку связывание Pcbp1 с феррити
периментов с регуляцией уровня экспрессии
ном на ранних стадиях дифференцировки вы
этих белков.
ше, а на более поздних - ниже. Постнатальный
Другие функции. Благодаря способности взаи
дефицит Pcbp1 у мышей приводит к дефициту
модействовать со многими элементами в нукле
БИОХИМИЯ том 84 вып. 3 2019
KH ДОМЕННЫЕ ПОЛИ(С) СВЯЗЫВАЮЩИЕ БЕЛКИ
319
иновых кислотах и широким спектром белков,
циклинов A2, D1 и E2, необходимых для нор
неудивительно, что KH белки могут выполнять
мального осуществления всех событий клеточ
многие другие функции, примеры которых опи
ного цикла, была значительно снижена в клет
саны ниже.
ках с дефицитом hnRNP K. В то же время экс
С помощью иммунопреципитации хромати
прессия мРНК G0S2 (G0/G1 switch 2) была по
на (ChIP) выявлено связывание hnRNP K с ря
вышена, что может приводить к остановке кле
дом немедленных ранних генов (IEG), включая
точного цикла. Количественный анализ hnRNP K
EGR (early growth response protein 1) и ZFP36
в промоторных областях генов с помощью им
(zinc finger protein 36 homolog), с наиболее высо
мунопреципитации хроматина (ChIP) и коли
кими значениями плотности в сайтах термина
чественной ПЦР (qPCR) показал, что нокдаун
ции транскрипции. Также hnRNP K может иг
hnRNP K приводил к снижению уровня hnRNP K
рать роль в привлечении 5' 3' экзонуклеазы
в промоторных областях циклина D1 и G0S2,
XRN2 в эти локусы генов, тем самым участвуя в
где уровень РНК полимеразы II либо снижался
согласовании процессинга 3' конца пре мРНК и
(в случае циклина D1), либо увеличивался (в слу
терминации транскрипции [71]. Кроме этого,
чае G0S2) [79].
hnRNP K участвует во взаимодействии крити
Белковый фактор MYU - прямая мишень
ческого элемента Xist РНК (XR PID) с иници
сигнального пути Wnt/c Myc - активируется в
ирующим комплексом поликомб (PCGF3/5
большинстве видов опухолей толстой кишки и
PRC1) для установления хромосомного сайлен
определяет их опухолегенность. MYU связыва
синга [72]. Показано, что hnRNP K ингибирует
ется с hnRNP K для стабилизации экспрессии
индуцированную тепловым шоком транскрип
циклинзависимой киназы 6 (CDK6) и тем са
ционную активность фактора теплового шока 1
мым способствует переходу G1 S клеточного
(HSF1), непосредственно взаимодействуя с ним,
цикла. Эти результаты свидетельствуют о том,
что приводит к подавлению трансляции мРНК
что ось MYU/hnRNP K/CDK6 функционирует
hsp70 и hsp27. Взаимодействие белка Pcbp1 чело
по сигналу Wnt/c Myc и играет критическую
века с сильно окисленной мРНК индуцирует реак
роль в пролиферации и опухолегенности рако
ции, связанные с апоптозом, включая активацию
вых клеток толстой кишки [80]. Полоподобные
каспазы 3 и расщепление PARP1 (Poly[ADPribose]
киназы 1 (PLK1), как и hnRNP K, положитель
polymerase 1), запускающих апоптоз клеток [73].
но связаны со злокачественными опухолями не
скольких типов, и высокий уровень их экспрес
сии коррелирует с неблагоприятным прогнозом
КН ДОМЕННЫЕ БЕЛКИ
[81]. Нокдаун hnRNP K приводит к уменьше
В БИОЛОГИЧЕСКИХ ПРОЦЕССАХ
нию экспрессии PLK1, и, наоборот, избыточная
экспрессия hnRNP K способствует увеличению
Клеточный цикл и рак. К настоящему време
уровня PLK1. hnRNP K стимулирует экспрес
ни опубликован значительный объем данных о
сию PLK1 через KH1 и KH2 домен зависимые
влиянии КН белков на клеточный цикл и/или
взаимодействия с 3' UTR мРНК PLK1. Было
опухолевый рост, однако некоторые из результа
также обнаружено, что подавление PLK1 путем
тов являются довольно неоднозначными и про
сайленсинга hnRNP K снижает способность
тиворечивыми. Как hnRNP K, так и Pcbp1 в од
клеток к делению и индуцирует апоптоз [81].
них случаях могут выступать в качестве опухоле
Кроме того, hnRNP K и матриксная металлоп
вых супрессоров, а в других - в качестве онкоге
ротеиназа 2 (MMP2) были идентифицированы как
нов (табл. 1).
жизненно важные мишени для DOC 2/DAB2
Экспрессия hnRNP K повышена в злокачест
взаимодействующего белка (DAB2IP) в раковых
венных опухолях человека различных типов, и
клетках прямой кишки (CRC). Снижение уров
аберрантная локализация этого белка в цито
ня DAB2IP увеличивает экспрессию hnRNP K
плазме обычно связана с плохим клиническим
через сигнальный путь MAPK/ERK. Транслока
прогнозом у больных раком. Например, увели
ция hnRNP K в ядро усиливает транскрипцион
чение экспрессии hnRNP K коррелирует с пло
ную активность MMP2 и способствует инвазии
хим прогнозом для пациентов с меланомой,
CRC и метастазированию [82]. Кроме того, нок
простатитом, раком груди, легких и пищевода,
даун hnRNP K ингибировал гены хеморезисте
колоректальным и гепатоцеллюлярным видами
нтности, такие как ERCC1 и ERCC4, однако сти
рака [74-78]. Нокдаун hnRNP K значительно
мулировал проапоптотические гены, такие как
ингибировал рост опухолевых клеток мочевого
CASP7 (ген каспазы 7) и XAF1 [79]. Снижение
пузыря [79]. Напротив, повышенная экспрессия
экспрессии hnRNP K способствует также повы
hnRNP K способствовала росту опухолевых кле
шению уровней каспазы 8 и каспазы 3, усиле
ток и образованию колоний. Экспрессия мРНК
нию апоптоза клеток и остановке клеточного
БИОХИМИЯ том 84 вып. 3 2019
320
НАЗАРОВ и др.
Таблица 1. Противоположные функции KH доменных поли(С) связывающих белков в опухолевых клетках
Белок
Вид рака/клетки
Эффект/функция
Мишень
Ссылка
hnRNP K
рак мочевого пузыря
онкоген
промоторы циклина D1 и G0S2
[79]
hnRNP K
рак толстой кишки
онкоген
мРНК CDK6
[80]
hnRNP K
несколько видов рака
онкоген
мРНК PLK1
[81]
hnRNP K
колоректальный рак
онкоген
MMP2
[82]
hnRNP K
рак желудка
онкосупрессор
p53/p21/CCND1
[85]
hnRNP K
острый миелоидный лейкоз
онкосупрессор
p21
[86]
Pcbp1 и Pcbp2
K562
контроль клеточного цикла
мРНК p21
[93]
Pcbp1
NMuMG
контроль клеточного цикла
мРНК Cdc27
[94]
Pcbp1
K562, MEL
контроль клеточного цикла
мРНК CDK2
[95]
Pcbp1
A2780, MDA MB 231
онкосупрессор
мРНК p27
[44]
Pcbp1
рак простаты
онкосупрессор
MAPK1
[96]
Pcbp1
рак молочной железы
онкосупрессор
мРНК PNUTS
[98]
Pcbp1
несколько видов рака
онкоген
мРНК CD44 и др.
[102]
цикла подоцитов на стадии G0/G1, что приво
c Myc соответственно. hnRNP K также непо
дит к протеинурии при многих хронических за
средственно влияет на экспрессию как онкоге
болеваниях почек [83]. hnRNP K участвует в
нов, так и опухолевых супрессоров, таких как
функционировании MYC регулируемых длин
SRC, MYC, HDM2 и EIF4E, благодаря его пря
ных некодирующих РНК (MYCLos), которые
мому связыванию с C богатыми областями в
имеют значение в трансформации рака и канце
промоторах генов этих факторов [4, 17, 87, 88].
рогенезе. MYCLos играют роль в пролиферации
В дополнение к регуляции экспрессии многих
клеток и клеточном цикле, регулируя экспрес
белков посредством связывания с промоторами
сию генов мишеней MYC, таких как ген белка
hnRNP K может действовать с помощью других
ингибитора циклин зависимой киназы
1А
механизмов и при этом влиять на экспрессию
(CDKN1A, p21) и 2B (CDKN2B, p15) [84].
генов в раковых клетках. Например, hnRNP K
Недавно были описаны примеры функциони
регулирует экспрессию гена путем прямого
рования hnRNP K в качестве опухолевого суп
взаимодействия с TATA связывающим белком
рессора. Повышенная экспрессия hnRNP K ин
(TBP) [89], связывания с lincRNA 21 [90, 91], а
гибировала пролиферацию клеток рака желудка
также путем взаимодействия с репрессивным
через сигнальный путь p53/p21/CCND1 и подав
комплексом Polycomb через его основной ком
ляла рост опухоли. Биоинформатический анализ
понент - Eed [92]. Таким образом, hnRNP K за
показал, что ассоциированные с hnRNP K гены
действован в чрезвычайно разнообразных регу
были связаны с клеточным циклом и процессом
ляторных путях и механизмах, что отражается в
репликации ДНК. Анализ белок белковых взаи
широком спектре различных эффектов.
модействий показал, что hnRNP K физически
Белки Pсbp1 и Pcbp2 также являются важны
взаимодействует с опухолевыми антигенами p53,
ми эффекторами клеточного цикла и, как след
p21 и продуктами других генов, оказывающими
ствие, оказывают значительное влияние на опу
влияние на опухолевый рост. Нокдаун hnRNP K
холи, где они часто действуют как онкосупрес
в клетках рака желудка блокировал сигнальный
соры (табл. 1). Комбинированное ингибирова
путь p53 и уменьшал уровень экспрессии p53 и
ние синтеза Pcbp1 и Pcbp2 приводило к замедле
p21, в то время как повышенная экспрессия
нию клеточной пролиферации и к задержке кле
hnRNP K демонстрировала противоположный
ток в фазе G1 клеточного цикла. Эффект комби
эффект [85]. Gallardo et al. показали, что сниже
нированного ингибирования выявил индукцию
ние экспрессии hnRNP K ведет к усилению
мРНК и белка p21. Было обнаружено, что мРНК
пролиферации острой миелоидной лейкемии,
p21 взаимодействует с белками Pcbp1 и Pcbp2,
которая напрямую связана со сниженной спо
благодаря чему достигается ее стабилизация.
собностью к активации транскрипции p21 [86].
Эти данные свидетельствуют о том, что Pcbp1 и 2
Два классических сигнальных пути, онкосуп
играют роль в p53 независимом контроле кле
рессивный и онкогенный, находятся непосредст
точного цикла посредством посттранскрипцион
венно под влиянием hnRNP K: пути p53/p21 и
ной модуляции экспрессии гена p21 [93]. Гомо
БИОХИМИЯ том 84 вып. 3 2019
KH ДОМЕННЫЕ ПОЛИ(С) СВЯЗЫВАЮЩИЕ БЕЛКИ
321
лог белка цикла клеточного деления 27 (CDC27)
сией и 47 транскриптов с повышенной экспрес
является основным компонентом способствую
сией. Онтологический анализ выявленных транс
щего развитию анафазы комплекса, осцилля
криптов позволил идентифицировать их как
торная активность которого отвечает за переход
связанные с нейрональными, метаболическими
метафазы в анафазу и митотический исход.
сигнальными путями (Wnt, TGF β), регулятора
Синтез белка CDC27 контролируется посттранс
ми развития, ядерными рецепторами, фактора
крипционно через Pcbp1. Нарушение Pcbp1
ми дифференцировки и трансляции [101].
опосредованной трансляционной регуляции
Pcbp1 является одной из мишеней пути
CDC27 приводит к нестабильности хромосом и
TGF β, посредством которого Pcbp1 становится
анеуплоидии. При этом уровень белка CDC27
фосфорилированным. TGF β опосредованное
представляет собой надежный маркер рецидива
фосфорилирование Pcbp1 индуцирует EMT с
рака молочной железы [94]. Связывание Pcbp1 с
последующим развитием и метастатическим
C богатым полипиримидиновым трактом, пред
прогрессированием опухолей [55]. В раковых клет
шествующим экзону 5 в транскрипте регулятора
ках фосфорилированный по С концу SMAD3
клеточного цикла - циклинзависимой киназы 2
ассоциируется с Pcbp1, связывает пре мРНК, ин
(CDK2) - усиливает включение этого экзона.
гибирует привлечение вспомогательного факто
Исключение экзона 5 из мРНК CDK2 резко по
ра 2 U2 snRNP (U2AF2) и сплайсосомную сбор
давляет экспрессию белка CDK2, что приводит
ку на субоптимальных экзонах. Это влияет на
к нарушению кинетики клеточного цикла [95].
альтернативный сплайсинг CD44 и других генов,
Ингибитор клеточного цикла p27Kip1 (p27) явля
связанных с EMT, которые способствуют разви
ется новым транскриптом, связанным с Pcbp1.
тию раковых опухолей [102]. С другой стороны,
Повышенный уровень белка р27 последователь
снижение уровня белка Pcbp1 может привести к
но ингибирует клеточную пролиферацию, ход
стимулированию опухолевого роста. Ингибин
событий клеточного цикла и канцерогенез.
(Inhibin) βA, член надсемейства TGF β, транс
Нокдаун Pcbp1, в свою очередь, компрометиру
ляционно регулируется TGF β через Pcbp1. Об
ет стабильность мРНК р27, что приводит к сни
работка TGF β или нокдаун Pcbp1 активирует
жению уровня белка р27 и к повышению опухо
трансляцию транскрипта ингибина βA, что при
легенеза in vivo [44].
водит к увеличению экспрессии и секретируе
Pcbp1 может действовать как супрессор опу
мых уровней ингибина βA. Такая повышающая
холи в эпителиальных клетках предстательной
трансляционная регуляция ингибина βA усили
железы путем ингибирования экспрессии мито
вает миграцию и инвазию клеток, которые
ген активируемой протеинкиназы 1 (MAPK1) [96].
прошли EMT, и способствует злокачественному
Экспрессия Pcbp1 и микроРНК 3978 (miR 3978)
росту in vivo [103].
подавляется при метастазировании перитоне
Таким образом, функции как hnRNP K, так и
ального рака желудка. Возобновление нормаль
Pcbp1 довольно разнообразны, а их влияние может
ной экспрессии Pcbp1 или miR 3978 в клеточ
приводить к различным последствиям для клеток.
ной линии перитонеального метастаза умень
По видимому, проявление тех или иных функций
шало синтез белка легумаина и хемосенсибили
этих белков зависит от типа клеток или тканей.
зировало клетки, что облегчало воздействие на
Раннее развитие, плюрипотентность и диффе
них доцетаксела [97]. Связывание Pcbp1 со струк
ренцировка клеток. hnRNP K экспрессируется
турным элементом, расположенным в экзоне 12
на высоком уровне в ооцитах и преимплантаци
мРНК PNUTS (также известной как PPP1R10),
онных эмбрионах мышей. В ооцитах hnRNP K
регулирует ее альтернативный сплайсинг. Отсут
накапливается в зародышевой везикуле, где он
ствие Pcbp1 в этом структурном элементе в ре
кластеризован. После распада зародышевой ве
зультате сайленсинга дает ход альтернативному
зикулы hnRNP K распределяется по цитоплаз
сплайсингу мРНК PNUTS, в результате которого
ме диффузно. Однако после оплодотворения бе
генерируется некодирующая изоформа PNUTS
лок перераспределяется в пронуклеусы самки и
(lncRNA PNUTS). В мезенхимальных опухолевых
самца, а впоследствии наблюдается в ядрах
клетках молочной железы и в образцах опухолей
бластомера [104].
молочной железы экспрессия lncRNA PNUTS
Через четыре дня после нокдауна hnRNP K в
повышена [98]. Pcbp1 действует как онкогенный
эмбриональных стволовых клетках мыши (mESC)
и метастатический супрессор в опухолевых
наблюдалось значительное уменьшение общего
клетках желудка, прямой кишки и легких [99] и
количества клеток в культуре, образование ти
ингибирует метастазы при раке легкого [100].
пичных колоний, а экспрессия маркеров плю
При подавлении эндогенного Pcbp1 в клетках
рипотентности Oct4, Nanog и Sox2 была значи
нейробластомы человека были идентифициро
тельно снижена. Кроме того, методом иммуно
ваны 328 транскриптов с уменьшенной экспрес
преципитации хроматина с помощью антител к
3 БИОХИМИЯ том 84 вып. 3 2019
322
НАЗАРОВ и др.
hnRNP K продемонстрировано присутствие это
торов плюрипотентности, не выявил значитель
го белка в промоторных областях, ассоцииро
ного эффекта ни hnRNP K, ни Pcbp1-4 как в
ванных с плюрипотентностью генов Nanog, Sox2
mESC [108], так и в эмбриональных стволовых
и Fgf4 в составе активационного комплекса с не
клетках человека (hESC) [107]. Однако hnRNP K
кодирующей РНК TUNA (Tcl1 Upstream Neuron
был первым в списке факторов, важных для про
Associated lincRNA) [105]. Эти факты указывают
лиферативной активности hESC [107]. В другом
на активирующий эффект hnRNP K, однако име
исследовании показано, что при нокдауне
ются другие данные, которые контрастируют с
hnRNP K экспрессия 264 генов была усилена, а
заключением относительно участия hnRNP K в
26 генов - подавлена [109]. Значительных изме
регуляции генов, контролирующих плюрипотент
нений в синтезе мРНК факторов плюрипотент
ность (табл. 2). Например, было продемонстри
ности не было обнаружено, однако продемон
ровано, что при репрограммировании эмбрио
стрировано повышение уровней мРНК марке
нальных фибробластов мыши в индуцирован
ров энтодермы и мезодермы: Gata6, Gata3, Tbx3,
ные плюрипотентные стволовые клетки (iPSC)
Tbx20, Foxa1, Nkx2 9 и Nkx2 2. Экспрессия
hnRNP K инактивирует ряд генов плюрипотент
Gata6 была настолько значительно увеличена в
ности посредством поддержания метилирова
клетках с нокдауном hnRNP K [109], что само
ния H3K9me3 и CpG в промоторах этих генов пу
по себе должно быть достаточным для индуци
тем взаимодействия с некодирующей РНК -
рования потери плюрипотентности и переходу к
lincRNA p21 [106]. Когда концентрация lincRNA p21
энтодермальной дифференцировке [110]. Несмот
или мРНК hnRNP K была экспериментально
ря на то что hnRNP K занимает ключевые регу
снижена, уровень мРНК многих генов регуля
ляторные элементы гена Oct4 in vivo (рис. 1), но
торов плюрипотентности, таких как Esrrb,
каут гена hnRNP K с использованием методики
Lin28a, Utf1, Nr5a2, Sall4, Lefty2 и Nanog, был зна
для направленного редактирования геномов
чительно увеличен [106]. Кроме того, в несколь
(CRISPR/Cas9) не оказывает заметного влияния
ких исследованиях [107-109] не было обнаруже
на экспрессию белка Oct4 в mESC (рис. 2, неопуб
но влияния нокдауна hnRNP K на экспрессию
ликованные данные).
плюрипотентных факторов. siРНК скрининг
Используя эмбриональные фибробласты мы
генов, влияющих на экспрессию основных фак ши и гемопоэтические стволовые клетки пред
Таблица 2. Влияние потери функции KH белков на экспрессию факторов, ассоциированных с плюрипотентностью,
пролиферативную активность клеток и развитие эмбриона
Воздействие
Эффект
Ссылка
Нокдаун hnRNP K
снижение уровней Oct4, Sox2, Nanog в mESC
[105]
Нокдаун hnRNP K
повышение уровней Esrrb, Lin28a, Utf1, Nr5a2, Sall4, Lefty2, Nanog
[106]
при репрограммировании эмбриональных фибробластов мыши
в индуцированные плюрипотентные стволовые клетки (iPSC)
Нокдаун Pcbp1 или Pcbp2 или hnRNP K
отсутствие значительного влияния на экспрессию Oct4 в mESC
[108]
Нокдаун Pcbp1 или Pcbp2 или hnRNP K
отсутствие значительного влияния на экспрессию маркеров
[107]
плюрипотентности в hESC
Нокдаун hnRNP K
отсутствие влияния на экспрессию маркеров плюрипотент
[109]
ности, значительно повышен уровень Gata6 и Gata3 в mESC
Нокдаун hnRNP K
снижение пролиферативной активности hESC
[107]
Гаплонедостаточность hnRNP K
стимуляция клеточной пролиферации эмбриональных фибро
[86]
бластов мыши и гемопоэтических стволовых клеток предшест
венников (mHSC)
Биаллельная делеция hnRNP K
гибель эмбриона на 13-14 й день
[86]
Биаллельная мутация Pcbp1
гибель эмбриона на 3-8 й день
[115], [116]
Биаллельная мутация Pcbp2
гибель эмбриона на 12-14 й день
[115]
БИОХИМИЯ том 84 вып. 3 2019
KH ДОМЕННЫЕ ПОЛИ(С) СВЯЗЫВАЮЩИЕ БЕЛКИ
323
шественники (mHSC), Gallardo et al. продемон
активность PU.1 во время созревания моноци
стрировали, что снижение экспрессии hnRNP K
тов [111]. hnRNP K также имеет значение для
приводит к стимуляции клеточной пролифера
дифференциации остеокластов и участвует в
ции, которая была связана с подавлением транс
нескольких функциях фактора GSK3β, который
крипции p21. Было также показано, что гапло
является критическим для дифференцировки и
недостаточность по hnRNP K приводит к сни
функций этих клеток [112].
жению выживаемости, увеличению образова
Pcbp1 и Pcbp2 также играют важную роль в
ния опухолей, нестабильности генома, а также к
раннем развитии и дифференцировке. Материн
развитию гемопоэтических новообразований с
ский Pcbp1 определяет синхронизацию образо
миелопролиферацией [86]. Наиболее ярким сви
вания нормального пронуклеуса в ооцитах мы
детельством того, что hnRNP K необходим для
ши [113], а также требуется для поддержания
развития, является наблюдение, что биаллель
состояния сайленсинга транскрипции в зрелых
ный нокаут по hnRNP K имеет летальный фено
ооцитах мыши [114]. Мутантные эмбрионы мы
тип на 13-14 й день (E13.5) [86]. hnRNP K и ге
ши, гомозиготные по Pcbp1, погибают в период
мопоэтический фактор транскрипции PU.1
с третьих до восьмых суток развития (E3.5-8.5)
(PU.1) образуют комплекс на промоторе CD11b,
[115, 116]. Эти результаты могут указывать на
белковый продукт которого является маркером
проблему перехода плюрипотентных стволовых
зрелых гранулоцитов и моноцитов. Хотя hnRNP K
клеток от наивного (mESC) к праймированному
и PU.1 действуют синергически во время грану
(EpiSC) состоянию, который происходит вскоре
лоцитарной дифференцировки, hnRNP K, по
после имплантации (E5.5 у мыши). Действитель
видимому, оказывает отрицательное влияние на
но, используя опосредованный CRISPR/Cas9
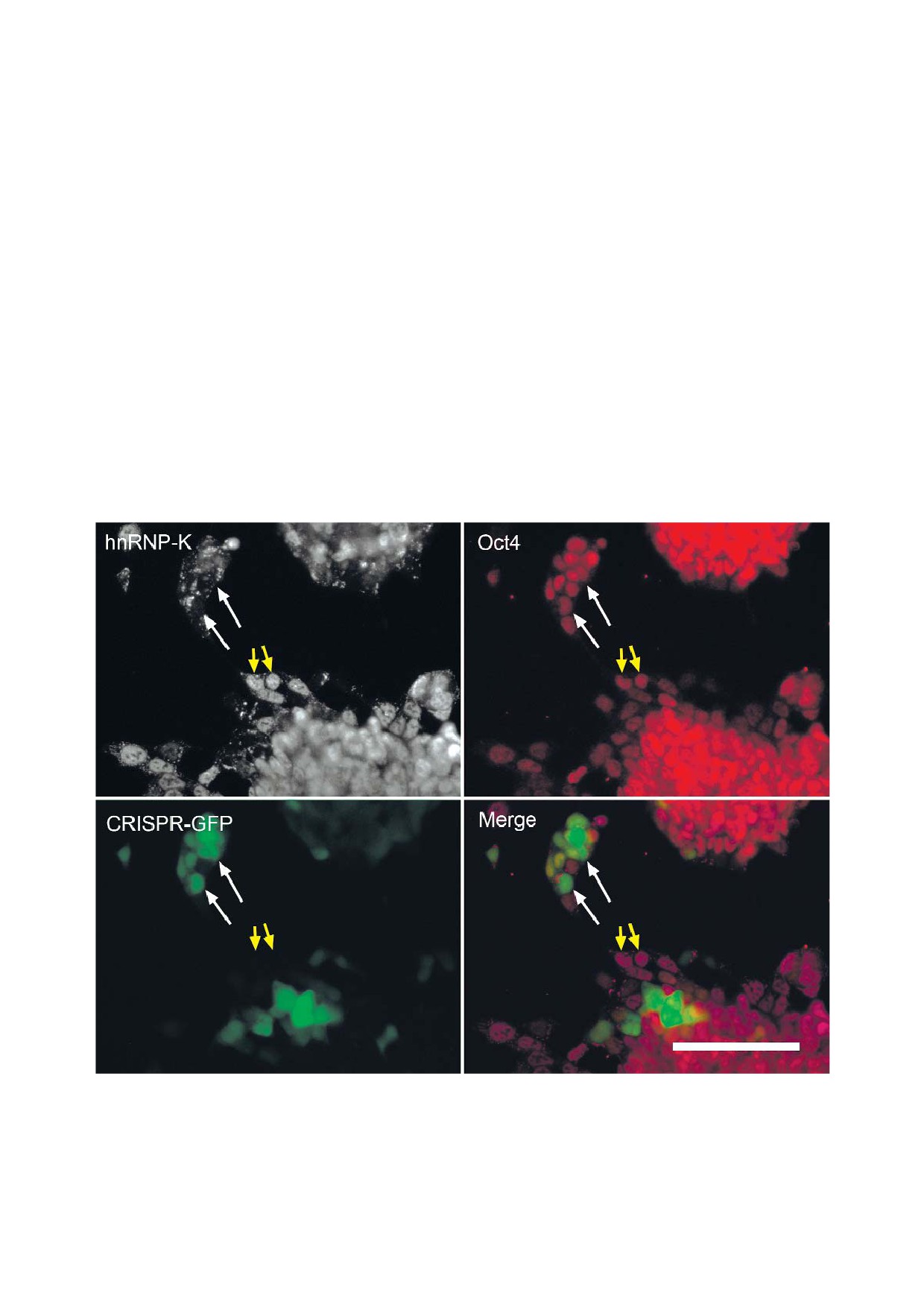
Рис. 2. Нокаут hnRNP K с помощью CRISPR/Cas9 не приводит к изменению уровня белка Oct4 (4 дня после нокаута). Бе
лые стрелки указывают на клетки с нокаутом hnRNP K, желтые стрелки - на клетки дикого типа. Длина масштабного
отрезка - 100 мкм.
С цветным вариантом рис. 2 можно ознакомиться в электронной версии статьи на сайте: www.elibrary.ru
БИОХИМИЯ том 84 вып. 3 2019
3*
324
НАЗАРОВ и др.
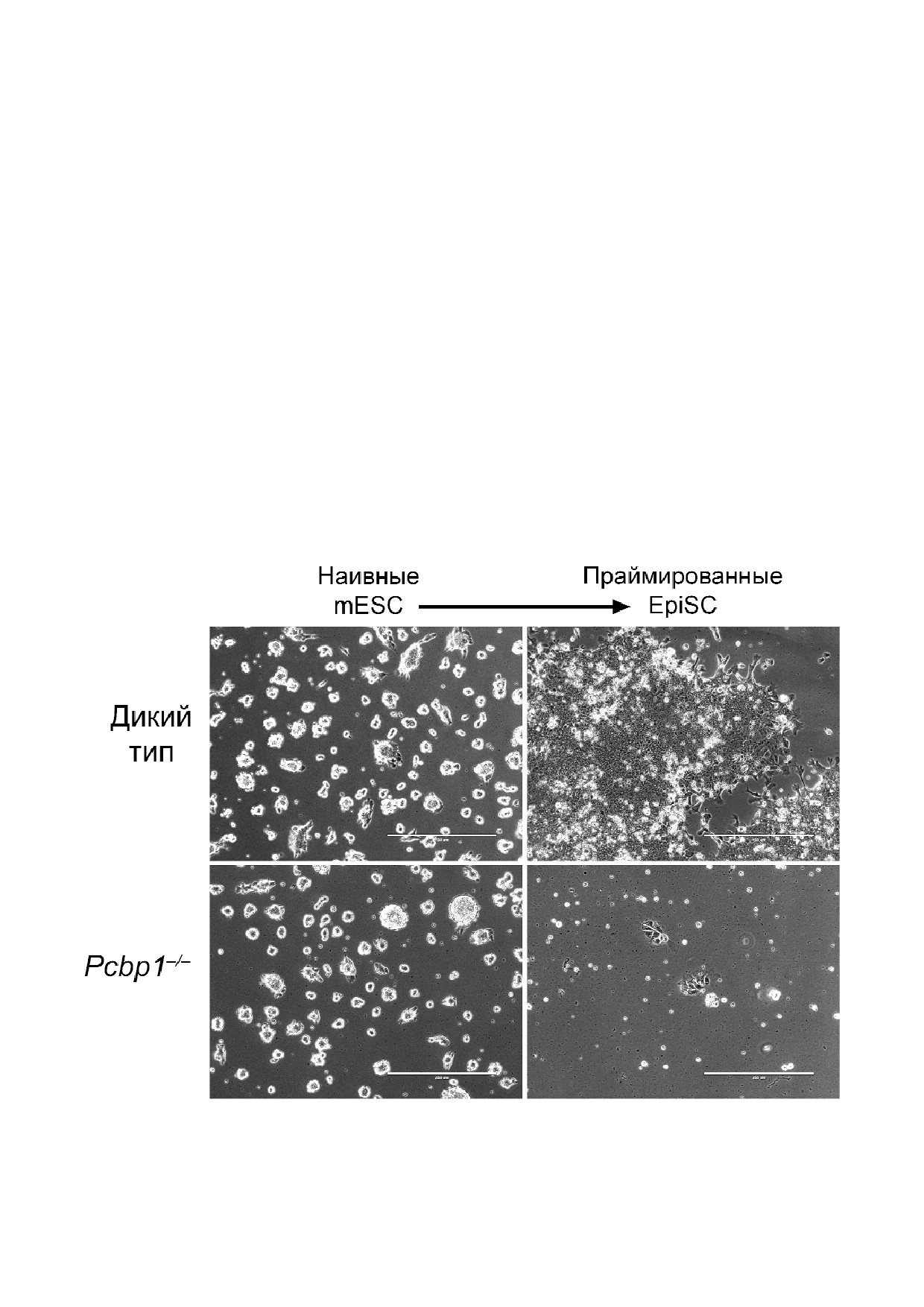
нокаут, мы получили Pcbp1-/- жизнеспособные
ровании гена Pcbp1 в миобластах скелетных
клоны mESC. Во время перехода mESC от наив
мышц мыши с помощью siРНК, так и у мыши с
ного к праймированному (EpiSC) плюрипотент
гипоморфной мутацией по Pcbp1 наблюдалось
ному состоянию in vitro, индуцированному пу
нарушение регуляции пролиферации и диффе
тем изменения условий культивирования [117],
ренцировки мышечных клеток. Кроме того,
мы наблюдали массивную гибель mESC Pcbp1-/-,
Pcbp1 модулировал процессинг обогащенных в
сопровождавшуюся повышением уровня марке
мышцах miR 1, miR 133 и miR 206, физически
ров энтодермы (рис. 3, неопубликованные дан
взаимодействуя с AGO2 (Argonaute 2) и другими
ные). Напротив, развитие гомозигот, мутантных
компонентами, участвующими в регуляции об
по Pcbp2, протекает нормально до второго три
разования miРНК [116]. Утверждается, что Pcbp1
местра беременности (E12.5-13.5), затем наб
является центральным регулятором, необходи
людается значительное снижение жизнеспособ
мым для поддержания стволовых клеток рака
ности эмбрионов, связанное с комбинирован
предстательной железы [118].
ными сердечно сосудистыми и гемопоэтичес
Таким образом, хотя вклад KH доменных
кими аномалиями. Мыши, гетерозиготные по
поли(С) связывающих белков в поддержание
одному из аллелей, имели дефекты только при
плюрипотентности остается неясным, их важ
начальном наборе веса и в послеродовом перио
ная роль в обеспечении ключевых процессов
де [115]. Уровень экспрессии Pcbp1 зависит от
как на ранних стадиях развития организмов, так
стадии развития организма. Например, у мышей
и в клеточной дифференцировке несомненна.
в скелетной мышце на эмбриональных и ранних
стадиях развития детектировали высокие уров
КH доменные поли(С) связывающие белки
ни Pcbp1, тогда как во взрослой мышце содер
являются представителями большой группы
жание Pcbp1 снижалось [116]. Как при ингиби
многофункциональных белков hnRNP, где они
Рис. 3. Переход наивных ESC мыши Pcbp1-/- в праймированное состояние сопровождается массовой гибелью клеток in vitro.
Длина масштабного отрезка - 400 мкм
БИОХИМИЯ том 84 вып. 3 2019
KH ДОМЕННЫЕ ПОЛИ(С) СВЯЗЫВАЮЩИЕ БЕЛКИ
325
представляют собой только отдельные компо
Финансирование
ненты факторов широкого спектра, которые
Работа выполнена при финансовой поддержке
взаимно организуют обширную сеть взаимодей
РНФ (№ 17 14 01407).
ствия сигналов, событий и процессов в живой
клетке. Эти белки, как и hnRNP K, служат для
Конфликт интересов
согласования сигналов под управлением нукле
Авторы декларируют отсутствие конфликта
иновой кислоты, где белки воспринимают, сое
интересов.
диняют и интегрируют сигналы из многих регу
ляторных каскадов [34]. В целом это придает
Соблюдение этических норм
клетке функциональную пластичность, создает
Настоящая статья не содержит описания ка
множество альтернатив в развитии, включая вы
ких либо исследований с использованием лю
бор клеточной судьбы.
дей и животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Siomi, H., Matunis, M.J., Michael, W.M., and Dreyfuss, G.
poly(C) binding protein alpha CP3 as a transcriptional
(1993) The pre mRNA binding K protein contains a novel
repressor of the mu opioid receptor gene, FASEB J., 21,
evolutionarily conserved motif, Nucleic Acids Res., 21,
3963-3973, doi: 10.1096/fj.07 8561com.
1193-1198.
14.
Du, K., Melnikova, I.N., and Gardner, P.D. (1998)
2.
Valverde, R., Edwards, L., and Regan, L. (2008) Structure
Differential effects of heterogeneous nuclear ribonucleo
and function of KH domains, FEBS J., 275, 2712-2726,
protein K on Sp1 and Sp3 mediated transcriptional acti
doi: 10.1111/j.1742 4658.2008.06411.x.
vation of a neuronal nicotinic acetylcholine receptor pro
3.
Choi, H.S., Hwang, C.K., Song, K.Y., Law, P.Y., Wei, L.N.,
moter, J. Biol. Chem., 273, 19877-19883.
and Loh, H.H. (2009) Poly(C) binding proteins as trans
15.
Ritchie, S.A., Pasha, M.K., Batten, D.J.P., Sharma, R.K.,
criptional regulators of gene expression, Biochem. Biophys. Res.
Olson, D.J.H., Ross, A.R.S., and Bonham, K. (2003)
Commun., 380, 431-436, doi: 10.1016/j.bbrc.2009.01.136.
Identification of the SRC pyrimidine binding protein
4.
Gallardo, M., Hornbaker, M.J., Zhang, X., Hu, P., Bueso
(SPy) as hnRNP K: implications in the regulation of
Ramos, C., and Post, S.M. (2016) Aberrant hnRNP K
SRC1A transcription, Nucleic Acids Res., 31, 1502-1513.
expression: аll roads lead to cancer, Cell Cycle, 15,
16.
Thakur, S., Nakamura, T., Calin, G., Russo, A., Tambur
1552-1557, doi: 10.1080/15384101.2016.1164372.
rino, J.F., Shimizu, M., Baldassarre, G., Battista, S.,
5.
Geuens, T., Bouhy, D., and Timmerman, V. (2016) The
Fusco, A., Wassell, R.P., Dubois, G., Alder, H., and Croce, C.M.
hnRNP family: insights into their role in health and disease,
(2003) Regulation of BRCA1 transcription by specific sin
Hum. Genet., 135, 851-867, doi: 10.1007/s00439 016 1683 5.
gle stranded DNA binding factors, Mol. Cell Biol., 23,
6.
Makeyev, A.V., and Liebhaber, S.A. (2002) The poly(C)
3774-3787, doi: 10.1128/mcb.23.11.3774 3787.2003.
binding proteins: a multiplicity of functions and a search
17.
Lynch, M., Chen, L., Ravitz, M.J., Mehtani, S.,
for mechanisms, RNA, 8, 265-278, doi: 10.1007/s00439
Korenblat, K., Pazin, M.J., and Schmidt, E.V. (2005)
016 1683 5.
hnRNP K binds a core polypyrimidine element in the
7.
Philpott, C.C., Ryu, M.S., Frey, A., and Patel, S. (2017)
eukaryotic translation initiation factor 4E (eIF4E) promot
Cytosolic iron chaperones: proteins delivering iron cofac
er, and its regulation of eIF4E contributes to neoplastic
tors in the cytosol of mammalian cells, J. Biol. Chem., 292,
transformation, Mol. Cell Biol., 25, 6436-6453, doi:
12764-12771, doi: 10.1074/jbc.R117.791962.
10.1128/MCB.25.15.6436 6453.2005.
8.
Michelotti, G.A., Michelotti, E.F., Pullner, A., Duncan, R.C.,
18.
Da Silva, N., Bharti, A., and Shelley, C.S. (2002) hnRNP K
Eick, D., and Levens, D. (1996) Multiple single stranded
and Pur(alpha) act together to repress the transcriptional
cis elements are associated with activated chromatin of the
activity of the CD43 gene promoter, Blood,
100,
human c myc gene in vivo, Mol. Cell Biol., 16, 2656-2669.
3536-3544.
9.
Ostrowski, J., Kawata, Y., Schullery, D.S., Denisenko, O.N.,
19.
Lau, J.S., Baumeister, P., Kim, E., Roy, B., Hsieh, T.Y.,
and Bomsztyk, K. (2003) Transient recruitment of the
Lai, M., and Lee, A.S. (2000) Heterogeneous nuclear
hnRNP K protein to inducibly transcribed gene loci,
ribonucleoproteins as regulators of gene expression
Nucleic Acids Res., 31, 3954-3962.
through interactions with the human thymidine kinase
10.
Choi, H.S., Song, K.Y., Hwang, C.K., Kim, C.S., Law, P.Y.,
promoter, J. Cell Biochem., 79, 395-406.
Wei, L.N., and Loh, H.H. (2008) A proteomics approach
20.
Moumen, A., Magill, C., Dry, K.L., and Jackson, S.P.
for identification of single strand DNA binding proteins
(2013) ATM dependent phosphorylation of heterogeneous
involved in transcriptional regulation of mouse mu opioid
nuclear ribonucleoprotein K promotes p53 transcriptional
receptor gene, Mol. Cell Proteomics, 7, 1517-1529, doi: 10.1074/
activation in response to DNA damage, Cell Cycle, 12,
mcp.M800052 MCP200.
698-704, doi: 10.4161/cc.23592.
11.
Kim, S.S., Pandey, K.K., Choi, H.S., Kim, S.Y., Law, P.Y.,
21.
Kaiser, C.E., Van Ert, N.A., Agrawal, P., Chawla, R., Yang, D.,
Wei, L.N., and Loh, H.H. (2005) Poly(C) binding protein
and Hurley, L.H. (2017) Insight into the complexity of the
family is a transcription factor in mu opioid receptor gene
i motif and G quadruplex DNA structures formed in the
expression, Mol. Pharmacol., 68, 729-736.
KRAS promoter and subsequent drug induced gene repres
12.
Rivera Gines, A., Cook, R.J., Loh, H.H., and Ko, J.L.
sion, J. Am. Chem. Soc., 139, 8522-8536, doi: 10.1021/
(2006) Interplay of Sps and poly(C) binding protein 1 on
jacs.7b02046.
the mu opioid receptor gene expression, Biochem. Biophys. Res.
22.
Banerjee, K., Wang, M., Cai, E., Fujiwara, N., Baker, H.,
Commun., 345, 530-537, doi: 10.1016/j.bbrc.2006.04.117.
and Cave, J.W. (2014) Regulation of tyrosine hydroxylase
13.
Choi, H.S., Kim, C.S., Hwang, C.K., Song, K.Y., Law, P.Y.,
transcription by hnRNP K and DNA secondary structure,
Wei, L.N., and Loh, H.H. (2007) Novel function of the
Nat. Commun., 5, 5769, doi: 10.1038/ncomms6769.
БИОХИМИЯ том 84 вып. 3 2019
326
НАЗАРОВ и др.
23.
He, Q., Zeng, P., Tan, J.H., Ou, T.M., Gu, L.Q., Huang, Z.S.,
36.
Expert Bezancon, A., Le Caer, J.P., and Marie, J. (2002)
and Li, D. (2014) G quadruplex mediated regulation of
Heterogeneous nuclear ribonucleoprotein (hnRNP) K is a
telomere binding protein POT1 gene expression, Biochim.
component of an intronic splicing enhancer complex
Biophys. Acta, 1840, 2222-2233, doi: 10.1016/j.bbagen.
that activates the splicing of the alternative exon 6A from
2014.03.001.
chicken beta tropomyosin pre mRNA, J. Biol. Chem., 277,
24.
Saradhi, M., Kumari, S., Rana, M., Mukhopadhyay, G.,
16614-16623, doi: 10.1074/jbc.M201083200.
and Tyagi, R.K. (2015) Identification and interplay of
37.
Cao, W., Razanau, A., Feng, D., Lobo, V.G., and Xie, J.
sequence specific DNA binding proteins involved in regu
(2012) Control of alternative splicing by forskolin through
lation of human Pregnane and Xenobiotic Receptor gene,
hnRNP K during neuronal differentiation, Nucleic Acids
Exp. Cell Res., 339, 187-196, doi: 10.1016/j.yexcr.2015.11.014.
Res., 40, 8059-8071, doi: 10.1093/nar/gks504.
25.
Uribe, D.J., Guo, K., Shin, Y.J., and Sun, D. (2011) Hete
38.
Venables, J.P., Koh, C.S., Froehlich, U., Lapointe, E.,
rogeneous nuclear ribonucleoprotein K and nucleolin as trans
Couture, S., Inkel, L., Bramard, A., Paquet, E.R., Watier, V.,
criptional activators of the vascular endothelial growth factor
Durand, M., Lucier, J.F., Gervais Bird, J., Tremblay, K.,
promoter through interaction with secondary DNA struc
Prinos, P., Klinck, R., Elela, S.A., and Chabot, B. (2008)
tures, Biochemistry, 50, 3796-3806, doi: 10.1021/bi101633b.
Multiple and specific mRNA processing targets for the
26.
Ghosh, A., Abdo, S., Zhao, S., Wu, C.H., Shi, Y., Lo, C.S.,
major human hnRNP proteins, Mol. Cell Biol., 28,
Chenier, I., Alquier, T., Filep, J.G., Ingelfinger, J.R.,
6033-6043, doi: 10.1128/MCB.00726 08.
Zhang, S.L., and Chan, J.S.D. (2017) Insulin Inhibits Nrf2
39.
Weiss, I.M., and Liebhaber, S.A. (1995) Erythroid cell spe
gene expression via heterogeneous nuclear ribonucleopro
cific mRNA stability elements in the alpha 2 globin 3' non
tein F/K in diabetic mice, Endocrinology, 158, 903-919,
translated region, Mol. Cell Biol., 15, 2457-2465.
doi: 10.1210/en.2016 1576
40.
Wang, X., Kiledjian, M., Weiss, I.M., and Liebhaber, S.A.
27.
Sutherland, C., Cui, Y., Mao, H., and Hurley, L.H. (2016)
(1995) Detection and characterization of a 3' untranslated
A mechanosensor mechanism controls the G quadru
region ribonucleoprotein complex associated with human
plex/i motif molecular switch in the MYC promoter NHE
alpha globin mRNA stability, Mol. Cell Biol., 15, 1769-1777.
III1, J. Am. Chem. Soc., 138, 14138-14151, doi: 10.1021/
41.
Ren, C., Cho, S.J., Jung, Y.S., and Chen, X. (2014) DNA
jacs.6b09196.
polymerase eta is regulated by poly(rC) binding protein 1 via
28.
Nazarov, I.B., Krasnoborova, V.A., Mitenberg, A.G.,
mRNA stability, Biochem. J., 464, 377-386, doi: 10.1042/
Chikhirzhina, E.V., Davidov Sinitzin, A.P., Liskovykh, M.A.,
BJ20141164.
and Tomilin, A.N. (2014) Transcription regulation of Oct4
42.
Hwang, C.K., Wagley, Y., Law, P.Y., Wei, L.N., and Loh, H.H.
(Pou5F1) gene by its distal enhancer, Cell Tissue Biol., 8,
(2017) Phosphorylation of poly(rC) binding protein
1
27-32, doi: 10.1134/s1990519x14010106.
(PCBP1) contributes to stabilization of mu opioid receptor
29.
Ji, X., Park, J.W., Bahrami Samani, E., Lin, L., Duncan
(MOR) mRNA via interaction with AU rich element
Lewis, C., Pherribo, G., Xing, Y., and Liebhaber, S.A.
RNA binding protein 1 (AUF1) and poly A binding pro
(2016) αCP binding to a cytosine rich subset of polypyrimi
tein (PABP), Gene, 598, 113-130, doi: 10.1016/j.gene.
dine tracts drives a novel pathway of cassette exon splicing
2016.11.003.
in the mammalian transcriptome, Nucleic Acids Res., 44,
43.
Song, K.Y., Choi, H.S., Law, P.Y., Wei, L.N., and Loh, H.H.
2283-2297, doi: 10.1093/nar/gkw088.
(2017) Post transcriptional regulation of the human mu
30.
Akker, S.A., Misra, S., Aslam, S., Morgan, E.L., Smith, P.J.,
opioid receptor (MOR) by morphine induced RNA
Khoo, B., and Chew, S.L. (2007) Pre spliceosomal binding
binding proteins hnRNP K and PCBP1, J. Cell Physiol.,
of U1 small nuclear ribonucleoprotein (RNP) and hete
232, 576-584, doi: 10.1002/jcp.25455.
rogenous nuclear RNP E1 is associated with suppression of
44.
Shi, H., Li, H., Yuan, R., Guan, W., Zhang, X., Zhang, S.,
a growth hormone receptor pseudoexon, Mol. Endo
Zhang, W., Tong, F., Li, L., Song, Z., Wang, C., Yang, S.,
crinol., 21, 2529-2540, doi: 10.1210/me.2007 0038.
and Wang, H. (2018) PCBP1 depletion promotes tumori
31.
Meng, Q., Rayala, S.K., Gururaj, A.E., Talukder, A.H.,
genesis through attenuation of p27(Kip1) mRNA stability and
O’Malley, B.W., and Kumar, R. (2007) Signaling depen
translation, J. Exp. Clin. Cancer Res., 37, 187, doi: 10.1186/
dent and coordinated regulation of transcription, splicing,
s13046 018 0840 1.
and translation resides in a single coregulator, PCBP1,
45.
Vidaki, M., Drees, F., Saxena, T., Lanslots, E., Taliaferro, M.J.,
Proc. Natl. Acad. Sci. USA, 104, 5866-5871, doi: 10.1073/
Tatarakis, A., Burge, C.B., Wang, E.T., and Gertler, F.B.
pnas.0701065104.
(2017) A requirement for Mena, an actin regulator, in local
32.
Zhang, T., Huang, X.H., Dong, L., Hu, D., Ge, C., Zhan, Y.Q.,
mRNA translation in developing neurons, Neuron, 95,
Xu, W.X., Yu, M., Li, W., Wang, X., Tang, L., Li, C.Y., and
608-622.e605, doi: 10.1016/j.neuron.2017.06.048.
Yang, X.M. (2010) PCBP 1 regulates alternative splicing of
46.
Lee, S.J., Oses Prieto, J.A., Kawaguchi, R., Sahoo, P.K.,
the CD44 gene and inhibits invasion in human hepatoma
Kar, A.N., Rozenbaum, M., Oliver, D., Chand, S., Ji, H.,
cell line HepG2 cells, Mol. Cancer, 9, 72, doi: 10.1186/
Shtutman, M., Miller Randolph, S., Taylor, R.J., Fainzil
1476 4598 9 72.
ber, M., Coppola, G., Burlingame, A.L., and Twiss, J.L.
33.
Lian, W.X., Yin, R.H., Kong, X.Z., Zhang, T., Huang, X.H.,
(2018) hnRNPs interacting with mRNA localization
Zheng, W.W., Yang, Y., Zhan, Y.Q., Xu, W.X., Yu, M., Ge, C.H.,
motifs define axonal RNA regulons, Mol. Cell. Proteomics,
Guo, J.T., Li, C.Y., and Yang, X.M. (2012) THAP11, a
11, 2091-2106, doi: 10.1074/mcp.RA118.000603.
novel binding protein of PCBP1, negatively regulates CD44
47.
Leal, G., Comprido, D., de Luca, P., Morais, E., Rod
alternative splicing and cell invasion in a human hepatoma
rigues, L., Mele, M., Santos, A.R., Costa, R.O., Pinto, M.J.,
cell line, FEBS Lett., 586, 1431-1438, doi: 10.1016/j.febslet.
Patil, S., Berentsen, B., Afonso, P., Carreto, L., Li, K.W.,
2012.04.016.
Pinheiro, P., Almeida, R.D., Santos, M.A.S., Bramham, C.R.,
34.
Bomsztyk, K., Denisenko, O., and Ostrowski, J. (2004)
and Duarte, C.B. (2017) The RNA binding protein
hnRNP K: one protein multiple processes, Bioessays, 26,
hnRNP K mediates the effect of BDNF on dendritic
629-638, doi: 10.1002/bies.20048.
mRNA metabolism and regulates synaptic NMDA recep
35.
Mikula, M., Dzwonek, A., Karczmarski, J., Rubel, T.,
tors in hippocampal neurons, eNeuro, 4, doi: 10.1523/
Dadlez, M., Wyrwicz, L.S., Bomsztyk, K., and Ostrowski, J.
ENEURO.0268 17.2017.
(2006) Landscape of the hnRNP K protein protein
48.
Chakraborty, A., Mukherjee, S., Saha, S., De, S., and
interactome, Proteomics, 6, 2395-2406, doi: 10.1002/pmic.
Sengupta Bandyopadhyay, S. (2017) Phorbol 12 myris
200500632.
tate 13 acetate mediated stabilization of leukemia
БИОХИМИЯ том 84 вып. 3 2019
KH ДОМЕННЫЕ ПОЛИ(С) СВЯЗЫВАЮЩИЕ БЕЛКИ
327
inhibitory factor (lif) mRNA: involvement of Nucleolin
63.
Dixon, S.J., and Stockwell, B.R. (2014) The role of iron
and PCBP1, Biochem. J., 474, 2349-2363, doi: 10.1042/
and reactive oxygen species in cell death, Nat. Chem. Biol.,
BCJ20170051.
10, 9-17, doi: 10.1038/nchembio.
49.
Tang, Y.S., Khan, R.A., Xiao, S., Hansen, D.K., Stabler, S.P.,
64.
Torti, S.V., and Torti, F.M. (2013) Iron and cancer: more
Kusumanchi, P., Jayaram, H.N., and Antony, A.C. (2017)
ore to be mined, Nat. Rev. Cancer, 13, 342-355, doi: 10.1038/
Evidence favoring a positive feedback loop for physiologic
nrc3495.
auto upregulation of hnRNP E1 during prolonged folate
65.
Nandal, A., Ruiz, J.C., Subramanian, P., Ghimire Rijal, S.,
deficiency in human placental cells, J. Nutr., 147,
Sinnamon, R.A., Stemmler, T.L., Bruick, R.K., and
482-498, doi: 10.3945/jn.116.241364.
Philpott, C.C. (2011) Activation of the HIF prolyl hydroxy
50.
Zhang, Y., Si, Y., Ma, N., and Mei, J. (2015) The RNA
lase by the iron chaperones PCBP1 and PCBP2, Cell
binding protein PCBP2 inhibits Ang II induced hypertrophy
Metab., 14, 647-657, doi: 10.1016/j.cmet.2011.08.015.
of cardiomyocytes though promoting GPR56 mRNA
66.
Frey, A.G., Nandal, A., Park, J.H., Smith, P.M., Yabe, T.,
degeneration, Biochem. Biophys. Res. Commun., 464,
Ryu, M.S., Ghosh, M.C., Lee, J., Rouault, T.A., Park, M.H.,
679-684, doi: 10.1016/j.bbrc.2015.06.139.
and Philpott, C.C. (2014) Iron chaperones PCBP1 and
51.
Holcik, M., and Liebhaber, S.A. (1997) Four highly stable
PCBP2 mediate the metallation of the dinuclear iron
eukaryotic mRNAs assemble 3' untranslated region RNA
enzyme deoxyhypusine hydroxylase, Proc. Natl. Acad. Sci.
protein complexes sharing cis and trans components, Proc.
USA, 111, 8031-8036, doi: 10.1073/pnas.1402732111.
Natl. Acad. Sci. USA, 94, 2410-2414.
67.
Yanatori, I., Richardson, D.R., Toyokuni, S., and Kishi, F.
52.
Ostareck, D.H., Ostareck Lederer, A., Wilm, M., Thiele, B.J.,
(2017) The iron chaperone poly(rC) binding protein 2
Mann, M., and Hentze, M.W. (1997) mRNA silencing in
forms a metabolon with the heme oxygenase 1/cytochrome
erythroid differentiation: hnRNP K and hnRNP E1 regu
P450 reductase complex for heme catabolism and iron
late 15 lipoxygenase translation from the 3' end, Cell, 89,
transfer, J. Biol. Chem., 292, 13205-13229, doi: 10.1074/
597-606, doi: 10.1016/s0030 6657(08)70226 9.
jbc.M117.776021.
53.
Ostareck, D.H., Ostareck Lederer, A., Shatsky, I.N., and
68.
Wang, Z., Yin, W., Zhu, L., Li, J., Yao, Y., Chen, F., Sun, M.,
Hentze, M.W. (2001) Lipoxygenase mRNA silencing in
Zhang, J., Shen, N., Song, Y., and Chang, X. (2018) Iron
erythroid differentiation: the 3'UTR regulatory complex
drives T helper cell pathogenicity by promoting RNA bin
controls
60S ribosomal subunit joining, Cell,
104,
ding protein PCBP1 mediated proinflammatory cytokine
281-290, doi: 10.1016/s0968 0004(05)00043 5.
production, Immunity, 49, 80-92 e87, doi: 10.1016/
54.
Collier, B., Goobar Larsson, L., Sokolowski, M., and
j.immuni.2018.05.008.
Schwartz, S. (1998) Translational inhibition in vitro of
69.
Yanatori, I., Yasui, Y., Tabuchi, M., and Kishi, F. (2014)
human papillomavirus type 16 L2 mRNA mediated
Chaperone protein involved in transmembrane transport of
through interaction with heterogenous ribonucleoprotein K
iron, Biochem. J., 462, 25-37, doi: 10.1042/BJ20140225.
and poly(rC) binding proteins 1 and 2, J. Biol. Chem., 273,
70.
Yanatori, I., Richardson, D.R., Imada, K., and Kishi, F.
22648-22656.
(2016) Iron export through the transporter ferroportin 1 is
55.
Chaudhury, A., Hussey, G.S., Ray, P.S., Jin, G., Fox, P.L.,
modulated by the iron chaperone PCBP2, J. Biol. Chem.,
and Howe, P.H. (2010) TGF beta mediated phosphoryla
291, 17303-17318, doi: 10.1074/jbc.M116.721936.
tion of hnRNP E1 induces EMT via transcript selective
71.
Mikula, M., Bomsztyk, K., Goryca, K., Chojnowski, K.,
translational induction of Dab2 and ILEI, Nat. Cell Biol.,
and Ostrowski, J. (2013) Heterogeneous nuclear ribonu
12, 286-293, doi: 10.1038/ncb2029
cleoprotein (HnRNP) K genome wide binding survey
56.
Evans, J.R., Mitchell, S.A., Spriggs, K.A., Ostrowski, J.,
reveals its role in regulating 3' end RNA processing and
Bomsztyk, K., Ostarek, D., and Willis, A.E.
(2003)
transcription termination at the early growth response 1
Members of the poly (rC) binding protein family stimulate
(EGR1) gene through XRN2 exonuclease, J. Biol. Chem.,
the activity of the c myc internal ribosome entry segment
288, 24788-24798, doi: 10.1074/jbc.M113.496679.
in vitro and in vivo, Oncogene, 22, 8012-8020, doi: 10.1038/
72.
Pintacuda, G., Wei, G., Roustan, C., Kirmizitas, B.A.,
sj.onc.1206645.
Solcan, N., Cerase, A., Castello, A., Mohammed, S.,
57.
Blyn, L.B., Towner, J.S., Semler, B.L., and Ehrenfeld, E.
Moindrot, B., Nesterova, T.B., and Brockdorff, N. (2017)
(1997) Requirement of poly(rC) binding protein 2 for
hnRNPK recruits PCGF3/5 PRC1 to the Xist RNA
translation of poliovirus RNA, J. Virol., 71, 6243-6246.
B repeat to establish polycomb mediated chromosomal
58.
Ogram, S.A., Spear, A., Sharma, N., and Flanegan, J.B.
silencing, Mol. Cell, 68, 955-969, e910, doi: 10.1016/
(2010) The 5'CL PCBP RNP complex, 3' poly(A) tail and
j.molcel.2017.11.013.
2A(pro) are required for optimal translation of poliovirus
73.
Ishii, T., Hayakawa, H., Igawa, T., Sekiguchi, T., and
RNA, Virology, 397, 14-22, doi: 10.1016/j.virol.2009.11.006.
Sekiguchi, M. (2018) Specific binding of PCBP1 to heavily
59.
Gamarnik, A.V., and Andino, R. (1997) Two functional
oxidized RNA to induce cell death, Proc. Natl. Acad. Sci.
complexes formed by KH domain containing proteins
USA, 115, 6715-6720, doi: 10.1073/pnas.1806912115.
with the 5' noncoding region of poliovirus RNA, RNA, 3,
74.
Carpenter, B., McKay, M., Dundas, S.R., Lawrie, L.C.,
882-892.
Telfer, C., and Murray, G.I. (2006) Heterogeneous nuclear
60.
Pickering, B.M., Mitchell, S.A., Evans, J.R., and Willis, A.E.
ribonucleoprotein K is over expressed, aberrantly localised
(2003) Polypyrimidine tract binding protein and poly r(C)
and is associated with poor prognosis in colorectal cancer,
binding protein 1 interact with the BAG 1 IRES and sti
Br. J. Cancer, 95, 921-927, doi: 10.1038/sj.bjc.6603349.
mulate its activity in vitro and in vivo, Nucleic Acids Res.,
75.
Chen, L.C., Chung, I.C., Hsueh, C., Tsang, N.M., Chi, L.M.,
31, 639-646.
Liang, Y., Chen, C.C., Wang, L.J., and Chang, Y.S. (2010)
61.
Napthine, S., Treffers, E.E., Bell, S., Goodfellow, I., Fang, Y.,
The antiapoptotic protein, FLIP, is regulated by heteroge
Firth, A.E., Snijder, E.J., and Brierley, I. (2016) A novel role
neous nuclear ribonucleoprotein K and correlates with
for poly(C) binding proteins in programmed ribosomal fra
poor overall survival of nasopharyngeal carcinoma patients,
meshifting, Nucleic Acids Res., 44, 5491-5503, doi: 10.1093/
Cell Death Differ., 17, 1463-1473, doi: 10.1038/cdd.2010.24.
nar/gkw480.
76.
Ciarlo, M., Benelli, R., Barbieri, O., Minghelli, S.,
62.
Bogdan, A.R., Miyazawa, M., Hashimoto, K., and Tsuji, Y.
Barboro, P., Balbi, C., and Ferrari, N. (2012) Regulation of
(2016) Regulators of iron homeostasis: new players in
neuroendocrine differentiation by AKT/hnRNPK/AR/
metabolism, cell death, and disease, Trends. Biochem. Sci.,
beta catenin signaling in prostate cancer cells, Int. J.
41, 274-286, doi: 10.1016/j.tibs.2015.11.012.
Cancer, 131, 582-590, doi: 10.1002/ijc.26402.
БИОХИМИЯ том 84 вып. 3 2019
328
НАЗАРОВ и др.
77.
Wen, F., Shen, A., Shanas, R., Bhattacharyya, A., Lian, F.,
proteins. Heterogeneous nuclear ribonucleoprotein K and
Hostetter, G., and Shi, J. (2010) Higher expression of the
Y box binding protein, J. Biol. Chem., 275, 15498-15503,
heterogeneous nuclear ribonucleoprotein k in melanoma,
doi: 10.1074/jbc.275.20.15498.
Ann. Surg. Oncol., 17, 2619-2627, doi: 10.1245/s10434
90. Dimitrova, N., Zamudio, J.R., Jong, R.M., Soukup, D.,
010 1121 1.
Resnick, R., Sarma, K., Ward, A. J., Raj, A., Lee, J.T.,
78.
Wu, C.S., Chang, K.P., Chen, L.C., Chen, C.C., Liang, Y.,
Sharp, P.A., and Jacks, T. (2014) LincRNA p21 activates
Hseuh, C., and Chang, Y.S. (2012) Heterogeneous ribonu
p21 in cis to promote Polycomb target gene expression and
cleoprotein K and thymidine phosphorylase are indepen
to enforce the G1/S checkpoint, Mol. Cell, 54, 777-790,
dent prognostic and therapeutic markers for oral squamous
doi: 10.1016/j.molcel.2014.04.025.
cell carcinoma, Oral Oncol., 48, 516-522, doi: 10.1016/
91. Huarte, M., Guttman, M., Feldser, D., Garber, M.,
j.oraloncology.
Koziol, M.J., Kenzelmann Broz, D., Khalil, A.M., Zuk, O.,
79.
Chen, X., Gu, P., Xie, R., Han, J., Liu, H., Wang, B., Xie, W.,
Amit, I., Rabani, M., Attardi, L.D., Regev, A., Lander, E.S.,
Xie, W., Zhong, G., Chen, C., Xie, S., Jiang, N., Lin, T.,
Jacks, T., and Rinn, J.L. (2010) A large intergenic noncoding
and Huang, J. (2017) Heterogeneous nuclear ribonucleo
RNA induced by p53 mediates global gene repression in
protein K is associated with poor prognosis and regulates
the p53 response, Cell, 142, 409-419, doi: 10.1016/j.cell.
proliferation and apoptosis in bladder cancer, J. Cell Mol.
2010.06.040.
Med., 21, 1266-1279, doi: 10.1111/jcmm.12999.
92. Denisenko, O.N., and Bomsztyk, K. (1997) The product of
80.
Kawasaki, Y., Komiya, M., Matsumura, K., Negishi, L.,
the murine homolog of the Drosophila extra sex combs
Suda, S., Okuno, M., Yokota, N., Osada, T., Nagashima, T.,
gene displays transcriptional repressor activity, Mol. Cell
Hiyoshi, M., Okada Hatakeyama, M., Kitayama, J.,
Biol., 17, 4707-4717.
Shirahige, K., and Akiyama, T. (2016) MYU, a target
93. Waggoner, S.A., Johannes, G.J., and Liebhaber, S.A.
lncRNA for Wnt/c Myc signaling, mediates induction of
(2009) Depletion of the poly(C) binding proteins
CDK6 to promote cell cycle progression, Cell Rep., 16,
alphaCP1 and alphaCP2 from K562 cells leads to p53
2554-2564, doi: 10.1016/j.celrep.2016.08.015.
independent induction of cyclin dependent kinase inhi
81.
Shin, C.H., Lee, H., Kim, H.R., Choi, K.H., Joung, J.G.,
bitor (CDKN1A) and G1 arrest, J. Biol. Chem., 284,
and Kim, H.H. (2017) Regulation of PLK1 through com
9039-9049, doi: 10.1074/jbc.M806986200.
petition between hnRNPK, miR 149 3p and miR 193b 5p,
94. Link, L.A., Howley, B.V., Hussey, G.S., and Howe, P.H.
Cell Death Differ., 24, 1861-1871, doi: 10.1038/cdd.2017.106.
(2016) PCBP1/HNRNP E1 protects chromosomal integrity
82.
Zhu, X.H., Wang, J.M., Yang, S.S., Wang, F.F., Hu, J.L.,
by translational regulation of CDC27, Mol. Cancer Res.,
Xin, S.N., Men, H., Lu, G.F., Lan, X.L., Zhang, D.,
14, 634-646, doi: 10.1158/1541 7786.MCR 16 0018.
Wang, X.Y., Liao, W.T., Ding, Y.Q., and Liang, L. (2017)
95. Ji, X., Humenik, J., Yang, D., and Liebhaber, S.A. (2018)
Down regulation of DAB2IP promotes colorectal cancer
PolyC binding proteins enhance expression of the CDK2
invasion and metastasis by translocating hnRNPK into
cell cycle regulatory protein via alternative splicing, Nucleic
nucleus to enhance the transcription of MMP2, Int. J.
Acids Res., 46, 2030-2044, doi: 10.1093/nar/gkx1255.
Cancer, 141, 172-183, doi: 10.1002/ijc.30701.
96. Zhang, Y., Meng, L., Xiao, L., Liu, R., Li, Z., and Wang, Y.L.
83.
Zhao, S., Feng, J., Wang, Q., Tian, L., Zhang, Y., and Li, H.
(2018) The RNA binding protein PCBP1 functions as a
(2018) hnRNP K plays a protective role in TNF alpha
tumor suppressor in prostate cancer by inhibiting mitogen
induced apoptosis in podocytes, Biosci. Rep., 38, BSR20180288,
activated protein kinase 1, Cell Physiol. Biochem., 48,
doi: 10.1042/BSR20180288.
1747-1754, doi: 10.1159/000492315.
84.
Kim, T., Jeon, Y.J., Cui, R., Lee, J.H., Peng, Y., Kim, S.H.,
97. Ji, F.J., Wu, Y.Y., An, Z., Liu, X.S., Jiang, J.N., Chen, F.F.,
Tili, E., Alder, H., and Croce, C.M. (2015) Role of MYC
and Fang, X.D. (2017) Expression of both poly r(C) binding
regulated long noncoding RNAs in cell cycle regulation
protein 1 (PCBP1) and miRNA 3978 is suppressed in perito
and tumorigenesis, J. Natl. Cancer Inst., 107, doi: 10.1093/
neal gastric cancer metastasis, Sci. Rep., 7, 15488, doi: 10.1038/
jnci/dju505
s41598 017 15448 9.
85.
Huang, H., Han, Y., Yang, X., Li, M., Zhu, R., Hu, J.,
98. Grelet, S., Link, L.A., Howley, B., Obellianne, C.,
Zhang, X., Wei, R., Li, K., and Gao, R. (2017) HNRNPK
Palanisamy, V., Gangaraju, V.K., Diehl, J.A., and Howe, P.H.
inhibits gastric cancer cell proliferation through
(2017) A regulated PNUTS mRNA to lncRNA splice
p53/p21/CCND1 pathway, Oncotarget, 8, 103364-103374,
switch mediates EMT and tumour progression, Nat. Cell
doi: 10.18632/oncotarget.21873.
Biol., 19, 1105-1115, doi: 10.1038/ncb359.
86.
Gallardo, M., Lee, H.J., Zhang, X., Bueso Ramos, C.,
99. Zhang, W., Shi, H., Zhang, M., Liu, B., Mao, S., Li, L.,
Pageon, L.R., McArthur, M., Multani, A., Nazha, A.,
Tong, F., Liu, G., Yang, S., and Wang, H. (2016) Poly C
Manshouri, T., Parker Thornburg, J., Rapado, I., Quintas
binding protein 1 represses autophagy through downregu
Cardama, A., Kornblau, S.M., Martinez Lopez, J., and
lation of LC3B to promote tumor cell apoptosis in starva
Post, S.M. (2015) hnRNP K is a haploinsufficient tumor
tion, Int. J. Biochem. Cell Biol., 73, 127-136, doi: 10.1016/
suppressor that regulates proliferation and differentiation
j.biocel.2016.02.009.
programs in hematologic malignancies, Cancer Cell, 28,
100. Li, J., Feng, Q., Wei, X., and Yu, Y. (2016) MicroRNA 490
486-499, doi: 10.1016/j.ccell.2015.09.001.
regulates lung cancer metastasis by targeting poly r(C) bin
87.
Enge, M., Bao, W., Hedstrom, E., Jackson, S.P., Moumen,
ding protein 1, Tumour Biol., 37, 15221-15228, doi: 10.1007/
A., and Selivanova, G. (2009) MDM2 dependent down
s13277 016 5347 9.
regulation of p21 and hnRNP K provides a switch between
101. Huo, L.R., Ju, W., Yan, M., Z]ou, J.H., Yan, W., He, B.,
apoptosis and growth arrest induced by pharmacologically
Zhao, X.L., Jenkins, E.C., Brown, W.T., and Zhong, N.
activated p53, Cancer Cell, 15, 171-183, doi: 10.1016/
(2010) Identification of differentially expressed transcripts and
j.ccr.2009.01.019.
translatants targeted by knock down of endogenous PCBP1,
88.
Moumen, A., Masterson, P., O’Connor, M.J., and
Biochim. Biophys. Acta, 1804, 1954-1964, doi: 10.1016/
Jackson, S.P. (2005) hnRNP K: an HDM2 target and trans
j.bbapap.2010.07.002.
criptional coactivator of p53 in response to DNA damage,
102. Tripathi, V., and Zhang, Y.E. (2017) Redirecting RNA
Cell, 123, 1065-1078, doi: 10.1016/j.cell.2005.09.032.
splicing by SMAD3 turns TGF beta into a tumor promoter,
89.
Shnyreva, M., Schullery, D.S., Suzuki, H., Higaki, Y., and
Mol. Cell Oncol., 4, e1265699, doi: 10.1080/23723556.
Bomsztyk, K. (2000) Interaction of two multifunctional
2016.1265699.
БИОХИМИЯ том 84 вып. 3 2019
KH ДОМЕННЫЕ ПОЛИ(С) СВЯЗЫВАЮЩИЕ БЕЛКИ
329
103. Howley, B.V., Hussey, G.S., Link, L.A., and Howe, P.H. (2016)
Differentiation of embryonic stem cells is induced by
Translational regulation of inhibin betaA by TGFbeta via
GATA factors, Genes Dev., 16, 784-789, doi: 10.1101/
the RNA binding protein hnRNP E1 enhances the inva
gad.968802.
siveness of epithelial to mesenchymal transitioned cells,
111.
Nika, E., Brugnoli, F., Piazzi, M., Lambertini, E.,
Oncogene, 35, 1725-1735, doi: 10.1038/onc.2015.238.
Grassilli, S., Bavelloni, A., Piva, R., Capitani, S., and
104. Zhang, P., Wang, N., Lin, X., Jin, L., Xu, H., Li, R., and
Bertagnolo, V. (2014) hnRNP K in PU.1 containing com
Huang, H. (2016) Expression and localization of heteroge
plexes recruited at the CD11b promoter: a distinct role in
neous nuclear ribonucleoprotein K in mouse ovaries and
modulating granulocytic and monocytic differentiation of
preimplantation embryos, Biochem. Biophys. Res. Commun.,
AML derived cells, Biochem. J., 463, 115-122, doi: 10.1042/
471, 260-265, doi: 10.1016/j.bbrc.2016.02.003.
BJ20140358.
105. Lin, N., Chang, K.Y., Li, Z., Gates, K., Rana, Z.A., Dang, J.,
112. Fan, X., Xiong, H., Wei, J., Gao, X., Feng, Y., Liu, X.,
Zhang, D., Han, T., Yang, C.S., Cunningham, T.J., Head, S.R.,
Zhang, G., He, Q.Y., Xu, J., and Liu, L.
(2015)
Duester, G., Dong, P.D., and Rana, T.M. (2014) An evolu
Cytoplasmic hnRNPK interacts with GSK3beta and is
tionarily conserved long noncoding RNA TUNA controls
essential for the osteoclast differentiation, Sci. Rep., 5,
pluripotency and neural lineage commitment, Mol. Cell,
17732, doi: 10.1038/srep17732.
53, 1005-1019, doi: 10.1016/j.molcel.2014.01.021.
113. Shi, Z., Zhao, C., Yang, Y., Teng, H., Guo, Y., Ma, M.,
106. Bao, X., Wu, H., Zhu, X., Guo, X., Hutchins, A.P., Luo, Z.,
Guo, X., Zhou, Z., Huo, R., and Zhou, Q. (2015)
Song, H., Chen, Y., Lai, K., Yin, M., Xu, L., Zhou, L.,
Maternal PCBP1 determines the normal timing of pronuc
Chen, J., Wang, D., Qin, B., Frampton, J., Tse, H.F., Pei, D.,
leus formation in mouse eggs, Cell. Mol. Life Sci., 72,
Wang, H., Zhang, B., and Esteban, M.A. (2015) The p53 in
3575-3586, doi: 10.1007/s00018 015 1905 3.
duced lincRNA p21 derails somatic cell reprogramming by
114. Xia, M., He, H., Wang, Y., Liu, M., Zhou, T., Lin, M.,
sustaining H3K9me3 and CpG methylation at pluripotency
Zhou, Z., Huo, R., Zhou, Q., and Sha, J. (2012) PCBP1 is
gene promoters, Cell Res., 25, 80-92, doi: 10.1038/cr.2014.165.
required for maintenance of the transcriptionally silent
107. Chia, N.Y., Chan, Y.S., Feng, B., Lu, X., Orlov, Y.L., Mo
state in fully grown mouse oocytes, Cell Cycle, 11,
reau, D., Kumar, P., Yang, L., Jiang, J., Lau, M.S., Huss, M.,
2833-2842, doi: 10.4161/cc.21169.
Soh, B.S., Kraus, P., Li, P., Lufkin, T., Lim, B., Clarke, N.D.,
115. Ghanem, L.R., Kromer, A., Silverman, I.M., Chatterji, P.,
Bard, F., and Ng, H.H. (2010) A genome wide RNAi
Traxler, E., Penzo Mendez, A., Weiss, M.J., Stanger, B.Z.,
screen reveals determinants of human embryonic stem cell
and Liebhaber, S.A. (2015) The Poly(C) binding protein
identity, Nature, 468, 316-320, doi: 10.1038/nature09531.
Pcbp2 and its retrotransposed derivative Pcbp1 are inde
108. Ding, L., Paszkowski Rogacz, M., Nitzsche, A., Slabicki, M.M.,
pendently essential to mouse development, Mol. Cell Biol.,
Heninger, A.K., de Vries, I., Kittler, R., Junqueira, M.,
36, 304-319, doi: 10.1128/MCB.00936 15.
Shevchenko, A., Schulz, H., Hubner, N., Doss, M.X.,
116. Espinoza Lewis, R.A., Yang, Q., Liu, J., Huang, Z.P., Hu, X.,
Sachinidis, A., Hescheler, J., Iacone, R., Anastassiadis, K.,
Chen, D., and Wang, D.Z. (2017) Poly(C) binding protein 1
Stewart, A.F., Pisabarro, M.T., Caldarelli, A., Poser, I.,
(Pcbp1) regulates skeletal muscle differentiation by modu
Theis, M, and Buchholz, F. (2009) A genome scale RNAi
lating microRNA processing in myoblasts, J. Biol. Chem.,
screen for Oct4 modulators defines a role of the Paf1 comp
292, 9540-9550, doi: 10.1074/jbc.M116.773671.
lex for embryonic stem cell identity, Cell Stem Cell, 4,
117. Hayashi, K., Ohta, H., Kurimoto, K., Aramaki, S., and
403-415, doi: 10.1016/j.stem.2009.03.009.
Saitou, M. (2011) Reconstitution of the mouse germ cell
109. Thompson, P.J., Dulberg, V., Moon, K.M., Foster, L.J.,
specification pathway in culture by pluripotent stem cells,
Chen, C., Karimi, M.M., and Lorincz, M.C. (2015)
Cell, 146, 519-532, doi: 10.1016/j.cell.2011.06.052.
hnRNP K coordinates transcriptional silencing by
118. Chen, Q., Cai, Z.K., Chen, Y.B., Gu, M., Zheng, D.C.,
SETDB1 in embryonic stem cells, PLoS Genet., 11,
Zhou, J., and Wang, Z. (2015) Poly r(C) binding protein 1
e1004933, doi: 10.1371/journal.pgen.1004933.
is central to maintenance of cancer stem cells in prostate can
110. Fujikura, J., Yamato, E., Yonemura, S., Hosoda, K.,
cer cells, Cell Physiol. Biochem., 35, 1052-1061, doi: 10.1159/
Masui, S., Nakao, K., Miyazaki Ji, J., and Niwa, H. (2002)
000373931.
THE KH DOMAIN POLY(C) BINDING PROTEINS AS VERSATILE
REGULATORS OF MULTIPLE BIOLOGICAL PROCESSES
I. B. Nazarov*, E. I. Bakhmet, and A. N. Tomilin
Institute of Cytology, Russian Academy of Sciences, 194064 St. Petersburg, Russia; E mail: i.nazarov@incras.ru
Received October 16, 2018
Revised November 10, 2018
Accepted November 21, 2018
Five known members of the family of KH domain containing poly(C) binding proteins (Pcbp1-4, hnRNP K) pos
sess an unusually broad spectrum of cellular functions that include the regulation of gene transcription, pre mRNA
processing, splicing, stability, translational silencing and enhancement, the control of iron turnover and many others.
Mechanistically, these proteins act via binding to nucleic acids and protein-protein interactions. Through performing
these multiple functions, the KH domain containing poly(C) binding proteins are involved in a wide variety of bio
logical processes such as embryonic development, cell differentiation, and cancer. Dysregulation of the KH domain
containing protein expression is frequently associated with severe developmental defects and neoplasia. This review
summarizes progress in studies of the KH domain containing proteins made over past two decades. The review also
reports our recent finding implying an involvement of the KH factor Pcbp1 in the control of transition from naive to
primed pluripotency state.
Keywords: Pcbp1-4, hnRNP K, gene expression, cell cycle, cancer, embryonic development, pluripotent stem cells
БИОХИМИЯ том 84 вып. 3 2019