БИОХИМИЯ, 2019, том 84, вып. 3, с. 330 - 342
УДК 576.53
СОВРЕМЕННЫЕ ТЕХНОЛОГИИ ПОЛУЧЕНИЯ
ПЕРВИЧНЫХ ПОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА in vitro
Обзор
© 2019 В.К. Абдыев1*, Э.Б. Дашинимаев2,3, И.В. Неклюдова1,
Е.А. Воротеляк1,2,3, А.В. Васильев1,2
1 Московский государственный университет им. М.В. Ломоносова,
биологический факультет, 119234 Россия, Москва;
электронная почта: mailtovepa@gmail.com
2 Институт биологии развития им. Н.К. Кольцова РАН,
119334 Москва, Россия
3 Российский национальный исследовательский медицинский
университет им. Н.И. Пирогова, 117997 Москва, Россия
Поступила в редакцию 14.09.2018
После доработки 20.11.2018
Принята к публикации 20.11.2018
Первичные половые клетки (ППК) - уникальный тип стволовых клеток человека, способный дать начало
тотипотентным стволовым клеткам и обеспечивающий фертильность организма и перенос генетической
информации следующим поколениям. Исследования ППК являются важной областью биологии развития,
в рамках которой проводится изучение фундаментальных проблем раннего эмбриогенеза, таких как меха$
низмы обособления, эпигенетические перестройки и геномный импринтинг при дифференцировке ППК
человека in vitro. На основе технологий получения ППК in vitro в перспективе возможна разработка новых
способов лечения бесплодия и определение причин идиопатического бесплодия. С учетом этической спе$
цифики работы с эмбрионами человека основным методом исследования ППК человека является работа с
клетками in vitro. В обзоре рассмотрены история вопроса исследований ППК человека in vitro, основные су$
ществующие модели и направления развития этой области.
КЛЮЧЕВЫЕ СЛОВА: первичные половые клетки, ППК, ИПСК, ЭСК, VASA, PRDM1, человек.
DOI: 10.1134/S0320972519030047
Половые клетки являются уникальным ти$
бласта, прилежащих к внезародышевой экто$
пом клеток, который в результате процесса сли$
дерме и расположенных на дорсальной стороне
яния способен дать начало тотипотентным
эмбриона мыши (рис. 1) [1, 2]. Впервые эти
стволовым клеткам. Когда и как в процессе раз$
клетки были обнаружены по экспрессии ткане$
вития половые клетки приобретают эту способ$
вой неспецифичной щелочной фосфатазы
ность - один из важнейших вопросов биологии
(TNAP) в основании аллантоиса на стадии
развития, который по$прежнему остается без
E7,0-7,5 [3-5]. С началом гаструляционных
ответа. Известно, что ППК у млекопитающих
движений у мыши такие клетки были обнаруже$
появляются в эпибласте предгаструляционного
ны сначала в мезодерме первичной бороздки и
периода. ППК у мышей образуются примерно
далее в энтодерме [2, 3]. Попадая в заднюю
на эмбриональной (Е) стадии 6,25 суток разви$
кишку [5], ППК мигрируют по ней к передней
тия (E6,25) из небольшой группы клеток эпи$
части зародыша, пока не достигают мезонефри$
ческой почки, а затем по дорсальному мезенте$
рию и через аорто$гонадо$мезонефральную об$
Принятые сокращения: ППК - первичные половые
клетки, чППК - первичные половые клетки человека,
ласть заселяют половые валики [6-8]. В даль$
ПСК - плюрипотентные стволовые клетки, ИПСК - ин$
нейшем именно клетки с высокой активностью
дуцированные плюрипотентные стволовые клетки, ЭСК - щелочной фосфатазы, сформированные под ал$
эмбриональные стволовые клетки, чФГСК - фетальные
лантоисом и мигрировавшие в зачаток гонады,
гонадные стромальные клетки человека, ВМР - костный
морфогенетический белок, TNAP - тканевая неспецифич$
превращаются в половые клетки, которые обес$
ная щелочная фосфатаза, ЭТ - эмбриональные тельца.
печивают фертильность и перенос генома в сле$
* Адресат для корреспонденции.
дующее поколение.
330
ПЕРВИЧНЫЕ ПОЛОВЫЕ КЛЕТКИ ЧЕЛОВЕКА in vitro
331
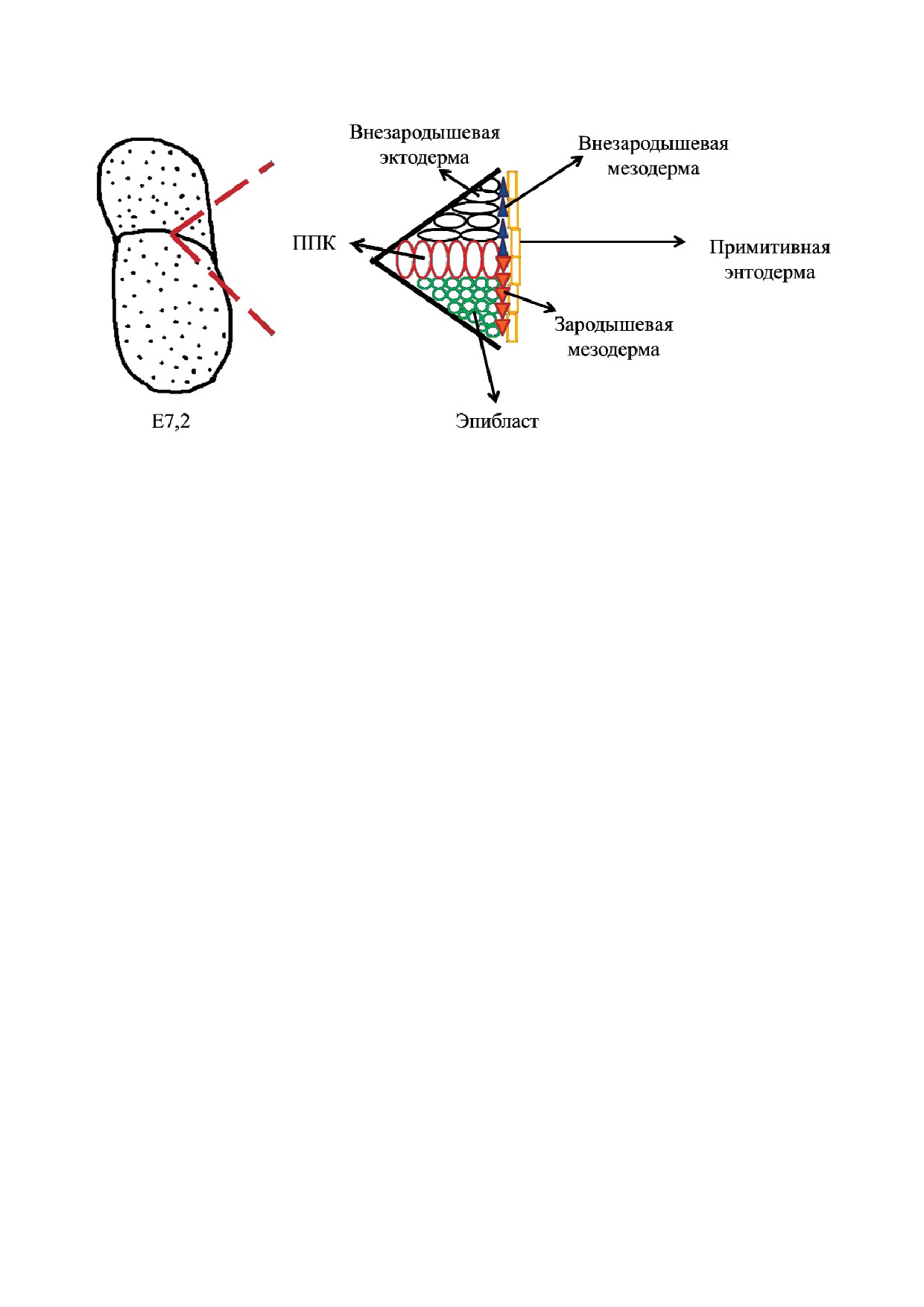
Рис. 1. Клеточное микроокружение ППК мыши на ранней стадии обособления.
С цветным вариантом рис. 1 можно ознакомиться в электронной версии статьи на сайте: www.elibrary.ru
У мыши предшественники ППК возникают
ном эпибласте зародышевого цилиндра на ста$
в результате индукционного воздействия экстра$
дии Е6,25, но со временем экспрессия Wnt3 наб$
эмбриональной эктодермы (через BMP4 и BMP8a;
людается в постериально$проксимальном эпиблас$
ВМР - bone morphogenetic protein) [9-11] и вис$
те и в будущей висцеральной энтодерме [37, 38].
церальной энтодермы (через BМР2) на клетки
ППК человека (чППК) были открыты двумя
проксимального эпибласта [5, 12]. В ответ на
независимыми исследователями (Fuss и Felix) в
индукционное воздействие окружающей ткани
1912 г. и описаны как крупные клетки сферичес$
в шести клетках в постериально$проксималь$
кой формы, содержащие большое число гранул
ном эпибласте (рис. 1) начинают экспрессиро$
в цитоплазме [6]. ППК были обнаружены в
ваться ранние маркерные гены ППК: Prdm1,
стенке желточного мешка на стадии 13-20 со$
Fragilis, Tnap и Stella [13, 14] (табл. 1). ВМР$сиг$
митов. В дальнейшем ППК, продолжая проли$
нальный путь воздействует через SMAD$каскад
ферировать, мигрируют из стенки желточного
[11], в котором сигнальный медиатор SMAD4 из
мешка в зачаток гонады. Следующие этапы
цитоплазмы смещается в ядро и активирует
идентификации чППК были связаны с откры$
экспрессию регуляторного гена Blimp1 в Fragilis$
тием того, что ППК демонстрируют положи$
позитивных клетках постериально$проксималь$
тельное окрашивание на гликогены (PAS$окра$
ного эпибласта, которые контактируют с экстра$
шивание) и TNAP [39]. Также в поисках марке$
эмбриональной эктодермой [5, 14]. В предшест$
ров чППК на фотографиях, полученных мето$
венниках ППК индуцируется экспрессия генов
дом электронной микроскопии, была обнаруже$
Blimp1, Prdm14 и Ifitm3 (Fragilis), являющихся
на специфическая структура Nuage, локализую$
маркерами ранних ППК [1, 6, 36]. Далее в пери$
щаяся перинуклеарно и выглядящая как сверх$
од миграции (стадия Е7) ППК пролиферируют,
плотный объект [6, 40]. На данный момент
перемещаются вместе с клетками экстраэмбрио$
функция этой структуры неизвестна, но в рабо$
нальной мезодермы через формирующуюся
тах, изучавших ППК мыши, было выявлено, что
первичную бороздку из основания аллантоиса и
Nuage вовлечена в процесс репрессии транспо$
образуют кластер, состоящий из ~40 клеток,
зонов посредством экспрессии специфических
экспрессируя при этом маркерные гены Tnap и
микроРНК, а также в поддержание сперматоге$
Stella, а также Cdh1 в энтодерму зачатка перед$
неза [41-43]. Невозможность эксперименталь$
ней кишки эмбриона мыши [5, 6]. WNT3 играет
ных исследований на эмбрионах человека и, как
важную опосредованную роль в формировании
следствие отсутствие работ, изучающих ранние
фенотипа ППК и, скорее всего, влияет на спо$
этапы развития ППК, не позволяют получить
собность эпибласта индуцировать ВМР$сиг$
пространственно$временную характеристику
нальный путь [4]. При нокауте Wnt3 у мутант$
процесса образования чППК in vivo. До сих пор
ных мышей на стадии Е7,5 отсутствовали
полностью не расшифрованы механизмы ин$
Blimp1$позитивные ППК [14]. Wnt3 изначально
дукционных процессов, влияющих на специфи$
экспрессируется в антериальном и постериаль$
кацию и детерминацию чППК, но благодаря
БИОХИМИЯ том 84 вып. 3 2019
332
АБДЫЕВ и др.
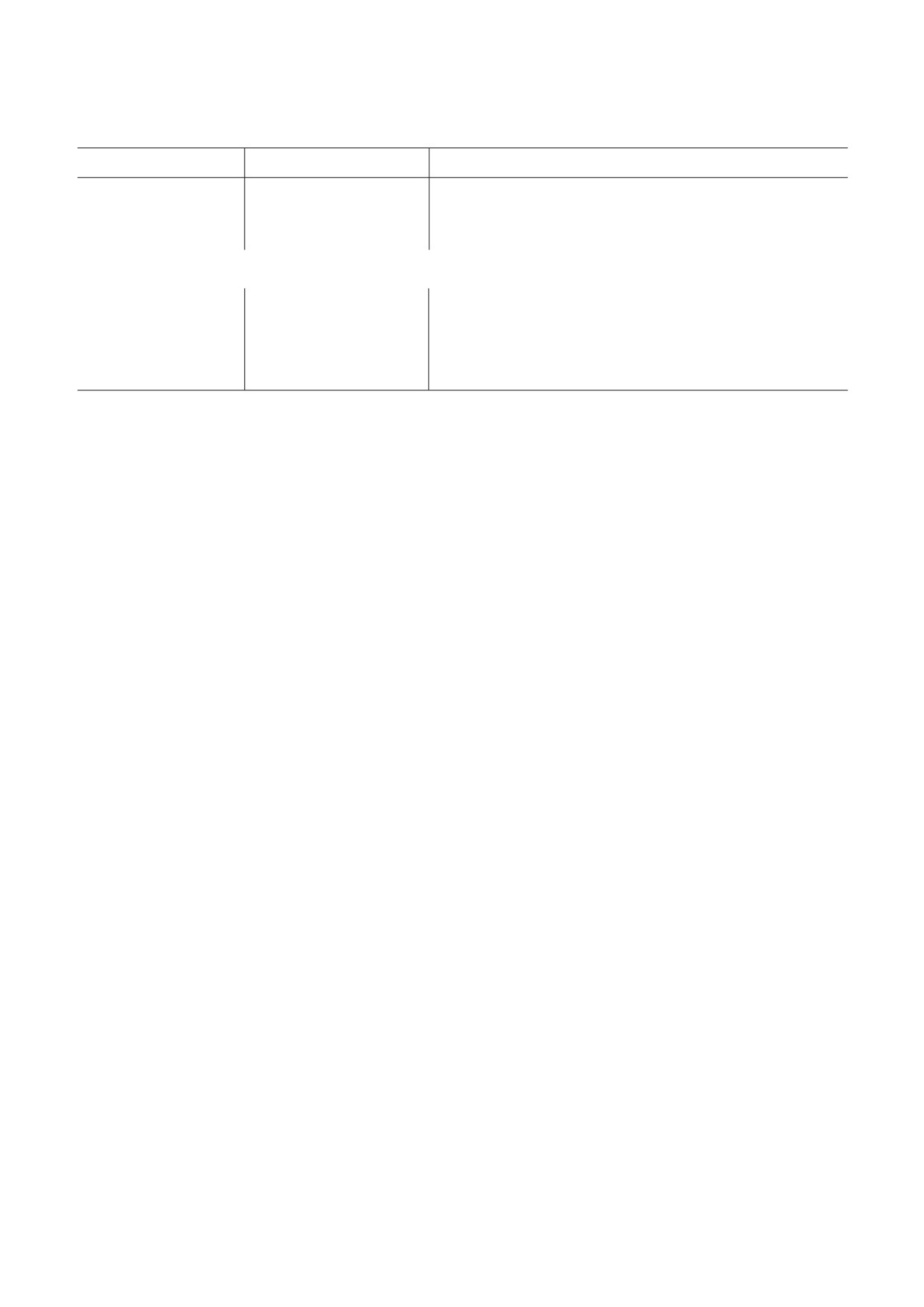
Таблица 1. Ключевые факторы, вовлеченные в спецификацию и пролиферацию/жизнеспособность ППК
Маркер
Описание
Функция в ППК
1
2
3
Транскрипционные факторы (ТФ)
OCT4
ТФ, содержащий
при подавлении гена, кодирующего OCT4, в ППК мыши ини$
POU$гомеодомен
циируется апоптоз, что приводит к ухудшению спецификации
[15, 16]
NANOG
ТФ, содержащий гомео$
подавление гена, кодирующего NANOG, приводит к апоптозу
домен
ППК мыши [17, 18] и снижению доли дифференцирующихся
клеток в ППК мыши in vitro [19]
PRDM14
ТФ, содержащий PR$до$
подавление гена, кодирующего PRDM14, приводит к ухудше$
мен и домен «цинковые
нию спецификации ППК мыши [20], т.е. угнетению экспрессии
пальцы»
регуляторных генов ранних ППК и ПСК мыши [21]. Повышен$
ная экспрессия гена, кодирующего PRDM14, вызывает дефекты
в пролиферации и дифференцировке ППК человека [22]
Tfap2c
ТФ, содержащий специ$
подавление гена, кодирующего Tfap2c, приводит к ухудшению
фический ДНК$связыва$
спецификации ППК мыши [23]. Tfap2c регулирует активацию
ющий домен
генов ППК или подавление генов соматических клеток в коор$
динации c PRDM1 и PRDM14 [24]
PRDM1 (BLIMP1)
ТФ, содержащий PR$до$
подавление гена, кодирующего PRDM1, приводит к ухудшению
мен и домен «цинковые
спецификации ППК мыши и снижению числа ППК в гетерози$
пальцы»
готных мутантах [10, 25]
SOX17
ТФ суперсемейства Sox,
подавление гена, кодирующего SOX17, приводит к репрессии
содержащий ДНК$связы$
NANOG и генов ППК человека (PRDM1, NANOS3, TFAP2C,
вающий HMG$домен.
STELLA, KIT) [26], в результате наблюдается полное отсутствие
SOX17 вовлечен в ингиби$
ППК
рование Wnt$сигнального
пути
РНК$связывающие белки
NANOS3
РНК$связывающий белок
подавление гена, кодирующего NANOS3, приводит к снижению
числа ППК на стадии Е8,5 и далее к полному отсутствию ППК
мыши [27, 28]
VASA (DDX4)
DEAD$бокс, содержащий
подавление гена, кодирующего VASA, приводит к нарушению
РНК$хеликазу
пролиферации мужских ППК после стадии Е11,5 мыши [29]
DAZL
сверхэкспрессия гена, кодирующего DAZL, подавляет трансля$
РНК$связывающий белок
цию OCT4 и влияет на экспрессию половых клеток, арест кле$
точного цикла и клеточной миграции в ППК человека [30].
Подавление гена, кодирующего DALZ, приводит к нарушению
мейозного деления и полному отсутствию сперматозоидов [31]
Рецепторы
cKIT (CD117)
рецептор с тирозинкиназ$
подавление гена, кодирующего cKIT, приводит к нарушению
ной активностью
пролиферации и миграции ППК мыши [32]
Поверхностные белки
SSEA1
углеводная антигенная де$
нокаут гена, кодирующего α$1,3$фукозилтрасферазу 9 (Fut9),
терминанта гликолипида
которая катализирует синтез эпитопов SSEA1, приводит к пол$
ному отсутствию SSEA1 у нокаутных мышей на ранних стадиях
развития. Родившиеся Fut9$нокаутированные мыши развива$
лись нормально и были фертильны [33]. SSEA1 не влияет на
формирование и развитие ППК
БИОХИМИЯ том 84 вып. 3 2019
ПЕРВИЧНЫЕ ПОЛОВЫЕ КЛЕТКИ ЧЕЛОВЕКА in vitro
333
Окончание табл. 1
1
2
3
FRAGILIS (IFITM3)
интерферон$индуцируе$
модулирует клеточную адгезию и влияет на дифференцировку.
мый трансмембранный
Ifitm3 экспрессируется в мигрирующих ППК мыши [2]
белок 3
Хроматин$связывающие белки
DPPA3/STELLA/PGC7
ППК$специфический
нокаутирование гена Stella приводит к пониженной фертиль$
белок 7, вовлеченный в
ности самок из$за отсутствия материнского белка Stella.
эпигенетическое репро$
Stella$дефицитные эмбрионы мыши редко достигают бласто$
граммирование хроматина
цисты и не имплантируются [34]. Stella играет важную роль в
зиготы
сохранении геномного импринтинга некоторых генов от деме$
тилирования [35]
моделям на мышах и развивающейся области
ные клетки обнаруживались в основном на пе$
исследований плюрипотентных стволовых кле$
риферии ЭТ, что может указывать на аналогию с
ток (ПСК) in vitro (для детального изучения
образованием ППК в наружных слоях эпиблас$
можно обратиться к работам Morohaku et al. [44]
та [47, 49-51].
и Zhou et al. [45]) открываются возможности
ППК из ПСК человека получают двумя ос$
моделирования дифференцировки и развития
новными методами: 1) совместным культивиро$
чППК.
ванием с соматическими клетками; 2) культиви$
В ранних работах, изучавших чППК in vitro,
рованием с использованием специальных про$
использовали эмбриональные стволовые клетки
токолов (табл. 2).
(ЭСК) человека, и эти исследования были на$
Ниша играет важную роль в развитии и диф$
правлены в основном на разработку методик по$
ференцировке стволовых клеток. В связи с этим
лучения и идентификации ППК [46-48]. При
необходимо упомянуть о ряде работ по совмест$
работе с чППК in vitro использовали многие
ному культивированию ПСК с соматическими
данные, полученные на ППК мыши. Важным
клетками с целью получения ППК. Совместное
этапом в исследованиях чППК стало открытие
культивирование ЭСК человека с фетальными
того, что центральным индуцирующим факто$
гонадными стромальными клетками человека
ром в детерминации чППК являются белки се$
(чФГСК), которые экспрессировали CYP19 (мар$
мейства BМР: ВМР4, ВМР7 и ВМР8b [49]. Экс$
кер клеток Лейдига), показало, что эффективность
перименты по воздействию на ЭСК человека
дифференцировки ППК в этом случае увеличи$
этими тремя факторами показали, что ВМР4 иг$
вается в 14-19 раз относительно контрольных
рает ключевую роль в дифференцировке чППК
групп (недифференцированных ПСК; ПСК, диф$
in vitro, а ВМР7 и ВМР8b увеличивают число об$
ференцируемых только на матригеле; ПСК, куль$
разующихся ППК [49]. В экспериментах с фор$
тивируемых в кондиционированной чФГСК среде
мированием эмбриоидных телец (ЭТ), получен$
на матригеле) [52]. В случае же использования
ных из ЭСК человека, и их спонтанной диффе$
ИПСК вместо ЭСК в присутствии чФГСК доля
ренцировкой добавление в культуральную среду
ППК увеличивалась в 38-47 раз, что может быть
рекомбинантного ВМР4 увеличивало экспрес$
связано с эпигенетическими различиями между
сию специфических маркерных генов половых
ИПСК и ЭСК. Показано, что эффект увеличе$
клеток - VASA и SYCP3 [49]. В этой работе иссле$
ния доли ППК in vitro был напрямую связан с
дователи обратили внимание на то, что только
клеточными контактами между ПСК и чФГСК, а
небольшое количество клеток реагирует на ин$
не с выделением растворимых факторов в среду.
дукцию ВМР, и попытались объяснить это тем,
В исследовании не использовались факторы рос$
что использование различных комбинаций раз$
та для индукции ППК [52]. В ряде работ было по$
ных рецепторов ВМР на поверхности клеточной
казано, что совместное культивирование мезен$
мембраны и сигнальных молекул в цитоплазме,
химальных стволовых клеток, полученных из пу$
по всей видимости, способствует дифференци$
почного канатика, с клетками Сертоли мыши при$
ровке клеток ЭТ в различных направлениях [49].
водило к увеличению экспрессии VASA, STELLA,
Возможно, только малая доля клеток изначаль$
DAZL и других поздних гонадных маркерных ге$
но экспрессировала специфические для ППК
нов [55], что подтверждает гипотезу о значитель$
рецепторы ВМР в дифференцирующихся ЭТ.
ном эффекте микроокружения в дифференциров$
Надо отметить, что подобные VASA$позитив$
ке ППК in vitro. Полученные в этих работах ре$
БИОХИМИЯ том 84 вып. 3 2019
334
АБДЫЕВ и др.
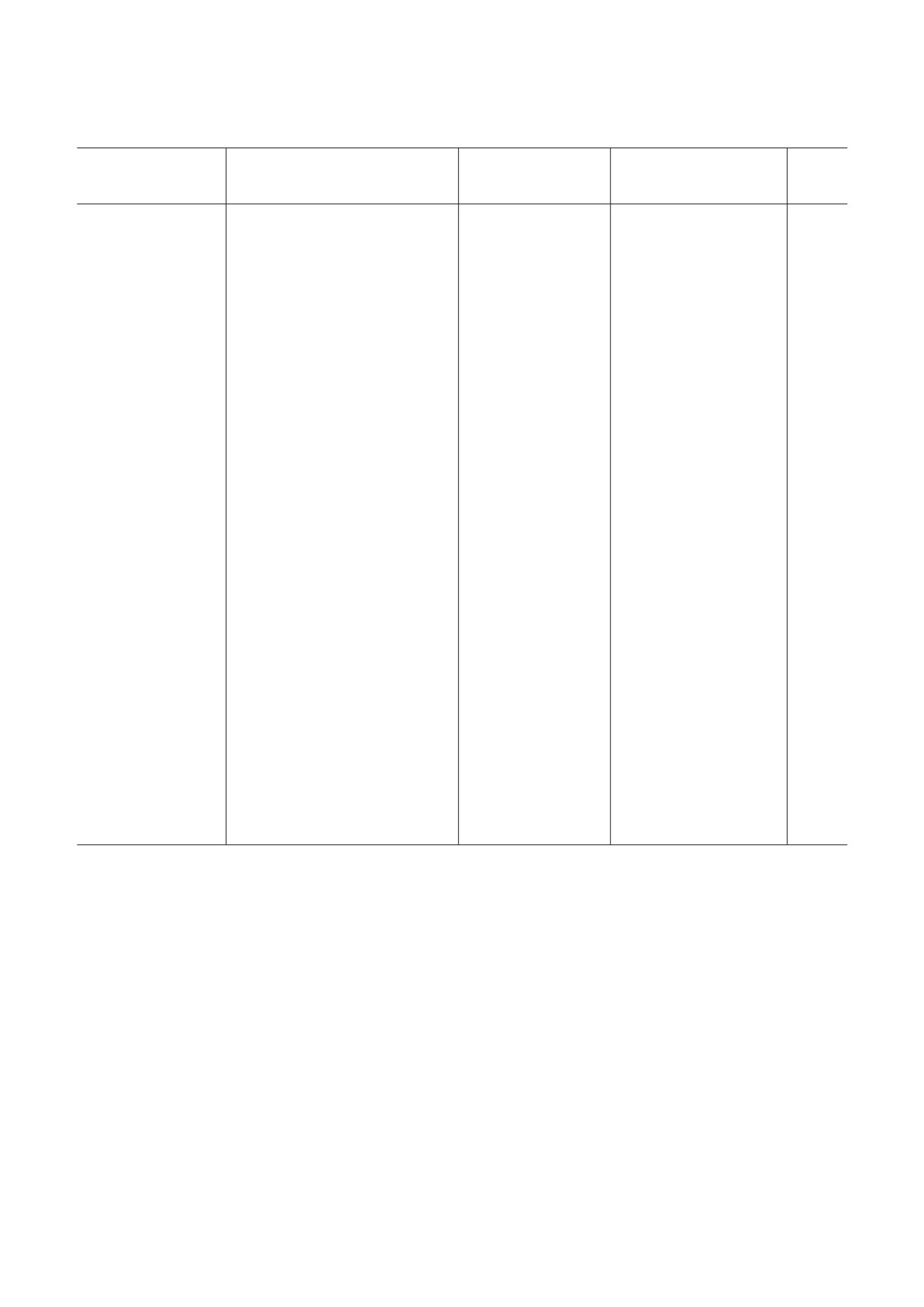
Таблица 2. Методы получения ППК из различных типов ПСК человека
Источник
Методы
Метод
Маркерные
Ссылка
(тип ПСК)
культивирования
идентификации
гены
ЭСК человека (HSF1,
спонтанная дифференцировка
-
OCT4, NANOG, STELLAR,
[47]
H9, HSF6), изолиро$
путем формирования и 14$суточ$
DAZL, VASA, cKIT, SYCP1,
ванные из внутрен$
ного культивирования эмбриоид$
GDF9, SCP1, TEKT1,
ней клеточной массы
ных телец (ЭТ)
PUM2
бластоцисты
ЭСК человека
индукция посредством BMP4,
SSEA1$позитивная
OCT4, NANOG, SSEA4,
[48]
(H9, hES$NCL1)
спонтанная дифференцировка,
клеточная сортировка
TRA<1<60, VASA, STELLA,
адгезивное культивирование и
SSEA1, cKIT, SCP1, SCP3
16$суточное культивирование ЭТ
ЭСК человека (HSF1,
сокультивирование с фетальными
тройные маркеры
cKIT/SSEA1/VASA,
[52]
HSF6, H9)
гонадальными стромальными
ППК
PLAP/SSEA1/VASA, AMH,
ИПСК человека
клетками человека
DPPA3, DAZL, SSEA4,
PRDM1
ИПСК человека, по$
адгезивное культивирование с до$
трансфекция GFP
OCT3/4, NANOG, VASA,
[53]
лученные из фибро$
бавлением ВМР4,7,8b; сверхэкс$
под промотором
STELLAR, DAZL, SCP3,
бластов взрослого
прессия генов DAZL и BOULE пу$
VASA
ACR (акрозин)
организма и эмбрио$
тем трансдукции
нальных фиброблас$
тов
ЭСК человека (ES,
адгезивное культивирование; ин$
сортировка клеток
OCT4, SOX2, NANOG,
[54]
HS306)
дукция дифференцировки добав$
CD9+/CD49f++/CD90-/
SSEA3, SSEA4, TRA<1<80,
ИПСК человека
лением ретиноевой кислоты,
SSEA4-
VASA, SSEA1, CD9, CD49f,
(KiPSCs, CBiPSCs)
факторов роста (bFGF, Forskolin -
CD90, SCP3, γH2AX, ACR
FRSK) и инги$биторов
(акрозин), VIM (виментин,
(rLIF, CYP26i)
маркер клеток Сертоли),
NES (нестин) и 3b<HSD
(маркеры клеток
Лейдига)
ЭСК человека (WIS2,
культивирование с цитокинами,
трансфекция вектор$
OCT4, SOX2, NANOG,
[26]
WIBR3, LIS1)
ингибиторами и факторами роста
ной конструкцией
SOX17, PRDM14, PRDM1,
ИПСК человека
путем формирования ЭТ в тече$
mCherry$NANOS3;
cKIT, NANOS3, STELLA,
(FX71.1 - линия
ние 8 дней; добавление в среду
сортировка с исполь$
TNAP, TFAP2C, CD38
ИПСК, полученная
ВМР2 и ВМР4
зованием двойных
от пациента мужско$
маркеров:
го пола с синдромом
NANOS3$mCherry/
ломки Х$хромосомы)
TNAP+ и NANOS3$
mCherry/CD38+
зультаты можно объяснить гетерогенностью куль$
относящийся к семейству РНК$хеликаз. Экспрес$
туры ПСК и присутствием в ней клеток, уже ком$
сия гена VASA важна для развития половых кле$
митированных к образованию половых клеток, и
ток, и он впервые был идентифицирован у
тем, что добавление соматических клеток гонад
Drosophila melanogaster, но, как впоследствии вы$
поддерживает процесс их дифференцировки и спо$
яснилось, функционирует у большинства бес$
собствует появлению экспрессии указанных мар$
позвоночных и позвоночных животных, а также
керов.
человека. VASA является маркером мигрирую$
Самыми сложными проблемами при получе$
щих и заселяющихся в гонады ППК в процессе
нии ППК in vitro являются идентификация и
развития человека и считается поздним марке$
выделение чистой культуры ППК. В ранних ра$
ром первичных гоноцитов (поздних ППК). Ген
ботах in vivo ППК идентифицировали по актив$
VASA экспрессируется на разных стадиях разви$
ности щелочной фосфатазы и характеризовали
тия половых клеток человека, в т.ч. в спермато$
по морфологическим признакам [56, 57]. В нас$
зоидах и зрелых ооцитах, и не экспрессируется в
тоящее время считается, что самым специфич$
соматических клетках [58], что позволяет ис$
ным маркером гоноцитов является белок VASA,
пользовать его для идентификации первичных
БИОХИМИЯ том 84 вып. 3 2019
ПЕРВИЧНЫЕ ПОЛОВЫЕ КЛЕТКИ ЧЕЛОВЕКА in vitro
335
гоноцитов. Белок VASA впервые обнаруживает$
[26, 70]. Так, например, при помощи различных
ся в мезенхиме половых желез на 7$й неделе раз$
методов было выявлено, что чППК экспресси$
вития человека и локализуется в основном в ци$
руют факторы OCT3/4 и NANOG, традиционно
топлазме [58, 59]. Park et al. для идентификации
связываемые с плюрипотентностью, однако, в
и изолирования первичных гоноцитов человека
отличие от ППК мыши, SOX2, такой же фунда$
разработали систему тройных маркеров: cKIT/
ментальный фактор плюрипотентности, не экс$
SSEA1/VASA и PLAP/SSEA1/VASA. В I триместре
прессируется в чППК [71]. Экспрессия PRDM1
развития плода человека все мигрирующие и засе$
подавляет в чППК экспрессию SOX2, который
ляющие гонады ППК демонстрируют положи$
необходим и для нейральной дифференцировки
тельное окрашивание по этим тройным маркерам
[65]. Стандартным методом индукции ППК из
in vivo. В культурах с дифференцирующимися в
ПСК человека является воздействие на ПСК ре$
ППК ЭСК и ИПСК человека получены похожие
комбинантным ВМР4, который увеличивает
результаты [52]. Маркеры cKIT (он же CD117),
экспрессию специфичных маркеров ППК во
PLAP и SSEA1 являются общими поверхностными
время дифференцировки ПСК в ЭТ [49, 72].
белками$маркерами клеток в I триместре развития
Следующим шагом является стандартизация
плода человека [52, 60, 61]. При спонтанной диф$
среды. Easley et al. показали, что после культиви$
ференцировке ЭСК в ЭТ в ряде исследований наб$
рования ЭСК и ИПСК в стандартизированной
людалось увеличение уровней экспрессии маркер$
культуральной среде для сперматогониальных
ных генов зрелых половых клеток, таких как
стволовых клеток мыши часть ЭСК и ИПСК
DPPA3 (STELLA), DAZL, VASA, BOL, SCP1, SCP3,
дифференцировалась в сперматоцитоподобные
GDF9 и TEKT1 [47, 55, 62-64]. Имеются данные,
клетки [73]. В культурах наблюдалось появление
говорящие о том, что белок PRDM1 (он же
LITF1$, PLZF$ и CDH1$позитивных сперматого$
BLIMP1) появляется на ранней стадии развития
ний$подобных клеток, HIWI$ и HILI$экспресси$
гонад человека и способствует детерминации судь$
рующих сперматоцитоподобных клеток и гапло$
бы ППК путем супрессии дифференцировки в со$
идных клеток, демонстрирующих положитель$
матические клетки [26, 62, 65, 66]. Также при ис$
ное окрашивание на акрозин, транзиторный бе$
следовании ППК, ЭСК и клеток зародышевой се$
лок 1 и протамин 1 [73]. Однако низкая частота и
миномы было установлено, что все три типа клеток
эффективность подобных дифференцировок в
обладают некими сходными характеристиками,
ППК in vitro (не более 5%) подталкивают иссле$
одной из которых является экспрессия поверх$
дователей к дальнейшему улучшению методик
ностного клеточного маркера CD38 [26]. Кроме
культивирования, которое осуществляется путем
того, было установлено, что транскрипционный
добавления различных цитокинов и ингибиторов
фактор SOX17 играет важную роль в детерминации
(например, LIF, GSK3$βi, ERK1/2i, p38i, JNKi,
чППК и является ранним маркером ППК [26].
ROCKi) в культуральные среды [74-76]. Подоб$
В идентификации и образовании первичных
ные методы позволяют увеличить частоту полу$
гоноцитов in vitro используют трансфекцию
чения ППК in vitro в 9 раз относительно традици$
чПСК репортерными флуоресцентными генами
онной индукции, стандартного культивирования
под промоторами маркерных генов ППК (ос$
ЭТ в присутствии ВМР4 [26]. Исследователи счи$
новными из них являются NANOS3 и VASA) с
тают, что добавление LIF, GSK3$βi, ERK1/2i, p38i
последующей сортировкой. NANOS3 - ранний
и JNKi в среду приближает культуры ПСК к ос$
маркер первичных гоноцитов, играющий важ$
новному состоянию наивной плюрипотентнос$
ную роль в формировании и детерминации эпи$
ти, что в итоге повышает эффективность получе$
генетической программы [67-69]. Отсутствие
ния ППК. Наивное состояние ПСК сходно с сос$
экспрессии гена VASA в остальных типах клеток
тоянием плюрипотентности внутренней клеточ$
делает его уникальным маркером, что позволяет
ной массы доимплантационной бластоцисты [74,
изучать с его помощью миграцию и позднюю
77]. Роль ROCKi, возможно, связана с ингибиро$
судьбу чППК в развитии. Трансфекция репор$
ванием апоптоза и повышением эффективности
терными генами ПСК in vitro предоставляет воз$
клонирования при образовании ЭТ [78]. Комби$
можность идентифицировать ППК [62, 63, 66] и
нирование вышеперечисленных подходов с куль$
работать с чистой культурой клеток [26].
тивированием в определенных условиях и индук$
Следующий подход в получении ППК состо$
цией специфическими факторами роста прибли$
ит в культивировании ПСК в определенных ус$
жает исследователей к моделированию специа$
ловиях и индукции дифференцировки при по$
лизации и дифференцировки ППК in vitro и сис$
мощи определенных факторов роста. Работы,
тематизации ключевых регуляторных компонен$
проведенные в этом направлении, показали, что
тов первичных гоноцитов.
развитие ППК in vitro у человека значительно
Регуляторные механизмы спецификации и
отличается от аналогичного процесса у мыши
дифференцировки ППК in vitro и in vivo также
БИОХИМИЯ том 84 вып. 3 2019
336
АБДЫЕВ и др.
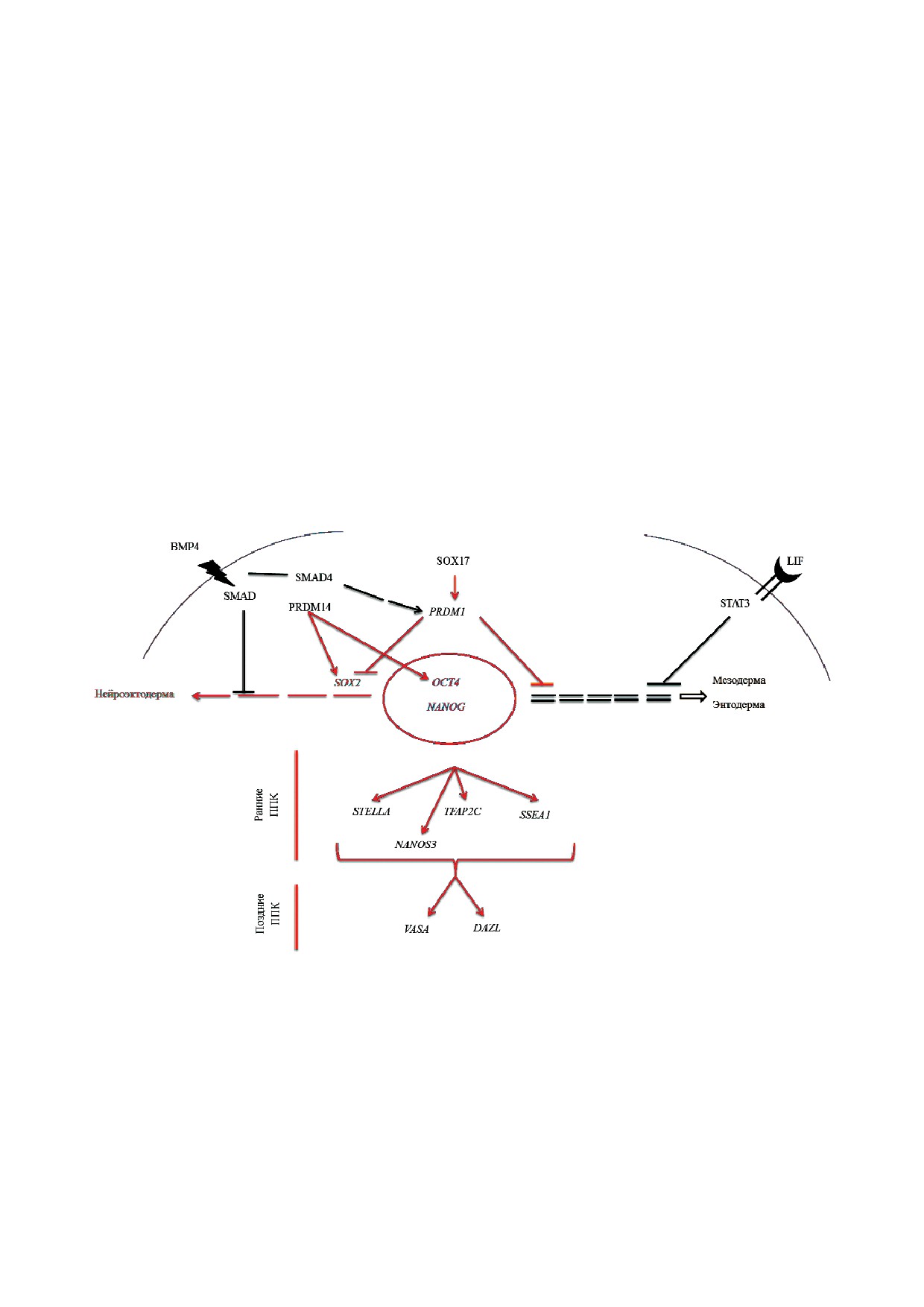
еще до конца не изучены (рис. 2). В настоящее
гуляторные элементы Prdm1 и Prdm14, и запуска$
время общепризнано, что ВМР4 является ос$
ется программа развития половой линии. Таким
новным индуктором дифференцировки ППК у
образом, экспрессия брахиури уже присутствует
человека [49]. Воздействие ВМР4 на ЭСК чело$
в мезодермальных клетках и опосредует индук$
века приводит к повышению концентрации
цию половой дифференцировки [82]. Также в
фосфорилированного SMAD1/5/8 [79]. Имму$
первые дни дифференцировки чППК была вы$
нофлуоресцентным методом было показано, что
явлена экспрессия энтодермального транскрип$
эти же клетки экспрессировали OCT4, VASA,
ционного фактора SOX17 и гена PRDM14, коди$
DAZL и STELLA в солокализации с поверхност$
рующего один из факторов поддержания плю$
ным белком EpCAM, который предположитель$
рипотентности и наивности ЭСК человека [26,
но является маркером чППК. Известно, что при
80, 83]. При дальнейшей дифференцировке
активации ВМР$каскада в клетках ЭТ начинает$
чППК экспрессия PRDM14 значительно снижа$
ся экспрессия раннего мезодермального марке$
ется, в отличие от дифференцировки ППК мы$
ра брахиури (Т$ген) [26, 80], что совпадает с дан$
ши [21], что может в очередной раз указывать на
ными, полученными на ЭТ мыши [81]. Брахиу$
уникальность механизмов дифференцировки
ри - маркер мезодермы, который вызывает
чППК и участия в них гена PRDM14 [84, 85].
экспрессию мезодермальных генов, активируе$
Было показано, что в поздних чППК SOX2 и
мую WNT3$путем. В работе Aramaki [82] было
PRDM14 экспрессируются на низких уровнях.
показано, что при воздействии BMP4 на клетки
Присутствие PRDM14 для них критично: низкий
проксимального эпибласта брахиури перемеща$
уровень экспрессии гена PRDM14 является дос$
ется с промоторов мезодермальных генов на ре$
таточным для дифференцировки чППК, а отсут$
Рис. 2. Механизмы взаимодействия различных транскрипционных факторов и сигнальных каскадов генов при дифферен$
цировке ПСК в ППК человека. ВМР4 связывается с рецептором, в результате происходит фосфорилирование белков
SMAD и их олигомеризация со SMAD4 канонического пути. Активированный SMAD4 переносится в ядро и индуцирует
экспрессию PRDM1, который непосредственно блокирует экспрессию SOX2, не давая клетке дифференцироваться в ней$
роэктодерму. Присутствие в клетке PRDM14 на низком уровне поддерживает активность генов OCT4, NANOG и SOX2.
ВМР4$сигнальный путь воздействует на экспрессию PRDM1. PRDM1 также блокирует дифференцировку клетки по ме$
зодермальному и энтодермальному путям. SOX17 с помощью PRDM1 индуцирует гены ППК: NANOS3, STELLA, TFAP2C,
SSEA1, VASA и DAZL. Сигнальный путь LIF/STAT3 блокирует дифференцировку ЭСК в мезодермальном и энтодермаль$
ном направлениях у мыши [95]. У человека при активации сигнального пути LIF/STAT3 не поддерживается возобновле$
ние ЭСК [96]. Возможно, в данном случае сигнальный путь LIF/STAT3 играет дополнительную роль в формировании
ППК человека путем блокирования дифференцировки в соматические клетки.
С цветным вариантом рис. 2 можно ознакомиться в электронной версии статьи на сайте: www.elibrary.ru
БИОХИМИЯ том 84 вып. 3 2019
ПЕРВИЧНЫЕ ПОЛОВЫЕ КЛЕТКИ ЧЕЛОВЕКА in vitro
337
ствие этого гена отражается на фенотипе
клеток - VASA и SCP3 [65]. Роль PRDM1, воз$
чППК [80] (табл. 1). В результате экспрессии
можно, также может заключаться в постоянном
SOX17 и PRDM14, по всей видимости, образует$
подавлении энтодермального и мезодермально$
ся гетерогенная мезодермальная клеточная по$
го путей развития клеток [26] (рис. 2). Ранний
пуляция [80, 83]. SOX17 в данном случае может
маркер - ядерный белок NANOS3 - был выяв$
играть ключевую роль регулятора в специфика$
лен в гоноцитах XX и XY [67]. При подавлении
ции чППК [44, 62], т.к. он обнаруживается в
морфалином экспрессии NANOS3 в гоноцитах
беспорядочно расположенных клетках ЭТ на са$
снижается число гоноцитов и подавляется
мых ранних этапах дифференцировки. Далее
экспрессия генов, ответственных за поддержа$
SOX17 экспрессируется вместе с PRDM1 (мар$
ние плюрипотентности, а также генов, регули$
кером ранних ППК) уже в кластере скопивших$
рующих инициацию и прохождение мейоза [67].
ся клеток ЭТ, готовых к миграции [26, 83]. По$
В дефицитных по NANOS3 клеточных линиях
добные наблюдения говорят о том, что SOX17
повышается экспрессия SOX17 и PRDM1 [64].
является более ранним маркером ППК, чем тот
Сверхэкспрессия гена NANOS3 приводит к удли$
же PRDM1, который находится ниже в иерар$
нению стадии плюрипотентности и задержке
хии каскада гена SOX17 и определяет дифферен$
дифференцировки [30]. В результате активности
цировку ППК из мезодермальноподобных кле$
генов ранних маркеров ППК (SOX17, PRDM14 и
ток. Было показано, что экспрессия PRDM1
PRDM1) начинает экспрессироваться ряд генов,
напрямую зависит от наличия BMP в среде и
отвечающих за пролиферацию, миграцию и
вызывает экспрессию маркерных генов половых
дальнейшее созревание половых клеток (табл. 3).
Таблица 3. Маркеры, специфичные для ПСК, ранних и поздних ППК и половых клеток
Маркер
ЭСК/ИПСК человека
Ранние ППК
Поздние ППК
Половые клетки
OCT4
+ [48, 53, 72, 74, 75]
+ [50, 53, 70]
SOX2
+ [54, 62, 70, 74, 78]
- [26, 52, 62, 65, 71, 83]
- [52]
NANOG
+ [48, 54, 70, 74, 75]
+ [18, 19]
PRDM14
+ [21, 85]
+ [26, 80]
± [80]
SSEA3
+ [74, 75, 76, 77]
SSEA4
+ [48, 74]
+ [52]
TRA1$60
+ [48, 74]
TRA1$81
+ [47, 48, 54, 74]
+ [80]
SSEA1
- [53, 54, 74]
+ [52, 70, 48]
+ [53, 70]
cKIT (CD117)
+ [50, 52, 68, 80, 87]
+ [47, 52, 53]
SOX17
- [50]
+ [64, 80, 87]
PRDM1 (BLIMP1)
- [50, 62]
+ [50, 62, 65, 87]
+ [53, 87]
- [62]
NANOS3
+ [28, 30, 62, 68, 80]
+ [80]
CD38
- [26]
+ [26]
+ [26]
VASA (DDX4)
- [53, 54]
+ [14, 47, 53, 58, 63]
DAZL
- [47]
+ [47]
+ [30, 47, 53, 63]
Tfap2c
+ [26, 80]
STELLAR
+ [47]
+ [47]
+ [47]
PLAP
- [52]
+ [79]
+ [52]
DPPA3 (STELLA)
+ [14, 62, 87]
+ [14, 53, 87]
SCP1
– [50]
+ [43, 47, 54]
SCP3
+ [43, 47, 54]
Акрозин
+ [53, 73]
Примечание. Знаком «плюс» показано наличие, знаком «плюс-минус» - возможное наличие, а знаком «минус» - отсут$
ствие экспрессии соответствующих маркеров.
4 БИОХИМИЯ том 84 вып. 3 2019
338
АБДЫЕВ и др.
После заселения гонады под воздействием рети$
ких и экологических причин [90-93] бесплоди$
ноевой кислоты в оогониях инициируется
ем страдают 15-25% пар репродуктивного воз$
мейоз, а в гонаде мужского типа эмбриональные
раста [87, 94]. Можно надеяться, что исследова$
клетки Сертоли синтезируют цитохром Cyp26b1
ния процессов развития ППК in vitro позволят
и разрушают ретиноевую кислоту, в результате
понять механизмы специализации и дифферен$
чего блокируется инициация мейоза [88, 89]
цировки ППК, что приведет к созданию компе$
(рис. 3).
тентных моделей бесплодия, врожденных ано$
Бесплодие является, как правило, неизлечи$
малий и т.д. С другой стороны, получение гоно$
мой патологией, которая вызвана различными
цитов человека in vitro - это новое направление
нарушениями половых клеток, их нефункцио$
вспомогательных репродуктивных технологий.
нальностью или даже полным их отсутствием.
Данные технологии могут быть востребованы
Подсчитано, что в результате снижения качест$
также в случаях, когда пациенты теряют репро$
венных и количественных характеристик мужс$
дуктивные способности вследствие химио$ или
ких и женских половых клеток из$за генетичес$
лучевой терапии злокачественных заболеваний.
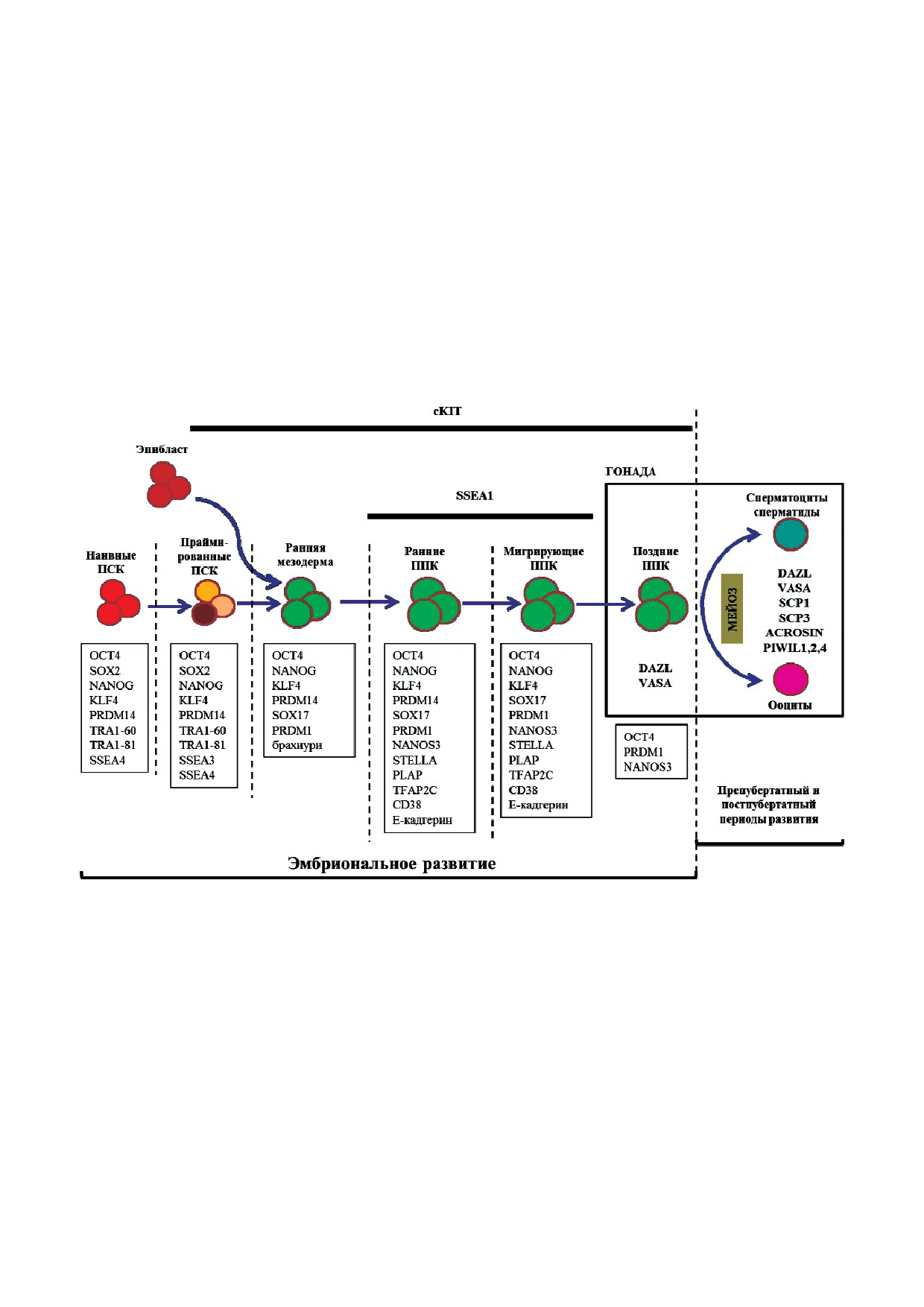
Рис. 3. Схема развития ППК человека. В формировании половых клеток выделяют два основных периода развития: эмбрио$
нальный и препубертатный/постпубертатный. Эмбриональное развитие включает раннее обособление ППК из эпиблас$
та под аллантоисом in vivo, дифференцировку ПСК в раннюю мезодерму, а затем в ранние ППК in vitro, стадию миграции
ППК и заселение ППК в гонаду. Пунктирной линией обозначены переходы между этапами. На каждом переходе активи$
руется и поддерживается экспрессия определенных наборов генов. Эпибласт и праймированные (primed) ПСК начинают
нарабатывать поверхностный белок cKIT, который сохраняется до заселения гонады. Ранние и мигрирующие ППК начи$
нают синтезировать поверхностный маркер SSEA1. Заселившие гонаду поздние ППК активируют мейоз у женского типа
гонады, а в мужском типе продолжается митотическое деление ППК. У женских ППК мейоз проходит до мейоза II деле$
ния и останавливается на стадии метафазы II деления мейоза до оплодотворения. Митотическое и мейотическое деления
женских половых клеток останавливаются в эмбриональном периоде. В препубертатном развитии мужских половых кле$
ток продолжается митотическое деление и структурное формирование семенника. В пубертатный период мужские поло$
вые клетки начинают мейотическое деление и дифференцировку в сперматозоиды. Женские половые клетки созревают
до ооцитов II деления мейоза, и в половозрелом возрасте начинается овуляция. Наивные ПСК - клетки, находящиеся в
состоянии плюрипотентности, схожие с внутренней клеточной массой бластоцисты. Праймированные ПСК - клетки в
состоянии плюрипотентности, схожие с эпибластом предгаструляцонного периода и уже коммитированные к дифферен$
цировке в три зародышевых листка.
С цветным вариантом рис. 3 можно ознакомиться в электронной версии статьи на сайте: www.elibrary.ru
БИОХИМИЯ том 84 вып. 3 2019
ПЕРВИЧНЫЕ ПОЛОВЫЕ КЛЕТКИ ЧЕЛОВЕКА in vitro
339
К перспективам использования ППК и их про$
биомедицины, которая может привести к про$
изводных, полученных in vitro, следует отнести
рыву в понимании биологии плюрипотентности.
приложения в фармацевтике для создания тест$
систем, изучающих влияние лекарственных
Финансирование
средств на половые клетки человека, а также
возможность исследования молекулярного па$
Работа выполнена в рамках Государственного
тогенеза таких болезней, как опухоли половых
задания Института биологии развития им. Н.К. Коль$
клеток, анеуплоидии и аномалии половых хро$
цова РАН.
мосом.
Подводя итог, можно сказать, что культиви$
Конфликт интересов
рование ПСК человека и получение из них ППК
Авторы заявляют об отсутствии конфликта
in vitro является быстро развивающейся сферой интересов.
СПИСОК ЛИТЕРАТУРЫ
1.
Kurimoto, K., Yabuta, Y., Ohinata, Y., Shigeta, M.,
13.
Lange, U.C., Saitou, M., Western, P.S., Barton, S.C., and
Yamanaka, K., and Saitou, M. (2008) Complex genome$
Surani, M.A. (2003) The fragilis interferon$inducible gene
wide transcription dynamics orchestrated by Blimp1 for
family of transmembrane proteins is associated with germ cell
the specification of the germ cell lineage in mice, Genes
specification in mice, BMC Dev. Biol., 3, 1, doi: 10.1186/
Dev., 22, 1617-1635, doi: 10.1101/gad.1649908.
1471$213X$3$1.
2.
Tanaka, S.S., Yamaguchi, Y.L., Tsoi, B., Lickert, H., and
14.
Ohinata, Y., Payer, B., O’Carroll, D., Ancelin, K., Ono, Y.,
Tam, P.P. (2005) IFITM/mil/fragilis family proteins
Sano, M., Barton, S.C., Obukhanych, T., Nussenzweig, M.,
IFITM1 and IFITM3 play distinct roles in mouse primor$
Tarakhovsky, A., and Surani, M.A. (2005) Blimp1 is a critical
dial germ cell homing and repulsion, Dev. Cell., 9,
determinant of the germ cell lineage in mice, Nature, 436,
745-756, doi: 10.1016/j.devcel.2005.10.010.
207-213, doi: 10.1038/nature03813.
3.
Ginsburg, M., Snow, M.H., and McLaren, A. (1990)
15.
Kehler, J., Tolkunova, E., Koschorz, B., Pesce, M., Gentile, L.,
Primordial germ cells in the mouse embryo during gastru$
Boiani, M., Lomeli, H., Nagy, A., McLaughlin, K.J.,
lation, Development, 110, 521-528.
Scholer, H.R., and Tomilin, A. (2004) Oct4 is required for
4.
Irie, N., Tang, W.W., and Azim Surani, M. (2014) Germ
primordial germ cell survival, EMBO Rep., 5, 1078-1083,
cell specification and pluripotency in mammals: a perspec$
doi: 10.1038/sj.embor.7400279.
tive from early embryogenesis, Reprod. Med. Biol., 13,
16.
Okamura, D., Tokitake, Y., Niwa, H., and Matsui, Y. (2008)
203-215. doi: 10.1007/s12522$014$0184$2.
Requirement of Oct3/4 function for germ cell specification,
5.
Saitou, M., and Yamaji, M. (2010) Germ cell specification
Dev. Biol., 317, 576-584, doi: 10.1016/j.ydbio.2008.03.002.
in mice: signaling, transcription regulation, and epigenetic
17.
Chambers, I., Silva, J., Colby, D., Nichols, J., Nijmeijer, B.,
consequences, Reproduction, 139, 931-942, doi: 10.1530/
Robertson, M., Vrana, J., Jones, K., Grotewold, L., and
REP$10$0043.
Smith, A. (2007) Nanog safeguards pluripotency and
6.
De Felici, M. (2013) Origin, migration, and proliferation of
mediates germline development, Nature, 450, 1230-1234,
human primordial germ cells, in Oogenesis (Coticchio, G.,
doi: 10.1038/nature06403.
Albertini, D.F., and De Santis, L., eds.), Springer, London,
18.
Yamaguchi, S., Kurimoto, K., Yabuta, Y., Sasaki, H.,
pp. 19-38, doi: 10.1007/978$0$85729$826$2.
Nakatsuji, N., Saitou, M., and Tada, T. (2009) Conditional
7.
Leitch, H.G., Tang, W.W., and Surani, M.A. (2013)
knockdown of Nanog induces apoptotic cell death in
Primordial germ$cell development and epigenetic repro$
mouse migrating primordial germ cells, Development, 136,
gramming in mammals, Curr. Top. Dev. Biol., 104,
4011-4020, doi: 10.1242/dev.041160.
149-187, doi: 10.1016/B978$0$12$416027$9.00005$X.
19.
Murakami, K., Gunesdogan, U., Zylicz, J.J., Tang, W.W.C.,
8.
Кожухарь В.Г. (2011) Первичные половые клетки мле$
Sengupta, R., Kobayashi, T., Kim, S., Butler, R.,
копитающих и человека. Происхождение, идентифи$
Dietmann, S., and Surani, A.M. (2016) NANOG alone
кация, миграция, Цитология, 53, 211-220.
induces germ cells in primed epiblast in vitro by activation
9.
Lawson, K.A., Dunn, N.R., Roelen, B.A., Zeinstra, L.M.,
of enhancers, Nature, 529, 1-22, doi: 10.1038/nature1
Davis, A.M., Wright, C.V., Korving, J.P., and Hogan, B.L.
6480.
(1999) Mouse embryo Bmp4 is required for the generation
20.
Yamaji, M., Seki, Y., Kurimoto, K., Yabuta, Y., Yuasa, M.,
of primordial germ cells in the mouse embryo, Genes Dev.,
Shigeta, M., Yamanaka, K., Ohinata, Y., and Saitou, M.
13, 424-436.
(2008) Critical function of Prdm14 for the establishment of
10.
Ohinata, Y., Ohta, H., Shigeta, M., Yamanaka, K.,
the germ cell lineage in mice, Nat. Genet., 40, 1016-1022,
Wakayama, T., and Saitou, M. (2009) A signaling principle
doi: 10.1038/ng.186.
for the specification of the germ cell lineage in mice, Cell,
21.
Grabole, N., Tischler, J., Hackett, J.A., Kim, S., Tang, F.,
137, 571-584, doi: 10.1016/j.cell.2009.03.014.
Leitch, H.G., Magnusdottir, E., and Surani, M.A. (2013)
11.
Okamura, D., Hayashi, K., and Matsui, Y. (2005) Mouse
Prdm14 promotes germline fate and naive pluripotency by
epiblasts change responsiveness to BMP4 signal required for
repressing FGF signalling and DNA methylation, EMBO
PGC formation through functions of extraembryonic ecto$
Reports, 14, 629-637, doi:10.1038/embor.2013.67.
derm, Mol. Reprod. Dev., 70, 20-29, doi: 10.1002/mrd.20136.
22.
Gell, J.J., Zhao, J., Chen, D., Hunt, T.J., and Clark, A.T.
12.
Ying, Y., and Zhao, G.Q. (2001) Cooperation of endoderm$
(2018) PRDM14 is expressed in germ cell tumors with
derived BMP2 and extraembryonic ectoderm$derived
constitutive overexpression altering human germline diffe$
BMP4 in primordial germ cell generation in the mouse,
rentiation and proliferation, Stem Cell Res., 27, 46-56,
Dev. Biol., 232, 484-492, doi: 10.1006/dbio.2001.0173.
doi: 10.1016/j.scr.2017.12.016.
БИОХИМИЯ том 84 вып. 3 2019
4*
340
АБДЫЕВ и др.
23.
Weber, S., Eckert, D., Nettersheim, D., Gillis, A.J.,
Wnt3 in vertebrate axis formation, Nat. Genet., 22,
Schafer, S., Kuckenberg, P., Ehlermann, J., Werling, U.,
361-365, doi: 10.1038/11932.
Biermann, K., Looijenga, L.H., and Schorle, H. (2010)
38.
Yoon, Y., Huang, T., Tortelote, G.G., Wakamiya, M.,
Critical function of AP$2 gamma/TCFAP2C in mouse
Hadjantonakis, A.K., Behringer, R.R., and Rivera$Perez, J.A.
embryonic germ cell maintenance, Biol. Reprod., 82,
(2015) Extra$embryonic Wnt3 regulates the establishment
214-223, doi: 10.1095/biolreprod.109.078717.
of the primitive streak in mice, Dev. Biol., 403, 80-88, doi:
24.
Kumar, D.L., and Defalco, T. (2017) Of mice and men: in
10.1016/j.ydbio.2015.04.008.
vivo and in vitro studies of primordial germ cell specifica$
39.
McKay, D.G., Hertig, A.T., Adams, E.C., and Danziger, S.
tion, Semin. Reprod. Med., 35, 139-146, doi: 10.1055/s$
(1953) Histochemical observations on the germ cells of
0037$1599085.
human embryos, Anat. Rec., 117, 201-219, doi: 10.1002/
25.
Vincent, S.D. (2005) The zinc finger transcriptional
ar.1091170206.
repressor Blimp1/Prdm1 is dispensable for early axis for$
40.
Kellokumpu$Lehtinen, P.L., and Soderstrom, K.O. (1978)
mation but is required for specification of primordial germ
Occurrence of nuage in fetal human germ cells, Cell Tissue
cells in the mouse, Development, 132, 1315-1325, doi: 10.1242/
Res., 194, 171-177, doi: 10.1007/BF00209243.
dev.01711.
41.
Findley, S.D., Tamanaha, M., Clegg, N.J., and Ruohola$
26.
Irie, N., Weinberger, L., Tang, W.W., Kobayashi, T.,
Baker, H. (2003) Maelstrom, a Drosophila spindle$class
Viukov, S., Manor, Y.S., Dietmann, S., Hanna, J.H., and
gene, encodes a protein that colocalizes with Vasa and
Surani, M.A. (2015) SOX17 is a critical specifier of human
RDE1/AGO1 homolog, Aubergine, in nuage, Development,
primordial germ cell fate, Cell, 160, 253-268, doi: 10.1016/
130, 859-871, doi: 10.1242/dev.00310.
j.cell.2014.12.013.
42.
Ishidate, T., Ozturk, A.R., Durning, D.J., Sharma, R.,
27.
Tsuda, M., Sasaoka, Y., Kiso, M., Abe, K., Haraguchi, S.,
Shen, E.Z, Chen, H., Seth, M., Shirayama, M., and
Kobayashi, S., and Saga, Y. (2003) Conserved role of nanos
Mello, C.C. (2018) ZNFX$1 functions within perinuclear
proteins in germ cell development, Science,
301,
nuage to balance epigenetic signals, Mol. Cell, 70,
1239-1241, doi: 10.1126/science.1085222.
P639-649.E6, doi: 10.1016/j.molcel.2018.04.009.
28.
Suzuki, H., Tsuda, M., Kiso, M., and Saga, Y. (2008)
43.
Soper, S.F.C., van der Heijden, G.W., Hardiman, T.C.,
Nanos3 maintains the germ cell lineage in the mouse by
Goodheart, M., Martin, S.L., de Boer, P., and Bortvin, A.
suppressing both Bax$dependent and $independent apop$
(2008) Mouse maelstrom, a component of nuage, is essen$
totic pathways, Dev. Biol., 318, 133-142, doi: 10.1016/
tial for spermatogenesis and transposon repression in
j.ydbio.2008.03.020.
meiosis, Dev. Cell., 15, 285-297, doi: 10.1016/j.devcel.
29.
Tanaka, S.S., Toyooka, Y., Akasu, R., Katoh$Fukui, Y.,
2008.05.015.
Nakahara, Y., Suzuki, R., Yokoyama, M., and Noce, T.
44.
Morohaku, K., Tanimoto, R., Sasaki, K., Kawahara$Miki, R.,
(2000) The mouse homolog of Drosophila Vasa is required
Kono, T., Hayashi, K., Hirao, Y., and Obata, Y. (2016)
for the development of male germ cells, Genes Dev., 14,
Complete in vitro generation of fertile oocytes from mouse
841-853, doi: 10.1101/gad.14.7.841.
primordial germ cells, Proc. Natl. Acad. Sci., 113,
30.
Panula, S., Reda, A., Stukenborg, J.$B. B., Ramathal, C.,
201603813-201603817, doi: 10.1073/pnas.1603817113.
Sukhwani, M., Albalushi, H., Edsgard, D., Nakamura, M.,
45.
Zhou, Q., Wang, M., Yuan, Y., Wang, X., Fu, R., Wan, H.,
Soder, O., Orwig, K.E., Yamanaka, S., Reijo Pera, R.A.,
Hirao, Y., and Zhou, Q. (2016) Complete meiosis from
and Hovatta, O. (2016) Over expression of NANOS3 and
embryonic stem cell$derived germ cells in vitro, Cell Stem
DAZL in human embryonic stem cells, PLoS One, 11,
Cell, 18, 330-340, doi: 10.1016/j.stem.2016.01.017.
e0165268, doi: 10.1371/journal.pone.0165268.
46.
Turnpenny, L., Brickwood, S., Spalluto, C.M., Piper, K.,
31.
Schrans$Stassen, B.H., Saunders, P.T., Cooke, H.J., and
Cameron, I.T., Wilson, D.I., and Hanley, N.A. (2003)
de Rooij, D.G. (2001) Nature of the spermatogenic arrest
Derivation of human embryonic germ cells: an alternative
in Dazl-/- mice, Biol. Reprod., 65, 771-776, doi: 10.1095/
source of pluripotent stem cells, Stem Cells, 21, 598-609,
biolreprod65.3.771.
doi: 10.1634/stemcells.21$5$598.
32.
Buehr, M., McLaren, A., Bartley, A., and Darling, S.
47.
Clark, A.T., Bodnar, M.S., Fox, M., Rodriquez, R.T.,
(1993) Proliferation and migration of primordial germ cells
Abeyta, M.J., Firpo, M.T., and Pera, R.A.
(2004)
in We/We mouse embryos, Dev. Dyn., 198, 182-189,
Spontaneous differentiation of germ cells from human
doi: 10.1002/aja.1001980304.
embryonic stem cells in vitro, Hum. Mol. Genet., 13,
33.
Kudo, T., Kaneko, M., Iwasaki, H., Togayachi, A.,
727-739, doi: 10.1093/hmg/ddh088.
Nishihara, S., Abe, K., and Narimatsu, H. (2004) Normal
48.
Tilgner, K., Atkinson, S.P., Golebiewska, A., Stojkovic, M.,
embryonic and germ cell development in mice lacking α
Lako, M., and Armstrong, L. (2008) Isolation of primor$
disappearance of stage$specific embryonic antigen 1 nor$
dial germ cells from differentiating human embryonic stem
mal embryonic and germ cell development in mice lacking
cells, Stem Cells, 26, 3075-3085, doi: 10.1634/stemcells.
1,3$fucosyltransferase IX (Fut9) which show disappea$
2008$0289.
rance of stage$specific E, Mol. Cell. Biol., 24, 4221-4228,
49.
Kee, K., Gonsalves, J.M., Clark, A.T., and Pera, R.A.
doi: 10.1128/MCB.24.10.4221.
(2006) Bone morphogenetic proteins induce germ cell dif$
34.
Payer, B., Saitou, M., Barton, S.C., Thresher, R.,
ferentiation from human embryonic stem cells, Stem Cells
Dixon, J.P.C., Zahn, D., Colledge, W.H., Carlton, M.B.,
Dev., 15, 831-837, doi: 10.1089/scd.2006.15.831.
Nakano, T., and Surani, M.A. (2003) Stella is a maternal
50.
Hubner, K., Fuhrmann, G., Christenson, L.K., Kehler, J.,
effect gene required for normal early development in mice,
Reinbold, R., De La Fuente, R., Wood, J., Strauss, J.F., 3rd,
Curr. Biol., 13, 2110-2117, doi: 10.1016/j.cub.2003.11.026.
Boiani, M., and Scholer, H.R. (2003) Derivation of
35.
Saitou, M., Kagiwada, S., and Kurimoto, K. (2012)
oocytes from mouse embryonic stem cells, Science, 300,
Epigenetic reprogramming in mouse pre$implantation
1251-1256, doi: 10.1126/science.1083452.
development and primordial germ cells, Development, 139,
51.
Geijsen, N., Horoschak, M., Kim, K., Gribnau, J., Eggan, K.,
15-31, doi: 10.1242/dev.050849.
Daley, G.Q., Change, G., and Jaarsveld, V.
(2004)
36.
De Felici, M. (2009) Primordial germ cell biology at the
Derivation of embryonic germ cells and male gametes from
beginning of the XXI century, Int. J. Dev. Biol., 53,
embryonic stem cells, Nature, 427, 148-154, doi: 10.1038/
891-894, doi: 10.1387/ijdb.082815mf.
nature02121.1.
37.
Liu, P., Wakamiya, M., Shea, M.J., Albrecht, U.,
52.
Park, T.S., Galic, Z., Conway, A.E., Lindgren, A., van
Behringer, R.R., and Bradley, A. (1999) Requirement for
Handel, B.J., Magnusson, M., Richter, L., Teitell, M.A.,
БИОХИМИЯ том 84 вып. 3 2019
ПЕРВИЧНЫЕ ПОЛОВЫЕ КЛЕТКИ ЧЕЛОВЕКА in vitro
341
Mikkola, H.K., Lowry, W.E., Plath, K., and Clark, A.T.
toward disease modeling of infertility, Fertil. Steril., 97,
(2009) Derivation of primordial germ cells from human
1250-1259, doi: 10.1016/j.fertnstert.2012.04.037.
embryonic and induced pluripotent stem cells is signifi$
67.
Angeles Julaton, V.T., and Reijo Pera, R.A.
(2011)
cantly improved by coculture with human fetal gonadal
NANOS3 function in human germ cell development, Hum.
cells, Stem Cells, 27, 783-795, doi: 10.1002/stem.13.
Mol. Genet., 20, 2238-2250, doi: 10.1093/hmg/ddr114.
53.
Panula, S., Medrano, J.V., Kee, K., Bergstrom, R.,
68.
Gkountela, S., Li, Z., Vincent, J.J., Zhang, K.X., Chen, A.,
Nguyen, H.N., Byers, B., Wilson, K.D., Wu, J.C., Simon, C.,
Pellegrini, M., and Clark, A.T. (2013) The ontogeny of
Hovatta, O., and Reijo Pera, R.A. (2011) Human germ cell
cKIT+ human primordial germ cells proves to be a resource
differentiation from fetal$ and adult$derived induced
for human germ line reprogramming, imprint erasure and
pluripotent stem cells, Hum. Mol. Genet., 20, 752-762,
in vitro differentiation, Nat. Cell Biol., 15, 113-122,
doi: 10.1093/hmg/ddq520.
doi: 10.1038/ncb2638.
54.
Eguizabal, C., Montserrat, N., Vassena, R., Barragan, M.,
69.
Hackett, J.A., Zylicz, J.J., and Surani, M.A. (2012) Parallel
Garreta, E., Garcia$Quevedo, L., Vidal, F., Giorgetti, A.,
mechanisms of epigenetic reprogramming in the germline,
Veiga, A., and Izpisua Belmonte, J.C. (2011) Complete
Trends Genet., 28, 164-174, doi: 10.1016/j.tig.2012.01.005.
meiosis from human induced pluripotent stem cells, Stem
70.
Hara, K., Kanai$Azuma, M., Uemura, M., Shitara, H.,
Cells, 29, 1186-1195, doi: 10.1002/stem.672.
Taya, C., Yonekawa, H., Kawakami, H., Tsunekawa, N.,
55.
Xie, L., Lin, L., Tang, Q., Li, W., Huang, T., Huo, X., Liu, X.,
Kurohmaru, M., and Kanai, Y. (2009) Evidence for crucial
Jiang, J., He, G., and Ma, L. (2015) Sertoli cell$mediated
role of hindgut expansion in directing proper migration of
differentiation of male germ cell$like cells from human
primordial germ cells in mouse early embryogenesis, Dev.
umbilical cord Wharton’s jelly$derived mesenchymal stem
Biol., 330, 427-439, doi: 10.1016/j.ydbio.2009.04.012.
cells in an in vitro co$culture system, Eur. J. Med. Res., 20,
71.
Perrett, R.M., Turnpenny, L., Eckert, J.J., O’Shea, M.,
9, doi: 10.1186/s40001$014$0080$6.
Sonne, S.B., Cameron, I.T., Wilson, D.I., Rajpert$De
56.
Fujimoto, T., Miyayama, Y., and Fuyuta, M. (1977) The
Meyts, E., and Hanley, N.A. (2008) The early human germ
origin, migration and fine morphology of human primor$
cell lineage does not express SOX2 during in vivo develop$
dial germ cells, Anat. Rec., 188, 315-329, doi: 10.1002/
ment or upon in vitro culture, Biol. Reprod., 78, 852-858,
ar.1091880305.
doi: 10.1095/biolreprod.107.066175.
57.
Funkuda, T. (1976) Ultrastructure of primordial germ cells
72.
West, J.A., Viswanathan, S.R., Yabuuchi, A., Cunniff, K.,
in human embryo, Virchows Archiv. B: Cell Pathology, 20,
Takeuchi, A., Park, I.H., Sero, J.E., Zhu, H., Perez$
85-89.
Atayde, A., Frazier, A.L., Surani, M.A., and Daley, G.Q.
58.
Castrillon, D.H., Quade, B.J., Wang, T.Y., Quigley, C., and
(2009) A role for Lin28 in primordial germ$cell develop$
Crum, C.P. (2000) The human VASA gene is specifically
ment and germ$cell malignancy, Nature, 460, 909-913,
expressed in the germ cell lineage, Proc. Natl. Acad. Sci.
doi: 10.1038/nature08210.
USA, 97, 9585-9590, doi: 10.1073/pnas.160274797.
73.
Easley, C.A., Phillips, B.T., McGuire, M.M., Barringer, J.M.,
59.
Eguizabal, C., Herrera, L., De Onate, L., Montserrat, N.,
Valli, H., Hermann, B.P., Simerly, C.R., Rajkovic, A.,
Hajkova, P., and Izpisua Belmonte, J.C. (2016) Charac$
Miki, T., Orwig, K.E., and Schatten, G.P. (2012) Direct
terization of the epigenetic changes during human gonadal
differentiation of human pluripotent stem cells into haploid
primordial germ cells reprogramming, Stem Cells, 34,
spermatogenic cells, Cell Reports, 2, 440-446, doi: 10.1016/
2418-2428, doi: 10.1002/stem.2422.
j.celrep.2012.07.015.
60.
Kerr, C.L., Hill, C.M., Blumenthal, P.D., and Gearhart, J.D.
74.
Gafni, O., Weinberger, L., Mansour, A.A., Manor, Y.S.,
(2008) Expression of pluripotent stem cell markers in the
Chomsky, E., Ben$Yosef, D., Kalma, Y., Viukov, S., Maza, I.,
human fetal ovary, Hum. Reprod., 23, 589-599, doi: 10.1093/
Zviran, A., Rais, Y., Shipony, Z., Mukamel, Z., Krupalnik, V.,
humrep/dem411.
Zerbib, M., Geula, S., Caspi, I., Schneir, D., Shwartz, T.,
61.
Kerr, C.L., Hill, C.M., Blumenthal, P.D., and Gearhart, J.D.
Gilad, S., Amann$Zalcenstein, D., Benjamin, S., Amit, I.,
(2008) Expression of pluripotent stem cell markers in the
Tanay, A., Massarwa, R., Novershtern, N., and Hanna, J.H.
human fetal testis, Stem Cells, 26, 412-421, doi: 10.1634/
(2013) Derivation of novel human ground state naive
stemcells.2007$0605.
pluripotent stem cells, Nature, 504, 282-286, doi: 10.1038/
62.
Leng, L., Tan, Y., Gong, F., Hu, L., Ouyang, Q., Zhao, Y.,
nature12745.
Lu, G., and Lin, G. (2015) Differentiation of primordial
75.
Kilens, S., Meistermann, Di., Moreno, Di., Chariau, C.,
germ cells from induced pluripotent stem cells of primary ova$
Gaignerie, A., Reignier, A., Lelievre, Y., Casanova, M.,
rian insufficiency, Hum. Reprod., 30, 737-748, doi: 10.1093/
Vallot, C., Nedellec, S., Flippe, L., Firmin, J., Song, J.,
humrep/deu358.
Charpentier, E., Lammers, J., Donnart, A., Marec, N.,
63.
Medrano, J.V., Ramathal, C., Nguyen, H.N., Simon, C.,
Deb, W., Bihouee, A., Le Caignec, C., Pecqueur, C.,
and Reijo Pera, R.A. (2012) Divergent RNA$binding pro$
Redon, R., Barriere, P., Bourdon, J., Pasque, V.,
teins, DAZL and VASA, induce meiotic progression in
Soumillon, M., Mikkelsen, T.S., Rougeulle, C., Freour, T.,
human germ cells derived in vitro, Stem Cells, 30, 441-451,
David, L.; Milieu Interieur Consortium (2018) Parallel
doi: 10.1002/stem.1012.
derivation of isogenic human primed and naive induced
64.
Zhao, Y., Ye, S., Liang, D., Wang, P., Fu, J., Ma, Q., Kong, R.,
pluripotent stem cells, Nat. Commun., 9, 1-13, doi: 10.1038/
Shi, L., Gong, X., Chen, W., Ding, W., Yang, W., Zhu, Z.,
s41467$017$02107$w.
Chen, H., Sun, X., Zhu, J., Li, Z., and Wang, Y. (2018)
76.
Theunissen, T.W., Friedli, M., He, Y., Planet, E., O’Neil, R.C.,
In vitro modeling of human germ cell development using
Markoulaki, S., Pontis, J., Wang, H., Iouranova, A.,
pluripotent stem cells, Stem Cell Reports, 10, 509-523,
Imbeault, M., Duc, J., Cohen, M.A., Wert, K.J.,
doi: 10.1016/j.stemcr.2018.01.001.
Castanon, R., Zhang, Z., Huang, Y., Nery, J.R., Drotar, J.,
65.
Lin, I.Y., Chiu, F.L., Yeang, C.H., Chen, H.F., Chuang, C.Y.,
Lungjangwa, T., Trono, D., Ecker, J.R., and Jaenisch, R.
Yang, S.Y., Hou, P.S., Sintupisut, N., Ho, H.N., Kuo, H.C.,
(2016) Molecular criteria for defining the naive human
and Lin, K.I. (2014) Suppression of the SOX2 neural effector
pluripotent state, Cell Stem Cell, 19, 502-515, doi: 10.1016/
gene by PRDM1 promotes human germ cell fate in emb$
j.stem.2016.06.011.
ryonic stem cells, Stem Cell Reports, 2, 189-204, doi: 10.1016/
77.
Ware, C.B., Nelson, A.M., Mecham, B., Hesson, J., Zhou, W.,
j.stemcr.2013.12.009.
Jonlin, E.C., Jimenez$Caliani, A.J., Deng, X., Cavanaugh, C.,
66.
Hayashi, Y., Saitou, M., and Yamanaka, S.
(2012)
Cook, S., Tesar, P.J., Okada, J., Margaretha, L., Sperber, H.,
Germline development from human pluripotent stem cells
Choi, M., Blau, C.A., Treuting, P.M., Hawkins, R.D.,
БИОХИМИЯ том 84 вып. 3 2019
342
АБДЫЕВ и др.
Cirulli, V., and Ruohola$Baker, H. (2014) Derivation of
85.
Yamaji, M., Ueda, J., Hayashi, K., Ohta, H., Yabuta, Y.,
naive human embryonic stem cells, Proc. Natl. Acad. Sci.
Kurimoto, K., Nakato, R., Yamada, Y., Shirahige, K., and
USA, 111, 4484-4489, doi: 10.1073/pnas.1319738111.
Saitou, M. (2013) PRDM14 ensures naive pluripotency
78.
Watanabe, K., Ueno, M., Kamiya, D., Nishiyama, A.,
through dual regulation of signaling and epigenetic path$
Matsumura, M., Wataya, T., Takahashi, J.B., Nishikawa, S.,
ways in mouse embryonic stem cells, Cell Stem Cell, 12,
Nishikawa, S.I., Muguruma, K., and Sasai, Y. (2007)
368-382, doi: 10.1016/j.stem.2012.12.012.
A ROCK inhibitor permits survival of dissociated human
86.
Chen, D., Gell, J.J., Tao, Y., Sosa, E., and Clark, A.T.
embryonic stem cells, Nat. Biotechnol., 25, 681-686,
(2017) Modeling human infertility with pluripotent stem
doi: 10.1038/nbt1310.
cells, Stem Cell Res., 21, 187-192, doi: 10.1016/j.scr.
79.
Chuang, C.Y., Lin, K.I., Hsiao, M., Stone, L., Chen, H.F.,
2017.04.005.
Huang, Y.H., Lin, S.P., Ho, N.N., and Kuo, H.C. (2012)
87.
Singh, K., and Jaiswal, D. (2011) Human male infertility:
Meiotic competent human germ cell$like cells derived
a complex multifactorial phenotype, Reprod. Sci., 18, 418-425,
from human embryonic stem cells induced by BMP4/
doi: 10.1177/1933719111398148.
WNT3A signaling and OCT4/EpCAM (epithelial cell
88.
Bowles, J. (2006) Retinoid signaling determines germ cell
adhesion molecule) selection, J. Biol. Chem.,
287,
fate in mice, Science, 312, 596-600, doi: 10.1126/science.
14389-14401, doi: 10.1074/jbc.M111.338434.
1125691.
80.
Sugawa, F., Arauzo$Bravo, M. J., Yoon, J., Kim, K.$P.,
89.
MacLean, G., Li, H., Metzger, D., Chambon, P., and
Aramaki, S., Wu, G., Stehling, M., Psathaki, O.E.,
Petkovich, M. (2007) Apoptotic extinction of germ cells in
Hubner, K., and Scholer, H.R. (2015) Human primordial
testes of Cyp26b1 knockout mice, Endocrinology, 148,
germ cell commitment in vitro associates with a unique
4560-4567, doi: 10.1210/en.2007$0492.
PRDM14 expression profile, EMBO J., 34, 1009-1024,
90.
Abrao, M.S., Muzii, L., and Marana, R.
(2013)
doi: 10.15252/embj.201488049.
Anatomical causes of female infertility and their manage$
81.
Bernardo, A.S., Faial, T., Gardner, L., Niakan, K.K.,
ment, Int. J. Gynecol. Obstet., 123, Suppl. 2, S18-S24,
Ortmann, D., Senner, C.E., Callery, E.M., Trotter, M.W.,
doi: 10.1016/j.ijgo.2013.09.008.
Hemberger, M., Smith, J.C., Bardwell, L., Moffett, A.,
91.
Anawalt, B.D. (2013) Approach to male infertility and
and Pedersen, R.A. (2011) BRACHYURY and CDX2
induction of spermatogenesis, J. Clin. Endocrinol. Metab.,
mediate BMP$induced differentiation of human and
98, 3532-3542, doi: 10.1210/jc.2012$2400.
mouse pluripotent stem cells into embryonic and extraem$
92.
Rieger, D. (2012) Culture systems: physiological and envi$
bryonic lineages, Cell Stem Cell, 9, 144-155, doi: 10.1016/
ronmental factors that can affect the outcome of human
j.stem.2011.06.015.
ART, Methods Mol. Biol., 912, 333-354, doi: 10.1007/978$1$
82.
Aramaki, S., Hayashi, K., Kurimoto, K., Ohta, H., Yabuta, Y.,
61779$971$6_19.
Iwanari, H., Mochizuki, Y., Hamakubo, T., Kato, Y.,
93.
Sharpe, R.M. (2010) Environmental/lifestyle effects on
Shirahige, K., and Saitou, M. (2013) A mesodermal factor, T,
spermatogenesis, Philos. Trans. R Soc. Lond B Biol. Sci.,
specifies mouse germ cell fate by directly activating
365, 1697-1712, doi: 10.1098/rstb.2009.0206.
germline determinants, Dev. Cell, 27, 516-529, doi: 10.1016/
94.
Handel, M.A., Eppig, J.J., and Schimenti, J.C. (2014)
j.devcel.2013.11.001.
Applying “gold standards” to in vitro$derived germ cells,
83.
Sasaki, K., Yokobayashi, S., Nakamura, T., Okamoto, I.,
Cell, 157, 1257-1261, doi: 10.1016/j.cell.2014.05.019.
Yabuta, Y., Kurimoto, K., Ohta, H., Moritoki, Y., Iwatani, C.,
95.
Bourillot, P.Y., Aksoy, I., Schreiber, V., Wianny, F., Schulz, H.,
Tsuchiya, H., Nakamura, S., Sekiguchi, K., Sakuma, T.,
Hummel, O., Hubner, N., and Savatier, P. (2009) Novel
Yamamoto, T., Mori, T., Woltjen, K., Nakagawa, M.,
STAT3 target genes exert distinct roles in the inhibition of
Yamamoto, T., Takahashi, K., Yamanaka, S., and Saitou, M.
mesoderm and endoderm differentiation in cooperation
(2015) Robust in vitro induction of human germ cell fate
with Nanog, Stem Cells, 27, 1760-1771, doi: 10.1002/stem.110.
from pluripotent stem cells, Cell Stem Cell, 17, 178-194,
96.
Daheron, L., Opitz, S.L., Zaehres, H., Lensch, W.M.,
doi: 10.1016/j.stem.2015.06.014.
Andrews, P.W., Itskovitz$Eldor, J., and Daley, G.Q. (2004)
84.
Saitou, M., Barton, S.C., and Surani, M.A. (2002) A mole$
LIF/STAT3 signaling fails to maintain self$renewal of
cular programme for the specification of germ cell fate in
human embryonic stem cells, Stem Cells, 22, 770-778, doi: 10.
mice, Nature, 418, 293-300, doi: 10.1038/nature00927.
1634/stemcells.22$5$770.
MODERN TECHNOLOGIES DERIVING
HUMAN PRIMORDIAL GERM CELLS in vitro
V. K. Abdyyev1*, E. B. Dashinimayev2,3, I. V. Neklyudova1, E. A. Vorotelyak1,2,3, and A. V. Vasilyev1,2
1 Lomonosov Moscow State University, Faculty of Biology, 119991 Moscow, Russia
2 Koltzov Institute of Developmental Biology, Russian Academy of Sciences, 119334 Moscow, Russia
3 Pirogov Russian Research Medical University, 117997 Moscow, Russia
Received September 14, 2018
Revised November 20, 2018
Accepted November 20, 2018
Primordial germ cells are unique type of stem cells capable of giving rise to totipotent stem cells and ensure the fer$
tility of an organism and the transfer of genome to the next generation. The research of primordial germ cells is an
important field of developmental biology, which includes fundamental studies of early embryogenesis and developing
technologies for obtaining primordial germ cells in vitro as promising treatment of infertility in the future. Considering
ethical concerns related to studies on human embryos, the main approach in human primary germ cells research is in
vitro studies on cells. In this review, we have considered the historical perspective of human primary germ cell
researches in vitro, the main existing models and further outlooks and applications in medicine and science.
Keywords: primordial germ cells, PGCs, iPSCs, ESCs, VASA, PRDM1, human
БИОХИМИЯ том 84 вып. 3 2019