БИОХИМИЯ, 2019, том 84, вып. 3, с. 343 - 353
УДК 611.018.2
ВНЕКЛЕТОЧНЫЙ МАТРИКС В РЕГУЛЯЦИИ
ДИФФЕРЕНЦИРОВКИ СТВОЛОВЫХ КЛЕТОК
Обзор
© 2019 Е.С. Новоселецкая1,2, О.А. Григорьева1,
А.Ю. Ефименко1,2*, Н.И. Калинина2
1 Институт регенеративной медицины, Медицинский научно образовательный центр,
Московский государственный университет им. М.В. Ломоносова,
119991 Москва, Россия; электронная почта: efimenkoan@gmail.com
2 Московский государственный университет им. М.В. Ломоносова,
факультет фундаментальной медицины, 119991 Москва, Россия.
Поступила в редакцию 09.11.2018
После доработки 06.12.2018
Принята к публикации 06.12.2018
Белки внеклеточного матрикса (ВКМ) заполняют пространство между клетками в многоклеточных орга!
низмах, создавая структуру органов и тканей. Механические свойства ВКМ хорошо изучены. В настоящее
время интенсивно исследуется роль отдельных компонентов ВКМ и трехмерных тканеспецифичных мат!
риксов в регуляции функциональной активности клеток, их пролиферации, миграции, приобретении спе!
циализированного фенотипа и его поддержании. В данном обзоре рассмотрены основные структурные бел!
ки, ферменты и внеклеточные везикулы, входящие в состав ВКМ; приведены данные об участии компонен!
тов ВКМ в регуляции дифференцировки и самоподдержания стволовых клеток; рассмотрены подходы к
моделированию микроокружения стволовых клеток с помощью децеллюляризированного ВКМ.
КЛЮЧЕВЫЕ СЛОВА: внеклеточный матрикс, стволовые клетки, дифференцировка, ниша стволовой клет!
ки, внеклеточные везикулы, децеллюляризация.
DOI: 10.1134/S0320972519030059
ОСНОВНЫЕ КОМПОНЕНТЫ
нов. Однако такой взгляд начал меняться с от!
ВНЕКЛЕТОЧНОГО МАТРИКСА
крытием интегринов, и в настоящий момент вне!
клеточный матрикс (ВКМ) считают необходи!
Если бы многоклеточные организмы состоя!
мой составляющей живого организма, определя!
ли из одних лишь плотно упакованных клеток,
ющей не только функции отдельно взятых кле!
они представляли бы собой разного размера ша!
ток, но и согласованную работу ткани в целом.
ры, и только благодаря способности клеток про!
Молекулярный состав ВКМ в организме
дуцировать внеклеточный матрикс стало воз!
постоянно обновляется, начиная с оплодотво!
можно появление всего многообразия форм жи!
рения яйцеклетки. У млекопитающих яйце!
вых существ. Долгое время внеклеточный ком!
клетка окружена выраженным матриксом (zona
понент, или матрикс (от лат. mater - основа),
pellucida), а при оплодотворении вследствие
рассматривали исключительно как инертную
кортикальной реакции происходит секреция
упаковку, создающую структуру тканей и орга!
новых матриксных белков, необходимых для
последующей имплантации и созревания эмб!
риона. В дальнейшем реализация программ
Принятые сокращения: ВКМ - внеклеточный мат!
специализации клеток эмбриона приводит к
рикс; дВКМ - децеллюляризированный ВКМ; ММП -
металлопротеиназа; МСК - мезенхимные стромальные
изменениям состава и морфологии ВКМ, необ!
клетки; NGN3 - нейрогенин 3 (neurogenin!3); PDX1 -
ходимым для формирования таких структур,
фактор транскрипции поджелудочной железы и желез две! как трубки, тяжи, пласты и полости. Нокаут ге!
надцатиперстной кишки (pancreatic and duodenal homeo! нов, кодирующих белки ВКМ, приводит к ги!
box 1); TAZ - коактиватор транскрипции с PDZ!связыва!
бели организма в эмбриональном или раннем
ющим мотивом (transcriptional coactivator with PDZ!binding
motif); TGF!β - трансформирующий фактор роста бета;
постнатальном периодах, а жизнеспособные
YAP (Yes!associated protein) - Yes!ассоциированный белок.
мутанты страдают от нарушений в скелетных
* Адресат для корреспонденции.
тканях, сердечно!сосудистой и центральной
343
344
НОВОСЕЛЕЦКАЯ и др.
нервной системах (суммировано в работе Rozario
менее 300 генов. Помимо структурных белков, в
и DeSimone [1]).
построении и обновлении матрикса активное
В уже сформированном постнатальном орга!
участие принимают ферменты, в первую оче!
низме ВКМ поддерживает функциональную ак!
редь матриксные металлопротеиназы (ММП),
тивность клеток, в т.ч. стволовых клеток. Некий
обусловливающие полимеризацию и созревание
усредненный ВКМ можно представить в виде
белковых фибрилл, а также протеолиз белков
трехмерной сети, сформированной такими фиб!
ВКМ [6]. Следует отметить, что под действием
риллярными белками, как коллаген, эластин,
различных ферментов происходят высвобожде!
тенасцины и фибронектин, которая помещена в
ние и активация депонированных в ВКМ фак!
трехмерный пористый гель, образованный не!
торов роста [7]. Так, в результате активности
фибриллярными коллагенами, перлеканом,
трансглутаминаз могут образовываться ковалент!
бигликаном, агрином и другими протеоглика!
ные связи в белке LTBP, связывающем транс!
нами. В зависимости от ткани соотношение
формирующий фактор роста бета (TGF!β), что
фибрилл и геля, а также плотность фибрилляр!
приводит к высвобождению активного TGF!β -
ной сети, величина и распределение пор протео!
известного регулятора гомеостаза ВКМ.
гликанового геля могут значительно меняться.
Считается, что тканеспецифичность ВКМ
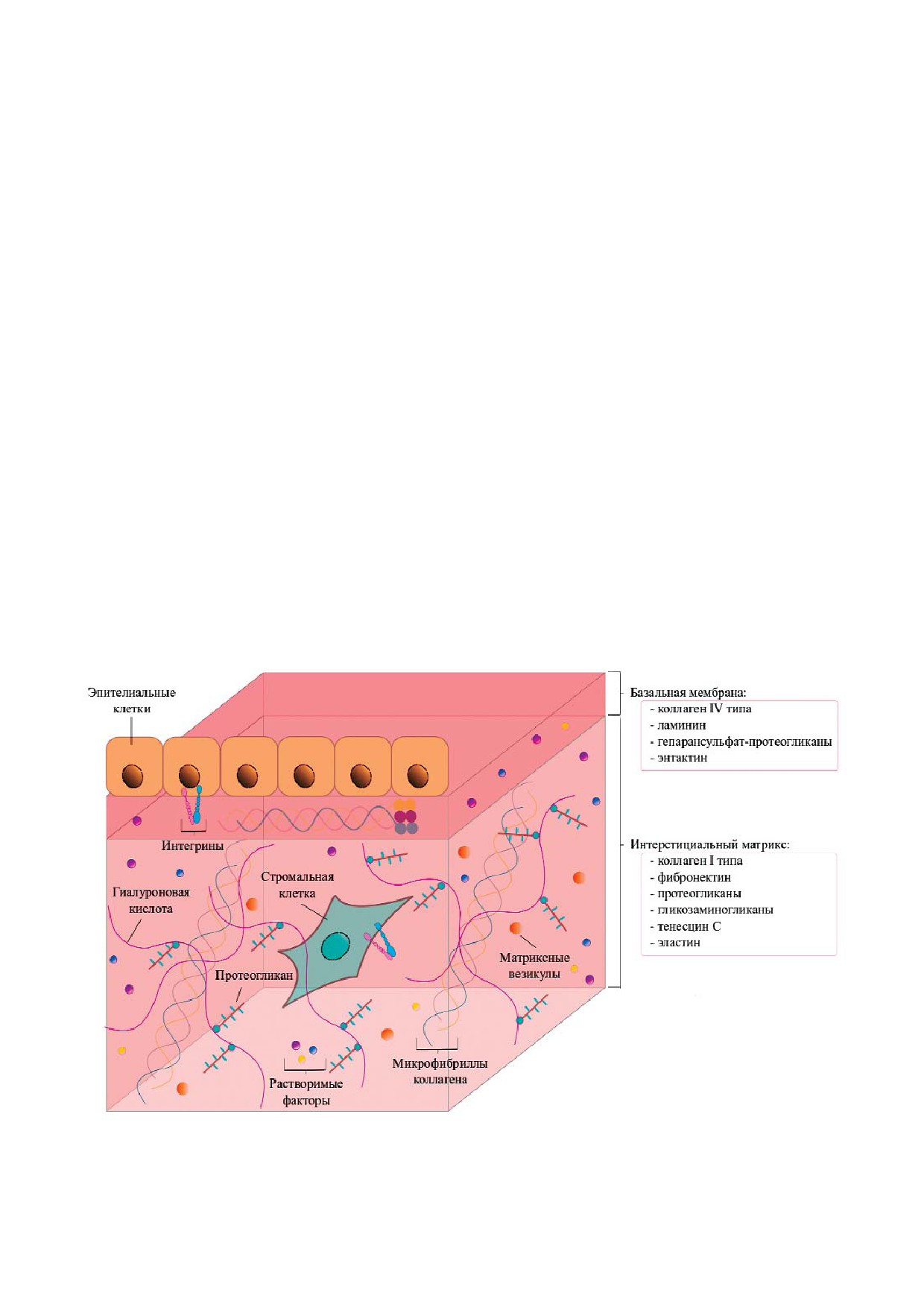
У млекопитающих существуют два типа ВКМ -
обеспечивается благодаря различиям клеточно!
интерстициальный матрикс и базальная мемб!
го состава тканей. Однако известно, что клетки
рана [2, 3]. В интерстициальном матриксе пре!
сходного фенотипа и функции, выделенные из
обладают фибриллярные белки [4], тогда как ба!
разных тканей, различаются по профилю экс!
зальная мембрана образована преимущественно
прессии белков ВКМ. Так, сравнительный про!
нефибриллярными белками, формирующими
теомный анализ ВКМ, секретированного ме!
пластины плотного геля [5] (рис. 1).
зенхимными стромальными клетками (МСК)
Состав ВКМ тканеспецифичен, несмотря на
костного мозга и жировой ткани, показал нали!
сравнительно небольшое количество генов, ко!
чие уникальных наборов белков, продуцируе!
дирующих так называемые структурные белки
мых каждым типом клеток. Это позволяет пред!
ВКМ. Так, у позвоночных структурные белки
полагать, что тканеспецифичность ВКМ фор!
ВКМ (коллагены, неколлагеновые гликопроте!
мируется уже в процессах гисто! и органогенеза
иды и протеогликаны) являются продуктами
и впоследствии поддерживается [8].
Рис. 1. Структура интерстициального матрикса и базальной мембраны млекопитающих
БИОХИМИЯ том 84 вып. 3 2019
РЕГУЛЯТОРНАЯ РОЛЬ ВНЕКЛЕТОЧНОГО МАТРИКСА
345
Данные последних лет убедительно доказы!
В микроокружении стволовых клеток были
вают, что в обновлении и перестройке ВМК, его
обнаружены многие структурные белки ВКМ,
деградации и минерализации важнейшую роль
включая коллагены, ламинины, фибронектин и
играют внеклеточные везикулы. Это мембран!
протеогликаны, клетки, синтезирующие и раз!
ные везикулы, которые могут происходить из
рушающие их [22], а также паракринные факто!
мультивезикулярных телец (экзосомы) или слу!
ры, оказывающие влияние на взаимодействие
щиваться с поверхности плазматической мемб!
стволовых клеток с матриксом [23].
раны (микровезикулы). В состав внеклеточных
Критическое значение ВКМ в поддержании
везикул входят белки, биоактивные липиды и
фенотипа стволовых клеток было установлено с
регуляторные РНК, которыми клетки могут об!
помощью лазерной абляции, после которой уже
мениваться друг с другом. В матриксе присут!
коммитированные к дифференцировке потом!
ствие внеклеточных везикул связывали с физио!
ки стволовой клетки заселяли пустую нишу и
логической и патологической минерализацией
приобретали фенотип стволовых клеток [24].
ВКМ [9-11]. В настоящее время показано, что
Ряд исследований показал, что ВКМ способ!
внеклеточные везикулы не только способствуют
ствует дифференцировке стволовых клеток в
кальцификации ВКМ [12, 13], но и активно
клетки той ткани, из которой он был выделен.
участвуют в его ремоделировании. Так, внекле!
Это доказывает, что ВКМ обладает тканеспеци!
точные везикулы содержат ферменты, расщеп!
фичностью в поддержании определенной ниши
ляющие ВКМ, включая ММП, гепараназы, гиа!
для клеток [25]. ВКМ обеспечивает адекватное
луронидазы и т.д. [14], а также сульфатирован!
расположение клеток микроокружения, а также
ные и несульфатированные гликозаминоглика!
их пролиферацию, поляризацию, миграцию,
ны. Более того, в состав мембран внеклеточных
что косвенно определяет дифференцировочный
везикул могут входить интегрины, что позволя!
статус стволовой клетки [7].
ет им взаимодействовать с белками ВКМ и
Какие клетки могут быть источником ВКМ,
распределяться в нем неслучайным образом.
необходимым для стволовых клеток? Наиболее
Таким образом, ВКМ представляет собой
вероятными кандидатами являются клетки
тканеспецифичную сеть белковых полимеров,
стромы, включая фибробласты, миофиброблас!
состав которой определяет его жесткость и уп!
ты и прогениторные стромальные клетки. Одна!
ругость, пористость, степень гидратации и спо!
ко далеко не все стромальные клетки обнаружи!
собность взаимодействовать с клетками, внекле!
ваются в непосредственном микроокружении
точными везикулами и такими биологически
стволовой клетки, а факторы, определяющие
активными молекулами, как факторы роста и др.
количество ниш стволовых клеток в конкретной
Все эти свойства ВКМ обусловливают его спо!
ткани, остаются неизвестными. В костном моз!
собность регулировать активность клеток, в
ге было обнаружено, что в состав ниш гематопо!
частности стволовых клеток постнатального
этических стволовых клеток входят прогенитор!
организма.
ные стромальные клетки [26]. Это наблюдение
позволяет предположить, что микроокружение
стволовых клеток в других тканях также форми!
ВКМ КАК КОМПОНЕНТ НИШИ
руется именно прогениторными стромальными
СТВОЛОВОЙ КЛЕТКИ
клетками. Действительно, такие клетки входят в
состав микроокружения стволовых клеток воло!
Обновление многих тканей организма чело!
сяного фолликула, а также скелетных мышц
века происходит благодаря пролиферации и
[27]. Однако для выяснения роли ВКМ, проду!
дифференцировке тканеспецифичных стволо!
цируемого стромальными прогениторными клет!
вых клеток, которые в тканях располагаются в
ками, в регуляции тканеспецифичных стволовых
специализированных «нишах». Понятие «ниша
клеток требуются дальнейшие исследования.
стволовой клетки» впервые было введено в 1978 г.
Можно выделить несколько основных меха!
Schofield [15] для гемопоэтических стволовых
низмов влияния белков ВКМ на активность
клеток и в дальнейшем было развито и примене!
стволовых клеток: 1) связывание с рецепторами
но для других типов стволовых клеток [16-19].
на поверхности клеток, 2) высвобождение/удер!
Согласно современным представлениям, нишу
жание факторов роста и других биологически!
стволовой клетки следует рассматривать как ди!
активных молекул, 3) депонирование внекле!
намичное микроокружение, которое обеспечи!
точных везикул. Прежде всего, клетки взаимо!
вает поддержание стволовых клеток в покоя!
действуют с белками ВКМ посредством транс!
щемся состоянии и активацию их пролифера!
мембранных рецепторов, среди которых наибо!
ции и дифференцировки под воздействием
лее изученными являются интегрины. Это транс!
внешних сигналов [7, 20, 21].
мембранные белки I типа, формирующие неко!
БИОХИМИЯ том 84 вып. 3 2019
346
НОВОСЕЛЕЦКАЯ и др.
валентно связанные гетеродимеры. У млеко!
ся запуск дифференцировки эпидермальных
питающих обнаружено 18 генов, кодирующих
стволовых клеток [32, 33] и асимметричное де!
α!субъединицы, и 8 генов, кодирующих β!субъ!
ление в нише сателлитных клеток скелетных
единицы, которые образуют 24 различных гете!
мышц [34]. Белки ВКМ стимулируют актива!
родимера. Следует отметить, что β1! и αV!субъ!
цию стволовых клеток эпителия молочных же!
единицы входят в состав 12 и 5 димеров соответ!
лез, клональную экспансию клеток!предшест!
ственно, в то время как прочие субъединицы
венников и рост альвеол посредством связыва!
встречаются только в одном гетеродимере. Спе!
ния с αVβ3!интегрином [35]. Молекулы ВКМ
цифичность связывания интегринов определя!
модулируют поддержание и дифференцировку
ется обеими субъединицами: все αV!интегрины
ниши нервных стволовых клеток, а также влия!
(α5β1, α8β1, αIIbβ3) связывают трипептид RGD
ют на миграцию малодифференцированных
в составе белков ВКМ; интегрины α4β1, α4β7,
клеток данной ниши [36]. Gu et al. показали, что
α9β1, β2 и αEβ7 взаимодействуют с последова!
ВКМ, продуцируемый шванновскими клетка!
тельностью L/I!D/E!V/S/T!P/S в остеопонтине
ми, может стимулировать рост аксонов и нейро!
и фибронектине; интегрины, α!субъединицы
нов спинального ганглия in vitro [37]. Saghatelyan
которых содержат A!домен (α1β1, α2β1, α10β1 и
et al. продемонстрировали экспрессию тенасци!
α11β1), связывают ламинины и коллагены; ин!
на!R в обонятельной луковице, где он способ!
тегрины α3β1, α6β1, α7β1 и α6β4 также взаимо!
ствует откреплению и радиальной миграции
действуют с ламининами, распознавая иную
нейрогенных предшественников [38].
последовательность, чем субъединицы, содер!
ВКМ имеет значение не только для регуля!
жащие A!домен.
ции миграции клеток, симметричности их деле!
Помимо структурных белков ВКМ, доказан!
ния, но и для распространения механических
ными лигандами интегринов также являются
воздействий по ткани. Так, модуль и вектор
ММП, плазминоген и такие факторы роста, как
распространения механических напряжений ре!
фактор роста соединительной ткани (CTGF),
гулирует поведение сателлитных клеток скелет!
фактор роста эндотелия сосудов (VEGF) и TGF!β
ных мышц [39]. Клетки способны распознавать
[28]. Взаимодействие интегринов с лигандами
механические сигналы и изменения эластич!
приводит к формированию адгезивных контак!
ности ВКМ. Наиболее изученным механизмом ме!
тов, в состав которых входят до 180 белков,
ханорецепции является интегрин!зависимая сбор!
включая сами интегрины, белки актинового ци!
ка фокальных контактов, которая приводит к пе!
тоскелета, а также многие ферменты, участвую!
рестройке цитоскелета и активации Rho!GTPазы.
щие в инициации передачи сигнала в ядро клет!
Сборка актиновых филаментов может напря!
ки [29]. На важность взаимодействия интегри!
мую влиять на транскрипцию генов посред!
нов с ВКМ в регуляции активности стволовых
ством активации белков ядерной оболочки
клеток указывает, например, тот факт, что неко!
неспринов, которые передают сигнал на ламин А,
торые интегрины выполняют функцию маркер!
расположенный в непосредственной близости
ных белков, определяющих иммунофенотип
от внутренней ядерной мембраны. Ламин А, в
стволовых клеток. Так, α6!субъединица интег!
свою очередь, взаимодействует с ДНК, регули!
ринов является маркерным белком нейральных,
руя экспрессию генов. Так, увеличение экспрес!
эмбриональных и гематопоэтических клеток.
сии ламина А опосредует индукцию остеоген!
Более того, дифференцировка эмбриональных
ной дифференцировки МСК в ответ на увеличе!
стволовых клеток сопровождается переключе!
ние жесткости ВКМ [40]. Кроме того, Rho!
нием экспрессии сплайс!изоформ этой субъеди!
GTPаза может вызывать активацию внутрикле!
ницы [30].
точного сигнального пути, опосредованного
Экспрессия интегринов необходима для на!
белками каскада Hippo, YAP (Yes!associated pro!
правленной миграции стволовых клеток, удер!
tein) и TAZ (transcriptional coactivator with PDZ!
жания их в нише, регуляции их пролиферации и
binding motif). YAP и TAZ регулируют диффе!
дифференцировки. Так, поддержание стволо!
ренцировку стволовых клеток в ответ на изме!
вых клеток в недифференцированном состоя!
нение механических свойств ВКМ и активиру!
нии, в первую очередь в эпителиальных нишах,
ют пролиферацию стволовых клеток эпителия
напрямую опосредовано локальным влиянием
кишечника, которые начинают дифференциро!
белков базальной мембраны, преимущественно
ваться на более эластичных субстратах [41]. В не!
ламининов [31, 32]. Потеря контакта с базаль!
давно опубликованной статье Mamidi et al. (2018)
ной мембраной при асимметричном делении
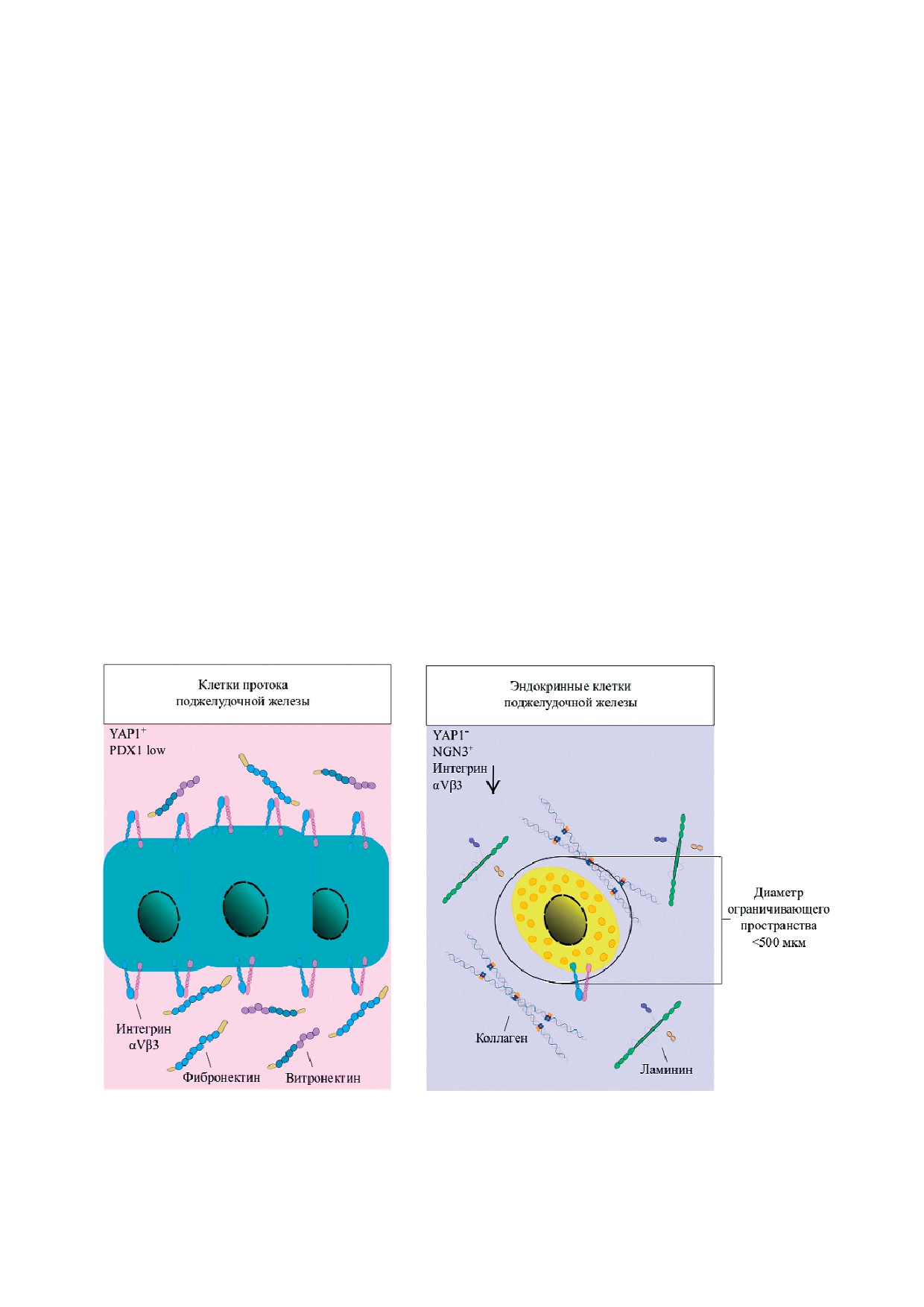
показана ключевая роль ВКМ в определении
стволовой клетки приводит к индукции диффе!
направления дифференцировки бипотентных
ренцировки одной из ее дочерних клеток. Ха!
прогениторных клеток поджелудочной железы
рактерными примерами этих процессов являют!
через взаимодействие компонентов сигнальной
БИОХИМИЯ том 84 вып. 3 2019
РЕГУЛЯТОРНАЯ РОЛЬ ВНЕКЛЕТОЧНОГО МАТРИКСА
347
оси «αV!интегрин - F!актин - YAP1- Notch»
Важную роль в ВКМ!опосредованном влия!
(рис. 2) [42]. Помимо интегринов и комплексов
нии на дифференцировку стволовых клеток мо!
фокальных контактов в качестве механорецеп!
жет играть соотношение разных изоформ белка
торов могут выступать ионные каналы, семидо!
в окружении клеток. Так, сдвиг соотношения
менные рецепторы, липидные плоты и гликока!
ламинина!332 и ламинина!511 в нише эпидер!
ликс. Теоретически любой белок (мультибелко!
мальной стволовой клетки приводит к подавле!
вый комплекс) плазматической мембраны мо!
нию BMP!сигнализации и активации TGF!β! и
жет участвовать в восприятии сигналов об изме!
Wnt!зависимых сигнальных путей, что, в свою
нениях механических свойств ВКМ.
очередь, запускает дифференцировку [44]. Кро!
В нишах стволовых клеток ВКМ формирует
ме того, ламинин!332, секретируемый при за!
микроанатомические компартменты и обусловли!
живлении раны и развитии волосяного фолли!
вает их разграничение. Так, базальная мембрана
кула, подвергается специфическому протеоли!
может ограничивать миграцию клеток и диффу!
тическому расщеплению, которое имеет решаю!
зию растворимых факторов, создавая локальную
щее значение для миграции кератиноцитов [45].
асимметрию в распределении регуляторных сиг!
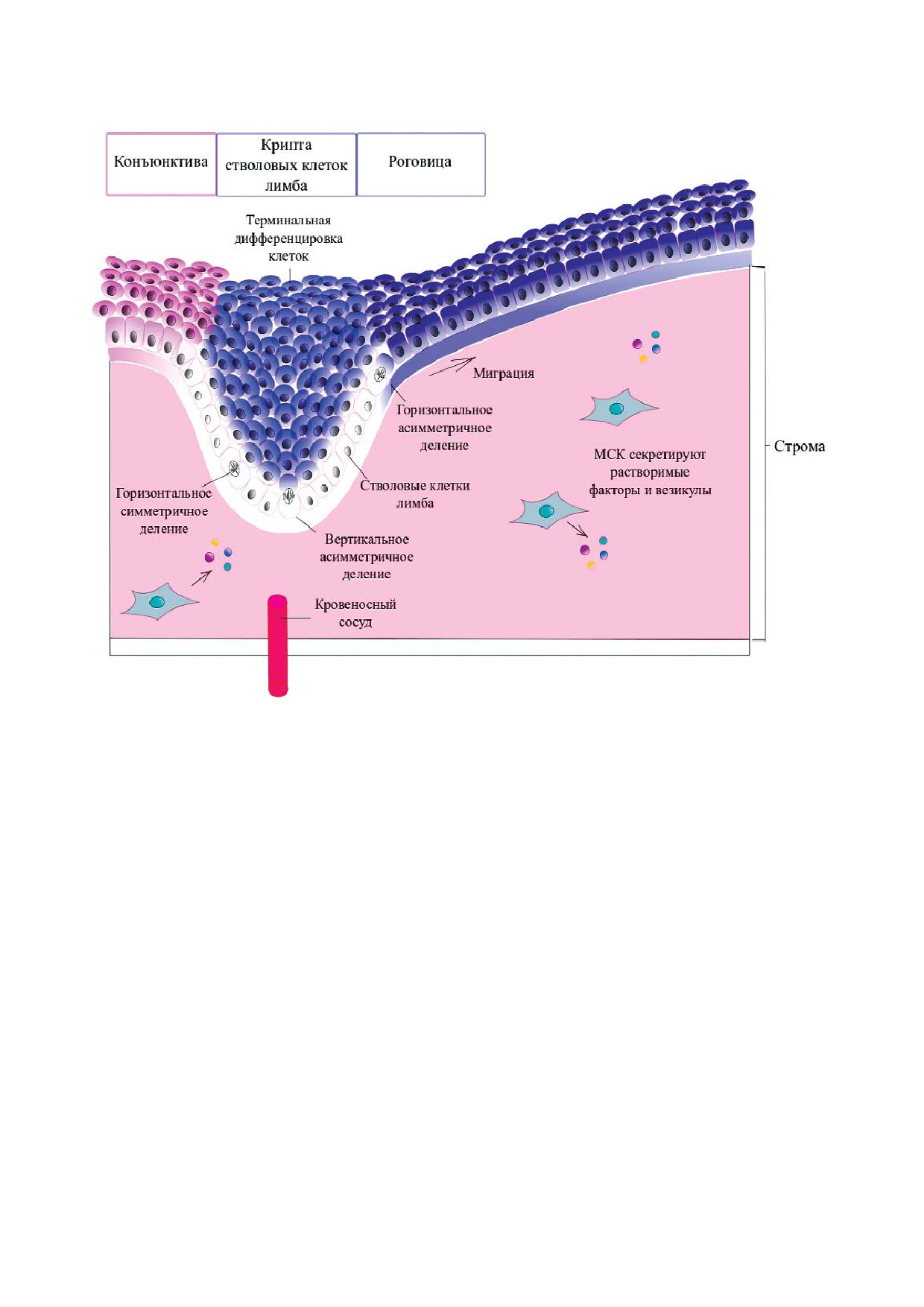
Примером влияния состава и строения ВКМ
налов [31]. Определенные факторы роста могут
на судьбу стволовых клеток может служить
удерживаться в отдельных микрокомпартментах
крипта эпителиальных стволовых клеток лимба
при гликозилировании ВКМ, формируя гради!
глаза. Состав белковых компонентов базальной
ент по отношению к стволовой клетке [43]. Мно!
мембраны лимба и роговицы определяет ориен!
гие другие молекулы также могут быть депони!
тацию веретена деления лимбальных стволовых
рованы в матриксе, при этом высвобождение и
клеток, а также дальнейшую миграцию и диф!
функционирование этих иммобилизованных
ференцировку их дочерних клеток (рис. 3). Бо!
факторов происходит при протеолитическом
лее того, ВКМ лимба может вызывать диффе!
расщеплении ВКМ в процессе ремоделирова!
ренцировку стволовых клеток волосяного фол!
ния ткани при морфогенезе и заживлении после
ликула в клетки эпителия роговицы [46].
повреждения [7]. Кроме того, сами белки ВКМ
Возможным механизмом опосредованного
могут являться источниками коротких пепти!
влияния ВКМ на дифференцировку стволовых
дов, которые участвуют в регуляции миграции и
клеток является презентация внеклеточных ве!
дифференцировки клеток сосудистой стенки.
зикул, которые также могут быть заякоренными
Рис. 2. Выбор направления дифференцировки прогениторных клеток поджелудочной железы мыши в эндокринные клет!
ки или клетки протоков в зависимости от состава и механических свойств внеклеточного матрикса
БИОХИМИЯ том 84 вып. 3 2019
348
НОВОСЕЛЕЦКАЯ и др.
Рис. 3. Роль состава и структуры внеклеточного матрикса в регуляции пролиферации и дифференцировки лимбальных
стволовых клеток человека
в матриксе, прежде всего, благодаря присутствию
бождение депонированных в нем факторов.
интегринов в составе их мембран. Таргетное
Стволовые и окружающие их клетки способны
связывание внеклеточных везикул с клетками!
обмениваться внеклеточными везикулами, что
реципиентами (например, через взаимодей!
приводит к переносу между ними регуляторных
ствие фосфатидилсерина с его рецептором на
и матричных РНК и перепрограммированию кле!
поверхности клеток) приводит к активации мак!
ток. Например, стволовые клетки опухолей с
ропиноцитоза и внутриклеточной сигнализации
помощью внеклеточных везикул могут «подго!
через тирозинкиназные пути. Важно отметить,
тавливать» стромальное микроокружение и фор!
что распределение внеклеточных везикул в
мировать удаленные метастатические ниши. Не!
ВКМ может создавать локальный градиент та!
ясно, однако, происходит ли такой «перенос ни!
кого важного для контроля дифференцировки
ши» для тканеспецифических стволовых клеток.
клеток фактора, как Wnt, перенос которого меж!
ВКМ также контролирует продукцию участвую!
ду клетками опосредован внеклеточными вези!
щих в регуляции миграции клеток внеклеточ!
кулами [47]. Другие факторы роста, включая
ных везикул (миграсом), в частности, связыва!
фактор некроза опухолей (TNF), эпидермаль!
ясь с интегринами на поверхности клеток.
ный фактор роста (EGF), фактор роста фибро!
Белки ВКМ и внеклеточные везикулы влия!
бластов (FGF), и их рецепторы также входят в
ют на дифференцировку стволовых клеток, уси!
состав внеклеточных везикул и могут быть депо!
ливая или ингибируя воздействие друг друга на
нированы во ВКМ. Кроме того, ММП, перено!
клетки. Так, сочетание ВКМ, специфичного для
симые внеклеточными везикулами, потенци!
остеобластов или адипоцитов, с внеклеточными
ально опосредуют деградацию ВКМ и высво!
везикулами, выделенными из этих клеток, быст!
БИОХИМИЯ том 84 вып. 3 2019
РЕГУЛЯТОРНАЯ РОЛЬ ВНЕКЛЕТОЧНОГО МАТРИКСА
349
рее активировало экспрессию маркерных генов
ционирования ниши стволовых клеток и мик!
в МСК по сравнению с ВКМ или внеклеточны!
роокружения клеток данный подход не привел.
ми везикулами, использованными по отдель!
Неоднократно были предприняты попытки
ности. Более того, культивирование МСК на
изучения влияния компонентов ВКМ на клетки
адипоцитарном ВКМ в присутствии внеклеточ!
в модельных системах, в т.ч. отечественными
ных везикул остеобластов индуцировало экспрес!
учеными (Г.П. Пинаев с соавт.). Так, МСК кост!
сию маркерных генов остеобластов, а культиви!
ного мозга, а также первичные клетки, выделен!
рование на ВКМ остеобластов в присутствии
ные из хряща, были высажены на покрытия из
внеклеточных везикул адипоцитов - экспрес!
коллагена, фибронектина или ламинина [53].
сию адипоцитарных генов. Эти данные указыва!
Было продемонстрировано, что клетки на каж!
ют на то, что внеклеточные везикулы могут ин!
дом покрытии имели разную морфологию. Кро!
гибировать воздействие тканеспецифичного
ме того, сравнение одного из компонентов ВКМ
ВКМ [48].
(коллагена I типа или фибронектина) с ВКМ,
Таким образом, как состав, так и физические
полученным из клеточного пласта МСК, проде!
свойства ВКМ влияют на самоподдержание,
монстрировало значимую достоверную разницу
пролиферацию и дифференцировку стволовых
в преимуществе функциональных эффектов
клеток. Это доказывает, что ВКМ является неза!
ВКМ [54, 55].
менимым участником формирования ниш ство!
Для изучения влияния ВКМ на стволовые
ловых клеток и поддержания их функциониро!
клетки используется также метод микропаттер!
вания. Однако механизмы влияния ВКМ на ак!
новых островков, который позволяет распреде!
тивность стволовых клеток при обновлении и
лить отдельные компоненты или паттерны ВКМ
восстановлении тканей остаются еще малоизу!
определенных форм и размеров на покровном
ченными.
стекле, а также обеспечивает селективную адге!
зию клеток в исследуемой области. Микропат!
терновые островки могут использоваться для
МОДЕЛИРОВАНИЕ
культивирования одиночных клеток, а также
МИКРООКРУЖЕНИЯ КЛЕТОК
для изучения специфических способов регуля!
С ПОМОЩЬЮ ВКМ И ЕГО
ции поведения стволовых клеток. Так, эпидер!
КОМПОНЕНТОВ
мальные стволовые клетки, культивируемые на
самых маленьких островках, с бóльшей вероят!
В настоящий момент используется несколь!
ностью дифференцируются, чем клетки с бóль!
ко подходов к исследованию и моделированию
шей свободой распространения, что позволяет
ВКМ как компонента микроокружения стволо!
установить влияние отдельных характеристик
вых клеток. Во многих работах изучается влия!
ВКМ на результат дифференцировки [56].
ние отдельных компонентов ВКМ или их ком!
Несмотря на огромный спектр используе!
бинаций на клетки в культуре. Например, куль!
мых подходов к моделированию ВКМ ex vivo,
тивирование клеток, иммобилизованных в гид!
большинство из них воспроизводят только от!
рогеле, используется для исследования влияния
дельные аспекты влияния компонентов ВКМ на
протеогликанов. При таком подходе клетка ока!
клетки и мало приближены к естественным ус!
зывается заключенной в полимерную сеть гид!
ловиям клеточного микроокружения в первую
рогеля, которая позволяет пропускать различ!
очередь из!за сложности воссоздания всего
ные вещества для создания определенного фе!
комплекса макромолекул, содержащихся в
нотипа у аллогенных или аутологичных клеток
ВКМ, включая депонированные в нем факторы
[49].
роста, внеклеточные везикулы и другие биоак!
Первые попытки моделирования микроок!
тивные компоненты. Перспективным подходом
ружения клеток ex vivo были предприняты при
для решения этой проблемы, в т.ч. для модели!
оптимизации условий культивирования ряда
рования ниши стволовой клетки, является полу!
клеточных линий с помощью витронектина, ла!
чение тканеспецифичного ВКМ с помощью де!
минина!111 или смеси ламининов, выделенных
целлюляризации сформированной клетками
из плаценты [50, 51]. Условия воссоздания мик!
многослойной пластинки (клеточного пласта),
роокружения часто связывают с такими свой!
ткани или тканеинженерной конструкции. Та!
ствами ВКМ, как топография поверхности
кой децеллюляризированный ВКМ (дВКМ) во
(прежде всего распределение участков связыва!
многом сохраняет состав и структуру исходного
ния интегринов и неинтегриновых рецепторов),
матрикса, включая дополнительные компонен!
жесткость, химическая модификация различны!
ты, и создает необходимое микроокружение для
ми биоактивными факторами [21, 49, 52]. Одна!
активности клеток, которые будут контактиро!
ко к значительным успехам в понимании функ!
вать с дВКМ in vitro или in vivo. Эти преимущест!
БИОХИМИЯ том 84 вып. 3 2019
350
НОВОСЕЛЕЦКАЯ и др.
ва могут помочь преодолеть один из важнейших
как новый перспективный биоматериал для уп!
недостатков синтетических полимеров - отсут!
равления регенеративными процессами. При
ствие сигналов распознавания клеток, а также
этом дВКМ обладает также значительным ангио!
обеспечить тканеспецифичный шаблон с естест!
генным потенциалом, что было показано в экс!
венной микроструктурой, способствующей естест!
периментах по привлечению эндотелиальных
венному формированию новых тканей [57].
клеток, их адгезии и активации формирования
Матриксы с уникальными физико!химичес!
трубчатых структур [69]. Кроме того, создание
кими свойствами, сформированные клетками
биоматериала из ВКМ на разных стадиях диф!
различных линий (например, фибробластами
ференцировки может помочь в оценке влияния
кожи, астроцитами и МСК), были использова!
микроокружения взрослого организма на ство!
ны в ряде биологических и медицинских иссле!
ловые клетки в нише [70].
дований [58-61]. Децеллюляризация этих кле!
Таким образом, ВКМ является одним из клю!
точных матриц позволяет получать аутологич!
чевых компонентов микроокружения стволовых
ные конструкции из стволовых или дифферен!
клеток и играет важную роль в регуляции их са!
цированных клеток [62]. Большинство работ
моподдержания и дифференцировки. Механиз!
проводили с использованием МСК, т.к. было
мы влияния ВКМ и отдельных макромолекул в
показано, что в секретоме этих клеток широко
его составе на различные типы стволовых и про!
представлены структурные белки ВКМ и моди!
гениторных клеток активно изучаются. На ос!
фицирующие их ферменты [63, 64], а также бы!
нове результатов этих исследований в настоя!
ла экспериментально подтверждена их способ!
щее время разрабатываются подходы к созда!
ность секретировать, депонировать и организо!
нию наиболее приближенных к естественным
вывать свой ВКМ [65].
условий культивирования клеток для поддержа!
В ряде работ изучалось влияние дВКМ на
ния их нормального функционирования, в т.ч.
дифференцировку МСК в хондрогенном, остео!
за счет использования отдельных белков или
генном и адипогенном направлениях. Исследо!
сложного комплекса макромолекул, содержа!
вание дифференцировки МСК костного мозга
щихся в ВКМ. Среди последних используемых
человека при культивировании на дВКМ, полу!
подходов наиболее перспективным представля!
ченном из этих же клеток, в сравнении с пласти!
ется децеллюляризация тканей или тканеинже!
ком показало значительное усиление индуциро!
нерных конструкций, состоящих из клеток, ко!
ванной дифференцировки в остеогенном и ади!
торые способны продуцировать компоненты
погенном направлениях при культивировании
ВКМ, необходимые для поддержания «стволо!
на дВКМ [66]. Продемонстрировано, что спо!
вости» и регуляции дифференцировки стволо!
собность МСК старых мышей к остеогенной
вых и прогениторных клеток. Однако для выяс!
дифференцировке, снижающаяся в результате
нения молекулярных механизмов взаимодей!
старения, может быть восстановлена, если их
ствия стволовых клеток с ВКМ и установления
культивировать на дВКМ, полученном из МСК
роли отдельных компонентов ВКМ в этих про!
молодых особей [67]. Данное явление также бы!
цессах необходимы дальнейшие исследования.
ло выявлено при культивировании МСК, выде!
ленных из костного мозга взрослого человека,
на дВКМ, полученном из МСК костного мозга
Финансирование
эмбриона человека. При выделении клеток и
последующем культивировании на дВКМ наб!
Работа выполнена при поддержке РНФ
людали бóльшее количество клеток, культиви!
(грант № 14!15!00439; исследование роли вне!
рование на матриксе также ускоряло дифферен!
клеточных везикул и взаимодействия ВКМ с МСК)
цировку МСК в остеогенном и адипогенном
и Минобрнауки России (грант № MK!2422.2017.7;
направлениях [68]. Таким образом, ВКМ, выде!
использование децеллюляризации для изучения
ленный из МСК, можно использовать для под!
роли ВКМ).
держания функциональных свойств самих МСК.
Приведенные выше примеры поддержания
Конфликт интересов
мультипотентности стволовых клеток и актива!
ции их дифференцировки [56, 66, 67] характери!
Авторы заявляют об отсутствии конфликта
зуют дВКМ, продуцируемый МСК человека,
интересов.
БИОХИМИЯ том 84 вып. 3 2019
РЕГУЛЯТОРНАЯ РОЛЬ ВНЕКЛЕТОЧНОГО МАТРИКСА
351
СПИСОК ЛИТЕРАТУРЫ
1.
Rozario, T., and DeSimone, D.W. (2010) The extracellular
tiation, PLoS One, 13, e0193059, doi: 10.1371/journal.
matrix in development and morphogenesis: a dynamic
pone.0193059.
view, Dev. Biol., 341, 126-140, doi: 10.1016/j.ydbio.
14.
Nawaz, M., Shah, N., Zanetti, B., Maugeri, M., Silvestre, R.,
2009.10.026.
Fatima, F., Neder, L., and Valadi, H. (2018) Extracellular
2.
Chen, F.M., and Liu, X. (2016) Advancing biomaterials of
vesicles and matrix remodeling enzymes: the emerging roles
human origin for tissue engineering, Prog. Polym. Sci., 53,
in extracellular matrix remodeling, progression of diseases
86-168, doi: 10.1016/j.progpolymsci.2015.02.004.
and tissue repair, Cells, 7, 167, doi: 10.3390/cells7100167.
3.
Yi, S., Ding, F., Gong, L., and Gu, X. (2017) Extracellular mat!
15.
Schofield, R. (1978) The relationship between the spleen
rix scaffolds for tissue engineering and regenerative medicine,
colony!forming cell and the haemopoietic stem cell, Blood
Curr. Stem Cell Res. Ther., 12, 233-246, doi: 10.2174/
Cells, 4, 7-25.
1574888X11666160905092513.
16.
Mashinchian, O., Pisconti, A., Le Moal, E., and Bentzin!
4.
Egeblad, M., Rasch, M.G., and Weaver, V.M. (2010)
ger, C.F. (2018) The muscle stem cell niche in health and
Dynamic interplay between the collagen scaffold and
disease, Curr. Top. Dev. Biol., 126, 23-65, doi: 10.1016/bs.
tumor evolution, Curr. Opin. Cell Biol., 22, 697-706, doi:
ctdb.2017.08.003.
10.1016/j.ceb.2010.08.015.
17.
Spit, M., Koo, B.K., and Maurice, M.M. (2018) Tales from
5.
Yurchenco, P.D. (2011) Basement membranes: cell scaf!
the crypt: intestinal niche signals in tissue renewal, plasticity
foldings and signaling platforms, Cold Spring Harb. Perspect
and cancer, Open Biol., 8, 180120, doi: 10.1098/rsob.180120.
Biol., 3, a004911, doi: 10.1101/cshperspect.a004911.
18.
Guo, P., Sun, H., Zhang, Y., Tighe, S., Chen, S., Su, C.W.,
6.
Naba, A., Clauser, K.R., Ding, H., Whittaker, C.A., Carr, S.A.,
Liu, Y., Zhao, H., Hu, M., and Zhu, Y. (2018) Limbal niche
and Hynes, R.O. (2016) The extracellular matrix: tools and
cells are a potent resource of adult mesenchymal progeni!
insights for the «omics» era, Matrix Biol., 49, 10-24,
tors, J. Cell Mol. Med., 22, 3315-3322, doi: 10.1111/
doi: 10.1016/ j.matbio.2015.06.003.
jcmm.13635.
7.
Gattazzo, F., Urciuolo, A., and Bonaldo, P.
(2014)
19.
Matarredona, E.R., Talaveron, R., and Pastor, A.M. (2018)
Extracellular matrix: a dynamic microenvironment for
Interactions between neural progenitor cells and microglia
stem cell niche, Biochim. Biophys. Acta, 1840, 2506-2519,
in the subventricular zone: physiological implications in
doi: 10.1016/j.bbagen.2014.01.010.
the neurogenic niche and after implantation in the injured
8.
Ragelle, H., Naba, A., Larson, B.L., Zhou, F., Prijic, M.,
brain, Front. Cell Neurosci., 12, 268, doi: 10.3389/fncel.
Whittaker, C.A., Rosarioa, A.D., Langer, R., Hynes, R.O.,
2018.00268.
and Anderson, D.G. (2017) Comprehensive proteomic
20.
Нимирицкий П.П., Сагарадзе Г.Д., Ефименко А.Ю.,
characterization of stem cell!derived extracellular matrices,
Макаревич П.И., Ткачук В.А. (2018) Ниша стволовой
Biomaterials, 128, 147-159, doi: 10.1016/j.biomaterials.
клетки, Цитология, 60, 575-586, doi: 10.31116/tsitol.
2017.03.008.
2018.08.01.
9.
Anderson, H.C. (1967) Electron microscopic studies of
21.
Donnelly, H., Salmeron!Sanchez, M., and Dalby, M.J.
induced cartilage development and calcification, J. Cell
(2018) Designing stem cell niches for differentiation and self!
Biol., 35, 81-101, doi: 10.1083/jcb.35.1.81.
renewal, J. R. Soc. Interface, 15, 20180388, doi: 10.1098/
10.
Bonucci, E. (1967) Fine structure of early cartilage calcifi!
rsif.2018.0388.
cation, J. Ultrastruct. Res., 20, 33-50, doi: 10.1016/S0022!
22.
Omelyanenko, N.P., and Karpov, I.N. (2017) Patterns of
5320(67)80034!0.
cell-matrix interactions during formation the distraction
11.
Yanez!Mo, M., Siljander, P.R.M., Andreu, Z., Bedina
bone regenerates, Bull. Exp. Biol. Med., 163, 510-514,
Zavec, A., Borras, F.E., Buzas, E.I., Buzas, K., Casal, E.,
doi: 10.1007/s10517!017!3840!9.
Cappello, F., Carvalho, J., Colas, E., Cordeiro!da Silva, A.,
23.
Muncie, J.M., and Weaver, V.M. (2018) The physical and
Fais, S., Falcon!Perez, J.M., Ghobrial, I.M., Giebel, B.,
biochemical properties of the extracellular matrix regulate
Gimona, M., Graner, M., Gursel, I., Gursel, M.,
cell fate, Curr. Top. Dev. Biol., 130, 1-37, doi: 10.1016/bs.
Heegaard, N.H.H., Hendrix, A., Kierulf, P., Kokubun, K.,
ctdb.2018.02.002.
Kosanovic, M., Kralj!Iglic, V., Kramer!Albers, E.!M.,
24.
Chermnykh, E., Kalabusheva, E., and Vorotelyak, E.
Laitinen, S., Lasser, C., Lener, T., Ligeti, E., Line, A., Lipps, G.,
(2018) Extracellular matrix as a regulator of epidermal
Llorente, A., Lotvall, J., Mancek!Keber, M., Marcilla, A.,
stem cell fate, Int. J. Mol. Sci., 19, 1003, doi: 10.3390/
Mittelbrunn, M., Nazarenko, I., Nolte!‘t Hoen, E.N.M.,
ijms19041003.
Nyman, T.A., O’Driscoll, L., Olivan, M., Oliveira, C.,
25.
Agmon, G., and Christman, K.L. (2016) Controlling stem
Pallinger, E., del Portillo, H.A., Reventos, J., Rigau, M.,
cell behavior with decellularized extracellular matrix scaf!
Rohde, E., Sammar, M., Sanchez!Madrid, F., Santarem, N.,
folds, Curr. Opin. Solid. State Mater. Sci., 20, 193-201, doi:
Schallmoser, K., Ostenfeld, M.S., Stoorvogel, W., Stukelj, R.,
10.1016/j.cossms.2016.02.001.
van der Grein, S.G., Vasconcelos, M.H., Wauben, M.H.M.,
26.
Mendez!Ferrer, S., Michurina, T.V., Ferraro, F., Maz!
and Colas, E. (2015) Biological properties of extracellular
loom, A.R., MacArthur, B.D., Lira, S.A., Scadden, D.T.,
vesicles and their physiological functions, J. Extracell.
Ma’ayan, A., Enikolopov, G.N., and Frenette, P.S. (2010)
Vesicles, 4, 27066, doi: 10.3402/jev.v4.27066.
Mesenchymal and haematopoietic stem cells form a unique
12.
Kapustin, A., Davies, J.D., Reynolds, J.L., McNair, R.,
bone marrow niche, Nature, 466, 829-834, doi: 10.1038/
Jones, G.T., Sidibe, A., Schurgers, L.J., Skepper, J.N.,
nature09262.
Proudfoot, D., Mayr, M., and Shanahan, C.M. (2011)
27.
Kfoury, Y., and Scadden, D.T. (2015) Mesenchymal cell
Calcium regulates key components of vascular smooth
contributions to the stem cell niche, Cell Stem Cell, 16,
muscle cell!derived matrix vesicles to enhance mineraliza!
239-253, doi: 10.1016/j.stem.2015.02.019.
tion, Circ. Res., 109, e1-e12, doi: 10.1161/CIRCRESAHA.
28.
Humphries, J.D., Byron, A., and Humphries, M.J. (2006)
110.238808.
Integrin ligands at a glance, J. Cell Sci., 119, 3901-3903,
13.
Wang, X., Omar, O., Vazirisani, F., Thomsen, P., and
doi: 10.1242/jcs.03098.
Ekstrom, K. (2018) Mesenchymal stem cell!derived exo!
29.
Geiger, T., and Zaidel!Bar, R. (2012) Opening the flood!
somes have altered microRNA profiles and induce osteo!
gates: proteomics and the integrin adhesome, Curr. Opin.
genic differentiation depending on the stage of differen!
Cell Biol., 24, 562-568, doi: 10.1016/j.ceb.2012.05.004.
БИОХИМИЯ том 84 вып. 3 2019
352
НОВОСЕЛЕЦКАЯ и др.
30.
Zhou, Z., Qu, J., He, L., Peng, H., Chen, P., and Zhou, Y.
45.
Sugawara, K., Tsuruta, D., Ishii, M., Jones, J.C., and
(2018) α6!Integrin alternative splicing: distinct cytoplas!
Kobayashi, H. (2008) Laminin!332 and !511 in skin, Exp.
mic variants in stem cell fate specification and niche inter!
Dermatol., 17, 473-480, doi: 10.1111/j.1600!0625.2008.
action, Stem Cell Res. Ther., 9, 122, doi: 10.1186/s13287!
00721.x.
018!0868!3.
46.
Nowell, C.S., and Radtke, F. (2017) Corneal epithelial
31.
Fujiwara, H., Ferreira, M., Donati, G., Marciano, D.K.,
stem cells and their niche at a glance, J. Cell Sci., 130,
Linton, J.M., Sato, Y., Hartner, A., Sekiguchi, K.,
1021-1025, doi: 10.1242/jcs.198119.
Reichardt, L.F., and Watt, F.M. (2011) The basement
47.
Shapiro, I.M., Landis, W.J., and Risbud, M.V. (2015)
membrane of hair follicle stem cells is a muscle cell niche,
Matrix vesicles: are they anchored exosomes? Bone, 79,
Cell, 144, 577-589, doi: 10.1016/j.cell.2011.01.014.
29-36, doi: 10.1016/j.bone.2015.05.013.
32.
Yamada, T., Hasegawa, S., Miyachi, K., Date, Y., Inoue, Y.,
48.
Narayanan, K., Kumar, S., Padmanabhan, P., Gulyas, B.,
Yagami, A., Arima, M., Iwata, Y., Yamamoto, N., Nakata, S.,
Wan, A.C., and Rajendran, V.M. (2018) Lineage!specific
Matsunaga, K., Sugiura, K., and Akamatsu, H. (2018)
exosomes could override extracellular matrix mediated
Laminin!332 regulates differentiation of human interfol!
human mesenchymal stem cell differentiation, Biomaterials,
licular epidermal stem cells, Mech. Ageing Dev., 171,
182, 312-322, doi: 10.1016/j.biomaterials.2018.08.027.
37-46, doi: 10.1016/j.mad.2018.03.007.
49.
Thomas, D., O’Brien, T., and Pandit, A. (2018) Toward
33.
Elbediwy, A., Vincent!Mistiaen, Z.I., and Thompson, B.J.
customized extracellular niche engineering: progress in
(2016) YAP and TAZ in epithelial stem cells: a sensor for
cell!entrapment technologies, Adv. Mat., 30, 1703948,
cell polarity, mechanical forces and tissue damage,
doi: 10.1002/adma.201703948.
Bioessays, 38, 644-653, doi: 10.1002/bies.201600037.
50.
Klebe, R.J. (1974) Isolation of a collagen!dependent cell
34.
Kuang, S., Kuroda, K., Le Grand, F., and Rudnicki, M.A.
attachment factor, Nature, 250, 248-251, doi: 10.1038/
(2007) Asymmetric self!renewal and commitment of satellite
250248a0.
stem cells in muscle, Cell, 129, 999-1010, doi: 10.1016/
51.
Timpl, R., Rohde, H., Robey, P.G., Rennard, S.I., Foidart, J.M.,
j.cell.2007.03.044.
and Martin, G.R. (1979) Laminin - a glycoprotein from base!
35.
Desgrosellier, S., Lesperance, J., Seguin, L., Gozo, M.,
ment membranes, J. Biol. Chem., 254, 9933-9937, doi: 114518.
Kato, S., Franovic, A., Yebra, M., Shattil, S.J., and Che!
52.
Takebayashi, T., Horii, T., Denno, H., Nakamachi, N.,
resh, D.A. (2014) Integrin αvβ3 drives Slug activation and
Otomo, K., Kitamura, S., Miyamoto, K., Horiuchi, T.,
stemness in the pregnant and neoplastic mammary gland,
and Ohta, Y. (2013) Human mesenchymal stem cells dif!
Dev. Cell, 30, 295-308, doi: 10.1016/j.devcel.2014.06.005.
ferentiate to epithelial cells when cultured on thick colla!
36.
Barros, C.S., Franco, S.J., and Muller, U.
(2011)
gen gel, Biomed. Mater. Eng., 23, 143-153, doi: 10.3233/
Extracellular matrix: functions in the nervous system, Cold
BME!120739.
Spring Harb. Perspect. Biol., 3, a005108, doi: 10.1101/csh!
53.
Sachenberg, E.I., Nikolaenko, N.N., and Pinaev, G.P.
perspect.a005108.
(2015) Spreading and actin cytoskeleton organization of
37.
Gu, Y., Zhu, J., Xue, C., Li, Z., Ding, F., Yang, Y., and Gu, X.
cartilage and bone marrow stromal cells cocultured on
(2014) Chitosan/silk fibroin!based, Schwann cell!derived
various extracellular matrix proteins, Cell Tissue Biol., 9,
extracellular matrix!modified scaffolds for bridging rat sciatic
1-8, doi: 10.1134/S1990519X15010083.
nerve gaps, Biomaterials, 35, 2253-2263, doi: 10.1016/
54.
Chen, X.D., Dusevich, V., Feng, J.Q., Manolagas, S.C.,
j.biomaterials.2013.11.087.
and Jilka, R.L. (2007) Extracellular matrix made by bone
38.
Saghatelyan, A., De Chevigny, A., Schachner, M., and
marrow cells facilitates expansion of marrow!derived mesen!
Lledo, P.M. (2004) Tenascin!R mediates activity!depen!
chymal progenitor cells and prevents their differentiation
dent recruitment of neuroblasts in the adult mouse fore!
into osteoblasts, J. Bone Miner. Res., 22, 1943-1956,
brain, Nat. Neurosci., 7, 347, doi: 10.1038/nn1211.
doi: 10.1359/jbmr.070725.
39.
Gilbert, P.M., Havenstrite, K.L., Magnusson, K.E.G., Sacco, A.,
55.
Lai, Y., Sun, Y., Skinner, C.M., Son, E.L., Lu, Z., Tuan, R.S.,
Leonardi, N.A., Kraft, P., Nguyen, N.K., Thrun, S.,
Jilka, R.L., Ling, J., and Chen, X.D. (2010) Reconstitu!
Lutolf, M.P., and Blau, H.M. (2010) Substrate elasticity
tion of marrow!derived extracellular matrix ex vivo: a ro!
regulates skeletal muscle stem cell self!renewal in culture,
bust culture system for expanding large!scale highly func!
Science, 329, 1078-1081, doi: 10.1126/science. 1191035.
tional human mesenchymal stem cells, Stem Cells Dev., 19,
40.
Swift, J., Ivanovska, I.L., Buxboim, A., Harada, T.,
1095-1107, doi: 10.1089/scd.2009.0217.
Dingal, P.D.P., Pinter, J., Pajerowski, J.D., Spinler, K.R.,
56.
Connelly, J.T., Gautrot, J.E., Trappmann, B., Tan, D.W.M.,
Shin, J.!W., Tewari, M., Rehfeldt, F., Speicher, D.W., and
Donati, G., Huck, W.T., and Watt, F.M. (2010) Actin and
Rehfeldt, F. (2013) Nuclear lamin!A scales with tissue
serum response factor transduce physical cues from the
stiffness and enhances matrix!directed differentiation,
microenvironment to regulate epidermal stem cell fate
Science, 341, 1240104, doi: 10.1126/science.1240104.
decisions, Nat. Cell Biol., 12, 711, doi: 10.1038/ncb2074.
41.
Meran, L., Baulies, A., and Li, V.S. (2017) Intestinal stem
57.
Chen, F.M., and Liu, X. (2016) Advancing biomaterials of
cell niche: the extracellular matrix and cellular compo!
human origin for tissue engineering, Prog. Polym. Sci., 53,
nents, Stem Cells Int., 2017, 7970385, doi: 10.1155/2017/
86-168, doi: 10.1016/j.progpolymsci.2015.02.004.
7970385.
58.
Wolchok, J.C., and Tresco, P.A. (2010) The isolation of cell
42.
Mamidi, A., Prawiro, C., Seymour, P.A., de Lichtenberg, K.H.,
derived extracellular matrix constructs using sacrificial
Jackson, A., Serup, P., and Semb, H. (2018) Mechanosig!
open!cell foams, Biomaterials, 31, 9595-9603, doi: 10.1016/
nalling via integrins directs fate decisions of pancreatic
j.biomaterials.2010.08.072.
progenitors, Nature, 564, 114-118, doi: 10.1038/s41586!
59.
Costa!Almeida, R., Granja, P.L., Soares, R., and
018!0762!2.
Guerreiro, S.G. (2014) Cellular strategies to promote vas!
43.
Brizzi, M.F., Tarone, G., and Defilippi, P.
(2012)
cularisation in tissue engineering applications, Eur. Cell
Extracellular matrix, integrins, and growth factors as tailors
Mater., 28, 51-57, doi: 10.22203/eCM.v028a05.
of the stem cell niche, Curr. Opin. Cell Biol., 24, 645-651,
60.
Lu, W.D., Zhang, L., Wu, C.L., Liu, Z.G., Lei, G.Y., Liu, J.,
doi: 10.1016/j.ceb.2012.07.001.
Gao, W., and Hu, Y.R. (2014) Development of an acellular
44.
Ahmed, М., and French!Constant, C. (2016) Extracellular
tumor extracellular matrix as a three!dimensional scaffold
matrix regulation of stem cell behavior, Curr. Stem Cell
for tumor engineering, PLoS One, 9, e103672, doi: 10.1371/
Rep., 2, 197-206, doi: 10.1007/s40778!016!0056!2.
journal.pone.0103672.
БИОХИМИЯ том 84 вып. 3 2019
РЕГУЛЯТОРНАЯ РОЛЬ ВНЕКЛЕТОЧНОГО МАТРИКСА
353
61. Xing, Q., Yates, K., Tahtinen, M., Shearier, E., Qian, Z.,
66. Shakouri!Motlagh, A., O’Connor, A.J., Brennecke, S.P.,
and Zhao, F. (2014) Decellularization of fibroblast cell
Kalionis, B., and Heath, D.E. (2017) Native and solubi!
sheets for natural extracellular matrix scaffold preparation,
lized decellularized extracellular matrix: a critical assess!
Tissue Eng. Part C Methods., 21, 77-87, doi: 10.1089/ten.
ment of their potential for improving the expansion of mesen!
tec.2013.0666.
chymal stem cells, Acta Biomater., 55, 1-12, doi: 10.1016/
62. Cheng, C.W., Solorio, L.D., and Alsberg, E. (2014) De!
j.actbio.2017.04.014.
cellularized tissue and cell!derived extracellular matrices as
67. Sun, Y., Li, W., Lu, Z., Chen, R., Ling, J., Ran, Q., Jilka, R.L.,
scaffolds for orthopaedic tissue engineering, Biotechnol.
and Chen, X.D. (2011) Rescuing replication and osteoge!
Adv., 32, 462-484, doi: 10.1016/j.biotechadv.2013.12.012.
nesis of aged mesenchymal stem cells by exposure to a
63. Kalinina, N., Kharlampieva, D., Loguinova, M., Butenko, I.,
young extracellular matrix, FASEB J., 25, 1474-1485,
Pobeguts, O., Efimenko, A., Ageeva, L., Sharonov, G.,
doi: 0.1096/fj.10!161497.
Ischenko, D., Alekseev, D., Grigorieva, O., Sysoeva, V.,
68. Ng, C.P., Sharif, A.R.M., Heath, D.E., Chow, J.W.,
Rubina, K., Lazarev, V., and Govorun, V. (2015) Charac!
Zhang, C.B., Chan!Park, M.B., Hammond, P.T., Chan, J.K.Y.,
terization of secretomes provides evidence for adipose!
and Griffith, L.G. (2014) Enhanced ex vivo expansion of
derived mesenchymal stromal cells subtypes, Stem Cell Res.
adult mesenchymal stem cells by fetal mesenchymal stem
Ther., 6, 221, doi: 10.1186/s13287!015!0209!8.
cell ECM, Biomaterials, 35, 4046-4057, doi: 10.1016/
64. Konala, V.B.R., Mamidi, M.K., Bhonde, R., Das, A.K.,
j.biomaterials.2014.01.081.
Pochampally, R., and Pal, R. (2016) The current landscape
69. Burns, J.S., Kristiansen, M., Kristensen, L.P., Larsen, K.H.,
of the mesenchymal stromal cell secretome: a new para!
Nielsen, M.O., Christiansen, H., Nehlin, J., Andersen, J.S.,
digm for cell!free regeneration, Cytotherapy, 18, 13-24,
and Kassem, M. (2011) Decellularized matrix from tumo!
doi: 10.1016/j.jcyt.2015.10.008.
rigenic human mesenchymal stem cells promotes neovas!
65. Kuznetsova, E.S., Nimiritsky, P.P., Grigorieva, O.A.,
cularization with galectin!1 dependent endothelial interac!
Sagaradze, G.D., Rodionov, S.A., Omelyanenko, N.P.,
tion, PLoS One, 6, e21888, doi: 10.1371/journal.pone.
Makarevich, P.I., and Efimenko, A.Yu. (2018) Decellula!
0021888.
rized extracellular matrix of human mesenchymal stromal
70. Hoshiba, T., Lu, H., Kawazoe, N., and Chen, G. (2010)
cells as a novel biomaterial for regenerative medicine,
Decellularized matrices for tissue engineering, Expert Opin.
Human Gene Therapy, A75-A76, doi: 10.1089/hum.
Biol. Ther., 10, 1717-1728, doi: 10.1517/14712598.2010.
2018.29077.abstracts.
534079.
EXTRACELLULAR MATRIX IN THE REGULATION
OF STEM CELL DIFFERENTIATION
E. S. Novoseletskaya1,2, О. А. Grigorieva1,
А. Yu. Efimenko1,2*, and N. I. Kalinina2
1 Institute for Regenerative Medicine, Medical Research
and Education Center, Lomonosov Moscow State University,
119991 Moscow, Russia; E mail: efimenkoan@gmail.com
2 Lomonosov Moscow State University,
Faculty of Fundamental Medicine, 119991 Moscow, Russia
Received November 9, 2018
Revised December 6, 2018
Accepted December 6, 2018
Extracellular matrix (ECM) proteins fill the space between cells in multicellular organisms, forming the structure of
organs and tissues. Mechanical properties of ECM are well studied. At present time, the role of individual compo!
nents of ECM and three!dimensional tissue!specific matrices in the regulation of cell functional activity, prolifera!
tion, migration, acquisition of a specialized phenotype and its maintenance is being intensively explored. In this
review, the main structural proteins, enzymes and extracellular vesicles as ECM components are described; data on
the participation of ECM components in regulation of stem cell differentiation and self!maintenance are given; the
approaches to modeling stem cells microenvironment using decellularized ECM are considered.
Keywords: extracellular matrix, stem cells, differentiation, stem cell niche, extracellular vesicles, decellularization
5 БИОХИМИЯ том 84 вып. 3 2019