БИОХИМИЯ, 2019, том 84, вып. 3, с. 354 - 364
УДК 575.224.234
МУТАЦИЯ R482L ГЕНА LMNA ИЗМЕНЯЕТ
ДИНАМИКУ МЫШЕЧНОЙ ДИФФЕРЕНЦИРОВКИ
С2С12 И СТИМУЛИРУЕТ ФОРМИРОВАНИЕ
ВНУТРИМЫШЕЧНЫХ ЛИПИДНЫХ КАПЕЛЬ
© 2019 Н.В. Хромова1*, К.И. Перепелина1,2, О.А. Иванова1,3,
А.Б. Малашичева1,2, А.А. Костарева1, Р.И. Дмитриева1
1 Национальный медицинский исследовательский центр им. В.А. Алмазова
Минздрава России, 197341 Санкт$Петербург, Россия;
электронная почта: khromova@almazovcentre.ru,
akostareva@hotmail.com, renata.i.dmitrieva@gmail.com
2 Санкт$Петербургский государственный университет, 199034 Санкт$Петербург,
Россия; электронная почта: kseniya.perepelina@mail.ru, amalashicheva@gmail.com
3 Санкт$Петербургский национальный исследовательский университет
информационных технологий, механики и оптики (Университет ИТМО),
197101 Санкт$Петербург, Россия; электронная почта: astroksana@gmail.com
Поступила в редакцию 12.09.2018
После доработки 16.11.2018
Принята к публикации 16.11.2018
Миссенс мутации в гене LMNA, в результате которых происходят замены высококонсервативного аргини
на в положении 482 в С концевом глобулярном домене ламина A/C, ассоциированы с возникновением се
мейной парциальной липодистрофии Дюннингана (FPLD2), при которой у пациентов нередко наблюдают
ся различные нарушения развития мышечной ткани. Механизмы возникновения этих нарушений в насто
ящее время до конца не определены. Целью нашей работы явилось исследование влияния мутации R482L
гена LMNA на динамику мышечной дифференцировки и накопление внутримышечного жира с использо
ванием экспериментальной клеточной модели, в которой миобласты мыши С2С12 были модифицирова
ны лентивирусными конструкциями, несущими ген ламина человека дикого типа LMNA WT и мутацию
LMNA R482L. В полученных образцах стимулировали миогенез и адипогенез, исследовали динамику
экспрессии маркеров мышечной и жировой дифференцировки, морфологию дифференцированных мио
трубок и динамику формирования внутримышечных жировых капель. Мы показали, что в образцах С2С12
LMNA R482L экспрессия десмина повышена на всех этапах мышечной дифференцировки, и миобласты,
несущие мутацию, формируют гипертрофированные (по сравнению с С2С12 LMNA WT) миотрубки. Сни
женный уровень экспрессии миогенного транскрипционного фактора Myf6 в LMNA R482L образцах ука
зывал на замедление процессов созревания мышечного волокна. Миобласты, модифицированные мутант
ным ламином LMNA R482L, в ответ на стимуляцию жировой дифференцировки накапливали жир гораздо
активнее, чем миобласты, модифицированные ламином дикого типа, а также экспрессировали маркеры ли
пидных капель: белок, связывающий жирные кислоты 4 го типа (FABP4), жировую триглицеридную липазу
(ATGL) и перилипин 2 (PLIN2). В этой работе мы показали, что мутация R482L гена LMNA нарушает дина
мику мышечной дифференцировки С2С12 и тканеспецифично стимулирует формирование жировых отло
жений в миобластах и миотрубках.
КЛЮЧЕВЫЕ СЛОВА: ген LMNA, мутация R482L гена LMNA, семейная парциальная липодистрофия Дюн
нингана, миогенез, адипогенез, миобласты С2С12.
DOI: 10.1134/S0320972519030060
Ядерные ламины - это фибриллярные бел
стабильность структуры ядерной оболочки,
а
ки, относящиеся к V классу промежуточных фи
также участвуют в регуляторных процессах, осу
ламентов, которые обеспечивают механическую
ществляющих контроль дифференцированного
Принятые сокращения: FPLD2 - семейная парциальная липодистрофия Дюннингана; DMEM - модифицирован
ная Дульбекко среда Игла; DM - дифференцировочная среда; PBS - фосфатно буферный раствор; WT - дикий тип;
MYH3 - эмбриональный миозин; Mymk - ген миомейкера/регулятор слияния; FABP4 - белок, связывающий жирные
кислоты 4 го типа; ATGL - жировая триглицеридная липаза; PLIN2 - перилипин 2; BSA - бычий сывороточный альбу
мин; DAPI - 4',6 диамидино 2 фенилиндол; MyoD - миогенный регуляторный фактор D; ПЦР РВ - полимеразная цеп
ная реакция в реальном времени.
* Адресат для корреспонденции.
354
МУТАЦИЯ R482L ГЕНА LMNA И МИО И АДИПОГЕНЕЗ В МИОБЛАСТАХ
355
состояния постэмбриональных соматических
Молекулярные и клеточные механизмы, свя
тканей [1]. Большинство дифференцированных
зывающие нарушения в развитии/распределе
соматических клеток экспрессируют ламин А и
нии жировой и мышечной тканей при FPLD2,
С типов, которые являются альтернативными
не ясны. Предполагают, что гипертрофия скелет
сплайс вариантами гена ламина (LMNA) [2].
ной мускулатуры у пациентов с FPLD2 может
Мутации в гене LMNA/C ассоциированы с раз
быть обусловлена накоплением внутримышеч
витием ламинопатий [3], которые представляют
ных липидов, неспецифической активацией ре
гетерогенную группу наследственных заболева
цепторов инсулиноподобного фактора роста 1
ний с широким спектром клинических проявле
(IGF 1 рецепторов), гиперандрогенемией и ги
ний, обусловленных дефектами развития раз
перинсулинемией, но убедительных клиничес
ных типов тканей, преимущественно мезенхим
ких данных, подтверждающих эти гипотезы, в
ного происхождения, таких как липодистрофия
настоящее время не существует [15, 17, 20].
(поражение жировой ткани), мандибулоакраль
Описанные факты свидетельствуют о том, что
ная дисплазия (поражение костной ткани), кар
мутация R482L в гене LMNA может вызывать
диомиопатия и мышечная дистрофия (пораже
нарушения развития двух типов тканей: и жиро
ние сердечной и скелетной мускулатуры) [4, 5].
вой, и мышечной. Ранее нами было показано,
Кроме того, одновременно могут быть затрону
что в мезенхимальных стволовых клетках жиро
ты различные типы тканей, что приводит к воз
вой ткани человека [21] и миокарда крысы [22],
никновению комбинированных фенотипов [6-10].
экспрессирующих белок LMNA с мутацией
Каким образом ламины регулируют молекуляр
R482L, была подавлена способность к жировой
ные механизмы, контролирующие клеточную
дифференцировке. Целью данной работы яви
дифференцировку, в настоящее время до конца
лось изучение влияния мутации R482L гена
не ясно. Во многих исследованиях было показа
LMNA на динамику мышечной дифференци
но прямое связывание ламинов с ДНК, хрома
ровки и адипогенной стимуляции миобластов.
тином, нуклеосомами и гистонами, но физиоло
Для этого мы использовали клеточную модель in
гическая значимость этих взаимодействий оста
vitro - генетически измененные миобласты мы
ется нераскрытой [11].
ши С2С12. Геном клеток был трансдуцирован
Одним из заболеваний, которое может быть
лентивирусами, несущими разные формы гена ла
вызвано унаследованными аутосомно доминант
мина человека. Для получения клеточной модели
ными мутациями гена LMNA, является семей
заболевания в работу были включены два типа
ная парциальная липодистрофия Дюннингана
миобластов: модифицированные конструкцией,
(FPLD2, OMIM # 151660) [12], для которой ха
содержащей ген ламин дикого типа (LMNA/C WT,
рактерна прогрессирующая потеря подкожного
контрольная линия), и несущие мутацию R482L
жира, в основном, в области верхних и нижних
этого гена, ассоциированную с FPLD2 [17, 21, 22].
конечностей [13]. В большинстве случаев у па
В исследованных клетках стимулировали мы
циентов с FPLD2 не происходит уменьшение
шечную и жировую дифференцировку. Кроме
объема межмышечного жира и жира костного
того, мы изучали изменение экспрессии марке
мозга, а на лице и в области шеи может наблю
ров обоих типов дифференцировки, а также
даться избыток жировой ткани [14, 15]. Мис
морфологию полученных миотрубок и динами
сенс мутации в гене LMNA, в результате кото
ку формирования жировых капель в культуре.
рых происходят замены высококонсервативно
го аргинина в положении 482 в С концевом гло
булярном домене ламина A/C, были обнаруже
МЕТОДЫ ИССЛЕДОВАНИЯ
ны у более чем 80% пациентов с FPLD2 [16, 17].
Известно, что помимо нарушений развития жи
Клеточная культура и дифференцировка. Мы ис
ровой ткани у пациентов с FPLD2 нередко наб
пользовали клеточную линию миобластов С2С12
людаются различные нарушения развития мы
(ATCC, CRL 1772), которую культивировали с
шечной ткани, в т.ч. тяжелые формы мышечной
применением модифицированной Дульбекко
дистрофии или гипертрофия мышечной ткани
среды Игла (DMEM; «Gibco», США) с добавле
[17, 18]. Клиническая картина развития мышеч
нием 20% эмбриональной бычьей сыворотки
ной дистрофии у FPLD2 пациентов может раз
(«Gibco», США), 1% L глутамина («Invitrogen»,
личаться: у некоторых пациентов миопатия мо
США) и 1% смеси антибиотиков пенициллина и
жет проявиться в раннем возрасте, тогда как
стрептомицина («Gibco», США).
симптомы FPLD2 появляются только в период
Для миогенной стимуляции была взята диф
полового созревания; также при FPLD2 наблю
ференцировочная среда (DM1), состоящая из
дается широкий клинический спектр мышеч
DMEM с добавлением 2% сыворотки лошади
ных дисфункций [17, 19].
(«Gibco», США), 1% смеси пенициллина и
БИОХИМИЯ том 84 вып. 3 2019
5*
356
ХРОМОВА и др.
стрептомицина, 1% L глутамина. Миогенную диф
ровали образцы 4% ным раствором параформ
ференцировку индуцировали после достижения
альдегида в PBS в течение 15 мин при комнат
культурой клеток субконфлюэнтного состояния.
ной температуре. Затем образцы дважды отмы
Среда для адипогенной дифференцировки
вали PBS и инкубировали с 0,2% ным раство
(DM2) включала в себя DМЕМ, 10% эмбрио
ром Triton X 100 («Sigma», США) в PBS в тече
нальной бычьей сыворотки, 1% смеси пеницил
ние 2 мин для пермеабилизации. После этого
лина и стрептомицина, 1% L глутамина с добав
клетки дважды отмывали PBS. Для блокировки
лением инсулина (5 мг/мл в фосфатно буфер
неспецифического связывания антител клетки
ном растворе (PBS), «Sigma», США), розиглита
были инкубированы в 10% ной эмбриональной
зона (2 мкМ, «Avandia», США), дексаметазона
бычьей сыворотке («Gibco», США) в PBS в тече
(1 мкМ в этаноле, «Sigma», США) и изобутилме
ние 30 мин при комнатной температуре. Затем
тилксантина (0,5 мМ в диметилсульфоксиде
из культуральной посуды удаляли раствор эмб
(ДМСО), «Sigma», США). Запуск адипогенной
риональной бычьей сыворотки и вносили раст
дифференцировки начинали также при дости
воры первичных мышиных антител в 1% ной
жении клеточной культурой субконфлюентного
эмбриональной бычьей сыворотке на фосфат
состояния. Смену дифференцировочной среды
ном буфере с 0,05% Tween 20, инкубация дли
производили через день.
лась 1 ч при комнатной температуре. После ин
С учетом динамики образования миотрубок
кубации с первичными антителами клетки
клетками С2С12 в эксперимент были взяты кле
дважды отмывали PBS. Раствор вторичных ан
точные культуры на 2 й и 7 й день от момента
тител в 1% ной эмбриональной бычьей сыво
начала дифференцировки.
ротке на PBS, конъюгированных с флуорохро
Продукция лентивируса и трансдукция. Продук
мами Alexa 488 или Alexa 546, был добавлен к
цию лентивируса осуществляли в соответствии с
культуре клеток и инкубирован 1 ч при комнат
ранее описанным нами протоколом [21]. Субкон
ной температуре в темноте. Затем следовала
флюэнтные клетки линии HEK 293T были транс
трехкратная отмывка PBS. Для визуализации
фицированы одновременно тремя плазмидами:
хроматина клетки были инкубированы в тече
pLVTHM (20 мкг), pMD2.G (5 мкг) и пакующей
ние 60 с в растворе 4',6 диамидино 2 фенилин
плазмидой pCMV dR8.74psPAX2 (5 мкг) с по
дола (DAPI) («Sigma», США) на PBS (1 : 10 000),
мощью кальций фосфатного метода. На следу
затем однократно отмыты PBS. Для флуоресцент
ющий день производили смену культуральной
ной микроскопии к образцам добавили тонкий
среды, затем инкубировали клетки еще 24 ч для
слой PBS. Клеточные образцы, выращенные на
продукции вируса в более высокой концентра
покровных стеклах, были заключены в среду
ции. Затем лентивирус концентрировали мето
Fluormount («Sigma», США) на предметных стек
дом ультрацентрифугирования (20 000 g) в тече
лах. Микроскопический анализ проводили на
ние 2 ч, ресуспендировали в 1% ном растворе
приборе Axio Observer («Zeiss», Германия).
бычьего сывороточного альбумина (BSA) в PBS
Окрашивание Oil Red. Через 5-7 дней после
(BSA/PBS) и замораживали при -80 °С.
индукции адипогенной дифференцировки клет
Сконцентрированные вирусные частицы до
ки окрашивали специфическим жирораствори
бавляли к культуре клеток С2С12 на следующий
мым красителем Oil Red («Sigma», США). Для
день после посадки в культуральные плашки,
окрашивания клеток сначала удаляли среду и
смену среды производили через 24 и 48 ч после
дважды промывали лунки с клетками холодным
трансдукции (при трансфекции с целью повы
PBS, фиксировали 4% ным раствором парафор
шения эффективности в культуральную среду
мальдегида в течение 30 мин при комнатной
был добавлен полибрен из расчета 1 мкл/мл сре
температуре. Затем дважды отмывали клетки во
ды). Эффективность трансдукции оценивали в
дой, далее инкубировали с 60% ным изопропа
параллельном эксперименте с использованием
нолом в течение 5 мин, после чего инкубирова
иммуноцитохимического окрашивания и выра
ли с красителем Oil Red в течение 30-60 мин,
жали как процент ядер, окрашенных антитела
после чего краситель удаляли, промывали лунки
ми к ламину человека, которые не проявляют
водой. Окрашенные образцы фотографировали.
кросс реактивности с ламином мыши, от обще
Определение морфологических параметров ми@
го числа ядер.
отрубок. Размер миотрубок определяли количе
Иммуноцитохимическое окрашивание. Имму
ственно, измеряя их ширину в поперечном сече
ноцитохимическое окрашивание проводили для
нии и длину в продольном сечении. Размеры
определения белка ламина (LMNA). Из культу
оценивали для 100 ± 20 миотрубок не менее чем
ральной посуды удаляли среду для культивиро
на 5 микрофотографиях с помощью программно
вания, затем проводили отмывку фосфатным
го обеспечения NIH ImageJ. Анализ проводили
буфером в течение 3-5 мин, после чего фикси
«вслепую» без маркировки условий стимуляции.
БИОХИМИЯ том 84 вып. 3 2019
МУТАЦИЯ R482L ГЕНА LMNA И МИО И АДИПОГЕНЕЗ В МИОБЛАСТАХ
357
Количественная ПЦР. РНК из культуры кле
ных лентивирусной конструкцией, несущей че
ток была выделена с использованием набора
ловеческий ламин дикого типа (WT), и сравни
Extract RNA («Евроген», Россия). Обратную транс
ли динамику экспрессии регуляторов и марке
крипцию общей РНК (500 нг) проводили с по
ров мышечной дифференцировки в исходном и
мощью набора MMLV RT Kit («Евроген», Рос
генетически модифицированном образцах кле
сия). Для постановки ПЦР в реальном времени
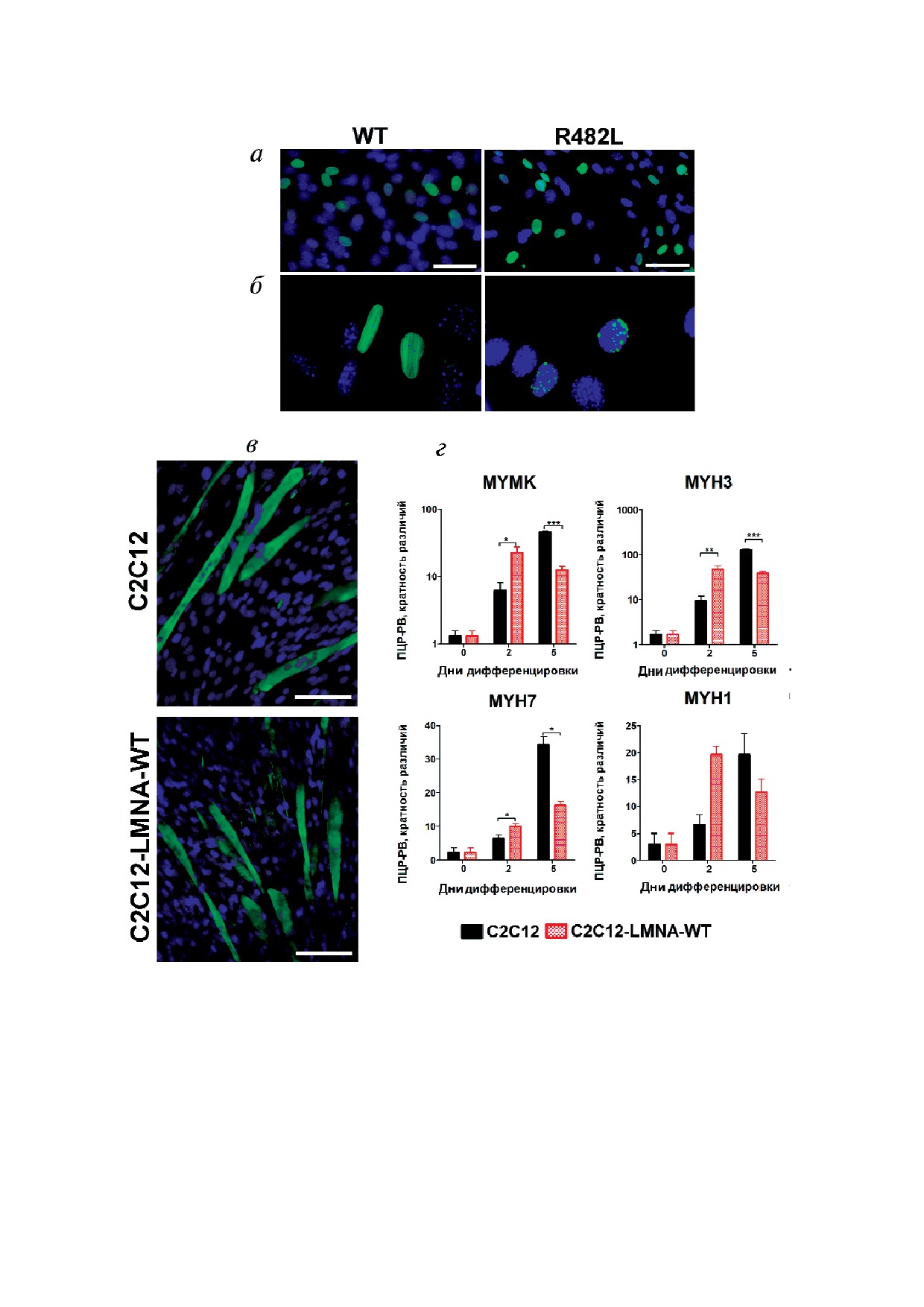
точной линии (рис. 1, в и г). Динамика экспрес
(ПЦР РВ) использовали ×5 реакционную смесь
сии маркеров миогенеза в контрольных и в
qPCRmix HS SYBR + HighROX («Евроген»,
трансдуцированных образцах С2С12 различа
Россия), приготовленную в соответствии с про
лась. Так, культуры С2С12 LMNA WT демонст
токолом и содержащую помимо интеркалирую
рировали стабильную динамику экспрессии
щего красителя SYBR Green следующие компо
маркеров эффективной мышечной дифферен
ненты: кДНК в качестве матрицы (5 мкл), пря
цировки: регулятора этапа слияния миобластов,
мой и обратный праймеры (1 мкл каждого) (таб
гена миомейкера (Mymk); и миозинов, экспрес
лица), а также стерильную воду до конечного
сия которых повышается на более поздних эта
объема 25 мкл. Реакцию проводили на приборе
пах развития мышечного волокна, эмбриональ
7500 Real Time PCR System («Life Technologies»,
ного миозина MYH3, изоформы быстрого миозина
США). Для нормализации уровня экспрессии
MYH1 и медленного миозина MYH7 (рис. 1, г).
исследуемых генов использовали ген глицераль
Кроме того, они стабильно дифференцирова
дегид 3 фосфат дегидрогеназы (GAPDH), так
лись с формированием хорошо различимых мио
называемый ген «домашнего хозяйства». Изме
трубок (рис. 1, в). К сожалению, в данных экспе
нение уровня экспрессии генов оценивали как
риментальных условиях мы не наблюдали попе
кратность различий с использованием метода
речнополосатую исчерченность миотрубок, ха
сравнения ΔΔCT.
рактерную для морфологически зрелого мышеч
ного волокна. Этот недостаток не явился для нас
неожиданным, поскольку незрелость миотру
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
бок, полученных в ходе миогенной дифферен
цировки, является хорошо задокументирован
Описание экспериментальной клеточной моде@
ным недостатком клеточной модели С2С12 [23].
ли исследования. В исследовании использовали
генетически модифицированные миобласты ли
нии С2С12. Для модификации генома исполь
Праймеры, использованные в работе
зовали трансдукцию лентивирусными конструк
циями, несущими разные формы ламина чело
Мишень
Последовательность 5'-3'
века: ламина дикого типа (WT) и ламина, несу
щего мутацию R482L, ассоциированную с
MYH1
Fw GCTGAGAGAAGCTACCACATT
FPLD2. Эффективность трансдукции и процес
Rv ACAAAGGCGTAGTCGTATGG
сов трансляции, полимеризации и внутрикле
точного транспорта кодируемого вирусом белка
MYH3
Fw CTATGCCACCTTCGCTACAACAG
в модифицированных клетках подтверждали
Rv CAGTGCAGAGACGGTTTGGAAGG
иммуноцитохимическим окрашиванием анти
MYH7
Fw TGCCCGATGACAAAGAAGAG
телами, специфичными к ламину человека, ко
Rv GTCACCGTCTTGCCATTCT
торые не проявляют кросс реактивности с ла
мином мыши. В среднем, эффективность транс
Myomaker
Fw CCTGTGATGGGCCTGGTTTGTC
Rv GGTTCATCAAAGTCGGCCAGTGC
дукции между WT и R482L конструкциями су
щественно не различалась и составляла (25 ± 3)
Desmin
Fw CCTACACCTGCGAGATTGATGCC
и (23 ± 4)% соответственно (рис. 1, а). Наруше
Rv GCTCCCTCATCTGCCTCATCAG
ния организации хроматина в клетках С2С12,
экспрессирующих мутантную форму ламина че
ATGL
Fw CCACTTTAGCTCCAAGGATGAG
Rv TTGGAGGGTAGGAGGAATGA
ловека R482L, хорошо детектировались и выра
жались в изменениях структуры внутриядерных
FABP4
Fw CACCGAGATTTCCTTCAAACT
агрегатов ламина (рис. 1, б).
Rv CCCGCCATCTAGGGTTAT
Чтобы убедиться в том, что трансдукция са
ма по себе не оказывает существенного воздей
Myf6
Fw CCAAGTGTTTCGGATCATTCCAGG
Rv GGAGGCTGAGGCATCCACG
ствия на основные функциональные свойства
миобластов С2С12, мы стимулировали миоген
mGapdh
Fw GGATCTGACGTGCCGCCTG
ную дифференцировку в контрольных образцах
Rv GAAGGTGGA AGAGTGGGAGTTGC
клеточной линии и в образцах, трансдуцирован
БИОХИМИЯ том 84 вып. 3 2019
358
ХРОМОВА и др.
Рис. 1. Описание экспериментальной модели исследования. а - Репрезентативные фотографии экспрессии белков
LMNA дикого типа (WT), а также несущих мутацию R482L в клетках С2С12 для подтверждения эффективности трансдук
ции; б - нарушения организации хроматина в клетках С2С12, экспрессирующих мутантную формы ламина, выражаются
в изменениях структуры внутриядерных агрегатов; клетки окрашены антителами специфичными к LMNA человека (зе
леное окрашивание). Ядра визуализированы окрашиванием DAPI (синий). Длина масштабной линейки - 50 мкм; в и г -
клеточная модель мышечной дифференцировки: в - контрольная (С2С12) и трансдуцированная (С2С12 LMNA WT)
культуры стабильно дифференцировались с формированием хорошо различимых миотрубок; миотрубки окрашены анти
телами к десмину, ядра визуализированы окраской DAPI (синий). Длина масштабной линейки - 100 мкм; г - динамика
экспрессии маркеров поздних этапов мышечной дифференцировки: регулятора слияния миобластов (MYMK), эмбрио
нального миозина (MYH3), быстрого миозина (MYH1) и медленного миозина (MYH7). Результаты представлены как
среднее значение ± SEM (n > 3; * p < 0,05; ** p < 0,01; *** p < 0,001)
БИОХИМИЯ том 84 вып. 3 2019
МУТАЦИЯ R482L ГЕНА LMNA И МИО И АДИПОГЕНЕЗ В МИОБЛАСТАХ
359
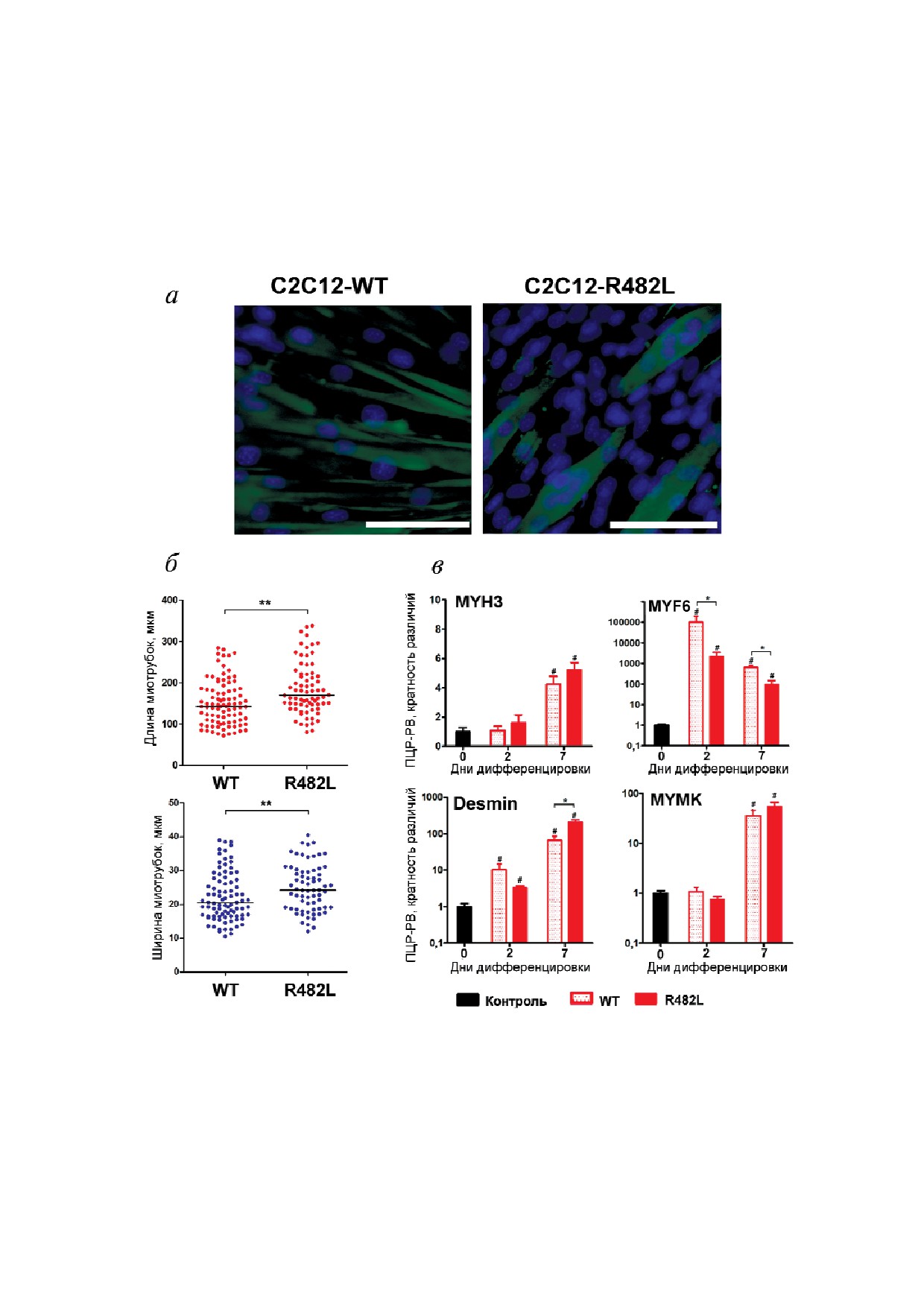
Несмотря на это, а также на различия между
ка после стимуляции, происходят на ранних
группами, мы пришли к выводу, что полученная
этапах этой дифференцировки.
экспериментальная модель может быть успешно
Морфологические и функциональные разли@
использована для решения задач, предусмот
чия между миотрубками, полученными после сти@
ренных в нашем исследовании, т.к. регулятор
муляции мышечной дифференцировки в образцах
ные события, связанные с выбором направле
С2С12@LMNA@WT и С2С12@LMNA@R482L. Ана
ния дифференцировки клетки предшественни
лиз морфологических особенностей миотрубок
Рис. 2. Морфологические и функциональные особенности миотрубок, полученных при стимуляции мышечной диффе
ренцировки в культурах С2С12 LMNA WT и С2С12 LMNA R482; а - миотрубки, сформированные в результате диффе
ренцировки генетически модифицированных миобластов С2С12. Миотрубки окрашены антителами к десмину, ядра ви
зуализированы окрашиванием DAPI (синий). Длина масштабной линейки - 50 мкм; б - морфологические характеристи
ки дифференцированных миотрубок: длина (красный маркер) и ширина (синий маркер), ** p < 0,01; в - динамика
экспрессии маркеров дифференцировки: десмина (Desmin), регулятора слияния миобластов (MYMK), эмбрионального
миозина (MYH3), миогенного фактора (MYF6). Результаты нормализованы на контрольное значение, рассчитаны и пред
ставлены как среднее значение ± SEM (* p < 0,05; # p < 0,05 по сравнению с уровнем экспрессии в контрольном образце)
БИОХИМИЯ том 84 вып. 3 2019
360
ХРОМОВА и др.
был проведен на 5 й день после стимуляции мы
дифференцировки. Результаты анализа этого
шечной дифференцировки контрольных образ
блока работы представлены на рис. 3. Как и
цов миобластов С2С12 и трансдуцированных
ожидалось, формирование миотрубок в этих ус
образцов. Миотрубки были визуализированы с
ловиях было подавлено как в клетках, экспрес
использованием иммуноцитохимического окра
сирующих ламин дикого типа, так и в клетках,
шивания антителами к десмину (рис. 2, а), пос
экспрессирующих ламин, несущий мутацию,
ле чего были измерены длина и ширина диффе
хотя наблюдалось слияние 2-3 миобластов с об
ренцированных миотрубок. Мы обнаружили, что
разованием малочисленных небольших трубок,
С2С12 миобласты, несущие мутацию LMNA R482L,
демонстрирующих положительную окраску на
формируют более массивные трубки, чем мио
десмин (рис. 3, а); при этом в обоих типах образ
бласты, несущие LMNA WT (рис. 2, а и б). Для
цов к седьмому дню после стимуляции сформиро
того чтобы определить, какие регуляторные со
вались Oil Red положительные клетки (рис. 3, а),
бытия могут стоять за выявленными морфоло
которые были существенно крупнее и много
гическими различиями, мы проанализировали
численнее в образцах С2С12 LMNA R482L.
динамику экспрессии регуляторов и маркеров
Анализ экспрессии маркера дифференцирован
мышечной дифференцировки: гена Mymk, кото
ных адипоцитов и транспортера жирных кислот
рый участвует в регуляции процесса слияния
FABP4 выявил существенный рост FABP4
миобластов на ранних этапах мышечной диф
мРНК в обеих культурах, но в образцах С2С12
ференцировки, а также гена эмбрионального
LMNA R482L рост экспрессии FABP4 был су
миозина MYH3. Динамика экспрессии данных
щественно выше (рис. 3, б). Кроме того, в образ
генов не различалась между образцами, транс
цах С2С12 LMNA R482L была повышена
дуцированными конструкциями LMNA WT и
экспрессия жировой триглицеридной липазы
LMNA R482L (рис. 2, в). Однако уровень экс
(ATGL) - основной липазы, участвующей в ли
прессии миогенного транскрипционного фак
полизе триглицеридов, заключенных во внутри
тора Myf6, который участвует в регуляции про
мышечные липидные капли [29, 30]. Помимо
цессов терминальной дифференцировки и за
этого, образцы С2С12, несущие мутацию, про
пуска экспрессии генов определенных структур
демонстрировали рост экспрессии перелипина 2
ных и сократительных белков, характерных для
(PLIN2) (рис. 3, б) - белка оболочки внутримы
зрелых миофибрилл [3, 24], был существенно
шечных липидных капель, одного из преоблада
ниже в образцах С2С12 LMNA R482L, чем в об
ющих белков семейства перелипинов, выявлен
разцах С2С12 LMNA WT (рис. 2, в), что может
ных в скелетных мышцах. Локализация этих
указывать на замедление процессов созревания
белков может указывать на их вовлеченность в
мышечного волокна в мутантных культурах.
контроль липолиза, индуцируемого мышечны
Кроме того, к седьмому дню дифференцировки
ми сокращениями [30].
в клетках С2С12 LMNA R482L наблюдалось
значительное увеличение экспрессии десмина
(рис. 2, в) - белка семейства промежуточных
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
филаментов, который экспрессируется в скелет
ной, сердечной и гладкой мускулатуре, а также в
Клеточная модель, использованная в нашей
сателлитных клетках мышечной ткани и проли
работе, позволила выявить некоторые законо
ферирующих миобластах [25, 26]. Десмин игра
мерности влияния ассоциированной с FPLD2
ет важную роль в регуляции слияния миоблас
мутации R482L гена LMNA на развитие мышеч
тов в ходе мышечной дифференцировки и ока
ной ткани и формирование внутримышечных
зывает влияние на миогенные транскрипцион
липидных капель.
ные факторы дифференцировки: миогенный ре
Полученные нами результаты согласуются с
гуляторный фактор D (MyoD) и миогенин [25].
клинической картиной заболевания FPLD2,
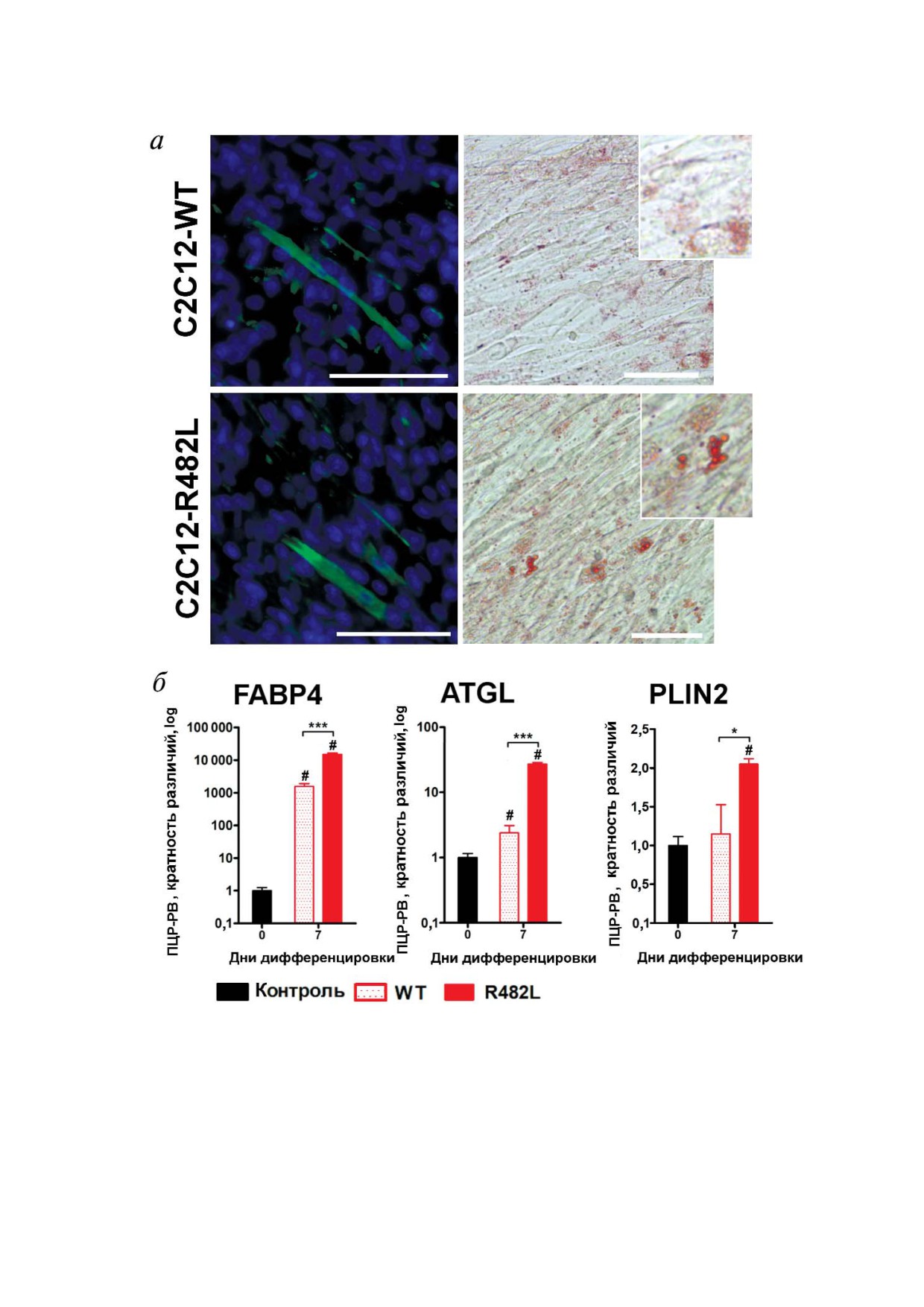
Стимуляция адипогенеза в образцах миоблас@
при котором у пациентов на фоне липодистро
тов С2С12, модифицированных лентивирусными
фии часто развиваются различные патологии
конструкциями LMNA@WT и LMNA@R482L. Из
скелетной мускулатуры [15, 17]. У пациентов с
вестно, что клетки линии миобластов мышей
FPLD2 в подростковом возрасте происходит по
С2С12 способны при соответствующей стиму
теря подкожной жировой ткани на конечностях
ляции трансдифференцироваться в клетки, по
и туловище, тогда как на лице, подбородке, шее
хожие по морфологии на адипоциты, накапли
наблюдается избыточное отложение жира. Так
вающие жировые капли, которые окрашивают
же при FPLD2 развиваются метаболические
ся красителем Oil Red [27, 28]. В нашем исследо
расстройства: нарушение толерантности к глю
вании мы проанализировали ответ модифици
козе и сахарный диабет второго типа, гипертри
рованных миобластов на стимуляцию жировой
глицеридемия, стеатоз печени (жировой гепа
БИОХИМИЯ том 84 вып. 3 2019
МУТАЦИЯ R482L ГЕНА LMNA И МИО И АДИПОГЕНЕЗ В МИОБЛАСТАХ
361
Рис. 3. Стимуляция адипогенеза в образцах миобластов С2С12, модифицированных лентивирусными конструкциями
LMNA WT и LMNA R482L. а - Миотрубки, сформированные в результате жировой дифференцировки генетически мо
дифицированных миобластов С2С12. Миотрубки окрашены антителами к десмину, ядра визуализированы окрашиванием
DAPI (синий). Длина масштабной линейки - 50 мкм. Липидные капли окрашены красителем Oil Red, миотрубки визуа
лизированы окраской гематоксилином; б - динамика экспрессии маркеров липидных капель: транспортера жирных кис
лот (FABP4), жировой триглицеридной липазы (ATGL) и перелипина 2 (PLIN). Результаты нормализованы на контроль
ное значение, рассчитаны и представлены как среднее значение ± SEM (* p < 0,05; *** p < 0,001; # p < 0,05 в сравнении с
уровнем экспрессии в контрольном образце)
БИОХИМИЯ том 84 вып. 3 2019
362
ХРОМОВА и др.
тит) [18]; нарушения развития и функциониро
резистентность к инсулину связана с уровнем
вания мышечной ткани могут проявляться как в
внутриклеточных триглицеридов, а неспособ
виде мышечной гипертрофии, так и в виде атро
ность накапливать подкожный жир может при
фии и нарушения метаболизма мышечной тка
вести к патологическому накоплению жира в
ни [20, 31]. Точные механизмы развития пере
мышечной ткани [20]. Однако убедительные
численных нарушений остаются невыясненны
клинические данные в поддержку этой гипотезы
ми, однако имеющиеся на настоящий момент
получены не были. В нашей работе мы обнару
клинические и экспериментальные данные сви
жили, что в ответ на стимуляцию жировой диф
детельствуют о том, что FPLD2 не является за
ференцировки миобласты, модифицированные
болеванием, связанным исключительно с пато
мутантным ламином LMNA R482L, гораздо ак
логией развития жировой ткани [17, 20].
тивнее накапливают жир, чем клетки, модифи
В данной работе мы показали, что индукция
цированные ламином дикого типа, а также
мышечной дифференцировки в клетках С2С12,
экспрессируют маркеры внутримышечных ли
экспрессирующих мутантную форму LMNA
пидных капель (рис. 3). Сравнительный анализ
R482L, вызывает формирование гипертрофиро
результатов, полученных нами ранее [21, 22] и в
ванных миотрубок, в которых существенно по
данном исследовании, убедительно указывает
вышена экспрессия десмина. Возможно, форми
на тканеспецифичность ответа на стимуляцию
рование массивных миотрубок в LMNA R482L
жировой дифференцировки: в то время как в
связано именно с высоким уровнем экспрессии
мезенхимальных стволовых клетках подкожной
десмина в этих образцах. Известно, что десмин
жировой клетчатки человека и мезенхимальных
участвует в поддержании объема мышечных во
стволовых клетках миокарда крысы, несущих
локон и их механических свойств [32, 33], а так
мутацию LMNA R482L, существенно снижался
же вовлечен в контроль перемещения ядер в
потенциал к жировой дифференцировке, в мио
многоядерном мышечном волокне из централь
бластах С2С12, трансдуцированных лентиви
ного положения на периферию волокна. Этот
русной конструкцией, несущей LMNA R482L,
механизм является важным регуляторным со
напротив, наблюдалась усиленная стимуляция
бытием во время стимуляции миогенеза и обес
адипогенеза по сравнению с клетками, несущи
печивается в т.ч. жесткой регуляцией структуры
ми LMNA дикого типа. Экспериментально про
ядерной оболочки ламином A/C [34]. Существу
демонстрированный тканеспецифичный ответ
ет блок экпериментальных данных, демонстри
хорошо сочетается с разнообразием фенотипов
рующих связь сигнальных путей, которые в ходе
мышечных патологий у пациентов с FPLD2 [15,
развития мышечной ткани согласованно регу
17, 20, 31, 36], поскольку в результате накопле
лируются десмином и ламином. Так, например,
ния внутримышечных жировых отложений мо
было показано, что в пролифелирующих мио
жет наблюдаться как увеличение объема мы
бластах, в которых подавлена экспрессия гена
шечных волокон, так и атрофия мышечной тка
LMNA, также существенно снижена экспрессия
ни вследствие нарушения взаимодействий
белков, определяющих мышечную дифферен
мышца-жир и метаболических расстройств,
цировку, в т.ч. MyoD и десмина, а экзогенная
связанных с патологическим увеличением внут
стимуляция экспрессии десмина и/или MyoD в
римышечных липидных отложений.
LMNA-/- миобластах сопровождается восста
новлением их способности к мышечной диффе
Финансирование
ренцировке. Это позволило авторам предполо
жить, что именно подавление экспрессии MyoD
Работа выполнена при финансовой поддержке
и десмина в LMNA-/- клетках является причи
РНФ (грант № 16 15 10178).
ной потери их способности к мышечной диффе
ренцировке, а LMNA непосредственно или
Конфликт интересов
опосредованно влияет на уровень их экспрессии
[35]. Возможно, в нашей экспериментальной
Авторы заявляют об отсутствии конфликта
модели нарушение взаимодействий ламин и
интересов.
десмин зависимых сигнальных путей является
одной из причин развития гипертрофирован
Соблюдение этических норм
ных миотрубок в образцах LMNA R482L.
Также высказывалась гипотеза, что гипертро
Настоящая статья не содержит описания ка
фия мышц при FPLD2 может быть обусловлена
ких либо исследований с использованием лю
накоплением липидов в миоцитах, поскольку
дей и животных в качестве объектов.
БИОХИМИЯ том 84 вып. 3 2019
МУТАЦИЯ R482L ГЕНА LMNA И МИО И АДИПОГЕНЕЗ В МИОБЛАСТАХ
363
СПИСОК ЛИТЕРАТУРЫ
1.
Hutchison, C.J., and Worman, H.J. (2004) A type lamins:
and Trembath, R.C. (2000) LMNA, encoding lamin A/C,
guardians of the soma? Nat. Cell Biol., 6, 1062-1067,
is mutated in partial lipodystrophy, Nat. Genet., 24,
doi: 10.1038/ncb1104 1062.
153-156, doi: 10.1038/72807.
2.
Lin, F., and Worman, H.J. (1993) Structural organization
17.
Vantyghem, M.C., Pigny, P., Maurage, C.A., Rouaix
of the human gene encoding nuclear lamin A and nuclear
Emery, N., Stojkovic, T., Cuisset, J.M., Millaire, A.,
lamin C, J. Biol. Chem., 268, 16321-16326.
Lascols, O., Vermersch, P., Wemeau, J.L., Capeau, J., and
3.
Dubinska Magiera, M., Zaremba Czogalla, M., and
Vigouroux, J.L. (2004) Patients with familial partial lipody
Rzepecki, R. (2013) Muscle development, regeneration
strophy of the Dunnigan type due to a LMNA R482W
and laminopathies: how lamins or lamina associated pro
mutation show muscular and cardiac abnormalities, J. Clin.
teins can contribute to muscle development, regeneration and
Endocrinol. Metab., 89, 5337-5346, doi: 10.1210/jc.2003
disease, Cell. Mol. Life Sci., 70, 2713-2741, doi: 10.1007/
031658.
s00018 012 1190 3.
18.
Guenantin, A.C., Briand, N., Bidault, G., Afonso, P.,
4.
Schreiber, K.H., and Kennedy, B.K. (2013) When lamins
Bereziat, V., Vatier, C., Lascols O., Caron Debarle, M.,
go bad: nuclear structure and disease, Cell,
152,
Capeau, J., and Vigouroux, C. (2014) Nuclear envelope
1365-1375, doi: 10.1016/j.cell.2013.02.015.
related lipodystrophies, Semin. Cell Dev. Biol.,
29,
5.
Ostlund, C., Bonne, G., Schwartz, K., and Worman, H.J.
148-157, doi: 10.1016/j.semcdb.2013.12.015.
(2001) Properties of lamin A mutants found in Emery
19.
Muchir, A., Bonne, G., van der Kooi, A.J., van Meegen, M.,
Dreifuss muscular dystrophy, cardiomyopathy and
Baas, F., Bolhuis, P.A. , de Visser, M., and Schwartz, K.
Dunnigan type partial lipodystrophy, J. Cell Sci., 114,
(2000) Identification of mutations in the gene encoding
4435-4445.
lamins A/C in autosomal dominant limb girdle muscular
6.
De Las Heras, J.I., Meinke, P., Batrakou, D.G., Srsen, V.,
dystrophy with atrioventricular conduction disturbances
Zuleger, N., Kerr, A.R., and Schirmer, E.C. (2013) Tissue
(LGMD1B), Hum. Mol. Genet., 9, 1453-1459.
specificity in the nuclear envelope supports its functional
20.
Boschmann, M., Engeli, S., Moro, C., Luedtke, A.,
complexity, Nucleus, 4, 460-477, doi: 10.4161/nucl.26872.
Adams, F., Gorzelniak, K., Rahn, G., Mahler, A.,
7.
Manju, K., Muralikrishna, B., and Parnaik, V.K. (2006)
Dobberstein, K., Kruger, A., Schmidt, S., Spuler, S., Luft, F.C.,
Expression of disease causing lamin A mutants impairs the
Smith, S.R., Schmidt, H.H. J., and Jordan, J. (2010)
formation of DNA repair foci, J. Cell Sci., 119, 2704-2714.
LMNA mutations, skeletal muscle lipid metabolism, and
8.
Parnaik, V.K., and Manju, K. (2006) Laminopathies: mul
insulin resistance, J. Clin. Endocrinol. Metab.,
95,
tiple disorders arising from defects in nuclear architecture,
1634-1643, doi: 10.1210/jc.2009 1293.
J. Biosci., 31, 405-421.
21.
Malashicheva, A., Bogdanova, M., Zabirnyk, A., Smolina, N.,
9.
Sebillon, P., Bouchier, C., Bidot, L.D., Bonne, G.,
Ignatieva, E., Freilikhman, O., Fedorov, A., Dmitrieva, R.,
Ahamed, K., Charron, P., Drouin Garraud, V., Millaire, A.,
Sjoberg, G., Sejersen, T., and Kostareva, A. (2015) Various
Desrumeaux, G., Benaiche, A., Charniot, J. C., Schwartz, K.,
lamin A/C mutations alter expression profile of mesenchy
Villard, E., and Komajda, M. (2003) Expanding the phe
mal stem cells in mutation specific manner, Mol. Genet.
notype of LMNA mutations in dilated cardiomyopathy and
Metab., 115, 118-127, doi: 10.1016/j.ymgme.2015.04.006.
functional consequences of these mutations, J. Med.
22.
Perepelina, K., Dmitrieva, R., Ignatieva, E., Borodkina, A.,
Genet., 40, 560-567.
Kostareva, A., and Malashicheva, A. (2018) Lamin A/C
10.
Sehgal, P., Chaturvedi, P., Kumaran, R.I., Kumar, S., and
mutation associated with lipodystrophy influences adi
Parnaik, V.K. (2013) Lamin A/C haploinsufficiency modu
pogenic differentiation of stem cells through interaction
lates the differentiation potential of mouse embryonic stem
with Notch signaling, Biochem. Cell Biol., 96, 342-348,
cells, PLoS One, 8, e57891, doi: 10.1371/journal.pone.
doi: 10.1139/bcb 2017 0210.
0057891.
23.
Perepelina, K.I., Smolina, N.A., Zabirnik, A.S, Dmitri
11.
Naetar, N., Ferraioli, S., and Foisner, R. (2017) Lamins in
eva, R.I., Malashicheva, A.B., and Kostareva, A.A. (2017)
the nuclear interior - life outside the lamina, J. Cell Sci.,
The role of LMNA mutations in myogenic differentiation
130, 2087-2096, doi: 10.1242/jcs.203430.
of C2C12 and primary satellite cells, Cell Tissue Biol., 59,
12.
Speckman, R.A., Garg, A., Du, F., Bennett, L., Veile, R.,
117-124, doi: 10.1134/S1990519X17030087.
Arioglu, E., Taylor, S.I., Lovett, M., and Bowcock, A.M.
24.
Bentzinger, С.F., Wang, Y.X., and Rudnicki, M.A. (2012)
(2000) Mutational and haplotype analyses of families with
Building muscle: molecular regulation of myogenesis, Cold
familial partial lipodystrophy (Dunnigan variety) reveal
Spring Harb. Perspect. Biol., 4, a008342, doi: 10.1101/
recurrent missense mutations in the globular C terminal
cshperspect.a008342.
domain of lamin A/C, Am. J. Hum. Genet., 66, 1192-1198,
25.
Hol, E.M., and Capetanaki, Y. (2017) Type III intermedi
doi: 10.1086/302836.
ate filaments desmin, glial fibrillary acidic protein (GFAP),
13.
Hegele, R.A., Huff, M.W., and Young, T.K
(2001)
vimentin, and peripherin, Cold Spring Harb. Perspect. Biol.,
Common genomic variation in LMNA modulates indexes
9, a021642, doi: 10.1101/cshperspect.a021642.
of obesity in Inuit, J. Clin. Endocrinol. Metab., 86,
26.
Capetanaki, Y., Milner, D.J., and Weitzer, G.
(1997)
2747-2751, doi: 10.1210/jcem.86.6.7550.
Desmin in muscle formation and maintenance: knockouts
14.
Garg, A., Peshock, R.M., and Fleckenstein, J.L.(1999)
and consequences, Cell Struct. Funct., 22, 103-116.
Adipose tissue distribution pattern in patients with familial
27.
Holst, D., Luquet, S., Kristiansen, K., and Grimaldi, P.A.
partial lipodystrophy (Dunnigan variety), J. Clin. Endocrinol.
(2003) Roles of peroxisome proliferator activated recep
Metab., 84, 70-74, doi: 10.1210/jcem.84.1.5383.
tors delta and gamma in myoblast transdifferentiation, Exp.
15.
Ji, H., Weatheral, P., Adams Huet, B., and Garg, A. (2013)
Cell Res., 288, 168-176, doi: 10.1016/S0014 4827(03)
Increased skeletal muscle volume in women with familial
00179 4.
partial lipodystrophy, Dunnigan variety, J. Clin. Endocrinol.
28.
Grimaldi, P.A., Teboul, L., Inadera, H., Gaillard, D., and
Metab., 98, E1410-E1413, doi: 10.1210/jc.2013 1297.
Amri, E.Z. (1997) Trans differentiation of myoblasts to
16.
Shackleton, S., Lloyd, D.J., Jackson, S.N.J., Evans, R.,
adipoblasts: triggering effects of fatty acids and thiazo
Niermeijer, M.F., Singh, B.M., Schmidt, H., Brabant, G.,
lidinediones, Prostaglandins. Leukot. Essent. Fatty Acids,
Kumar, S., Durrington, P.N., Gregory, S., O’Rahilly, S.,
57, 71-75.
БИОХИМИЯ том 84 вып. 3 2019
364
ХРОМОВА и др.
29. Bosma, M. (2016) Lipid droplet dynamics in skeletal muscle,
tioning of nuclei in skeletal muscle fibers, J. Cell. Physiol.,
Exp. Cell Res., 340, 180-186, doi: 10.1016/j.yexcr.2015.10.023.
209, 874-882, doi: 10.1002/jcp.20780.
30. MacPherson, R.E.K., Ramos, S.V., Vandenboom, R.,
34. Roman, W., Martins, J.P., Carvalho, F.A., Voituriez, R.,.
Roy, B.D., and Peters, S.J. (2013) Skeletal muscle PLIN
Abella, J.V.G, Santos, N.C., Cadot, B., Way, M., and
proteins, ATGL and CGI 58, interactions at rest and fol
Gomes, E.R. (2017) Myofibril contraction and crosslinking
lowing stimulated contraction, Am. J. Physiol. Regul. Integr.
drive nuclear movement to the periphery of skeletal mus
Comp. Physiol., 304, R644-R650, doi: 10.1152/ajpregu.
cle, Nat. Cell Biol., 19, 1189-1201, doi: 10.1038/ncb3605.
00418.2012.
35. Frock, R.L., Kudlow, B.A., Evans, A.M., Jameson, S.A.,
31. Rankin, J., and Ellard, S. (2006) The laminopathies: a cli
Hauschka, S.D., and Kennedy, B.K., (2006) Lamin A / C
nical review, Clin. Genet., 70, 261-274, doi: 10.1111/j.
and emerin are critical for skeletal muscle satellite cell dif
1399 0004.2006.00677.x.
ferentiation, Genes Dev., 20, 486-500, doi: 10.1101/gad.
32. Shah, S.B., Davis, J., Weisleder, N., Kostavassili, I.,
1364906.
McCulloch, A.D., Ralston, E., Capetanaki, Y., and Lieber, R.L.
36. Соркина Е.Л., Калашникова М.Ф., Мельниченко Г.А.,
(2004) Structural and functional roles of desmin in mouse
Тюльпаков А.Н. (2015) Семейная парциальная липо
skeletal muscle during passive deformation, Biophys. J., 86,
дистрофия (синдром DUNNIGAN) вследствие мута
2993-3008, doi: 10.1016/S0006 3495(04)74349 0.
ции в гене LMNA: первое описание клинического слу
33. Ralston, E., Lu, Z., Biscocho, N., Soumaka, E.,
чая в России, Терапевтический архив, 87, 83-87, doi: 10.
Mavroidis, M., Prats, C., Lomo, T., Capetanaki, Y., and
17116/terarkh201587383 87.
Ploug, T. (2006) Blood vessels and desmin control the posi
LMNA GENE R482L MUTATION AFFECTS THE DYNAMICS
OF C2C12 MYOGENIC DIFFERENTIATION AND STIMULATES
THE FORMATION OF INTRAMUSCULAR LIPID DROPLETS
N. V. Khromova1*, K. I. Perepelina1,2, O. A. Ivanova1,3,
A. B. Malashicheva1,2, A. A. Kostareva1, and R. I. Dmitrieva1
1 Almazov National Medical Research Centre, Ministry of Health
of the Russian Federation, 197341 St. Petersburg, Russia;
E$mail: khromova@almazovcentre.ru, akostareva@hotmail.com,
renata.i.dmitrieva@gmail.com
2 St. Petersburg State University, 199034 St. Petersburg, Russia;
E$mail: kseniya.perepelina@mail.ru, amalashicheva@gmail.com
3 St. Petersburg National Research University of Information
Technologies, Mechanics and Optics, 197101 St. Petersburg,
Russia; E$mail: astroksana@gmail.com
Received September 12, 2018
Revised November 16, 2018
Accepted November 16, 2018
Missense mutations in the LMNA gene that result in the replacement of a highly conserved arginine 482 in the C ter
minal globular domain of lamin A/C are associated with Dunnigan familial partial lipodystrophy (FPLD2). Various
disorders of muscle development are often detected in FPLD2 patients, and molecular mechanisms of those disorders
are not fully understood. The aim of our work was to investigate the effects of the LMNA gene R482L mutation on the
dynamics of muscle differentiation and the intramuscular fat accumulation during muscle development. The experi
mental cell model based on C2C12 mouse myoblasts was employed. C2C12 cells were modified with lentiviral con
structs bearing wild type human LMNA gene (LMNA WT) or LMNA gene R482L mutation. In myoblasts carrying
LMNA WT or LMNA gene R482L mutation, myogenesis and adipogenesis were stimulated, and then the dynamics
of expression of muscular and adipose differentiation markers, the morphology of differentiated myotubes, and the
dynamics of formation of intramuscular fat drops were analyzed. We demonstrated that in C2C12 LMNA R482L
samples, desmin expression was upregulated at all stages of muscle differentiation, and myoblasts bearing the muta
tion differentiated into hypertrophic (compared to C2C12 LMNA WT) myotubes. The downregulated expression
level of myogenic transcription factor Myf6 in LMNA R482L samples indicated a delay in maturation of muscle
fibers. In response to stimulation of fat differentiation, LMNA R482L myoblasts accumulated fat much more active
ly than LMNA WT myoblasts and demonstrated increased expression levels of lipid droplets markers FABP4, ATGL,
PLIN2. To summarize, we revealed that the LMNA gene R482L mutation affects the dynamics of myogenesis in
C2C12 myoblasts and stimulates the formation of fat deposits in myoblasts and myotubes in tissue specific manner.
Keywords: LMNA gene, LMNA gene R482L mutation, Dunnigan familial partial lipodystrophy, myogenesis, adipoge
nesis, С2С12 myoblasts
БИОХИМИЯ том 84 вып. 3 2019