БИОХИМИЯ, 2019, том 84, вып. 3, с. 380 - 391
УДК 576.32.36
ИЗМЕНЕНИЕ ТРАНСКРИПЦИИ ГЕНОВ,
АССОЦИИРОВАННЫХ С РЕАКЦИЕЙ НА ГИПОКСИЮ,
В МЕЗЕНХИМАЛЬНЫХ СТРОМАЛЬНЫХ КЛЕТКАХ
ПРИ РЕПЛИКАТИВНОМ СТАРЕНИИ В УСЛОВИЯХ
ФИЗИОЛОГИЧЕСКОГО СОДЕРЖАНИЯ КИСЛОРОДА
© 2019 А.Ю. Ратушный, Ю.В. Рудимова, Л.Б. Буравкова*
Институт медико биологических проблем РАН, 123007 Москва,
Россия; электронная почта: buravkova@imbp.ru
Поступила в редакцию 09.11.2018
После доработки 04.12.2018
Принята к публикации 04.12.2018
Мезенхимальные стромальные клетки (МСК) являются одной из популяций стволовых клеток взрослого
организма, способной модулировать функциональный статус окружающих тканей. Однако при достижении
состояния клеточного старения биологическая активность МСК изменяется, что может стать причиной
изменения тканевого гомеостаза. Известно, что снижение уровня кислорода в условиях in vitro до физиоло&
гических значений, характерных для ниши данной популяции клеток, способствует смягчению некоторых
морфофункциональных изменений, ассоциированных со старением. Целью данной работы являлось изуче&
ние экспрессии генов МСК, ассоциированных с реакцией на гипоксию, на модели репликативного старе&
ния с использованием физиологического (5%) и атмосферного (20%) уровней кислорода при культивирова&
нии. Согласно полученным данным, значимое снижение пролиферативных свойств МСК происходит пос&
ле 20 пассажей, что составляет ~50 клеточных делений. Вне зависимости от уровня кислорода в сенесцент&
ных клетках повышалась экспрессия генов PKM2, SERPINE1, VEGFA и снижалась экспрессия генов
ANKRD37, DDIT4, HIF1A, TXNIP. Помимо этого в гипоксических условиях обнаружено уменьшение коли&
чества мРНК генов ADORA2B, BNIPL, CCNG2, EGLN1, MAP3K1, MXI1 и P4HA1. Влияние уровня кислорода
как на клеточном, так и на транскрипционном уровнях оказалось более выраженным на ранних пассажах.
Независимо от пассажа при гипоксии снижалась экспрессия генов ANGPTL4, GYS1, PKM2, SERPINE1 и
TP53. При этом на ранних этапах культивирования дополнительно обнаружено уменьшение количества
мРНК ADM, F10, HMOX1, P4HB, PFKL и SLC16A3, а на поздних - мРНК HK2. Повышение уровня экспрес&
сии показано лишь для гена ANKRD37, причем и на ранних, и на поздних пассажах.
КЛЮЧЕВЫЕ СЛОВА: мезенхимальные стромальные клетки, репликативное старение, уровень кислорода.
DOI: 10.1134/S0320972519030084
Увеличение средней продолжительности
располагающимися в периваскулярном прост&
жизни в экономически развитых странах ставит
ранстве. Снижение регенеративной способнос&
перед регенеративной медициной вопросы, ка&
ти тканей коррелирует со снижением функцио&
сающиеся клеточной терапии при заболевани&
нальной активности этих клеток, с одновремен&
ях, ассоциированных с возрастом. Одним из ос&
ным уменьшением плотности и пластичности
новных проявлений старения организма являет&
микроваскулярного русла. Изменение морфо&
ся нарушение тканевого гомеостаза, поддержи&
функциональных характеристик клеточной по&
ваемого прогениторными клетками, в т.ч. мезен&
пуляции при последовательных делениях клеток
химальными стромальными клетками (МСК),
диктует необходимость изучения свойств МСК,
понимания механизмов клеточного старения и
поиска возможных путей их предотвращения
Принятые сокращения: МСК - мезенхимальные
стромальные клетки; сенМСК - сенесцентные МСК; HIF -
(уменьшения).
фактор, индуцируемый гипоксией; PD - количество удво&
Анализ возрастных изменений позволяет
ений клеточных популяций; SA&β&gal - β&галактозидаза, выделить девять ключевых признаков старения
ассоциированная со старением (senescence&associated β&ga&
организма: нестабильность генома, укороче&
lactosidase); SASP - секреторный фенотип, ассоциирован&
ный со старением (senescence&associated secretory pheno&
ние теломер, эпигенетические альтерации, на&
type).
рушение протеостаза, нарушение распознавания
* Адресат для корреспонденции.
питательных веществ, митохондриальная дис&
380
СТАРЕНИЕ МСК ПРИ ГИПОКСИИ
381
функция, клеточное старение, истощение пула
[14, 15]. Модификация условий культивирова&
стволовых клеток и изменение межклеточного
ния, в частности снижение уровня кислорода,
взаимодействия [1, 2]. Одним из центральных
может приводить к сходным эффектам [11,
звеньев в процессе старения является клеточное
16-20]. Ранее нами было показано, что при дли&
старение (сенесценция) [3]. Данный феномен
тельном культивировании МСК наиболее выра&
характеризуется необратимым арестом клеточ&
женное увеличение экспрессии маркерных ге&
ного цикла и сопровождается выраженными фе&
нов клеточного старения (CCND1, SERPINE1)
нотипическими изменениями, включая ремоде&
наблюдается в стандартных условиях (20% О2).
лирование хроматина, модуляцию метаболизма,
При этом уменьшается уровень мРНК ингиби&
усиление аутофагических процессов и продук&
торов данного процесса и позитивных регулято&
цию провоспалительных цитокинов [4-6]. Сре&
ров пролиферации (ID1, IGF1). Снижение со&
ди наиболее известных маркеров сенесцентного
держания кислорода уменьшает интенсивность
состояния клетки стоит выделить морфологи&
проявлений ассоциированных со старением
ческие изменения - уплощение и увеличение раз&
признаков, в т.ч. на уровне экспрессии генов
мера клетки, повышение активности ассоцииро&
[19, 20]. Хорошо известно, что в реакции клеток
ванной со старением β&галактозидазы (SA&β&gal)
на гипоксию ведущую роль играет транскрип&
и увеличение частоты возникновения гетеро&
ционный фактор HIF&1, изменяющий транскрип&
хроматиновых фокусов - γH2AX [7]. Остановка
цию широкого спектра генов [21].
клеточного деления при сенесценции достига&
Целью данной работы являлось изучение
ется путем активации сигнальных каскадов суп&
экспрессии генов, ассоциированных с реакцией
рессоров опухолей p16INK4a/Rb и p53/p21CIP1,
на гипоксию, при длительном культивировании
которые опосредуют реакцию клетки на повреж&
МСК в условиях физиологического (5%) и ат&
дения ДНК.
мосферного (20%) уровней кислорода.
Кроме того, одним из наиболее характерных
признаков сенесцентных клеток (и, возможно,
наиболее важным с точки зрения старения всего
МЕТОДЫ ИССЛЕДОВАНИЯ
организма) является секреторный фенотип, ас&
социированный со старением (SASP - senes&
Выделение и культивирование МСК. МСК вы&
cence&associated secretory phenotype). SASP ха&
деляли из жировой ткани человека по стандарт&
рактеризуется значительным сдвигом парак&
ной методике [22] с модификациями [23]. В ис&
ринной активности и включает сотни секрети&
следовании использовали образцы жировой
руемых факторов, в т.ч. провоспалительные ци&
ткани от пяти различных доноров (женщины
токины, хемокины, факторы роста и протеазы
35-45 лет), предоставленные в рамках договора
[8, 9]. Оценка экспрессии генов сенМСК (се&
Многопрофильной клиникой «Союз» (Москва).
несцентных МСК) показала увеличение коли&
Клетки культивировали в среде α&MEM, со&
чества транскриптов и других секретируемых
державшей 10% фетальной телячьей сыворотки
факторов, многие из которых обладают про&
(ФТС), 50 ед/мл пенициллина, 50 мкг/мл стреп&
воспалительным действием, включая GRO1,
томицина («ПанЭко», Россия) в условиях 5%&ного
MCP&2, RANTES, GM&CSF, металлопротеазу
уровня СО2, 37 °С, 100%&ной влажности при со&
MMP3 и ICAM&1 [10, 11]. В целом эти данные
держании кислорода 20% и 5%. Иммунофено&
свидетельствуют о том, что SASP модифицирует
тип МСК (CD90+ CD73+ CD105+ CD44+ CD29+
паракринную коммуникацию между МСК и их
HLA&ABC+ CD45-) [24] подтверждали с по&
физиологическим/патологическим микроокру&
мощью соответствующих антител с флуоресцент&
жением.
ными метками («BD», США) методом проточ&
На сегодняшний день существует несколько
ной цитофлуориметрии на приборе Accuri C6
потенциальных подходов поддержания или по&
(«BD», США). Пассирование осуществляли при
вышения терапевтической эффективности МСК
80-90%&ной конфлюентности клеточного слоя.
путем регулирования конкретных факторов,
Длительное пассирование культуры продолжали
способных повлиять на характеристики МСК,
до наступления состояния репликативного ста&
в т.ч. на старение. Для активации эндогенной
рения.
теломеразы предлагается использовать аспирин,
Число удвоений популяций (PD) за пассаж (7 дней)
витамин С и цитокин FGF&2 [12]. Перспектив&
подсчитывали по формуле: PD = [log(N/N0)]/log 2,
ным может быть применение антиоксидантов
где N0 и N - начальное и конечное количество
или ингибиторов некоторых сигнальных путей,
клеток [25]. Затем полученные значения усред&
таких как N&ацетил&L&цистеин (NAC), предшест&
няли для нескольких пассажей.
венник глутатиона [13], производные пластохи&
Распределение популяций МСК по фазам кле&
нона (SkQ1), ориентированные на митохондрии
точного цикла оценивали методом проточной
БИОХИМИЯ том 84 вып. 3 2019
382
РАТУШНЫЙ и др.
цитофлуориметрии на приборе Accuri C6 («BD»,
до достижения лимита Хейфлика и появления
США). Для анализа клетки фиксировали 70%&
характерных признаков.
ным этанолом и в течение 15 мин обрабатывали
Одним из главных признаков клеточного
раствором, содержавшим 50 мкг/мл иодида про&
старения является неспособность клетки к деле&
пидия (PI) и 25 мкг/мл РНКазы А.
нию, т.е. необратимая потеря ее пролифератив&
Клоногенную активность МСК оценивали,
ных свойств. Анализ среднего количества удвое&
высевая клетки с низкой плотностью на чашки
ний популяций за пассаж (PD) пяти клеточных
Петри диаметром 35 мм (~100 клеток на чашку).
линий выявил, что МСК, выделенные из жиро&
После двух недель культивирования при соответ&
вой ткани человека, активно делятся в среднем
ствующем уровне кислорода клетки фиксирова&
до 21-23 пассажей (~50 клеточных делений),
ли и окрашивали 0,5%&ным раствором крис&
после чего количество удвоений популяции дос&
талл&виолета в метаноле в течение 5 мин.
товерно (p < 0,05) снижается (рис. 1). Данный
Экспрессию SA@β@gal в клетках оценивали с
факт не только указывает на приобретение соот&
помощью набора Senescence Cells Histochemical
ветствующего фенотипа стареющих клеток, но и
Staining Kit («Sigma», США) согласно инструк&
является одним из главных свидетельств отсут&
ции производителя. Анализировали пять полей
ствия спонтанной иммортализации. Также по&
зрения, полученных с использованием светово&
лученные данные показали значительные инди&
го фазово&контрастного микроскопа Eclipse TiU
видуальные различия в зависимости от донора
(«Nikon», Япония). Подсчет клеток проводили с
МСК, поэтому во всех дальнейших эксперимен&
помощью программы Sigma ScanPro 5.0 Image
тах использовали клетки поздних пассажей
Analysis Software («SPSS Inc.», США).
(p19-28), для которых предварительно подтверж&
Для определения уровня экспрессии генов вы&
дали значительное снижение пролиферативной
деляли тотальную РНК с помощью лизирующе&
активности, указывающее на достижение сенес&
го реагента QIAzol («Qiagen», США), после чего
центного состояния.
проводили реакцию обратной транскрипции с
Постоянное культивирование клеток в усло&
использованием QuantiTect Reverse Transcription
виях с физиологическим уровнем кислорода
Kit («Qiagen», США) согласно инструкциям
(5%) приводило к увеличению среднего PD на
производителя. Контроль концентрации и чис&
ранних этапах культивирования (рис. 1). При
тоты РНК и кДНК в образцах осуществляли при
более длительном пассировании клеток эффект
помощи спектрофотометра Nanodrop ND&2000c
влияния уровня кислорода не был статистичес&
(«Thermo Scientific», США). Полученную кДНК
ки подтвержден, но тенденция сохранялась.
использовали для проведения количественной
Такой параметр, как количество удвоений
ПЦР с применением коммерческого реагента
популяции, может зависеть от двух основных
RT2 Real Time SYBR Green/ROX PCR Master Mix
факторов - пролиферативной активности кле&
(«Qiagen», США) и планшетов RT2 Profiler™
ток и клеточной гибели. Ранее мы показали, что
PCR Array Human Cellular Senescence и RT2 Pro&
в сенесцентных культурах МСК в несколько раз
filer™ PCR Array Human Hypoxia Signaling Pathway
увеличивается доля поврежденных клеток по
(«Qiagen», США) с иммобилизованными лио&
сравнению с «молодыми», при этом снижение
филизированными праймерами. Для нормали&
уровня кислорода до физиологических значе&
зации результатов исследования использовали
праймеры для референсных генов (ACTB, B2M,
GAPDH, HPRT1, RPLP0), входящие в состав на&
бора. Уровень экспрессии оценивали методом
2-ΔΔCt [26].
Статистическую достоверность различий
между группами данных выявляли попарно с
помощью непараметрического критерия Ман&
на-Уитни.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Данное исследование предполагало получе&
ние сенесцентных культур МСК in vitro, вклю&
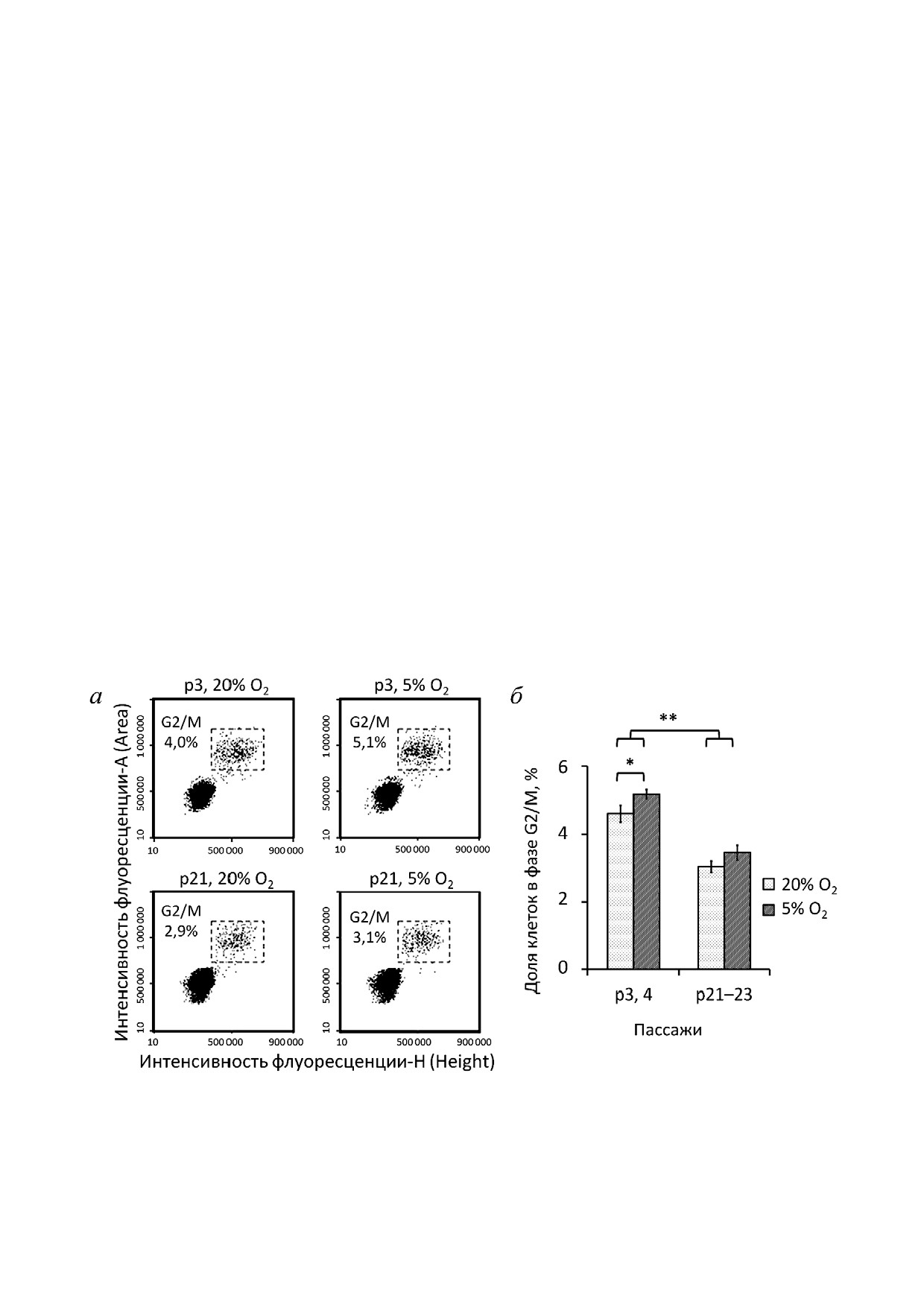
Рис. 1. Среднее количество удвоений клеточных популя&
чая подтверждение состояния репликативного
ций МСК по пассажам (PD) при длительном культивиро&
старения. Репликативного старения культур
вании в условиях с различным содержанием кислорода.
достигали путем длительного культивирования
Данные представлены как M ± SEM; n
5; * p
0,05; ** p
0,01
БИОХИМИЯ том 84 вып. 3 2019
СТАРЕНИЕ МСК ПРИ ГИПОКСИИ
383
ний позволяло уменьшить долю клеточной ги&
данному параметру не выявлено, хотя тенден&
бели как на ранних, так и на поздних пассажах
ция сохранялась (рис. 2).
[20].
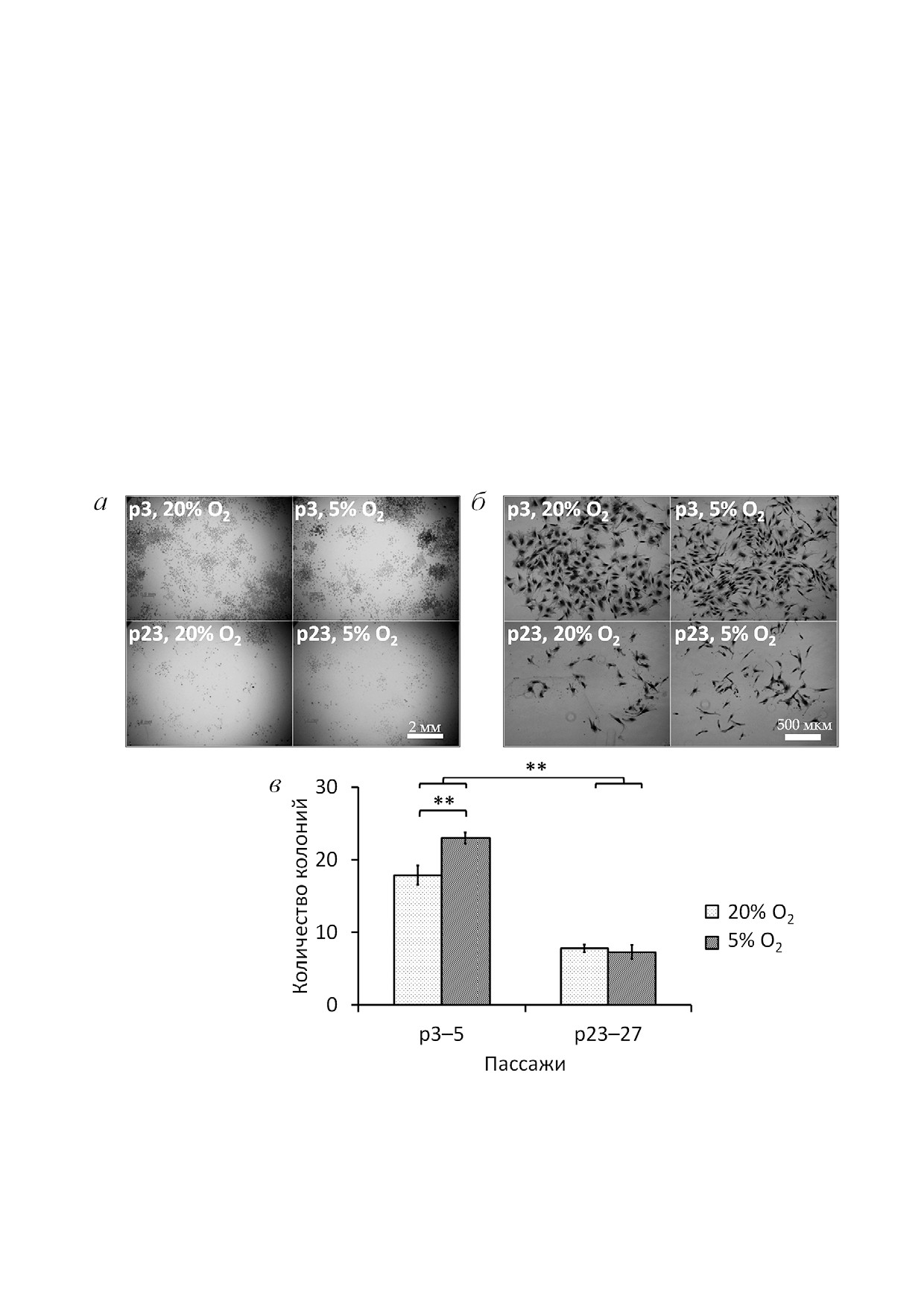
Анализ клоногенной активности показал
Пролиферативный потенциал культуры
аналогичную закономерность. На ранних пасса&
МСК оценивали по ряду параметров, включая
жах в условиях с атмосферным уровнем кисло&
распределение МСК по фазам клеточного цик&
рода среднее количество колоний составляло
ла, клоногенную активность и накопление кле&
17,9 на чашку, что указывает на то, что лишь
ток с активной SA&β&gal.
~18% клеток в культуре МСК in vitro обладало
Популяция МСК, в т.ч. выделенная из жиро&
значительными пролиферативными свойства&
вой ткани, представляет собой гетерогенную
ми. На поздних пассажах выявлено значимое
культуру, включающую клетки разной степени
снижение КОЕ до 7,8, т.е. более чем двукратное
коммитированности с различным пролифера&
уменьшение пула активно делящихся клеток на
тивным потенциалом [27, 28]. Для оценки доли
популяцию по сравнению с ранними пассажами
делящихся клеток при достижении конфлюент&
(рис. 3). Анализируемые колонии отличались не
ности монослоя 80-90% использовали метод,
только количественно, но и качественно. Так,
позволяющий определить разницу в количестве
колонии сенМСК были гораздо менее плотны&
ДНК и разделить по этому показателю МСК по
ми и занимали меньшую площадь, что может
фазам клеточного цикла. Так, в фазе G1/G0 в
быть одним из следствий снижения пролифера&
клетках содержится в 2 раза меньше ДНК, чем в
тивной активности. Полученные результаты
фазе G2 и во время митоза (M). Анализ распре&
позволяют заключить, что при репликативном
деления популяции МСК ранних и поздних пас&
старении происходит не только уменьшение до&
сажей по фазам клеточного цикла выявил су&
ли МСК, способных к активной пролиферации,
щественное снижение доли активно делящихся
но и снижение пролиферативного потенциала
клеток (G2/M) при длительном культивирова&
субпопуляции делящихся клеток.
нии (рис. 2).
Культивирование МСК при физиологичес&
Культивирование МСК при физиологичес&
ком уровне кислорода приводило к увеличению
ком уровне кислорода приводило к увеличению
среднего количества колоний на ранних пасса&
доли делящихся клеток на ранних пассажах. Од&
жах до 23 на чашку против 17,9 в условиях ат&
нако на поздних сроках значимых различий по
мосферного О2. Однако в сенесцентных культу&
Рис. 2. Распределение МСК по фазам клеточного цикла на стадии 80-90%&ной конфлюентности на ранних и поздних пас&
сажах при длительном культивировании в условиях с различным содержанием кислорода. а - Репрезентативные диа&
граммы, проточная цитофлуориметрия; б - доля МСК в фазе клеточного цикла G2/M. Данные представлены как M ± SEM;
n
3; * p
0,05; ** p
0,01
БИОХИМИЯ том 84 вып. 3 2019
384
РАТУШНЫЙ и др.
рах значимых различий по данному параметру
тивной SA&β&gal значительно увеличивается на
не выявлено (рис. 3).
поздних пассажах в среднем до 68,7 против 9%
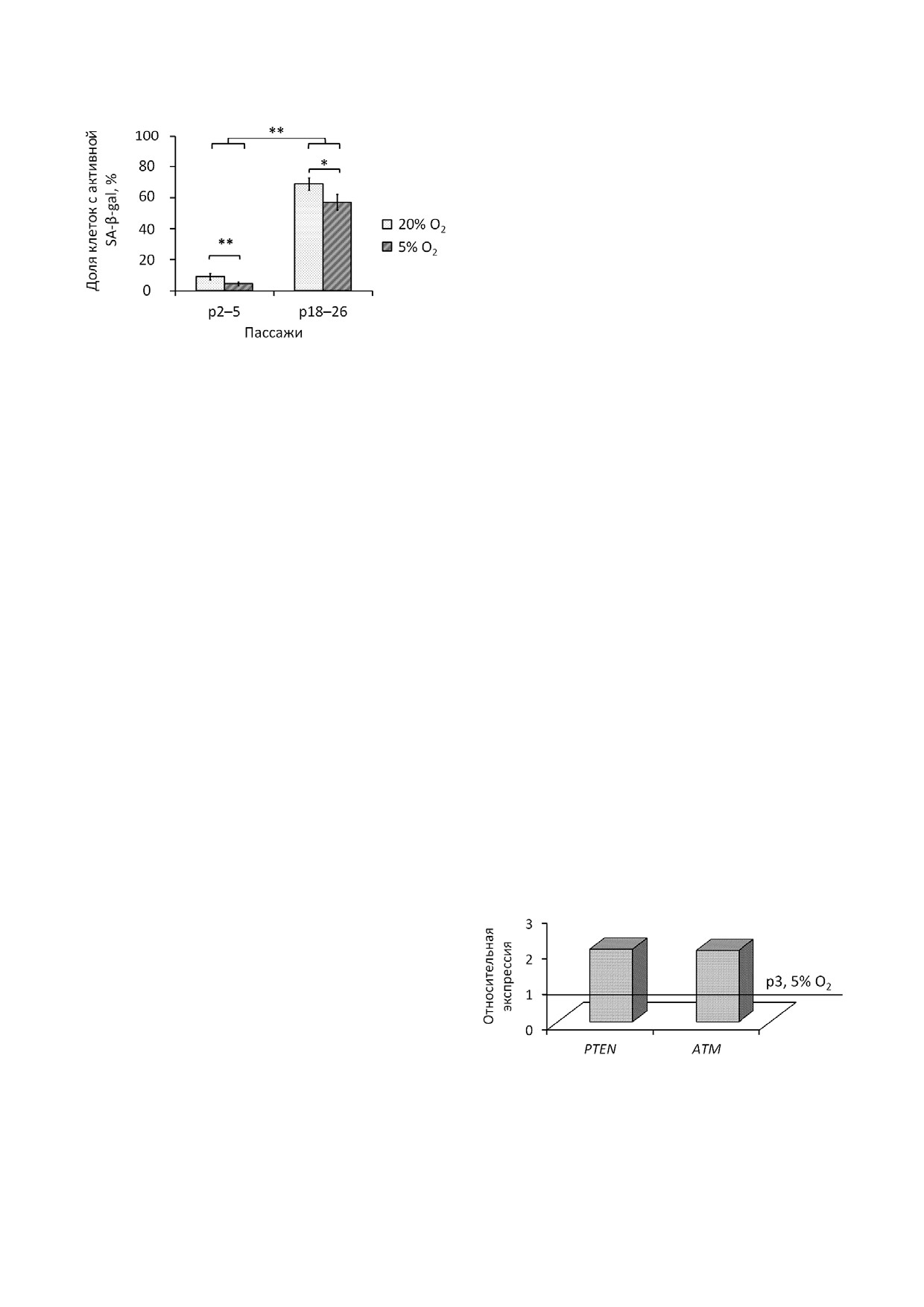
Длительное культивирование клеток приво&
на ранних этапах культивирования (рис. 4). При
дило к увеличению активности SA&β&gal, что
снижении уровня кислорода до 5% доля пози&
наблюдается при аресте клеточного цикла. Дан&
тивно окрашенных клеток уменьшается как на
ный фермент относится к лизосомальным гид&
ранних, так и на поздних пассажах.
ролазам и в норме проявляет активность при рН 4.
Анализ транскрипционной активности ге&
Было обнаружено, что в сенесцентных клетках
нов, ассоциированных со старением, проводили
SA&β&gal активируется и при рН 6 [29], что по&
методом количественной ПЦР с помощью сис&
служило доказательством возможности ее ис&
темы RT2 Profiler™ PCR Array Human Cellular
пользования для количественной оценки сенес&
Senescence («Qiagen», США). Было обнаружено,
центного состояния клеточной культуры. В нас&
что культивирование МСК до 3&го пассажа в ус&
тоящий момент специфическая реакция на вы&
ловиях 20%&ного и 5%&ного содержания О2 не
явление активности SA&β&gal является одним из
приводит к различиям в экспрессии значитель&
наиболее широко используемых методов детек&
ного числа генов, продукты которых участвуют в
ции клеточного старения.
процессах старения. При 20%&ном уровне О2 по
В нашей работе показано, что при длитель&
сравнению с клетками при 5%&ном уровне О2
ном пассировании МСК в условиях стандартно&
наблюдалось двукратное повышение экспрес&
го культивирования (20% О2) доля клеток с ак&
сии лишь двух из анализируемых 84 генов -
Рис. 3. Клоногенная активность МСК на ранних и поздних пассажах при длительном культивировании в условиях с раз&
личным содержанием кислорода. а - Репрезентативные микрофотографии областей чашек Петри с колониями клеток;
б - репрезентативные микрофотографии отдельных колоний; в - количество колоний. Данные представлены как M ± SEM;
n
3; * p
0,05; ** p
0,01
БИОХИМИЯ том 84 вып. 3 2019
СТАРЕНИЕ МСК ПРИ ГИПОКСИИ
385
нов ANKRD37, DDIT4, HIF1A, TXNIP, т.е. изме&
нения носили однонаправленный характер
(табл. 1). Помимо этого в гипоксических усло&
виях обнаружено уменьшение количества мРНК
ADORA2B, BNIP3L, CCNG2, EGLN1, LOX, MXI1 и
P4HA1.
По сравнению с культурами клеток 3&го пас&
сажа, в сенесцентных клетках наблюдалось сни&
жение уровня экспрессии не только гена HIF1A,
кодирующего α&субъединицу HIF&1 (фактора 1,
индуцируемого гипоксией), но и гена EGLN1.
Белок, кодируемый этим геном, катализирует
посттрансляционное формирование 4&гидрокси&
Рис. 4. Выявление активной β&галактозидазы (SA&β&gal) в
пролина в α&субъединице HIF&1. HIF&1 функ&
МСК на ранних и поздних пассажах при длительном куль&
ционирует как главный регулятор клеточного и
тивировании в условиях с различным содержанием кисло&
системного гомеостатического ответа на гипок&
рода. Окрашивание проводили через семь дней после по&
сева в стандартной плотности (3000 кл/см2). Данные
сию, активируя транскрипцию многих генов,
представлены как M ± SEM; n
5; * p
0,05; ** p
0,01
вовлеченных в энергетический метаболизм, ан&
гиогенез, апоптоз, а также генов, белковые про&
дукты которых увеличивают доставку кислорода
ATM и PTEN (рис. 5). Известно, что продукт ге&
или облегчают метаболическую адаптацию к ги&
на ATM участвует в ответе на повреждения ДНК,
поксии. Механизм его действия изучен доволь&
а повышенная экспрессия PTEN способствует
но подробно [21]. Синтез субъединицы HIF&1α
снижению пролиферативной активности клеток
происходит конститутивно, однако в присут&
[30]. Активация АТМ&киназы, одного из эффек&
ствии кислорода она деградирует: пролилгид&
торов DDR (DNA Damage Response), запускает
роксилазы, неактивные при низком уровне О2
сигнальные каскады, приводящие к аресту кле&
(1-4% О2), гидроксилируют консервативные
точного цикла [31, 32]. Киназа АТМ фосфори&
пролиловые остатки на HIF&1α. После этого
лирует Сhk2, которая может транслоцироваться
следует связывание с белком фон Хиппель-Лин&
в ядро и активировать свои мишени. Chk2 явля&
дау, который направляет субъединицу на убик&
ется компонентом сигнального пути, приводя&
витин&зависимую протеасомную деградацию.
щего к остановке клеточного цикла преимуще&
Другой механизм контроля - фактор FIH&1
ственно в фазе G1 в ответ на повреждение ДНК
(factor inhibiting HIF&1), который неактивен в
[33, 34]. Активированная Chk2 способна фосфо&
гипоксических условиях, но в присутствии О2
рилировать р53, который может напрямую фос&
гидроксилирует аспарагиновый остаток на транс&
форилироваться и киназой АТМ [4, 35]. Полу&
активационном домене HIF&1α. При гипоксии
ченные данные могут указывать на то, что стан&
HIF&1α стабилизируется и транслоцируется в
дартное культивирование при 20%&ном содер&
ядро, соединяясь с HIF&1β. Далее димер присо&
жании О2 оказывает некоторое повреждающее
единяется к домену HRE (hypoxia&response ele&
действие на ДНК клетки, способствуя сниже&
ment), связанному с коактиватором, например,
нию скорости клеточного деления.
CBP/p300, и таким образом осуществляет регу&
Для выявления транскриптомных измене&
ляцию экспрессии ~70 генов. Также в сенМСК
ний генов, ассоциированных с реакцией на ги&
поксию, при длительном культивировании в ус&
ловиях с пониженным содержанием кислорода
были изучены МСК 23&го и 3&го пассажей. Ана&
лиз проводили методом количественной ПЦР с
помощью системы RT2 Profiler™ PCR Array
Human Hypoxia Signaling Pathway («Qiagen»,
США). Показано, что при длительном культи&
вировании в условиях с 20%&ным содержанием
О2 изменялась экспрессия семи генов, в то вре&
мя как в условиях гипоксии обнаружены изме&
нения экспрессии 14 генов (табл. 1). Вне зависи&
Рис. 5. Относительная экспрессия генов МСК 3&го пасса&
жа при культивировании в условиях атмосферного уровня
мости от уровня кислорода в сенесцентных
кислорода (20%) и относительной гипоксии (5%). Представ&
клетках повышалась экспрессия генов PKM2,
лены гены, экспрессия которых достоверно (p
0,05) изме&
SERPINE1, VEGFA и снижалась экспрессия ге&
нилась более чем в 2 раза
7 БИОХИМИЯ том 84 вып. 3 2019
386
РАТУШНЫЙ и др.
Таблица 1. Относительная экспрессия HIF&зависимых генов в сенМСК
Относительная экспрессия
Ген
Продукт гена
20% О2
5% О2
ADORA2B
рецептор аденозина A2b
0,66
0,18*
ANKRD37
анкириновый повтор домена 37
0,15*
0,19*
BNIP3L
аденовирус E1B19k&связывающий белок B5
0,74
0,45*
CCNG2
циклин G2
0,63
0,46*
DDIT4
транскрипт 4, индуцируемый повреждением ДНК
0,24*
0,45*
EGLN1
HIF&пролилгидроксилаза 2
0,77
0,43*
HIF1A
фактор 1, индуцируемый гипоксией, α&субъединица
0,36*
0,31*
LOX
лизилоксидаза
0,66
0,50*
MXI1
MAX&связывающий фактор транскрипции
0,51
0,27*
P4HA1
пролил&4&гидроксилаза, α&субъединица 1
0,77
0,32*
PKM2
пируваткиназа (мышца)
2,05*
2,18*
SERPINE1
ингибитор активатора плазминогена 1
2,54*
2,06*
TXNIP
тиоредоксин&связывающий белок
0,27*
0,50*
VEGFA
эндотелиальный фактор роста сосудов А
2,51*
2,31*
Примечание. За контроль приняты клетки 3&го пассажа, культивируемые при соответствующем уровне кислорода. Представ&
лены гены, экспрессия которых изменилась более чем в 2 раза. * p
0,05; n = 3.
отмечалось снижение уровня экспрессии ряда
основным регулятором редокс&сигнализации и
HIF&зависимых генов. Было выявлено умень&
защищает клетки от окислительного стресса.
шение количества мРНК DDIT4. Продукт этого
Тиоредоксинсвязывающий белок ингибирует
гена действует как негативный регулятор mTOR,
антиоксидантную функцию тиоредоксина, что
серин/треонинкиназы, опосредующей различ&
приводит к накоплению активных форм кислоро&
ные клеточные функции, такие как рост, проли&
да и клеточному стрессу (RefSeq Gene ID 10628).
ферация и аутофагия [36]. Обычно продукция
Кроме того, отмечено снижение уровня экспрес&
этого транскрипта резко возрастает в ответ на
сии гена BNIP3L, кодирующего проапоптоти&
гипоксию, поскольку DDIT4 является мишенью
ческий белок, который, взаимодействуя с Bcl&2,
как для HIF&1α, так и для HIF&2α [37-39]. От&
приводит к выходу цитохрома c из митохондрий
мечено снижение уровня экспрессии гена
[42].
ANKRD37, продукт которого также является бел&
Наблюдаемое снижение пролиферативной
ком&мишенью HIF&1 и имеет четыре сайта свя&
активности сенМСК сопровождается снижени&
зывания с ним [40].
ем уровня экспрессии гена CCNG2, кодирующе&
Сравнительный анализ МСК 3&го и 23&го
го циклин G2, который является негативным
пассажей показал снижение уровня экспрессии
регулятором клеточного цикла и может влиять
гена ADORA2B, кодирующего аденозиновый ре&
на пролиферацию, клеточную гибель и канце&
цептор А2В, посредством которого осуществля&
рогенез [43, 44].
ется цитопротекторное действие аденозина при
Кроме того, в МСК 23&го пассажа выявлен
гипоксии и ишемии. Есть данные, что продук&
более низкий уровень экспрессии двух генов: ге&
ция IL&6 фибробластами десны человека опос&
на P4HA1, кодирующего фермент пролил&4&гид&
редована аденозиновым рецептором А2В [41].
роксилазу (катализирует процесс трехмерного
Культивирование МСК до 23&го пассажа
сворачивания вновь синтезированных цепочек
приводило к снижению уровня экспрессии гена
проколлагена), и гена LOX, кодирующего фер&
MXI1, продуктом которого является транскрип&
мент лизилоксидазу (катализирует образование
ционный репрессор, отрицательно регулирую&
нерастворимого коллагена из тропоколлагена).
щий функцию MYC (онкогенный фактор транс&
Некоторые данные указывают на то, что лизил&
крипции). Следовательно, MXI1 представляет
оксидаза играет решающую роль на стадии ком&
собой потенциальный супрессор опухоли (RefSeq
митирования плюрипотентных стволовых кле&
Gene ID 4601). Выявлено снижение уровня экс&
ток в адипоциты. Отсутствие этого фермента
прессии гена TXNIP, кодирующего тиоредоксин&
может приводить к дефектам трансформирую&
связывающий белок. Тиоредоксин представляет
щего фактора роста β, который контролирует
собой тиолоксидоредуктазу, которая является
рост и дифференцировку клеток [45].
БИОХИМИЯ том 84 вып. 3 2019
СТАРЕНИЕ МСК ПРИ ГИПОКСИИ
387
Культивирование МСК до 23&го пассажа при&
теплового шока 32, участвует в механизмах за&
водило к усилению экспрессии генов SERPINE1,
щиты клеток от повреждений, вызванных окис&
VEGFA и PKM2 как при 20%&ном уровне кисло&
лительным стрессом [48].
рода, так и при физиологической гипоксии (5% О2).
Более низкий уровень мРНК в клетках при
Ген SERPINE1 кодирует сериновую протеазу,
5%&ном уровне О2 был отмечен для гена GYS1,
которая вовлечена в ремоделирование внекле&
кодирующего гликогенсинтазу 1 - фермент, ко&
точного матрикса и активно экспрессируется в
торый играет важную роль в клеточном ответе
клетках при старении [46]. Ген VEGFA кодирует
на долгосрочную адаптацию к гипоксии. Кроме
эндотелиальный фактор роста сосудов А, кото&
того, показано, что активация этого гена может
рый, в свою очередь, индуцирует пролиферацию
приводить к чрезмерному накоплению гликоге&
и миграцию сосудистых эндотелиальных кле&
на [49].
ток, а также играет важную роль как в физиоло&
Культивирование при 5%&ном уровне О2
гическом, так и в патологическом ангиогенезе
приводило к уменьшению экспрессии несколь&
(RefSeq Gene ID 7422). Ген PKM2 кодирует пиру&
ких генов, продукты которых принимают учас&
ваткиназу, которая катализирует последнюю
тие в метаболизме глюкозы в процессе гликоли&
стадию гликолиза, превращение фосфоенолпи&
за. Сравнительный анализ экспрессии этих ге&
рувата до енольной формы пирувата с образова&
нов показал уменьшение уровня экспрессии
нием одной молекулы АТФ.
трех ферментов: 1) одной из изоформ гексоки&
Результаты сравнительного анализа диффе&
назы (HK2) - фермента, катализирующего пер&
ренциальной экспрессии генов МСК, культиви&
вую стадию гликолиза и превращение глюкозы в
руемых при 5%&ном уровне О2 по сравнению с
глюкозо&6&фосфат (RefSeq Gene ID 3099); 2) од&
клетками, культивируемыми при 20%&ном уров&
ной из изоформ фосфофруктокиназы (PFKL),
не О2, также выявили однонаправленную тен&
осуществляющей фосфорилирование фруктозо&
денцию к изменению в МСК 3&го и 23&го пасса&
6&фосфата с образованием фруктозо&1,6&дифос&
жей (табл. 2). Однако более низкий уровень
фата; 3) пируваткиназы (PKM2).
экспрессии гена ADM был достоверно подтверж&
Транспортировка лактата и пирувата через
ден только в клетках 3&го пассажа. Адреноме&
плазматическую мембрану катализируется чле&
дуллин, кодируемый этим геном, может регули&
нами семейства протон&связанных монокарбок&
ровать ангиогенез и повышать толерантность
силатных транспортеров, к семейству которых
клеток к окислительному стрессу и гипоксичес&
относится продукт гена SLC16A3 (RefSeq Gene
кому повреждению [47]. Также при 5%&ном
ID 9123). Экспрессия этого гена также снижается
уровне О2 отмечено снижение экспрессии гена
в МСК, культивируемых при 5%&ном уровне О2.
HMOX1, продукт которого, гемоксигеназа 1, яв&
Анализ элементов транскриптома МСК при
ляясь родственным белком семейства белков
5%&ном содержании О2, по сравнению с клетка&
Таблица 2. Относительная экспрессия HIF&зависимых генов при 5%&ном содержании
Относительная экспрессия
Ген
Продукт гена
p3
p23
ADM
адреномедуллин
0,22*
0,40
ANGPTL4
ангиопоэтинподобный белок 4
0,25*
0,11*
ANKRD37
анкириновый повтор домена 37
2,33*
3,17*
F10
фактор свертывания 10
0,26*
0,82
GYS1
гликогенсинтаза 1 (мышца)
0,21*
0,28*
HK2
гексокиназа 2
0,57
0,32*
HMOX1
гемоксигеназа 1
0,31*
0,21*
P4HB
пролил&4&гидроксилаза, β&субъединица
0,18*
0,69
PFKL
фосфофруктокиназа (печень)
0,19*
0,53
PKM2
пируваткиназа (мышца)
0,35*
0,36*
SERPINE1
ингибитор активатора плазминогена 1
0,34*
0,32*
SLC16A3
монокарбоксилатный транспортер 3
0,13*
0,97
TP53
опухолевый супрессор р53
0,28*
0,38*
Примечание. За контроль приняты клетки соответствующего пассажа, культивируемые при 20%&ном содержании О2.
Представлены гены, экспрессия которых изменилась более чем в 2 раза * p
0,05; n = 3.
БИОХИМИЯ том 84 вып. 3 2019
7*
388
РАТУШНЫЙ и др.
ми при 20%&ном содержании О2, также показал
Независимо от пассажа снижалась экспрессия
низкий уровень экспрессии гена ANGPTL4, про&
генов ANGPTL4, GYS1, PKM2, SERPINE1 и TP53.
дукт которого функционирует как гормон, регу&
При этом на ранних этапах культивирования до&
лирующий гомеостаз глюкозы, липидный об&
полнительно обнаружено уменьшение количе&
мен и чувствительность к инсулину. Известно,
ства мРНК ADM, F10, HMOX1, P4HB, PFKL и
что этот белок также может действовать как
SLC16A3, а на поздних - мРНК HK. При этом
фактор выживания при апоптозе в эндотелиаль&
выявлено повышение уровня экспрессии толь&
ных клетках сосудов [50]. Кроме того, было вы&
ко одного гена - ANKRD37 (ankyrin repeat
явлено снижение уровня экспрессии гена TP53,
domain 37). Известно, что этот ген является ми&
кодирующего белок&супрессор опухолей. Дан&
шенью HIF&1 и активно экспрессируется в усло&
ный белок реагирует на различные стрессы и из&
виях гипоксии.
меняет экспрессию генов&мишеней, тем самым
Таким образом, наши предыдущие результа&
вызывая остановку клеточного цикла, апоптоз,
ты [19, 20] полностью подтверждают рекоменда&
старение, восстановление ДНК или изменения
ции ряда исследователей по использованию по&
метаболизма (RefSeq Gene ID 7157).
ниженного содержания кислорода при длитель&
Полученные результаты указывают на то,
ном культивировании МСК как с целью клини&
что направленность транскрипционных изме&
ческого применения клеточных препаратов, так
нений ассоциированных с гипоксией генов в
и при изучении функциональных свойств МСК
МСК при достижении завершающей фазы реп&
[16-18]. Анализ транскрипционного профиля
ликативного старения однотипна и слабо зави&
культивируемых МСК показал его значитель&
сит от содержания кислорода. В то же время, как
ную вариабельность в зависимости от ткани,
нами было показано ранее, при длительном
особенностей донора, пассажа, плотности посе&
культивировании МСК основные маркерные
ва культуры, используемых культуральных сред
гены старения изменяют свою экспрессию бо&
и т.д. Например, из&за торможения пролифера&
лее выражено при использовании условий стан&
ции в условиях атмосферного уровня О2 суб&
дартного культивирования (20% О2) [19, 20].
культивирование МСК из костного мозга чело&
Несмотря на преимущественно посттранс&
века становится невозможным уже после 7&го
ляционную регуляцию активности HIF&1, в на&
пассажа, тогда как в условиях гипоксии этот по&
шей работе показано снижение уровня экспрес&
рог успешно преодолевается [52]. В настоящей
сии гена HIF1А в сенМСК, что указывает на
работе определен ряд дифференциально экспрес&
связь этого транскрипционного фактора и ряда
сируемых генов, ассоциированных с реакцией
регулируемых им генов с процессом клеточного
МСК на гипоксию, при длительном культиви&
старения. При этом не обнаружено значитель&
ровании (до репликативного старения) в усло&
ных различий между МСК, постоянно культи&
виях с различным уровнем кислорода. Получен&
вируемых в условиях 5%&ного и 20%&ного содер&
ные данные позволят выявить новые гены&ми&
жания кислорода. Ранее в нашей лаборатории
шени, потенциально ответственные за модуля&
были получены данные, касающиеся динамики
цию функционального состояния МСК, культи&
экспрессии HIF1A в МСК при кратковременных
вируемых при тканевом уровне О2.
экспозициях (до 24 ч) в условиях физиологичес&
кой гипоксии [51]. Показано, что экспрессия
этого гена значимо увеличивается лишь в пер&
Финансирование
вые 8 ч после смены условий (при перемещении
клеток в условия даже относительно мягкой ги&
Работа выполнена при поддержке РФФИ
поксии - 5% О2). Новые результаты также демон&
(грант № 16&04&01244&А).
стрируют, что изменение транскрипционной
активности HIF1А носит транзиторный харак&
Конфликт интересов
тер и не выявляется при постоянном культиви&
ровании в условиях 5%&ного содержания О2.
Авторы заявляют об отсутствии конфликта
Согласно полученным данным, постоянное
интересов.
пассирование МСК при разном уровне кисло&
рода приводит к более выраженным различиям
Соблюдение этических норм
на ранних этапах культивирования, в то время
как на поздних пассажах данный фактор оказы&
Настоящая статья не содержит описания ка&
вает меньшее влияние. Подобный эффект, веро&
ких&либо исследований с участием людей и ис&
ятно, связан с адаптационными процессами.
пользованием животных в качестве объектов.
БИОХИМИЯ том 84 вып. 3 2019
СТАРЕНИЕ МСК ПРИ ГИПОКСИИ
389
СПИСОК ЛИТЕРАТУРЫ
1.
Munoz&Espin, D., and Serrano, M. (2014) Cellular senes&
Xu, F., and Wan Safwani, W.K. (2015) In situ normoxia
cence: from physiology to pathology, Nat. Rev. Mol. Cell
enhances survival and proliferation rate of human adipose
Biol., 15, 482-496, doi: 10.1038/nrm3823.
tissue&derived stromal cells without increasing the risk of
2.
Lopez&Otin, C., Blasco, M.A., Partridge, L., Serrano, M.,
tumourigenesis, PLoS One, 10, e0115034, doi: 10.1371/
and Kroemer, G. (2013) The hallmarks of aging, Cell, 153,
journal.pone.0115034.
1194-1217, doi: 10.1016/j.cell.2013.05.039.
18.
Buravkova, L.B., Andreeva, E.R., Gogvadze, V., and Zhi&
3.
McHugh, D., and Gil, J. (2018) Senescence and aging:
votovsky, B. (2014) Mesenchymal stem cells and hypoxia:
causes, consequences, and therapeutic avenues, J. Cell
where are we? Mitochondrion, 19, 105-112, doi: 10.1016/
Biol., 217, 65-77, doi: 10.1083/jcb.201708092.
j.mito.2014.07.005.
4.
Campisi, J., and d’Adda di Fagagna, F. (2007) Cellular
19.
Lobanova, M.V., Ratushnyy, A.Y., and Buravkova, L.B.
senescence: when bad things happen to good cells, Nat.
(2016) Expression of senescence&associated genes in mul&
Rev. Mol. Cell Biol., 8, 729-740, doi: 10.1038/nrm2233.
tipotent mesenchymal stromal cells during long&term cul&
5.
Collado, M., Blasco, M.A., and Serrano, M. (2007)
tivation at various hypoxic levels, Dokl. Biochem. Biophys.,
Cellular senescence in cancer and aging, Cell, 130,
470, 326-328, doi: 10.1134/S1607672916050057.
223-233, doi: 10.1016/j.cell.2007.07.003.
20.
Ratushnyy, A., Lobanova, M., and Buravkova, L.B. (2017)
6.
Salama, R., Sadaie, M., Hoare, M., and Narita, M. (2014)
Expansion of adipose tissue&derived stromal cells at «physio&
Cellular senescence and its effector programs, Genes Dev.,
logic» hypoxia attenuates replicative senescence, Cell
28, 99-114, doi: 10.1101/gad.235184.113.
Biochem. Funct., 35, 232-243, doi: 10.1002/cbf.3267.
7.
Watanabe, S., Kawamoto, S., Ohtani, N., and Hara, E.
21.
Semenza, G.L. (2007) Hypoxia&inducible factor 1 (HIF&1)
(2017) Impact of senescence&associated secretory pheno&
pathway, Sci. STKE, 2007, cm8, doi: 10.1126/stke.
type and its potential as a therapeutic target for senescence&
4072007cm8.
associated diseases, Cancer Sci., 108, 563-569, doi: 10.1111/
22.
Zuk, P.A., Zhu, M., Mizuno, H., Huang, J., Futrell, J.W.,
cas.13184.
Katz, A.J., Benhaim, P., Lorenz, H.P., and Hedrick, M.H.
8.
Kuilman, T., and Peeper, D.S. (2009) Senescence&messaging
(2001) Multilineage cells from human adipose tissue:
secretome: SMS&ing cellular stress, Nat. Rev. Cancer, 9,
implications for cell&based therapies, Tissue Eng., 7,
81-94, doi: 10.1038/nrc2560.
211-228, doi: 10.1089/107632701300062859.
9.
Coppe, J.P., Desprez, P.Y., Krtolica, A., and Campisi, J.
23.
Буравкова Л.Б., Гринаковская О.С., Андреева Е.Р.,
(2010) The senescence&associated secretory phenotype:
Жамбалова А.П., Козионова М.П. (2009) Характерис&
the dark side of tumor suppression, Annu. Rev. Pathol., 5,
тика мезенхимных стромальных клеток из липоаспи&
99-118, doi: 10.1146/annurev&pathol&121808&102144.
рата человека, культивируемых при пониженном содер&
10.
Minieri, V., Saviozzi, S., Gambarotta, G., Lo Iacono, M.,
жании кислорода, Цитология, 51, 5-11, doi: 10.1134/
Accomasso, L., Cibrario Rocchietti, E., Gallina, C.,
S1990519X09010039.
Turinetto, V., and Giachino, C. (2015) Persistent DNA
24.
Dominici, M., Le Blanc, K., Mueller, I., Slaper&Corten&
damage&induced premature senescence alters the func&
bach, I., Marini, F., Krause, D., Deans, R., Keating, A.,
tional features of human bone marrow mesenchymal stem
Prockop, D.J., and Horwitz, E. (2006) Minimal criteria for
cells, J. Cell Mol. Med., 19, 734-743, doi: 10.1111/jcmm.
defining multipotent mesenchymal stromal cells. The
12387.
International Society for Cellular Therapy position
11.
Turinetto, V., Vitale, E., and Giachino, C.
(2016)
statement, Cytotherapy,
8,
315-317, doi:
10.1080/
Senescence in human mesenchymal stem cells: functional
14653240600855905.
changes and implications in stem cell&based therapy, Int. J.
25.
Greenwood, S.K., Hill, R.B., Sun, J.T., Armstrong, M.J.,
Mol. Sci., 17, 1164, doi: 10.3390/ijms17071164.
Johnson, T.E., Gara, J.P., and Galloway, S.M. (2004)
12.
Wei, F., Qu, C., Song, T., Ding, G., Fan, Z., Liu, D., Liu, Y.,
Population doubling: a simple and more accurate estima&
Zhang, C., Shi, S., and Wang, S. (2012) Vitamin C treat&
tion of cell growth suppression in the in vitro assay for chro&
ment promotes mesenchymal stem cell sheet formation
mosomal aberrations that reduces irrelevant positive
and tissue regeneration by elevating telomerase activity, J.
results, Environ. Mol. Mutagen., 43, 36-44, doi: 10.1002/
Cell Physiol., 227, 3216-3224, doi: 10.1002/jcp.24012.
em.10207.
13.
Lin, T.M., Tsai, J.L., Lin, S.D., Lai, C.S., and Chang, C.C.
26.
Livak, K.J. and Schmittgen, T.D. (2001) Analysis of rela&
(2005) Accelerated growth and prolonged lifespan of adi&
tive gene expression data using real&time quantitative
pose tissue&derived human mesenchymal stem cells in a
PCR and the 2-ΔΔCT method, Methods, 25, 402-408,
medium using reduced calcium and antioxidants, Stem
doi: 10.1006/meth.2001.1262.
Cells Dev., 14, 92-102, doi: 10.1089/scd.2005.14.92.
27.
McLeod, C.M., and Mauck, R.L. (2017) On the origin and
14.
Skulachev, V.P. (2013) Cationic antioxidants as a powerful
impact of mesenchymal stem cell heterogeneity: new
tool against mitochondrial oxidative stress, Biochem.
insights and emerging tools for single cell analysis, Eur. Cell
Biophys. Res. Commun., 441, 275-279, doi: 10.1016/j.bbrc.
Mater., 34, 217-231, doi: 10.22203/eCM.v034a14.
2013.10.063.
28.
Gonzalez&Cruz, R.D., Fonseca, V.C., and Darling, E.M.
15.
Skulachev, M.V., and Skulachev, V.P. (2017) Programmed
(2012) Cellular mechanical properties reflect the differen&
aging of mammals: proof of concept and prospects of bioche&
tiation potential of adipose&derived mesenchymal stem
mical approaches for anti&aging therapy, Biochemistry (Moscow),
cells, Proc. Natl. Acad. Sci. USA, 109, E1523-E1529,
82, 1403-1422, doi: 10.1134/S000629791712001X.
doi: 10.1073/pnas.1120349109.
16.
Fehrer, C., Brunauer, R., Laschober, G., Unterluggauer, H.,
29.
Dimri, G.P., Lee, X., Basile, G., Acosta, M., Scott, G.,
Reitinger, S., Kloss, F., Gully, C., Gassner, R., and
Roskelley, C., Medrano, E.E., Linskens, M., Rubelj, I.,
Lepperdinger, G. (2007) Reduced oxygen tension attenu&
Pereira&Smith, O., Peacocke, M., and Campisi, J. (1995) A
ates differentiation capacity of human mesenchymal stem
biomarker that identifies senescent human cells in culture
cells and prolongs their lifespan, Aging Cell, 6, 745-757,
and in aging skin in vivo, Proc. Natl. Acad. Sci. USA, 92,
doi: 10.1111/j.1474&9726.2007.00336.x.
9363-9367.
17.
Choi, J.R., Pingguan&Murphy, B., Wan Abas, W.A., Yong, K.W.,
30.
Xu, L.N., Lin, N., Xu, B.N., Li, J.B., and Chen, S.Q.
Poon, C.T., Noor Azmi, M.A., Omar, S.Z., Chua, K.H.,
(2015) Effect of human umbilical cord mesenchymal stem
БИОХИМИЯ том 84 вып. 3 2019
390
РАТУШНЫЙ и др.
cells on endometriotic cell proliferation and apoptosis,
Adenosine regulates the production of interleukin&6 by
Genet. Mol. Res., 14, 16553-16561, doi: 10.4238/2015.
human gingival fibroblasts via cyclic AMP/protein kinase A
December.11.2.
pathway, J. Periodont. Res., 35, 93-101.
31.
Bakkenist, C.J., and Kastan, M.B. (2004) Phosphatases
42.
Ray, R., Chen, G., Vande Velde, C., Cizeau, J., Park, J.H.,
join kinases in DNA&damage response pathways, Trends
Reed, J.C., Gietz, R.D., and Greenberg, A.H. (2000)
Cell Biol., 14, 339-341, doi: 10.1016/j.tcb.2004.05.001.
BNIP3 heterodimerizes with Bcl&2/Bcl&X(L) and induces
32.
Zhan, H., Suzuki, T., Aizawa, K., Miyagawa, K., and
cell death independent of a Bcl&2 homology 3 (BH3)
Nagai, R. (2010) Ataxia telangiectasia mutated (ATM)&
domain at both mitochondrial and nonmitochondrial sites,
mediated DNA damage response in oxidative stress&
J. Biol. Chem., 275, 1439-1448.
induced vascular endothelial cell senescence, J. Biol.
43.
Ahmed, S., Al&Saigh, S., and Matthews, J. (2012) FOXA1
Chem., 285, 29662-29670, doi: 10.1074/jbc.M110.125138.
is essential for aryl hydrocarbon receptor&dependent regula&
33.
Buscemi, G., Perego, P., Carenini, N., Nakanishi, M.,
tion of cyclin G2, Mol. Cancer Res., 10, 636-648, doi: 10.1158/
Chessa, L., Chen, J., Khanna, K., and Delia, D. (2004)
1541&7786.MCR&11&0502.
Activation of ATM and Chk2 kinases in relation to the
44.
Sun, G.G., Zhang, J., and Hu, W.N. (2014) CCNG2
amount of DNA strand breaks, Oncogene, 23, 7691-7700,
expression is downregulated in colorectal carcinoma and
doi: 10.1038/sj.onc.1207986.
its clinical significance, Tumour Biol., 35, 3339-3346,
34.
Lukas, C., Falck, J., Bartkova, J., Bartek, J., and Lukas, J.
doi: 10.1007/s13277&013&1440&5.
(2003) Distinct spatiotemporal dynamics of mammalian
45.
Huang, H.Y., Chen, S.Z., Zhang, W.T., Wang, S.S., Liu, Y.,
checkpoint regulators induced by DNA damage, Nat. Cell
Li, X., Sun, X., Li, Y.M., Wen, B., Lei, Q.Y., and Tang, Q.Q.
Biol., 5, 255-260, doi: 10.1038/ncb945.
(2013) Induction of EMT&like response by BMP4 via up&
35.
Von Zglinicki, T., Saretzki, G., Ladhoff, J., d’Adda di
regulation of lysyl oxidase is required for adipocyte lineage
Fagagna, F., and Jackson, S.P. (2005) Human cell senes&
commitment, Stem Cell Res., 10, 278-287, doi: 10.1016/
cence as a DNA damage response, Mech. Ageing Dev., 126,
j.scr.2012.12.005.
111-117, doi: 10.1016/j.mad.2004.09.034.
46.
Kortlever, R.M., Higgins, P.J., and Bernards, R. (2006)
36.
Sofer, A., Lei, K., Johannessen, C.M., and Ellisen, L.W.
Plasminogen activator inhibitor&1 is a critical downstream
(2005) Regulation of mTOR and cell growth in response to
target of p53 in the induction of replicative senescence,
energy stress by REDD1, Mol. Cell Biol., 25, 5834-5845,
Nat. Cell Biol., 8, 877-884, doi: 10.1038/ncb1448.
doi: 10.1128/MCB.25.14.5834&5845.2005.
47.
Zhang, Y., Xu, Y., Ma, J., Pang, X., and Dong, M. (2017)
37.
Shoshani, T., Faerman, A., Mett, I., Zelin, E., Tenne, T.,
Adrenomedullin promotes angiogenesis in epithelial ovari&
Gorodin, S., Moshel, Y., Elbaz, S., Budanov, A., Chajut, A.,
an cancer through upregulating hypoxia&inducible factor&1α
Kalinski, H., Kamer, I., Rozen, A., Mor, O., Keshet, E.,
and vascular endothelial growth factor, Sci. Rep., 7, 40524,
Leshkowitz, D., Einat, P., Skaliter, R., and Feinstein, E.
doi: 10.1038/srep40524.
(2002) Identification of a novel hypoxia&inducible fac&
48.
Chen, K., and Maines, M.D. (2000) Nitric oxide induces
tor 1&responsive gene, RTP801, involved in apoptosis, Mol.
heme oxygenase&1 via mitogen&activated protein kinases
Cell. Biol., 22, 2283-2293, doi: 10.1128/MCB.22.7.2283&
ERK and p38, Cell Mol. Biol. (Noisy le grand), 46,
2293. 2002.
609-617.
38.
Wolff, N.C., Vega&Rubin&de&Celis, S., Xie, X.J., Castril&
49.
Pescador, N., Villar, D., Cifuentes, D., Garcia&Rocha, M.,
lon, D.H., Kabbani, W., and Brugarolas, J. (2011) Cell&
Ortiz&Barahona, A., Vazquez, S., Ordonez, A., Cuevas, Y.,
type&dependent regulation of mTORC1 by REDD1 and
Saez&Morales, D., Garcia&Bermejo, M.L., Landazuri, M.O.,
the tumor suppressors TSC1/TSC2 and LKB1 in response
Guinovart, J., and del Peso, L. (2010) Hypoxia promotes
to hypoxia, Mol. Cell. Biol., 31, 1870-1884, doi: 10.1128/
glycogen accumulation through hypoxia inducible factor
MCB.01393&10.
(HIF)&mediated induction of glycogen synthase 1, PLoS
39.
Kucejova, B., Sunny, N.E., Nguyen, A.D., Hallac, R., Fu, X.,
One, 5, e9644, doi: 10.1371/journal.pone.0009644.
Pena&Llopis, S., Mason, R.P., Deberardinis, R.J., Xie, X.J.,
50.
Kim, I., Kim, H.G., Kim, H., Kim, H.H., Park, S.K.,
Debose&Boyd, R., Kodibagkar, V.D., Burgess, S.C., and
Uhm, C.S., Lee, Z.H., and Koh, G.Y. (2000) Hepatic
Brugarolas, J. (2011) Uncoupling hypoxia signaling from
expression, synthesis and secretion of a novel
oxygen sensing in the liver results in hypoketotic hypo&
fibrinogen/angiopoietin&related protein that prevents
glycemic death, Oncogene, 30, 2147-2160, doi: 10.1038/
endothelial&cell apoptosis, Biochem. J., 346, 603-610.
onc.2010.587.
51.
Погодина М.В., Буравкова Л.Б. (2015) Особенности
40.
Benita, Y., Kikuchi, H., Smith, A.D., Zhang, M.Q.,
экспрессии HIF1A в мультипотентных мезенхималь&
Chung, D.C., and Xavier, R.J. (2009) An integrative
ных стромальных клетках при гипоксии, Бюлл. экспер.
genomics approach identifies hypoxia inducible factor&1
биол. мед., 159, 333-335.
(HIF&1)&target genes that form the core response to
52.
Tsai, C.C., Chen, Y.J., Yew, T.L., Chen, L.L., Wang, J.Y.,
hypoxia, Nucleic Acids Res., 37, 4587-4602, doi: 10.1093/
Chiu, C.H., and Hung, S.C. (2011) Hypoxia inhibits
nar/gkp425.
senescence and maintains mesenchymal stem cell proper&
41.
Murakami, S., Terakura, M., Kamatani, T., Hashikawa, T.,
ties through down®ulation of E2A&p21 by HIF&TWIST,
Saho, T., Shimabukuro, Y., and Okada, H.
(2000)
Blood, 117, 459-469, doi: 10.1182/blood&2010&05&287508.
БИОХИМИЯ том 84 вып. 3 2019
СТАРЕНИЕ МСК ПРИ ГИПОКСИИ
391
ALTERATION OF HYPOXIA@ASSOCIATED
GENE EXPRESSION IN REPLICATIVE SENESCENT
MESENCHYMAL STROMAL CELLS UNDER
PHYSIOLOGICAL OXYGEN LEVEL
A. Yu. Ratushnyy, Yu. V. Rudimova, and L. B. Buravkova*
Institute of Biomedical Problems (IBMP), Russian Academy of Sciences,
123007 Moscow, Russia; E mail: buravkova@imbp.ru
Received November 9, 2018
Revised December 4, 2018
Accepted December 4, 2018
Mesenchymal stromal cells (MSCs) are one of the populations of progenitor cells of adults that can modulate func&
tional status of surrounding tissues. However, biological activity of MSCs changes upon cell senescence that may
result in shifting tissue homeostasis. The decrease in oxygen content in vitro to physiological level is known to suppress
a number of senescence&associated markers. The aim of this work was to study the MSC hypoxia&associated gene
expression in a replicative senescence model using physiological (5%) and atmospheric (20%) oxygen levels during
cell cultivation. According to our data, MSC proliferative potential significantly decreased after 20 passages (~50 cell
divisions). Regardless of oxygen level, the expression of PKM2, SERPINE1, and VEGFA genes was up®ulated and
that of ANKRD37, DDIT4, HIF1A, and TXNIP genes was down®ulated in senescent MSCs. Additionally, in hypoxia,
a decrease in ADORA2B, BNIPL, CCNG2, EGLN1, MAP3K1, MXI1, and P4HA1 mRNAs was found. The effect of
hypoxia both at cellular and transcriptional levels was more pronounced during early passages. Regardless of cultiva&
tion time, ANGPTL4, GYS1, PKM2, SERPINE1, and TP53 genes were down®ulated under hypoxia. In addition,
in early passages, the ADM, F10, HMOX1, P4HB, PFKL, and SLC16A3 genes were down®ulated and in senescent
cells the HK2 gene expression was decreased. Only one gene, ANKRD37, was up®ulated in hypoxia at both early
and late passages.
Keywords: mesenchymal stromal cells, replicative senescence, oxygen level
БИОХИМИЯ том 84 вып. 3 2019