БИОХИМИЯ, 2019, том 84, вып. 3, с. 392 - 403
УДК 576.32/.36
ВНЕКЛЕТОЧНЫЕ микроРНК И МИТОХОНДРИАЛЬНАЯ
ДНК КАК ПОТЕНЦИАЛЬНЫЕ БИОМАРКЕРЫ
АРИТМОГЕННОЙ КАРДИОМИОПАТИИ
© 2019 А.А. Худяков1*, Н.А. Смолина1, К.И. Перепелина1,2,
А.Б. Малашичева1,2, А.А. Костарева1
1 Национальный медицинский исследовательский центр им. В.А. Алмазова
Минздрава России, 197341 Санкт$Петербург, Россия;
электронная почта: khudyakov_aa@almazovcentre.ru
2 Санкт$Петербургский государственный университет,
199034 Санкт$Петербург, Россия
Поступила в редакцию 16.10.2018
После доработки 03.12.2018
Принята к публикации 03.12.2018
Дифференциальная диагностика аритмогенной кардиомиопатии во время скрытой фазы заболевания -
сложная клиническая задача. В связи с этим актуален поиск биомаркеров аритмогенной кардиомиопатии.
Известно, что внеклеточные нуклеиновые кислоты благодаря стабильности, специфичности и простоте вы#
явления могут служить надежными биомаркерами различных заболеваний. В настоящем исследовании бы#
ли определены уровни внеклеточных микроРНК и митохондриальной ДНК в кондиционированной среде,
собранной с кардиомиоцитов. Кардиомиоциты были получены путем направленной дифференцировки из
индуцированных плюрипотентных стволовых клеток пациента с аритмогенной кардиомиопатией и здоро#
вого донора. Были выявлены микроРНК, уровень которых в анализируемых образцах значимо различался,
что позволяет рассматривать их в качестве потенциальных биомаркеров аритмогенной кардиомиопатии.
КЛЮЧЕВЫЕ СЛОВА: аритмогенная кардиомиопатия, кардиомиоциты, микроРНК, митохондриальная
ДНК, индуцированные плюрипотентные стволовые клетки.
DOI: 10.1134/S0320972519030096
Аритмогенная кардиомиопатия (АКМП) яв#
миокарде уже происходят изменения проводя#
ляется наследственным аутосомно#доминант#
щих систем сердца [3].
ным заболеванием, которое характеризуется на#
Оценка уровня внеклеточных микроРНК
рушением работы проводящей системы сердца
представляется перспективным методом ранней
наряду с прогрессирующей дисфункцией мио#
диагностики заболеваний. МикроРНК — это
карда, развивающейся в результате его замеще#
малые некодирующие РНК (длиной ~22 нуклео#
ния на жировую и соединительную ткань [1]. Ге#
тидов), которые регулируют экспрессию генов
нетические исследования выявили, что с разви#
через комплементарное связывание с 3'#нетранс#
тием АКМП ассоциированы мутации в генах,
лируемой областью мРНК, что приводит либо к
кодирующих белки десмосомы [2]. Наиболее
блокированию трансляции, либо к деградации
часто встречаются мутации в гене PKP2, кодиру#
мРНК [4, 5]. Внеклеточные микроРНК были
ющем плакофиллин#2 [2]. Современные методы
обнаружены почти во всех биологических жид#
дифференциальной диагностики АКМП недо#
костях: сыворотке и плазме крови, спинномоз#
статочно чувствительны и не позволяют поста#
говой жидкости, слюне, моче, грудном молоке и
вить диагноз в течение скрытой стадии заболе#
др. Кроме того, сочетания микроРНК, найден#
вания, при которой в морфологически здоровом
ных в образцах жидкостей, отражали патофизи#
ологическое состояние организма [6]. Было по#
казано, что микроРНК секретируются клетками
Принятые сокращения: АКМП - аритмогенная кар# в составе микровезикул, экзосом, белковых
диомиопатия; иПСК - индуцированные плюрипотентные
комплексов, а также липопротеиновых частиц
стволовые клетки; мтДНК - митохондриальная ДНК;
DAPI - 4',6#диамидино#2#фенилиндол; miR - микроРНК;
высокой и низкой плотности, что обеспечивает
PBS - фосфатно#солевой буфер.
их устойчивость к воздействию внеклеточной
* Адресат для корреспонденции.
среды [6-10].
392
микроРНК - БИОМАРКЕРЫ АРИТМОГЕННОЙ КАРДИОМИОПАТИИ
393
К настоящему времени опубликовано не#
(иПСК), а также из иПСК от пациента с АКМП,
сколько исследований, описывающих изменение
и последующая оценка возможности использо#
уровней микроРНК у пациентов с АКМП. В ре#
вания микроРНК и мтДНК в качестве биомар#
зультате сравнения содержания микроРНК в
керов АКМП.
плазме пациентов с АКМП и здоровых доноров
была выявлена микроРНК#302a (miR#302a),
уровень которой был понижен у пациентов с
МЕТОДЫ ИССЛЕДОВАНИЯ
АКМП [11]. Анализ экспрессии более тысячи
различных микроРНК в ткани миокарда выявил
Культивирование иПСК. В исследовании были
две микроРНК, miR#21 и miR#135b, экспрессия
использованы две линии иПСК (FAMRCi001#A
которых была значительно повышена или пони#
и FAMRCi001#B) от пациента с АКМП, являв#
жена у пациентов с АКМП по сравнению с
шегося носителем двух мутаций в гене PKP2
контролем [12]. Известно, что miR#21, miR#135b
(c.354delT и p.Lys859Arg), а также две контроль#
и miR#320a принимают участие в сигнальных
ные линии от здорового донора (FAMRCi003#A
путях Wnt/β#катенин и Hippo и регулируют про#
и FAMRCi003#B). Все линии иПСК были заре#
цессы клеточной пролиферации, апоптоза, ади#
гистрированы в базе данных плюрипотентных
погенеза и фиброза [13-16], а также, предполо#
жительно, могут принимать участие в патогене#
Линии иПСК были ранее охарактеризованы сог#
зе АКМП. В другом исследовании, посвящен#
ласно стандартному протоколу [26, 27]. иПСК
ном изучению циркулирующих микроРНК в
культивировали на плашках, покрытых 1%#ным
плазме пациентов с диагнозом АКМП и паци#
раствором Geltrex («Thermo Fisher Scientific»,
ентов с идиопатической желудочковой тахикар#
США) в среде Essential 8 («Thermo Fisher Scien#
дией, было выявлено достоверное повышение
tific», США), содержавшей 50 МЕ/мл пеницил#
уровней miR#144, miR#145, miR#185 и miR#494 в
лина, 50 мкг/мл стрептомицина («Thermo Fisher
плазме пациентов с АКМП [17], что позволило
Scientific», США). Для пересадки иПСК исполь#
дифференциально диагностировать раннюю
зовали реагент ReleSR («Stemcell», США) в со#
фазу АКМП и идиопатическую желудочковую
ответствии с рекомендациями производителя.
тахикардию.
Дифференцировка иПСК в кардиомиоциты.
Другим типом секретируемых клеткой нук#
иПСК дифференцировали согласно ранее опуб#
леиновых кислот является митохондриальная
ликованному протоколу [28] с модификациями.
ДНК (мтДНК). Поскольку митохондрии эволю#
Клетки снимали при помощи реагента для дис#
ционно произошли от α#протеобактерий и со#
социации StemPro Accutase («Thermo Fisher
хранили некоторые бактериальные признаки [18,
Scientific», США), отмывали путем центрифуги#
19], внеклеточная мтДНК распознается систе#
рования при 300 g в течение 5 мин и засевали в
мой врожденного иммунитета как бактериаль#
плотности 200-1000 тыс. клеток на лунку в
ная [20]. Существенная доля исследований роли
12#луночный культуральный планшет, покры#
мтДНК в развитии и прогрессировании заболе#
тый 1%#ным раствором Geltrex («Thermo Fisher
ваний сердца посвящена внеклеточной мтДНК,
Scientific», США). При достижении клетками
циркулирующей в крови [21, 22]. Повышение
конфлуентности запускали дифференцировку
уровня циркулирующей мтДНК в свободной
путем смены ростовой среды на дифференци#
форме или в составе внеклеточных везикул раз#
ровочную, содержавшую RPMI1640 Glutamax,
ного размера (микровезикул, экзосом) описано
с добавлением B27 без инсулина, 50 МЕ/мл пени#
при кардиомиопатиях, хронической сердечной
циллина, 50 мкг/мл стрептомицина («Thermo
недостаточности и инфаркте миокарда [22-25].
Fisher Scientific», США), а также 6 мкМ ингиби#
Циркулирующая мтДНК может распознаваться
тора CHIR99021 («Selleckchem», США). Через
и захватываться как иммунокомпетентными
двое суток среду меняли на дифференцировоч#
клетками (нейтрофилами, макрофагами), так и
ную, содержавшую 5 мкМ ингибитора IWP2
кардиомиоцитами, что, в свою очередь, может
(«Tocris», США). Еще через двое суток и далее
приводить к развитию стерильного воспаления,
раз в два дня среду меняли на дифференциро#
наблюдаемого в патогенезе кардиомиопатий и
вочную. Начиная с 7#го дня дифференцировки
других патологий миокарда [22].
и далее раз в два дня среду меняли на среду для
Целью настоящего исследования являлось
роста кардиомиоцитов, содержавшую RPMI1640
проведение сравнительного анализа уровней
Glutamax, с добавлением B27, 50 МЕ/мл пени#
ряда микроРНК и мтДНК в кондиционирован#
циллина, 50 мкг/мл стрептомицина («Thermo
ной среде, собранной с кардиомиоцитов, диф#
Fisher Scientific», США). Для проведения мета#
ференцированных из контрольных индуциро#
болической селекции дифференцированные
ванных плюрипотентных стволовых клеток
кардиомиоциты (14#й день дифференцировки)
БИОХИМИЯ том 84 вып. 3 2019
394
ХУДЯКОВ и др.
культивировали в течение 3-5 дней в селектиру#
выделении РНК в реагент Trizol LS добавляли
ющей среде, содержавшей среду Игла в моди#
синтетическую микроРНК C. elegans (cel#miR#
фикации Дульбекко (DMEM) без глюкозы и пи#
39#3p) для контроля качества выделения и тРНК
рувата («Thermo Fisher Scientific», США), 4 мМ
E. coli в качестве носителя. Тотальную ДНК вы#
лактата натрия («Sigma Aldrich», США), 2 мМ
деляли при помощи коммерческого набора
глутамина, 50 МЕ/мл пенициллина, 50 мкг/мл
FlexiGene DNA kit («Qiagen», США) согласно
стрептомицина («Thermo Fisher Scientific», США).
рекомендациям производителя. При выделении
Образцы кондиционированной среды отбирали
ДНК из образцов кондиционированной среды к
на 30#й день дифференцировки. Для сбора об#
ним добавляли плазмиду pLVTHM в количестве
разцов использовали как минимум три незави#
5 нг для контроля качества выделения.
симые дифференцировки иПСК.
Реакция обратной транскрипции. Реакцию об#
Иммуноцитохимическое окрашивание клеток.
ратной транскрипции тотальной РНК проводи#
Для проведения иммуноцитохимического окра#
ли при помощи набора MMLV RT kit («Евроген»,
шивания кардиомиоциты пересаживали при по#
Россия) согласно рекомендациям производителя.
мощи реагента Tryple Select («Thermo Fisher
Реакцию обратной транскрипции микроРНК
Scientific», США) на покровные стекла, покры#
осуществляли индивидуально для каждой мик#
тые 1%#ным раствором Geltrex, фиксировали
роРНК с помощью набора TaqMan MicroRNA
4%#ным раствором параформальдегида на фос#
Reverse Transcription Kit («Thermo Fisher Scien#
фатно#буферном растворе (PBS), обрабатывали
tific», США) и наборов TaqMan Assay («Thermo
0,05%#ным раствором тритона X#100 на PBS.
Fisher Scientific», США), перечисленных в табл. 1.
Клетки инкубировали с первичными антитела#
ПЦР в режиме реального времени. Измерение
ми, специфичными к сердечной изоформе тро#
уровней РНК в образцах проводили методом
понина Т, затем - с вторичными антителами,
ПЦР в режиме реального времени. Для опреде#
конъюгированными с флуорохромом Alexa
ления уровня экспрессии генов специфичный
Fluor 488 («Life Technologies», США). Ядра кле#
фрагмент кДНК амплифицировали с помощью
ток окрашивали 4',6#диамидино#2#фенилиндо#
праймеров, подобранных с использованием ал#
лом (DAPI) («Invitrogen», США). Микрофото#
графии получали на микроскопе AxioObserver.D1
gov/tools/primer#blast/), а также смеси qPCRmix#
(«Carl Zeiss», Германия), обработку полученных
HSSYBR + LowROX («Евроген», Россия). Для
изображений производили в программе Zen 2012
амплификации микроРНК использовали TaqMan
(«Carl Zeiss», Германия). Для оценки эффектив#
Universal Master Mix II no UNG и соответствую#
ности дифференцировки проводили обсчет
щий TaqMan Assay («Thermo Fisher Scientific»,
микрофотографий и вычисляли процентное от#
США) в соответствии с рекомендациями произ#
ношение тропонин#Т#позитивных клеток к об#
водителя. Число копий мтДНК в образцах кон#
щему количеству ядер. Двухядерные кардиомио#
диционированной среды также определяли ме#
циты считали как две отдельные клетки.
тодом ПЦР в режиме реального времени. Амп#
Сбор образцов кондиционированной среды.
лификацию участка мтДНК проводили с по#
Среду для роста кардиомиоцитов (400 мкл),
мощью ранее опубликованных праймеров [29] и
кондиционированную в течение 48 ч, отбирали
смеси qPCRmix#HSSYBR + LowROX («Евроген»,
и центрифугировали при 3000 g в течение 10 мин
Россия). Для построения стандартной кривой в
при 4 °C. Надосадочную жидкость переносили в
качестве матрицы реакции использовали серию
новую пробирку и центрифугировали при 16 000 g
разведений ПЦР#фрагмента известной длины.
в течение 15 мин при 4 °C. Полученную надоса#
Амплификацию WRPE#участка плазмиды pLVTHM
дочную жидкость использовали для выделения
осуществляли аналогично мтДНК с помощью
РНК и ДНК (фракция супернатанта). Получен#
соответствующих праймеров. Последователь#
ный осадок растворяли в 1 мл PBS встряхивани#
ности использованных праймеров и номера на#
ем, затем снова осаждали центрифугированием
боров TaqMan приведены в табл. 1.
при 16 000 g в течение 15 мин при 4 °C. Получен#
Анализ и статистическая обработка данных.
ный осадок растворяли в 400 мкл PBS и также
Для количественной оценки относительной
использовали для выделения РНК и ДНК (фрак#
экспрессии генов использовали метод ΔΔCt, в
ция осадка).
качестве референсного гена была взята последо#
Выделение РНК и ДНК. Тотальную РНК из
вательность, кодирующая 18S РНК. Относи#
клеток выделяли с помощью реагента Extract
тельные количества микроРНК вычисляли по
RNA («Евроген», Россия) согласно рекоменда#
формуле 2Сq, где Сq - значение порогового цик#
циям производителя. Тотальную РНК из образцов
ла. Минимальное значение относительного ко#
среды выделяли с помощью реагента Trizol LS
личества среди экспериментальных групп при#
согласно рекомендациям производителя. При
нимали за единицу. Для измерения количества
БИОХИМИЯ том 84 вып. 3 2019
микроРНК - БИОМАРКЕРЫ АРИТМОГЕННОЙ КАРДИОМИОПАТИИ
395
копий фрагмента мтДНК строили стандартную
экспериментальных образцах. Статистический
кривую и выводили уравнение прямой. Коэф#
анализ проводили в программах GraphPad Prism
фициенты уравнения были использованы для
количественной оценки числа копий мтДНК в R#Studio версии 1.0.53 c R версии 3.0.1. Для
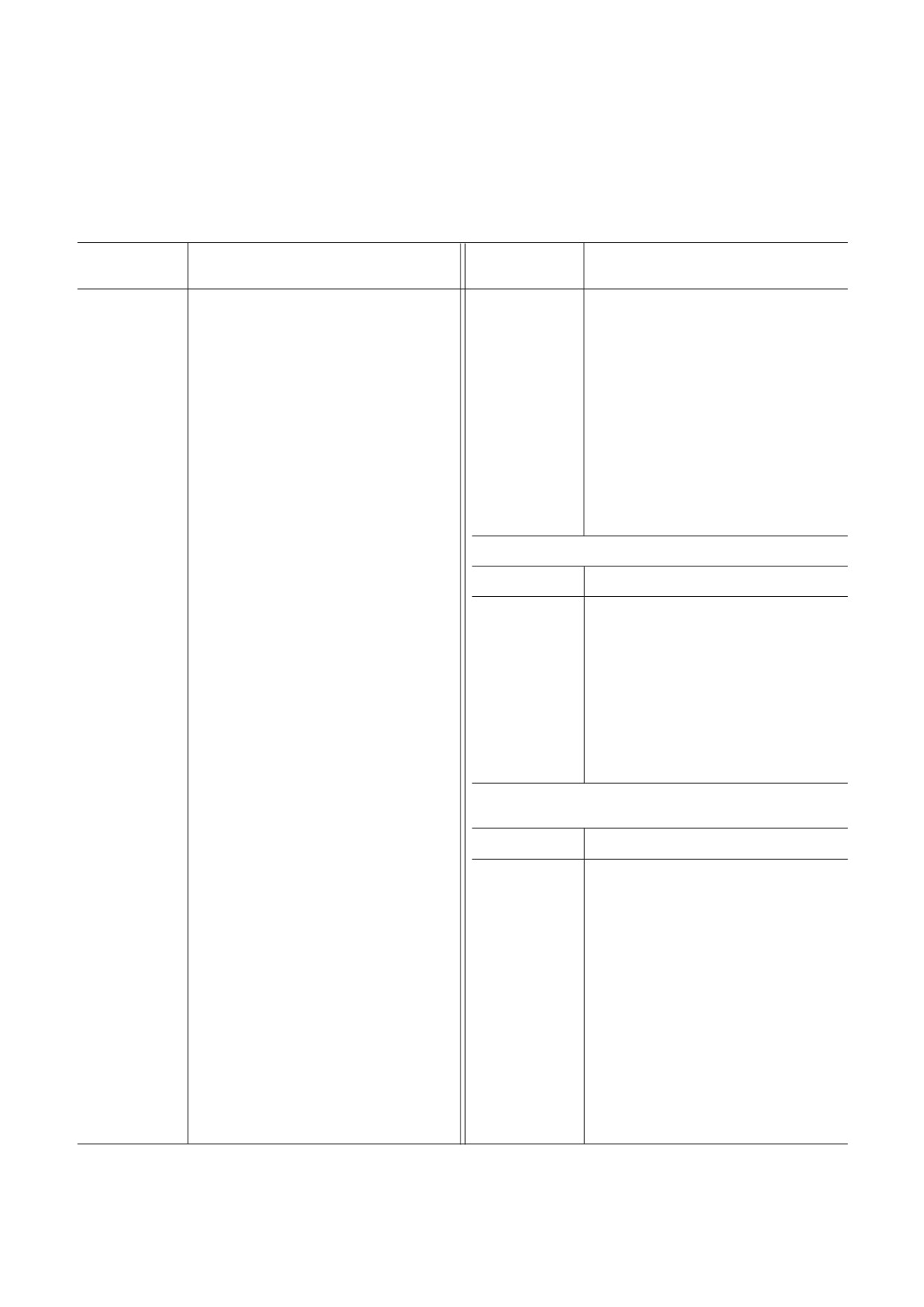
Таблица 1. Последовательности праймеров и наборы, использованные в исследовании
Мишень
Последовательности прямого и
Мишень
Последовательности прямого и
обратного праймеров (5'-3')
обратного праймеров (5'-3')
MMP10
GTGAAACAGTTTAGAAGAAAGGACA
FABP4
GCCAGGAATTTGACGAAGTC
GGCAGAATCAACAGCATCTCT
TGGTTGATTTTCCATCCCAT
MMP24
GATTGGAGGAGACACCCACTTTGA
PPARG
AGCCTTCCAACTCCCTCATGGCA
CATGCACAGCCACCAGGAAGA
TCCGGAAGAAACCCTTGCATCCT
GREM1
GGACCCGCCGCACTGACA
18S rDNA
GTAACCCGTTGAACCCCATT
CTTCAGCAGCCGGCAGCAG
CCATCCAATCGGTAGTAGCG
HEY1
TGGATCACCTGAAAATGCTG
WRPE
GGCACTGACAATTCCGTGGT
CGAAATCCCAAACTCCGATA
AGGGACGTAGCAGAAGGACG
HES1
AGCACAGAAAGTCATCAAAG
мтДНК
ACTACAACCCTTCGCTGACG
AGGTGCTTCACTGTCATTTC
(Mito_DS1.F,
GCGGTGATGTAGAGGGTGAT
Mito_DS1.R)
NOTCH1
GTCAACGCCGTAGATGACC
TTGTTAGCCCCGTTCTTCAG
Наборы TaqMan для ПЦР в режиме реального времени
NOTCH3
GGAGCCAATAAGGACATGCAGGAT
Мишень
Идентификационный номер
GGCAAAGTGGTCCAACAGCAGC
DLL1
CTACTACGGAGAGGGCTGCT
SMAD6
Hs00178579_m1
CCAGGGTTGCACACTTTCTC
STAT1
Hs01013996_m1
SNAI1
CTCTTTCCTCGTCAGGAAGC
GGCTGCTGGAAGGTAAACTC
TGFBR2
Hs00234253_m1
SNAI2
ATGAGGAATCTGGCTGCTGT
TIMP1
Hs00171558_m1
CAGGAGAAAATGCCTTTGGA
TIMP3
Hs00165949_m1
NF2
GGGATTTTTGGCCCAAGAGGAATT
TGCGTACCAAGCAGTAATTCTCT
MMP2
Hs01548727_m1
Наборы TaqMan для обратной транскрипции и ПЦР
ISL1
GCGGAGTGTAATCAGTATTTGGA
GCATTTGATCCCGTACAACCT
в режиме реального времени микроРНК
GATA4
CGACACCCCAATCTCGATATG
Мишень
Идентификационный номер
GTTGCACAGATAGTGACCCGT
NKX2.5
CCAAGGACCCTAGAGCCGAA
miR#39
cel#miR#39#3p ID 000200
ATAGGCGGGGTAGGCGTTAT
miR#1
hsa#miR#1#3p ID 002222
CCND1
AGACCTTCGTTGCCCTCTGT
miR#21
hsa#miR 21#5p ID 000397
AGTTGTTGGGGCTCCTCAG
miR#29b#2
hsa#miR#29b#2#3p ID 000413
ATF2
TCCAGGGGTGCTTTGTAAAC
GCTTCCAGGAATACCTTAGCTG
miR#30c
hsa#miR#30c#5p ID 000419
MEF2A
ACTACAGACCTCACAGTGCCA
miR#133a
hsa#miR#133a#3p ID 002246
GCCTAAGCTATTTGCACCAGT
miR#208a
hsa#miR#208a#3p ID 000511
MEF2C
CCAACTTCGAGATGCCAGTCT
miR#302b
hsa#miR#302b#3p ID 000531
GTCGATGTGTTACACCAGGAG
miR#378a
hsa#miR#378a#3p ID 001314
CEBPA
CCTCAGCCTTGTTTGTACTGTATG
TTTGGAAAGCTTGTCATAACTCCG
miR#494
hsa#miR#494#3p ID 002365
БИОХИМИЯ том 84 вып. 3 2019
396
ХУДЯКОВ и др.
сравнения экспериментальных групп применя#
пользовали линии иПСК клеток, ранее полу#
ли критерий Манна-Уитни с последующей кор#
ченные и охарактеризованные в нашей лабора#
рекцией множественных сравнений методом
тории [26, 27]. В ходе проведения кардиодиффе#
Бенджамини-Хочберга. Использовали уровень
ренцировки иПСК в течение 30 дней методом
альфа, равный 0,05. Данные представлены в ви#
модулирования сигнального пути Wnt/β#катенин и
де среднего ± стандартная ошибка среднего.
последующей метаболической селекции (рис. 1, а)
наблюдали появление сокращающихся клеток,
которые положительно окрашивались на сер#
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
дечную изоформу тропонина Т и демонстриро#
вали характерную неупорядоченную структуру
Характеристика кардиомиоцитов, дифферен@
саркомера (рис. 1, б). Для последующих экспе#
цированных из иПСК. Для получения пациент#
риментов выбирали лунки с высоким содержа#
специфичной культуры кардиомиоцитов ис#
нием кардиомиоцитов (88 ± 4)% (рис. 1, в). Ана#
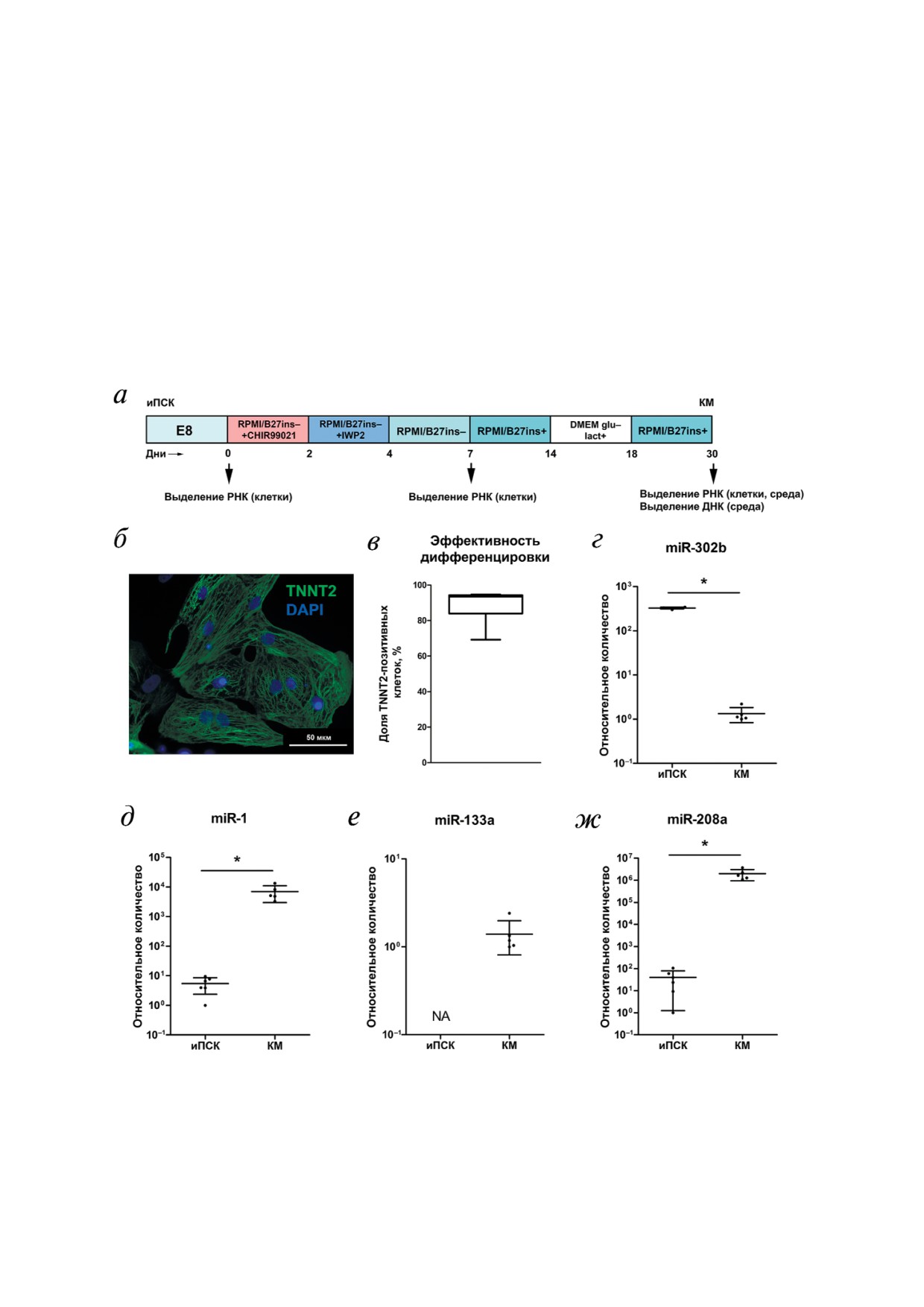
Рис. 1. Характеристика кардиомиоцитов, дифференцированных из индуцированных плюрипотентных стволовых клеток.
а - Схема протокола дифференцировки иПСК. Указаны временные точки забора экспериментальных образцов; б - им#
мунофлуоресцентная окраска дифференцированных кардиомиоцитов на сердечную изоформу тропонина Т (TNNT2), ядра
клеток окрашены DAPI; в - оценка эффективности дифференцировки иПСК; анализ экспрессии miR#302b (г), miR#1 (д),
miR#133a (е) и miR#208a (ж) соответственно. Обозначения: КМ - кардиомиоциты, NA - значение не определено. * p < 0,05
БИОХИМИЯ том 84 вып. 3 2019
микроРНК - БИОМАРКЕРЫ АРИТМОГЕННОЙ КАРДИОМИОПАТИИ
397
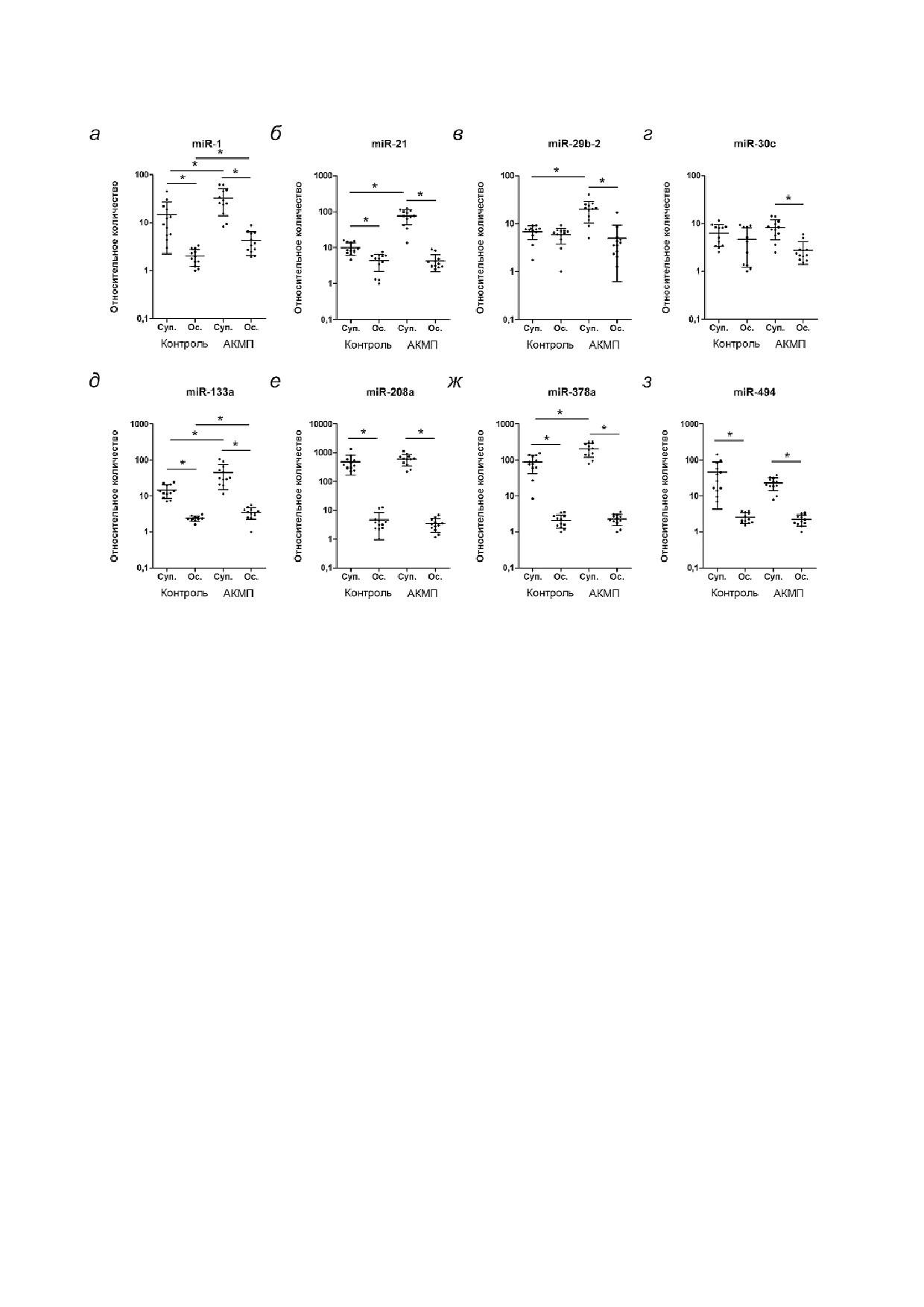
лиз уровней экспрессии микроРНК, специфич#
натанта и осадка не различались (рис. 2, в, г).
ных для определенного типа клеток, выявил
Уровни miR#21, miR#29b#2, miR#378a во фрак#
преобладание miR#302b, характерной для плю#
ции супернатанта были повышены в образцах
рипотентных клеток, в недифференцированных
среды от АКМП#кардиомиоцитов по сравне#
иПСК клетках (рис. 1, г) (326,3 ± 5,7 в иПСК
нию с соответствующей фракцией среды от
против 1,3 ± 0,2 в кардиомиоцитах). В то же вре#
контрольных кардиомиоцитов (рис. 2, б, г, з)
мя дифференцированные из иПСК кардиомио#
(76,5 ± 9,8 против 9,9 ± 1,2 - для miR#21, 19,9 ± 2,7
циты обладали высоким уровнем экспрессии
против 6,8 ± 0,6 - для miR#29b#2, 203,2 ± 24,4
кардиоспецифичных микроРНК (рис. 1, д-ж):
против 87,8 ± 13,2 - для miR#378a). Уровни
miR#1 (5,5 ± 1,3 в иПСК против 6960 ± 1778 в кар#
miR#1 и miR#133a были повышены в обеих
диомиоцитах), miR#133a (в иПСК не детектиро#
фракциях образцов среды от АКМП#кардиомио#
вана, в кардиомиоцитах присутствовала), miR#208a
цитов по сравнению с контрольными кардио#
(40,0 ± 15,8 в иПСК против 1,99e6 ± 4,72e5 в
миоцитами (рис. 2, а, д) (32,4 ± 5,3 против
кардиомиоцитах). Таким образом, было показа#
14,8 ± 3,6 - для miR#1 в супернатанте, 4,2 ± 0,6
но, что на 30#й день дифференцировки иПСК
против 2,0 ± 0,2 - для miR#1 в осадке, 44,6 ± 8,5
кардиомиоциты демонстрировали специфич#
против 14,5 ± 1,7 - для miR#133a в супернатан#
ные для кардиомиоцитов признаки: спонтанные
те, 3,5 ± 0,3 против 2,4 ± 0,1 - для miR#133a в
сокращения, формирование поперечно#исчер#
осадке). Таким образом, было показано, что не#
ченного саркомера, экспрессию кардиоспеци#
которые микроРНК присутствуют преимущест#
фичных микроРНК.
венно во фракции супернатанта. Также были вы#
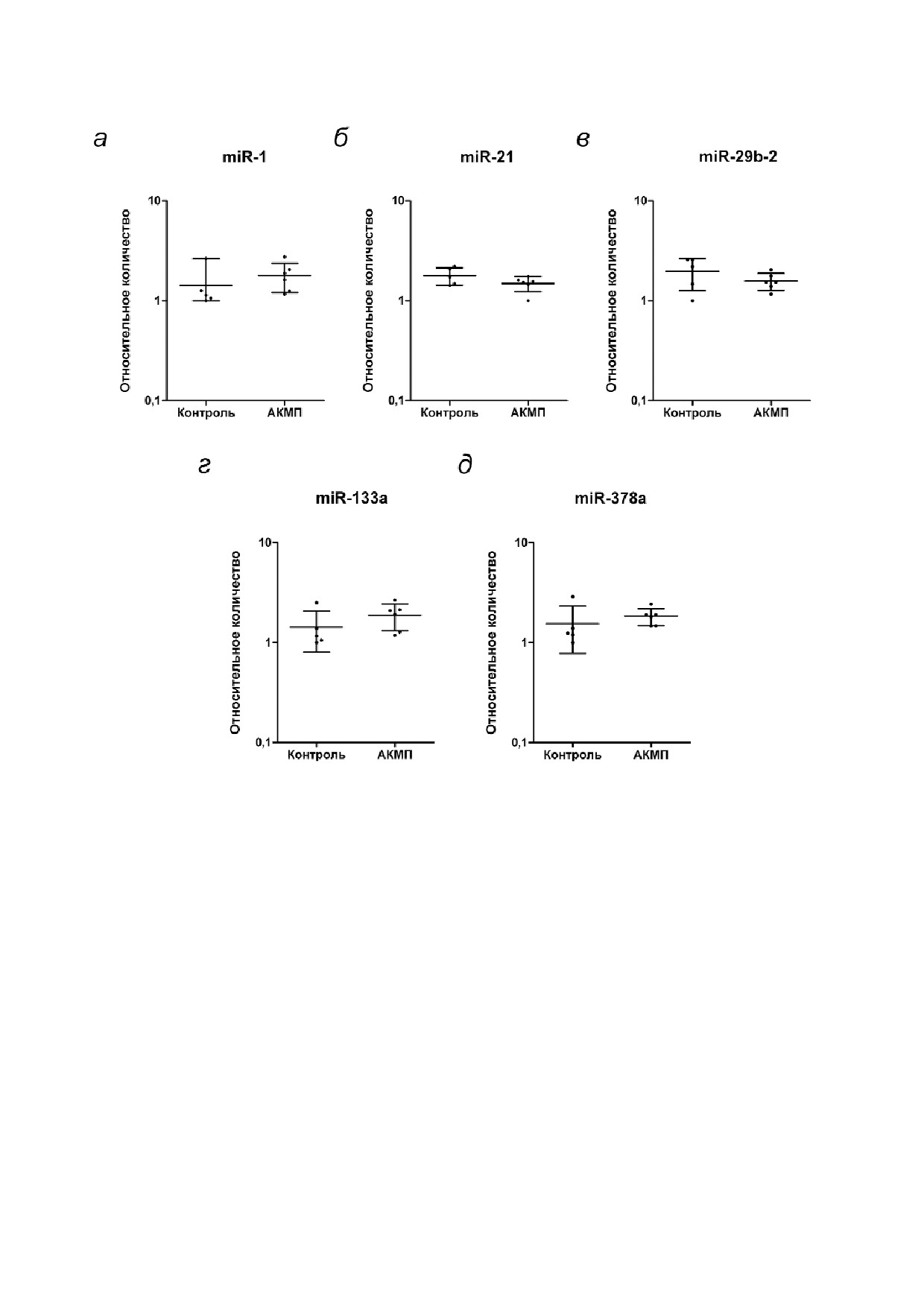
Анализ экспрессии генов@регуляторов сигналь@
явлены микроРНК, уровень которых был повы#
ных путей на 7@й день дифференцировки иПСК.
шен в образцах среды от АКМП#кардиомиоци#
Ранее нами было продемонстрировано сниже#
тов по сравнению с контрольными образцами.
ние активности сигнального пути Wnt/β#катенин
Анализ внутриклеточных уровней микроРНК в
при кардиодифференцировке линий АКМП#
пациент@специфичных кардиомиоцитах, диффе@
иПСК [26]. Для оценки вклада сниженной ак#
ренцированных из иПСК. Чтобы определить, яв#
тивности сигнального пути Wnt/β#катенин в
ляется ли повышенный уровень miR#1, miR#21,
процесс кардиодифференцировки иПСК была
miR#29b#2, miR#133a и miR#378a во фракциях
измерена экспрессия 26 генов, кодирующих
кондиционированной среды от АКМП#кардио#
белки#участники сигнальных путей ранней
миоцитов следствием повышенного содержа#
дифференцировки иПСК (7#й день). Экспрес#
ния этих микроРНК внутри клетки, был прове#
сия генов, регулирующих процессы фиброза
ден количественный анализ данных микроРНК
(SMAD, STAT1, TGFBR2, TIMP1, TIMP3, MMP2,
в дифференцированных из иПСК кардиомио#
MMP10, MMP24, GREM1) и адипогенной диф#
цитах. Было показано, что внутриклеточные
ференцировки (CEBPA, FABP4, PPARG), не раз#
уровни miR#1, miR#21, miR#29b#2, miR#133a и
личалась на 7#й день дифференцировки АКМП#
miR#378a в АКМП#кардиомиоцитах не отлича#
иПСК и контрольных иПСК (табл. 2). Экспрес#
ются от контрольных кардиомиоцитов (рис. 3,
сия двух генов#мишеней сигнального пути
а-д). Таким образом, было установлено отсут#
Notch, HEY1 и HES1, была повышена, что сви#
ствие различий экспрессии исследуемых мик#
детельствует о возможной активации этого пу#
роРНК в клетках.
ти. Таким образом, в ходе дифференцировки
Количественный анализ мтДНК в различных
АКМП#иПСК активации сигнальных путей,
фракциях кондиционированной среды. Для коли#
связанных с развитием фиброза и адипогенной
чественной оценки внеклеточной мтДНК во
дифференцировки, не наблюдалось.
фракциях кондиционированной среды методом
Анализ уровней микроРНК в различных фрак@
ПЦР в режиме реального времени было опреде#
циях кондиционированной среды. Для количест#
лено абсолютное количество копий амплифи#
венной оценки внеклеточной микроРНК мето#
цированного участка мтДНК (рис. 4). Различий
дом ПЦР в режиме реального времени были из#
в содержании мтДНК между фракциями среды
мерены уровни 8 микроРНК в двух фракциях
обнаружено не было. Однако уровень мтДНК во
кондиционированной среды от дифференциро#
фракции супернатанта от АКМП#кардиомио#
ванных кардиомиоцитов - фракции осадка, по#
цитов был достоверно понижен по сравнению
лученного центрифугированием при 16 000 g, и
с образцами контрольных кардиомиоцитов
фракции супернатанта. Уровни miR#1, miR#21,
(2,6e9 ± 5,6e8 копий против 5,8e9 ± 6,4e8 ко#
miR#133a, miR#208a, miR#378a, miR#494 были
пий). Таким образом, было показано, что коли#
достоверно выше во фракции супернатанта по
чество мтДНК во фракции супернатанта образ#
сравнению с фракцией осадка (рис. 2, а, б, д-з).
цов среды от АКМП#кардиомиоцитов пониже#
Уровни miR#29b#2 и miR#30c во фракциях супер#
но по сравнению с контролем.
БИОХИМИЯ том 84 вып. 3 2019
398
ХУДЯКОВ и др.
Таблица 2. Анализ экспрессии генов#регуляторов сигнальных путей на 7#й день кардиодифференцировки иПСК
Кратность
Ген
Транскрипт (RefSeqID)
различий
Значение p
экспрессии
относительно
контроля
SMAD6
NM_005585.4
1,2
1,00
STAT1
NM_007315.3, NM_139266.2
0,9
0,69
TGFBR2
NM_001024847.2, NM_003242.5
0,7
0,42
TIMP1
NM_003254.2
0,4
0,15
TIMP3
NM_000362.4
2,2
0,55
MMP2
NM_001127891.2, NM_001302508.1, NM_001302509.1,
2,3
0,42
NM_001302510.1, NM_004530.5
MMP10
NM_002425.2
1,1
1,00
MMP24
NM_006690.3
0,9
0,66
GREM1
NM_001191323.1, NM_013372.6
1,2
0,61
HEY1
NM_012258.3, NM_001040708.1
1,3
0,02*
HES1
NM_005524.3
1,8
0,03*
NOTCH1
NM_017617.4
1,4
0,43
NOTCH3
NM_000435.2
1,0
0,69
DLL1
NM_005618.3
1,5
0,22
SNAI1(SNAIL)
NM_005985.3
0,9
0,55
SNAI2(SLUG)
NM_003068.4
1,0
0,84
NF2
NM_000268.3, NM_016418.5, NM_181828.2, NM_181829.2,
1,7
0,06
NM_181830.2, NM_181832.2, NM_181825.2, NM_181831.2
ISL1
NM_002202.2
0,5
0,06
GATA4
NM_002052.4
0,8
0,42
NKX2.5
NM_004387.3, NM_001166175.1, NM_001166176.1
2,8
0,69
CCND1
NM_053056.2
0,7
0,06
ATF2
NM_001880.3, NM_001256090.1, NM_001256091.1, NM_001256092.1,
1,3
0,69
NM_001256093.1, NM_001256094.1
MEF2A
NM_005587.3, NM_001130926.2, NM_001130927.2, NM_001130928.2,
1,2
0,55
NM_001171894.2, NM_001319206.1, NM_001352614.1, NM_001352615.1,
NM_001352616.1, NM_001352617.1, NM_001352618.1
MEF2C
NM_002397.4, NM_001131005.2, NM_001193347.1, NM_001193348.1,
0,6
0,10
NM_001193349.1, NM_001193350.1, NM_001308002.1
CEBPA
NM_004364.4
0,8
0,22
FABP4
NM_001442.2
5,8
0,69
PPARG
NM_138712.3, NM_015869.4, NM_138711.3, NM_005037.5,
8,2
0,25
NM_001330615.1, NM_001354666.1, NM_001354667.1,
NM_001354668.1,NM_001354669.1, M_001354670.1
* p < 0,05.
БИОХИМИЯ том 84 вып. 3 2019
микроРНК - БИОМАРКЕРЫ АРИТМОГЕННОЙ КАРДИОМИОПАТИИ
399
Рис. 2. Анализ уровней микроРНК в различных фракциях кондиционированной среды от пациент#специфичных кардио#
миоцитов. Анализ экспрессии miR#1 (а), miR#21 (б), miR#29b#2 (в), miR#30c (г), miR#133a (д), miR#208a (е), miR#378a (ж)
и miR#494 (з). Обозначения: Суп. - фракция супернатанта, Ос. - фракция осадка. * p < 0,05
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
экспресии кардиоспецифичных miR#1, miR#133a,
miR#208a и обладали низким уровнем экспрес#
В последнее время большое внимание уделя#
сии miR#302a, специфичной для плюрипотент#
ется использованию циркулирующих мик#
ных клеток. Это согласуется с ранее опублико#
роРНК в качестве биомаркеров заболеваний
ванными данными по экспрессии генов в про#
[30]. Анализ микроРНК, содержащихся в плаз#
цессе кардиодифференцировки плюрипотент#
ме крови, доказал существование определенных
ных стволовых клеток человека [34].
циркулирующих микроРНК, качественные и
Ранее на различных клеточных моделях
количественные изменения которых могут сви#
АКМП было показано, что в клетках, несущих
детельствовать о развитии патологических про#
ассоциированные с АКМП мутации, происхо#
цессов [30-32].
дит активация сигнальных путей, регулирующих
В настоящем исследовании в качестве кле#
процессы фиброза и адипогенной дифференци#
точной модели была использована культура па#
ровки [35-37]. В результате анализа экспрессии
циент#специфичных кардиомиоцитов, диффе#
генов#регуляторов сигнальных путей в процессе
ренцированных из иПСК. Несмотря на то, что
кардиодифференцироввки АКМП#иПСК нами
полученные таким образом кардиомиоциты
не было обнаружено различий в экспрессии
имеют фенотип эмбриональных и отличаются
профибротических и проадипогенных генов
по многим параметрам от зрелых кардиомиоци#
между АКМП#кардиомиоцитами и контроль#
тов человека, они обладают пациент#специфич#
ными кардиомиоцитами на раннем этапе диф#
ным генотипом и схожим со зрелыми кардио#
ференцировки. На основании полученных дан#
миоцитами паттерном экспрессии генов, что де#
ных можно сделать вывод о том, что соответ#
лает их ценной моделью для исследований пато#
ствующие сигнальные пути в используемой мо#
логий сердечно#сосудистой системы [33].
дели не были активированы. Полученные ре#
Полученные пациент#специфичные кардио#
зультаты согласуются с данными о важной роли
миоциты демонстрировали высокий уровень внешней стимуляции в регуляции сигнальных
БИОХИМИЯ том 84 вып. 3 2019
400
ХУДЯКОВ и др.
Рис. 3. Анализ экспрессии микроРНК в пациент#специфичных кардиомиоцитах. Анализ экспрессии miR#1 (а), miR#21 (б),
miR#29b#2 (в), miR#133a (г) и miR#378a (д)
путей [37], а также участии других типов клеток
шение уровней кардиоспецифичных miR#1 и
миокарда, например, мезенхимных клеток, в
miR#133a в кондиционированной среде от
развитии фенотипа АКМП [38].
АКМП#кардиомиоцитов. Ранее было показано,
При анализе уровней микроРНК во фракци#
что появление этих микроРНК в плазме являет#
ях кондиционированной среды от кардиомио#
ся индикатором повреждения миокарда [39].
цитов было обнаружено, что содержание мик#
Также было установлено повышение внеклеточ#
роРНК различается между фракциями. Уровни
ных уровней miR#21 и miR#29b#2, вовлеченных
большинства исследованных микроРНК были в
в регуляцию процессов фиброза. Известно, что
разы выше во фракции супернатанта. Эти дан#
miR#21 способствует развитию фиброза [40, 41],
ные согласуются с ранее опубликованными ис#
в то время как miR#29b#2 наряду с miR#133a, на#
следованиями, в которых было показано, что
оборот, осуществляют негативную регуляцию
внеклеточные микроРНК часто находятся в сос#
про#фибротических генов [42, 43]. В образцах
таве белковых комплексов и микровезикул ма#
кондиционированной среды от АКМП#кардио#
лого размера, не осаждаемых при использован#
миоцитов был повышен уровень miR#378a. Из#
ном нами режиме центрифугирования [6-8].
вестно, что miR#378a экспрессируется в адипо#
В результате количественной оценки вне#
цитах, играет важную роль в метаболизме жир#
клеточных микроРНК было обнаружено повы# ных кислот и может являться индикатором по#
БИОХИМИЯ том 84 вып. 3 2019
микроРНК - БИОМАРКЕРЫ АРИТМОГЕННОЙ КАРДИОМИОПАТИИ
401
мтДНК
цитов. Было показано снижение уровня мтДНК
в образцах среды от АКМП#кардиомиоцитов.
1011
Полученные данные позволяют предположить, что
развитие воспаления, наблюдаемое в патогенезе
*
АКМП, не связано с секретируемой мтДНК.
Полученные результаты носят характер
предварительного скрининга in vitro, в дальней#
10
10
шем планируется их проверка и подтверждение
на биологическом материале, полученном от
пациентов с АКМП. Перспективным подходом
является использование перикардиальной жид#
кости, омывающей миокард [45]. Использова#
109
ние перикардиальной жидкости позволит детек#
тировать внеклеточные микроРНК и мтДНК,
секретируемые непосредственно миокардом,
что повысит специфичность их количественно#
го измерения.
108
Суп.
Ос.
Суп.
Ос.
Финансирование
Контроль
АКМП
Работа выполнена при финансовой поддержке
Рис. 4. Оценка уровня мтДНК в различных фракциях кон#
РФФИ (№ 18#315#00177\18 мол_а).
диционированной среды от пациент#специфичных кардио#
миоцитов. Представлено абсолютное количество копий
Конфликт интересов
фрагмента мтДНК. Обозначения: Суп. - фракция суперна#
танта, Ос. - фракция осадка. * p < 0,05
Авторы заявляют об отсутствии конфликта
явления жировых клеток или изменения мета#
интересов.
болизма мышечных клеток, в т.ч. кардиомиоци#
тов [44].
Соблюдение этических норм
С целью определения, являются ли обнару#
женные изменения уровней микроРНК след#
Все процедуры, выполненные в исследова#
ствием усиления их секреции клеткой или ре#
нии с участием людей, соответствуют этическим
зультатом повышения количества этих мик#
стандартам институционального и/или нацио#
роРНК в клетках, была проведена оценка внут#
нального комитета по исследовательской этике
риклеточного содержания этих микроРНК.
и Хельсинкской декларации 1964 года и ее пос#
Уровни внутриклеточных микроРНК между
ледующим изменениям или сопоставимым нор#
АКМП#кардиомиоцитами и контролем не раз#
мам этики.
личались. Таким образом, можно предполо#
От каждого из включенных в исследование
жить, что причиной наблюдаемых изменений в
участников было получено информированное
уровнях микроРНК в кондиционированной
добровольное согласие.
среде являются различия в регуляции секреции
этих микроРНК.
Благодарности
Для проверки гипотезы о роли внеклеточной
мтДНК в индукции воспаления в миокарде бы#
Авторы выражают благодарность Антону
ла проведена количественная оценка содержа#
Федорову и Кириллу Кондратову за ценные ре#
ния внеклеточной мтДНК в кондиционирован#
комендации по планированию и постановке
ной среде от дифференцированных кардиомио#
экспериментов с микроРНК.
СПИСОК ЛИТЕРАТУРЫ
1.
Thiene, G., Nava, A., Corrado, D., Rossi, L., and
len, J.P., and van der Zwaag, P.A. (2015) The ARVD/C
Pennelli, N. (1988) Right ventricular cardiomyopathy and
genetic variants database: 2014 update, Hum. Mutat., 36,
sudden death in young people, N. Engl. J. Med., 318,
403-410, doi: 10.1002/humu.22765.
129-133, doi: 10.1056/NEJM198801213180301.
3.
Corrado, D., Basso, C., and Thiene, G. (2009) Arrhythmo#
2.
Lazzarini, E., Jongbloed, J.D.H., Pilichou, K., Thiene, G.,
genic right ventricular cardiomyopathy: an update, Heart,
Basso, C., Bikker, H., Charbon, B., Swertz, M., van Tinte#
95, 766-773, doi: 10.1136/hrt.2008.149823.
8 БИОХИМИЯ том 84 вып. 3 2019
402
ХУДЯКОВ и др.
4.
Bartel, D.P. (2004) MicroRNAs: genomics, biogenesis, me#
Liao, J.#N., Lin, C.#Y., Chang, Y.#T., Te, A.L.D., Tsai, Y.#N.,
chanism, and function, Cell, 116, 281-297, doi: 10.1016/
and Chen, S.#A. (2018) Circulating microRNAs in arrhyth#
S0092#8674(04)00045#5.
mogenic right ventricular cardiomyopathy with ventricular
5.
He, L., and Hannon, G.J. (2004) MicroRNAs: small
arrhythmia, Europace, 20, f37-f45, doi: 10.1093/euro#
RNAs with a big role in gene regulation, Nat. Rev. Genet.,
pace/ eux289.
5, 522-531, doi: 10.1038/nrg1379.
18.
Sagan, L. (1967) On the origin of mitosing cells, J. Theor.
6.
Sohel, M.H. (2016) Extracellular/circulating microRNAs:
Biol., 14, 255-274, doi: 10.1016/0022#5193(67)90079#3.
release mechanisms, functions and challenges, Achiev. Life
19.
Gray, M.W., Burger, G., and Lang, B.F. (2001) The origin
Sci., 10, 175-186, doi: 10.1016/j.als.2016.11.007.
and early evolution of mitochondria, Genome Biol., 2.
7.
Arroyo, J.D., Chevillet, J.R., Kroh, E.M., Ruf, I.K.,
doi: 10.1186/gb#2001#2#6#reviews1018.
Pritchard, C.C., Gibson, D.F., Mitchell, P.S., Bennett, C.F.,
20.
Zhang, Q., Raoof, M., Chen, Y., Sumi, Y., Sursal, T.,
Pogosova#Agadjanyan, E.L., Stirewalt, D.L., Tait, J.F., and
Junger, W., Brohi, K., Itagaki, K., and Hauser, C.J. (2010)
Tewari, M. (2011) Argonaute 2 complexes carry a popula#
Circulating mitochondrial DAMPs cause inflammatory
tion of circulating microRNAs independent of vesicles in
responses to injury, Nature, 464, 104-107, doi: 10.1038/
human plasma, Proc. Natl. Acad. Sci. USA,
108,
nature08780.
5003-5008, doi: 10.1073/pnas.1019055108.
21.
Chiu, R.W., Chan, L.Y., Lam, N.Y., Tsui, N.B., Ng, E.K.,
8.
Turchinovich, A., Weiz, L., Langheinz, A., and Burwinkel, B.
Rainer, T.H., and Lo, Y.M. (2003) Quantitative analysis of
(2011) Characterization of extracellular circulating mic#
circulating mitochondrial DNA in plasma, Clin. Chem., 49,
roRNA, Nucleic Acids Res., 39, 7223-7233, doi: 10.1093/
719-726, doi: 10.1373/49.5.719.
nar/gkr254.
22.
Bliksoen, M., Mariero, L.H., Ohm, I.K., Haugen, F.,
9.
Vickers, K.C., Palmisano, B.T., Shoucri, B.M.,
Yndestad, A., Solheim, S., Seljeflot, I., Ranheim, T.,
Shamburek, R.D., and Remaley, A.T. (2011) MicroRNAs
Andersen, G.O., Aukrust, P., Valen, G., and Vinge, L.E.
are transported in plasma and delivered to recipient cells by
(2012) Increased circulating mitochondrial DNA after
high#density lipoproteins, Nat. Cell Biol., 13, 423-433,
myocardial infarction, Int. J. Cardiol., 158, 132-134,
doi: 10.1038/ncb2210.
doi: 10.1016/j.ijcard.2012.04.047.
10.
Wagner, J., Riwanto, M., Besler, C., Knau, A.,
23.
Sudakov, N.P., Apartsin, K.A., Lepekhova, S.A., Nikiforov, S.B.,
Fichtlscherer, S., Roxe, T., Zeiher, A.M., Landmesser, U.,
Katyshev, A.I., Lifshits, G.I., Vybivantseva, A.V, and
and Dimmeler, S. (2013) Characterization of levels and
Konstantinov, Y.M. (2017) The level of free circulating
cellular transfer of circulating lipoprotein#bound
mitochondrial DNA in blood as predictor of death in case
microRNAs, Arterioscler. Thromb. Vasc. Biol.,
33,
of acute coronary syndrome, Eur. J. Med. Res., 22, 1,
1392-1400, doi: 10.1161/ATVBAHA.112.300741.
doi: 10.1186/s40001#016#0241#x.
11.
Sommariva, E., D’Alessandra, Y., Farina, F. M., Casella, M.,
24.
Oka, T., Hikoso, S., Yamaguchi, O., Taneike, M., Takeda, T.,
Cattaneo, F., Catto, V., Chiesa, M., Stadiotti, I., Bram#
Tamai, T., Oyabu, J., Murakawa, T., Nakayama, H.,
billa, S., Dello Russo, A., Carbucicchio, C., Vettor, G.,
Nishida, K., Akira, S., Yamamoto, A., Komuro, I., and
Riggio, D., Sandri, M.T., Barbuti, A., Vernillo, G.,
Otsu, K. (2012) Mitochondrial DNA that escapes from
Muratori, M., Dal Ferro, M., Sinagra, G., Moimas, S.,
autophagy causes inflammation and heart failure, Nature,
Giacca, M., Colombo, G.I., Pompilio, G., and Tondo, C.
485, 251-255, doi: 10.1038/nature10992.
(2017) MiR#320a as a potential novel circulating biomarker
25.
Ye, W., Tang, X., Yang, Z., Liu, C., Zhang, X., Jin, J., and
of arrhythmogenic cardiomyopathy, Sci. Rep., 7, 4802,
Lyu, J. (2017) Plasma#derived exosomes contribute to
doi: 10.1038/s41598#017#05001#z.
inflammation via the TLR9#NF#kappaB pathway in
12.
Zhang, H., Liu, S., Dong, T., Yang, J., Xie, Y., Wu, Y.,
chronic heart failure patients, Mol. Immunol.,
87,
Kang, K., Hu, S., Gou, D., and Wei, Y. (2016) Profiling of
114-121, doi: 10.1016/j.molimm.2017.03.011.
differentially expressed microRNAs in arrhythmogenic right
26.
Худяков А.А., Костина Д.А., Костарева А.А., Томилин А.Н.,
ventricular cardiomyopathy, Sci. Rep., 6, 28101, doi: 10.1038/
Малашичева А.Б. (2015). Влияние мутаций в гене пла#
srep28101.
кофиллина#2 на активность канонического сигналь#
13.
Sun, J.#Y., Huang, Y., Li, J.#P., Zhang, X., Wang, L.,
ного пути Wnt, Цитология, 57, 868-875.
Meng, Y.#L., Yan, B., Bian, Y.#Q., Zhao, J., Wang, W.#Z.,
27.
Khudiakov, A., Kostina, D., Zlotina, A., Yany, N.,
Yang, A.#G., and Zhang, R. (2012) MicroRNA#320a sup#
Sergushichev, A., Pervunina, T., Tomilin, A., Kostareva, A.,
presses human colon cancer cell proliferation by directly
and Malashicheva, A. (2017) Generation of iPSC line from
targeting beta#catenin, Biochem. Biophys. Res. Commun.,
patient with arrhythmogenic right ventricular cardio#
420, 787-792, doi: 10.1016/j.bbrc.2012.03.075.
myopathy carrying mutations in PKP2 gene, Stem Cell Res.,
14.
Huang, K., Zhang, J.#X., Han, L., You, Y.#P., Jiang, T.,
24, 85-88, doi: 10.1016/j.scr.2017.08.014.
Pu, P.#Y., and Kang, C.#S. (2010) MicroRNA roles in
28.
Burridge, P.W., Matsa, E., Shukla, P., Lin, Z.C., Churko, J.M.,
beta#catenin pathway, Mol. Cancer, 9, 252, doi: 10.1186/
Ebert, A.D., Lan, F., Diecke, S., Huber, B., Mordwinkin, N.M.,
1476#4598#9#252.
Plews, J.R., Abilez, O.J., Cui, B., Gold, J.D., and Wu, J.C.
15.
Hashimi, S.T., Fulcher, J.A., Chang, M.H., Gov, L., Wang, S.,
(2014) Chemically defined generation of human cardiomyocytes,
and Lee, B. (2009) MicroRNA profiling identifies miR#34a
Nat. Methods, 11, 855-860, doi: 10.1038/nmeth.2999.
and miR#21 and their target genes JAG1 and WNT1 in the
29.
Rothfuss, O., Gasser, T., and Patenge, N. (2010) Analysis
coordinate regulation of dendritic cell differentiation,
of differential DNA damage in the mitochondrial genome
Blood,
114,
404-414, doi:
10.1182/blood#2008#09#
employing a semi#long run real#time PCR approach,
179150.
Nucleic Acids Res., 38, e24, doi: 10.1093/nar/gkp1082.
16.
Lin, C.#W., Chang, Y.#L., Chang, Y.#C., Lin, J.#C., Chen, C.#C.,
30.
Chen, X., Ba, Y., Ma, L., Cai, X., Yin, Y., Wang, K., Guo, J.,
Pan, S.#H., Wu, C.#T., Chen, H.#Y., Yang, S.#C., Hong, T.#M.,
Zhang, Y., Chen, J., Guo, X., Li, Q., Li, X., Wang, W.,
and Yang, P.#C. (2013) MicroRNA#135b promotes lung
Zhang, Y., Wang, J., Jiang, X., Xiang, Y., Xu, C., Zheng, P.,
cancer metastasis by regulating multiple targets in the Hippo
Zhang, J., Li, R., Zhang, H., Shang, X., Gong, T., Ning, G.,
pathway and LZTS1, Nat. Commun., 4, 1877, doi: 10.1038/
Wang, J., Zen, K., Zhang, J., and Zhang, C.#Y. (2008)
ncomms2876.
Characterization of microRNAs in serum: a novel class of
17.
Yamada, S., Hsiao, Y.#W., Chang, S.#L., Lin, Y.#J., Lo, L.#W.,
biomarkers for diagnosis of cancer and other diseases, Cell
Chung, F.#P., Chiang, S.#J., Hu, Y.#F., Tuan, T.#C., Chao, T.#F.,
Res., 18, 997-1006. doi: 10.1038/cr.2008.282.
БИОХИМИЯ том 84 вып. 3 2019
микроРНК - БИОМАРКЕРЫ АРИТМОГЕННОЙ КАРДИОМИОПАТИИ
403
31.
Gupta, S.K., Bang, C., and Thum, T. (2010) Circulating
39.
Kuwabara, Y., Ono, K., Horie, T., Nishi, H., Nagao, K.,
microRNAs as biomarkers and potential paracrine media#
Kinoshita, M., Watanabe, S., Baba, O., Kojima, Y.,
tors of cardiovascular disease, Circ. Cardiovasc. Genet., 3,
Shizuta, S., Imai, M., Tamura, T., Kita, T., and Kimura, T.
484-488, doi: 10.1161/CIRCGENETICS.110.958363.
(2011) Increased microRNA#1 and microRNA#133a levels
32.
Wang, K., Zhang, S., Marzolf, B., Troisch, P., Brightman, A.,
in serum of patients with cardiovascular disease indicate
Hu, Z., Hood, L.E., and Galas, D.J. (2009) Circulating
myocardial damage, Circ. Cardiovasc. Genet., 4, 446-454,
microRNAs, potential biomarkers for drug#induced liver
doi: 10.1161/CIRCGENETICS.110.958975.
injury, Proc. Natl. Acad. Sci. USA, 106, 4402-4407,
40.
Thum, T., Gross, C., Fiedler, J., Fischer, T., Kissler, S.,
doi: 10.1073/pnas.0813371106.
Bussen, M., Galuppo, P., Just, S., Rottbauer, W., Frantz, S.,
33.
Casini, S., Verkerk, A.O., and Remme, C.A.
(2017)
Castoldi, M., Soutschek, J., Koteliansky, V., Rosenwald, A.,
Human iPSC#derived cardiomyocytes for investigation of
Basson, M.A., Licht, J.D., Pena, J.T.R., Rouhanifard, S.H.,
disease mechanisms and therapeutic strategies in inherited
Muckenthaler, M.U., Tuschl, T., Martin, G.R., Bauer#
arrhythmia syndromes: strengths and limitations,
sachs, J., and Engelhardt, S. (2008) MicroRNA#21 con#
Cardiovasc. Drugs Ther., 31, 325-344, doi: 10.1007/
tributes to myocardial disease by stimulating MAP kinase
s10557#017#6735#0.
signalling in fibroblasts, Nature, 456, 980-984, doi: 10.1038/
34.
Fu, J.#D., Rushing, S.N., Lieu, D.K., Chan, C.W., Kong, C.#W.,
nature07511.
Geng, L., Wilson, K.D., Chiamvimonvat, N., Boheler, K.R.,
41.
Roy, S., Khanna, S., Hussain, S.#R.A., Biswas, S., Azad, A.,
Wu, J.C., Keller, G., Hajjar, R.J., and Li, R.A. (2011)
Rink, C., Gnyawali, S., Shilo, S., Nuovo, G.J., and Sen, C.K.
Distinct roles of microRNA#1 and #499 in ventricular
(2009) MicroRNA expression in response to murine
specification and functional maturation of human embry#
myocardial infarction: miR#21 regulates fibroblast metal#
onic stem cell#derived cardiomyocytes, PLoS One, 6,
loprotease#2 via phosphatase and tensin homologue,
e27417, doi: 10.1371/journal.pone.0027417.
Cardiovasc. Res., 82, 21-29, doi: 10.1093/cvr/cvp015.
35.
Dubash, A.D., Kam, C.Y., Aguado, B.A., Patel, D.M.,
42.
Van Rooij, E., Sutherland, L.B., Thatcher, J.E., DiMaio, J.M.,
Delmar, M., Shea, L.D., and Green, K.J.
(2016)
Naseem, R.H., Marshall, W.S., Hill, J.A., and Olson, E.N.
Plakophilin#2 loss promotes TGF#β1/p38 MAPK#depen#
(2008) Dysregulation of microRNAs after myocardial
dent fibrotic gene expression in cardiomyocytes, J. Cell
infarction reveals a role of miR#29 in cardiac fibrosis, Proc.
Biol., 212, 425-438, doi: 10.1083/jcb.201507018.
Natl. Acad. Sci. USA, 105, 13027-13032, doi: 10.1073/
36.
Chen, S.N., Gurha, P., Lombardi, R., Ruggiero, A.,
pnas.0608791103.
Willerson, J.T., and Marian, A.J. (2014) The Hippo path#
43.
Matkovich, S.J., Wang, W., Tu, Y., Eschenbacher, W.H.,
way is activated and is a causal mechanism for adipogene#
Dorn, L.E., Condorelli, G., Diwan, A., Nerbonne, J.M.,
sis in arrhythmogenic cardiomyopathy, Circ. Res., 114,
and Dorn, G.W. (2010) MicroRNA#133a protects against
454-468, doi: 10.1161/CIRCRESAHA.114.302810.
myocardial fibrosis and modulates electrical repolarization
37.
Kim, C., Wong, J., Wen, J., Wang, S., Wang, C., Spiering, S.,
without affecting hypertrophy in pressure#overloaded adult
Kan, N.G., Forcales, S., Puri, P.L., Leone, T.C., Marine, J.E.,
hearts, Circ. Res., 106, 166-175, doi: 10.1161/CIRCRE#
Calkins, H., Kelly, D.P., Judge, D.P., and Chen, H.#S.V.
SAHA.109.202176.
(2013) Studying arrhythmogenic right ventricular dyspla#
44.
Gerin, I., Bommer, G.T., McCoin, C.S., Sousa, K.M.,
sia with patient#specific iPSCs, Nature, 494, 105-110,
Krishnan, V., and MacDougald, O.A. (2010) Roles for
doi: 10.1038/nature11799.
miRNA#378/378* in adipocyte gene expression and lipo#
38.
Sommariva, E., Brambilla, S., Carbucicchio, C., Gambini, E.,
genesis, Am. J. Physiol. Endocrinol. Metab.,
299,
Meraviglia, V., Dello Russo, A., Farina, F.M., Casella, M.,
E198-206, doi: 10.1152/ajpendo.00179.2010.
Catto, V., Pontone, G., Chiesa, M., Stadiotti, I., Cogliati, E.,
45.
Beltrami, C., Besnier, M., Shantikumar, S., Shearn, A.I.U.,
Paolin, A., Ouali Alami, N., Preziuso, C., D’Amati, G.,
Rajakaruna, C., Laftah, A., Sessa, F., Spinetti, G.,
Colombo, G.I., Rossini, A., Capogrossi, M.C., Tondo, C.,
Petretto, E., Angelini, G.D., and Emanueli, C. (2017)
and Pompilio, G. (2016) Cardiac mesenchymal stromal
Human pericardial fluid contains exosomes enriched with
cells are a source of adipocytes in arrhythmogenic car#
cardiovascular#expressed microRNAs and promotes thera#
diomyopathy, Eur. Heart J., 37, 1835-1846, doi: 10.1093/
peutic angiogenesis, Mol. Ther., 25, 679-693, doi: 10.1016/
eurheartj/ehv579.
j.ymthe.2016.12.022.
EXTRACELLULAR microRNA AND MITOCHONDRIAL DNA AS POTENTIAL
BIOMARKERS OF ARRHYTHMOGENIC CARDIOMYOPATHY
A. A. Khudiakov1*, N. A. Smolina1, K. I. Perepelina1,2, A. B. Malashicheva1,2, and A. A. Kostareva1
1 Almazov National Medical Research Centre, 197341 St. Petersburg, Russia; E$mail: khudyakov_aa@almazovcentre.ru
2 St. Petersburg State University, 199034 St. Petersburg, Russia
Received October 16, 2018
Revised December 3, 2018
Accepted December 3, 2018
Nowadays, differential diagnosis of arrhythmogenic cardiomyopathy (ACM) during the latent phase of the disease is
challenging. Thus, a search for early biomarkers of arrhythmogenic cardiomyopathy is of particular interest.
Extracellular nucleic acids serve as reliable biomarkers of various diseases, since they are highly specific and stable,
and they could be easily detected. In the present study, extracellular levels of miRNAs and mitochondrial DNA in
conditioned medium from cardiomyocytes were evaluated. The ACM patient#specific iPSC#derived cardiomyocytes
and matched healthy#control iPSC#derived cardiomyocytes were used. Differentially expressed microRNAs were
revealed, suggesting their use as potential biomarkers of arrhythmogenic cardiomyopathy.
Keywords: arrhythmogenic cardiomyopathy, cardiomyocytes, microRNA, mitochondrial DNA, induced pluripotent stem cells
БИОХИМИЯ том 84 вып. 3 2019
8*