БИОХИМИЯ, 2019, том 84, вып. 3, с. 404 - 412
УДК 577.218
УВЕЛИЧЕНИЕ ЭФФЕКТИВНОСТИ СОМАТИЧЕСКОГО
РЕПРОГРАММИРОВАНИЯ ПРИ НОКАУТЕ ГЕНА Kaiso
© 2019 Д.С. Каплун1, Р.Э. Фок2, В.С. Коростина3,
Е.Б. Прохорчук1, С.В. Женило1*
1 ФИЦ «Фундаментальные основы биотехнологии» РАН,
119071 Москва, Россия; электронная почта: zhenilo@biengi.ac.ru
2 Институт медицинских исследований Израиль-Канада,
Медицинская школа Еврейского университета,
91120 Иерусалим, Израиль
3 ООО «Эбботт Лэбораториз», медицинский отдел,
125171 Москва, Россия
Поступила в редакцию 09.11.2018
После доработки 27.11.2018
Принята к публикации 27.11.2018
Репрограммирование соматических клеток - процесс, связанный с преодолением установленного эпигене
тического барьера. Ключевыми событиями в этом процессе являются изменения ландшафта метилирова
ния ДНК и модификаций гистонов. Исследование факторов, влияющих на эпигенетическую пластичность,
позволяет не только раскрыть принципы, лежащие в основе репрограммирования, но и найти возможные
способы влияния на этот процесс. Транскрипционный фактор Kaiso является одним из белков интерпрета
торов метилированной ДНК. Связываясь с метилированной ДНК, Kaiso привлекает корепрессионные
комплексы, влияющие на структуру хроматина. В данной работе было показано, что нокаут гена Kaiso спо
собствует более эффективному соматическому репрограммированию, влияя как на пролиферацию клеток,
так и на метилирование ДНК. Предполагаемой причиной увеличения эффективности соматического ре
программирования при нокауте гена Kaiso является снижение уровня метилирования в промоторной облас
ти Oct4 в эмбриональных фибробластах мыши до начала репрограммирования.
КЛЮЧЕВЫЕ СЛОВА: Kaiso, репрограммирование, метилирование ДНК, индуцированные плюрипотент
ные стволовые клетки.
DOI: 10.1134/S0320972519030102
В 2006 г. японским ученым Shinya Yamanaka
пор остаются без ответа многие фундаменталь
и его коллегами была открыта технология полу
ные вопросы: каков молекулярный механизм
чения плюрипотентных стволовых клеток из со
репрограммирования, какие факторы вовлече
матических клеток с помощью экспрессии экзо
ны в этот процесс, почему не все клетки подвер
генных транскрипционных факторов Oct4,
гаются репрограммированию. Ответы на эти
Sox2, c Myc и Klf4 [1]. Во время репрограммиро
вопросы не только позволят раскрыть молеку
вания соматических клеток в индуцированные
лярный механизм репрограммирования клеток,
плюрипотентные стволовые клетки (ИПСК)
но и будут способствовать безопасному приме
происходят глобальные изменения в эпигенети
нению данной технологии в терапии.
ческих профилях, влияющих на структуру хро
Одним из ключевых этапов репрограммиро
матина и приводящих к перезапуску экспрессии
вания соматических клеток является установле
генов: подавляется транскрипция соматических
ние профиля метилирования ДНК, характерно
генов, и активируются гены плюрипотентности.
го для недифференцированного состояния [2].
Несмотря на достигнутый прогресс в исследова
Метилирование ДНК - важная эпигенетичес
нии механизмов репрограммирования, до сих
кая модификация в геноме высших эукариот.
У позвоночных животных метилированию ДНК
Принятые сокращения: ИПСК - индуцированные подвергается 60-80% CpG динуклеотидов. Од
плюрипотентные стволовые клетки, МЭФ - эмбриональ
ним из механизмов регуляции транскрипции ге
ные фибробласты мыши, АР - щелочная фосфатаза, МТТ -
нов является привлечение к метилированной
3 (4,5 диметилтиазол 2 ил) 2,5 дифенилтетразолия бромид,
DAPI - 4',6 диамидино 2 фенилиндол (4',6 diamidino 2
ДНК крупных белковых комплексов [3]. Метил
phenylindole), WT - дикий тип, KO - нокаут гена Kaiso.
ДНК связывающие белки взаимодействуют с
* Адресат для корреспонденции.
метилированными участками ДНК либо с по
404
Kaiso - МОДУЛЯТОР РЕПРОГРАММИРОВАНИЯ КЛЕТОК
405
мощью метил ДНК связывающих доменов MBD
и трансгенных мышей линии 4F2A/C57BL/6 с
(MBD семейство белков: MeCP2, MBD1, MBD2,
нокаутом гена Kaiso (предоставлены д.б.н. Томи
MBD3), либо с помощью домена «цинковые
линым А.С., Институт цитологии РАН).
пальцы» (Kaiso подобное семейство белков:
Клеточные линии. Эмбриональные фибро
Kaiso/ZBTB33, ZBTB4, ZBTB38). Такие белки
бласты мыши (МЭФ) были получены из эмбрио
выступают в качестве транскрипционных факто
нов мышей на 13 й день развития, согласно про
ров самостоятельно или привлекают к регулятор
токолу Nefzger et al. [8]. МЭФ и клетки эмбрио
ным элементам генома различные гистоновые
нальной почки человека линии HEK293T (System
деацетилазы и корепрессорные белковые комп
Bioscience, LV900A 1) культивировали в среде
лексы. Метил ДНК связывающие белки не толь
DMEM с добавлением 10% фетальной бычьей сы
ко «читают» и «интерпретируют» эпигенетичес
воротки (FBS, «Hyclone», США) и 1× пеницилли
кие сигналы, но и обеспечивают связь между ме
на/стрептомицина. ИПСК культивировали в
тилированием ДНК и модификациями гистонов.
среде KnockOut DMEM с добавлением 5% FBS,
Именно поэтому большое внимание уделяется
квалифицированной для работы со стволовыми
роли метил ДНК связывающих белков в процес
клетками, 10% SR (Serum Replacement; «Gibco»,
сах репрограммирования соматических клеток.
США), 1% MEM NEAA (100×, non essential amino
Одним из неисследованных в этой области
acids, «ThermoFisher», США), 1× пенициллина/
факторов является Kaiso, который относится к
стрептомицина, 1000 ед/мл LIF (leukemia inhi
BTB/POZ семейству метил ДНК связывающих
bitory factor, «ThermoFisher», США), 50 мМ β мер
белков. Он связывает метилированные CpG ди
каптоэтанола и глутамакса.
нуклеотиды за счет С концевого домена «цин
Генотипирование эмбрионов мышей. ДНК вы
ковые пальцы» С2Н2 типа. На N конце белка
деляли из МЭФ фенол хлороформовым мето
Kaiso находится домен BTB/POZ, обладающий
дом, осаждали этанолом, растворяли в воде и
способностью к привлечению крупных репрес
использовали для генотипирования методом
сионных комплексов к метилированной ДНК,
ПЦР по генам Kaiso, Col и наличию 4F2A кассе
например, корепрессора NCoR в комплексе с
ты. Последовательности праймеров представле
гистоновой деацетилазой [4]. Помимо репрес
ны в таблице. Амплификацию проводили на
сионной активности, Kaiso может выступать и в
приборе T100 Thermal Cycler («Bio Rad», США)
роли активатора, что опосредуется его пост
при следующих условиях: 95 °С - 3 мин; 30 цик
трансляционными модификациями [5]. В отсут
лов: 95 °С - 30 с, 59 °С - 30 c; далее 72 °С - 10 мин.
ствие Kaiso нарушается эмбриогенез у земно
Продукты ПЦР анализировали с помощью
водных и рыб, однако нокаут гена Kaiso у мышей
электрофореза в 1% ном агарозном геле с по
не приводит к ярко выраженным изменениям в
следующим окрашиванием бромистым этидием
фенотипе, и мыши развиваются здоровыми и
и визуализацией ПЦР продуктов в УФ свете.
фертильными [6]. Исследования в различных
Получение лентивируса и трансдукция МЭФ.
патогенетических модельных системах показа
Лентивирус получали с помощью кальций фос
ли, что Kaiso вовлечен в развитие хронического
фатной трансфекции (Profection Mensal Trans
воспаления и рака кишечника [6, 7].
fection System; «Promega», США) клеток HEK293T
Целью данной работы являлось исследова
вектором pHAGE STEMCCA [9], который со
ние роли Kaiso в репрограммировании сомати
держит доксициклин индуцируемую кассету,
ческих клеток. Основная гипотеза, которая лег
позволяющую эквимолярно экспрессировать
ла в основу работы, заключалась в нашем пред
факторы Яманаки (Oct4, Sox2, c Myc, Klf4) при
положении, что в отсутствие Kaiso клетка проще
добавлении в среду доксициклина. Вирус осаж
идет по пути программирования, поскольку ос
дали 40% ным ПЭГ, ресуспендировали в среде
лабляется механизм поддержания неактивного
OptiMEM («ThermoFisher», США) и хранили
состояния генов/хроматина.
при -70 °С. При трансдукции МЭФ лентивиру
сом в среду добавляли полибрен до концентра
ции 8 мкг/мл. Начиная со следующего дня,
МЕТОДЫ ИССЛЕДОВАНИЯ
клетки культивировали в среде для ИПСК с до
бавлением доксициклина до конечной концент
Линии мышей. В работе использовали мышей
рации 2 мкг/мл. Эффективность трансдукции
дикого типа линии C57BL/6 и мышей линии
МЭФ определяли с помощью иммунофлуорес
С57BL/6 с нокаутом гена Kaiso (предоставлены
центного окрашивания на Oct4 на следующий
виварием Института цитологии и генетики СО
день после добавления доксициклина.
РАН); трансгенных мышей линии 4F2A/C57BL/6,
Получение ИПСК. МЭФ получали из эмбрио
несущих доксициклин индуцибельную кассету
нов на стадии Е13 в соответствии с протоколом
с факторами Яманаки (Sox2, c Myc, Klf4, Oct4),
Nefzger et al. [8]. МЭФ из мышей дикого типа
БИОХИМИЯ том 84 вып. 3 2019
406
КАПЛУН и др.
Последовательности праймеров, использованных в работе
Мишень
Название праймера
Последовательность праймера (5'-3')
Kaiso
KaisoLS3For
CAGCGCATCGCCTTCTATCG
KaisoRev
AGAAGGCTGATCTCCATTTGGA
KaisoBTBRev
AGGCTGAAAGGATGTTCCTATG
Col/4F2A
Col frtA For
GCACAGCATTGCGGACATGC
Col frtB Rev
CCCTCCATGTGTGACCAAGG
Col 4F2A Rev
TTGCTCAGCGGTGCTGTCCA
Nanog
Nanog For
ATTTATAGGGTTGGTGGGGCG
Nanog Rev
TTTTTGGGTGTGAGTATAGTTAT
Oct4
Oct4 For
TGGATATGGGTTGAAATATTGGG
Oct4 Rev
TCCTCTCACCCCTACCTTAAAT
линии C57BL/6 и мышей линии C57BL/6 с но
Пролиферативный анализ клеток. МЭФ высе
каутом гена Kaiso трансдуцировали лентивиру
вали в 96 луночные планшеты (1000-7000 кле
сом, содержащим доксициклин индуцируемую
ток на лунку) и инкубировали в течение ночи.
кассету с факторами Яманаки. Репрограммиро
Пролиферативную активность клеток оценива
вание индуцировали добавлением доксциклина
ли с помощью МТТ анализа. МТТ (Thiazolyl
к трансдуцированным МЭФ или МЭФ, получен
Blue Tetra zolium Bromide, 98%; «Sigma Aldrich»,
ным из трансгенных мышей линии 4F2A/C57BL/6
США) вносили в каждую лунку (конечная кон
и трансгенных мышей линии 4F2A/C57BL/6 с
центрация 0,5 мг/мл) с последующей 3 часовой
нокаутом гена Kaiso. Эффективность формиро
инкубацией. Затем среду отбирали и добавляли
вания ИПСК оценивали по наличию колоний,
50 мкл ДМСО. Оптическую плотность получен
окрашенных на щелочную фосфатазу (АР;
ного MTT формазана, растворенного в ДМСО,
«Merck», США) на 14 й день репрограммирова
измеряли при длине волны 540 нм на прибо
ния. Количество окрашенных колоний норми
ре iMarkTM Microplate Absorbance Reader («Bio
ровали на эффективность трансдукции. Эффек
Rad», США).
тивность трансдукции определяли с помощью
Таргетный бисульфитный анализ. ДНК выде
иммунофлуоресцентного окрашивания на Oct4
ляли из МЭФ фенол хлороформовым методом,
на 1 й день после добавления доксциклина к
осаждали этанолом и растворяли в воде. Бисуль
клеткам. Было сделано не менее трех биологи
фитную конвертацию проводили с помощью на
ческих повторов.
бора EZ DNA Methylation Kit («Zymo Research»,
Иммунофлуоресцентное окрашивание. Клетки
США) согласно инструкции изготовителя. Кон
культивировали на покровном стекле, промыва
вертированную ДНК амплифицировали с по
ли 1× PBS, фиксировали в течение 10 мин при
мощью ПЦР на приборе T100 Thermal Cycler
комнатной температуре в 4% ном параформаль
(«Bio Rad», США). Последовательности прай
дегиде. Далее клетки промывали 3 раза PBS/гли
меров приведены в таблице. Условия ПЦР: 95 °С -
цином, инкубировали в течение 5 мин в 0,2% ном
3 мин; 35 циклов: 95 °С - 30 с, 59 °С - 1 мин и
Tween 20/PBS и еще раз промывали PBS/глици
72 °С - 1 мин; далее 72 °С - 10 мин. Продукты
ном 3 раза. Блокировку проводили в 0,3% ном
ПЦР очищали с помощью QIAquick Gel Extrac
молоке/PBS в течение 1 ч при комнатной темпе
tion Kit («Qiagen», США), а затем клонировали в
ратуре. Клетки инкубировали в блокирующем бу
вектор pTZ57R/T («Thermo Scientific», США) с
фере с первичными антителами к Oct4 (ab19857;
помощью набора Ins TAclone PCR Cloning Kit
«Abcam», США), Sox2 (ab97959; «Abcam», США)
(«Thermo Scientific», США). Клоны анализиро
и SSEA1 (ab16285; «Abcam», США) в течение но
вали секвенированием по Сэнгеру с праймера М13
чи при 4 °С. После отмывки от первичных анти
на приборе 3730 DNAanalyzer («Applied Biosys
тел проводили связывание с флуоресцентно ме
tems», США).
ченными вторичными антителами Alexa Fluor
Статистическая обработка результатов. Полу
488 goat anti rabbit в течение 1 ч в блокирующем
ченные в работе значения представлены в виде
буфере. После отмывки от вторичных антител
средних значений и их стандартных ошибок.
клетки окрашивали DAPI («ThermoFisher», США).
Анализ проводили с помощью t критерия Стью
Анализ иммунофлуоресценции проводили на
дента и однофакторного анализа ANOVA
микроскопе Eclipse Ti S («Nikon», Япония).
(GraphPad).
БИОХИМИЯ том 84 вып. 3 2019
Kaiso - МОДУЛЯТОР РЕПРОГРАММИРОВАНИЯ КЛЕТОК
407
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Kaiso, трансдуцировали доксициклин индуци
руемой кассетой, содержащей факторы Яманаки
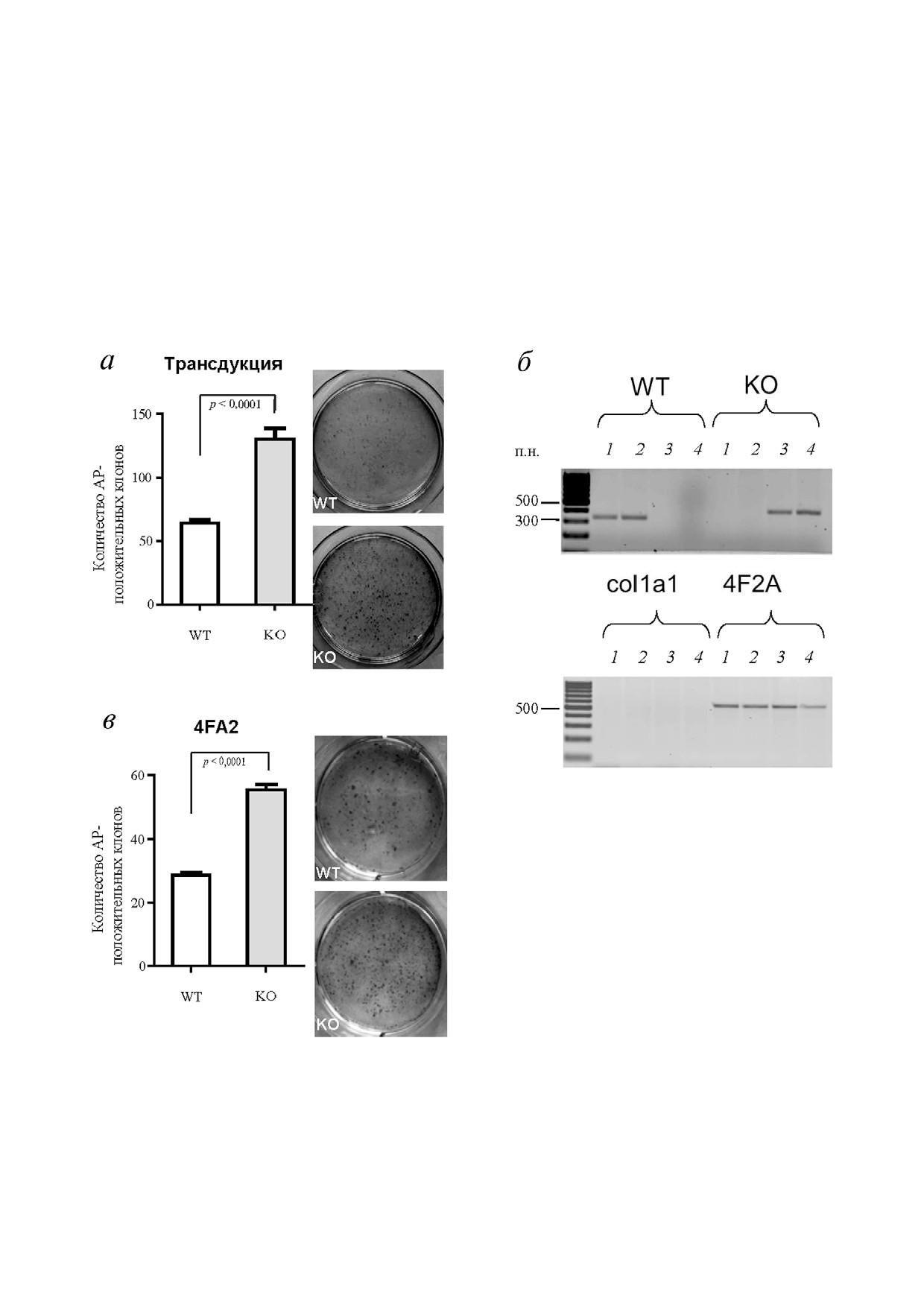
Нокаут гена Kaiso повышает эффективность
(Oct4, Sox2, Klf4, c Myc). Окрашивание репро
репрограммирования соматических клеток. Ос
граммированных клеток на щелочную фосфа
новной вопрос, который нас интересовал, сос
тазу на 14 й день после добавления доксицикли
тоял в том, влияет ли отсутствие белка Kaiso на
на выявило 2 кратное увеличение количества
определение судьбы клетки при репрограмми
АР положительных колоний в клетках, нокаут
ровании. Мы использовали модельную систему
ных по гену Kaiso, по сравнению с клетками ди
получения ИПСК из эмбриональных фибро
кого типа (рис. 1, а). Увеличение эффективнос
бластов мыши (МЭФ). МЭФ, полученные из мы
ти репрограммирования клеток с нокаутом гена
шей дикого типа и мышей, нокаутных по гену
Kaiso, полученных путем заражения лентивиру
Рис. 1. Нокаут гена Kaiso приводит к увеличению эффективности репрограммирования МЭФ. Колонии ИПСК окраше
ны на щелочную фосфатазу (АР) на 14 й день репрограммирования клеток, зараженных лентивирусом (а), и клеток на ос
нове модельной системы 4F2A (в); приведены данные обсчета колоний в четырех повторах и фотографии чашек Петри с
клетками, окрашенными на АР (а, в); б - результаты генотипирования по наличию доксициклин индуцибельной кассе
ты и гена Kaiso у эмбрионов линии мышей 4F2A дикого типа (1, 2) и мышей, нокаутных по гену Kaiso (3, 4); col1a1 - ло
кус, в который вставлена 4F2A кассета
БИОХИМИЯ том 84 вып. 3 2019
408
КАПЛУН и др.
сом, было подтверждено в экспериментах на ге
нии в нокаутных клетках по сравнению с клет
нетической модели мышей со встроенной в ге
ками дикого типа (рис. 3, а). Мы предположили,
ном доксициклин индуцибельной кассетой
что одной из причин более активного формиро
(4F2A) с четырьмя факторами Яманаки (Oct4,
вания клонов может выступать измененная про
Sox2, Klf4 и c Myc) (рис. 1, б). Статус плюрипо
лиферативная активность клеток с делецией ге
тентности полученных клонов был подтвержден
на Kaiso. При помощи МТТ анализа было выяв
иммунофлуоресцентным окрашиванием на
лено, что нокаут гена Kaiso приводит к значи
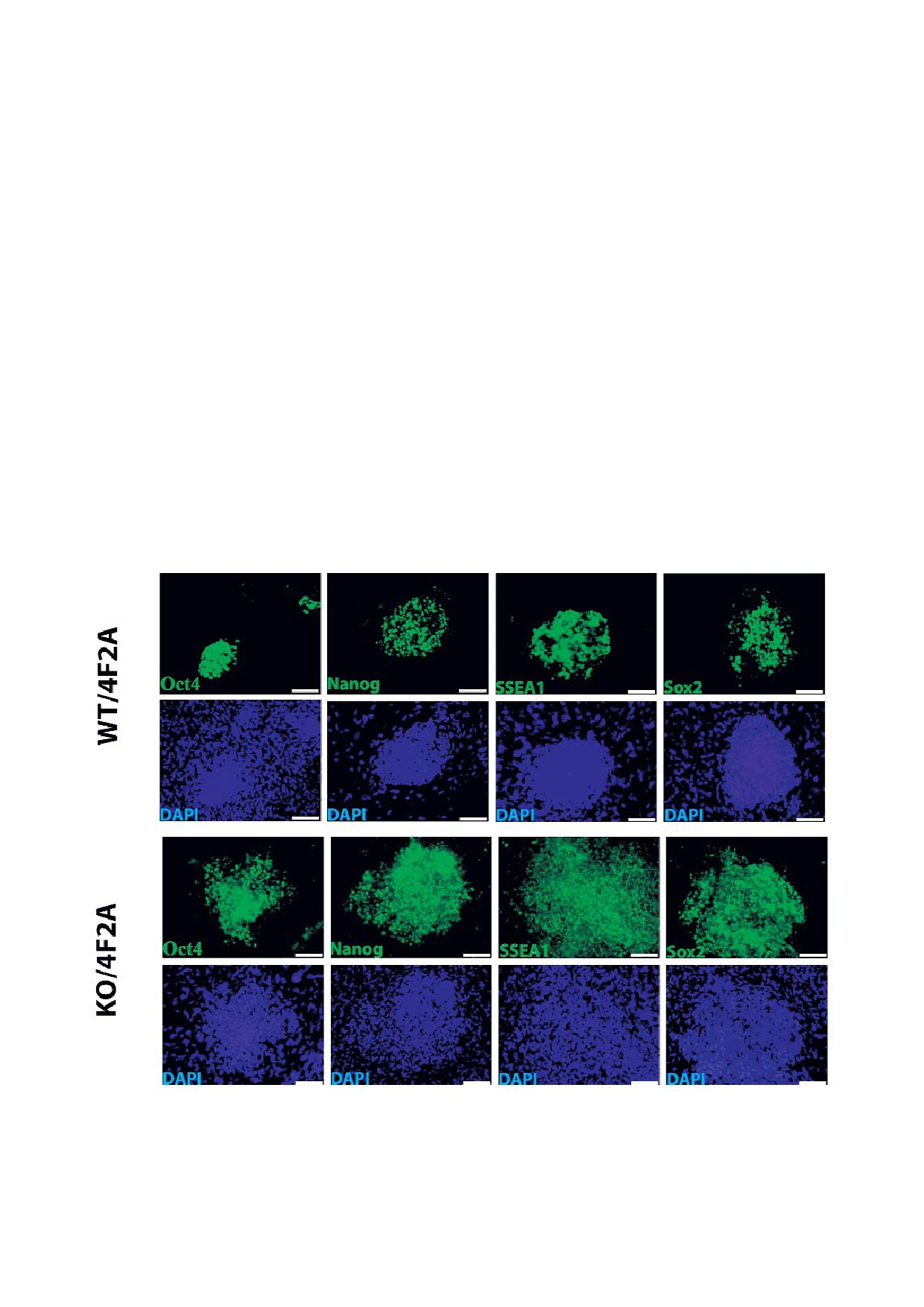
маркеры Oct4, Nanog, SSEA1 и SOX2 (рис. 2).
тельному увеличению пролиферативной актив
Таким образом, было доказано, что белок Kaiso
ности МЭФ (рис. 3, б).
участвует в молекулярной сети во время репрог
Kaiso может оказывать влияние на метилироB
раммирования, что приводит к повышению эф
вание промотора фактора плюрипотентности
фективности этого процесса.
Oct4. Учитывая, что изменения в метилирова
Влияние Kaiso на раннюю стадию репрограмB
нии ДНК являются скорость лимитирующим
мирования у МЭФ. В ходе экспериментов было
процессом при репрограммировании [10], мы
выявлено, что нокаут гена Kaiso способствует не
предположили, что клетки с нокаутом гена Kaiso
только увеличению количества образовавшихся
могут иметь модифицированный ландшафт ме
ИПСК подобных колоний, но и уменьшению
тилирования ДНК в фибробластах, способству
времени, необходимого для их формирования,
ющий более эффективному репрограммирова
по сравнению с ИПСК дикого типа.
нию. Для доказательства данного утверждения
Было проведено иммунофлуоресцентное ок
был проведен таргетный бисульфитный анализ
рашивание клеток на 3 й и 8 й дни репрограм
статуса метилирования промоторов генов Oct4 и
мирования. Уже на 3 й день репрограммирова
Nanog в МЭФ дикого типа и в клетках, нокаут
ния детектировалось бóльшее количество Oct4
ных по гену Kaiso. Промоторы генов Oct4 и
положительных клеток в пределах одной коло Nanog активно деметилируются при репрограм
Рис. 2. Колонии ИПСК экспрессируют основные факторы плюрипотентности. Иммунофлуоресцентное окрашивание на
маркеры Oct4, Sox2, SSEA1 и Nanog. Ядра окрашены DAPI.
С цветным вариантом рис. 2 можно ознакомиться в электронной версии статьи на сайте: www.elibrary.ru
БИОХИМИЯ том 84 вып. 3 2019
Kaiso - МОДУЛЯТОР РЕПРОГРАММИРОВАНИЯ КЛЕТОК
409
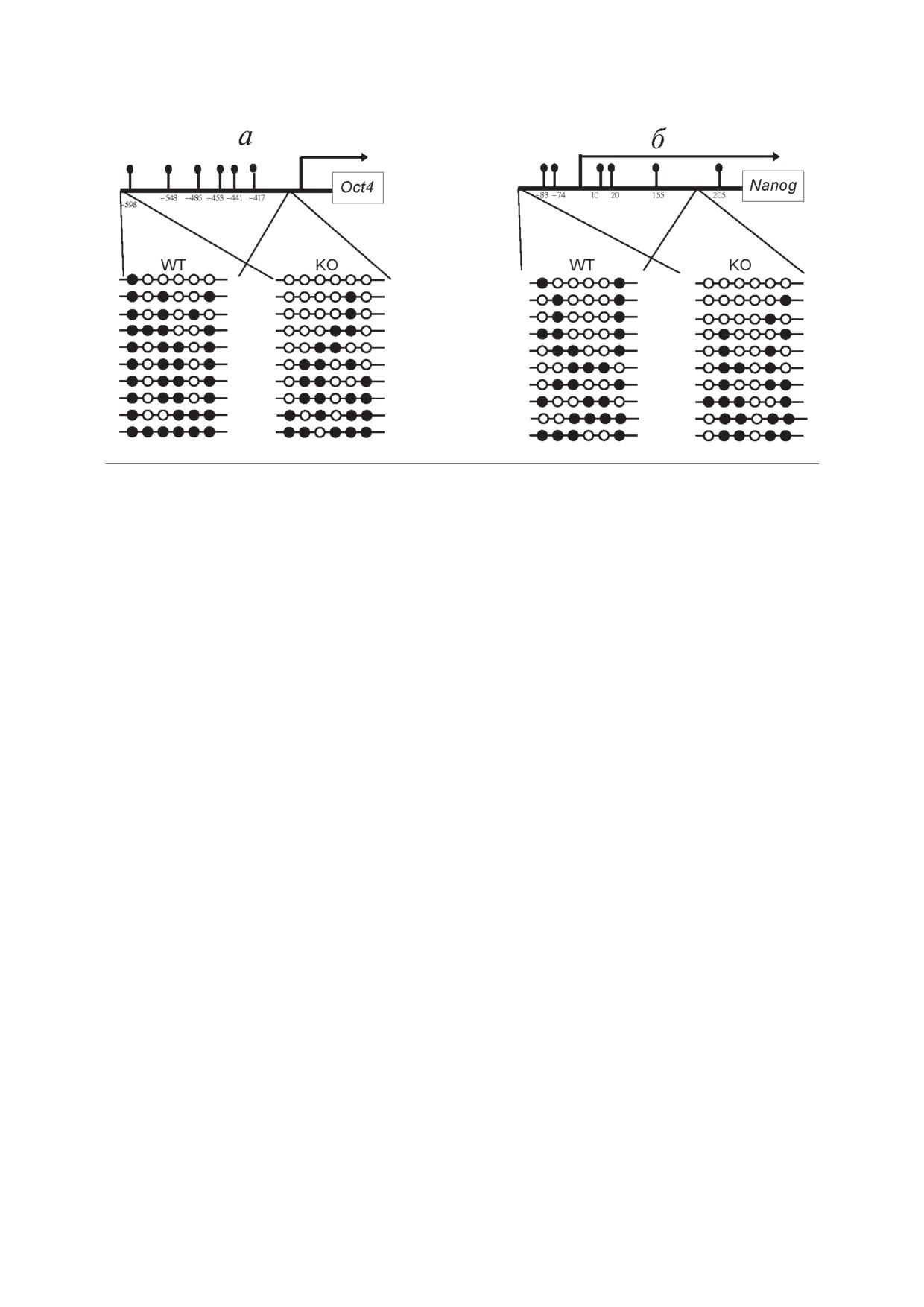
мировании. Нам удалось продемонстрировать
результатам, средний уровень метилирования
снижение уровня метилирования участка в про
исследуемого участка был на 23% ниже в клет
моторе гена Oct4 (рис. 4). Согласно полученным
ках с нокаутом гена Kaiso по сравнению с клет
Рис. 3. Нокаут гена Kaiso приводит к увеличению количества Oct4 положительных клеток уже на 3 й день репрограмми
рования. а - Иммунофлуоресцентное окрашивание на Oct4 на 1, 3 и 8 й дни после начала репрограммирования, ядра ок
рашены DAPI; б - MTT анализ уровня пролиферации МЭФ дикого типа и нокаутных по гену Kaiso в зависимости от
плотности клеток. Эксперимент выполнен в четырех повторах.
С цветным вариантом рис. 3 можно ознакомиться в электронной версии статьи на сайте: www.elibrary.ru
БИОХИМИЯ том 84 вып. 3 2019
410
КАПЛУН и др.
Рис. 4. Метилирование промоторного участка гена Oct4 в МЭФ снижается при нокауте гена Kaiso. Схематическое представ
ление бисульфитного анализа промоторной области Oct4 (a) и Nanog (б). Черные кружки обозначают метилированный
цитозин в составе CpG динуклеотида, незакрашенные кружки - неметилированный цитозин
ками дикого типа, в то время как метилирова
Неизвестно, вызвано ли влияние Kaiso на про
ние промотора гена Nanog статистически значи
цессы репрограммирования изменением в экс
мо не изменялось.
прессии рибосомальных генов, но у клеток, но
каутных по гену Kaiso, пролиферативная актив
ность была выше, чем у клеток дикого типа. Не
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
обходимо также отметить, что Kaiso может свя
зываться с теми же метилированными последо
При репрограммировании клеток происхо
вательностями ДНК, что и один из факторов
дит подавление транскрипции тканеспецифи
Яманаки Klf4 [13, 14]. Фактор Klf4, связываясь с
ческих генов и реактивация генов плюрипотент
метилированной ДНК, может привлекать диок
ности. Репрограммирование сопряжено с изме
сигеназу ТЕТ2, что приводит к деметилирова
нениями эпигенетических модификаций: струк
нию ДНК [15]. Исходя из данных рентгено
туры хроматина и метилирования ДНК. Ключе
структурного анализа, Klf4 и Kaiso не просто
вая роль эпигенетических модификаций в про
взаимодействуют с одними и теми же последо
цессе репрограммирования подтверждается
вательностями, но и образуют структурно иден
экспериментами по обработке клеток как инги
тичный комплекс «цинковые пальцы-ДНК» [14].
биторами гистондеацетилаз (вальпроевой кис
Это позволяет предположить, что Kaiso и Klf4
лотой и бутиратом), так и ингибитором ДНК
могут конкурировать за связывание с метилиро
метилтрансфераз 5 аза 2' цитидином [11]. При
ванной ДНК. В отсутствие Kaiso Klf4 проще
менение этих ингибиторов во время соматичес
связаться с регуляторными элементами генов
кого репрограммирования приводит к более эф
мишеней. Данный факт может объяснить более
фективному переходу клеток из дифференциро
эффективное репрограммирование клеток, но
ванного состояния в ИПСК. В данной работе
каутных по гену Kaiso. Ранее было показано, что
было показано, что метил ДНК связывающий
Kaiso может влиять на модификации гистонов
белок Kaiso влияет на эффективность репрог
за счет посттрансляционных модификаций [5].
раммирования MЭФ. Нокаут гена Kaiso приво
Оставался открытым вопрос, способен ли Kaiso
дил к ускоренному и более эффективному ре
оказывать воздействие на метилирование ДНК.
программированию. Аналогичная картина наб
Ранее при исследовании регуляторных элемен
людалась при нокауте гена, кодирующего дру
тов генов мишеней Kaiso, не связанных с под
гой метил ДНК связывающий белок MeCP2.
держанием плюрипотентности, не удавалось де
Отсутствие MeCP2 приводило к повышению
тектировать изменение уровня их метилирова
пролиферативной активности клеток за счет уве
ния [16]. В данной работе впервые удалось пока
личения экспрессии рибосомальных генов [12].
зать снижение уровня метилирования участка в
БИОХИМИЯ том 84 вып. 3 2019
Kaiso - МОДУЛЯТОР РЕПРОГРАММИРОВАНИЯ КЛЕТОК
411
промоторной области гена плюрипотентости
Благодарности
Oct4 при нокауте гена Kaiso. Результаты данной
Авторы выражают благодарность д.б.н. Томи
работы подчеркивают актуальность исследова
лину А.Н. за предоставление 4F2A животных с
ния уровня метилирования ДНК в полногеном
доксициклин индуцируемой кассетой с факто
ном масштабе при нокауте гена Kaiso и проведе
рами Яманаки и вектора pHAGE STEMCCA и
ния корреляционного анализа с участками свя
д.б.н. Лагарьковой М.А. за предоставление век
зывания Klf4. Мы предполагаем, что отсутствие
торов для вирусной инфекции клеток, а также
белка Kaiso влияет на характер метилирования
консультации и помощь в налаживании работы
генома таким образом, что количество CpG ди
с ИПСК.
нуклеотидов, состояние которых необходимо
изменить для преодоления эпигенетического
Конфликт интересов
барьера, уменьшается.
Авторы заявляют об отсутствии конфликта
интересов.
Финансирование
Соблюдение этических норм
Работа выполнена в рамках государственно
Все применимые международные, националь
го задания № 01201371085 ФИЦ «Фундамен
ные и/или институциональные принципы ухода и
тальные основы биотехнологии» РАН.
использования животных были соблюдены.
СПИСОК ЛИТЕРАТУРЫ
1.
Takahashi, K., and Yamanaka, S. (2006) Induction of
cation of iPS cell intermediates from a reprogrammable
pluripotent stem cells from mouse embryonic and adult
mouse model, J. Vis. Exp., 6, e51728, doi: 10.3791/51728
fibroblast cultures by defined factors, Cell, 126, 663-676,
9.
Sommer, C.A., Stadtfeld, M., Murphy, G.J.,
doi: 10.1016/j.cell.2006.07.024.
Hochedlinger, K., Kotton, D.N., and Mostoslavsky, G.
2.
Lee, D.S., Shin, J.Y., Tonge, P.D., Puri, M.C., Lee, S.,
(2009) Induced pluripotent stem cell generation using a
Park, H., Lee, W.C., Hussein, S.M., Bleazard, T., Yun, J.Y.,
single lentiviral stem cell cassette, Stem Cells, 27, 543-559,
Kim, J., Li, M., Cloonan, N., Wood, D., Clancy, J.L.,
doi: 10.1634/stemcells.2008 1075.
Mosbergen, R., Yi, J.H., Yang, K.S., Kim, H., Rhee, H.,
10.
Papp, B., and Plath, K. (2013) Epigenetics of reprogram
Wells, C.A., Preiss, T., Grimmond, S.M., Rogers, I.M.,
ming to induced pluripotency, Cell, 152, 1324-1343,
Nagy, A., and Seo, J.S. (2014) An epigenomic roadmap to
doi: 10.1016/j.cell.2013.02.043.
induced pluripotency reveals DNA methylation as a repro
11.
Kretsovali, A., Hadjimichael, C., and Charmpilas, N.
gramming modulator, Nat. Commun., 5, 5619, doi: 10.1038/
(2012) Histone deacetylase inhibitors in cell pluripotency,
ncomms6619.
differentiation, and reprogramming, Stem Cells Int., 2012,
3.
Defossez, P.A., and Stancheva, I. (2011) Biological func
184154, doi: 10.1155/2012/184154.
tions of methyl CpG binding proteins, Prog. Mol. Biol.
12.
Zhang, W., Feng, G., Wang, L., Teng, F., Wang, L., Li, W.,
Transl. Sci., 101, 377-398, doi: 10.1016/B978 0 12
Zhang, Y., and Zhou, Q. (2018) MeCP2 deficiency pro
387685 0.00012 3.
motes cell reprogramming by stimulating IGF1/AKT/
4.
Yoon, H.G., Chan, D.W., Reynolds, A.B., Qin, J., and
mTOR signaling and activating ribosomal protein mediated
Wong, J. (2003) N CoR mediates DNA methylation
cell cycle gene translation, J. Mol. Cell Biol., 10, 515-526,
dependent repression through a methyl CpG binding pro
doi: 10.1093/jmcb/mjy018.
13.
Spruijt., C.G., Gnerlich, F., Smits, A.H., Pfaffeneder, T.,
org/10.1016/j.molcel.2003.08.008.
Jansen, P.W., Bauer, C., Munzel, M., Wagner, M., Muller, M.,
5.
Zhenilo, S., Deyev, I., Litvinova, E., Zhigalova, N.,
Khan, F., Eberl, H.C., Mensinga, A., Brinkman, A.B.,
Kaplun, D., Sokolov, A., Mazur, A., and Pro
Lephikov, K., Muller, U., Walter, J., Boelens, R., van
khortchouk, E. (2018) DeSUMOylation switches Kaiso
Ingen, H., Leonhardt, H., Carell, T., and Vermeulen, M.
from activator to repressor upon hyperosmotic stress,
(2013) Dynamic readers for 5 (hydroxy)methylcytosine and
Cell Death Differ., 25, 1938-1951, doi: 10.1038/s41418
its oxidized derivatives, Cell, 152, 1146-1159, doi: 10.1016/
018 0078 7.
j.cell.2013.02.004.
6.
Prokhortchouk, A., Sansom, O., Selfridge, J., Caballero, I.M.,
14.
Liu, Y., Olanrewaju, Y.O., Zheng, Y., Hashimoto, H.,
Salozhin, S., Aithozhina, D., Cerchietti, L., Meng, F.G.,
Blumenthal, R.M., Zhang, X., and Cheng, X. (2014)
Augenlicht, L.H., Mariadason, J.M., Hendrich, B.,
Structural basis for Klf4 recognition of methylated DNA,
Melnick, A., Prokhortchouk, E., Clarke, A., and Bird, A.
Nucleic Acids Res., 42, 4859-4867, doi: 10.1093/nar/gku134.
(2006) Kaiso deficient mice show resistance to intestinal
15.
Sardina, J.L., Collombet, S., Tian, T.V., Gomez, A., Di
cancer, Mol. Cell. Biol., 26, 199-208, doi: 10.1128/MCB.
Stefano, B., Berenguer, C., Brumbaugh, J., Stadhouders, R.,
26.1.199 208.2006.
Segura Morales, C., Gut, M., Gut, I.G., Heath, S., Aran
7.
Pierre, C.C., Longo, J., Mavor, M., Milosavljevic, S.B.,
da, S., Di Croce, L., Hochedlinger, K., Thieffry, D., and
Chaudhary, R., Gilbreath, E., Yates, C., and Daniel, J.M.
Graf, T. (2018) Transcription factors drive Tet2 mediated
(2015) Kaiso overexpression promotes intestinal inflam
enhancer demethylation to reprogram cell fate, Cell Stem
mation and potentiates intestinal tumorigenesis in ApcMin/+
Cell, 23, P727-741.E9, doi: 10.1016/j.stem.2018.08.016.
mice, Biochim. Biophys. Acta, 1852, 1846-1855, doi: 10.1016/
16.
Жигалова Н.А., Соколов А.С., Прохорчук Е.Б., Жени
j.bbadis.2015.06.011.
ло С.В. (2015) S100A3 - новый ген мишень белка Kaiso
8.
Nefzger, C.M., Alaei, S., Knaupp, A.S., Holmes, M.L.,
в коже млекопитающих, Мол. биология, 49, 362-365,
and Polo, J.M. (2014) Cell surface marker mediated purifi
doi: 10.1134/S002689331502017X.
БИОХИМИЯ том 84 вып. 3 2019
412
КАПЛУН и др.
INCREASED EFFICIENCY OF SOMATIC
REPROGRAMMING IN Kaiso KNOCKOUT CELLS
D. S. Kaplun1, R. E. Fok2, V. S. Korostina3,
E. B. Prokhortchouk1, and S. V. Zhenilo1*
1 Federal Research Centre Fundamentals of Biotechnology,
Russian Academy of Sciences, 119071 Moscow, Russia;
E?mail: zhenilo@biengi.ac.ru
2 Department of Developmental Biology and Cancer Research,
Institute of Medical Research Israel-Canada, Jewish Medical
School University, 91120 Jerusalem, Israel
3 Abbott Laboratories LLC, 125171 Moscow, Russia
Received November 9, 2018
Revised November 27, 2018
Accepted November 27, 2018
Cell somatic reprogramming is accompanied by overcoming an established epigenetic barrier. Key events in this
process - changes in the landscape of DNA methylation and histone marks. Study of factors affecting epigenetic plas
ticity enables us to reveal the principles underlying the reprogramming and to find opportunities to influence this
process. Transcription factor Kaiso is a protein interpreter of methylated DNA. Kaiso, bound to methylated DNA,
attracts corepressors that affect chromatin structure. In this work, it was shown that Kaiso gene knockout contributes
to more efficient somatic reprogramming, affecting both cell proliferation and DNA methylation. Assumed reason for
the increased efficiency of somatic reprogramming in Kaiso knockout cells is a decline in the methylation level in the
promoter region of Oct4 in mouse embryonic fibroblasts before the beginning of reprogramming.
Keywords: Kaiso, reprogramming, DNA methylation, induced pluripotent stem cells
БИОХИМИЯ том 84 вып. 3 2019