БИОХИМИЯ, 2019, том 84, вып. 3, с. 413 - 422
УДК 576.32/.36; 575.155
ИСПОЛЬЗОВАНИЕ ПАЦИЕНТ СПЕЦИФИЧНЫХ
ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ
КЛЕТОК ДЛЯ СОЗДАНИЯ МОДЕЛИ ГИПЕРТРОФИЧЕСКОЙ
КАРДИОМИОПАТИИ
© 2019 Е.В. Дементьева1,2,3*, С.П. Медведев1,2,3,4, В.Р. Коваленко1,2,3,4,
Ю.В. Вяткин4,5, Е.И. Кретов2, М.М. Слотвицкий6, Д.Н. Штокало5,
Е.А. Покушалов2, С.М. Закиян1,2,3,4
1 ФИЦ Институт цитологии и генетики СО РАН, 630090 Новосибирск,
Россия; электронная почта: dementyeva@bionet.nsc.ru
2 Национальный медицинский исследовательский центр
им. акад. Е.Н. Мешалкина Минздрава России,
630055 Новосибирск, Россия
3 Институт химической биологии и фундаментальной медицины
СО РАН, 630090 Новосибирск, Россия
4 Новосибирский национальный исследовательский государственный
университет, 630090 Новосибирск, Россия
5 ООО «Новые программные системы», 630090 Новосибирск, Россия
6 Московский физико>технический институт, 141701 Долгопрудный
Московской обл., Россия
Поступила в редакцию 07.10.2018
После доработки 25.11.2018
Принята к публикации 25.11.2018
Получение пациент специфичных индуцированных плюрипотентных стволовых клеток (ИПСК) и их после
дующая направленная дифференцировка в кардиомиоциты открывают новые возможности для изучения
патогенеза наследственных сердечно сосудистых заболеваний. Одним из таких заболеваний является гипер
трофическая кардиомиопатия, для которой до сих пор не разработано эффективных методов терапии.
В данной работе подход, основанный на пациент специфичных ИПСК, был применен для создания моде
ли этого заболевания. Проведен генетический анализ пациента с гипертрофической кардиомиопатией, ко
торый выявил мутацию R326Q в гене MYBPC3. Получены и охарактеризованы ИПСК данного пациента.
ИПСК пациента и здорового донора были дифференцированы в кардиомиоциты. Пациент специфичные
кардиомиоциты воспроизводили такие признаки гипертрофической кардиомиопатии, как нарушения в ди
намике потоков ионов кальция и их повышенное внутриклеточное содержание. Таким образом, кардиомио
циты, полученные в результате направленной дифференцировки ИПСК пациента с гипертрофической кар
диомиопатией, могут быть использованы в качестве модельной системы для изучения патогенеза данного
заболевания.
КЛЮЧЕВЫЕ СЛОВА: индуцированные плюрипотентные стволовые клетки, модели заболеваний человека,
гипертрофическая кардиомиопатия, кардиомиоциты.
DOI: 10.1134/S0320972519030114
Принятые сокращения: ГКМП - гипертрофическая кардиомиопатия; ИПСК - индуцированные плюрипотентные
стволовые клетки; ACTC1 - кардиальный α актин; aSMA - гладкомышечный α актин; CAV3 - кавеолин 3; CHIR99021 -
ингибитор протеинкиназы GSK3β; cTnT - кардиальный тропонин Т; DAPI - 4',6 диамидино 2 фенилиндол; DNMT3B -
ДНК метилтрансфераза 3B; GLA - α галактозидаза; GSK3β - гликогенсинтаза киназа 3β; IWP2 - ингибитор WNT; KLF4 -
Крюппель подобный фактор 4; LAMP2 - ассоциированный с лизосомами мембранный белок 2; LEFTB - фактор лево
правосторонней асимметрии; LIN28 - РНК связывающий белок семейства LIN28; L MYC - протоонкогенный белок
MYCL; MLC2 - вентрикулярная форма регуляторной легкой цепи β миозина; MYBPC3 - миозин связывающий белок С;
MYH7 - тяжелая цепь β миозина; MYL2 - вентрикулярная форма регуляторной легкой цепи β миозина; MYL3 - легкая
цепь миозина; NANOG - транскрипционный фактор, содержащий гомеобокс; NF200 - нейрофиламент 200; NFAT -
ядерный фактор активированных Т клеток; NODAL - лиганд белков суперсемейства TGFβ; OCT4 - транскрипционный
фактор с гомеодоменом POU; PODXL - подокаликсинподобный белок; PRKAG2 - некаталитическая субъединица γ2
АМФ активируемой протеинкиназы; SNP - однонуклеотидный полиморфизм; SOX2 - транскрипционный фактор се
мейства Sox (SRY box 2); SSEA 4 - стадиеспецифичный эмбриональный антиген 4; TNNC1 - тропонин С, тип 1; TNNI3 -
кардиальный тропонин I, тип 3; TNNT2 - кардиальный тропонин Т, тип 2; TPM1 - тропомиозин 1; TRA 1 60 - эпитоп
подокаликсина; TTR - транстиретин; WNT - Wingless/Integrated; Y 27632 - ингибитор протеинкиназы ROCK.
* Адресат для корреспонденции.
413
414
ДЕМЕНТЬЕВА и др.
Гипертрофическая кардиомиопатия (ГКМП) —
мерных белков. Такие кардиомиоциты демон
заболевание, которое характеризуется утолще
стрируют основные признаки ГКМП на клеточ
нием стенки левого желудочка и межжелудочко
ном уровне: увеличенный размер, дезорганиза
вой перегородки, прогрессирующей сердечной
цию саркомеров и миофибрилл, нарушенную
недостаточностью, аритмиями и высоким рис
динамику потоков ионов кальция и более высо
ком внезапной сердечной смерти. Данное забо
кую частоту аритмических событий [12-14]. Од
левание является одной из наиболее распрост
нако то, каким образом мутации в саркомерных
раненных сердечно сосудистых патологий (1 слу
белках приводят к гипертрофии кардиомиоци
чай на 500 человек) [1]. Частота ежегодной
тов и нарушению динамики потоков ионов
смертности из за ГКМП составляет 1-5% [2].
кальция, еще только предстоит выяснить.
Около 50% случаев ГКМП обусловлено мутаци
Целью данной работы являлось создание
ями в генах, кодирующих главным образом сар
клеточной модели для изучения молекулярных
комерные белки [3, 4]. На сегодняшний день не
механизмов ГКМП. Технология ИПСК была
существует способов остановить прогрессирова
использована для получения кардиомиоцитов
ние ГКМП, поскольку существующая медика
пациента с ГКМП, а способность кардиомиоци
ментозная терапия является симптоматической.
тов воспроизводить характерные особенности
Проблема заключается в отсутствии адекватных
данного заболевания была проверена на приме
модельных систем, которые позволяли бы изу
ре такого раннего признака ГКМП, как нару
чать патологические процессы, имеющие место
шенная динамика потоков ионов кальция.
при ГКМП, и подбирать для терапии лекарства,
которые воздействуют на причины развития за
болевания, а не на его последствия.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование взаимосвязи между мутация
ми в саркомерных белках и развитием патологи
Поиск мутаций в генах, ассоциированных с
ческого фенотипа ограничено трудностями по
наследственной ГКМП. Геномную ДНК выделя
лучения образцов сердечной ткани пациентов c
ли из мононуклеарных клеток крови пациента с
ГКМП и невозможностью долгосрочного под
диагнозом ГКМП с помощью Quick DNA Mini
держания и размножения кардиомиоцитов в
prep Kit («Zymo Research», США). В компании
культуре. В связи с этим много работ по изуче
«Генотек» (Россия) на платформе HiSeq 2500
нию ГКМП было проведено на моделях транс
(«Illumina», США) было проведено массовое па
генных животных [5-7]. Однако различия в
раллельное секвенирование клинического экзо
экспрессии саркомерных белков, частоте сокра
ма (5300 генов) пациента. Полученные нуклео
щений, электрофизиологии и регуляции пото
тидные последовательности были выравнены на
ков ионов кальция между кардиомиоцитами че
геном человека (версия hg_38). На наличие не
ловека и других животных значительно снижа
синонимичных нуклеотидных замен были про
ют эффективность использования таких моде
верены следующие гены, ассоциированные с
лей [8, 9]. Решение проблемы моделирования
наследственной ГКМП: ACTC1, CAV3, GLA,
ГКМП становится возможным благодаря техно
LAMP2, MYBPC3, MYH7, MYL2, MYL3, PRKAG2,
логии репрограммирования соматических кле
TNNC1, TNNI3, TNNT2, TPM1 и TTR. Выявлен
ток человека к плюрипотентному состоянию с
ная в 12 м экзоне гена MYBPC3 мутация R326Q
помощью индукции сверхэкспрессии опреде
была подтверждена с помощью секвенирования
ленного набора генов и получению так называе
по Сэнгеру, которое выполняли на секвенаторе
мых индуцированных плюрипотентных стволо
ABI 3130XL Genetic Analyser («Applied Biosys
вых клеток (ИПСК) [10, 11]. В дальнейшем
tems», США) в ЦКП «Геномика» СО РАН.
ИПСК могут быть дифференцированы в любой
Получение пациент специфичных ИПСК. Мо
тип клеток организма, включая кардиомиоци
нонуклеарные клетки выделяли из крови паци
ты, которые можно использовать в качестве мо
ента с ГКМП посредством центрифугирования
делей наследственных сердечно сосудистых за
в градиенте фиколла (1,077 г/мл) и культивиро
болеваний. Данный подход открывает новые
вали на покрытых 0,1% ным желатином поверх
возможности для исследования патогенеза сер
ностях в среде StemPro34 («Thermo Fisher Scien
дечно сосудистых заболеваний на клеточном и
tific», США), содержавшей StemPro34 Supplement
молекулярном уровнях, поиска лекарственных
(«Thermo Fisher Scientific», США), 1× пенициллин
препаратов и других методов терапии.
стрептомицин («Lonza», Швейцария), 100 нг/мл
Благодаря использованию ИПСК и их по
фактора стволовых клеток («Peprotech», США),
следующей направленной дифференцировке
50 нг/мл интерлейкина 3 («Peprotech», США),
удалось получить кардиомиоциты пациентов с
25 нг/мл гранулоцитарно макрофагального ко
вызывающими ГКМП мутациями в генах сарко
лониестимулирующего фактора («Peprotech»,
БИОХИМИЯ том 84 вып. 3 2019
МОДЕЛИРОВАНИЕ ГИПЕРТРОФИЧЕСКОЙ КАРДИОМИОПАТИИ
415
США), 2 ед/мл эритропоэтина («Биннофарм»,
вания эмбриоидных телец [15]. 14 Дневные
Россия), 40 нг/мл инсулиноподобного фактора
эмбриоидные тельца дезагрегировали 0,25% ным
роста 1 («Peprotech», США) и 1 мкг/мл дексаме
трипсином. Клеточную суспензию рассаживали
тазона («Дальхимфарм», Россия). Мононукле
в 4 луночные планшеты и культивировали еще
арные клетки (2-3 млн) были нуклеофицирова
семь дней до проведения иммунофлуоресцент
ны смесью эписомных векторов, экспрессирую
ного окрашивания.
щих гены OCT4, SOX2, KLF4, L>MYC и LIN28
Иммунофлуоресцентное окрашивание. ИПСК
(«Addgene», США; IDs #41855 41858, #41813 41814),
или их дифференцированные производные фик
по 0,6 мкг каждого вектора. Нуклеофекцию
сировали в течение 10 мин в 4% ном парафор
проводили с использованием Amaxa™ Human
мальдегиде, пермеабилизировали в течение 10 мин
CD34 Cell Nucleofector™ Kit («Lonza», Швейца
в 0,4% ном Triton X100 или 96% ном этаноле
рия) на приборе Lonza Nucleofector 2b («Lonza»,
(для TRA 1 60). Иммунофлуоресцентное окра
Швейцария). После нуклеофекции клетки рас
шивание для SSEA 4 выполняли без стадии пер
саживали на Geltrex LDEV Free hESC Qualified
меабилизации. Клетки инкубировали в течение
Reduced Growth Factor Basement Membrane
30 мин в блокирующем буфере (1% ный БСА в
Matrix («Thermo Fisher Scientific», США) в среду
PBS), 18 ч при 4 °C с первыми антителами и 1 ч
для культивирования мононуклеарных клеток.
при комнатной температуре со вторыми антите
Репрограммирование проводили согласно про
лами. После каждой инкубации с антителами
токолу к Epi5™ Episomal iPSC Reprogramming Kit
проводили отмывку в PBS (2 раза по 15 мин).
(«Thermo Fisher Scientific», США). На следую
Для общего окрашивания клеток использовали
щий день после нуклеофекции среду меняли на
4',6 диамидино 2 фенилиндол (DAPI). Образцы
Advanced DMEM/F12 («Thermo Fisher Scientific»,
анализировали с помощью инвертированного
США), содержавшую 1× N2 Supplement («Thermo
флуоресцентного микроскопа Eclipse Ti E («Ni
Fisher Scientific», США), 1× B27 Supplement
kon», Япония).
(«Thermo Fisher Scientific», США), 1× раствор за
Первые антитела и рабочие разведения: OCT4
менимых аминокислот («Lonza», Швейцария),
(sc 5279; «Santa Cruz Biotechnology», США; 1 : 200),
1× GlutaMAX Supplement («Thermo Fisher Scien
NANOG (RCAB003P; «ReproCELL», Япония; 1 : 200),
tific», США), 0,1 мМ β меркаптоэтанол («Sigma
SSEA 4 (ab16287; «Abcam», Великобритания; 1 : 50),
Aldrich», США) и 100 нг/мл основного фактора
TRA 1 60 (ab16288; «Abcam», Великобритания;
роста фибробластов («Biolegend», США). Начи
1 : 200), нейрофиламент 200 (N0142; «Sigma Aldrich»,
ная с 9 го дня после нуклеофекции, клетки куль
США; 1 : 500), βIII тубулин (ab7751; «Abcam», Ве
тивировали в среде Essential 8 Medium («Thermo
ликобритания; 1 : 100), CD31 (131M; «Cell Marque»,
Fisher Scientific», США). Через неделю после
США; 1 : 100), гладкомышечный α актин (M0851;
перевода клеток на среду Essential 8 Medium
«Dako», США; 1 : 100), кардиальный тропонин T
формировались колонии, сходные по морфоло
(ab8295; «Abcam», Великобритания; 1 : 100), вент
гии с колониями плюрипотентных клеток чело
рикулярная форма регуляторной легкой цепи
века. Колонии переносили с помощью капилля
β миозина (ab79935; «Abcam», Великобритания;
ра на слой фидера (митотически инактивиро
1 : 100).
ванных фибробластов мыши) и культивировали
Вторые антитела («Thermo Fisher Scientific»,
в среде Knockout DMEM («Thermo Fisher Scien
США; рабочее разведение - 1 : 400): Alexa Fluor
tific», США), содержавшей 15% Knockout Serum
568 goat anti mouse IgG (H + L) highly cross
Replacement («Thermo Fisher Scientific», США),
adsorbed (A11031), Alexa Fluor 488 goat anti
1× GlutaMAX Supplement («Thermo Fisher Scien
mouse IgG (H + L) highly cross adsorbed (A11029),
tific», США), 1× пенициллин стрептомицин
Alexa Fluor 488 goat anti mouse IgG1 cross
(«Lonza», Швейцария), 1× раствор заменимых
adsorbed (A21121), Alexa Fluor 568 goat anti rabbit
аминокислот («Lonza», Швейцария), 0,05 мM
IgG (H + L) cross adsorbed (A11011), Alexa Fluor
β меркаптоэтанол («Sigma Aldrich», США) и
488 goat anti rabbit IgG (H + L) cross adsorbed
10 нг/мл основного фактора роста фиброблас
(A11008).
тов («Biolegend», США).
Направленная дифференцировка ИПСК в кар
Характеристика линий ИПСК. Анализ экспрес
диомиоциты. ИПСК культивировали 2-3 пасса
сии щелочной фосфатазы и генов, вовлеченных
жа в бесфидерных условиях: на Geltrex LDEV
в поддержание плюрипотентного состояния, а
Free hESC Qualified Reduced Growth Factor Base
также бисульфитное секвенирование промотор
ment Membrane Matrix в среде Essential 8 Medium
ной области гена NANOG в полученных при ре
(«Thermo Fisher Scientific», США). ИПСК в со
программировании клеточных линиях проводи
отношении 1 : 8 рассаживали в 12 луночный план
ли, как описано ранее [15]. Спонтанную диффе
шет. Через 3-4 дня по достижении конфлюэнт
ренцировку клеток осуществляли путем образо
ности клеток 80-90% проводили дифференци
БИОХИМИЯ том 84 вып. 3 2019
416
ДЕМЕНТЬЕВА и др.
ровку в соответствии с протоколом Burridge et al.
Biosciences», США). В качестве изотипического
[16], начиная с добавления к клеткам на 48 ч
контроля использовали клетки, инкубировав
среды RPMI 1640 («Lonza», Швейцария), содер
шиеся только со вторыми антителами.
жавшей 1× B27 Supplement без инсулина («Ther
Исследование динамики потоков ионов каль
mo Fisher Scientific», США) и 6-8 мкМ CHIR99021
ция. Динамику потоков ионов кальция в кардио
(«Sigma Aldrich», США). Для запуска диффе
миоцитах исследовали с помощью кальций за
ренцировки линии ИПСК HCM11f3 использо
висимого флуоресцентного красителя fluo 4,
вали 6 мкМ CHIR99021, а для линии ИПСК
AM («Thermo Fisher Scientific», США) [18]. К клет
m34Sk3 - 8 мкМ CHIR99021. Через 72 ч после на
кам добавляли нагретую до 37 °C среду RPMI
чала дифференцировки на 48 ч добавляли среду
1640/В27 Supplement, содержавшую 4 мкг/мл
RPMI 1640, содержавшую 1× B27 Supplement без
fluo 4. Инкубацию с красителем проводили в те
инсулина и 5 мкМ IWP2 («Sigma Aldrich», США).
чение 30 мин при 37 °C в CO2 инкубаторе
Начиная с 7 го дня дифференцировки, клетки
(«Binder», Германия). Далее среду с fluo 4 заме
культивировали в среде RPMI 1640, содержавшей
няли на нагретый до 37 °C раствор Tyrode (140 мМ
1× B27 Supplement («Thermo Fisher Scientific»,
NaCl, 4,5 мМ КCl, 10 мМ глюкоза, 10 мМ HEPES,
США).
1 мМ MgCl2, 1,8 мМ CaCl2, 1% ный пенициллин/
На 20 й день дифференцировки клетки рас
стрептомицин, рН 7,4).
саживали с помощью TrypLETM Express («Thermo
Запись видеоизображений динамики каль
Fisher Scientific», США) на покрытые 0,1% ным
ций зависимой флуоресценции проводили в те
желатином поверхности в среду RPMI 1640
чение 30 с при экспозиции 400 и 100 мс с по
(«Lonza», Швейцария), содержавшую 20% эмб
мощью инвертированного флуоресцентного
риональной бычьей сыворотки («Thermo Fisher
микроскопа Eclipse Ti E («Nikon», Япония) и
Scientific», США) и 10 мкМ Y 27632 («StemRD»,
программного обеспечения к нему. Видеоизоб
США). Для выделения чистой популяции кар
ражения обрабатывали с использованием прог
диомиоцитов, начиная со следующего дня после
пересадки, клетки в течение 7-10 дней подвер
Статистическую значимость различий пара
гали метаболической селекции и культивирова
метров между кардиомиоцитами пациента с
ли в среде RPMI 1640 без D глюкозы («Thermo
ГКМП и здорового донора оценивали с по
Fisher Scientific», США), содержавшей 213 мкг/мл
мощью ANOVA теста с использованием F кри
L>ascorbic acid 2>phosphate sesquimagnesium salt
терия отсутствия соответствия и последующим
hydrate («Sigma Aldrich», США), 500 мкг/мл ре
наименее значимым различием Фишера для
комбинантного альбумина человека, экспресси
межгруппового сравнения. Статистически зна
рованного в Oryza sativa («Sigma Aldrich», США),
чимыми считали значения p < 0,05.
и 5 мМ DL лактат натрия (L4263, «Sigma Aldrich»,
США) [16]. Метаболическая селекция основана
на способности кардиомиоцитов, в отличие от
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
других типов клеток, метаболизировать лактат в
отсутствие глюкозы и выживать в данной среде.
Генетический анализ пациента с ГКМП. 41 Лет
Проточная цитофлуориметрия. На 20 й день
ний пациент с ГКМП с обструкцией выходного
направленной дифференцировки популяцию диф
отдела левого желудочка проходил лечение в
ференцированных производных ИПСК дезагре
НМИЦ им. акад. Е.Н. Мешалкина Минздрава
гировали с помощью TrypLETM Express до од
России. Для клинической картины пациента
ноклеточного состояния. Число жизнеспособ
также были характерны умеренная митральная
ных клеток подсчитывали на CountessTM Auto
недостаточность, артериальная гипертония 2 й
mated Cell Counter («Thermo Fisher Scientific»,
степени, хроническая сердечная недостаточ
США) с использованием окрашивания трипа
ность 1 й степени c функциональным классом II
новым синим. Фиксацию, пермеабилизацию
(по NYHA), а также синкопе. Массовое парал
клеток, инкубирование с антителами и отмывку
лельное секвенирование клинического экзома
от несвязавшихся антител проводили согласно
(5300 генов) пациента и анализ результатов сек
протоколу Lian et al. [17]. Первые антитела -
венирования для 14 генов, ассоциированных с
кардиальный тропонин Т (ab8295, 8 мкг на 500 тыс.
наследственной ГКМП, выявили миссенс му
клеток; «Abcam», Великобритания). Вторые ан
тацию - замену аргинина на глутамин (R326Q) в
титела - Alexa Fluor 488 goat anti mouse IgG (H + L)
12 м экзоне одного из аллелей гена MYBPC3, ко
highly cross adsorbed (A11029, 2 мкг на 500 тыс.
дирующего саркомерный белок - миозин свя
клеток; «Thermo Fisher Scientific», США). Подсчет
зывающий белок С. Секвенирование 12 го экзо
доли позитивных по кардиальному тропонину Т
на гена MYBPC3 по Сэнгеру подтвердило нали
клеток выполняли на BD FACS Canto II («BD
чие данной мутации у пациента (рис. 1, а).
БИОХИМИЯ том 84 вып. 3 2019
МОДЕЛИРОВАНИЕ ГИПЕРТРОФИЧЕСКОЙ КАРДИОМИОПАТИИ
417
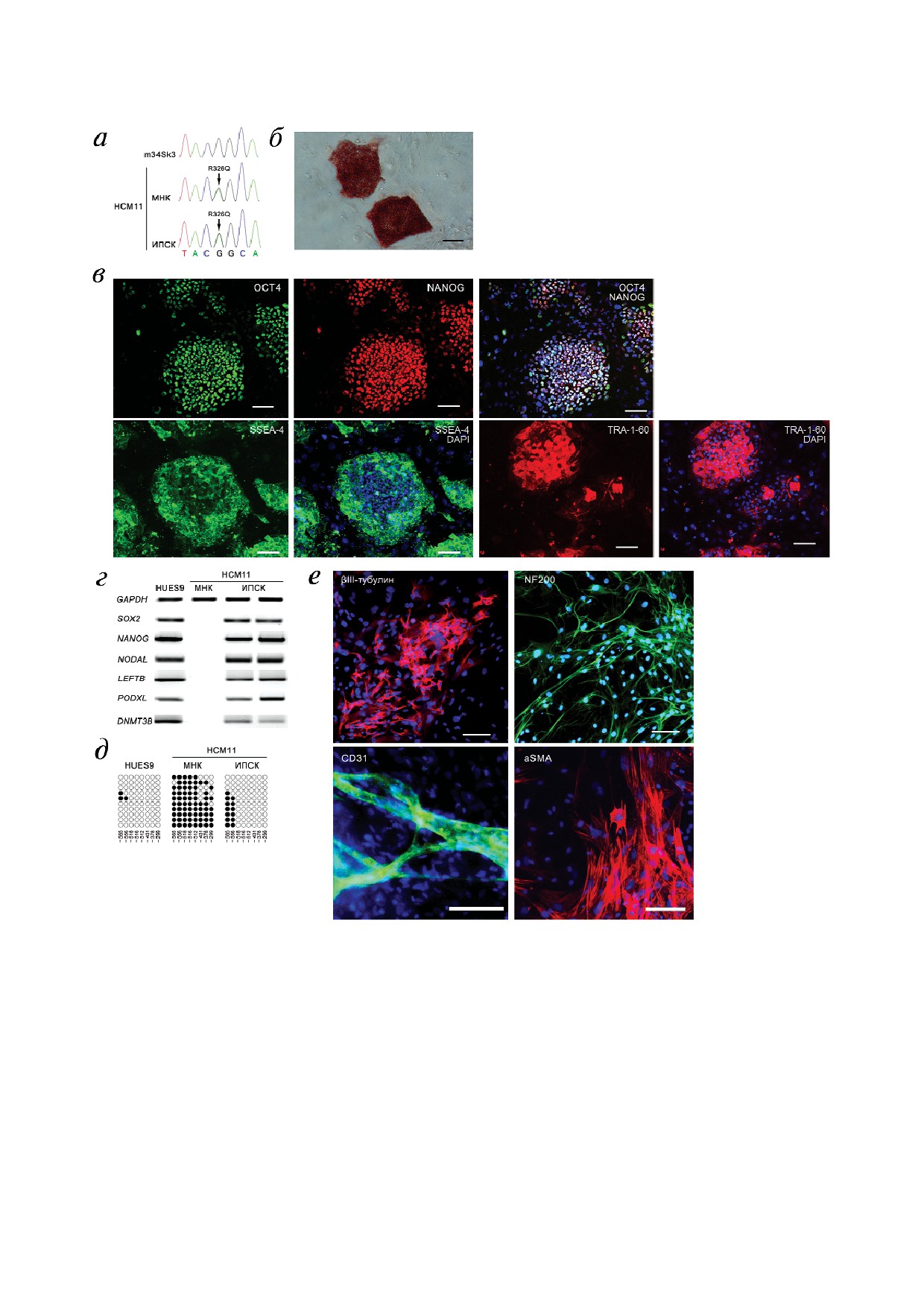
Рис. 1. Характеристика ИПСК, полученных в результате репрограммирования к плюрипотентному состоянию мононук
леарных клеток пациента с ГКМП. HCM11 - пациент с ГКМП, МНК - мононуклеарные клетки, ИПСК - индуцирован
ные плюрипотентные стволовые клетки. а - Наличие мутации R326Q в 12 м экзоне гена MYBPC3 в мононуклеарных клет
ках и ИПСК пациента с ГКМП, m34Sk3 - здоровый контроль; б - экспрессия щелочной фосфатазы в полученных при
репрограммировании линиях клеток. Масштабный отрезок - 100 мкм; в - экспрессия транскрипционных факторов
OCT4 и NANOG, а также поверхностных антигенов SSEA 4 и TRA 1 60 в полученных при репрограммировании линиях
клеток. Ядра клеток окрашены DAPI. Масштабный отрезок - 100 мкм; г - анализ транскрипции генов, экспрессирую
щихся в плюрипотентных клетках человека, в линии эмбриональных стволовых клеток человека HUES9, мононуклеар
ных клетках пациента с ГКМП и полученных при репрограммировании линиях клеток; д - профиль метилирования
CpG динуклеотидов промоторной области гена NANOG. Черными и белыми кружками показаны метилированные и не
метилированные CpG динуклеотиды соответственно. Числами обозначены позиции CpG динуклеотидов в промоторной
области гена NANOG; е - спектр спонтанной дифференцировки полученных при репрограммировании линий клеток.
Экспрессия маркеров эктодермы (βIII тубулин, NF200) и мезодермы (CD31, aSMA) в дифференцированных производ
ных. Ядра клеток окрашены DAPI. Масштабный отрезок - 100 мкм
9 БИОХИМИЯ том 84 вып. 3 2019
418
ДЕМЕНТЬЕВА и др.
Получение пациент специфичных ИПСК. На
го донора (m34Sk3), полученную и охарактери
следующем этапе мононуклеарные клетки кро
зованную ранее [20]. При направленной диффе
ви пациента с мутацией R326Q в гене MYBPC3
ренцировке ИПСК обоих типов первые зоны
были нуклеофицированы эписомными вектора
спонтанных сокращений появлялись на 8-9 й
ми, экспрессирующими гены OCT4, SOX2, KLF4,
дни дифференцировки. На 20 й день дифферен
L>MYC и LIN28 [19]. Колонии, сходные по мор
цировки в популяции дифференцированных
фологии с колониями плюрипотентных клеток
клеток оценивали долю клеток, экспрессирую
человека, появлялись, начиная с 15 го дня пос
щих кардиальный тропонин Т, являющийся мар
ле нуклеофекции. Колонии культивировали на
кером кардиомиоцитов. Эффективность нап
слое фидера в среде для плюрипотентных кле
равленной дифференцировки в кардиомиоциты
ток человека до образования стабильных кле
для пациент специфичных ИПСК составила
точных линий. В результате репрограммирова
42,3%, а для контрольной линии - 47% (рис. 2, б).
ния мононуклеарных клеток пациента с ГКМП
Далее дифференцированные клетки были под
к плюрипотентному состоянию были получены
вергнуты метаболической селекции для выделе
четыре линии клеток, которые были в дальней
ния чистой популяции кардиомиоцитов. На 45 й
шем охарактеризованы.
день дифференцировки практически все клетки,
Полученные клеточные линии экспрессиро
прошедшие метаболическую селекцию, экспрес
вали такие маркеры плюрипотентного состояния,
сировали кардиальный тропонин Т (рис. 2, в).
как щелочная фосфатаза (рис. 1, б), транскрип
Наряду с кардиальным тропонином Т, в паци
ционные факторы OCT4 и NANOG, поверхност
ент специфичных и контрольных кардиомио
ные антигены SSEA 4 и TRA 1 60 (рис. 1, в).
цитах была исследована экспрессия вентрикуляр
Помимо экспрессии генов OCT4 и NANOG, в по
ной формы регуляторной легкой цепи β миози
лученных клеточных линиях была обнаружена
на (MLC2) - саркомерного белка, экспрессия
экспрессия ряда других генов, вовлеченных в
которого специфична для вентрикулярных кар
поддержание плюрипотентного состояния (SOX2,
диомиоцитов. Данный белок экспрессировался
NODAL, LEFTB, PODXL, DNMT3B) (рис. 1, г).
более чем в 90% клеток, позитивных по карди
Аналогичный профиль экспрессии этих генов
альному тропонину Т. Следовательно, кардио
наблюдался в линии эмбриональных стволовых
миоциты, полученные в результате направлен
клеток человека HUES9, взятой в качестве по
ной дифференцировки пациент специфичных
ложительного контроля плюрипотентного сос
и контрольных ИПСК, были преимущественно
тояния, в то время как в исходных мононуклеар
вентрикулярными.
ных клетках эти гены не экспрессировались. Бо
Нарушенная динамика потоков ионов кальция
лее того, промоторная область гена NANOG в по
в пациент специфичных кардиомиоцитах. Дина
лученных клеточных линиях была деметилиро
мика потоков ионов кальция в кардиомиоцитах,
вана, как и в линии HUES9, в то время как про
полученных при направленной дифференци
моторная область гена NANOG в мононуклеар
ровке пациент специфичных и контрольных
ных клетках - метилирована (рис. 1, д). Анализ
ИПСК, была исследована с использованием
спектра дифференцированных производных,
флуоресцентного красителя fluo 4, интенсив
полученных при спонтанной дифференцировке
ность флуоресценции которого зависит от кон
клеточных линий, выявил экспрессию маркеров
центрации ионов кальция в клетке. На 74 й день
двух зародышевых листков: эктодермы и мезо
дифференцировки для пациент специфичных и
дермы (рис. 1, е). Таким образом, полученные ли
контрольных кардиомиоцитов были записаны
нии клеток соответствовали критериям ИПСК:
видеоизображения флуоресценции fluo 4, отра
имели характерную для плюрипотентных кле
жающие динамику потоков ионов кальция. В ре
ток морфологию, экспрессировали основные
зультате обработки видеоизображений были
маркеры плюрипотентного состояния и были
построены графики динамики потоков ионов
способны дифференцироваться в производные
кальция в пациент специфичных и контроль
различных зародышевых листков. Секвенирова
ных кардиомиоцитах (рис. 2, г). Контрольные
ние 12 го экзона гена MYBPC3 в пациент специ
кардиомиоциты демонстрировали регулярное
фичных ИПСК подтвердило наличие мутации
чередование процессов выброса ионов кальция
R326Q (рис. 1, а).
из саркоплазматического ретикулума и их об
Направленная дифференцировка пациент спе
ратного захвата (рис. 2, г), в то время как паци
цифичных ИПСК в кардиомиоциты. Линия паци
ент специфичные кардиомиоциты показывали
ент специфичных ИПСК с мутацией R326Q в
нерегулярное чередование выбросов ионов каль
гене MYBPC3 (HCM11f3) была дифференциро
ция из саркоплазматического ретикулума и их
вана в кардиомиоциты (рис. 2, а). В качестве
обратного захвата (рис. 2, г), более продолжи
контроля использовали линию ИПСК здорово
тельное время между выбросами ионов кальция
БИОХИМИЯ том 84 вып. 3 2019
МОДЕЛИРОВАНИЕ ГИПЕРТРОФИЧЕСКОЙ КАРДИОМИОПАТИИ
419
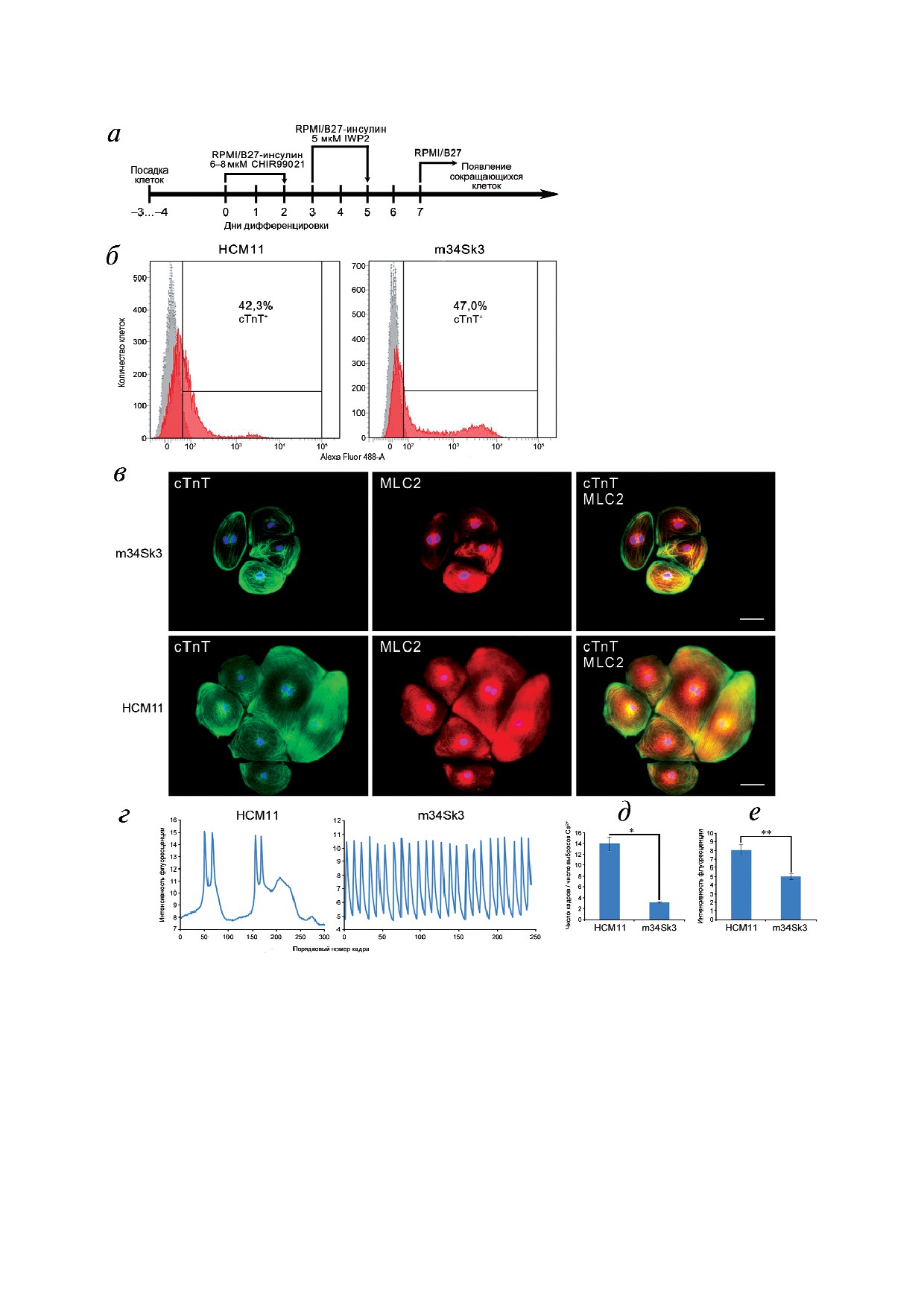
Рис. 2. Получение и характеристика кардиомиоцитов пациента с ГКМП (HCM11) и здорового донора (m34Sk3). а - Схе
ма протокола, использованного для направленной дифференцировки ИПСК в кардиомиоциты; б - эффективность нап
равленной дифференцировки ИПСК в кардиомиоциты. cTnT - кардиальный тропонин Т. Серым цветом показан изоти
пический контроль; в - экспрессия кардиального тропонина Т (cTnT) и вентрикулярной формы регуляторной легкой це
пи β миозина (MLC2) в кардиомиоцитах, полученных в результате направленной дифференцировки ИПСК, на 45 й день
дифференцировки. Ядра клеток окрашены DAPI. Масштабный отрезок - 50 мкм; г - нарушение регулярности выбросов
ионов кальция из саркоплазматического ретикулума и их обратного захвата в кардиомиоцитах, полученных при диффе
ренцировке ИПСК пациента с ГКМП, в сравнении с контрольными кардиомиоцитами; д - увеличение времени между
выбросами ионов кальция в кардиомиоцитах, полученных при дифференцировке ИПСК пациента с ГКМП, в сравнении
с контрольными кардиомиоцитами; * p < 0,01; е - повышенная внутриклеточная концентрация ионов кальция в состоя
нии покоя в кардиомиоцитах, полученных при дифференцировке ИПСК пациента с ГКМП, в сравнении с контрольны
ми кардиомиоцитами; ** p < 0,05
БИОХИМИЯ том 84 вып. 3 2019
9*
420
ДЕМЕНТЬЕВА и др.
из саркоплазматического ретикулума (рис. 2, д)
вали на слое фидера и переводили в бесфидер
и повышенную внутриклеточную концентра
ные условия культивирования (Geltrex и среда
цию ионов кальция на стадии покоя (рис. 2, е).
Essential 8 Medium) лишь за 2-3 пассажа до на
Таким образом, кардиомиоциты, полученные от
чала направленной дифференцировки в кардио
пациента с мутацией R326Q в гене MYBPC3 с по
миоциты. Тем не менее даже 40-50% ная эф
мощью технологии ИПСК, демонстрировали
фективность дифференцировки ИПСК в кардио
такие ранние признаки ГКМП, как нарушенная
миоциты, особенно в сочетании с метаболичес
динамика потоков ионов кальция и их повы
кой селекцией, может оказаться вполне доста
шенная внутриклеточная концентрация.
точной для успешного моделирования и иссле
дования механизмов наследственных сердечно
сосудистых заболеваний.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что кардиомиоциты, полученные
в результате направленной дифференцировки
В результате генетического анализа у паци
плюрипотентных клеток, имеют незрелый фе
ента с ГКМП была выявлена мутация R326Q в
нотип - неупорядоченную организацию мио
гене MYBPC3. MYBPC3, наряду с MYH7, являет
фибрилл, экспрессируют атриальную форму ре
ся геном, в котором наиболее часто встречаются
гуляторной легкой цепи β миозина, имеют про
мутации, вызывающие наследственную ГКМП.
межуточную атриально подобную форму по
Их частота составляет ~40% [21]. Однако, сог
тенциала действия. В процессе культивирова
ласно результатам популяционно генетических
ния кардиомиоцитов происходит их созревание.
исследований, мутация R326Q в гене MYBPC3
Примерно на 30 й день дифференцировки на
имеет статус «benign» (база данных ClinVar, NCBI),
чинается их специализация по типам (вентрику
т.е. считается нейтральной и не приводит к раз
лярные, атриальные, нодальные), причем боль
витию ГКМП. В связи с этим было интересно
шинство кардиомиоцитов становится вентрику
проверить, обладают ли кардиомиоциты с дан
лярными [16]. Оценка коэкспрессии кардиаль
ной мутацией какими либо особенностями,
ного тропонина Т (раннего маркера кардиаль
связанными с ГКМП.
ной дифференцировки) и MLC2 (саркомерного
Кардиомиоциты с мутацией R326Q в гене
белка вентрикулярных кардиомиоцитов) в па
MYBPC3 были получены путем направленной диф
циент специфичных и контрольных кардиомио
ференцировки пациент специфичных ИПСК с
цитах на 45 й день дифференцировки показала,
помощью протокола, основанного на активации
что более 90% кардиомиоцитов являются вент
сигнального пути WNT/β катенин посредством
рикулярными (рис. 2, в). Этот факт согласуется с
ингибирования протеинкиназы GSK3β (с по
результатами других протоколов направленной
мощью CHIR99021) и последующем ингибиро
дифференцировки плюрипотентных клеток в
вании WNT (с помощью IWP2) и использовании
кардиомиоциты [16].
среды RPMI 1640 c добавлением B27 Supplement
Одним из ранних признаков ГКМП, кото
[16]. Аналогичным образом была осуществлена
рый предшествует гипертрофическому ремоде
дифференцировка ИПСК здорового донора.
лированию кардиомиоцитов, является нару
Эффективность дифференцировки в исходном
шенная динамика внутриклеточных потоков
протоколе составила в среднем 81%, в то время
ионов кальция, приводящая к повышенному со
как эффективность дифференцировки ИПСК
держанию ионов кальция в цитоплазме в период
пациента с ГКМП и здорового донора варьиро
покоя кардиомиоцита. Показано, что повышен
вала в диапазоне 40-50% (рис. 2, б). Более низ
ная внутриклеточная концентрация ионов каль
кая эффективность направленной дифференци
ция вызывает активацию фосфатазы кальцинев
ровки в кардиомиоциты в нашем исследовании
рин, которая дефосфорилирует и активирует
может объясняться различиями в методах полу
транскрипционный фактор NFAT, что приводит
чения и культивирования линий ИПСК. Так,
к изменению паттерна экспрессии генов и раз
Burridge et al. для доставки факторов репрограм
витию гипертрофии кардиомиоцитов. Кроме
мирования использовали вирус Сендай (для
того, повышенная концентрация ионов кальция
фибробластов и мононуклеарных клеток) и
предрасполагает к аритмическим событиям в
плазмидные векторы (для фибробластов). После
кардиомиоцитах [12, 22]. По сравнению с конт
получения линии ИПСК культивировали в бес
рольными кардиомиоцитами, пациент специ
фидерных условиях - на покрытии Synthemax
фичные кардиомиоциты имели целый ряд нару
II SC («Corning», США) в среде Essential 8 Me
шений в динамике потоков ионов кальция: не
dium. В нашем исследовании были использова
регулярность выбросов ионов кальция из сар
ны ИПСК, полученные с помощью эписомных
коплазматического ретикулума и их обратного
векторов. После получения ИПСК культивиро
захвата, большее время между выбросами ионов
БИОХИМИЯ том 84 вып. 3 2019
МОДЕЛИРОВАНИЕ ГИПЕРТРОФИЧЕСКОЙ КАРДИОМИОПАТИИ
421
кальция, свидетельствующее о более продолжи
анализ пациента должен стать предметом для
тельном обратном захвате ионов кальция сар
дальнейших исследований.
коплазматическим ретикулумом, и повышен
Таким образом, с использованием техноло
ную внутриклеточную концентрацию ионов
гии ИПСК получены кардиомиоциты пациента
кальция в состоянии покоя (рис. 2, г-е). Похо
с ГКМП, способные воспроизводить такие
жая динамика потоков ионов кальция была по
признаки данного заболевания, как нарушенная
казана в кардиомиоцитах, полученных в резуль
динамика потоков ионов кальция и их повы
тате направленной дифференцировки пациент
шенная внутриклеточная концентрация, что де
специфичных ИПСК и несущих мутации R663H
лает данные клетки перспективной моделью для
и R442G в гене MYH7, вызывающие наслед
изучения патогенеза ГКМП.
ственную ГКМП [12, 13]. Более того, повышен
ная внутриклеточная концентрация ионов каль
Финансирование
ция в пациент специфичных кардиомиоцитах
согласуется с эпизодами синкопе у пациента с
Работа выполнена при поддержке РНФ (про
ГКМП, которые указывают на наличие аритми
ект № 18 75 10039).
ческих событий в клинической картине. Тот
факт, что кардиомиоциты, полученные при на
Конфликт интересов
правленной дифференцировке пациент специ
фичных ИПСК, демонстрируют нарушения в
Авторы заявляют об отсутствии конфликта
динамике потоков ионов кальция, предполага
интересов.
ет, что наряду с мутацией R326Q в гене MYBPC3
у пациента могут быть еще мутации и/или SNPs,
Соблюдение этических норм
которые и приводят к подобным эффектам.
Поскольку результаты секвенирования клини
Все процедуры, выполненные в исследова
ческого экзома оценивались только для 14 ассо
нии с участием людей, соответствуют этическим
циированных с ГКМП генов, список анализи
стандартам Хельсинкской декларации 1964 года
руемых генов следует расширить, включив в не
и ее последующим изменениям или сопостави
го гены, которые могут быть ассоциированы с
мым нормам этики.
ГКМП в более редких случаях или задействова
От включенного в исследование пациента
ны в работе саркоплазматического ретикулума.
было получено информированное доброволь
Следовательно, более детальный генетический
ное согласие.
СПИСОК ЛИТЕРАТУРЫ
1.
Maron, B.J. (2002) Hypertrophic cardiomyopathy: a sys
(2002) The L type calcium channel inhibitor diltiazem
tematic review, JAMA, 287, 1308-1320, doi: 10.1001/jama.
prevents cardiomyopathy in a mouse model, J. Clin.
287.10.1308.
Invest., 109, 1013-1020, doi: 10.1172/JCI14677.
2.
Maron, B.J., Maron, M.S., and Semsarian, C. (2012)
8.
Salama, G., and London, B. (2007) Mouse models of long
Genetics of hypertrophic cardiomyopathy after 20 years:
QT syndrome, J. Physiol., 578, 43-53, doi: 10.1113/jphysiol.
clinical perspectives, J. Am. Coll. Cardiol., 60, 705-715,
2006.118745.
doi: 10.1016/j.jacc.2012.02.068.
9.
Ross, S.B., Fraser, S.T., and Semsarian, C. (2016) Induced
3.
Houston, B.A., and Stevens, G.R. (2014) Hypertrophic
pluripotent stem cells in the inherited cardiomyopathies:
cardiomyopathy: a review, Clin. Med. Insights Cardiol., 8,
from disease mechanisms to novel therapies, Trends
53-65, doi: 10.4137/CMC.S15717.
Cardiovasc. Med., 26, 663-672, doi: 10.1016/j.tcm.
4.
Semsarian, C., Ingles, J., Maron, M.S., and Maron, B.J.
2016.05.001.
(2015) New perspectives on the prevalence of hypertrophic
10. Takahashi, K., and Yamanaka, S. (2006) Induction of
cardiomyopathy, J. Am. Coll. Cardiol., 65, 1249-1254,
pluripotent stem cells from mouse embryonic and adult
doi: 10.1016/j.jacc.2015.01.019.
fibroblast cultures by defined factors, Cell, 126, 663-676,
5.
Yang, Q., Sanbe, A., Osinska, H., Hewett, T.E., Klevitsky, R.,
doi: 10.1016/j.cell.2006.07.024.
and Robbins, J. (1998) A mouse model of myosin binding
11. Yu, J., Vodyanik, M.A., Smuga Otto, K., Antosiewicz
protein C human familial hypertrophic cardiomyopathy,
Bourget, J., Frane, J.L., Tian, S., Nie, J., Jonsdottir, G.A.,
J. Clin. Invest., 102, 1292-1300, doi: 10.1172/JCI3880.
Ruotti, V., Stewart, R., Slukvin, I.I., and Thomson, J.A.
6.
Marian, A.J., Wu, Y., Lim, D.S., McCluggage, M., Youker, K.,
(2007) Induced pluripotent stem cell lines derived from
Yu, Q.T., Brugada, R., DeMayo, F., Quinones, M., and
human somatic cells, Science, 318, 1917-1920, doi: 10.1126/
Roberts, R. (1999) A transgenic rabbit model for human
science.1151526.
hypertrophic cardiomyopathy, J. Clin. Invest.,
104,
12. Lan, F., Lee, A.S., Liang, P., Sanchez Freire, V., Nguyen, P.K.,
1683-1692, doi: 10.1172/JCI7956.
Wang, L., Han, L., Yen, M., Wang, Y., Sun, N., Abilez, O.J.,
7.
Semsarian, C., Ahmad, I., Giewat, M., Georgakopoulos, D.,
Hu, S., Ebert, A.D., Navarrete, E.G., Simmons, C.S.,
Schmitt, J.P., McConnell, B.K., Reiken, S., Mende, U.,
Wheeler, M., Pruitt, B., Lewis, R., Yamaguchi, Y., Ashley, E.A.,
Marks, A.R., Kass, D.A., Seidman, C.E., and Seidman, J.G.
Bers, D.M., Robbins, R.C., Longaker, M.T., and Wu, J.C.
БИОХИМИЯ том 84 вып. 3 2019
422
ДЕМЕНТЬЕВА и др.
(2013) Abnormal calcium handling properties underlie
17. Lian, X., Zhang, J., Azarin, S.M., Zhu, K., Hazeltine, L.B.,
familial hypertrophic cardiomyopathy pathology in
Bao, X., Hsiao, C., Kamp, T.J., and Palecek, S.P. (2013)
patient specific induced pluripotent stem cells, Cell Stem
Directed cardiomyocyte differentiation from human plu
Cell, 12, 101-113, doi: 10.1016/j.stem.2012.10.010.
ripotent stem cells by modulating Wnt/β catenin signaling
13. Han, L., Li, Y., Tchao, J., Kaplan, A.D., Lin, B., Mich
under fully defined conditions, Nat. Protoc., 8, 162-175,
Basso, J., Lis, A., Hassan, N., London, B., Bett, G.C.,
doi: 10.1038/nprot.2012.150.
Tobita, K., Rasmusson, R.L., and Yang, L. (2014) Study
18. Слотвицкий М.М., Цвелая В.А., Фролова Ш.Р., Де
familial hypertrophic cardiomyopathy using patient spe
ментьева Е.В., Агладзе К.И. (2018) Исследование
cific induced pluripotent stem cells, Cardiovasc. Res., 104,
функциональности получаемых из индуцированных
258-269, doi: 10.1093/cvr/cvu205.
плюрипотентных стволовых клеток кардиомиоцитов
14. Tanaka, A., Yuasa, S., Mearini, G., Egashira, T., Seki, T.,
для моделирования сердечных аритмий при синдроме
Kodaira, M., Kusumoto, D., Kuroda, Y., Okata, S.,
удлиненного интервала QT, Вавиловский журнал гене>
Suzuki, T., Inohara, T., Arimura, T., Makino, S., Kimura, K.,
тики и селекции, 22, 187-195, doi: 10.18699/VJ18.346.
Kimura, A., Furukawa, T., Carrier, L., Node, K., and
19. Okita, K., Yamakawa, T., Matsumura, Y., Sato, Y., Amano, N.,
Fukuda, K. (2014) Endothelin 1 induces myofibrillar dis
Watanabe, A., Goshima, N., and Yamanaka, S. (2013) An
array and contractile vector variability in hypertrophic car
efficient nonviral method to generate integration free
diomyopathy induced pluripotent stem cell derived car
human induced pluripotent stem cells from cord blood and
diomyocytes, J. Am. Heart Assoc., 3, e001263, doi: 10.1161/
peripheral blood cells, Stem Cells, 31, 458-466, doi: 10.1002/
JAHA.114.001263
stem.1293.
15. Medvedev, S.P., Grigor’eva, E.V., Shevchenko, A.I.,
20. Валетдинова К.Р. (2016) Получение модельной системы
Malakhova, A.A., Dementyeva, E.V., Shilov, A.A.,
спинальной мышечной атрофии на основе индуцирован>
Pokushalov, E.A., Zaidman, A.M., Aleksandrova, M.A.,
ных плюрипотентных стволовых клеток человека. Дис.
Plotnikov, E.Y., Sukhikh, G.T., and Zakian, S.M. (2011)
канд. биол. наук, ИЦиГ, Новосибирск.
Human induced pluripotent stem cells derived from fetal
21. Pasipoularides, A. (2018) Challenges and controversies in
neural stem cells successfully undergo directed differentiation
hypertrophic cardiomyopathy: clinical, genomic and basic
into cartilage, Stem Cells Dev., 20, 1099-1112, doi: 10.1089/
science perspectives, Rev. Esp. Cardiol. (Engl. Ed.), 71,
scd.2010.0249.
132-138, doi: 10.1016/j.rec.2017.07.003.
16. Burridge, P.W., Matsa, E., Shukla, P., Lin, Z.C., Churko, J.M.,
22. Konno, T., Chang, S., Seidman, J.G., and Seidman, C.E.
Ebert, A.D., Lan, F., Diecke, S., Huber, B., Mordwinkin, N.M.,
(2010) Genetics of hypertrophic cardiomyopathy, Curr.
Plews, J.R., Abilez, O.J., Cui, B., Gold, J.D., and Wu, J.C.
Opin. Cardiol.,
25,
205-209, doi:
10.1097/HCO.
(2014) Chemically defined generation of human cardiomyo
0b013e3283375698.
cytes, Nat. Methods, 11, 855-860, doi: 10.1038/nmeth.2999.
APPLYING PATIENT SPECIFIC INDUCED PLURIPOTENT STEM CELLS
TO CREATE A MODEL OF HYPERTROPHIC CARDIOMYOPATHY
E. V. Dementyeva1,2,3*, S. P. Medvedev1,2,3,4, V. R. Kovalenko1,2,3,4, Yu. V. Vyatkin4,5,
E. I. Kretov2, M. M. Slotvitsky6, D. N. Shtokalo5, E. A. Pokushalov2, and S. M. Zakian1,2,3,4
1 Federal Research Center Institute of Cytology and Genetics, Siberian Branch of the Russian Academy
of Sciences, 630090 Novosibirsk, Russia; E>mail: dementyeva@bionet.nsc.ru
2 Meshalkin National Medical Research Center, Ministry of Health of Russian Federation,
630055 Novosibirsk, Russia
3 Institute of Chemical Biology and Fundamental Medicine, Siberian Branch of the Russian
Academy of Sciences, 630090 Novosibirsk, Russia
4 Novosibirsk State University, 630090 Novosibirsk, Russia
5 Novel Software Systems Ltd., 630090 Novosibirsk, Russia
6 Moscow Institute of Physics and Technology, 141701 Dolgoprudny,
Moscow Region, Russia
Received October 7, 2018
Revised November 25, 2018
Accepted November 25, 2018
Generating patient specific induced pluripotent stem cells (iPSCs) and their subsequent differentiation into car
diomyocytes afford new opportunities to study pathogenesis of inherited cardiovascular diseases. One of such diseases
is hypertrophic cardiomyopathy, for which effective therapy methods have not been developed so far. In this study, an
approach based on patient specific iPSCs was applied to create a model of the disease. Genetic analysis revealed the
R326Q mutation in MYBPC3 gene of patient with hypertrophic cardiomyopathy. iPSCs of the patient were generated
and characterized. iPSCs of the patient and a healthy donor were differentiated into cardiomyocytes. The patient spe
cific cardiomyocytes reproduced such traits of hypertrophic cardiomyopathy as the abnormal calcium handling and
increased intracellular calcium. Thus, cardiomyocytes obtained by directed differentiation of iPSCs of the hyper
trophic cardiomyopathy patient may be used as a model system to study pathogenesis of the disease.
Keywords: induced pluripotent stem cells, human disease models, hypertrophic cardiomyopathy, cardiomyocytes
БИОХИМИЯ том 84 вып. 3 2019