БИОХИМИЯ, 2019, том 84, вып. 3, с. 423 - 435
УДК 577.29
ПЛАТФОРМА ДЛЯ ИССЛЕДОВАНИЯ МЕХАНИЗМОВ
НЕЙРОДЕГЕНЕРАЦИИ С ПОМОЩЬЮ ГЕНЕТИЧЕСКИ
КОДИРУЕМЫХ БИОСЕНСОРОВ
© 2019 Е.И. Устьянцева1,2,3,4, С.П. Медведев1,2,3,4, А.С. Ветчинова5,
Ю.М. Минина1, С.Н. Иллариошкин5, С.М. Закиян1,2,3,4*
1 ФИЦ Институт цитологии и генетики СО РАН, 630090 Новосибирск,
Россия; электронная почта: Zakian@bionet.nsc.ru
2 Институт химической биологии и фундаментальной медицины СО РАН,
630090 Новосибирск, Россия
3 Национальный медицинский исследовательский центр им. ак. Е.Н. Мешалкина,
Минздрава России, 630055 Новосибирск, Россия
4 Новосибирский национальный исследовательский государственный университет,
630090 Новосибирск, Россия
5 Научный центр неврологии, 125367 Москва, Россия
Поступила в редакцию 14.10.2018
После доработки 11.11.2018
Принята к публикации 11.11.2018
Пациент специфичные индуцированные плюрипотентные стволовые клетки (ИПСК) представляют собой
перспективный источник для исследований патологических процессов и поиска методов их коррекции, по
скольку они способны к направленной дифференцировке в клетки релевантного типа. Однако в настоящий
момент не существует общепринятых стратегий использования клеточных линий в исследовании заболева
ний. Генетически кодируемые биосенсоры в режиме реального времени дают возможность регистрировать
активность ферментов, сигналы от специфических молекул и метаболитов и выражать эти показатели коли
чественно. Такой подход позволяет измерить вклад определенных молекул в развитие патологии. В представ
ленной работе описан процесс разработки универсальной клеточной платформы, предназначенной для изу
чения отдельных патологических процессов, характерных для нейродегенерации при боковом амиотрофи
ческом склерозе. Созданы конструкции, необходимые для встраивания в геном клеток генетически кодиру
емых биосенсоров, с помощью которых можно исследовать различные процессы: стресс эндоплазматичес
кого ретикулума (ЭПР), окислительный стресс, апоптоз и Ca2+ зависимую гипервозбудимость. Кроме того,
получена пара трансгенных линий ИПСК: с мутацией в гене SOD1 и условно здоровая контрольная линия,
которые несут встроенный трансактиватор для доксициклин управляемой экспрессии трансгенов и могут быть
использованы для встраивания большого количества различных биосенсорных конструкций за один шаг.
КЛЮЧЕВЫЕ СЛОВА: индуцируемые плюрипотентные стволовые клетки, биосенсоры, CRISPR/Cas9.
DOI: 10.1134/S0320972519030126
Феномен индуцированной плюрипотентнос
рой описали получение плюрипотентных ство
ти был открыт относительно недавно - в 2006 г.,
ловых клеток из фибробластов взрослой мыши
когда была опубликована работа, авторы кото
путем эктопической экспрессии четырех генов:
Принятые сокращения: ИПСК - индуцированные плюрипотентные стволовые клетки; ЭПР - эндоплазматичес
кий ретикулум; БАС - боковой амиотрофический склероз; SOD1 - супероксиддисмутаза 1 (superoxide dismutase 1); ПЦР -
полимеразная цепная реакция; ОТ ПЦР - полимеразная цепная реакция с обратной транскрипцией; CRISPR/Cas9 - ко
роткие палиндромные повторы, регулярно расположенные группами/CRISPR ассоциированный белок 9 (clustered regu
larly interspaced short palindromic repeats/CRISPR associated 9); PBS - фосфатно солевой буфер (phosphate buffered saline);
KLF4 - Круппель подобный фактор 4 (Kruppel like factor 4); GDF3 - фактор роста и дифференцировки 3 (growth differ
entiation factor 3); TDGF1 - фактор роста, полученный из тератокарциномы (teratocarcinoma derived growth factor 1);
DNMT3B - ДНК метилтрансфераза β (DNA methyltransferase 3 beta); hTERT - обратная транскриптаза теломеразы
(telomerase reverse transcriptase); PODXL - подокаликсин подобный белок (podocalyxin like); GAPDH - глицеральдегид 3
фосфатдегидрогеназа (glyceraldehyde 3 phosphate dehydrogenase); SSEA4 - стадиеспецифичный эмбриональный антиген 4
(stage specific embryonic antigen 4); PAX6 - ген окулоромбина (paired box 6); MAP2 - белок, ассоциированный с микротру
бочками (microtubule associated protein 2); FOXA2 - forkhead box A2, AFP - альфа фетопротеин (alpha fetoprotein); GFP -
зеленый флуоресцентный белок (green fluorescent protein); RFP - красный флуоресцентный белок (red fluorescent protein).
* Адресат для корреспонденции.
423
424
УСТЬЯНЦЕВА и др.
Oct4, Sox2, Klf4 и c=Myc [1]. Такие клетки были
Исследования БАС на животных модельных
названы индуцированными плюрипотентными
системах во многом помогли понять картину
стволовыми клетками (ИПСК). ИПСК челове
системных нарушений, которые развиваются в
ка были получены годом позже [2] и сразу прив
процессе дегенерации моторных нейронов, од
лекли к себе внимание в качестве системы для
нако они не позволяют исследовать патологи
изучения физиологических и патологических
ческие изменения нервной системы в режиме
процессов ввиду способности к самообновле
реального времени, от инициации до ранних,
нию и широкого спектра дифференцировки.
а затем и поздних стадий заболевания [18, 19].
Возможность получения ИПСК из соматичес
Технологии получения ИПСК от больных БАС,
ких клеток человека открыла новый путь для
совершенствование протоколов по направлен
изучения различных патологических состояний,
ной дифференцировке в моторные нейроны
чаще всего обусловленных генетическими мута
позволили разработать модельную систему для
циями.
изучения патологических особенностей нейро
С момента получения первых ИПСК челове
нов пациентов. Но большинство работ по изуче
ка был разработан ряд моделей заболеваний на
нию клеточных моделей ограничивается иссле
основе пациент специфичных ИПСК [3, 4].
дованием профилей экспрессии генов с после
Большинство из них - моногенные наслед
дующим поиском возможных ассоциаций [9]
ственные заболевания, хотя имеются и модели
или изучением определенных метаболических
спорадических мультифакторных заболеваний,
процессов [20, 21], что также не способствует ус
таких как болезнь Альцгеймера [5]. Важно отме
тановлению причинно следственных связей
тить, что в большинстве случаев полученные из
между процессами, приводящими к гибели мо
ИПСК специфические типы клеток воспроиз
торных нейронов.
водили патологический фенотип, доказывая
Генетически кодируемые биологические сен
лишний раз адекватность подобных модельных
соры представляют собой известные инструмен
систем [6-9].
ты для изучения биологических процессов. Они
Особый интерес представляет использова
позволяют в режиме реального времени регист
ние ИПСК для исследования нейродегенера
рировать сигнальные молекулы, метаболиты и
тивных заболеваний, характеризующихся неяс
активность ферментов в живых системах различ
ной этиологией, сложным патогенезом и, как
ной сложности: от культивируемых клеток до
следствие, отсутствием эффективных препара
трансгенных животных [22, 23]. В качестве непо
тов, предотвращающих гибель специфических
средственного сенсора обычно выступает белок,
нейронов. К таким заболеваниям относится бо
способный претерпевать конформационные из
ковой амиотрофический склероз (БАС), кото
менения в ответ на определенные стимулы [24],
рый морфологически характеризуется гибелью
приводящие к появлению репортерного сигнала:
центрального и периферического моторных
электрохимического, люминесцентного или флуо
нейронов [10]. Клинически на первый план вы
ресцентного, который может быть выражен коли
ходит прогрессирующий паралич скелетной
чественно. На основе флуоресцентных белков ре
мускулатуры и диафрагмы, что делает дыхатель
гулярно создаются генетически кодируемые био
ную недостаточность основной причиной смер
сенсоры, позволяющие исследовать протекание
ти больных [11]. Однако по совокупности кли
различных клеточных реакций в живых системах
нических особенностей, начиная от возраста
[25, 26]. Такие биосенсоры позволяют измерять
манифестации и скорости прогрессии симпто
активность основных патологических процессов,
мов и заканчивая наличием/отсутствием когни
сопровождающих гибель нейронов: апоптоз,
тивных нарушений, БАС является одним из са
окислительный стресс, стресс ЭПР, гипервозбу
мых гетерогенных среди нейродегенеративных
димость, и активно применяются для их исследо
заболеваний. На настоящий момент нет ясности
вания на моделях других заболеваний [27-29].
как в вопросах этиологии БАС, так и в механиз
мах патогенеза заболевания [12-14]. До 10%
случаев БАС имеют доказанный наследственный
МЕТОДЫ ИССЛЕДОВАНИЯ
характер, причем список генов, мутации в кото
рых приводят к развитию заболевания, состав
Конструкция плазмиды, кодирующей компоB
ляет >100 наименований [15]. Продукты этих ге
ненты CRISPR/Cas9. Плазмида, кодирующая
нов чаще всего связаны с обеспечением базовых
компоненты системы Cas9 и направляющую
клеточных процессов, таких как метаболизм
РНК для внесения двунитевого разрыва в локу
белков, РНК, внутриклеточный транспорт, ме
се AAVS1 (pX458 AAVS1), была сконструирована
ханизмы защиты клеток от активных форм кис
на основе pSpCas9(BB) 2A GFP
(«Addgene»
лорода [16, 17].
#48138, [30]). Для этого фрагмент, полученный
БИОХИМИЯ том 84 вып. 3 2019
ИССЛЕДОВАНИЕ НЕЙРОДЕГЕНЕРАЦИИ С ПОМОЩЬЮ БИОСЕНСОРОВ
425
путем отжига олигонуклеотидов sgAAVS1 F и
Донорные плазмиды pCasper3 BG donor и
sgAAVS1 R (табл. 1), был встроен в вектор по
pCasper3 GR donor были получены с помощью
сайтам рестрикции BbsI.
встраивания фрагментов Casper3 BG и Casper3
Сборка плазмидBдоноров для встраивания биоB
GR в pSpCas9 HF1 donor по сайтам рестрикции
логических сенсоров в геном. Сборку донорных
MluI и AflII.
плазмид осуществляли путем последовательно
Для создания плазмид pAAVS TRE CMV
го гидролиза плазмидных векторов эндонуклеа
GCaMP6f/m/s фрагменты GCaMP6f, GCaMP6m
зами рестрикции и лигирования фрагментов,
и GCaMP6s, полученные с помощью ПЦР, встра
полученных с помощью ПЦР амплификации
ивали в вектор pSpCas9 HF1 donor по сайтам
участков плазмид, последовательности которых
рестрикции MluI и AgeI.
находятся в открытом доступе (табл. 1).
Все плазмиды нарабатывали в штамме про
В плазмиду pBluescript SK(+) по сайтам
дуценте E. coli XL10 GOLD Kanr («Agilent»,
Acc65I и SpeI клонировали двухцепочечный оли
США). Выращивание трансформированных бак
гонуклеотид, содержавший сайты AflII и MluI,
терий осуществляли при 30 °С. Для проведения
который был получен ранее при отжиге двух од
ПЦР во всех случаях использовали высокоточ
ноцепочечных олигонуклеотидов: HM MCS U
ные ДНК полимеразы Q5® High Fidelity DNA
и HM MCS L (табл. 1). В результате была созда
Polymerase («New England Biolabs», США) или
на плазмида pBluescript SK(+) MCS, в которую по
Phusion™ Hot Start II High Fidelity DNA Polyme
сайтам SpeI и MluI встроили фрагмент HA R
rase («Thermo Fisher Scientific», США). Для кло
CMV. Затем между сайтами MluI и AflII в полу
нирования фрагментов применяли эндонуклеазы
ченную плазмиду, поместили фрагмент Cas9 HF1.
рестрикции производства «New England Biolabs»
Сигнал полиаденилирования bGHpolyA изме
(США), «Promega» (США) и «СибЭнзим» (Рос
нили на SV40poly(A) посредством замены соот
сия), а также T4 ДНК лигазу («Thermo Fisher
ветствующего фрагмента, ограниченного сайта
Scientific», США). Правильность сборки конструк
ми AgeI и AflII. На финальной стадии в получен
ций проверяли с помощью рестрикционного
ную конструкцию между сайтами Acc65I и AflII
анализа и секвенирования методом Сенгера.
поместили фрагмент HA L Puro.
Размораживание, культивирование и репрограмB
Последующие плазмиды конструировали на
мирование мононуклеарных клеток периферичесB
основе полученного вектора pSpCas9 HF1 donor
кой крови к плюрипотентному состоянию. Моно
посредством замены фрагмента плазмиды между
нуклеарные клетки крови больного наслед
сайтами рестрикции MluI и AgeI/AflII.
ственной формой БАС (мутация D90A в гене
Для создания плазмиды pXBP1 TagRFP ERSS
SOD1) были получены от пациента коллегами из
получили фрагмент XBP1, который клонирова
ФГБНУ «Научный центр неврологии» (Москва,
ли в вектор pGEM T Easy («Promega», США).
Россия) методом центрифугирования в градиен
Плазмидный вектор pGEM T Easy_XBP1 ис
те фиколла (1,077 г/мл; «Биолот», Россия). Мо
пользовали в качестве матрицы для амплифика
нонуклеары размораживали за пять дней до пе
ции фрагментов XBP1ΔDBD, XBP1_indel, кото
репрограммирования и культивировали в росто
рые затем поместили между сайтами NheI и
вой среде известного состава [31]. Клетки куль
Acc65I в вектор pcDNA 3.1/Hygro (-). Между
тивировали в CO2 инкубаторе при 37 °C, 5% CO2
сайтами Acc65I и AflII полученного вектора
и влажности 90%.
встроили фрагмент tagRFP. Итоговую плазмиду
Мононуклеары были перепрограммированы
использовали в качестве матрицы для ПЦР амп
к плюрипотентному состоянию посредством
лификации фрагментов XBP1 tagRFP, XBP1
трансформации набором эписомных векторов
tagRFP_indel, которые впоследствии были встав
(pCE hUL, pCE hSK, pCE hOCT3/4, pCE
лены в вектор pSpCas9 HF1 donor по сайтам
mp53DD, pCE GFP, pCXB EBNA 1 («Addgene»
рестрикции MluI и AgeI.
#41855 58, #41813 14)) методом электропорации
Для создания плазмид pCyto Grx1 roGFP2
на приборе Neon Trans fection System («Thermo
donor и pMito Grx1 roGFP2 donor с помощью
Fisher Scientific», США), согласно опубликован
ПЦР получили фрагменты Cyto Grx1 roGFP2 и
ному ранее протоколу [32]. Первичные колонии
Mito Grx1 roGFP2 соответственно, которые за
ИПСК механически пересаживали на слой эмб
тем клонировали в вектор pSpCas9 HF1 donor
риональных фибро бластов мыши (фидер) или
по сайтам рестрикции MluI и AgeI. Донорные
искусственный матрикс Matrigel («Corning»,
плазмиды pCyto roGFP2 Orp1 donor и pMito
США) на 20-30 й день перепрограммирования.
roGFP2 Orp1 donor были сконструированы пу
Для культивирования на фидере использовали
тем встраивания фрагментов Cyto roGFP2 Orp1
ростовую среду известного состава [33], на искус
и Mito roGFP2 Orp1 по сайтам рестрикции
ственном матриксе - ростовую среду Е8 («Thermo
MluI и AgeI в вектор pSpCas9 HF1 donor.
Fisher Scientific», США).
БИОХИМИЯ том 84 вып. 3 2019
426
УСТЬЯНЦЕВА и др.
Таблица 1. Фрагменты, использованные для конструкции донорных плазмид
Название
Содержимое фрагмента
Источник и праймеры для ПЦР, 5'-3'
1
2
3
sgAAVS1 F
-
CACCGGTCACCAATCCTGTCCCTAG
sgAAVS1 R
-
AAACCTAGGGACAGGATTGGTGACC
HM MCS U
полилинкер
CGGCGCGCCCTTAAGGTTAACACGCGTGGCGCGCCA
HM MCS L
полилинкер
CTAGTGGCGCGCCACGCGTGTTAACCTTAAGGGCGC
GCCGGTAC
HA R CMV
правое плечо гомологии к ло
Puro Cas9 donor («Addgene» #58409, [38]),
кусу AAVS1 (HA R), промотор
ACGCGTGGCGATCTGACGGTTCACT,
TRE minCMV
ACTAGTAGAGCAGAGCCAGGAACC
Cas9 HF1
SpCas9 HF1, SV40 NLS,
VP12 («Addgene» #72247, [39]),
эпитоп 3хFLAG, bGHpoly(A)
ACGCGTGCCACCATGGATAAAAAG,
CTTAAGCCATAGAGCCCACCGCA
SV40poly(A)
SV40poly(A)
pcDNA 3.1/Hygro (-),
GCAACCGGTACGAGATTTCGATTCCACCG,
CAGCTTAAGTAAGATACATTGATGAGTTTG
HA L Puro
левое плечо гомологии
Puro Cas9 donor («Addgene» #58409, [38]),
к локусу AAVS1 (HA L), ген
GGTACCTGCTTTCTCTGACCAGCATT,
устойчивости к пуромицину с
CTTAAGCCATAGAGCCCACCGCAT
сайтом полиаденилирования
bGHpoly(A)
XBP1
фрагмент XBP1, содержащий
кДНК, полученная методом ОТ ПЦР с использованием
стресс чувствительный интрон
РНК из тканей головного мозга человека,
GCGCGGTGCGTAGTCTGGAGC,
GGTATATATGTGGTCAAAACG
XBP1ΔDBD, XBP1_indel
сплайсированный и несплай
pGEM T Easy_XBP1, CAAGCTAGCGCCACCATGGACTA
сированный варианты XBP1
CAAAGACGATGACGACAAGGAGAAAACTCATGGCCTTG
TAGTTGAG,
AATGGTACCCCCTAAGTCAATACCGCCAGAATCC
TagRFP
TagRFP без старт кодона
pTagRFP N («Евроген», Россия),
GTCGGTACCGTGTCTAAGGGCGAAGAGCTG,
GCGCTTAAGTTAATTAAGCTTGTGCCCCA
XBP1 TagRFP, XBP1
XBP1, TagRFP
pCMV XBP1 TagRFP, pCMV XBP1 TagRFP_indel,
TagRFP_indel
CTGACGCGTGCCACCATGGACTACAAAG,
CGCACCGGTTCAATTAAGTTTGTGCCCCA
Cyto Grx1 roGFP2
Grx1 roGFP2
pLPCX cyto Grx1 roGFP2 («Addgene» #64975 [22]),
ACCACGCGTGCCACCATGGCTCAAGAGTTTGTGAAC,
TTTACCGGTTTACTTGTACAGCTCGTCC
Mito Grx1 roGFP2
Grx1 roGFP2, сигнальная
pLPCX mito Grx1 roGFP2 («Addgene» #64977, [22]),
последовательность (субъеди
GACACGCGTGCCACCATGGCCTCCACTCGTGTCCTC,
ница ATP синтазы 9)
TTTACCGGTTTACTTGTACAGCTCGTCC
Cyto roGFP2 Orp1
roGFP2 Orp1
pLPCX roGFP2 Orp1 («Addgene» #64991, [40]),
GACACGCGTGCCACCATGGTGAGCAAGGGCGAGGAG,
TTTACCGGTCTATTCCACCTCTTTCAAAAG
Mito roGFP2 Orp1
roGFP2 Orp1, сигнальная
pLPCX mito roGFP2 Orp1 («Addgene» #64992, [40]),
последовательность (субъеди
GACACGCGTGCCACCATGGCCTCCACTCGTGTCC,
ница ATP синтазы 9)
TTTACCGGTCTATTCCACCTCTTTCAAAAG
БИОХИМИЯ том 84 вып. 3 2019
ИССЛЕДОВАНИЕ НЕЙРОДЕГЕНЕРАЦИИ С ПОМОЩЬЮ БИОСЕНСОРОВ
427
Окончание табл. 1
1
2
3
Casper3 BG
BFP, tagGFP2, сайт гидролиза
pCasper3 BG («Евроген», Россия),
каспазой 3
CCAACGCGTGCCACCATGAGCGAGCTGAT,
CGCCTTAAGATACATTGATGAGTTTGGAC
Casper3 GR
tagGFP2, RFP, сайт гидролиза
pCasper3 GR («Евроген», Россия),
каспазой 3
CCAACGCGTGCCACCATGGTGAGCGAGCT,
CGCCTTAAGATACATTGATGAGTTTGGAC
GCaMP6f
кальмодулин_fast, GFP,
pAAV.Syn.GCaMP6f.WPRE.SV40 («Addgene» #100837, [29]),
кальмодулин связывающий
GATACGCGTGCCACCATGGGTTCTCATCATC,
пептид
GATACCGGTTCACTTCGCTGTCATCATTTGTAC
GCaMP6m
кальмодулин_medium, GFP,
pAAV.Syn.GCaMP6m.WPRE.SV40 («Addgene» #100841,[29]),
кальмодулин связывающий
GATACGCGTGCCACCATGGGTTCTCATCATC,
пептид
GATACCGGTTCACTTCGCTGTCATCATTTGTAC
GCaMP6s
кальмодулин_slow, GFP,
pAAV.Syn.GCaMP6s.WPRE.SV40 («Addgene» #100843, [29]),
кальмодулин связывающий
GATACGCGTGCCACCATGGGTTCTCATCATC,
пептид
GATACCGGTTCACTTCGCTGTCATCATTTGTAC
Спонтанная дифференцировка in vitro. Для
от несвязавшихся антител PBS при комнатной
спонтанной дифференцировки клетки наращи
температуре. Для окрашивания ядер препара
вали до 85-90% ной конфлюэнтности, диссо
тов использовали 4',6 диамидино 2 фенилин
циировали от поверхности культуральной ем
дол (DAPI, «Sigma Alrich», США) в концентра
кости, инкубируя с коллагеназой IV типа («Sigma
ции 1 мкг/мл в PBS. Анализ препаратов произ
Aldrich», США) в течение 20-30 мин при 37 °С.
водили на флуоресцентном микроскопе Nikon
Затем полученные агрегаты клеток аккуратно
Eclipse Ti E («Nikon», Япония).
переносили в культуральную емкость, покры
Выделение РНК, синтез кДНК и ОТBПЦР.
тую слоем 1% ной агарозы, для предотвращения
РНК из клеток выделяли с помощью TRIzol
прикрепления клеток и образования эмбриоид
reagent («Thermo Fisher Scientific», США) по про
ных телец (ЭТ). Клетки культивировали в виде
токолу производителя. Для очистки образцов
эмбриоидных телец (ЭТ) в среде без основного
РНК от контаминации геномной ДНК исполь
фактора роста фибробластов (basic fibroblast
зовали набор реагентов DNA free («Ambion»,
growth factor, bFGF) в течение двух недель, пос
США). Полученную РНК хранили при -70 °С и
ле чего распластывали на поверхности культу
использовали для синтеза кДНК методом обрат
ральных планшетов, покрытых желатином, и
ной транскрипции с помощью набора Super
культивировали еще две недели.
Script II («Thermo Fisher Scientific», США) по
Иммунофлуоресцентное окрашивание. Для
протоколу производителя. ОТ ПЦР на выявле
иммунофлуоресцентного окрашивания клетки
ние экспрессии маркеров плюрипотентности и
дважды промывали фосфатно солевым буфером
тканеспецифичных маркеров проводили, исполь
(PBS), фиксировали в 4% ном растворе фор
зуя праймеры и условия реакции, описанные ра
мальдегида в течение 10 мин, затем отмывали
нее [1].
PBS 2 раза по 15 мин. Пермеабилизацию прово
Анализ кариотипа. Анализ кариотипа полу
дили при комнатной температуре с помощью
ченных линий ИПСК проводили, как описано
0,5% ного раствора Triton X 100 в течение 30 мин,
ранее [34].
затем снова дважды отмывали PBS по 15 мин.
Электропорация ИПСК. Для ИПСК, расту
Далее лунки с клетками инкубировали при ком
щих на слое фидера, первоначально осущест
натной температуре в течение 30 мин с блокиру
вляли перевод клеточной культуры на искус
ющим буфером (раствор бычьего сывороточно
ственный матрикс. За 24 ч до трансфекции клет
го альбумина в PBS, 10 мг/мл). Инкубацию с
ки пересаживали на новый матрикс в соотноше
первичными антителами проводили при 4 °С в
нии 1 : 3...1 : 4. В день трансфекции клетки сни
течение ночи, со вторичными антителами - при
мали диссоциирующим реагентом TrypLE («Ther
комнатной температуре 1,5-2 ч. После инкуба
mo Fisher Scientific», США), ресуспендировали
ции с первичными и вторичными антителами
до одноклеточного состояния в PBS, центрифу
препараты клеток дважды по 15 мин отмывали
гировали в течение 5 мин при 200 g. Из расчета
БИОХИМИЯ том 84 вып. 3 2019
428
УСТЬЯНЦЕВА и др.
конечной концентрации 0,5 × 107 клеток/мл их
клеток, в которых произошла CRISPR опосре
ресуспендировали в буфере R (Neon Transfection
дованная вставка трансгена в целевой сайт, бы
System 100ul Kit, «Thermo Fisher Scientific», США),
ли использованы праймеры, представленные в
добавляли 2 мкг pX458 AAVS1 и 3 мкг AAVS
табл. 2.
Neo M2rtTA («Addgene» #60843, [35]). Электро
порацию проводили в 100 мкл при следующих
параметрах электрического импульса: 1100 V,
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
30 мс, 1 импульс. После электропорации клетки
переносили в подготовленные культуральные
Создание донорных плазмид, кодирующих поB
планшеты с подогретой ростовой средой, содер
следовательности биосенсоров. В результате ра
жавшей 10 нг/мл ингибитора Rho ассоциирован
боты был создан ряд плазмидных донорных век
ной протеинкиназы (Y 27632, «Sigma Aldrich»,
торов, предназначенных для встраивания после
США). Среду меняли через 4 ч после электропо
довательностей биосенсоров в локус AAVS1:
рации на свежую с добавлением Y 27632.
pXBP1 TagRFP ERSS, pCyto Grx1 roGFP2 do
Отбор субклонов ИПСК на селективной среде.
nor, pMito Grx1 roGFP2 donor, pCyto roGFP2
Для поиска желаемых вставок проводили куль
Orp1 donor, pMito roGFP2 Orp1 donor, pCasper3
тивирование ИПСК на селективной среде, со
BG donor, pCasper3 GR donor, pAAVS TRE
державшей антибиотик - сульфат неомицина
CMV GCaMP6f/m/s. Каждый биосенсор содер
(«Thermo Fisher Scientific», США). Концентра
жит плечи гомологии к локусу AAVS1, необходи
цию антибиотика подбирали для каждой линии
мые для встраивания конструкции посредством
клеток методом титрования. Селекцию прово
гомологичной рекомбинации (табл. 3).
дили в течение 5 дней. Через 24-48 ч после от
Перепрограммирование пациентBспецифичных
мены антибиотика проводили механическое вы
мононуклеарных клеток крови и характеристика
деление устойчивых колоний ИПСК с их после
ИПСК. В течение первых четырех недель после
дующим переносом в отдельные лунки культу
электропорации мононуклеарных клеток пери
ральных планшетов для культивирования и ана
ферической крови было получено 13 первичных
лиза.
колоний ИПСК: две - в условиях xeno free (в от
Анализ субклонов и отбор субклонов, содержаB
сутствие биологических компонентов животно
щих целевую вставку. Выделение геномной ДНК
го происхождения, в среде с химически опреде
из клеток осуществляли с помощью реагента
ленным составом), 11 - на слое фидера. Клетки
Quick Extract DNA Extraction Solution («Epicentre»,
полученных линий ИПСК отличались характер
США) по протоколу производителя, и выделен
ной для плюрипотентных клеток высокой ско
ную ДНК хранили при -20 °С. ПЦР проводили
ростью пролиферации, большим ядерно цито
с реагентом БиоМастер HS Taq ПЦР Color (2×)
плазматическим соотношением и морфологией
(«Биолабмикс», Россия). Для выявления клонов
колоний, схожей с морфологией эмбриональ
Таблица 2. Праймеры для идентификации встраивания
Праймер
Последовательность (5'-3')
Комментарий
AAVS1_WT F
CTCTGGCTCCATCGTAAGCAA
длина продукта - 555 п.н.
AAVS1_WT R
CCCAAAGTACCCCGTCTCCC
амплификация аллеля дикого типа, без целевой вставки
HA_L OUT
CCGGACCACTTTGAGCTCTAC
отжиг вне плеча гомологии, необходим для определения правиль
ности позиции вставки
Neo_in R
GCCCAGTCATAGCCGAATAG
+ HA_L OUT, длина продукта - 1042 п.н., определение позиции
вставки
+ HA_L F1, длина продукта - 461 п.н., определение наличия
вставки
HA_L F1
CTGTGGATTCGGGTCACCTC
отжиг внутри плеча гомологии
M13 R
CAGGAAACAGCTATGAC
+Neo_in R, длина продукта - 1063 п.н., определение наличия
дополнительных нецелевых вставок плазмиды в геном
БИОХИМИЯ том 84 вып. 3 2019
ИССЛЕДОВАНИЕ НЕЙРОДЕГЕНЕРАЦИИ С ПОМОЩЬЮ БИОСЕНСОРОВ
429
Таблица 3. Генетически кодируемые биосенсоры и сфера их применения
Название
Мишень
Область исследований
pXBP1 TagRFP ERSS
XBP1 - индикатор стресса ЭПР
нейродегенеративные заболевания [28], болезнь
Крона [27]
pCyto Grx1 roGFP2 donor,
roGFP2 Grx1 - сенсор окислительного
онкологические заболевания, диабет [36]
pMito Grx1 roGFP2 donor
потенциала глутатиона
pCyto roGFP2 Orp1 donor,
roGFP2 Orp1 - сенсор окислительной
хронические воспалительные заболевания [37]
pMito roGFP2 Orp1 donor
активности H2O2
pCasper3 BG donor,
каспаза 3 - эффекторный белок
роль апоптоза в дегенеративных заболеваниях
pCasper3 GR donor
апоптоза
pAAVS TRE CMV
Ca2+ зависимая гипервозбудимость
исследование возбудимости специфических
GCaMP6f/m/s
типов клеток, в т.ч. нейронов [29]
ных стволовых клеток, экспрессировали эндо
нов линии iMA_1L имеют интактный протоспей
генную щелочную фосфатазу и основные мар
сер в сайте AAVS1 на гомологичной хромосоме.
керы плюрипотентных клеток (рис. 1, а). При
Поиск дополнительных нецелевых вставок доB
спонтанной дифференцировке полученных кле
норной плазмиды в геном. Поскольку плазмиды
ток образуются производные трех зародышевых
имеют склонность к случайной интеграции в ге
листков (рис. 1, б). Таким образом, было показа
ном, необходимо было удостовериться, что по
но, что ИПСК являются плюрипотентными по
лученные субклоны не имеют дополнительных
статусу экспрессии основных маркеров плюри
вставок донорной плазмиды, которые потенци
потентности, а также способны давать произ
ально могут оказывать влияние на проявление
водные трех зародышевых листков при спонтан
фенотипических признаков патологии в паци
ной дифференцировке in vitro. Анализ кариоти
ент специфичных ИПСК/контрольных ИПСК.
па полученных линий на 10 м пассаже показал
Была подобрана пара праймеров для ПЦР
отсутствие хромосомных перестроек (рис. 1, в).
амплификации неинтегрирующегося участка
Клетки сохраняют особенности генотипа доно
донорной плазмиды. В результате анализа бы
ра, содержат однонуклеотидную замену в чет
ло обнаружено, что субклоны sc 4, sc 11, sc 3.2,
вертом экзоне гена SOD1, которая приводит к
sc 6.2 линии iMA_1L и sc 7, sc 12, sc 16, sc 27 ли
замене Asp на Ala в 90 й позиции (рис. 1, г).
нии 1M_iALS имеют дополнительные вставки
Внесение последовательности трансактиватоB
в геном, а субклоны sc 17, sc 19.2, sc 24.2 линии
ра для доксициклинBуправляемой экспрессии в лоB
iMA_1L и sc 2, sc 17 линии 1M_iALS - нет
кус AAVS1 при помощи CRISPR/Cas9. В локус
(рис. 2, а и б).
AAVS1 пациент специфичных ИПСК (линия
1M_iALS) и условно здоровых контрольных
ИПСК (линия iMA_1L) при помощи CRISPR/
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Cas9 была встроена последовательность транс
активатора для доксициклин управляемой экс
Ранее на различных модельных системах бы
прессии. В результате трансфекции каждой ли
ло показано, что стресс ЭПР, окислительный
нии ИПСК с последующей селекцией было по
стресс, апоптоз и гипервозбудимость нейронов
лучено 23-32 субклонов, которые были проана
играют основную роль в патофизиологии БАС.
лизированы на наличие встроенного трансакти
Тем не менее выявить вклад каждого из компо
ватора и корректность его положения в сайте
нентов в инициацию и развитие заболевания не
AAVS1. Все полученные субклоны содержали
представлялось возможным вследствие отсутствия
вставку в целевом сайте. Однако для того, чтобы
подходящих методов для исследования. В дан
полученные линии были пригодны для встраи
ной работе были получены конструкции, кото
вания последовательностей биосенсоров, про
рые кодируют биосенсоры, предназначенные
тоспейсер для CRISPR/Cas9 в локусе AAVS1 на
для детекции патологических процессов в жи
гомологичной хромосоме должен быть неизме
вых клетках (табл. 3). Представленный способ
ненным. Секвенирование участка локуса AAVS1,
создания плазмидных векторов универсален, и на
содержавшего протоспейсер, показало, что
его основе можно создавать биосенсоры других
шесть субклонов линии 1M_iALS и семь субкло
клеточных процессов (рис. 3, а). Последова
БИОХИМИЯ том 84 вып. 3 2019
430
УСТЬЯНЦЕВА и др.
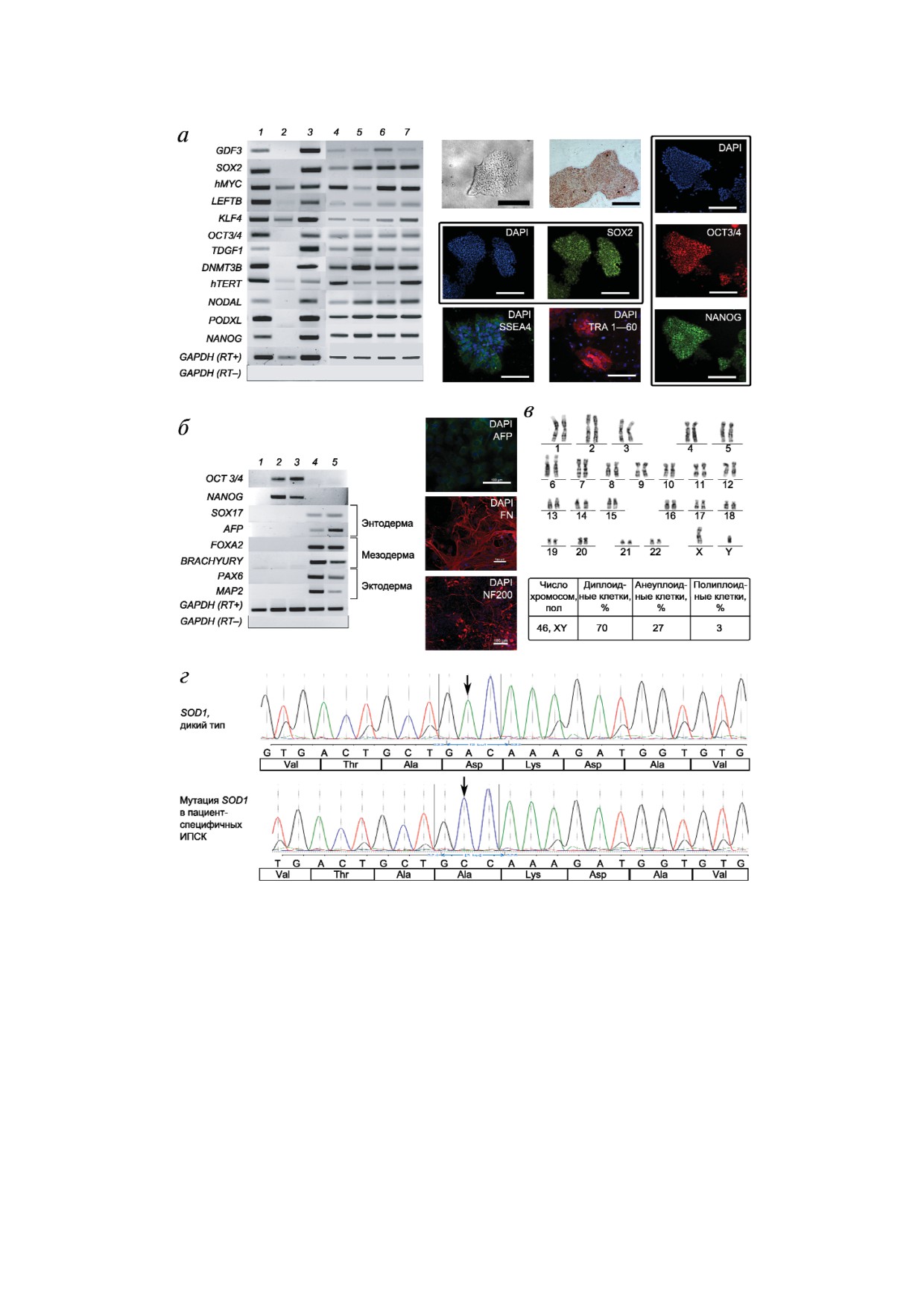
Рис. 1. Характеристика полученных пациент специфичных линий ИПСК. а - Слева - ОТ ПЦР анализ транскрипции ге
нов - маркеров плюрипотентности в пяти линиях ИПСК: 1 - положительный контроль (кДНК эмбриональных стволо
вых клеток линии HUES9); 2 - отрицательный контроль (кДНК мононуклеарных клеток крови); 3-7 - линии ИПСК:
1M_iALS, 2g_iALS, 1g_iALS, 2M_iALS, 3M_iALS соответственно. Показано наличие экспрессии генов транскрипцион
ных факторов: SOX2, hMYC, KLF4, OCT 3/4, NANOG, и различных регуляторных белков: GDF3, LEFTB, TDGF1, DNMT3B,
hTERT, NODAL, PODXL. GAPDH (RT+) - положительный контроль реакции обратной транскрипции, GAPDH (RT-) -
контроль на наличие контаминации геномной ДНК; справа - морфология колоний ИПСК, экспрессия эндогенной ще
лочной фосфатазы, иммунофлуоресцентное окрашивание колоний ИПСК антителами к белкам транскрипционных фак
торов SOX2, OCT3/4, NANOG и поверхностным антигенам SSEA4 и TRA 1 60 (линия 1М_iALS). Ядра окрашены DAPI.
Увеличение ×10, масштабная линейка - 250 мкм; б - спонтанная дифференцировка in vitro. ОТ ПЦР анализ транскрип
ции генов - маркеров производных эктодермы (PAX6, MAP2), мезодермы (FOXA2, BRACHYURY), энтодермы (AFP, SOX17):
1 - кДНК мононуклеарных клеток крови; 2, 3 - кДНК линий ИПСК 1M_iALS и 3M_iALS; 4, 5 - кДНК эмбриоидных телец,
полученных из 1M_iALS и 3M_iALS соответственно. Иммунофлуоресцентное окрашивание, демонстрирующее экспрессию
производных трех зародышевых листков: энтодермы (α фетопротеин, AFP), мезодермы (фибронектин, FN), эктодермы
(нейрофиламент 200, NF200). Ядра окрашены DAPI. Масштабная линейка - 100 мкм; в - кариотип линии 2M_iALS;
г - электрофореграмма участка экзона 4 гена SOD1, подтверждающая наличие однонуклеотидной замены в ИПСК
БИОХИМИЯ том 84 вып. 3 2019
ИССЛЕДОВАНИЕ НЕЙРОДЕГЕНЕРАЦИИ С ПОМОЩЬЮ БИОСЕНСОРОВ
431
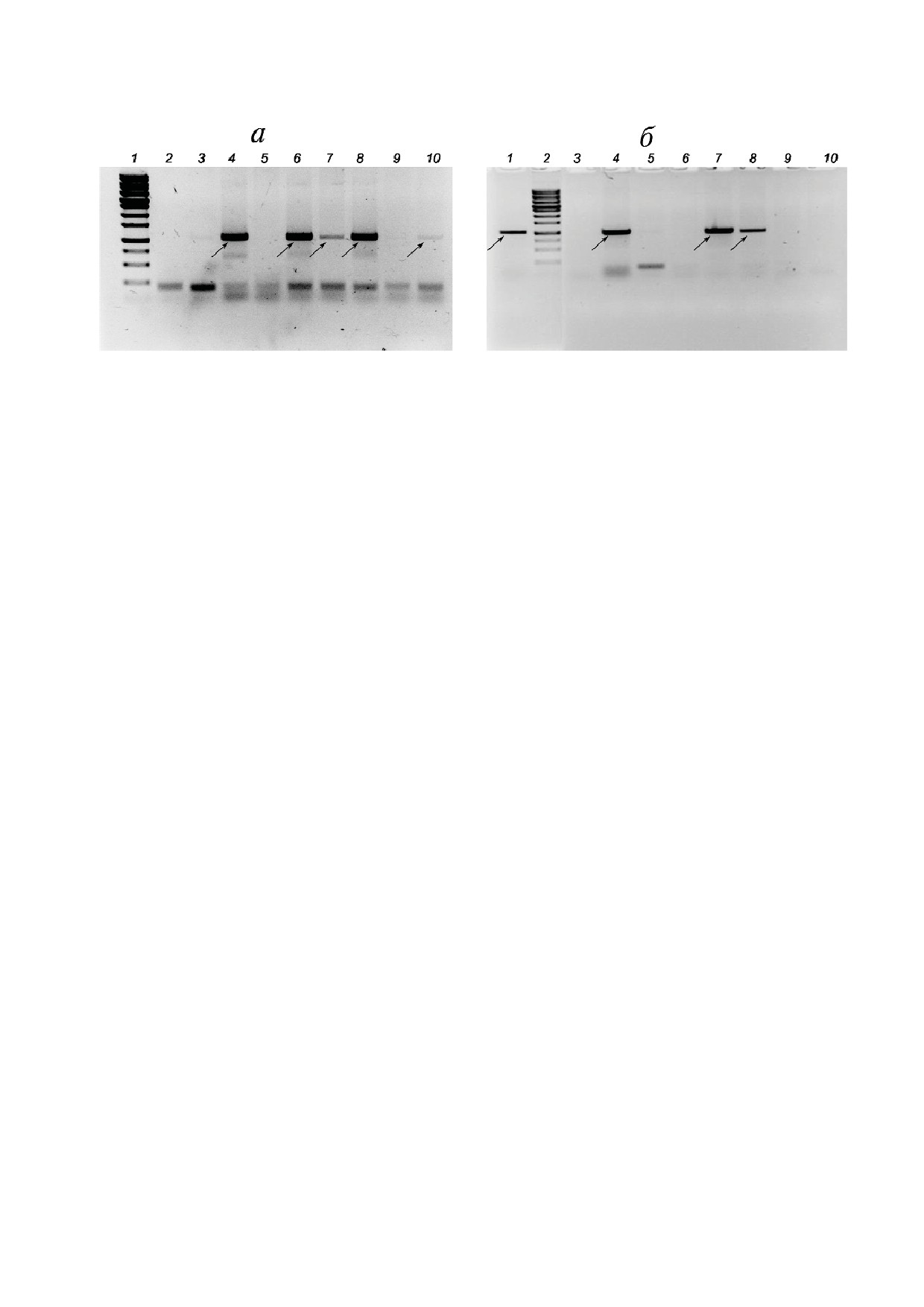
Рис. 2. ПЦР анализ субклонов на наличие дополнительной случайной интеграции плазмиды в геном. a - Анализ субкло
нов линии 1M_iALS: 1 - ДНК маркер (Sky High, «Биолабмикс», Россия); 2 - вода; 3 - отрицательный контроль (геном
ная ДНК исходной линии, не содержащая вставки); 4 - положительный контроль (плазмидная ДНК, использованная в
качестве донора для гомологичной рекомбинации); 5-10 - субклоны линии 1M_iALS, содержащие целевую вставку в ло
кусе AAVS1: № 2, 7, 12, 16, 17 и 27 соответственно; б - анализ субклонов линии iMA_1L: 1 - положительный контроль
(плазмидная ДНК, использованная в качестве донора для гомологичной рекомбинации); 2 - ДНК маркер (Sky High,
«Биолабмикс», Россия); 3 - отрицательный контроль (геномная ДНК исходной линии, не содержащая вставки); 4-10 -
субклоны линии 1M_iALS, содержащие целевую вставку в локусе AAVS1: № 4, 11, 17, 3.2, 6.2, 19.2 и 24.2 соответственно.
Стрелками отмечен целевой продукт длиной 1063 п.н.
тельность плазмидного донора построена таким
числом хромосом. Перестроек или аберрантных
образом, что протоспейсер для CRISPR/Cas9,
хромосом не обнаружено. Выявленная анеуплои
который используется для создания двухцепо
дия некоторых клеток связана, скорее всего, с
чечного разрыва в целевом сайте, отсутствует в
приготовлением препаратов.
структуре встраивающейся части плазмиды, что
Полученные пациент специфичные ИПСК,
предотвращает как гидролиз самой донорной
наравне с контрольными ИПСК линии iMA_1L,
последовательности, так и последующий гидро
были использованы для создания трансгенных
лиз вставки в геноме.
линий, несущих вставку трансактиватора для
Данные биосенсоры можно использовать и
доксициклин управляемой экспрессии, а также
для изучения патологических процессов, проте
ген устойчивости к неомицину. Интеграция дан
кающих в моторных нейронах, полученных от
ной конструкции была произведена с помощью
больных нейродегенеративными заболевания
CRISPR/Cas9 индуцируемого разрыва в локусе
ми, такими как БАС. Тем не менее для проведе
AAVS1, который относится к локусам «Safe har
ния подобных исследований необходима уни
bour» в геноме, и, следовательно, вставки в дан
версальная клеточная платформа, из которой
ный участок не влияют на функционирование
возможно генерировать систему для исследова
клетки [36]. В результате были получены субкло
ния патологии в один шаг (рис. 3, б, в). В пред
ны пациент специфичных ИПСК линии 1M_iALS
ставленной работе описано получение такой сис
и контрольных ИПСК линии iMA_1L, толерант
темы, состоящей из пары линий ИПСК: паци
ные к содержанию неомицина в ростовой среде.
ент специфичной линии, полученной от донора,
Среди отобранных субклонов только малая часть
больного БАС, и условно здоровой контроль
содержала интактный протоспейсер CRISPR/Cas9
ной линии, уже содержащих вставку трансакти
на гомологичной хромосоме, что необходимо
ватора для доксициклин управляемой экспрес
для последующего внесения конструкций, ко
сии трансгенов (рис. 3, г). Для создания паци
дирующих биосенсоры.
ент специфичной линии ИПСК были исполь
Для поиска субклонов, у которых отсутству
зованы мононуклеарные клетки периферичес
ют дополнительные интеграции плазмиды в ге
кой крови пациента с наследственной формой
ном, был использован метод ПЦР. Известно,
БАС, которые имеют мутацию D90A в гене
что лишь часть донорной плазмиды должна ин
SOD1. ИПСК демонстрируют характерную мор
тегрироваться в геном, если имеют место только
фологию, свойственную стволовым клеткам,
целевые события. Следовательно, спустя опре
экспрессируют основные маркеры плюрипотент
деленное время после трансфекции будет не
ности и способны давать производные трех за
возможно детектировать те фрагменты плазми
родышевых листков при спонтанной дифферен
ды, которые не должны встраиваться в геном.
цировке. Хромосомный набор линий ИПСК
При трансфекции было использовано 6 мкг
стабилен, преобладают клетки с диплоидным
(963,3 фмоль) pTA_donor на 106 клеток. При усло
БИОХИМИЯ том 84 вып. 3 2019
432
УСТЬЯНЦЕВА и др.
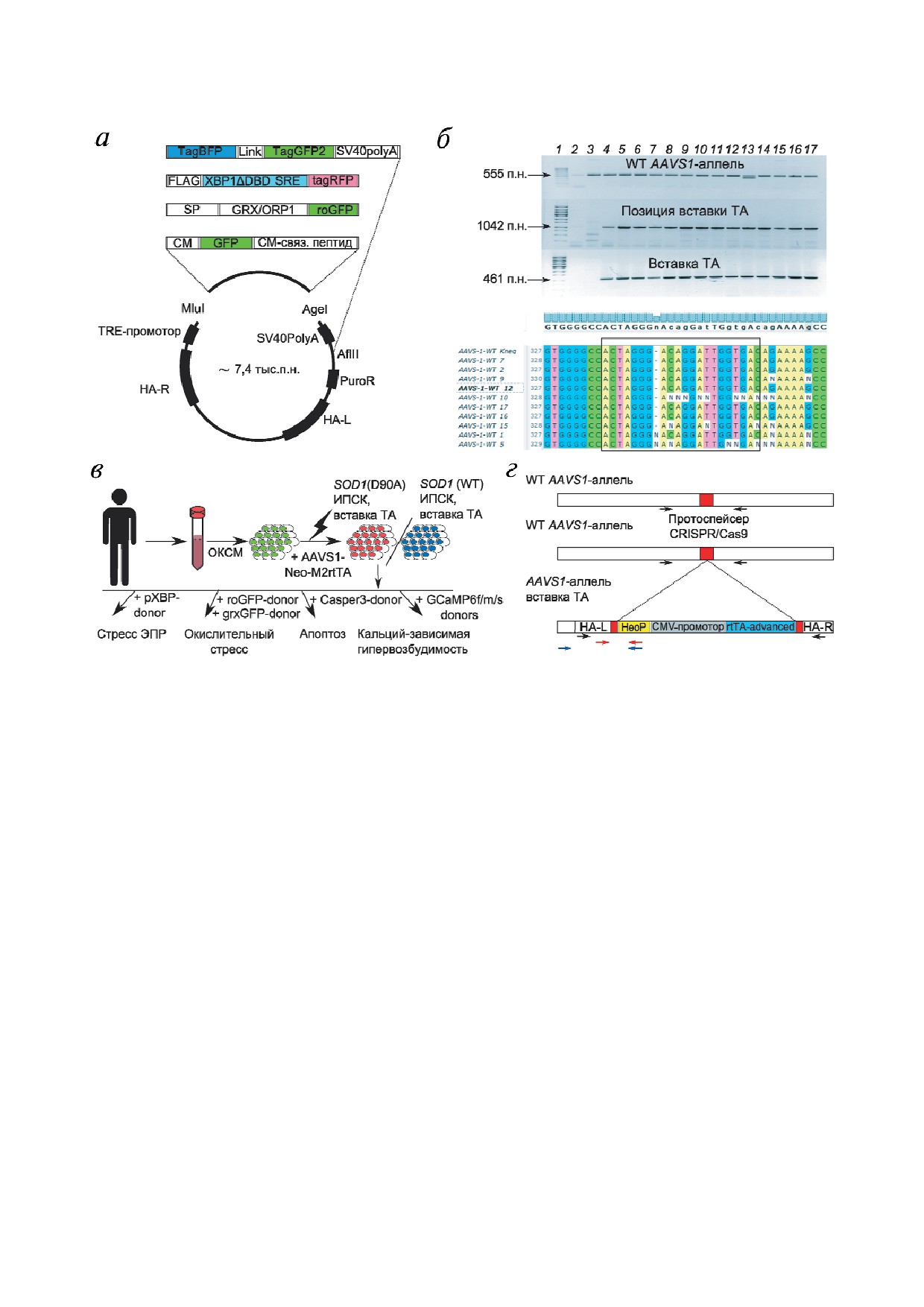
Рис. 3. Создание универсальной клеточной платформы для исследования нейродегенерации. Обозначения: WT - дикий
тип, ТА - трансактиватор для доксициклин управляемой экспрессии трансгенов; а - схема строения полученных донор
ных плазмид. Показана общая для всех доноров основа, содержащая плечи гомологии к локусу AAVS1 (HA R, HA L), про
мотор TRE (Tetracyclin responsive element) и ген устойчивости к пуромицину, и вариативная часть, содержащая функцио
нальные элементы биосенсора. XBP1ΔDBD - участок гена XBP1, SRE - stress responsive element, SP - signal peptide, сиг
нальный пептид (для плазмид pMito Grx1 roGFP2 donor, pMito roGFP2 Orp1 donor) - субъединица АTP синтазы 9,
Link - сайт гидролиза каспазой 3, CM - кальмодулин; б - ПЦР анализ субклонов 1M_iALS на предмет наличия вставки,
корректности ее положения в локусе AAVS1: 1 - ДНК маркер (панели «WT AAVS1 аллель» и «Вставка TA» - Step 100,
«Биолабмикс», Россия; панель «Позиция вставки TA» - Sky High, «Биолабмикс», Россия); 2 - вода; 3 - отрицательный
контроль - исходная линия ИПСК без вставки; 4-17 - субклоны 1M_iALS. Под электрофореграммой приведены резуль
таты секвенирования локуса AAVS1 гомологичной хромосомы. Рамкой отмечена область протоспейсера CRISPR/Cas9.
Показано, что некоторые субклоны имеют мутации - результат внесенного двунитевого разрыва, исправленного с поте
рей нуклеотидов; в - стратегия использования полученной клеточной платформы для исследования БАС. ОКСМ - фак
торы перепрограммирования OCT3/4, KLF4, SOX2, MYC; г - структура локуса AAVS1 полученных трансгенных линий
ИПСК. Показана вставка последовательности трансактиватора для доксициклин управляемой экспрессии трансгенов и
разрушенный протоспейсер в одном аллеле и интактный протоспейсер в другом аллеле. Стрелки черного цвета - прай
меры для ПЦР амплификации продукта дикого типа AAVS1; стрелки красного цвета - праймеры для ПЦР амплифика
ции фрагмента вставки для подтверждения ее наличия; стрелки синего цвета - праймеры для ПЦР амплификации фраг
мента вставки и локуса AAVS1 для подтверждения корректности позиции встраивания; НеоР - ген устойчивости к неоми
цину, rtTA advanced - вариант трансактиватора для доксициклин управляемой экспрессии
вии, что все копии плазмиды попадают внутрь
четах авторы принимают, что все плазмиды бы
клетки при электропорации, и учитывая размер
ли доставлены внутрь клетки. Если принять, что
плазмиды 10 080 п.н., получается, что на одну
при каждом делении количество плазмиды в
клетку приходилось (963,3 × 10-15 моль × 6,022 ×
клетке уменьшается в 2 раза, то полная ее эли
минация произойдет не позднее, чем через log2
calculator.neb.com/#!/dsdnaamt). Но, поскольку
5,8 × 105 = 19,146...20,000 делений клетки, или
в условиях эксперимента невозможно опреде
через ~2 недели культивирования [37]. В резуль
лить реальную долю плазмид, которые проник
тате анализа были обнаружены два субклона ли
ли внутрь клетки, в представленных далее рас
нии 1M_iALS и три субклона линии iMA_1L,
БИОХИМИЯ том 84 вып. 3 2019
ИССЛЕДОВАНИЕ НЕЙРОДЕГЕНЕРАЦИИ С ПОМОЩЬЮ БИОСЕНСОРОВ
433
содержавшие единственную вставку трансакти
ма РАН «Фундаментальные исследования для био
ватора в целевом сайте и не содержавшие допол
медицинских технологий» (проект № 0324 2018
нительных интеграций в геном.
0042) в части конструирования плазмид доноров,
В итоге мы получили универсальную клеточ
кодирующих последовательности биосенсоров.
ную платформу, которая имеет в составе как
опытную линию ИПСК с патологической мута
Конфликт интересов
цией в гене SOD1, так и контрольную линию. Из
описанных клеточных линий за один шаг можно
Авторы заявляют об отсутствии конфликта
создавать клеточные линии с встроенными био
интересов.
логическими сенсорами, необходимыми для ис
следования ряда патологических процессов,
Соблюдение этических норм
связанных с нейродегенерацией. Данная систе
ма позволяет исследовать тонкие нарушения,
Все процедуры, выполненные в исследова
возникающие в моторных нейронах больного,
нии с участием людей, соответствуют этическим
переводить полученные от биосенсоров флуо
стандартам Хельсинкской декларации 1964 г. и
ресцентные сигналы в количественное выраже
ее последующим изменениям или сопостави
ние, тем самым открывая новый путь для поис
мым нормам этики. От каждого из включенных
ка потенциальных модификаторов заболевания.
в исследование участников было получено ин
формированное добровольное согласие.
Финансирование
Благодарности
Работа выполнена при финансовой поддержке
Исследования выполнены с использованием
РФФИ (№ 18 34 00440) в части получения и ха
оборудования ЦКП «Центр генетических ресур
рактеристики пациент специфичных ИПСК,
сов лабораторных животных» ФИЦ ИЦиГ СО
внесения трансгенов в локус AAVS1 и последую
РАН, поддержанного Минобрнауки России
щего анализа трансгенных линий, а также прог
(уникальный идентификатор проекта RFME
раммы фундаментальных исследований Президиу
FI62117X0015).
СПИСОК ЛИТЕРАТУРЫ
1.
Takahashi, K., and Yamanaka, S. (2006) Induction of
cell disease, Blood, 118, 4599-4608, doi: 10.1182/blood
pluripotent stem cells from mouse embryonic and adult
2011 02 335554.
fibroblast cultures by defined factors, Cell, 126, 663-676,
7. Ananiev, G., Williams, E.C., Li, H., and Chang, Q. (2011)
doi: 10.1016/j.cell.2006.07.024.
Isogenic pairs of wild type and mutant induced pluripotent
2.
Yu, J., Vodyanik, M.A., Smuga Otto, K., Antosiewicz
stem cell (iPSC) lines from Rett syndrome patients as in
Bourget, J., Frane, J.L., Tian, S., Nie, J., Jonsdottir, G.A.,
vitro disease model, PLoS One, 6, e25255, doi: 10.1371/
Ruotti, V., Stewart, R., Slukvin, I.I., and Thomson J.A.
journal.pone.0025255.
(2007) Induced pluripotent stem cell lines derived from
8. Dimos, J.T., Rodolfa, K.T., Niakan, K.K., Weisenthal, L.M.,
human somatic cells, Science, 318, 1917-1920, doi: 10.1126/
Mitsumoto, H., Chung, W., Croft, G.F., Saphier, G.,
science.1151526.
Leibel, R., Goland, R., Wichterle, H., Henderson, C.E., and
3.
Wiethoff, S., Arber, C., Li, A., Wray, S., Houlden, H., and
Eggan, K. (2008) Induced pluripotent stem cells generated from
Patani, R. (2015) Using human induced pluripotent stem
patients with ALS can be differentiated into motor neurons,
cells to model cerebellar disease: hope and hype, J. Neu=
Science, 321, 1218-1221, doi: 10.1126/science.1158799.
rogenet.,
29,
95-102, doi:
10.3109/01677063.2015.
9. Alves, C.J., Dariolli, R., Jorge, F.M., Monteiro, M.R.,
1053478.
Maximino, J.R., Martins, R.S., Strauss, B.E., Krieger, J.E.,
4.
Ghaffari, L.T., Starr, A., Nelson, A.T., and Sattler, R.
Callegaro, D., and Chadi, G. (2015) Gene expression pro
(2018) Representing diversity in the dish: using patient
filing for human iPS derived motor neurons from sporadic
derived in vitro models to recreate the heterogeneity of neu
ALS patients reveals a strong association between mito
rological disease, Front. Neurosci., 12, 1-18, doi: 10.3389/
chondrial functions and neurodegeneration, Front. Cell.
fnins.2018.00056.
Neurosci., 9, 289, doi: 10.3389/fncel.2015.00289.
5.
Israel, M.A., Yuan, S.H., Bardy, C., Reyna, S.M., Mu, Y.,
10. Wijesekera, L.C., and Leigh, P.N. (2009) Amyotrophic
Herrera, C., Hefferan, M.P., Van Gorp, S., Nazor, K.L.,
lateral sclerosis, Orphanet J. Rare Dis., 4, 3, doi: 10.1186/
Boscolo, F.S., Carson, C.T., Laurent, L.C., Marsala, M.,
1750 1172 4 3.
Gage, F.H., Remes, A.M., Koo, E.H., and Goldstein, L.S.B.
11. Brites, D., and Vaz, A.R. (2014) Microglia centered patho
(2012) Probing sporadic and familial Alzheimer’s disease
genesis in ALS: insights in cell interconnectivity, Front.
using induced pluripotent stem cells, Nature,
482,
Cell. Neurosci., 8, 117, doi: 10.3389/fncel. 2014.00117.
216-220, doi: 10.1038/nature10821.
12. Celeste, D.B., and Miller, M.S. (2018) Reviewing the evi
6.
Zou, J., Mali, P., Huang, X., Dowey, S.N., and Cheng, L.
dence for viruses as environmental risk factors for ALS: a
(2011) Site specific gene correction of a point mutation in
new perspective, Cytokine, 108, 173-178, doi: 10.1016/j.
human iPS cells derived from an adult patient with sickle
cyto.2018.04.010.
10 БИОХИМИЯ том 84 вып. 3 2019
434
УСТЬЯНЦЕВА и др.
13.
Oskarsson, B., Horton, D.K., and Mitsumoto, H. (2015)
Schreiber, S., Glimcher, L.H., and Blumberg, R.S. (2008)
Potential environmental factors in amyotrophic lateral
XBP1 links ER stress to intestinal inflammation and con
sclerosis, Neurol. Clin., 33, 877-888, doi: 10.1016/j.ncl.
fers genetic risk for human inflammatory bowel disease,
2015.07.009.
Cell, 134, 743-756, doi: 10.1016/j.cell.2008.07.021.
14.
Ajroud Driss, S., and Siddique, T. (2014) Sporadic and here
28.
Nishitoh, H., Kadowaki, H., Nagai, A., Maruyama, T.,
ditary amyotrophic lateral sclerosis (ALS), Biochim. Biophys.
Yokota, T., Fukutomi, H., Noguchi, T., Matsuzawa, A.,
Acta, 1852, 679-684, doi: 10.1016/j.bbadis. 2014.08.010.
Takeda, K., and Ichijo, H. (2008) ALS linked mutant
15.
Abel, O., Powell, J.F., Andersen, P.M., and Al Chalabi, A.
SOD1 induces ER stress and ASK1 dependent motor
(2012) ALSoD: a user friendly online bioinformatics tool
neuron death by targeting Derlin 1, Genes Dev., 22,
for amyotrophic lateral sclerosis genetics, Hum. Mutat., 33,
1451-1464, doi: 10.1101/gad.1640108.
1345-1351, doi: 10.1002/humu.22157.
29.
Chen, T. W., Wardill, T.J., Sun, Y., Pulver, S.R.,
16.
Doi, H., Koyano, S., Suzuki, Y., Nukina, N., and
Renninger, S.L., Baohan, A., Schreiter, E.R., Kerr, R.A.,
Kuroiwa, Y. (2010) The RNA binding protein FUS/TLS is
Orger, M.B., Jayaraman, V., Looger, L.L., Svoboda, K., and
a common aggregate interacting protein in polyglutamine
Kim, D.S. (2013) Ultrasensitive fluorescent proteins for
diseases, Neurosci. Res., 66, 131-133, doi: 10.1016/j.
imaging neuronal activity, Nature, 499, 295-300, doi: 10.1038/
neures.2009.10.004.
nature12354.
17.
Cortese, A., Plagnol, V., Brady, S., Simone, R., Lashley, T.,
30.
Ran, F.A., Hsu, P.D., Wright, J., Agarwala, V., Scott, D.A.,
Acevedo Arozena, A., de Silva, R., Greensmith, L.,
and Zhang, F. (2013). Genome engineering using the
Holton, J., Hanna, M.G., Fisher, E.M.C., and Fratta, P.
CRISPR Cas9 system, Nat. Protoc., 8, 2281-2308, doi: 10.1038/
(2014) Widespread RNA metabolism impairment in spo
nprot.2013.143.
radic inclusion body myositis TDP43 proteinopathy,
31.
Soares, F.A.C., Pedersen, R.A., and Vallier, L. (2015) in
Neurobiol. Aging, 35, 1491-1498, doi: 10.1016/j.neurobio
Induced pluripotent stem (iPS) cells. Methods Mol. Biol.
laging.2013.12.029.
(Turksen, K., and Nagy, A. eds), Humana Press, N.Y.,
18.
Watson, M.R., Lagow, R.D., Xu, K., Zhang, B., and
pp. 23-31, doi: 10.1007/7651_2015_202.
Bonini, N.M. (2008) A Drosophila model for amyotrophic
32.
Okita, K., Yamakawa, T., Matsumura, Y., Sato, Y., Amano, N.,
lateral sclerosis reveals motor neuron damage by human
Watanabe, A., Goshima, N., and Yamanaka, S. (2013) An
SOD1, J. Biol. Chem., 283, 24972-24981, doi: 10.1074/
efficient nonviral method to generate integration free
jbc.M804817200.
human induced pluripotent stem cells from cord blood
19.
Sakowski, S.A., Lunn, J., Busta, A.S., Oh, S., Zamora
and peripheral blood cells, Stem Cells, 31, 458-466,
Berridi, G., Palmer, M., Rosenberg, A.A., Philip, S.G.,
doi: 10.1002/stem.1293.
Dowling, J.J., and Feldman, E.L. (2012) Neuromuscular
33.
Medvedev, S.P., Grigor’eva, E.V., Shevchenko, A.I.,
effects of G93A SOD1 expression in zebrafish, Mol.
Malakhova, A.A., Dementyeva, E. V., Shilov, A.A.,
Neurodegener., 7, 44, doi: 10.1186/1750 1326 7 44.
Pokushalov, E.A., Zaidman, A.M., Aleksandrova, M.A.,
20.
Allen, S.P., Rajan, S., Duffy, L., Mortiboys, H., Higgin
Plotnikov, E.Y., Sukhikh, G.T., and Zakian, S.M. (2011)
bottom, A., Grierson, A.J., and Shaw, P.J.
(2014)
Human induced pluripotent stem cells derived from fetal
Superoxide dismutase 1 mutation in a cellular model of
neural stem cells successfully undergo directed differen
amyotrophic lateral sclerosis shifts energy generation from
tiation into cartilage, Stem Cells Dev., 20, 1099-1112,
oxidative phosphorylation to glycolysis, Neurobiol. Aging,
doi: 10.1089/scd.2010.0249.
35, 1499-1509, doi: 10.1016/j.neurobiolaging.2013.11.
34.
Minina, J.M., Borodin, P.M., Searle, J.B., Volobouev, V.T.,
025.
and Zhdanova, N.S. (2007) Standard DAPI karyotype of
21.
Richardson, K., Allen, S.P., Mortiboys, H., Grierson, A.J.,
the common shrew Sorex araneus L. (Soricidae, Eulipo
Wharton, S.B., Ince, P.G., Shaw, P.J., and Heath, P.R.
typhla), Russ. J. Teriology, 6, 3-6, doi: 10.15298/rusjtheri
(2013) The effect of SOD1 mutation on cellular bioener
ol.6.1.02.
getic profile and viability in response to oxidative stress and
35.
DeKelver, R.C., Choi, V.M., Moehle, E.A., Paschon, D.E.,
influence of mutation type, PLoS One, 8, e68256, doi:
Hockemeyer, D., Meijsing, S.H., Sancak, Y., Cui, X.,
10.1371/journal.pone.0068256.
Steine, E.J., Miller, J.C., Tam, P., Bartsevich, V.V., Meng, X.,
22.
Gutscher, M., Pauleau, A. L., Marty, L., Brach, T.,
Rupniewski, I., Gopalan, S.M., Sun, H.C., Pitz, K.J.,
Wabnitz, G.H., Samstag, Y., Meyer, A.J., and Dick, T.P.
Rock, J.M., Zhang, L., Davis, G.D., Rebar, E.J., Cheese
(2008) Real time imaging of the intracellular glutathione
man, I.M., Yamamoto, K.R., Sabatini, D.M., Jaenisch, R.,
redox potential, Nat. Methods, 5, 553-559, doi: 10.1038/
Gregory, P.D., and Urnov, F.D.
(2010) Functional
nmeth.1212.
genomics, proteomics, and regulatory DNA analysis in iso
23.
Iwawaki, T., Akai, R., Kohno, K., and Miura, M. (2004) A
genic settings using zinc finger nuclease driven transgene
transgenic mouse model for monitoring endoplasmic reticu
sis into a safe harbor locus in the human genome, Genome
lum stress, Nat. Med., 10, 98-102, doi: 10.1038/nm970.
Res., 20, 1133-1142, doi: 10.1101/gr. 106773.110.
24.
Schwarzlander, M., Dick, T.P., Meyer, A.J., and Morgan, B.
36.
Papapetrou, E.P., and Schambach, A. (2016) Gene insertion into
(2016) Dissecting redox biology using fluorescent protein
genomic safe harbors for human gene therapy, Mol. Ther.
sensors, Antioxid. Redox Signal., 24, 680-712, doi: 10.1089/
Am. Soc. Gene Cell Ther., 24, 678-684, doi: 10.1038/mt.2016.38.
ars.2015.6266.
37.
Wadkin, L.E., Elliot, L.F., Neganova, I., Parker, N.G.,
25.
Esposito, S., Masala, A., Sanna, S., Rassu, M., Pim
Chichagova, V., Swan, G., Laude, A., Lako, M., and
xayvong, V., Iaccarino, C., and Crosio, C. (2017) Redox
Shukurov, A. (2017) Dynamics of single human embryonic
sensitive GFP to monitor oxidative stress in neurodegene
stem cells and their pairs: a quantitative analysis, Sci. Rep.,
rative diseases, Rev. Neurosci., 28, 133-144, doi: 10.1515/
7, 570, doi: 10.1038/s41598 017 00648 0.
revneuro 2016 0041.
38.
Gonzalez, F., Zhu, Z., Shi, Z. D., Lelli, K., Verma, N., Li, Q.V.,
26.
Morgan, B., Sobotta, M.C., and Dick, T.P.
(2011)
and Huangfu, D. (2014) An iCRISPR platform for rapid,
Measuring E(GSH) and H2O2 with roGFP2 based redox
multiplexable, and inducible genome editing in human plu
probes, Free Radic. Biol. Med., 51, 1943-1951, doi: 10.1016/
ripotent stem cells, Cell Stem Cell, 15, 215-226, doi: 10.1016/
j.freeradbiomed.2011.08.035.
j.stem.2014.05.018.
27.
Kaser, A., Lee, A. H., Franke, A., Glickman, J.N.,
39.
Kleinstiver, B.P., Pattanayak, V., Prew, M.S., Tsai, S.Q.,
Zeissig, S., Tilg, H., Nieuwenhuis, E.E.S., Higgins, D.E.,
Nguyen, N.T., Zheng, Z., and Joung, J.K. (2016) High fidelity
БИОХИМИЯ том 84 вып. 3 2019
ИССЛЕДОВАНИЕ НЕЙРОДЕГЕНЕРАЦИИ С ПОМОЩЬЮ БИОСЕНСОРОВ
435
CRISPR-Cas9 nucleases with no detectable genome wide
based protein thiol oxidation by H2O2 scavenging peroxi
off target effects, Nature, 529, 490-495, doi: 10.1038/nature16526.
dases, J. Biol. Chem., 284, 31532-31540, doi: 10.1074/
40. Gutscher, M., Sobotta, M.C., Wabnitz, G.H., Ballikaya, S.,
jbc.M109.059246.
Meyer, A.J., Samstag, Y., and Dick, T.P. (2009) Proximity
PLATFORM FOR STUDYING NEURODEGENERATION
MECHANISMS USING GENETICALLY ENCODED
BIOSENSORS
E. I. Ustyantseva1,2,3,4 , S. P. Medvedev1,2,3,4, A. S. Vetchinova5,
J. M. Minina1, S. N. Illarioshkin5, and S. M. Zakian1,2,3,4*
1 Federal Research Center Institute of Cytology and Genetics,
Siberian Branch of the Russian Academy of Sciences,
630090 Novosibirsk, Russia; E=mail: Zakian@bionet.nsc.ru
2 Institute of Chemical Biology and Fundamental Medicine,
Siberian Branch of the Russian Academy of Sciences,
630090 Novosibirsk, Russia
3 Meshalkin National Medical Research Center, Ministry of Health
of the Russian Federation, 630055 Novosibirsk, Russia
4 Novosibirsk State University, 630090 Novosibirsk, Russia
5 Research Center of Neurology, 125367 Moscow, Russia
Received October 14, 2018
Revised November 11, 2018
Accepted November 11, 2018
Patient specific induced pluripotent stem cells (IPSCs) represent a promising source for studying pathological
processes and search for methods of their correction, since they are capable to differentiate into desirable cell type.
However, to date, conventional strategies for using IPSCs in disease research are not yet established. Genetically
encoded biosensors enable us to register messengers, metabolites and enzyme activity in real time and present these
signals quantitatively, thus providing possibility to assess the impact of certain molecules on development of a pathology.
In this article we present the development of universal cell based platform for studying pathological processes involved
in amyotrophic lateral sclerosis. A number of plasmid constructs for insertion into cell genome of genetically encoded
biosensors allowing investigation of endoplasmic reticulum stress, oxidative stress, apoptosis and Ca2+ dependent
hyperexcitability has been created. Moreover, two transgenic IPSC lines (with SOD1 gene mutation and healthy control)
have been obtained, which carry an insert of a transactivator for doxycycline controlled gene expression and can be
used for a single step insertion of various biosensors.
Keywords: induced pluripotent stem cells, biosensors, CRISPR/Cas9
БИОХИМИЯ том 84 вып. 3 2019
10*