БИОХИМИЯ, 2019, том 84, вып. 3, с. 448 - 456
УДК 576.535
«ГОЛЬ НА ВЫДУМКИ ХИТРА», ИЛИ ДЕШЕВЫЙ,
НАДЕЖНЫЙ И ВОСПРОИЗВОДИМЫЙ СПОСОБ
ПОЛУЧЕНИЯ ОРГАНОИДОВ
© 2019 А.В. Еремеев*, Е.А. Воловиков, Л.Д. Шувалова, А.В. Давиденко,
Е.А. Хомякова, М.Е. Богомякова, О.С. Лебедева, О.А. Зубкова,
М.А. Лагарькова*
Федеральный научно клинический центр физико химической
медицины ФМБА России, 119435 Москва, Россия,
электронная почта: lagar@rcpcm.org, art eremeev@yandex.ru
Поступила в редакцию 05.11.2018
После доработки 07.12.2018
Принята к публикации 07.12.2018
Органоиды представляют собой трехмерные (3D) культуры клеток, которые повторяют некоторые из клю
чевых особенностей морфологии, пространственной архитектуры и функций определенного органа. Орга
ноиды можно получать и из региональных, и из плюрипотентных стволовых клеток (ПСК), а также созда
вать сложные органоиды, комбинируя разные типы клеток, в т.ч. дифференцированных. Способность про
изводных ПСК к самоорганизации в органотипические структуры, содержащие несколько специфичных
для того или иного органа клеточных подтипов, была использована для создания органоидов мозга, глаза,
почки, кишечника и других органов. Несмотря на преимущества использования ПСК для получения орга
ноидов, существенным недостатком, мешающим их широкому применению, до сих пор являлся низкий
выход при их получении из монослойной культуры ПСК, большая вариация по размерам, что приводило к
большой гетерогенности при дальнейшей дифференцировке. В этой статье мы описали собственный про
токол получения стандартизованных органоидов с акцентом на метод получения органоидов мозга, кото
рый позволяет масштабировать и значительно удешевить и упростить их культивирование.
КЛЮЧЕВЫЕ СЛОВА: дифференцировка, культура клеток, эмбриональные стволовые клетки, индуциро
ванные плюрипотентные стволовые клетки, органоиды, биореактор.
DOI: 10.1134/S032097251903014X
Исследования последних лет, связанные с
ные попытки создания многоклеточных органо
созданием 3D органоидов из плюрипотентных
идов мозга человека [1-5], толстой кишки [6-8],
стволовых клеток (ПСК) - эмбриональных
почек [9-10], сетчатки [11-13], печени [14, 15].
стволовых клеток (ЭСК) или индуцированных
Разумеется, пока 3D модели многоклеточных
плюрипотентных стволовых клеток (ИПСК), -
органов на основе 2D культур имеют свои огра
существенно облегчили исследования в области
ничения и лишь слабо имитируют их сложную
моделирования органогенеза человека in vitro и
архитектонику [16]. Тем не менее органоиды все
стали мощным инструментом для исследования
активнее используются в биомедицине. Напри
механизмов развития различных патологий
мер, с помощью органоидов, дифференциро
сложных органов, равно как и разработки новых
ванных из ИПСК, уже были сделаны интерес
подходов к их терапии. В течение нескольких
нейшие выводы о механизмах наследственных
последних лет были сделаны достаточно успеш
заболеваний мозга [1, 17-19], а на органоидах
мозга и кишечника проводят тестирование кан
дидатных лекарственных препаратов для лече
Принятые сокращения: ПСК - плюрипотентные
стволовые клетки; ИПСК - индуцированные плюрипотент
ния муковисцидоза, а также лихорадки, вызван
ные стволовые клетки; bFGF - основной фактор роста
ной вирусом Зика [20-22].
фибробластов (basic fibroblast growth factor); DAPI - 4',6 ди
Сейчас исследователями предлагается мно
амино 2 фенилииндол дигидрохлорид; PBS - фосфатно со
жество вариантов протоколов для получения ор
левой буфер (phosphate buffered saline); FBS - эмбриональная
ганоидов, состоящих из нескольких типов кле
бычья сыворотка (fetal bovine serum); DMEM - среда Игла
в модификации Дульбекко (Dulbecco’s Modified Eagle’s
ток головного мозга, или же клеток определен
Medium); SR - заменитель сыворотки (serum replacement).
ных зон. Добавление факторов морфогенеза поз
* Адресат для корреспонденции.
воляет получать органоиды различных регио
448
ПОЛУЧЕНИЕ ОРГАНОИДОВ С ПОМОЩЬЮ МИНИБИОРЕАКТОРОВ
449
нальных подтипов мозга [23-25]: коры головно
димость разработки приспособлений, позволя
го мозга [1, 4, 26], мозжечка [27], среднего моз
ющих масштабировать этот процесс. В этой ра
га, переднего мозга, гипоталамуса [28-30], гип
боте мы описали методику получения и испыта
покампа [31]. Между тем, все протоколы можно
ния простых и недорогих микробиореакторов,
разделить на две большие группы по способу
позволяющих получать органоиды высокого ка
получения агрегатов и дальнейшему их культи
чества в большом количестве.
вированию с дифференцировкой. Первая груп
па - это различные модификации протокола
Ланкастер (2014) или схожие по технологии схе
МЕТОДЫ ИССЛЕДОВАНИЯ
мы дифференцировки [32, 33], различающиеся
между собой сроками культивирования и ин
Культуры плюрипотентных стволовых клеток.
дукторами дифференцировки с последующим
Линии ИПСК (IPSHD76.4L, IPSHUV4.5S, IPSRG6L)
вызреванием органоидов на шейкере в специ
или эмбриональных стволовых клеток (ЭСК)
альных низкоадгезионных приспособлениях по
(hESM01) культивировали на чашках Петри ди
типу микропробирок или планшетов [23]. Вто
аметром 6 см, предварительно покрытых матри
рая группа протоколов подразумевает использо
гелем («Corning», США), в среде mTESR1 («Stem
вание специальных биореакторов [30]. Так,
cell technologies», Канада), как описано в инструк
Krefft et al. (2018) показали возможность получе
ции производителя.
ния органоидов мозга за четыре этапа [34]. Этот
Индукция дифференцировки в нейрональном
протокол включал в себя следующие этапы: по
направлении. Дифференцировку начинали при
лучение агрегатов ИПСК (предварительно клет
достижении 80-85% ной конфлюэнтной плот
ки культивировали до состояния монослоя); ин
ности монослоя. Для этого на первые 2 дня
дукцию передней нейроэктодермы; инкапсуля
клетки переводили на среду Игла в модифика
цию нейроэктодермальных агрегатов в матрицу
ции Дульбекко (Dulbecco’s Modified Eagle’s
(экстракт базальной мембраны); дифференци
Medium, DMEM)/среда Фишера (F12) с добав
ровку мозгоподобных органоидов, характерных
лением 1% заменителя сыворотки (serum repla
для переднего мозга. Данный протокол позво
cement, SR) («Gibco», США), 1% N2 и 2% Нейро
лил получить стандартные по размеру органои
макса («ПанЭко», Россия), 0,1 мкМ LDN 193189
ды, но в небольшом количестве, по причине
(«MACS Miltenyi Biotec», Германия), 3 мкМ дор
большой технической трудоемкости, связанной
соморфина («MACS Miltenyi Biotec», Германия),
с иммобилизацией каждого отдельного органо
10 мкМ SB431542 («MACS Miltenyi Biotec», Гер
ида в капле матрицы. Более того, использование
мания), 1% GlutaMAX («Gibco», США), 50 ед/мл
условно стерильных приспособлений типа «paraf
смеси пенициллина и стрептомицина («ПанЭко»,
fin film» для иммобилизации в геле несет высо
Россия) и 50 мМ β меркаптоэтанола («Gibco»,
кие риски контаминации и делает невозмож
США). Через день клетки переводили на среду
ным использование этого протокола для нара
без добавления SR, все остальные добавки ос
ботки большого количества органоидов, напри
тавляли без изменений. Далее в течение двух не
мер, для скрининговых исследований. В прото
дель среду меняли регулярно через день. Когда
коле, предложенном Qian et al. (2018), были раз
начиналась кластеризация нейроэпителиальных
работаны высокотехнологичные механические
клеток предшественников в 2D культуре (ро
лопастные планшетные миниреакторы, позво
зеткообразование), переходили к этапу получе
ляющие регулировать частоту вращения лопа
ния сфероидов с помощью микролуночного
ток роторов во всех лунках [30]. Однако, не
планшета Aggrewell 400 («Stemcell technologies»,
смотря на высокую эффективность предложен
Канада).
ного способа получения органоидов, при масш
Подготовка чашек Петри для культивирования
табировании стоимость таких реакторов будет
органоидов. Схема минибиореактора приведена
существенной составляющей в исследованиях.
на рис. 1, а. В центр чашки Петри с низкой адге
К тому же большое количество механических
зией (ultra low adhesion, «Corning», США) при
элементов в таких реакторах будет затруднять
крепляли пластиковое кольцо. Кольца высотой
его деконтаминацию и снизит надежность при
7-8 мм вырезали из стерильных 15 мл пробирок
длительной эксплуатации.
(«Greiner», «Falcon», США, «SPL Life Sciences»,
Анализ всевозможных протоколов указывает
Ю. Корея) и автоклавировали. Из чашек Петри для
на необходимость культивирования органоидов
микробиологической работы наламывали плас
в условиях циркулирующей питательной среды
тиковую крошку, которую растворяли в хлорофор
[1-4, 6]. Между тем, отсутствие простых и деше
ме в течение 16 ч для получения вязкой однород
вых систем для получения стандартных по мор
ной массы из расчета 1 г пластиковой крошки на
фологии и размерам органоидов диктует необхо
10 мл хлороформа. После этого проводили вклейку
11 БИОХИМИЯ том 84 вып. 3 2019
450
ЕРЕМЕЕВ и др.
колец по центру чашки Петри диаметром 6 см
ли чашку Петри диаметром 90-100 мм, в сере
(ultra low adhesion, «Corning», США, или микро
дину которой вклеивали чашку диаметром 35 мм
биологической чашки, предварительно проверен
(рис. 1, в). В таком случае в эту чашку можно до
ной на отсутствие токсичности для культуры
бавить 2 мл воды для дополнительного увлажне
клеток эукариот) с помощью полученного плас
ния атмосферы в миниреакторе. Собранные по не
тикового клея в ламинарном шкафу (рис. 1, б).
скольку штук в большие чашки Петри или другие
Чашки оставляли открытыми до полного высы
стерильные контейнеры миниреакторы могут быть
хания в ламинарном шкафу. После высыхания
расположены ярусами на полках СО2 инкубато
чашки дополнительно обрабатывали в ламинаре
ра (рис.1, д) для масштабирования работы.
ультрафиолетовым светом в течение 15 мин. Для
Получение культуры сфероидов из нейроэпитеB
большого числа органоидов (>400) использова лиальных клетокBпредшественников. Через 14-15 су
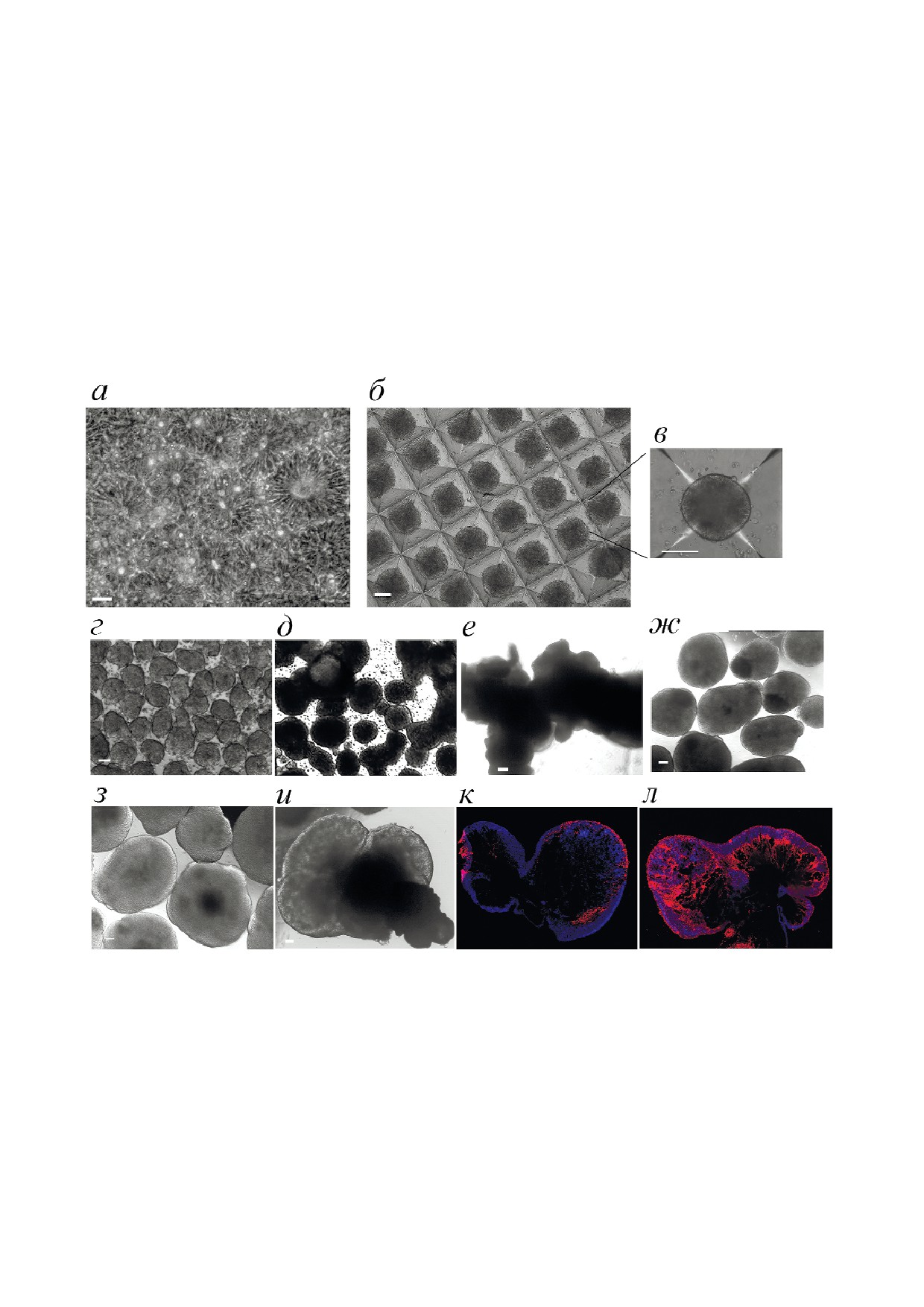
а
б
в
г
Рис. 1. Минибиореакторы, приготовленные из чашек Петри с низкой адгезией. а, б - Внешний вид чашек Петри с вкле
енным по центру цилиндром; в - внешний вид минибиореактора с культивируемыми в нем органоидами, полученными
из клеток линии IPSHUV4.5S; г - установка миниреакторов в СО2 инкубаторе на орбитальном шейкере (показана воз
можность многоярусной установки миниреакторов друг на друга). Масштабная линейка - 1 см.
С цветным вариантом рис. 1 можно ознакомиться в электронной версии статьи на сайте: www.elibrary.ru
БИОХИМИЯ том 84 вып. 3 2019
ПОЛУЧЕНИЕ ОРГАНОИДОВ С ПОМОЩЬЮ МИНИБИОРЕАКТОРОВ
451
ток с момента перевода культур плюрипотент
иды промывали 1× фосфатно солевым буфером
ных клеток на индуцирующую в нейрональном
(PBS), фиксировали 30 мин при комнатной тем
направлении среду клетки снимали с чашек
пературе в 4% ном параформальдегиде/PBS, за
Петри с помощью раствора Версена («ПанЭко»,
тем заливали жидкостью для заморозки ткани
Россия). После отмывки путем центрифугиро
(«Leica», Германия), замораживали в парах жид
вания при 200 g в течение 5 мин в чистой среде
кого азота в течение 5 мин, затем делали срезы
DMEM/F12 («Gibco», США) c 10% SR («Gibco»,
толщиной 5-10 мкм на криотоме Leica. Срезы
Германия) при комнатной температуре клетки пе
фиксировали на предметном стекле, охлажден
реводили на AggreWellTM 400, которую предвари
ном до -20 °С ацетоном в течение 5 мин, про
тельно подготавливали с помощью центрифуги
мывали дважды по 5 мин PBS и инкубировали в
рования со средой культивирования для удаления
блокирующем буфере с первичными антитела
пузырьков согласно инструкции производителя.
ми в течение ночи во влажной камере при 4 °С.
Затем сфероиды помещали в среду DMEM/F12
Первичные антитела наносили в разведениях,
с добавлением 0,1 мкМ LDN 193189 («MACS
рекомендованных производителем, в PBS с
Miltenyi Biotec», Германия), 5 мкМ дорсоморфи
0,1% Tween 20, содержавшем 5% эмбриональной
на («MACS Miltenyi Biotec», Германия), 10 мкМ
бычьей сыворотки (fetal bovine serum, FBS) и 2%
SB431542 («MACS Miltenyi Biotec», Германия),
сыворотки козы, инкубировали в течение 1 ч при
5 мкМ Y 27632 («MACS Miltenyi Biotec», Герма
комнатной температуре, затем отмывали 3 раза
ния), 50 мкМ β меркаптоэтанола.
по 5 мин в PBS с 0,1% Tween 20. Вторичные ан
Получение и культивирование органоидов. Че
титела («Invitrogen», США), конъюгированные с
рез один день образовавшиеся сфероиды (буду
флуоресцентными метками (Alexa 488, Alexa 555),
щие органоиды) аккуратно собирали из лунок
наносили в разведениях, рекомендованных про
серологической пипеткой объемом 2-5 мл в про
изводителем, инкубировали 30 мин при комнат
бирку на 15 мл, отстаивали 2-3 мин, затем су
ной температуре в темноте, отмывали 3 раза по
пернатант отбирали. Органоиды, которые под
5 мин в PBS c 0,1% Tween 20. Затем препараты
действием силы тяжести опускались на дно про
инкубировали в течение 10 мин с 4',6 диамино
бирки, помещали сначала в только что разморо
2 фенилииндол дигидрохлоридом (DAPI) в кон
женный при 4 °С неразведенный матригель
центрации 0,1 мкг/мл в PBS для визуализации
(«Corning», США), через 30 мин отмывали от
ядер, отмывали 2 раза PBS. Полученные препа
него путем пассивной седиментации в пробирке
раты исследовали под флуоресцентным микро
объемом 15 мл или мягким центрифугировани
скопом Olympus.
ем в течение 1 мин при 100 g, затем органоиды
перемещали в описанные выше минибиореак
торы, которые размещали на орбитальном шей
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
кере («Inforse» Швейцария) в СО2 инкубаторе.
Дальнейшее культивирование органоидов про
В ходе культивирования в индуцирующей ней
водили при 37 °С, в атмосфере 5% СО2, 80% ной
рональную дифференцировку среде, начиная с
влажности, при частоте вращения 60-70 rpm. Коль
6-7 дня, наблюдалось образование кластеров
ца не давали сфероидам концентрироваться в
(«розеток»), будущих участков морфогенеза нерв
центре чашки, что позволяло избежать образо
ной ткани (рис. 2, а). После снятия «розеток» с
вания агрегатов и адгезии клеток на чашке. Че
чашек Петри на десятый день и перевода их в
рез сутки среду меняли на DMEM/F12 с добав
лунки микролуночного планшета AggreWellTM в
лением 1× N 2 и 1× Neuromax («ПанЭко», Рос
течение суток происходило образование сферо
сия), 100× GlutaMAX, 50 ед/мл смеси пеницил
идов: в каждой лунке наблюдалось образование
лина и стрептомицина, 3 мкМ пурморфамина
клеточных агрегатов в количестве, равнознач
(«MACS Miltenyi Biotec», Германия) и 50 мкМ
ном числу микролунок в одной ячейке планше
β меркаптоэтанола и основного фактора роста
та (рис. 2, б и в). При этом все сфероиды были
фибробластов (bFGF) в концентрации 10 нг/мл.
одинакового размера. После переноса в микро
Дальнейшую смену среды проводили через 4-6
реакторы и дальнейшего культивирования их
дней без центрифугирования за счет оседания
размеры увеличивались в равных пропорциях
органоидов под действием силы тяжести в про
(рис. 2, г, ж и з), равно как и морфогенез прохо
бирке объемом 15 мл с последующей аспираци
дил у всех органоидов морфологически одина
ей надосадочной жидкости. В пробирку добав
ково (рис. 2, ж и з) с четким выделением зон
ляли объем среды, равный удаленному, после
дифференцировки. Между тем, при культиви
чего органоиды возвращали в миниреакторы.
ровании в лунках планшета с низкой адгезив
Иммунофлуоресцентное окрашивание. Для
ностью без качания (рис. 2, д) или в обычной
иммунофлуоресцентного окрашивания органо
чашке Петри с низкой адгезией (рис. 2, е) сферо
БИОХИМИЯ том 84 вып. 3 2019
11*
452
ЕРЕМЕЕВ и др.
иды образовывали слипшиеся скопления раз
последующему распаду [36]. Кроме того, сли
ной морфологии и размеров, со временем пре
пание органоидов друг с другом может приво
вращаясь в бесформенные мегагрегаты. Высо
дить к нарушению поляризации, и, как след
коадгезивные свойства органоидов друг к другу
ствие, дальнейший морфогенез может нару
или к пластику можно объяснить природой кле
шаться [37].
ток, составляющих органоид, и их способ
Постепенное увеличение размера органоидов
ностью к спонтанной агрегации [35], а также на
наблюдалось в течение первых трех месяцев, за
личием иммобилизованного в нем матригеля,
тем этот рост прекратился, скорее всего, из за не
обладающего высокими адгезивными свойства
возможности дальнейшего поступления питатель
ми. Образование таких структур приводит к зна
ных веществ и выведения продуктов метаболиз
чительному ухудшению снабжения нутриента
ма. Максимальный размер органоидов, получен
ми и газами мегаорганоида, приводя к некроти
ных для органоидов мозга, культивированных в
ческой гибели значительной части клеток и его
течение 6 месяцев, составил 6 мм (рис. 2, и). Им
Рис. 2. Приготовление органоидов мозга. Показаны репрезентативные микрофотографии органоидов линий hESM01 и
IPSRG06L. а - Образование нейроэпителиальных розеток; б - образование сфероидов в микролунках AggreWellTM 400;
в - морфология сфероида, будущего органоида; г - органоиды в первый день культивирования; д - слипшиеся кластеры
органоидов после культивирования в среде для дифференцировки без перемешивания; e - образование мегагрегатов непра
вильной формы при культивировании в течение 21 дня в обычных чашках Петри с низкой адгезией; ж - органоиды моз
га с зонами морфогенеза после культивирования в среде для дифференцировки в миниреакторах в течение 21 дня; з - ор
ганоиды мозга с зонами морфогенеза после культивирования в среде для дифференцировки в миниреакторах в течение
45 дней; и - органоид мозга после 200 дней культивирования в минибиореакторе; а-и - фазовый контраст; к, л - иммуно
гистохимический анализ криосрезов органоида мозга, изображенного на фотографии и; к - окрашивание антителами на
нестин (красный); л - окрашивание антителами на βIII тубулин (красный). Ядра клеток окрашены DAPI (синий). Масш
табная линейка на всех микрофотографиях - 100 мкм.
С цветным вариантом рис. 2 можно ознакомиться в электронной версии статьи на сайте: www.elibrary.ru
БИОХИМИЯ том 84 вып. 3 2019
ПОЛУЧЕНИЕ ОРГАНОИДОВ С ПОМОЩЬЮ МИНИБИОРЕАКТОРОВ
453
муногистохимический анализ криосрезов орга
ноидов мозга показал наличие морфологически
детерминированных структур, положительных
по маркерам нейрогенеза нестину и микротубу
лин связанному протеину 2 (Microtubule associ
ated protein 2, Мap 2) (рис. 2, к, л), характерных
для образования глии (GFAP, данные не приве
дены). Нужно отметить, что нейральные клетки
в органоидах в течение нескольких месяцев сох
раняли свою жизнеспособность и после обработ
ки органоидов аккъютазой могли быть выделены
для дальнейшего культивирования в 2D культу
ре (рис. 3).
Таким образом, генерация сфероидов одина
кового размера с дальнейшим их культивирова
нием и последующей организацией в органоиды
является критическим моментом для получения
Рис. 3. Иммунофлуоресцентный анализ клеток, выделен
стандартных по размерам, способных к образо
ных из органоида мозга линии клеток IPSHD76.4L через
ванию равнозначных и стандартных по морфо
120 дней и затем культивированных на подложке из матри
генезу (паттернингу) структур, что успешно дос
геля в течение 2 недель. Окрашивание антителами к Map 2
(красный), ядра окрашены DAPI (синий). Хорошо видны
тигнуто в условиях миниреакторов. Максималь
длинные нейриты нейронов, образовавших разветвленную
ное время, в течение которого мы культивировали
нейрональную сеть. Масштабная линейка - 100 мкм.
органоиды мозга, составило 200 дней, т.е. ~7 ме
С цветным вариантом рис. 3 можно ознакомиться в элект
сяцев (рис. 2, и, к, л). Органоиды получаются стан
дартными по размеру, морфологии и могут быть
использованы для дальнейших исследований.
па), существует проблема нехватки места в CO2
инкубаторе. В нашей системе эта проблема ре
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
шается легко, т.к. чашки и даже плашки с вкле
енными кольцами можно ставить друг на друга.
Согласно определению, органоид - это про
Таким образом, на платформе, аналогичной
дукт самоорганизации клеток. Органоиды, спо
платформе Inforse для CO2 инкубаторов, можно
собные к выполнению хотя бы части физиоло
культивировать до 30 миниреакторов с органои
гической функции органа, состоят из несколь
дами (рис. 1, д). В отсутствие перемешивания
ких типов клеток. Органоиды могут «собраться»
органоиды могут слипаться, а также может наб
не только из плюрипотентных клеток, но и из
людаться локальное закисление среды и сниже
взрослых стволовых клеток, и даже из диффе
ние газообмена. Получение органоидов бóльше
ренцированных клеток [21, 38-41]. Существует
го размера с помощью биореакторов (в нашем
несколько препятствий, которые затрудняют
случае предельные размеры органоидов мозга
широкое использование органоидов для скри
достигали
6 мм) на сегодняшний день является
нинга лекарственных средств, изучения молеку
пока еще не решенной задачей, поскольку прос
лярных механизмов заболеваний и других задач
тая диффузия нутриентов и кислорода наклады
клеточной биологии, биологии развития и био
вает ограничения на дальнейший рост. Однако
медицины. Во первых, методами, представляю
проблему, вероятно, можно преодолеть с помо
щими собой модификации протокола Ланкас
щью комбинированых подходов, улучшающих
тер, трудно получить сфероиды одинакового
трофику растущих тканей, например, индукция
размера. Кроме того, минимальный объем, в ко
сосудообразования или сочетанная иммобили
тором работает большинство биореакторов, в
зация клеток сосудистого эндотелия вместе с
т.ч. одноразовый биореактор Corning Costar (ка
нейрональными предшественниками в комп
таложный номер #3152), составляет
75 мл, что
лексе с микроперфузионными системами с по
делает культивирование очень дорогим и, пос
следующим переходом на перфузионное культи
кольку требует магнитной мешалки, не позволя
вирование по мере роста органоида [42].
ет использовать много биореакторов одновре
В этой работе мы представили очень простой
менно. При большом количестве культур, из ко
способ изготовления органоидов, который сос
торых нужно получить органоиды (например,
тоит из двух основных стадий:
нужно сравнить органоиды, полученные из не
1) стадии образования 3D структур из одно
скольких мутантных ИПСК и ИПСК дикого ти
го или нескольких типов клеток; при этом ис
БИОХИМИЯ том 84 вып. 3 2019
454
ЕРЕМЕЕВ и др.
пользование плашек Aggrewell позволяет полу
агрегаты должны быть условно оптически проз
чить сфероиды одного размера и одинакового
рачны, только такие следует отбирать для иммо
клеточного состава;
билизации в матригеле. При строгом соблюде
2) стадии культивирования при постоянном
нии протокола будут получаться стандартизиро
перемешивании; кольцеобразная форма культу
ванные партии органоидов с однородностью
90%
ральной посуды не позволяет сфероидам пере
в поляризованном свете. В ходе всего культиви
мещаться в середину и слипаться.
рования не требуется добавления сложного кок
Движение органоида и окружающей его сре
тейля рекомбинантных факторов роста и мор
ды в минибиореакторе подчиняется законам ме
фогенеза, кроме bFGF, вся основная дифферен
ханики и гидродинамики и зависит от ряда па
цировка, по видимому, происходит за счет ма
раметров: скорости орбитального вращения
лых молекул дорсоморфина и SB431542 (инги
платформы, геометрии минибиореактора, высо
биторы BMP/TGFb) и агониста Shh - пурмор
ты уровня жидкости, ее вязкости, размера и
фамина, а также за счет аутокринных процессов,
плотности органоидов и т.д. Моделированию и
протекающих в самом органоиде.
анализу динамики жидкости, расчету распреде
Варьируя среды и типы клеток, составляю
ления векторов скоростей различных частей
щие основу сфероида, мы испытали нашу систе
среды, а также исследованию других параметров
му для нескольких видов органоидов: органои
при орбитальном вращении жидкости в цилинд
дов мозга, сетчатки, комбинированных органо
рическом объеме специально посвящены от
идов из клеток карциномы печени и мезенхи
дельные исследования [43]. В этих работах при
мальных стволовых клеток (МСК), комбиниро
ведены системы дифференциальных уравнений
ванных органоидов из гепатобластов, МСК и
для описания поведения как жидкости, так и
кроветворных стволовых клеток, дифференци
различных модельных частиц в ней, а также
рованных из ИПСК, органоидов кишечника
представлены численные решения таких систем
(данные не приведены).
уравнений, подтвержденные эксперименталь
Мы предполагаем, что, варьируя изначаль
ными данными. В нашей работе, в которой мо
ный состав клеток в сфероиде, факторы диффе
делирование поведения органоидов в культу
ренцировки, культуральные среды, матриксы, а
ральной среде при орбитальном вращении мик
также, возможно, состав газовой смеси, ско
робиореактора не является предметом исследо
рость вращения платформы и другие парамет
вания, условия перемешивания подобраны эм
ры, с помощью предложенных в нашей работе
пирически, но могут быть легко воспроизведе
минибиореакторов можно получать органоиды
ны, т.к. для изготовления миниреакторов и всех
одинаковой формы, размера и морфологии, мо
дальнейших процедур используются общеупот
делирующие различные органы и ткани.
ребительные приборы и среды для культивиро
вания, а также культуральная посуда.
Финансирование
Кроме вышеперечисленных технических ре
шений, критическим моментом в получении ор
Работа выполнена при финансовой поддержке
ганоидов мозга является использование культур
РНФ (грант № 14 15 00930).
ПСК высокого качества. Важно, чтобы ПСК не
содержали участков дифференцированных кле
Конфликт интересов
ток до начала направленной дифференцировки
в нейральном направлении. Следует использо
Авторы заявляют об отсутствии конфликта
вать только культуры, которые представляют со
интересов.
бой однородный монослой недифференциро
ванных клеток в исходной популяции. Кроме
Соблюдение этических норм
того, поскольку для приготовления агрегатов
используются не ПСК, а дифференцированные
Настоящая статья не содержит описания ка
из них нейроэктодермальные предшественни
ких либо исследований с использованием лю
ки, эти дифференцировки тоже должны быть
дей и животных в качестве объектов.
высокоэффективными (
90%). Качество клеток
можно проверить по соответствующим марке
Благодарности
рам ранней дифференцировки (Pax 6, NCAM).
После формирования агрегатов (на 1 й или 2 й
Авторы благодарны н.с. Д.В. Басманову (ФГБУ
день) клеточные сфероиды должны иметь глад
ФНКЦ ФХМ ФМБА России) за обсуждение ре
кие края (рис. 2, а и б). В этот момент клеточные
зультатов при подготовке рукописи к печати.
БИОХИМИЯ том 84 вып. 3 2019
ПОЛУЧЕНИЕ ОРГАНОИДОВ С ПОМОЩЬЮ МИНИБИОРЕАКТОРОВ
455
СПИСОК ЛИТЕРАТУРЫ
1.
Lancaster, M.A., Renner, M., Martin, C.A., Wenzel, D.,
Cell diversity and network dynamics in photosensitive
Bicknell, L.S., Hurles, M.E., Homfray, T., Penninger, J.M.,
human brain organoids, Nature, 545, 48-53, doi: 10.1038/
Jackson, A.P., and Knoblich, J.A.
(2013) Cerebral
nature22047.
organoids model human brain development and micro
14.
Huch, M., Gehart, H., van Boxtel, R., Hamer, K.,
cephaly, Nature, 501, 373-379, doi: 10.1038/nature12517.
Blokzijl, F., Verstegen, M.M., Ellis, E., van Wenum, M.,
2.
Lancaster, M.A., and Knoblich, J.A. (2014) Organogenesis in
Fuchs, S.A., de Ligt, J., van de Wetering, M., Sasaki, N.,
a dish: modeling development and disease using organoid
Boers, S.J., Kemperman, H., de Jonge, J., Ijzermans, J.N.,
technologies, Science, 345, 124-125, doi: 10.1126/science.
Nieuwenhuis, E.E., Hoekstra, R., Strom, S., Vries, R.R.,
1247125.
van der Laan, L.J., Cuppen, E., and Clevers, H. (2015)
3.
Pasca, A.M., Sloan, S.A., Clarke, L.E., Tian, Y.,
Long term culture of genome stable bipotent stem cells
Makinson, C.D., Huber, N., Kim, C.H., Park, J.Y.,
from adult human liver, Cell, 160, 299-312, doi: 10.1016/
O'Rourke, N.A., Nguyen, K.D., Smith, S.J., Huguenard, J.R.,
j.cell.2014.11.050.
Geschwind, D.H., Barres, B.A., and Pasca, S.P. (2015)
15.
Takebe, T., Sekine, K., Enomura, M., Koike, H., Kimura, M.,
Functional cortical neurons and astrocytes from human
Ogaeri, T., Zhang, R.R., Ueno, Y., Zheng, Y.W., Koike, N.,
pluripotent stem cells in 3D culture, Nat. Methods, 12,
Aoyama, S., Adachi, Y., and Taniguchi, H.
(2013)
671-678, doi: 10.1038/nmeth.3415.
Vascularized and functional human liver from an iPSC derived
4.
Kadoshima, T., Sakaguchi, H., Nakano, T., Soen, M.,
organ bud transplant, Nature, 499, 481-484, doi: 10.1038/
Ando, S., Eiraku, M., and Sasai, Y. (2013) Self organiza
nature12271.
tion of axial polarity, inside out layer pattern, and species
16.
Giandomenico, S.L., and Lancaster, M.A. (2017) Probing
specific progenitor dynamics in human ES cell derived
human brain evolution and development in organoids,
neocortex, Proc. Natl. Acad. Sci. USA, 110, 20284-20289,
Curr. Opin. Cell Biol., 44, 36-43, doi: 10.1016/j.ceb.
doi: 10.1073/pnas.1315710110.
2017.01.001.
5.
Renner, M., Lancaster, M.A., Bian, S., Choi, H., Ku, T.,
17.
Conforti, P., Besusso, D., Bocchi, V.D., Faedo, A.,
Peer, A., Chung, K., and Knoblich, J.A. (2017) Self orga
Cesana, E., Rossetti, G., Ranzani, V., Svendsen, C.N.,
nized developmental patterning and differentiation in cere
Thompson, L.M., Toselli, M., Biella, G., Pagani, M., and
bral organoids, EMBO J., 36, 1316-1329, doi: 10.15252/
Cattaneo, E. (2018) Faulty neuronal determination and
embj.201694700.
cell polarization are reverted by modulating HD early phe
6.
Sato, T., Vries, R.G., Snippert, H.J., Wetering, M., Barker, N.,
notypes, Proc. Natl. Acad. Sci. USA, 115, E762-E771,
Stange, D.E., Es, J.H., Abo, A., Kujala, P., Peters, P.J., and
doi: 10.1073/pnas.1715865115.
Clevers, H. (2009) Single Lgr5 stem cells build crypt villus
18.
Lebedeva, O.S., and Lagarkova, M.A. (2018) Pluripotent
structures in vitro without a mesenchymal niche, Nature, 459,
stem cells for modelling and cell therapy of Parkinson’s
262-265, doi: 10.1038/nature07935.
disease, Biochemistry (Moscow), 83, 1046-1056, doi: 10.1134/
7.
Wells, J.M., and Spence, J.R. (2014) How to make an
S0006297918090067.
intestine, Development, 141, 752-760, doi: 10.1242/dev.
19.
Clevers, H. (2016) Modeling development and disease with
097386.
organoids, Cell,
165,
1586-97, doi:
10.1016/j.cell.
8.
Spence, J.R., Mayhew, C.N., Rankin, S.A., Kuhar, M.F.,
2016.05.082.
Vallance, J.E., Tolle, K., Hoskins, E.E., Kalinichenko, V.V.,
20.
Dang, J., Tiwari, S.K., Lichinchi, G., Qin, Y., Patil, V.S.,
Wells, S.I., Zorn, A.M., Shroyer, N.F., and Wells, J.M.
Eroshkin, A.M., and Rana, T.M. (2016) Zika virus depletes
(2011) Directed differentiation of human pluripotent stem
neural progenitors in human cerebral organoids through
cells into intestinal tissue in vitro, Nature, 470, 105-109,
activation of the innate immune receptor TLR3, Cell Stem
doi: 10.1038/nature09691.
Cell, 19, 258-265, doi: 10.1016/j.stem.2016.04.014.
9.
Takasato, M., Er, P.X., Chiu, H.S., Maier, B., Baillie, G.J.,
21.
Chen, K.G., Mallon, B.S., Park, K., Robey, P.G.,
Ferguson, C., Parton, R.G., Wolvetang, E.J., Roost, M.S.,
McKay, R.D.G., Gottesman, M.M., and Zheng, W. (2018)
Chuva de Sousa Lopes, S.M., and Little, M.H. (2015)
Pluripotent stem cell platforms for drug discovery, Trends
Kidney organoids from human iPS cells contain multiple
Mol. Med., 24, 805-820, doi: 10.1016/j.molmed.2018.
lineages and model human nephrogenesis, Nature, 526,
06.009.
564-568, doi: 10.1038/nature15695.
22.
Qian, X., Nguyen, H.N., Jacob, F., Song, H., and Ming,
10.
Takasato, M., Er, P.X., Becroft, M., Vanslambrouck, J.M.,
G.L. (2017) Using brain organoids to understand Zika
Stanley, E.G., Elefanty, A.G., and Little M.H. (2014)
virus induced microcephaly, Development, 144, 952-957,
Directing human embryonic stem cell differentiation
doi: 10.1242/dev.140707.
towards a renal lineage generates a self organizing kidney,
23.
Kelava, I., and Lancaster, M.A. (2016) Stem cell models of
Nat. Cell Biol., 16, 118-26, doi: 10.1038/ncb2894.
human brain development, Cell Stem Cell, 18, 736-748,
11.
Nakano, T., Ando, S., Takata, N., Kawada, M.,
doi: 10.1016/j.stem.2016.05.022.
Muguruma, K., Sekiguchi, K., Saito, K., Yonemura, S.,
24.
Di Lullo, E., and Kriegstein, A.R. (2017) The use of brain
Eiraku, M., and Sasai, Y. (2012) Self formation of optic
organoids to investigate neural development and disease, Nat.
cups and storable stratified neural retina from human
Rev. Neurosci., 18, 573-584, doi: 10.1038/nrn.2017.107.
ESCs, Cell Stem Cell, 10, 771-785, doi: 10.1016/j.stem.
25.
Camp, J.G., Badsha, F., Florio, M., Kanton, S., Gerber, T.,
2012.05.009.
Wilsch Brauninger, M., Lewitus, E., Sykes, A., Hevers, W.,
12.
Eiraku, M., Takata, N., Ishibashi, H., Kawada, M.,
Lancaster, M., Knoblich, J.A., Lachmann, R., Paabo, S.,
Sakakura, E., Okuda, S., Sekiguchi, K., Adachi, T., and
Huttner, W.B., and Treutlein, B. (2015) Human cerebral
Sasai, Y. (2011) Self organizing optic cup morphogenesis in
organoids recapitulate gene expression programs of fetal
three dimensional culture, Nature, 472, 51-56, doi: 10.1038/
neocortex development, Proc. Natl. Acad. Sci. USA, 112,
nature09941.
15672-15677, doi: 10.1073/pnas.1520760112.
13.
Quadrato, G., Nguyen, T., Macosko, E.Z., Sherwood, J.L.,
26.
Xiang, Y., Tanaka, Y., Patterson, B., Kang, Y.J.,
Min Yang, S., Berger, D.R., Maria, N., Scholvin, J.,
Govindaiah, G., Roselaar, N., Cakir, B., Kim, K.Y.,
Goldman, M., Kinney, J.P., Boyden, E.S., Lichtman, J.W.,
Lombroso, A.P., Hwang, S.M., Zhong, M., Stanley, E.G.,
Williams, Z.M., McCarroll, S.A., and Arlotta, P. (2017)
Elefanty, A.G., Naegele, J.R., Lee, S.H., Weissman, S.M.,
БИОХИМИЯ том 84 вып. 3 2019
456
ЕРЕМЕЕВ и др.
and Park, I.H. (2017) Fusion of regionally specified
34.
Krefft, O., Jabali, A., Iefremova, V., Koch, P., and
hPSC derived organoids models human brain develop
Ladewig, J. (2018) Generation of standardized and repro
ment and interneuron migration, Cell Stem Cell, 21,
ducible forebrain type cerebral organoids from human in
383-398, doi: 10.1016/j.stem.2017.07.007.
duced pluripotent stem cells, J. Vis. Exp., 131, 56768-56776,
27. Muguruma, K., Nishiyama, A., Kawakami, H., Hashi
doi: 10.3791/56768.
moto, K., and Sasai, Y. (2015) Self organization of polari
35.
Zweigerdt, R., Olmer, R., Singh, H., Haverich, A., and
zed cerebellar tissue in 3D culture of human pluripotent
Martin, U. (2011) Scalable expansion of human pluripo
stem cells, Cell Rep., 10, 537-550, doi: 10.1016/j.celrep.
tent stem cells in suspension culture, Nat. Protoc., 6,
2014.12.051.
689-700, doi: 10.1038/nprot.2011.318.
28. Jo, J., Xiao, Y., Sun, A.X., Cukuroglu, E., Tran, H.D.,
36.
Eldred, M.K., Charlton Perkins, M., Muresan, L., and
Goke, J., Tan, Z.Y., Saw, T.Y., Tan, C.P., Lokman, H., Lee, Y.,
Harris, W.A. (2017) Self organising aggregates of zebrafish
Kim, D., Ko, H.S., Kim, S.O., Park, J.H., Cho, N.J.,
retinal cells for investigating mechanisms of neural lamina
Hyde, T.M., Kleinman, J.E., Shin, J.H., Weinberger, D.R.,
tion, Development, 144, 1097-1106, doi: 10.1242/dev.142760.
Tan, E.K., Je, H.S., and Ng, H.H. (2016) Midbrain like
37.
Raja, W.K., Mungenast, A.E., Lin, Y.T., Ko, T., Abdurrob, F.,
organoids from human pluripotent stem cells contain func
Seo, J., and Tsai, L.H. (2016) Self organizing 3D human
tional dopaminergic and neuromelanin producing neurons,
neural tissue derived from induced pluripotent stem cells
Cell Stem Cell, 19, 248-257, doi: 10.1016/j.stem.2016.07.005.
recapitulate Alzheimer’s disease phenotypes, PLoS One,
29. Qian, X., Nguyen, H.N., Song, M.M., Hadiono, C.,
11, e0161969, doi: 10.1371/journal.pone.0161969.
Ogden, S.C., Hammack, C., Yao, B., Hamersky, G.R.,
38.
Eiraku, M., and Sasai, Y. (2012) Self formation of layered
Jacob, F., Zhong, C., Yoon, K.J., Jeang, W., Lin, L., Li, Y.,
neural structures in three dimensional culture of ES
Thakor, J., Berg, D.A., Zhang, C., Kang, E., Chickering, M.,
cells, Curr. Opin. Neurobiol., 22, 768-777, doi: 10.1016/
Nauen, D., Ho, C.Y., Wen, Z., Christian, K.M., Shi, P.Y.,
j.conb.2012.02.005.
Maher, B.J., Wu, H., Jin, P., Tang, H., Song, H., and
39.
Belair, D.G., Wolf, C.J., Moorefield, S.D., Wood, C., Be
Ming, G.L. (2016) Brain region specific organoids using
cker, C., and Abbott, B.D. (2018) A three dimensional
mini bioreactors for modeling ZIKV exposure, Cell, 165,
organoid culture model to assess the influence of chemicals
1238-1254, doi: 10.1016/j.cell.2016.04.032.
on morphogenetic fusion, Toxicol. Sci., 166, 394-408,
30. Qian, X., Jacob, F., Song, M.M., Nguyen, H.N., Song, H.,
doi: 10.1093/toxsci/kfy207.
and Ming, G.L. (2018) Generation of human brain region
40.
Liu, S., Xie, B., Song, X., Zheng, D., He, L., Li, G., Gao, G.,
specific organoids using a miniaturized spinning bioreactor,
Peng, F., Yu, M., Ge, J., and Zhong, X. (2018) Self forma
Nat. Protoc., 13, 565-580, doi: 10.1038/nprot.2017.152.
tion of RPE spheroids facilitates enrichment and expansion
31. Sakaguchi, H., Kadoshima, T., Soen, M., Narii, N.,
of hiPSC derived RPE generated on retinal organoid induc
Ishida, Y., Ohgushi, M., Takahashi, J., Eiraku, M., and
tion platform, Invest. Ophthalmol. Vis. Sci., 59, 5659-5669,
Sasai, Y. (2015) Generation of functional hippocampal
doi: 10.1167/iovs.17 23613.
neurons from self organizing human embryonic stem cell
41.
Linxweiler, J., Hammer, M., Muhs, S., Kohn, M., Pryalu
derived dorsomedial telencephalic tissue, Nat. Commun., 6,
khin, A., Veith, C., Bohle, R.M., Stockle, M., Junker, K.,
8896, doi: 10.1038/ncomms9896.
and Saar, M. (2018) Patient derived, three dimensional
32. Nasr, B., Chatterton, R., Yong, J.H.M., Jamshidi, P.,
spheroid cultures provide a versatile translational model for
D'Abaco, G.M., Bjorksten, A.R., Kavehei, O., Chana, G.,
the study of organ confined prostate cancer, J. Cancer Res.
Dottori, M., and Skafidas, E. (2018) Self organized nano
Clin. Oncol., doi: 10.1007/s00432 018 2803 5.
structure modified microelectrode for sensitive electro
42.
Flint, J.J., Menon, K., Hansen, B., Forder, J., and Black
chemical glutamate detection in stem cells derived brain
band, S.J. (2015) A microperfusion and in bore oxygenator
organoids, Biosensors (Basel), 8, E14, doi: 10.3390/
system designed for magnetic resonance microscopy studies on
bios8010014.
living tissue explants, Sci. Rep., 5, 18095, doi: 10.1038/srep18095.
33. Yakoub, A.M., and Sadek, M. (2018) Development and
43.
Salek, M.M., Sattari, P., and Martinuzzi, R.J.
(2012)
characterization of human cerebral organoids: an optimi
Analysis of fluid flow and wall shear stress patterns inside
zed protocol, Cell Transplant., 27, 393-406, doi: 10.1177/
partially filled agitated culture well plates, Ann. Biomed.
0963689717752946.
Eng., 40, 707-728, doi: 10.1007/s10439 011 0444 9.
«NECESSITY IS THE MOTHER OF INVENTION», OR CHEAP, RELIABLE
AND REPRODUCIBLE PROTOCOL OF GENERATING ORGANOIDS
A. V. Eremeev*, E. A. Volovikov, L. D. Shuvalova, A. V. Davidenko, E. A. Khomyakova,
M. E. Bogomiakova, O. S. Lebedeva, O. A. Zubkova, and M. A. Lagarkova*
Federal Research and Clinical Center of Physical Chemical Medicine, Federal Medical Biological
Agency of Russia, 119435 Moscow, Russia; E mail: lagar@rcpcm.org, art eremeev@yandex.ru
Received November 5, 2018
Revised December 7, 2018
Accepted December 7, 2018
Organoids are three dimensional (3D) cell cultures that replicate some of the key features of morphology, spatial
architecture, and functions of a particular organ. Organoids can be generated from both adult and pluripotent stem
cells (PSCs), and also complex organoids can be established by combining different cell types, including differentiated
cells. The ability of pluripotent cells to self organize into organotypic structures containing several cell subtypes spe
cific for a particular organ is being used to create organoids of brain, eye, kidney, intestine, and other organs.
Alongside the benefits of using РSCs for obtaining organoids, significant disadvantages that prevent their widespread
use so far have been a low yield in their obtaining from a pluripotent cell’s monolayer culture and a large variation in
size that leads to great heterogeneity in further differentiation. In this article, we describe our own protocol of genera
ting standardized organoids, with an emphasis on the method of generating brain organoids, which allows scaling up
experiments and makes organoid generation less expensive and easier.
Keywords: differentiation, cell culture, embryonic stem cells, induced pluripotent stem cells, organoids, bioreactor
БИОХИМИЯ том 84 вып. 3 2019