БИОХИМИЯ, 2019, том 84, вып. 4, с. 481 - 493
УДК 577.2
ТРАНСПОРТ ЭРГОСТЕРИНА В КЛЕТКАХ ДРОЖЖЕЙ
Saccharomyces cerevisiae: ФИЗИОЛОГИЧЕСКИЕ
ПОСЛЕДСТВИЯ НАРУШЕНИЯ БИОСИНТЕЗА
И РАСПРЕДЕЛЕНИЯ ЭРГОСТЕРИНА
Обзор
© 2019 С.С. Соколов1*, Н.И. Трушина2, Ф.Ф. Северин1, Д.А. Кнорре1,3
1 НИИ физико химической биологии им. А.Н. Белозерского,
Московский государственный университет им. М.В. Ломоносова,
119991 Москва, Россия; электронная почта: sviatoslav.sokolov@gmail.com
2 Московский государственный университет им. М.В. Ломоносова,
факультет биоинженерии и биоинформатики, 119991 Москва, Россия
3 Первый московский государственный медицинский университет
им. И.М. Сеченова, 119992 Москва, Россия
Поступила в редакцию 01.10.2018
После доработки 21.11.2018
Принята к публикации 21.11.2018
Стерины являются важным компонентом биологических мембран, они определяют их физико химические
свойства и влияют на работу мембранных белков. Будучи нерастворимыми в воде, стерины не могут свобод
но проникать из одной клеточной мембраны в другую через водную фазу. Поэтому распределение стерина
по мембранам разных органелл происходит неравномерно. Перемещение стеринов между мембранами осу
ществляется преимущественно невезикулярным транспортом, с помощью белков семейств Lam и Osh. В об
зоре обсуждаются последствия нарушения биосинтеза и транспорта эргостерина, в качестве примера ис
пользуется модельный организм - пекарские дрожжи Saccharomyces cerevisiae. Несмотря на то, что молеку
лярные механизмы работы Lam и Osh белков хорошо изучены, их биологическая роль остается неясной. Это
связано с тем, что делеции отдельных LAM или OSH генов практически не имеют проявлений. В то же вре
мя нарушение биосинтеза эргостерина приводит к гибели клеток или их сенсибилизации ко многим стрес
сам. Однако в некоторых условиях, таких как мягкий солевой или тепловой стрессы, снижение содержания
эргостерина в мембранах, наоборот, приводит к увеличению относительной приспособленности клеток.
Это говорит о том, что клеткам может быть выгодно быстро менять содержание стеринов в плазматической
мембране. Предполагается, что биологическая роль Lam белков заключается, в частности, в оптимизации
стеринового состава клеточных мембран при изменениях условий внешней среды.
КЛЮЧЕВЫЕ СЛОВА: дрожжи, мембраны, метаболизм, стерины, Lam белки, Osh белки.
DOI: 10.1134/S032097251904002X
Стерины - это основные неполярные липи
кривизны мембран [7], поддержании уровня
ды клеточных мембран эукариот. В клетках жи
проницаемости мембран [8] и регуляции работы
вотных преобладает холестерин, у многих видов
рецепторов [9]. Многие животные, в частности,
грибов, включая наиболее изученный вид - пе
насекомые, не способны синтезировать стери
карские дрожжи Saccharomyces cerevisiae, преоб
ны и нуждаются в получении стеринов с пищей.
ладает эргостерин, а в клетках растений присут
Иногда формируется симбиоз с основным доно
ствуют разнообразные фитостерины [1, 2]. Сте
ром стеринов - грибами аскомицетами [10, 11].
рины играют важную роль в эндоцитозе [3], ста
Так, основным стерином у дрозофил является
билизации мембранных белков [4], сортировке
получаемый ими из дрожжей эргостерин [12].
белков [5, 6], формировании и поддержании
Нематоды Caenorhabditis elegans также не спо
собны к синтезу стеринов [13]. В их мембранах
содержание холестерина относительно неболь
Принятые сокращения: МЛУ - множественная ле
карственная устойчивость; ММК - межмембранные кон
шое, однако он играет важную роль в структуре
такты; ПМ - плазматическая мембрана; ЭР - эндоплазма
мембран. Считается, что в нематодах он выпол
тический ретикулум.
няет сигнальные функции, например, регулиру
* Адресат для корреспонденции.
ет линьку у их личинок [14].
481
482
СОКОЛОВ и др.
Плазматическая мембрана помимо стеринов
тем гетерологической экспрессией ортологич
содержит большое количество сфинголипидов.
ного гена человека. Такая большая доля возмож
Согласно модели «зонтика», такое сочетание
ных замен является максимальной среди всех
липидов вызвано не внутримембранными меж
биосинтетических путей [21]. Пути биосинтеза
молекулярными взаимодействиями, а тем, что
эргостерина и холестерина схожи и различаются
стерины не содержат гидрофильной части.
только на последних стадиях. Биосинтез стери
Крупная гидрофильная группа сфинголипидов,
нов подразделяют на несколько этапов: 1) обра
при относительно малой гидрофобной части,
зование мевалоновой кислоты из ацетил КоА,
необходима для компенсации избытка гидро
2) образование изопентенил дифосфата из мева
фобных молекул стерина в этом участке мемб
лоновой кислоты, 3) образование сквалена из
раны [15]. Стерины являются ключевым липид
изопентенил дифосфата, 4) циклизация сквале
ным компонентом особых мембранных струк
на в ланостерин, 5) превращение ланостерина в
тур, называемых липидными «рафтами». Ли
эргостерин. В биосинтезе эргостерина у дрож
пидные рафты более структурированы и упако
жей S. cerevisiae вовлечены 25 ферментов, назы
ваны плотнее, чем окружающий их липидный
ваемых Erg (ERGosterol biosynthesis - биосинтез
бислой, в них преобладают насыщенные жир
эргостерина [22-25]). Начиная со сквалена, все
ные кислоты [16]. Физико химические свойства
промежуточные продукты биосинтеза эргосте
рафтов отличаются от свойств окружающей этот
рина нерастворимы в водной среде и дальней
рафт мембраны. В частности, рафты толще ос
шие превращения происходят на мембранах эн
тальной мембраны, из за чего на их границе
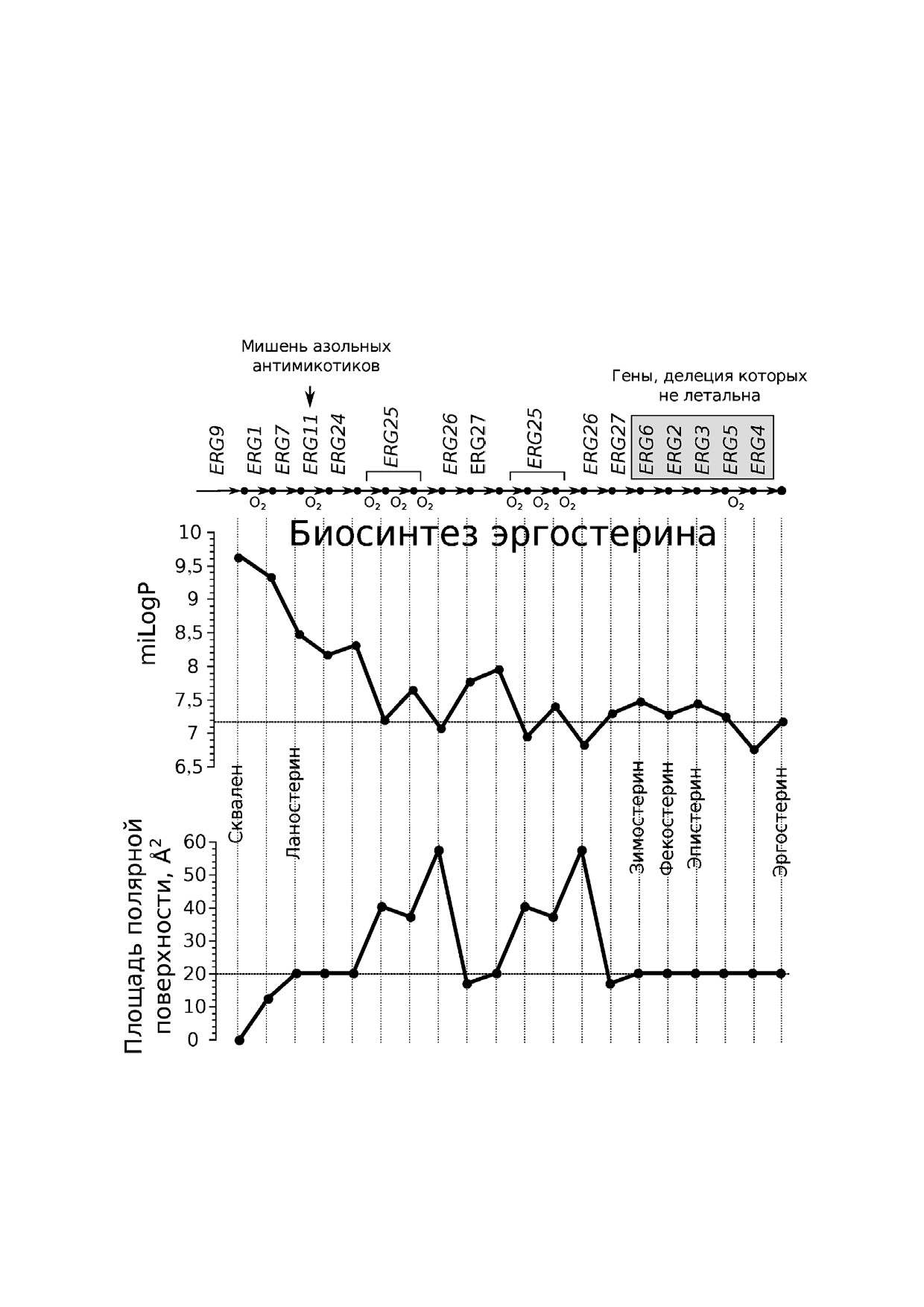
доплазматического ретикулума [22, 23] (рис. 1,
возникает поверхностное натяжение. В то же
см. также работу Hu et al. [25], в которой приве
время стерины делают мембрану устойчивой к
дены структурные формулы интермедиатов пу
действию неионных детергентов [15]. Рафты струк
ти). При этом Erg6р и другие ферменты биосин
турируют плазматическую мембрану: многие бел
теза стеринов, а также эфиры промежуточных про
ки, например, Na+/H+ антипортер Nha1p [17] и
дуктов обнаруживаются в липидных каплях [26].
P АТФаза Pma1p [18] локализованы в рафтах.
Несколько стадий биосинтеза стеринов, осу
Разрушение рафтов приводит к ошибочной ад
ществляемых белками Erg1р (сквален моноок
ресации Pma1p в другие мембраны клетки, что
сигеназа КФ:1.14.13.132), Erg11р (ланостерин де
указывает на функциональную значимость раф
метилаза, цитохром P450 КФ:1.14.13.70), Erg25р
тов при сортировке белков [18]. Таким образом,
(C 4 метил стерин оксидаза КФ:1.14.13.72) и
биологическая роль стеринов обуславливается
Erg5р (C 22 стерин десатураза КФ:1.14.19.41)
как их непосредственным влиянием на физико
требуют присутствия кислорода, поэтому в ана
химические свойства липидных мембран, так и
эробных условиях синтез эргостерина не проис
опосредованно - их наличие влияет на сорти
ходит [23] (рис. 1).
ровку и активность мембранных белков.
Дрожжи S. cerevisiae являются удобным мо
дельным объектом для исследований липидного
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ
обмена. Это связано с простотой проведения ге
ВНУТРИКЛЕТОЧНОГО ТРАНСПОРТА
нетических манипуляций с ними, а также с тем,
СТЕРИНОВ. ФИЗИОЛОГИЧЕСКИЕ
что липидный состав дрожжей хорошо изучен и
ПОСЛЕДСТВИЯ НАРУШЕНИЙ
при этом не так богат, как липидный состав
многоклеточных животных. В дрожжах S. cere
Стерины синтезируются в ЭР, откуда транс
visiae содержится ~250 различных липидов [19],
портируются в другие клеточные мембраны.
а у млекопитающих - более 1000 [20]. У дрож
Несмотря на постоянный липидный обмен
жей эргостерин является одним из самых рас
между мембранами, клетка всегда поддерживает
пространенных липидов, его молярная доля от
градиент стеринов: концентрация стеринов в ЭР
всех липидов составляет до 12%. Больше всего
составляет ~5 молярных %, увеличивается в сек
эргостерина содержится в плазматической
реторных путях и достигает максимума (до 40 мо
мембране, где его концентрация достигает 40%.
лярных %) в ПМ, в которой содержится до 90%
Меньше всего эргостерина - в мембранах мито
клеточных стеринов [27-31]. Скорость транс
хондрий. Во всех остальных мембранах клетки
порта стеринов между ЭР и ПМ довольно высо
молярная доля эргостерина составляет ~5% [19].
ка: показано, что время полувыравнивания но
Синтез стеринов - один из самых консерва
восинтезированного эргостерина с пулом ПМ
тивных биосинтетических путей в эукариоти
составляет 10-15 мин. Это соответствует пере
ческих клетках. Было показано, что потерю
носу ~105 молекул эргостерина ежесекундно. Та
многих генов биосинтеза эргостерина (17 из 19
кая скорость более чем в 10 раз превышает рас
незаменимых генов) можно компенсировать пу
четную величину пополнения эргостеринового
БИОХИМИЯ том 84 вып. 4 2019
ТРАНСПОРТ ЭРГОСТЕРИНА В КЛЕТКАХ ДРОЖЖЕЙ
483
пула ПМ, необходимого для клеточного удвое
Osh и Lam. Последовательности генов, кодиру
ния [32, 33].
ющих белки этих семейств, обнаружены у боль
Ингибирование везикулярного транспорта
шинства крупных таксонов эукариот. Однако
не оказывает существенного влияния на транс
поскольку подробнее всего они изучены на при
порт стеринов в ПМ, поэтому считается, что ос
мере дрожжей S.cerevisiae, в данном обзоре рас
новным путем обмена стеринов между мембра
смотрена роль этих белков и сделан акцент на
нами является невезикулярный транспорт через
транспорте эргостерина в дрожжевой клетке.
водную фазу в комплексе с белком [32]. Транс
Osh-белки. Белковое семейство Osh (Oxysterol
порт осуществляют два семейства эволюционно
binding protein [OSBP] homologs - гомологи окси
консервативных стерин связывающих белков:
стреин связывающих белков) представлено у
Рис. 1. Метаболический путь биосинтеза эргостерина из сквалена в клетках дрожжей S. cerevisiae. На схеме отражена:
1) последовательность реакций и обозначены гены, отвечающие за соответствующие стадии биосинтеза. Обозначены
реакции, включающие в качестве реагента молекулярный кислород; 2) предсказанные in silico (www.molinspiration.com)
изменения logP и площадь полярной поверхности интермедиатов биосинтеза стеринов. На схеме отмечены только неко
торые интермедиаты биосинтеза, имеющие тривиальные названия
БИОХИМИЯ том 84 вып. 4 2019
484
СОКОЛОВ и др.
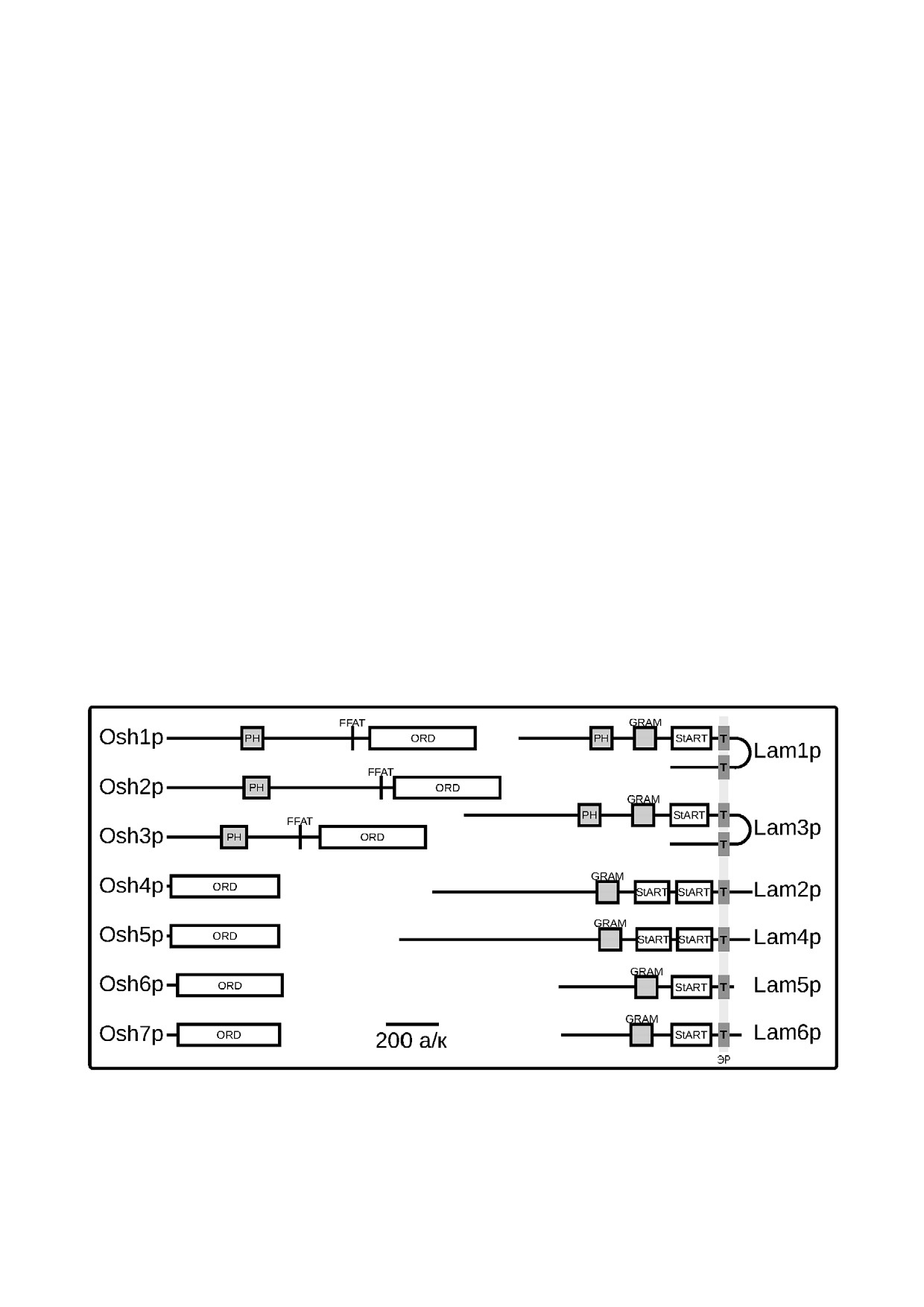
дрожжей S. cerevisiae семью цитоплазматически
мембранным ЭР белком VAP [38] и N концевой
ми белками Osh1p-Osh7p, которые содержат
РН домен, который связывается с поверхностью
~400 аминокислотный липид связывающий
Гольджи через белок Arf1р и фосфатидилинози
ORD (OSBP related domain) домен и являются
тол 4 фосфат [39]. Таким образом, OSBP посред
переносчиками стеринов [34]. В клетках челове
ством FFAT и PH доменов создает ММК, в ко
ка гомологичное OSBP семейство представлено
тором его ORD домен способен быстро обмени
16 белками, закодированными 12 ю генами, со
вать стерины на фосфатидилинозитол 4 фосфат.
держащими варианты сплайсинга [35]. Экспе
Аналогичным доменным устройством обладают
рименты на искусственных мембранах показали,
белки Osh1p, Osh2p и Osh3p S. cerevisiae [40]
что основной Osh белок Osh4p достаточно мед
(рис. 2).
ленно переносит стерины между ними [36]. В даль
Несмотря на принадлежность к Osh белкам,
нейших функциональных и структурных рабо
Osh6p и его близкий гомолог Osh7p транспорти
тах было показано, что Osh4p может связывать не
руют преимущественно не стерины. Их ORD
только стерин, но и фосфатидилинозитол 4 фос
домен обладает большим сродством к фосфати
фат во взаимоисключающей манере и, таким
дилсерину и транспортирует его из ЭР в ПМ,
образом, обменивать эти два липида между
аналогично остальным Osh белкам, обменивая
мембранами [37]. Это открытие послужило объ
на фосфатидилинозитол 4 фосфат [41, 42]. При
яснением молекулярного механизма создания
этом Osh6p и Osh7p способны связывать холес
градиента стеринов в клетках.
терин [43].
Согласно современным моделям, для уско
В работе Beh et al. было проведено широко
рения межмембранного переноса стеринов он
масштабное исследование фенотипических
осуществляется в специализированных местах
последствий нарушений OSH генов и попытка
межмембранных контактов (ММК), где рассто
определить степень их взаимозаменяемости.
яние между мембранами сокращается до 30 нм
Были получены 127 мутантов со всеми комбина
[35]. Механизм формирования и работы ММК
циями нарушений семи OSH генов. Одиночное,
был показан для гомолога Osh OSBP человека,
как и двойные, тройные и даже четверные нару
который также функционирует как стерин/фос
шения OSH генов не приводили к существенно
фатидилинозитол 4 фосфат обменник между
му снижению жизнеспособности в нормальных
ЭР и транс отделом аппарата Гольджи. OSBP
условиях роста. Сверхэкспрессия любого из се
кроме стерин связывающего домена (ORD) со
ми OSH генов на мультикопийной плазмиде
держит FFAT мотив, который связывается с транс
восстанавливала способность к росту штамма с
Рис. 2. Доменная структура Lam и Osh белков дрожжей S. cerevisiae. На схеме обозначены стерин связывающие: StART
подобные домены Lam белков и ORD Osh белков; РН домен, который связывается с поверхностью Гольджи через белок
Arf1p и фосфатидилинозитол 4 фосфат; GRAM РН подобный домен Lam белков; FFAT мотив, который связывается с
трансмембранным ЭР белком VAP; Т - трансмембранный домен, заякоренный в ЭР
БИОХИМИЯ том 84 вып. 4 2019
ТРАНСПОРТ ЭРГОСТЕРИНА В КЛЕТКАХ ДРОЖЖЕЙ
485
нарушением всех семи OSH генов. Все мутанты
полость, которая может связывать стерины.
были проверены на фенотипы, типичные для
Субстратная специфичность Lam белков до сих
штаммов с нарушением стеринового обмена, та
пор полностью не определена. Однако, по всей
кие, как изменение чувствительности к добавле
видимости, Lam белки способны переносить
нию в среду роста ловастатина (ингибитор
довольно широкую группу стеринов. Так, нап
HMG CoA редуктазы, осуществляющей лими
ример, Lam2p (Ysp2p) способен переносить не
тирующий этап биосинтеза стеринов и изопре
только эргостерин, но также холестерин и ди
ноидов) [44], нистатина (полиеновый противо
гидро эргостерин [48]. С другой стороны, не
грибковый антибиотик, связывающийся с эрго
давно была определена структура стерин связы
стерином клеточной мембраны и образующий
вающего StART домена Lam2p. Выяснилось, что
каналы) [45], высоких концентраций хлорида
сайт связывания эргостерина расположен ближе
натрия. Одиночные нарушения osh2 и osh4 при
ко входу в карман, чем считалось ранее. В то же
водили к устойчивости к нистатину, но не изме
время в глубине кармана содержится несколько
няли суммарного содержания эргостерина в
молекул структурированной воды, образующих
клетках. Поэтому было предположено, что
водородные связи с 3 гидроксильной группой
Osh2р и Osh4р участвуют в транспорте эргосте
эргостерина [48]. Опубликованная структура и
рина к ПМ. Нарушение osh1 приводило к повы
проведенный авторами мутационный анализ
шенной чувствительности к ловостатину. Нару
кармана связывания позволяет предположить,
шение osh5 или osh6 повышало суммарное со
что константа связывания эргостерина с белком
держание стеринов в клетках в полтора раза.
Lam2p может быть все же несколько выше, чем
Нарушение всех семи OSH генов приводило к
константы связывания этого белка с интермеди
3,5 кратному увеличению суммарного содержа
атами биосинтеза эргостерина.
ния эргостерина в клетках. Был сделан вывод,
Lam семейство представлено у дрожжей S. ce
что OSH1, OSH5 и OSH6 каким то образом во
revisiae шестью Lam1р Lam6р белками. Их отли
влечены в регуляцию биосинтеза эргостерина.
чительной от Osh белков особенностью являет
Однако, несмотря на существенную взаимоза
ся наличие трансмембранного С концевого до
меняемость, все Osh белки, по всей видимости,
мена, заякоренного в ЭР. Гены LAM1 LAM6 яв
имеют и свою уникальную роль: во первых, про
ляются попарными гомологами, возникшими в
фили экспрессии генов в OSH мутантах отлича
результате полногеномной дупликации (рис. 2).
лись друг от друга и от дикого типа; исключение
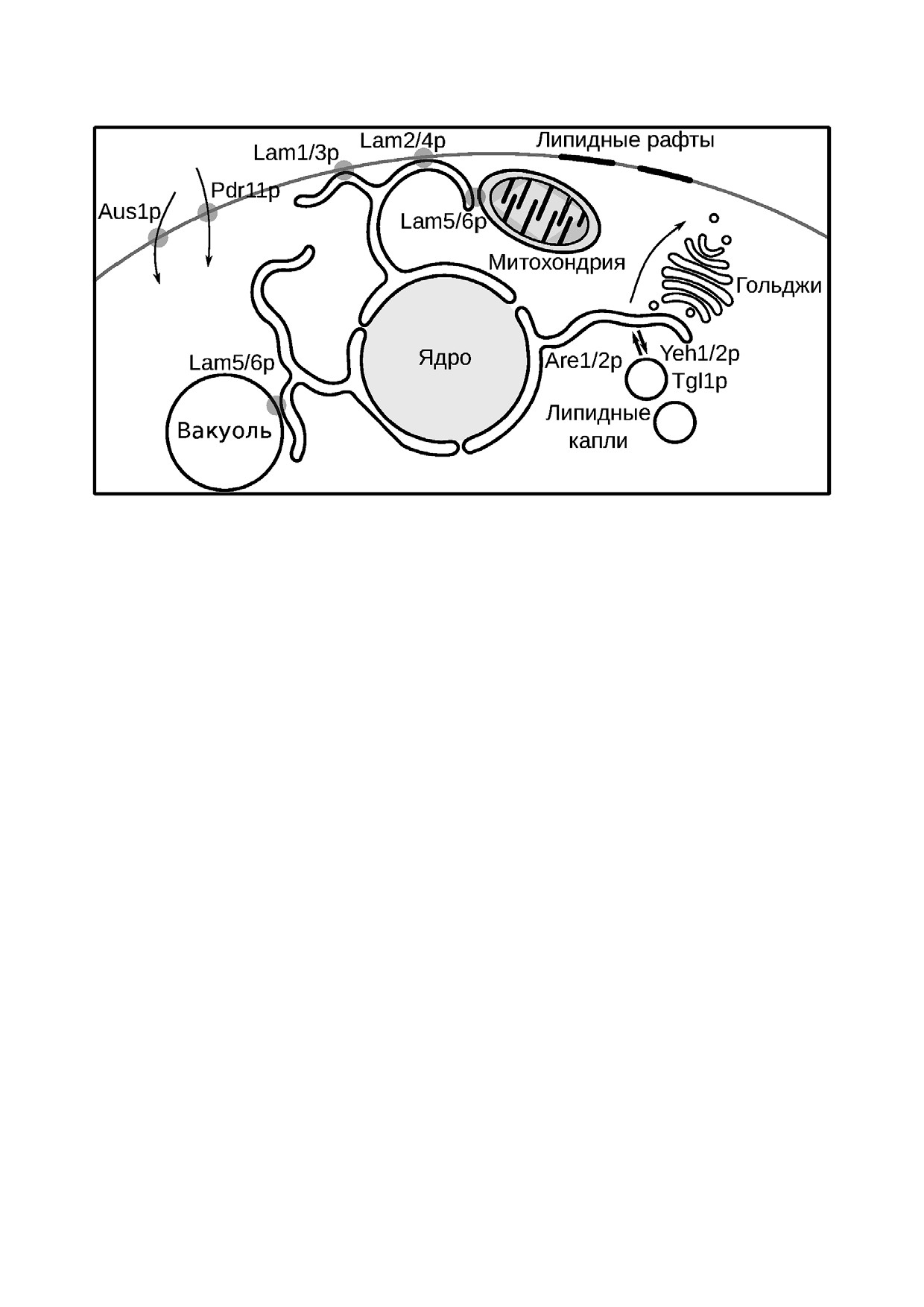
Lam белки локализованы в ММК ЭР с осталь
составили относительно схожие osh5 и osh6. Во
ными мембранами: Lam1р(Ysp1р), Lam2р(Ysp2р),
вторых, оказалось, что многие тройные делеции
Lam3р(Sip3р) и Lam4р находятся в ММК ЭР и
OSH генов более вредны для клетки, чем четвер
ПМ [47], Lam5р и Lam6р в ЭР митохондриаль
ные. Это предполагает антагонистичность дейст
ных и ЭР вакуолярных контактах [47, 49] (рис. 3).
вия отдельных Osh белков. Например, если два
Причем Lam содержащие ММК не совпадают с
отдельно взятых Osh белка участвуют в переносе
известными ММК и являются новым типом меж
липидов в противоположном направлении, то
мембранных контактов. Основной функцией
делеция одного из них теоретически может при
Lam является либо непосредственный невезику
водить к большему изменению липидного сос
лярный транспорт стеринов, либо организация
тава мембран, чем делеция сразу обоих генов.
транспорта стеринов цитозольными Osh белками
В третьих, было показано, что функция Osh5p
в контактных сайтах между ЭР и другими мембра
иногда оказывается противоположной функци
нами. Способность Lam белков непосредственно
ям Osh3p и Osh6p. Об этом говорит то, что нару
переносить стерины между мембранами была по
шение osh1 и osh4 самих и в комбинации с дру
казана экспериментально [47, 48]. Также сущест
гими OSH приводит к увеличению чувствитель
вует модель, согласно которой основной функци
ности клеток к 1,2 М NaCl, а нарушение osh6 и
ей Lam может быть организация ММК и функци
osh7, напротив, к устойчивости [46].
онирования Osh белков в нем [50]. Примечатель
Lam-белки. Биоинформатический анализ,
но, что белки Lam и Osh, согласно доступной ин
выполненный в группе T. Levine, показал еще
формации из базы данных о белковых семействах
одно эволюционно консервативное белковое
Pfam [51], закодированы в геноме насекомых, ко
семейство, содержащее стерин связывающий
торые, как обсуждалось выше, не способны син
StART подобный домен (steroidogenic acute regu
тезировать стерины. Это свидетельствует о том,
latory transfer). Данные белки были названы Lam
что белки этих семейств могут осуществлять и об
(lipid transfer protein anchored at a membrane contact
ратный транспорт стеринов от плазматической
site - липид переносящие белки, заякоренные в
мембраны к мембранам клеточных органелл.
местах контактов мембран) [47]. StART подоб
Нарушение отдельных LAM генов не меняет
ные домены Lam белков имеют гидрофобную
скорости роста клеток S. cerevisiae в оптималь
БИОХИМИЯ том 84 вып. 4 2019
486
СОКОЛОВ и др.
Рис. 3. Основные места транспорта стеринов в S. cerevisiae. Мембранные белки транспортеры стеринов обозначены серыми
кружками. Стрелки указывают направление транспорта стеринов
ных условиях. Единственным известным нам за
ствии в них Mdm34p (субъединица ЭР митохо
документированным фенотипом штамма Δysp2
ндриального ММК ERMES). LAM6 необходим
(Δlam2) является повышенная раздробленность
для образования стерин богатых доменов в ва
митохондриальной сети в стационарной фазе
куолях в ответ на стресс [49]. Делеция сразу обо
роста [52]. Это согласуется с тем, что распреде
их паралогичных генов lam2 и lam4 приводит к
ление стеринов по мембранам клетки может
заметному увеличению резистентности мемб
оказывать влияние на митохондриальную дина
ран к ингибитору биосинтеза сфинголипидов -
мику: репрессия некоторых генов, необходимых
мириоцину [58], в то время как делеция каждого
для биосинтеза эргостерина, вызывает значи
из них по отдельности не оказывает никакого
тельные нарушения структуры митохондриаль
эффекта. Мы предполагаем, что проявление яв
ной сети [53]. Отсутствие выраженных феноти
ных фенотипов делеций в стрессорных условиях
пов делеций говорит о том, что, по всей види
указывает на то, что 1) в условиях стресса функ
мости, паралогичные LAM гены дрожжей спо
ции одного из двух паралогичных генов оказы
собны взаимозаменять друг друга.
вается недостаточно для нужд клетки или о том,
Нарушение LAM генов может приводить как
что 2) функция Lam белков востребована, в пер
к снижению, так и к значительному увеличению
вую очередь, в стрессорных условиях. Следует
устойчивости клеток к стрессу. Так, LAM1 (YSP1)
отметить, что эти два предположения не явля
и LAM2 (YSP2, LTC4) изначально были охарак
ются взаимоисключающими.
теризованы нами как гены, продукты которых
участвуют в развитии клеточной гибели, выз
ванной амиодароном, альфа фактором или ук
ФИЗИОЛОГИЧЕСКИЕ ПОСЛЕДСТВИЯ
сусной кислотой [52, 54, 55]. Гены были названы
НАРУШЕНИЯ БИОСИНТЕЗА
YSP1 (yeast suicidal protein) и YSP2 соответствен
ЭРГОСТЕРИНА
но [54, 55]. Нарушение lam3 (SIP3) приводит к
многократному увеличению устойчивости кле
Поскольку невезикулярный транспорт сте
ток S. cerevisiae к миконазолу [56] и хинину [57].
ринов вносит основной вклад в обмен стеринов
Делеции lam1, lam2 и lam3, но не lam4 (LTC3),
между мембранами, можно предположить, что
lam5 и lam6 приводят к гиперчувствительности к
нарушение транспорта стеринов вызывает такие
амфотерицину В, токсичность которого опосре
же (или похожие) изменения в клетке, что и на
дована связыванием со стеринами [47]. Наруше
рушение биосинтеза стеринов. В этом разделе
ние lam6 (LTC1) влияет на рост клеток при отсут
мы рассмотрим последствия нарушения био
БИОХИМИЯ том 84 вып. 4 2019
ТРАНСПОРТ ЭРГОСТЕРИНА В КЛЕТКАХ ДРОЖЖЕЙ
487
синтеза стеринов на примере клеток дрожжей.
ность клеток к его субстратам, таким как цикло
В отличии от переносчиков стеринов, делеция
гексимид [68], а делеция erg2 erg6 генов в такой
большинства ERG генов летальна. Исключение
системе значительно снижала этот защитный
составляют пять последних ферментов, кодиру
эффект [69]. Позднее было показано, что добав
емых генами ERG2-ERG6 и осуществляющих
ление экзогенного эргостерина на фоне мута
превращение зимостерина в эргостерин [59, 60].
ции upc2 1, активирующей способность клеток
Вероятно, это связано с тем, что последние семь
поглощать внеклеточные стерины, позволяет
последних интермедиатов биосинтеза эргосте
частично компенсировать неблагоприятный
рина довольно слабо отличаются от эргостерина
эффект делеции erg2 на защиту клетки от цикло
по ключевым физико химическим свойствам -
гексимида. Повышенная проницаемость плаз
гидрофобности и площади полярной поверх
матической мембраны erg2 для циклогексимида
ности (рис. 1). Нарушение этих генов не убивает
объяснялась увеличением анизотропии мембра
клетки дрожжей [61], но меняет их устойчивость
ны [67]. Из за нарушений барьерной функции
к некоторым стрессам [62, 63]. В стандартных
плазматической мембраны и снижения актив
лабораторных условиях на богатой среде неле
ности помп МЛУ клетки дрожжей с делециями
тальные ERG мутанты, за исключением erg5,
генов последних стадий биосинтеза эргостерина
растут с такой же кинетикой, как у дикого типа.
обычно оказываются сверхчувствительными к
Снижении скорости роста erg5 обусловлено его
ингибиторам, чьи мишени локализованы в ци
участием не только в биосинтезе эргостерина,
топлазме клетки [70-72].
но и в биосинтезе ненасыщенных жирных кис
Нарушение работы неспецифических ABC
лот в митохондриях. Нарушение erg5 приводит к
переносчиков в плазматической мембране не
образованию дыхательно некомпетентных кле
является единственной причиной повышенной
ток в популяции [64]. Однако в стрессовых усло
чувствительности клеток дрожжей с нарушен
виях (высушивание, гиперосмотический стресс,
ными системами синтеза эргостерина к стрес
тепловой стресс) выживание ERG мутантов су
сам. Изменение стеринового состава в клетках
щественно снижается [65].
приводит к изменению резистентности к стрес
Выявление непосредственной роли эргосте
сам, непосредственно не связанным с работой
рина в защите клеток от стресса затруднено,
помп МЛУ. Так, делеция генов erg3 или erg6 сни
поскольку нарушение его биосинтеза приводит
жает устойчивость дрожжей к перекиси водоро
не только к исчезновению эргостерина из кле
да. Данный эффект, по всей видимости, связан с
точных мембран, но и к значительным вторич
ограниченной скоростью диффузии перекиси
ным перестройкам, в том числе к изменению
водорода через мембраны, содержащие эргосте
содержания различных сфинголипидов в этих
рин [73]. В то же время, добавление экзогенного
мембранах [66]. В то же время добавление экзо
эргостерина приводит к увеличению чувствитель
генного эргостерина к таким клеткам требует
ности клеток к прооксиданту менадиону [74].
дополнительных вмешательств в геном дрожжей
Это позволяет предположить, что главным вкла
или создания анаэробиоза, что создает неопре
дом эргостерина в антиоксидантную защиту клет
деленности при интерпретации результатов та
ки является ограничение диффузии перекиси во
ких экспериментов. Кроме того, изменение сте
дорода через плазматическую мембрану. С дру
ринового состава плазматической мембраны ме
гой стороны, как было показано, мутация по erg5
няет как свойства фосфолипидного бислоя [67],
(и в меньшей степени erg2 и erg4) сенсибилизи
так и активность белков, входящих в ее состав.
рует клетки к терт бутилгидропероксиду [75]),
Так, например, в клетках дикого типа перенос
что указывает на роль стеринов в защите мембран
чик триптофана Tat2p локализован в ПМ при
от перекисного окисления ее липидов.
низком содержании триптофана в клетке и в ва
Делеции генов erg2 и erg6 увеличивают
куоли - при высоком. Однако в штамме с деле
чувствительность клеток к высокой концентра
цией гена erg6 белок Tat2p адресуется в вакуоль
ции солей [76]. По всей видимости, это связано
вне зависимости от концентрации триптофана.
с повышением трансмембранного потенциала
Это делает мутацию erg6 летальной в штамме,
на плазматической мембране. Штаммы erg2 и
ауксотрофном по триптофану [6].
erg6 с большой скоростью захватывают ионы ме
Было показано, что работа неспецифичес
таллов (Li+, Na+), а также липофильный катион
ких ABC переносчиков, являющихся частью
метиловый фиолетовый [76, 77]. Этот же эффект
системы множественной лекарственной устой
служит причиной повышенной чувствительнос
чивости (МЛУ) клетки, зависит от наличия эр
ти мутантов по генам биосинтеза эргостерина к
гостерина. Сверхэкспрессия гена основного
тетраметиламмонию [78].
неспецифического ABC переносчика плазмати
На разобранных выше примерах видно, что
ческой мембраны PDR5 увеличивала резистент
наличие оптимального набора стеринов в плаз
БИОХИМИЯ том 84 вып. 4 2019
488
СОКОЛОВ и др.
матической мембране клетки определяет изби
Транскрипционные факторы Upc2p и
рательность ее проницаемости и способствует
Ecm22p являются сенсорами стеринов в клетке,
нормальной работе белков, расположенных в
это паралоги, возникшие в результате полноге
этой мембране. Тем не менее, нарушение по
номной дупликации. Они являются основными
следних стадий биосинтеза эргостерина могут
регуляторами биосинтеза эргостерина в клетках
приводить и к увеличению резистентности к
дрожжей. В условиях низкой концентрации сте
стрессам. Так делеция генов erg2 erg5 увеличива
ринов (например, в условиях гипоксии, так как
ла скорость роста клеток при 39,5 °C [63]. Деле
без кислорода невозможен синтез эргостерина,
ция erg5 увеличивает устойчивость клеток дрож
см рис. 1) Upc2p индуцирует экспрессию генов
жей к калиевому ионофору валиномицину, одна
пути биосинтеза эргостерина, связываясь с ре
ко стоит отметить, что делеция гена erg3, отвеча
гуляторным элементом в области промотора.
ющего за предыдущий этап биосинтеза эргосте
Связывание эргостерина с Upc2p репрессирует
рина, вызывает обратный эффект [62]. Прерыва
его транскрипционную активность. Это проис
ние пути биосинтеза эргостерина на уровне
ходит предположительно из за того, что связы
ERG11, вызванное добавлением флюконазола в
вание эргостерина закрывает адресную последо
небольшой концентрации (20 мкМ), приводит к
вательность белка ядерной локализации [81].
увеличению скорости роста клеток в присут
При гипоксии Upc2p также индуцирует продук
ствии 400 мМ NaCl. Более того, в таких условиях
цию ABC переносчиков Aus1p и Pdr11p, кото
клетки сами пытаются выключить биосинтез эр
рые участвуют в захвате стеринов из среды [82]
гостерина: добавление 400 мМ NaCl снижает
(рис. 3).
уровень экспрессии генов ERG11, ERG2 и ERG3
Существует много механизмов регуляции го
[74]. Это говорит о том, что изменение стерино
меостаза стеринов в аэробных условиях. Один
вого состава мембран может быть адаптивным
из способов - это запасание избытка стеринов в
ответом на повышенную концентрацию соли во
виде сложных эфиров в липидных каплях. Дру
внешней среде. Мы предполагаем, что одной из
гой - экспорт стеринов в среду в ацетилирован
функций невезикулярного транспорта стеринов
ном виде. Ацетилирование стеринов может так
может быть быстрое изменение липидного соста
же служить для удаления поврежденных моле
ва плазматической мембраны в условиях стресса.
кул. Эта реакция в клетках дрожжей осущест
вляется ацетилтрансферазой Atf2p, а деацетили
рование - деацетилазой Say1p, оба этих фер
РЕГУЛЯЦИЯ БИОСИНТЕЗА
мента располагаются в ЭР [83]. Новосинтезиро
ЭРГОСТЕРИНА. ТРАНСПОРТ СТЕРИНОВ
ванный эргостерин тоже ацетилируется Arf2p,
ИЗ ВНЕШНЕЙ СРЕДЫ. ЗАПАСАНИЕ
но быстро деацетилируется Say1p; при этом нез
В ЛИПИДНЫХ КАПЛЯХ
релые интермедиаты биосинтеза эргостерина
также могут ацетилироваться, но не деацетили
Содержание стеринов в мембранных компарт
руются. Для удаления ацетилированных стери
ментах определяется не только скоростью его
нов они доставляются к ПМ, где связываются с
транспорта между этими компартментами, но и
белками (pathogen related yeast - Pry), способ
скоростью его биосинтеза. В этом разделе мы
ными связывать стерины [84]. Два белка этого
рассматриваем регуляторные механизмы, поз
семейства - Pry1p и Pry2p - являются секрети
воляющие клеткам дрожжей поддерживать со
руемыми, и мутанты по этим генам не могут сек
держание эргостерина в мембранах на прибли
ретировать ацетилированные стерины. Этери
зительно постоянном уровне. Регуляция синте
фикация стеринов и гидролиз стериновых эфи
за стеринов очень важна, поскольку избыток сте
ров служат для поддержания оптимального со
ринов токсичен для клеток. Поддержание коли
отношения стеринов в различных клеточных
чества стеринов достигается механизмами об
компартментах [85].
ратной связи на транскрипционном, трансля
Избыток свободных стеринов в ЭР может
ционном и посттрансляционном уровнях [79].
быть этерефицирован с длинноцепочечными
Способность дрожжей противостоять стрессу
жирными кислотами двумя ЭР локализованны
часто связана с уровнем содержания эргостери
ми ацил СоА: стерин ацилтрансферазами, Are1p
на. Так, например, содержание эргостерина в
and Are2p, а образованный стериновый эфир за
штаммах дрожжей, устойчивых к заморажива
пасается в липидных каплях [86-88] (рис. 3).
нию, выше, чем в обычных дрожжах. В условиях
Are1p работает в основном в условиях гипоксии,
высоких концентраций этанола в среде S. cere
Are2p активна в аэробных условиях [89]. Благо
visiae увеличивают содержание эргостерина для
даря ацилтрансферазе Are2p в аэробных услови
предотвращения повреждения и поддержания
ях флуоресцентный аналог эргостерина, дегид
нормальной проницаемости мембран [80].
роэргостероин, перераспределяется внутри клет
БИОХИМИЯ том 84 вып. 4 2019
ТРАНСПОРТ ЭРГОСТЕРИНА В КЛЕТКАХ ДРОЖЖЕЙ
489
ки и собирается в липидные капли, для чего тре
мейства Lam, выравнивают эти градиенты. С чем
буется ATP [90]. За обратный процесс в дрожжах
может быть связано наличие такой противопо
отвечают три гидролазы сложных эфиров Yeh1p,
ложно направленной активности переносящих
Yeh2p и Tgl1p [91, 92]. Tgl1p и Yeh1p локализуют
белков? Мы предполагаем, что функционирова
ся в липидных каплях, а Yeh2p - в плазматичес
ние этой системы необходимо для того, чтобы
кой мембране, где наблюдается наибольшая
клетка имела возможность быстро менять со
гидролазная активность. Этерификация стери
держание эргостерина в плазматической мем
нов и запасание в липидных каплях -потенци
бране при резком изменении условий среды. Это
альный механизм предотвращения избыточного
может быть важным для защиты как от гиперос
накопления стеринов в мембранах. Процесс
мотического стресса, так и от бактериальных
этерификации не является жизненно важным
токсинов, способных встраиваться в стерин со
при росте в стандартных условиях, что свиде
держащую мембрану эукариотической клетки
тельствует о достаточности регуляции скорости
(см. [99]). Кроме того, поскольку возможности
биосинтеза и транспорта стеринов в клетке для
эукариот по утилизации стеринов ограничены,
предотвращения избыточного накопления сте
можно предположить, что обмен стеринов меж
ринов. Липидные капли формируются из ЭР и
ду мембранами и липидными каплями позволя
состоят преимущественно из триацилглицерина
ет клетке поддерживать их концентрацию в
и эфиров стеринов, окруженных фосфолипида
мембранах на относительно постоянном (опти
ми. Подробно о строении и роли липидных ка
мальном) уровне. Липидные капли могут высту
пель в метаболизме (см. обзоры [93, 94]). Многие
пать в качестве резервуара для стеринов и, в со
белки биосинтеза эргостерина присутствуют в
вокупности с системами транспорта, уменьшать
липидных каплях [94], Erg6p считается маркер
необходимость тонкой регуляции биосинтеза
ным белком для липидных капель [95].
стеринов - мультистадийного процесса, завися
Еще один белок, который участвует в перено
щего от многих внешних факторов (например,
се стеринов и поглощении экзогенных стеринов,
от наличия кислорода). Многие аспекты меха
кодируется геном ARV1 и обнаружен среди раз
низма работы и биологической роли стерин
личных эукариот. Делеция arv1 приводит к уве
транспортирующих белков остаются до сих пор
личению уровней стеринов в ЭР и в мембранах
нераскрытыми. Это обусловлено взаимозаменя
вакуолей, а также к уменьшению содержания
емостью функций этих белков друг другом в
стеринов в плазматической мембране. Поглоще
пределах каждого из семейств. Например, не до
ние стеринов из среды в клетках с инактивиро
конца ясна субстратная специфичность стерин
ванным arv1 нарушено. Ортолог ARV1 человека
связывающих доменов. Неизвестно, способны
способен восполнить нарушение arv1 в S. cere
ли Lam белки переносить модифицированные
visiae [96]. Нарушение гомолога ARV1 в млекопи
молекулы стеринов или интермедиаты его био
тающих приводило к аналогичным последстви
синтеза. Также пока неясно, существуют ли
ям, кроме того повышался уровень желчных
посттрансляционные механизмы регуляции ак
кислот [97]. Нарушение arv1 не влияет на транс
тивности стерин переносящих систем. Решение
порт стеринов между ПМ и ЭР. Вместо этого ис
этих вопросов позволит получить полную кар
следователи показали различия в морфологии ЭР
тину пространственной организации потока
и организации липидного бислоя ПМ между клет
стеринов в эукариотической клетке.
ками дикого типа и arv1, что указывает на роль
Arv1р в мембранном гомеостазе. В клетках arv1
проявляются специфические дефекты, позволя
Финансирование
ющие предположить, что Arv1р катализирует встра
ивание в мембраны белков с якорным C терми
Работа выполнена при поддержке гранта
нальным одинарным трансмембранным доме
РНФ (18 14 00151).
ном, вовлеченных в гомеостаз мембран [98].
Конфликт интересов
Доступная на данный момент информация о
механизмах синтеза, транспорта, запасания и
Авторы заявляют об отсутствии конфликта
экспорта стеринов в клетках дрожжей говорит о
интересов.
том, что клетка инвестирует существенные ре
сурсы в транспорт стеринов между клеточными
Благодарности
мембранами. При этом, с одной стороны, ак
тивность Osh белков способствует созданию и
Мы очень благодарны рецензентам за цен
поддержанию градиентов стеринов. С другой сто
ные замечания, а также Аглае Азбаровой за по
роны, отдельные Osh белки, а также белки се
мощь с редактированием нашей рукописи.
3 БИОХИМИЯ том 84 вып. 4 2019
490
СОКОЛОВ и др.
СПИСОК ЛИТЕРАТУРЫ
1.
Desmond, E., and Gribaldo, S. (2009) Phylogenomics of
gun mass spectrometry, Proc. Natl. Acad. Sci. USA, 106,
sterol synthesis: insights into the origin, evolution, and
2136-2141, doi: org/10.1073/pnas.0811700106.
diversity of a key eukaryotic feature, Genome Biol. Evol., 1,
20.
Sampaio, J.L., Gerl, M.J., Klose, C., Ejsing, C.S., Beug, H.,
364-381, doi: org/10.1093/gbe/evp036.
Simons, K., and Shevchenko A. (2011) Membrane
2.
Weete, J.D., Abril, M., and Blackwell, M.
(2010)
lipidome of an epithelial cell line, Proc. Natl. Acad. Sci.
Phylogenetic distribution of fungal sterols, PLoS One, 5,
USA, 108, 1903-1907, doi: org/10.1073/pnas.1019267108.
e10899, doi: org/10.1371/journal.pone.0010899.
21.
Kachroo, A.H., Laurent, J.M., Yellman, C.M., Meyer, A.G.,
3.
Souza, C.M., and Pichler, H. (2007) Lipid requirements
Wilke, C.O., and Marcotte, E.M. (2015) Evolution.
for endocytosis in yeast, Biochim. Biophys. Acta, 1771,
Systematic humanization of yeast genes reveals conserved
442-454, doi: org/10.1016/j.bbalip.2006.08.006.
functions and genetic modularity, Science, 348, 921-925,
4.
Gimpl, G., and Fahrenholz, F. (2002) Cholesterol as stabi
doi: org/10.1126/science.aaa0769.
lizer of the oxytocin receptor, Biochim. Biophys. Acta, 1564,
22.
Daum, G., Lees, N.D., Bard, M., and Dickson, R. (1998)
384-392.
Biochemistry, cell biology and molecular biology of lipids
5.
Mayor, S., Sabharanjak, S., and Maxfield, F.R. (1998)
of Saccharomyces cerevisiae, Yeast, 14, 1471-1510.
Cholesterol dependent retention of GPI anchored pro
23.
Kristan, K., and Rizner, T.L. (2012) Steroid transforming
teins in endosomes, EMBO J., 17, 4626-4638, doi: org/
enzymes in fungi, J. Steroid Biochem. Mol. Biol., 129,
10.1093/emboj/17.16.4626.
79-91, doi: org/10.1016/j.jsbmb.2011.08.012.
6.
Umebayashi, K., and Nakano, A. (2003) Ergosterol is
24.
Klug, L., and Daum, G. (2014) Yeast lipid metabolism at a
required for targeting of tryptophan permease to the yeast
glance, FEMS Yeast Res., 14, 369-388, doi: org/10.1111/
plasma membrane, J. Cell. Biol., 161, 1117-1131, doi: org/
1567 1364.12141.
10.1083/jcb.200303088.
25.
Hu, Z., He, B., Ma, L., Sun, Y., Niu, Y., and Zeng, B.
7.
Lucero, H.A., and Robbins, P.W. (2004) Lipid rafts protein
(2017) Recent advances in ergosterol biosynthesis and regu
association and the regulation of protein activity, Arch.
lation mechanisms in Saccharomyces cerevisiae, Indian J.
Biochem. Biophys., 426, 208-224, doi: org/10.1016/j.abb.
Microbiol., 57, 270-277, doi: org/10.1007/s12088 017
2004.03.020.
0657 1.
8.
Mullner, H., and Daum, G. (2004) Dynamics of neutral
26.
Zinser, E., Paltauf, F., and Daum, G. (1993) Sterol com
lipid storage in yeast, Acta Biochim. Polonica, 51, 323-47,
position of yeast organelle membranes and subcellular dis
doi: org/035001323.
tribution of enzymes involved in sterol metabolism, J. Bac
9.
Gimpl, G., Burger, K., and Fahrenholz, F.
(1997)
teriol., 175, 2853-2858.
Cholesterol as modulator of receptor function,
27.
Lange, Y., Swaisgood, M.H., Ramos, B.V., and Steck, T.L.
Biochemistry,
36,
10959-10974, doi: org/10.1021/
(1989) Plasma membranes contain half the phospholipid
bi963138w.
and 90% of the cholesterol and sphingomyelin in cultured
10.
Blackwell, M. (2017) Made for each other: ascomycete
human fibroblasts, J. Biol. Chem., 264, 3786-3793.
yeasts and insects, Microbiol. Spect., 5, doi: org/10.1128/
28.
Schneiter, R., Brugger, B., Sandhoff, R., Zellnig, G.,
microbiolspec.FUNK 0081 2016.
Leber, A., Lampl, M. Athenstaedt, K., Hrastnik, C., Eder, S.,
11.
Clark, A.J., and Block, K. (1959) The absence of sterol
Daum, G., Paltauf, F., Wieland, F.T., and Kohlwein, S.D.
synthesis in insects, J. Biol. Chem., 234, 2578-2582.
(1999) Electrospray ionization tandem mass spectrometry
12.
Rietveld, A., Neutz, S., Simons, K., and Eaton, S. (1999)
(ESI MS/MS) analysis of the lipid molecular species com
Association of sterol and glycosylphosphatidylinositol
position of yeast subcellular membranes reveals acyl chain
linked proteins with Drosophila raft lipid microdomains,
based sorting/remodeling of distinct molecular species en
J. Biol. Chem., 274, 12049-12054.
route to the plasma membrane, J. Cell Biol., 146, 741-754.
13.
C. elegans Sequencing Consortium
(1998) Genome
29.
Brugger, B., Sandhoff, R., Wegehingel, S., Gorgas, K.,
sequence of the nematode C. elegans: a platform for inves
Malsam, J., Helms, J.B., Lehmann, W.D., Nickel, W., and
tigating biology, Science, 282, 2012-2008.
Wieland, F.T. (2000) Evidence for segregation of sphin
14.
Kurzchalia, T.V., and Ward, S. (2003) Why do worms need
gomyelin and cholesterol during formation of COPI coated
cholesterol? Nat. Cell Biol., 5, 684-688, doi: org/10.1038/
vesicles, J. Cell Biol., 151, 507-518.
ncb0803 684.
30.
Klemm, R.W., Ejsing, C.S., Surma, M.A., Kaiser, H. J.,
15.
Huang, J., and Feigenson, G.W. (1999) A microscopic
Gerl, M.J., Sampaio, J.L., de Robillard, Q., Ferguson, C.,
interaction model of maximum solubility of cholesterol in
Proszynski, T.J., Shevchenko, A., and Simons, K.
(2009)
lipid bilayers, Biophys. J., 76, 2142-2157, doi: org/10.1016/
Segregation of sphingolipids and sterols during formation
S0006 3495(99)77369 8.
of secretory vesicles at the trans Golgi network, J. Cell
16.
Simons, K., and Ehehalt, R. (2002) Cholesterol, lipid rafts,
Biol., 185, 601-612, doi: org/10.1083/jcb.200901145.
and disease, J. Clin. Invest., 110, 597-603, doi: org/10.1172/
31.
Mesmin, B., and Maxfield, F.R. (2009) Intracellular sterol
JCI16390.
dynamics, Biochim. Biophys. Acta, 1791, 636-645, doi: org/
17.
Mitsui, K., Hatakeyama, K., Matsushita, M., and
10.1016/j.bbalip.2009.03.002.
Kanazawa, H. (2009) Saccharomyces cerevisiae Na+/H+
32.
Baumann, N.A., Sullivan, D.P., Ohvo Rekila, H.,
antiporter Nha1p associates with lipid rafts and requires
Simonot, C., Pottekat, A., Klaassen, Z. Beh, C.T., and
sphingolipid for stable localization to the plasma mem
Menon, A.K. (2005) Transport of newly synthesized sterol
brane, J. Biochem., 145, 709-720, doi: org/10.1093/
to the sterol enriched plasma membrane occurs via non
jb/mvp032.
vesicular equilibration, Biochemistry, 44, 5816-5826, doi: org/
18.
Bagnat, M., Chang, A., and Simons, K. (2001) Plasma
10.1021/bi048296z.
membrane proton ATPase Pma1p requires raft association
33.
Sullivan, D.P., Ohvo Rekila, H., Baumann, N.A., Beh, C.T.,
for surface delivery in yeast, Mol. Biol. Cell, 12, 4129-4138,
and Menon, A.K. (2006) Sterol trafficking between the endo
doi: org/10.1091/mbc.12.12.4129.
plasmic reticulum and plasma membrane in yeast, Bio
19.
Ejsing, C.S., Sampaio, J.L., Surendranath, V., Duchoslav, E.,
chem. Soc. Trans., 34, 356-358, doi: org/10.1042/BST0340356.
Ekroos, K., Klemm, R.W., and Shevchenko, A. (2009)
34.
Kentala, H., Weber Boyvat, M., and Olkkonen, V.M.
Global analysis of the yeast lipidome by quantitative shot
(2016) OSBP related protein family: mediators of lipid
БИОХИМИЯ том 84 вып. 4 2019
ТРАНСПОРТ ЭРГОСТЕРИНА В КЛЕТКАХ ДРОЖЖЕЙ
491
transport and signaling at membrane contact sites, Intern.
50.
Wong, L.H., and Levine, T.P. (2016) Lipid transfer proteins
Rev. Cell. Mol. Biol., 321, 299-340, doi: org/10.1016/bs.
do their thing anchored at membrane contact sites… but
ircmb.2015.09.006.
what is their thing? Biochem. Soc. Trans., 44, 517-527,
35.
Tong, J., Manik, M.K., Yang, H., and Im, Y.J. (2016)
doi: org/10.1042/BST20150275.
Structural insights into nonvesicular lipid transport by the
51.
Finn, R.D., Bateman, A., Clements, J., Coggill, P.,
oxysterol binding protein homologue family, Biochim.
Eberhardt, R.Y., Eddy, S.R., Heger, A., Hetherington, K.,
Biophys. Acta, 1861, 928-939, doi: org/10.1016/j.bbalip.
Holm, L., Mistry, J., Sonnhammer, E.L., Tate, J., and
2016.01.008.
Punta, M. (2014) Pfam: the protein families database,
36.
Raychaudhuri, S., Im, Y.J., Hurley, J.H., and Prinz, W.A.
Nucleic Acids Res., 42, 222-230, doi: org/10.1093/
(2006) Nonvesicular sterol movement from plasma mem
nar/gkt1223.
brane to ER requires oxysterol binding protein related
52.
Knorre, D.A., Ojovan, S.M., Saprunova, V.B., Sokolov, S.S.,
proteins and phosphoinositides, J. Cell Biol.,
173,
Bakeeva, L.E., and Severin, F.F. (2008) Mitochondrial
107-119, doi: org/10.1083/jcb.200510084.
matrix fragmentation as a protection mechanism of yeast
37.
De Saint Jean, M., Delfosse, V., Douguet, D., Chicanne, G.,
Saccharomyces cerevisiae, Biochemistry, 73, 1254-1259.
Payrastre, B., Bourguet, W., Antonny B., and Drin, G.
53.
Altmann, K., and Westermann, B. (2005) Role of essential
(2011) Osh4p exchanges sterols for phosphatidylinositol
genes in mitochondrial morphogenesis in Saccharomyces
4 phosphate between lipid bilayers, J. Cell Biol., 195,
cerevisiae, Mol. Biol. Cell, 16, 5410-5417, doi: org/10.
965-978, doi: org/10.1083/jcb.201104062.
1091/mbc.e05 07 0678.
38.
Loewen, C.J.R., Roy, A., and Levine, T.P. (2003) A con
54.
Pozniakovsky, A.I., Knorre, D.A., Markova, O.V., Hyman, A.A.,
served ER targeting motif in three families of lipid binding
Skulachev, V.P., and Severin, F.F. (2005) Role of mito
proteins and in Opi1p binds VAP, EMBO J.,
22,
chondria in the pheromone and amiodarone induced
2025-2035, doi: org/10.1093/emboj/cdg201.
programmed death of yeast, J. Cell. Biol., 168, 257-269,
39.
Levine, T.P., and Munro, S. (2002) Targeting of Golgi spe
doi: org/10.1083/jcb.200408145.
cific pleckstrin homology domains involves both PtdIns
55.
Sokolov, S., Knorre, D., Smirnova, E., Markova, O.,
4 kinase dependent and independent components, Curr.
Pozniakovsky, A., Skulachev, V., and Severin, F. (2006)
Biol., 12, 695-704.
Ysp2 mediates death of yeast induced by amiodarone or
40.
Raychaudhuri, S., and Prinz, W.A. (2010) The diverse
intracellular acidification, Bioch. Biophys. Acta, 1757,
functions of oxysterol binding proteins, Ann. Rev. Cell.
1366-1370, doi: org/10.1016/j.bbabio.2006.07.005.
Dev. Biol., 26, 157-177, doi: org/10.1146/annurev.cellbio.
56.
Francois, I.E.J.A., Bink, A., Vandercappellen, J., Ays
042308.113334.
cough, K.R., Toulmay, A., Schneiter, R., van Gyseghem, E.,
41.
Maeda, K., Anand, K., Chiapparino, A., Kumar, A.,
van den Mooter, G., Borgers, M., Vandenbosch, D.,
Poletto, M., Kaksonen, M., and Gavin, A.C. (2013)
Coenye, T., Cammue, B.P., and Thevissen, K. (2009)
Interactome map uncovers phosphatidylserine transport by
Membrane rafts are involved in intracellular miconazole
oxysterol binding proteins, Nature, 501, 257-261, doi: org/
accumulation in yeast cells, J. Biol. Chem.,
284,
10.1038/nature12430.
32680-32685, doi: org/10.1074/jbc.M109.014571.
42.
Moser von Filseck, J., Copic, A., Delfosse, V., Vanni, S., Jack
57.
Dos Santos, S.C., and Sa Correia, I. (2011) A genome
son, C.L., Bourguet, W., and Drin, G. (2015) Intracellular
wide screen identifies yeast genes required for protection
transport. Phosphatidylserine transport by ORP/Osh pro
against or enhanced cytotoxicity of the antimalarial drug
teins is driven by phosphatidylinositol 4 phosphate,
quinine. Mol. Gen. Genom., 286, 333-346, doi: org/10.
Science, 349, 432-436, doi: org/10.1126/science.aab1346.
1007/s00438 011 0649 5.
43.
Tian, S., Ohta, A., Horiuchi, H., and Fukuda, R. (2018)
58.
Murley, A., Yamada, J., Niles, B.J., Toulmay, A., Prinz, W.A.,
Oxysterol binding protein homologs mediate sterol trans
Powers, T., and Nunnari, J. (2017) Sterol transporters at
port from the endoplasmic reticulum to mitochondria in
membrane contact sites regulate TORC1 and TORC2 sig
yeast, J. Biol. Chem., 293, 5636-5648, doi: org/10.1074/
naling, J. Cell Biol., 216, 2679-2689, doi: org/10.1083/
jbc.RA117.000596.
jcb.201610032.
44.
Alberts, A.W., Chen, J., Kuron, G., Hunt, V., Huff, J.,
59.
Lees, N.D., Skaggs, B., Kirsch, D.R., and Bard, M. (1995)
Hoffman, C., et al. (1980) Mevinolin: a highly potent
Cloning of the late genes in the ergosterol biosynthetic
competitive inhibitor of hydroxymethylglutaryl coenzyme
pathway of Saccharomyces cerevisiae - a review, Lipids, 30,
A reductase and a cholesterol lowering agent, Proc. Natl.
221-226.
Acad. Sci. USA, 77, 3957-3961.
60.
Munn, A.L., Heese Peck, A., Stevenson, B.J., Pichler, H.,
45.
Woods, R.A. (1971) Nystatin resistant mutants of yeast:
and Riezman, H. (1999) Specific sterols required for the
alterations in sterol content, J. Bacteriol., 108, 69-73.
internalization step of endocytosis in yeast, Mol. Biol. Cell,
46.
Beh, C.T., Cool, L., Phillips, J., and Rine, J.
(2001)
10, 3943-3957, doi: org/10.1091/mbc.10.11.3943.
Overlapping functions of the yeast oxysterol binding pro
61.
Giaever, G., Chu, A.M., Ni, L., Connelly, C., Riles, L.,
tein homologues, Genetics, 157, 1117-1140.
Veronneau, S., et al. (2002) Functional profiling of the
47.
Gatta, A.T., Wong, L.H., Sere, Y.Y., Calderon Norena, D.M.,
Saccharomyces cerevisiae genome, Nature, 418, 387-391,
Cockcroft, S., Menon, A.K., and Levine, T.P. (2015) A new
doi: org/10.1038/nature00935.
family of StART domain proteins at membrane contact
62.
Jakubkova, M., Dzugasova, V., Truban, D., Abelovska, L.,
sites has a role in ER PM sterol transport, eLife, 4, doi: org/
Bhatia Kissova, I., Valachovic, M., Klobucnikova, V.,
10.7554/eLife.07253.
Zeiselova, L., Griac, P., Nosek, J., and Tomaska, L. (2016)
48.
Horenkamp, F.A., Valverde, D.P., Nunnari, J., and
Identification of yeast mutants exhibiting altered ensitivity
Reinisch, K.M. (2018) Molecular basis for sterol transport
to valinomycin and nigericin demonstrate pleiotropic
by StART like lipid transfer domains, EMBO J., 37, doi: org/
effects of ionophores on cellular processes, PLoS One, 11,
10.15252/embj.201798002.
e0164175, doi: org/10.1371/journal.pone.0164175.
49.
Murley, A., Sarsam, R.D., Toulmay, A., Yamada, J., Prinz, W.A.,
63.
Liu, G., Chen, Y., Faergeman, N.J., and Nielsen, J. (2017)
and Nunnari, J. (2015) Ltc1 is an ER localized sterol
Elimination of the last reactions in ergosterol biosynthesis
transporter and a component of ER mitochondria and
alters the resistance of Saccharomyces cerevisiae to multiple
ER vacuole contacts, J. Cell Biol., 209, 539-548, doi: org/
stresses, FEMS Yeast Res., 17, doi: org/10.1093/femsyr/
10.1083/jcb.201502033.
fox063.
БИОХИМИЯ том 84 вып. 4 2019
3*
492
СОКОЛОВ и др.
64.
Contamine, V., and Picard, M. (2000) Maintenance and
resistance pumps in Saccharomyces cerevisiae, PLoS One,
integrity of the mitochondrial genome: a plethora of
10, e0139306, doi: org/10.1371/journal.pone.0139306.
nuclear genes in the budding yeast, Microbiol. Mol. Biol.
79.
Espenshade, P.J., and Hughes, A.L. (2007) Regulation of
Rev., 64, 281-315.
sterol synthesis in eukaryotes, Ann. Rev. Genet., 41,
65.
Dupont, S., Lemetais, G., Ferreira, T., Cayot, P., Gervais, P.,
401-427, doi: org/10.1146/annurev.genet.41.110306.130315
and Beney, L. (2012) Ergosterol biosynthesis: a fungal
80.
Aguilera, F., Peinado, R.A., Millan, C., Ortega, J.M., and
pathway for life on land? Evolution, 66, 2961-2968, doi: org/
Mauricio, J.C. (2006) Relationship between ethanol tole
10.1111/j.1558 5646.2012.01667.x.
rance, H+ ATPase activity and the lipid composition of the
66.
Guan, X.L., Souza, C.M., Pichler, H., Dewhurst, G.,
plasma membrane in different wine yeast strains, Intern. J.
Schaad, O., Kajiwara, K., Wakabayashi, H., Ivanova, T.,
Food Microbiol., 110, 34-42, doi: org/10.1016/j.ijfoodmi
Castillon, G.A., Piccolis, M., Abe, F., Loewith, R.,
cro.2006.02.002.
Funato, K., Wenk, M.R., and Riezman, H.
(2009)
81.
Yang, H., Tong, J., Lee, C.W., Ha, S., Eom, S.H., and Im, Y.J.
Functional interactions between sphingolipids and sterols in
(2015) Structural mechanism of ergosterol regulation by
biological membranes regulating cell physiology, Mol. Biol.
fungal sterol transcription factor Upc2, Nat. Commun., 6,
Cell, 20, 2083-2095, doi: org/10.1091/mbc.E08 11 1126.
6129, doi: org/10.1038/ncomms7129.
67.
Abe, F., and Hiraki, T. (2009) Mechanistic role of ergo
82.
Zavrel, M., Hoot, S.J., and White, T.C.
(2013)
sterol in membrane rigidity and cycloheximide resistance
Comparison of sterol import under aerobic and anaerobic
in Saccharomyces cerevisiae, Biochim. Biophys. Acta, 1788,
conditions in three fungal species, Candida albicans,
743-752, doi: org/10.1016/j.bbamem.2008.12.002.
Candida glabrata, and Saccharomyces cerevisiae, Eukaryot.
68.
Leppert, G., McDevitt, R., Falco, S.C., Van Dyk, T.K.,
Cell, 12, 725-738, doi: org/10.1128/EC.00345 12.
Ficke, M.B., and Golin, J. (1990) Cloning by gene ampli
83.
Tiwari, R., Koffel, R., and Schneiter, R. (2007) An acety
fication of two loci conferring multiple drug resistance in
lation/deacetylation cycle controls the export of sterols
Saccharomyces, Genetics, 125, 13-20.
and steroids from S. cerevisiae, EMBO J., 26, 5109-5119,
69.
Kaur, R., and Bachhawat, A.K. (1999) The yeast multidrug
doi: org/10.1038/sj.emboj.7601924.
resistance pump, Pdr5p, confers reduced drug resistance in
84.
Choudhary, V., Darwiche, R., Gfeller, D., Zoete, V.,
erg mutants of Saccharomyces cerevisiae, Microbiology,
Michielin, O., and Schneiter, R. (2014) The caveolin
145, 809-818, doi: org/10.1099/13500872 145 4 809.
binding motif of the pathogen related yeast protein Pry1, a
70.
Desmoucelles, C., Pinson, B., Saint Marc, C., and
member of the CAP protein superfamily, is required for in
Daignan Fornier, B. (2002) Screening the yeast «disrup
vivo export of cholesteryl acetate, J. Lipid Res., 55,
tome» for mutants affecting resistance to the immunosup
883-894, doi: org/10.1194/jlr.M047126.
pressive drug, mycophenolic acid, J. Biol. Chem., 277,
85.
Korber, M., Klein, I., and Daum, G. (2017) Steryl ester
27036-27044, doi: org/10.1074/jbc.M111433200.
synthesis, storage and hydrolysis: a contribution to sterol
71.
Fleming, J.A., Lightcap, E.S., Sadis, S., Thoroddsen, V.,
homeostasis, Biochim. Biophys. Acta, Mol. Cell Biol. Lipids,
Bulawa, C.E., and Blackman, R.K. (2002) Complemen
1862, 1534-1545, doi: org/10.1016/j.bbalip.2017.09.002.
tary whole genome technologies reveal the cellular
86.
Yang, H., Bard, M., Bruner, D.A., Gleeson, A.,
response to proteasome inhibition by PS 341, Proc. Natl.
Deckelbaum, R.J., Aljinovic, G., Pohl, T.M., Rothstein R.,
Acad. Sci. USA, 99, 1461-1466, doi: org/10.1073/pnas.
and Sturley, S.L. (1996) Sterol esterification in yeast: a two
032516399.
gene process, Science, 272, 1353-1356.
72.
Viladevall, L., Serrano, R., Ruiz, A., Domenech, G.,
87.
Yu, C., Kennedy, N.J., Chang, C.C., and Rothblatt, J.A.
Giraldo, J., Barcelo, A., and Arino, J.
(2004)
(1996) Molecular cloning and characterization of two iso
Characterization of the calcium mediated response to
forms of Saccharomyces cerevisiae acyl CoA: sterol acyl
alkaline stress in Saccharomyces cerevisiae, J. Biol. Chem.,
transferase, J. Biol. Chem., 271, 24157-24163.
279, 43614-43624, doi: org/10.1074/jbc.M403606200.
88.
Zweytick, D., Leitner, E., Kohlwein, S.D., Yu, C.,
73.
Branco, M.R., Marinho, H.S., Cyrne, L., and Antunes, F.
Rothblatt, J., and Daum, G. (2000) Contribution of Are1p
(2004) Decrease of H2O2 plasma membrane permeability
and Are2p to steryl ester synthesis in the yeast Saccha
during adaptation to H2O2 in Saccharomyces cerevisiae,
romyces cerevisiae, Eur. J. Biochem., 267, 1075-1082.
J. Biol. Chem., 279, 6501-6506.
89.
Koffel, R., and Schneiter, R. (2006) Yeh1 constitutes the
74.
Montanes, F.M., Pascual Ahuir, A., and Proft, M. (2011)
major steryl ester hydrolase under heme deficient condi
Repression of ergosterol biosynthesis is essential for stress
tions in Saccharomyces cerevisiae, Eukaryot. Cell, 5,
resistance and is mediated by the Hog1 MAP kinase and
1018-1025, doi: org/10.1128/EC.00002 06.
the Mot3 and Rox1 transcription factors, Mol. Microbiol.,
90.
Georgiev, A.G., Sullivan, D.P., Kersting, M.C., Dittman, J.S.,
79, 1008-1023, doi: org/10.1111/j.1365 2958.2010.07502.x.
Beh, C.T., and Menon, A.K. (2011) Osh proteins regulate
75.
Gazdag, Z., Mate, G., Certik, M., Turmer, K., Virag, E.,
membrane sterol organization but are not required for
Pocsi, I., and Pesti, M. (2014) Butyl hydroperoxide
sterol movement between the ER and PM, Traffic, 12,
induced differing plasma membrane and oxidative stress
1341-1355, doi: org/10.1111/j.1600 0854.2011.01234.x.
processes in yeast strains BY4741 and erg5Δ, J. Basic
91.
Mullner, H., Deutsch, G., Leitner, E., Ingolic, E., and
Microbiol., 54, 50-62, doi: org/10.1002/jobm.201300925.
Daum, G. (2005) YEH2/YLR020c encodes a novel steryl
76.
Bard, M., Lees, N.D., Burrows, L.S., and Kleinhans, F.W.
ester hydrolase of the yeast Saccharomyces cerevisiae,
(1978) Differences in crystal violet uptake and cation
J. Biol. Chem., 280, 13321-13328, doi: org/10.1074/jbc.
induced death among yeast sterol mutants, J. Bacteriol.,
M409914200.
135, 1146-1148.
92.
Jandrositz, A., Petschnigg, J., Zimmermann, R., Natter, K.,
77.
Welihinda, A.A., Beavis, A.D., and Trumbly, R.J. (1994)
Scholze, H., Hermetter, A. Kohlwein, S.D., and Leber, R.
Mutations in LIS1 (ERG6) gene confer increased sodium
(2005) The lipid droplet enzyme Tgl1p hydrolyzes both
and lithium uptake in Saccharomyces cerevisiae, Biochim.
steryl esters and triglycerides in the yeast, Saccharomyces
Biophys. Acta, 1193, 107-117, doi: org/10.1016/0005
cerevisiae, Biochim. Biophys. Acta, 1735, 50-58, doi: org/
2736(94)90339 5.
10.1016/j.bbalip.2005.04.005.
78.
Kodedova, M., and Sychrova, H. (2015) Changes in the
93.
Walther, T.C., and Farese, R.V. Jr. (2012) Lipid droplets and
sterol composition of the plasma membrane affect mem
cellular lipid metabolism. Ann. Rev. Biochem., 81, 687-714,
brane potential, salt tolerance and the activity of multidrug
doi: org/10.1146/annurev biochem 061009 102430.
БИОХИМИЯ том 84 вып. 4 2019
ТРАНСПОРТ ЭРГОСТЕРИНА В КЛЕТКАХ ДРОЖЖЕЙ
493
94. Wang, C. W. (2015) Lipid droplet dynamics in budding
(2010) Decreased expression of ARV1 results in cholesterol
yeast, Cell. Mol. Life Sci., 72, 2677-2695, doi: org/
retention in the endoplasmic reticulum and abnormal bile
10.1007/s00018 015 1903 5.
acid metabolism, J. Biol. Chem., 285, 33632-33641, doi: org/
95. Ueno, K., Nagano, M., Shimizu, S., Toshima, J.Y., and
10.1074/jbc.M110.165761.
Toshima, J. (2016) Lipid droplet proteins, Lds1p, Lds2p,
98. Georgiev, A.G., Johansen, J., Ramanathan, V.D., Sere, Y.Y.,
and Rrt8p, are implicated in membrane protein transport
Beh, C.T., and Menon, A.K. (2013) Arv1 regulates PM and
associated with ergosterol, Biochim. Biophys. Res. Com
ER membrane structure and homeostasis but is dispensable
mun., 475, 315-321, doi: org/10.1016/j.bbrc.2016.05.099.
for intracellular sterol transport, Traffic, 14, 912-921, doi: org/
96. Tinkelenberg, A.H., Liu, Y., Alcantara, F., Khan, S., Guo, Z.,
10.1111/tra.12082.
Bard, M., and Sturley, S.L. (2000) Mutations in yeast
99. Heuck, A.P., Moe, P.C., and Johnson, B.B. (2010) The
ARV1 alter intracellular sterol distribution and are comple
cholesterol dependent cytolysin family of gram positive
mented by human ARV1, J. Biol. Chem., 275, 40667-40670,
bacterial toxins, Sub Cell. Biochem., 51, 551-577, doi: org/
doi: org/10.1074/jbc.C000710200.
10.1007/978 90 481 8622 8_20.
97. Tong, F., Billheimer, J., Shechtman, C.F., Liu, Y., Crooke, R.,
Graham, M., Cohen, D.E., Sturley, S.L., and Rader, D.J.
ERGOSTEROL TURNOVER IN YEAST:
AN INTERPLAY OF THE BIOSYNTHESIS
AND TRANSPORT
S. S. Sokolov1*, N. I. Trushina2, F. F. Severin1, and D. A. Knorre1,3
1 Belozersky Institute of Physico Chemical Biology, Lomonosov
Moscow State University, 119991 Moscow, Russia;
E mail: sviatoslav.sokolov@gmail.com
2 Lomonosov Moscow State University, Faculty of Bioengineering
and Bioinformatics, 119991 Moscow, Russia
3 Sechenov First Moscow State Medical University,
119991 Moscow, Russia
Received October 1, 2018
Revised November 21, 2018
Accepted November 21, 2018
Sterols are an important component of biological membranes. They determine their physicochemical properties and
affect the functioning of membrane proteins. Being insoluble in water, sterols cannot freely diffuse from one cell
membrane to another through an aqueous phase. Therefore, the distribution of sterols across membranes of different
organelles is extremely uneven. Sterol transport between membranes occurs mainly in a non vesicular manner and is
catalyzed by proteins of Lam and Osh families. In this review, we discuss the consequences of disruption of ergosterol
biosynthesis and transport using as an example a model organism - baker's yeast Saccharomyces cerevisiae. Despite
the fact that molecular mechanisms of functioning of Lam and Osh proteins are well studied, their biological roles
remain unclear. This is because deletions of the individual LAM or OSH genes display virtually no physiological mani
festations. At the same time, it is known that disruption of ergosterol biosynthesis sensitizes cells to a variety of stresses.
However, under certain conditions, such as mild osmotic or thermal stress, a decrease in the level of ergosterol leads
to an increase in the relative fitness of cells. This suggests that the cells need to possess a mechanism of rapid adjust
ment of the plasma membrane sterol content. We argue that the biological role of Lam proteins is, in particular, in
rapid optimization of sterol composition of cell membranes in a variable environment.
Keywords: lam proteins, membrane, metabolism, Osh proteins, sterols, yeast, YSP2
БИОХИМИЯ том 84 вып. 4 2019