БИОХИМИЯ, 2019, том 84, вып. 4, с. 550 - 559
УДК 577.151.6
АМИНОКИСЛОТНЫЕ ОСТАТКИ β139, β189 И β319
H+ FOF1 АТФ СИНТАЗЫ Escherichia coli: ВЛИЯНИЕ
НА АДФ ИНГИБИРОВАНИЕ*
© 2019 А.С. Лапашина1,2, Т.Е. Шугаева1, К.М. Березина1,
Т.Д. Холина1, Б.А. Фенюк1,2**
1 Московский государственный университет им. М.В. Ломоносова,
факультет биоинженерии и биоинформатики, 119991 Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова,
НИИ физико(химической биологии им. А.Н. Белозерского,
119991 Москва, Россия; электронная почта: feniouk@fbb.msu.ru
Поступила в редакцию 09.10.2018
После доработки 06.11.2018
Принято к публикации 06.11.2018
Протон транслоцирующая FOF1 АТФ синтаза (АТФаза F типа, F АТФаза или FOF1), обнаруженная в мито
хондриях, хлоропластах и большинстве эубактерий, является одним из ключевых ферментов биоэнергети
ки и осуществляет синтез/гидролиз АТФ, сопряженный с транспортом протонов через мембрану. АТФазная
активность фермента подавляется в отсутствии протондвижущей силы несколькими регуляторными меха
низмами. Наиболее консервативным из этих механизмов, обнаруженным во всех исследованных фермен
тах, является аллостерическое ингибирование гидролиза АТФ комплексом MgАДФ (АДФ ингибирование).
Когда MgАДФ связывается без фосфата в каталитическом сайте, фермент переходит в неактивное состоя
ние, а MgАДФ оказывается замкнут в каталитическом сайте и не обменивается со средой. Степень выра
женности АДФ ингибирования различается у FOF1 из разных организмов. У фермента из Escherichia coli
АДФ ингибирование выражено слабо, и, в отличие от наблюдаемого на FOF1 из других организмов, усили
вается, а не ослабляется фосфатом. В данной работе, с помощью сайт направленного мутагенеза FOF1
E. сoli, была изучена роль аминокислотных остатков β139, β158, β189 и β319 в процессе АДФ ингибирова
ния и влияние на него протондвижущей силы. Тип аминокислотного остатка в этих позициях отличается
между FOF1 бета и гамма протеобактерий (включая E. coli) и ферментами прочих эубактерий, хлороплас
тов и митохондрий. Замена βN158L не повлияла на активность фермента. Замены βF139Y, βF189L и βV319T
мало повлияли на АТФазную активность при гидролизе 1 мМ АТФ. Однако в смеси АТФ и АДФ активность
мутантных ферментов снижалась слабее, чем в FOF1 дикого типа. Кроме того, мутации βF189L и βV319T
привели к ослаблению ингибирования АТФазной активности фермента фосфатом в присутствие АДФ. Мы
предполагаем, что остатки β139, β189 и β319 задействованы в механизме АДФ ингибирования и его моду
ляции фосфатом.
КЛЮЧЕВЫЕ СЛОВА: АТФ синтаза, F АТФаза, АДФ ингибирование, регуляция, Escherichia coli, FOF1.
DOI: 10.1134/S0320972519040080
FOF1 АТФ синтаза представляет собой мемб
каталитическая F1 часть фермента несет сайты,
ранный мультисубъединичный фермент, кото
связывающие нуклеотиды, и осуществляет син
рый катализирует синтез АТФ из АДФ и неорга
тез/гидролиз АТФ. Гидрофобная FO часть нахо
нического фосфата (ФН). Фермент обнаружен в
дится в мембране и отвечает за перенос прото
бактериальной плазматической мембране, во
нов. Комплекс F1 Escherichia coli состоит из пяти
внутренней мембране митохондрий и в тилако
типов субъединиц в стехиометрии α3β3γ1δ1ε1, а
идной мембране в хлоропластах. Гидрофильная
комплекс FO состоит из трех типов субъединиц в
стехиометрии a1b2c10 [1]. Синтез/гидролиз АТФ,
катализируемый F1, и сопряженный с ним
Принятые сокращения: СБЧ - суббактериальные транспорт H+ через FO реализуются с помощью
мембранные частицы, ФН - неорганический фосфат.
ротационного механизма [2-4]. Под действием
* Первоначально английский вариант рукописи опублико
протондвижущей силы, создаваемой фермента
ми дыхательной и фотосинтетической цепи пе
msu.ru/biokhimiya, в рубрике «Papers in Press», BM 18 283,
31.12.2018.
реноса электронов, H+ переносятся через мемб
** Адресат для корреспонденции.
рану в области контакта субъединицы a и коль
550
МУТАЦИИ В АТФ СИНТАЗЕ, ВЛИЯЮЩИЕ НА АДФ ИНГИБИРОВАНИЕ
551
цевого олигомера c10 и индуцируют вращение
АДФ высвобождается, и фермент вновь активи
последнего относительно ab2 комплекса. В свою
руется. С другой стороны, умеренная энергиза
очередь, ab2 комплекс связан с α3β3δ комплек
ция мембраны также противодействует АДФ ин
сом, а субъединицы γ и ε связаны с c10 кольцом.
гибированию за счет увеличения сродства ката
В результате протонный транспорт оказывается
литических сайтов к ФН, тем самым снижая ве
сопряжен с вращением комплекса c10γε, называ
роятность того, что АДФ будет связан в катали
емого «ротор», относительно комплекса ab2α3β3δ.
тическом сайте без ФН [13, 14].
Вращение субъединицы γ внутри гексамера α3β3
Однако картина АДФ ингибирования в FOF1
индуцирует последовательные конформацион
из E. coli, по видимому, отличается от описан
ные изменения, которые приводят к связыва
ной выше. Во первых, фермент E. coli менее уяз
нию АДФ и ФН, синтезу и высвобождению АТФ.
вим для ингибирования MgАДФ, чем другие
Если протондвижущая сила падает ниже термо
АТФ синтазы. Во вторых, у фермента E. coli
динамического порога для синтеза АТФ, реак
АДФ ингибирование не предотвращается, а уси
ция обращается. Гидролиз АТФ вызывает кон
ливается неорганическим фосфатом [11, 15].
формационные изменения в гексамере α3β3, ко
Ранее нами было показано, что на свойства
торые приводят к вращению γεac10-комплекса.
АДФ ингибирования влияет остаток в положе
Вращение c10 кольца относительно субъедини
нии, соответствующем β249 фермента E. coli.
цы a приводит к трансмембранному переносу
В этом положении у бета протеобактерий и гам
H+ и генерации протондвижущей силы.
ма протеобактерий (включая E. coli) присут
АТФазная активность FOF1 может играть
ствует лейцин, а у ферментов митохондрий, хло
важную роль в условиях, когда активность пер
ропластов и большинства остальных эубактерий -
вичных генераторов протондвижущей силы па
глутамин. Замена глутамина на лейцин резко
дает. Примерами таких условий являются тем
ослабила АДФ ингибирование в FOF1 из термо
ное время для фотосинтетических бактерий и
фильной бактерии Bacillus PS3 sp. [16], а обрат
растений, недостаток кислорода для аэробных
ная замена βL249Q усилила АДФ ингибирова
бактерий и митохондрий. В таких условиях FOF1
ние в ферменте E. coli и поменяла на противопо
остается единственным ферментом, способным
ложный эффект ФН: в мутантном FOF1 фосфат не
поддерживать (за счет гидролиза АТФ) протон
усиливал, а ослаблял АДФ ингибирование [17].
движущую силу, необходимую для ряда физио
В данной работе мы изучили роль в АДФ ин
логически важных процессов. Однако, когда
гибировании еще нескольких позиций в субъ
концентрация внутриклеточного АТФ значи
единице β, в которых тип аминокислотного ос
тельно уменьшается, или когда проницаемость
татка различается в FOF1 бета протеобактерий и
мембраны для протонов увеличивается, напри
гамма протеобактерий и в АТФ синтазах мито
мер, в присутствии разобщителей протонофо
хондрий, хлоропластов и большинства осталь
ров или токсинов, катализируемый FOF1 гидро
ных эубактерий.
лиз АТФ может исчерпать внутриклеточные за
пасы АТФ и потому может представлять угрозу
для клетки. В этой связи неудивительно, что
МЕТОДЫ ИССЛЕДОВАНИЯ
АТФазная активность FOF1 регулируется с по
мощью нескольких механизмов [5].
Построение множественного выравнивания
Неконкурентное ингибирование гидролиза
β субъединиц FOF1. Для построения выравнива
АТФ с помощью MgАДФ является наиболее кон
ния был выбран набор полностью секвениро
сервативным из этих механизмов и известно для
ванных 711 геномов архей и бактерий, взятый за
всех изученных F АТФаз [6-12]. Если MgАДФ
основу последней версии базы Clusters of Ortho
оказывается связан в каталитическом сайте без
logous Groups of proteins (COG) [18]. Также к базе
ФН, то фермент может претерпеть конформаци
были добавлены последовательности митохон
онный переход в неактивное состояние. В мито
дриального (бык, пекарские дрожжи) и хлоро
хондриальных, хлоропластных и многих бакте
пластного (шпинат) ферментов. Для поиска по
риальных АТФ синтазах ФН противодействует
базе белков использовались профили скрытых
этому переходу. Активация ингибированного
марковских моделей (HMM), составленные по
FOF1 требует протондвижущей силы, причем ее
данным последней версии базы COG. HMM
величина должна быть сравнима или превышать
профили были получены как описано в статье
уровень, необходимый для синтеза АТФ. Пред
Dibrova et al. [19] и использовались при поиске
положительно, индуцированное протондвижу
по базе программой HMMscan 3.1 из пакета
щей силой вращение субъединицы γ приводит к
HMMer3 [20]. Поскольку при поиске по HMM
переходу каталитического сайта со связанным
профилю часто находятся родственные белки
ингибирующим АДФ в открытое состояние,
(например, α субъединицы при поиске по про
БИОХИМИЯ том 84 вып. 4 2019
552
ЛАПАШИНА и др.
филю β), результаты были отобраны по порогу
Последовательности праймеров, использованных для вве
дения мутаций
E value. Для субъединицы β был принят порог
7,7 × 10-103, после которого наблюдался скачок в
Аминокислот
5'-3' последовательность праймеров
значениях E value, отделяющий искомую субъе
ная замена
диницу от родственных.
Подобным образом также были отобраны
βF139Y
AGATCTGATGGCTCCGTACGCTAAGGG
остальные субъединицы FOF1. Получившиеся
βN158L
AGGTAAAACCGTACTGATGATGGAGC
наборы субъединиц были разбиты на потенци
βF189L
CATTTCGTGGTACAGGTCGTTACCCTC
ально принадлежащие АТФ синтазам F типа и
βV319T
ACAGTACTGAGCCGTCAGATCGCG
N типа. Последними считались опероны, со
держащие все субъединицы F1 и FO, кроме δ.
Субъединицы β, принадлежащие АТФ синтазам
F типа, были взяты за основу для множествен
растили 18-20 ч при 37 °С в колбах Эрленмейе
ного выравнивания. Множественное выравни
ра объемом 2 литра при перемешивании. Полу
вание строилось программой MUSCLE 3.8 [21].
ченную суспензию (общий объем жидкой куль
Для визуализации и анализа выравнивания ис
туры составлял 3 литра) центрифугировали 10 мин
пользовалась программа Jalview 2.10.5 [22].
(ротор JA 10, 7000 об/мин) («Beckman Coulter»,
Сайт направленный мутагенез. Мутагенез
США) при комнатной температуре. Сырой вес
производили на плазмиде pFV2, содержащей
клеток, полученных в результате осаждения,
unc оперон (кодирует a, b, c, α, β, γ, δ, ε субъе
составлял 10-20 г. Клетки собирали центрифу
диницы АТФ синтазы E. coli) и ген устойчивос
гированием (10 000 g, 10 мин), промывали буфе
ти к ампициллину. В последовательности генов
ром, содержащим 10 мМ HEPES NaOH, pH 7,5,
АТФ синтазы на этой плазмиде введен гистиди
5 мМ MgCl2, 10% (w/v) глицерина, ресуспенди
новый тэг на N конце субъединицы β, а цисте
ровали в 25-30 мл того же буфера и разрушали с
ин кодирующие кодоны (кроме цистеина b21)
помощью двух последовательных пассажей на
заменены на кодоны аланинов. Показано, что
Френч прессе («SLM Aminco», США) при дав
эти замены не оказывают значительного влия
лении 1000 PSI. Разрушение клеток и все после
ния на активность [23]. Фермент, экспрессируе
дующие манипуляции выполнялись при 4 °C или
мый с плазмиды pFV2, в дальнейшем будет на
на льду. Неразрушенные клетки и крупные об
зываться диким типом.
ломки собирали центрифугированием при 13 700 g,
Мутации в β субъединицу вводили с по
30 мин, и отбрасывали. Супернатант центрифу
мощью полимеразной цепной реакции с мута
гировали при 390 000 g в течение 1 ч для осажде
генными праймерами, используя pFV2 дикого
ния вывернутых суббактериальных мембранных
типа в качестве матрицы. Вкратце, два прайме
частиц (СБЧ), которые затем повторно суспен
ра, один из которых содержал нужную мутацию,
дировали в 25 мл того же буфера и снова центри
использовали для синтеза олигонуклеотида (ме
фугировали при тех же условиях. Отмытые та
гапраймера) размером 200-400 п.о., несущего
ким образом СБЧ ресуспендировали в 1-1,5 мл
мутацию и ближайший сайт эндонуклеазы рест
того же буфера. Затем СБЧ аликвотировали по
рикции, уникальный для pFV2. Затем третий
50 мкл, замораживали в жидком азоте и хранили
праймер использовали для расширения фраг
при -80 °C. Концентрацию белка в мембранных
мента с мутацией, чтобы фланкировать ее дру
частицах определяли с помощью коммерческого
гим уникальным сайтом рестрикции. Фрагмент
набора Pierce™ BCA Protein Assay kit («Thermo
клонировали в вектор pBluescript II SK (-), сек
Scientific», США) с использованием растворов
венировали и переносили в pFV2. Клонирова
бычьего сывороточного альбумина в качестве
ние проводили в штамме XL 1 Blue E. coli. Затем
стандарта. В норме концентрация белка в сус
pFV2 дикого типа или с внесенной мутацией
пензии СБЧ составляла 20-80 мг/мл.
экспрессировали в штамме E. coli BW25113
Измерение АТФазной активности. АТФазную
(ΔatpB atpC), в котором большая часть оперона,
активность СБЧ измеряли с помощью регистра
кодирующего АТФ синтазу, была заменена кас
ции закисления среды [24] по изменению по
сетой резистентности к канамицину [16].
глощения pH индикатора фенолового красного
В таблице приведены праймеры («ДНК син
(щелочной пик 558 нм, изобестическая точка
тез», Россия), которые были использованы для
477 нм).
внесения мутаций.
При измерениях на планшетном ридере
Получение вывернутых суббактериальных
CLARIOstar («BMG Labtech», Германия) суспен
частиц. Суспензию 1 мл ночной культуры E. coli
зию мембранных частиц в буфере pheRed, со
инокулировали в 600 мл среды LB («Amresco»,
держащем 2 мM HEPES, 1 мM MgCl2, 100 мM
США) с добавлением ампициллина (100 мг/л) и
KCl, 30 мкМ фенолового красного, pH 8,0, по
БИОХИМИЯ том 84 вып. 4 2019
МУТАЦИИ В АТФ СИНТАЗЕ, ВЛИЯЮЩИЕ НА АДФ ИНГИБИРОВАНИЕ
553
мещали в 96 луночный планшет («Greiner Bio
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
One», США) по 150 мкл в лунку. Для измерений
в присутствии ФН использовали буфер pheRed с
Для поиска аминокислотных остатков, кото
добавлением K2HPO4 до 6 мМ. Измерения про
рые могут играть роль в механизме АДФ инги
водили при температуре 37 °C. В каждой лунке
бирования, мы провели биоинформатический
плашки осуществлялась следующая последова
анализ последовательностей β субъединиц про
тельность действий: 3-5 с вели измерение погло
кариотических FOF1. Для этого использовался
щения (при 558 и 477 нм), далее вводили 150 мкл
набор из 711 геномов архей и бактерий, взятый
буфера, содержавшего АТФ или смесь АТФ/АДФ
за основу последней версии базы Clusters of
(2 мM HEPES, 1 мM MgCl2, 100 мM KCl, 2 мМ
Orthologous Groups of proteins (COG) [18], к ко
АТФ или АТФ/АДФ в суммарной концентрации
торому были добавлены последовательности
2 мМ, 30 мкМ фенолового красного, pH 8,0), за
митохондриального (бык, пекарские дрожжи) и
тем вновь регистрировали поглощение в течение
хлоропластного (шпинат) ферментов. Из набора
30-50 с. Далее дважды добавляли по 30 нмоль
найденных в геномах FOF1 были отсеяны после
NaOH для того, чтобы установить соответствие
довательности N АТФаз, роль которых, по ви
между изменением поглощения и изменением
димому, связана с откачиванием ионов натрия, а
рН пробы (калибровочные добавки). Расчет
не с синтезом АТФ и АТФ зависимой генераци
АТФазной активности производили с помощью
ей протондвижущей силы [26]. У архей и неко
программы CLARIOstar - Data Analysis («BMG
торых эубактерий в геноме отсутствует FOF1, и в
Labtech», Германия) и обработки данных с по
результате анализируемый набор содержал 492
мощью программы, написанной на python 2.7
эубактериальных белка, 2 митохондриальных и
(«Python Software Foundation», США).
1 хлоропластный. На рис. 1 представлено фраг
При измерениях на двулучевом спектрофо
ментарное выравнивание некоторых из проана
тометре DW 2000 («SLM Aminco», США) сус
лизированных белков.
пензию мембранных частиц в буфере pheRed
Анализ выравнивания показал, что в иссле
помещали в пластиковую кювету объемом 3 мл.
дованном наборе последовательностей у всех
Измерение поглощения проводили при 558 и
бета протеобактерий (34 вида) и гамма протео
477 нм. Снимали базовую линию, затем реак
бактерий (62 вида, плюс 2 штамма E. coli) в по
цию гидролиза начинали добавлением АТФ или
зициях, соответствующих β139, β158, β189 и
смеси АТФ/АДФ, pH 7,9 (конечная суммарная
β319 фермента E. coli, высоко консервативными
концентрация в кювете 1 мM). Делали несколько
являются фенилаланин, аспарагин, фенилала
калибровочных добавок по 3 мкл 100 мМ раст
нин и валин, а у прочих проанализированных
вора NaOH до конечной концентрации 100 мкM.
эубактериальных белков и у митохондриального
Измерения проводили при 37 °C. Анализ кри
и хлоропластного ферментов - тирозин, лейцин,
вых и расчет активности производили с по
лейцин и треонин.
мощью программного пакета Origin («OriginLab»,
Мы предположили, что эти остатки могут,
США).
подобно остатку β249 E. coli [17], влиять на сте
Измерение АТФ зависимого протонного транс
пень выраженности и характеристики АДФ ин
порта. Для измерения АТФ зависимого про
гибирования фермента. С помощью сайт спе
тонного транспорта был использован флуорес
цифического мутагенеза были сделаны замены
центный краситель 9 амино 6 хлоро 2 меток
каждого из этих остатков на соответствующую
сиакридин (ACMA) («Sigma Aldrich», США),
ему аминокислоту митохондриального/хлоро
который в отсутствие градиента pH на мембра
пластного фермента (мутации βF139Y, βN158L,
не находится в растворе и флуоресцирует, а при
βF189L и βV319T). Кроме того, был получен
возникновении ΔpH связывается с мембра
двойной мутант βF139Y + βV319T. Мутантные
нами, что приводит к тушению флуоресцен
белки, а также белок дикого типа экспрессиро
ции [25]. Измерение флуоресценции проводи
вались с плазмиды pFV2 в штамме E. coli, у кото
ли на спектрофлуориметре Fluoromax 3 («Ho
рого оперон АТФ синтазы был удален из гено
riba Jobin Yvon», Япония) в 1 см акриловых кю
ма. Из клеток были получены суббактериальные
ветах при длинах волн возбуждения и эмиссии
инвертированные мембранные частицы, для ко
410 и 480 нм соответственно. Буфер содержал
торых были проведены измерения АТФазной
10 мМ HEPES, pH 7,5, 100 мМ KCl, 5 мМ
активности. Для выяснения влияния протон
MgCl2. Концентрация ACMA в кювете состав
движущей силы на активность, к СБЧ добавляли
ляла 0,3 мкг/мл. Реакцию инициировали до
смесь валиномицина и нигерицина, которая в
бавлением в кювету АТФ до концентрации
присутствии ионов калия деэнергизует мембра
500 мкМ. Измерения проводились при ком
ну. Кроме того, было изучено влияние 3 мМ ФН
натной температуре.
на АТФазную активность. Для образцов с мута
7 БИОХИМИЯ том 84 вып. 4 2019
554
ЛАПАШИНА и др.
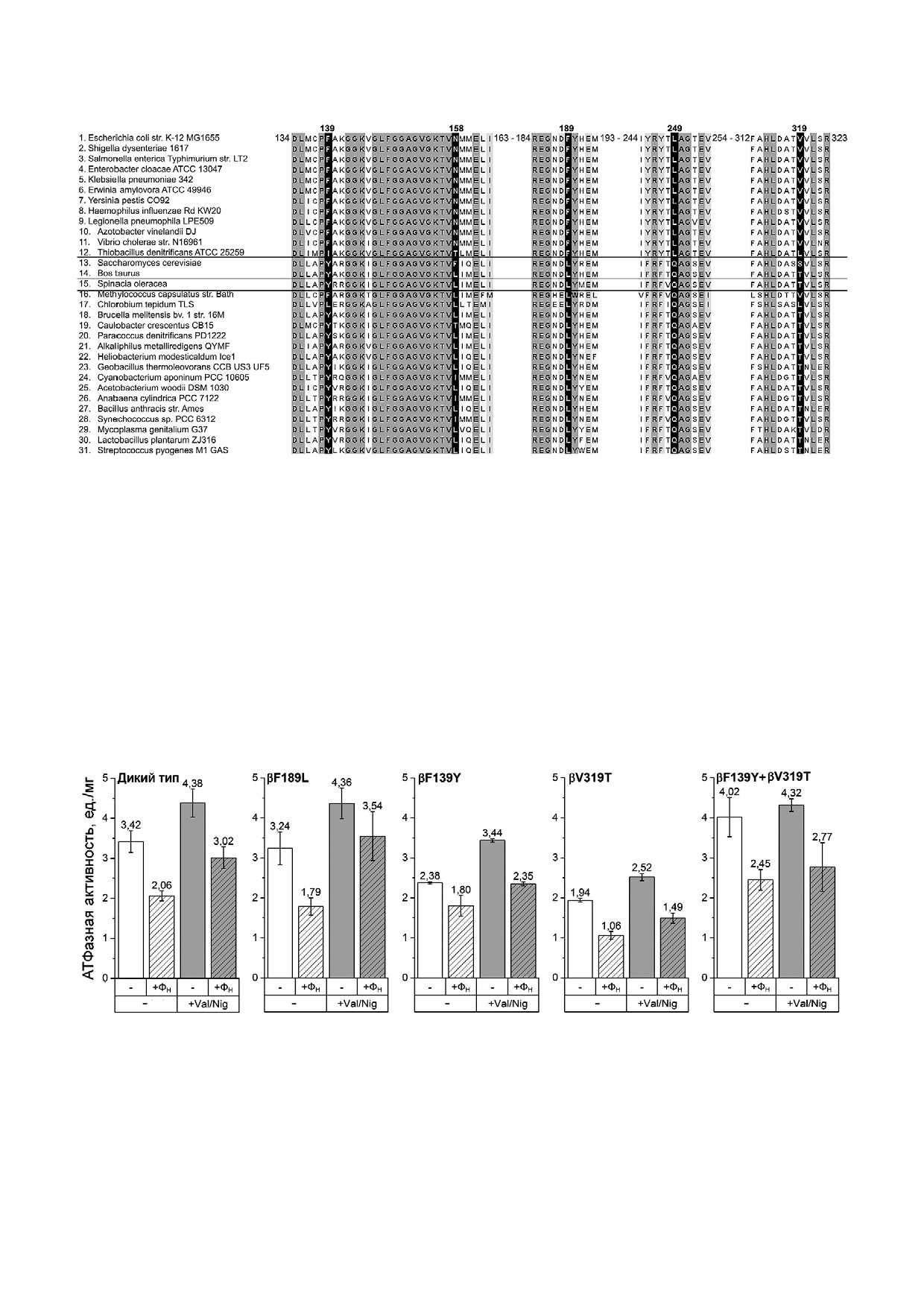
Рис. 1. Множественное выравнивание аминокислотных последовательностей участков субъединицы β АТФ синтазы.
1-12 - Гамма протеобактерии и бета протеобактерии, 13-14 - митохондрии; 15 - хлоропласты, 16-31 - эубактерии,
не относящиеся к гамма протеобактериям и бета протеобактериям. Нумерация остатков в верхней строке соответствует
субъединице β АТФ синтазы E. coli. Оттенки серого соответствуют степени консервативности аминокислотных остатков.
Черным выделены 4 позиции, изучавшиеся в данной работе, и позиция, изученная ранее (β249)
цией βN158L мы не обнаружили достоверных
объясняться как небольшим влиянием мутации
отличий по АТФазной активности от дикого ти
на активность, так и разбросом в уровне
па ни в одном из проведенных экспериментов.
экспрессии FOF1 в разных образцах. ФН в концент
Результаты измерений по остальным исследо
рации 3 мМ снижал АТФазную активность во
ванным мутантам представлены на рис. 2.
всех исследованных штаммах, однако в мутанте
Во всех четырех исследованных мутантах
βF139Y этот эффект был менее выражен (~30%,
АТФазная активность была сравнима с таковой
в то время как в образцах дикого типа и осталь
у дикого типа. Наблюдаемые отличия абсолют
ных мутантов - 60-80%). Добавка разобщите
ных значений (1,94-4,02 ед./мг белка) могут
лей, резко повышающая проводимость мембра
Рис. 2. Влияние разобщителя и фосфата на АТФазную активность СБЧ дикого типа и мутантов βF139Y, βF189L, βV319T
и βF139Y + βV319T. Измерения проводились на СБЧ с АТФ синтазой дикого типа (WT), а также с мутантными белками
(βF139Y, βF189L, βV319T и βF139Y + βV319T). Активность измерялась при концентрации АТФ 1 мМ как указано в разде
ле «Методы исследования». Для каждого штамма измерялась активность без добавок, в присутствии разобщителя
(+Val/Nig, валиномицин и нигерицин в концентрациях 500 нМ каждый), фосфата (+ФН, концентрация 3 мМ) или обеих
добавок. Средние значения активностей по результатам 5-8 измерений указаны над соответствующими колонками, раз
брос представляет собой стандартное отклонение. Единица активности соответствует гидролизу 1 мкмоль АТФ в минуту
в расчете на мг мембранного белка
БИОХИМИЯ том 84 вып. 4 2019
МУТАЦИИ В АТФ СИНТАЗЕ, ВЛИЯЮЩИЕ НА АДФ ИНГИБИРОВАНИЕ
555
ны для протонов и приводящая к исчезновению
движущей силы при добавке разобщителя,
протондвижущей силы, достоверно стимулиро
АТФазная активность СБЧ дикого типа оказа
вала АТФазную активность во всех образцах,
лась более чувствительна к снижению отноше
кроме СБЧ из мутанта βF139Y + βV319T, где эф
ния АТФ/АДФ, чем таковая в случае СБЧ из му
фект был в пределах ошибки измерения. Добав
танта βF139Y + βV319T.
ление ФН на фоне разобщителя также снижало
Помимо эффектов на АТФазную актив
скорость гидролиза АТФ во всех образцах, но в
ность, изучаемые мутации могли оказать влия
СБЧ из мутанта βF189L эффект был менее вы
ние на сопряжение между гидролизом АТФ и
ражен (данные не приведены).
протонным транспортом. Хотя добавка разоб
Для дальнейшего прояснения влияния ис
щителя стимулировала АТФазную активность
следуемых остатков на АДФ ингибирование
СБЧ дикого типа и одиночных мутантов, что
FOF1, АТФазная активность каждого мутанта бы
указывает на наличие сопряжения, для непосред
ла измерена в присутствии АДФ. К образцам СБЧ
ственной проверки были поставлены опыты по
добавляли либо АТФ (до концентрации 1 мМ),
либо смесь АТФ и АДФ (до концентрации
750/250 или 400/600 мкМ). Также было исследо
вано влияние протондвижущей силы и ФН на
АТФазную активность в присутствии АДФ. Резуль
таты экспериментов представлены на рис. 3-6.
В отсутствие добавок АДФ подавлял актив
ность СБЧ мутанта βF139Y меньше, чем в случае
дикого типа (рис. 3). В отсутствие протондви
жущей силы этот эффект был еще более выра
жен. Однако, в присутствии 3 мМ ФН эффекта
не наблюдали, как в сопряженных, так и в ра
зобщенных СБЧ. Следует также отметить, что,
как и в диком типе, в образце βF139Y ФН значи
тельно сильнее подавлял АТФазную активность
в присутствии АДФ.
Тот же набор экспериментов был проведен с
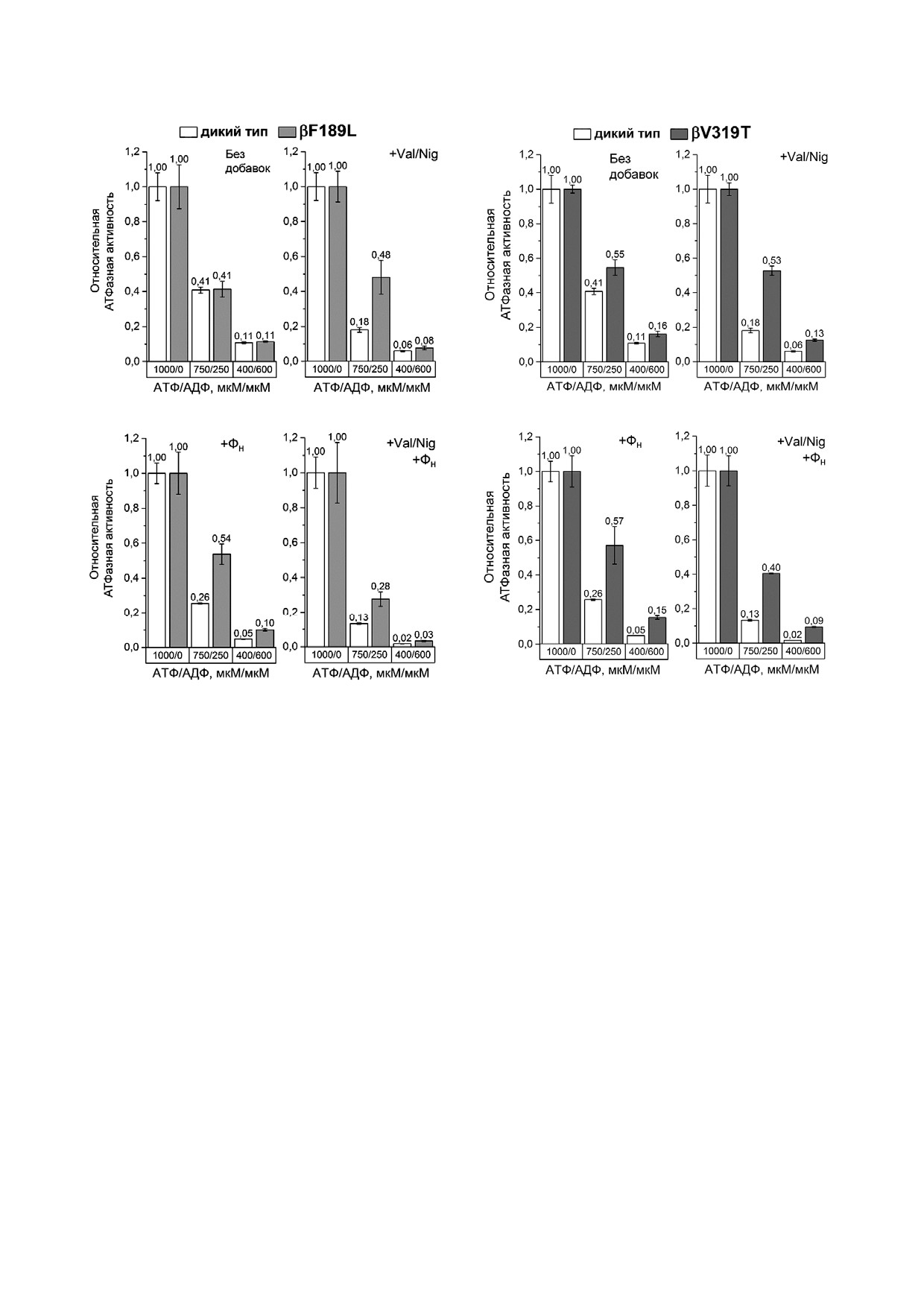
СБЧ из мутанта βF189L. В отсутствиe разобщи
теля и ФН снижение отношения АТФ/АДФ оди
наково влияло на АТФазную активности образ
ца βF189L и дикого типа (рис. 4). Однако, как в
присутствии разобщителя, так и в присутствии
3 мМ ФН, активность СБЧ из мутанта βF189L в
смеси 750 мкМ АТФ и 250 мкМ АДФ была дос
товерно выше, чем таковая СБЧ дикого типа. При
этом, при более низком отношении АТФ/АДФ
этот эффект был менее выражен.
На СБЧ из мутанта βV319T в отсутствие ФН
и разобщителя также не наблюдали значитель
ных различий в изменении АТФазной активнос
ти при снижении отношения АТФ/АДФ по
сравнению со штаммом дикого типа (рис. 5). Но
в присутствии разобщителя и/или 3 мМ ФН ак
тивность СБЧ βV319T в ответ на повышение кон
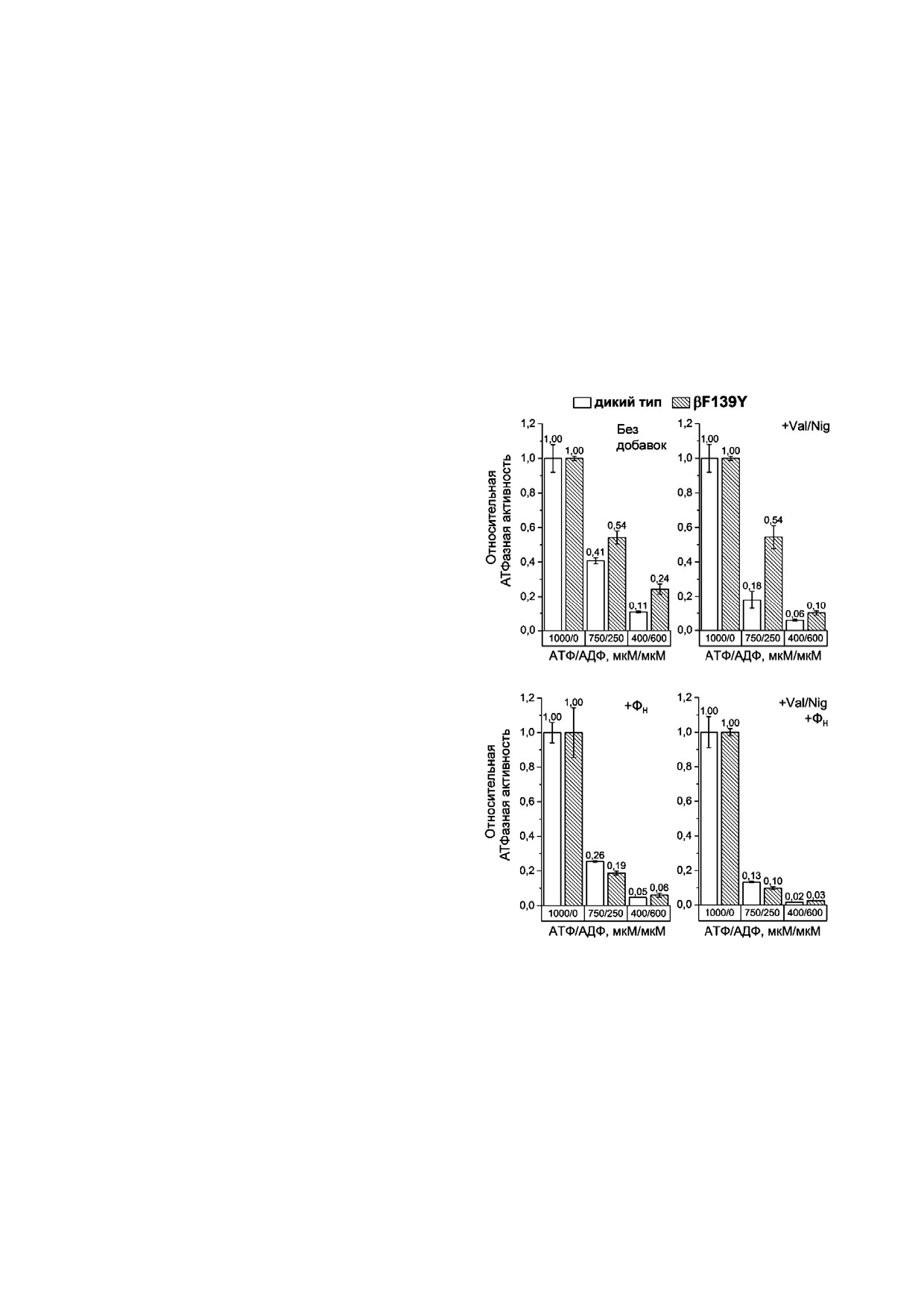
Рис. 3. Относительная АТФазная активность СБЧ дикого
центрации АДФ снижалась значительно слабее,
типа и мутанта βF139Y при разном соотношении АТФ/АДФ.
чем в СБЧ дикого типа. При этом данный эф
Реакция запускалась добавкой АТФ (конечная концентра
ция 1 мМ) или смеси АТФ и АДФ (конечные концентра
фект был более выражен при низком значении
ции 750 и 250 мкМ, или 400 и 600 мкМ). Измерялась актив
отношения АТФ/АДФ.
ность без добавок, в присутствии разобщителя (+Val/Nig,
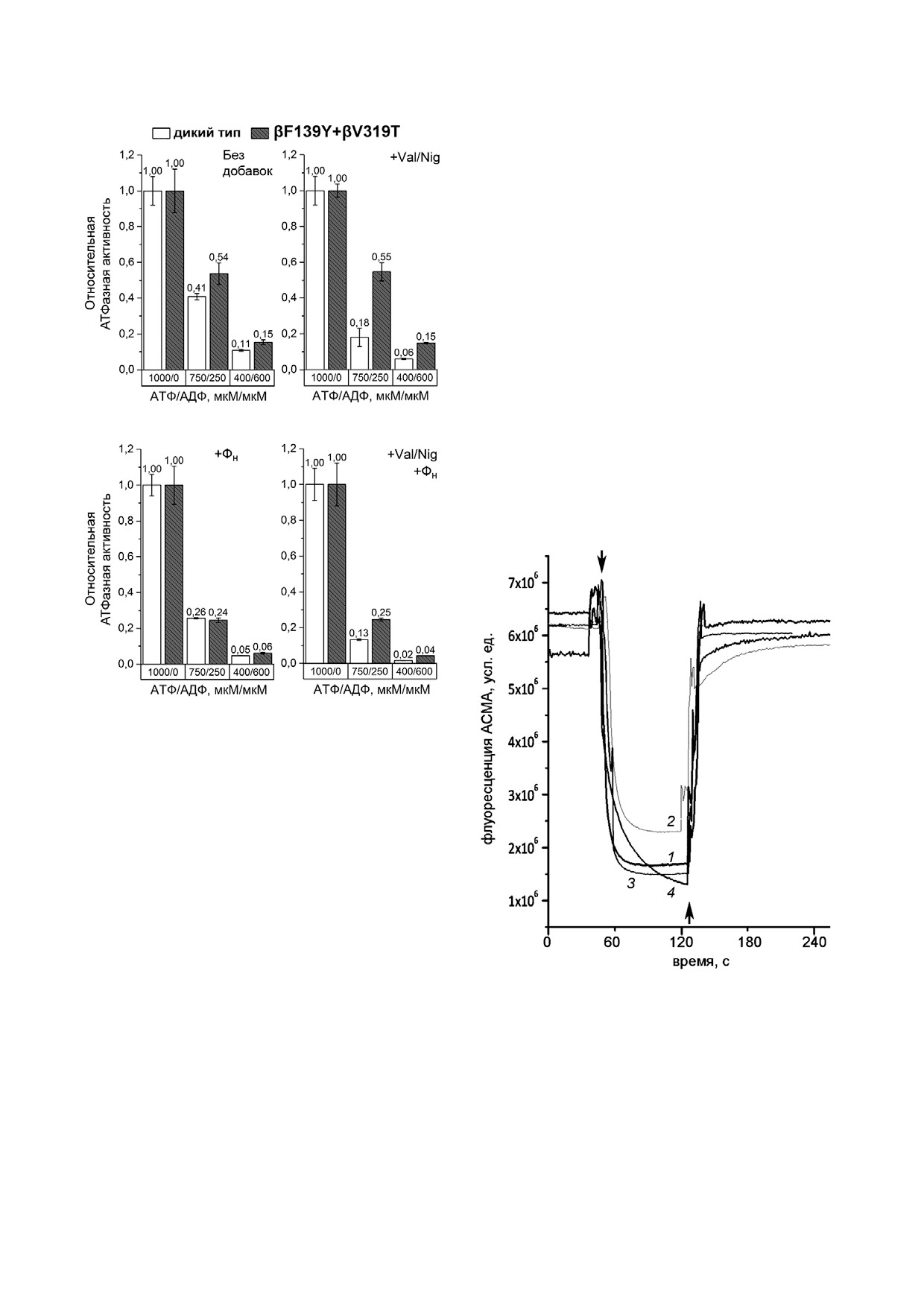
Наконец, измерения на СБЧ из мутанта
валиномицин и нигерицин в концентрациях 500 нМ каж
βF139Y + βV319T показали, что отношение
дый), фосфата (+ФН, концентрация 3 мМ), или обеих до
бавок вместе. Средние значения активностей по результа
АТФ/АДФ оказывает сходный эффект на АТФаз
там 5-8 измерений указаны над соответствующими колон
ную активность сопряженных мембран дикого
ками, разброс представляет собой стандартное отклоне
типа и мутанта, как в присутствии, так и в отсу
ние. За единицу принималась активность без добавок при
тствие ФН (рис. 6). Однако в отсутствие протон
гидролизе 1 мМ АТФ
БИОХИМИЯ том 84 вып. 4 2019
7*
556
ЛАПАШИНА и др.
Рис. 4. Относительная АТФазная активность СБЧ дикого
Рис. 5. Относительная АТФазная активность СБЧ дикого
типа и мутанта βF189L при разном соотношении АТФ/АДФ.
типа и мутанта βV319T при разном соотношении АТФ/АДФ.
Измерения проводились так же, как для мутанта βF139Y на
Измерения проводились так же, как для мутанта βF139Y на
рис. 3
рис. 3
измерению АТФ зависимого протонного транс
[6, 9, 13, 14], в соответствующем положении на
порта. Как показано на рис. 7, в ответ на добав
ходится глутамин. Ранее было показано, что за
ку АТФ наблюдали гашение флуоресценции ин
мена βL249Q в FOF1 из E. coli приводит к усиле
дикатора ACMA, вызываемое возникновением
нию АДФ ингибирования и меняет на противо
градиента pH на мембране, как в СБЧ дикого
положный эффект фосфата [17].
типа, так и в изученных мутантах. Добавка раз
Проведенный в данной работе биоинформа
общителя после АТФ приводила к рассеиванию
тический анализ последовательностей субъеди
градиента и увеличению флуоресценции до ис
ниц β прокариотических АТФ синтаз показал,
ходного уровня.
что тип аминокислотного остатка в положениях,
соответствующих β139, β158, β189, β249 и β319
FOF1 из E. coli, различается между ферментами
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
бета и гамма протеобактерий (включая E. coli)
и ферментами из остальных эубактерий, хлоро
У FOF1 из E. coli, отличающегося от прочих
пластов и митохондрий (рис. 1).
изученных АТФ синтаз слабо выраженным АДФ
Мы предположили, что, как и в случае β249,
ингибированием [12] и усилением этого инги
тип аминокислотного остатка в этих позициях
бирования ФН [11, 15], в положении β249 нахо
может влиять на выраженность АДФ ингибиро
дится лейцин, в то время как у прочих изучен
вания и его модуляцию ФН. Для проверки этой
ных ферментов, имеющих более сильное АДФ
гипотезы были сделаны мутанты E. coli, в кото
ингибирование, которое ослабляется фосфатом
рых аминокислотный остаток, характерный для
БИОХИМИЯ том 84 вып. 4 2019
МУТАЦИИ В АТФ СИНТАЗЕ, ВЛИЯЮЩИЕ НА АДФ ИНГИБИРОВАНИЕ
557
предположить, что СБЧ этого мутанта изна
чально имели повышенную протонную прово
димость, которая уже не могла быть увеличена
добавкой разобщителя.
Влияние изучаемых мутаций на АТФазную
активность FOF1 было обнаружено в условиях,
когда в среду добавляли АДФ. Чтобы смодели
ровать ситуацию, возникающую в клетке в усло
виях снижения запасов АТФ, когда общая кон
центрация адениновых нуклеотидов остается по
стоянной, но падает отношение АТФ/АДФ, мы из
мерили АТФазную активность СБЧ в двух вари
антах смеси АТФ/АДФ (750/250 и 400/600 мкМ).
В таких условиях мутация βF139Y снижала ин
гибирующий эффект АДФ только в отсутствие
ФН (рис. 3). Это дает основание предположить,
что тип аминокислотного остатка в этом поло
жении может оказывать влияние на стабиль
ность АДФ ингибированного состояния фер
мента, однако не влияет на способность ФН мо
дулировать вероятность перехода FOF1 из актив
Рис. 6. Относительная АТФазная активность СБЧ дикого
типа и мутанта βF139Y + βV319T при разном соотношении
АТФ/АДФ. Измерения проводились так же, как для мутан
та βF139Y на рис. 3
бета и гамма протеобактерий, был заменен на
остаток, характерный для прочих эубактерий,
митохондрий и хлоропластов.
Для остатка β158 эта гипотеза не подтверди
лась: во всех опробованных условиях мы не об
наружили достоверных отличий фермента с за
меной βN158L от FOF1 E. coli дикого типа. Ос
тальные мутации также не оказали заметного
влияния на АТФазную активность FOF1 E. coli
при гидролизе 1 мМ АТФ в отсутствие добав
Рис. 7. Изменение флуоресценции зонда АСМА, вызван
ленного АДФ (рис. 2). Немного меньшая по
ное АТФ зависимым протонным транспортом в суббакте
сравнению с диким типом активность в мутан
риальных частицах (СБЧ). Возникновение градиента pH
тах βF139Y и βV319T может быть связана как с
на мембранах СБЧ в ответ на добавление АТФ до концент
пониженной экспрессией мутантного белка, так
рации 500 мкМ регистрировалось по гашению флуорес
и с небольшим отрицательным влиянием мута
ценции индикатора ACMA как описано в разделе «Методы
исследования». Стрелками сверху отмечены добавки АТФ,
ций на активность. Несколько повышенная ак
стрелками снизу - добавки разобщителя (смесь валино
тивность двойного мутанта βF139Y + βV319T и
мицина и нигерицина в концентрациях 500 нМ каждый).
отсутствие стимуляции активности при исчез
1 - СБЧ дикого типа, 2 - СБЧ из мутанта βF139Y, 3 - СБЧ
новении протондвижущей силы позволяют
из мутанта βF189L, 4 - СБЧ из мутанта βV319T
БИОХИМИЯ том 84 вып. 4 2019
558
ЛАПАШИНА и др.
ного в АДФ ингибированное состояние. Мута
степень выраженности АДФ ингибирования,
ция βF189L, наоборот, заметно меняла влияние
свойственная ферменту E. coli, определяется
величины отношения АТФ/АДФ на активность
именно аминокислотами в положении β249 и
в присутствии ФН (рис. 4). У СБЧ дикого типа в
описанными в данной работе β139, β189 и β319,
присутствии ФН подавление АТФазной актив
и свойственна АТФ синтазам бета и гамма
ности в ответ на снижение отношения АТФ/АДФ
протеобактерий в целом. Дальнейшее изучение
было выражено вдвое сильнее, чем у мутантного
различий в молекулярном механизме АДФ ин
образца. Примечательно, что схожий эффект
гибирования между митохондриальным FOF1 и
наблюдали и без ФН на разобщенных СБЧ. Все
ферментом гамма протеобактерий, среди кото
перечисленные выше эффекты мутации βF189L
рых есть ряд опасных патогенов (рис. 1), пред
еще ярче были выражены на СБЧ из мутанта
ставляет не только научный, но и прикладной
βV319T (рис. 5). Не исключено, что их понижен
интерес. Прояснение этого механизма, возмож
ная АТФазная активность (рис. 2) связана с об
но, позволит найти низкомолекулярные соеди
щим усилением АДФ ингибирования. В сово
нения, избирательно влияющие на АДФ инги
купности эти результаты позволяют предполо
бирование и подавляющие активность АТФ син
жить, что мутации βF189L и βV319T до некото
тазы патогенных гамма протеобактерий, но не
рой степени препятствуют характерному для
оказывающие заметного влияния на эукариоти
FOF1 из E. coli усилению АДФ ингибирования ФН.
ческий фермент. В случае H+ транслоцирующе
По всей видимости, аминокислотные остатки в
го комплекса FO такой подход уже увенчался ус
данных положениях влияют на зависящую от
пехом и позволил разработать новый антибио
протондвижущей силы модуляцию ФН перехода
тик, эффективно и избирательно подавляющий
фермента из активного состояния в АДФ инги
АТФ синтазу микобактерий [27, 28].
бированное.
Введение мутации βV319T, на фоне замены
βF139Y, мало повлияло на активность СБЧ в от
Финансирование
сутствии ФН: картина, наблюдаемая на двойном
мутанте, напоминала таковую на каждом из оди
Работа выполнена при финансовой поддержке
ночных. Однако в присутствии 3 мМ ФН эффект
Российского Научного Фонда (проект 14 14
замены βF139Y «перевесил»: при пониженном от
00128 «Молекулярные механизмы преобразова
ношении АТФ/АДФ у двойного мутанта не наб
ния энергии при бактериальном окислительном
людали характерной для образцов βV319T высо
фосфорилировании»).
кой по сравнению с диким типом активности.
Благодарности
Суммируя полученные нами результаты,
можно сказать, что аминокислотный остаток в
Авторы выражают благодарность Алексею
трех из обнаруженных нами четырех позиций в
Елисееву за помощь с экспериментами на му
субъединице β, различающихся по типу консер
танте βN158L.
вативной аминокислоты в FOF1 бета и гамма
протеобактерий (включая E. coli) и ферментах
Конфликт интересов
из остальных эубактерий, хлоропластов и мито
хондрий, оказывает влияние на АДФ ингибиро
Авторы заявляют, что у них нет конфликта
вание АТФ синтазы. Не исключено, что низкая
интересов.
СПИСОК ЛИТЕРАТУРЫ
1.
Sobti, M., Smits, C., Wong, A.S., Ishmukhametov, R.,
6.
Carmeli, C., and Lifshitz, Y. (1972) Effects of Pi and ADP
Stock, D., Sandin, S., and Stewart, A.G. (2016) Cryo EM
on ATPase activity in chloroplasts, Biochim. Biophys. Acta,
structures of the autoinhibited E. coli ATP synthase in three
267, 86-95.
rotational states, Elife, 5, e21598.
7.
Minkov, I.B., Fitin, A.F., Vasilyeva, E.A., and Vinogra
2.
Stewart, A.G., Laming, E.M., Sobti, M., and Stock, D.
dov, A.D. (1979) Mg2+ induced ADP dependent inhibi
(2014) Rotary ATPases - dynamic molecular machines,
tion of the ATPase activity of beef heart mitochondrial
Curr. Opin. Struct. Biol., 25, 40-48.
coupling factor F1, Biochem. Biophys. Res. Commun., 89,
3.
Watanabe, R. (2013) Rotary catalysis of FOF1 ATP syn
1300-1306.
thase, Biophysics, 9, 51-56.
8.
Yoshida, M., and Allison, W.S. (1983) Modulation by ADP
4.
Junge, W., and Nelson, N. (2015) ATP synthase, Annu.
and Mg2+ of the inactivation of the F1 ATPase from the
Rev. Biochem., 84, 631-657.
thermophilic bacterium, PS3, with dicyclohexylcarbodi
5.
Feniouk, B.A., and Yoshida, M. (2008) Regulatory mecha
imide, J. Biol. Chem., 258, 14407-14412.
nisms of proton translocating FOF1 ATP synthase, Results
9.
Turina, P., Rumberg, B., Melandri, B.A., and Graber, P.
Probl. Cell Differ., 45, 279-308.
(1992) Activation of the H+ ATP synthase in the photosyn
БИОХИМИЯ том 84 вып. 4 2019
МУТАЦИИ В АТФ СИНТАЗЕ, ВЛИЯЮЩИЕ НА АДФ ИНГИБИРОВАНИЕ
559
thetic bacterium Rhodobacter capsulatus, J. Biol. Chem.,
a web server for analysis of distant relationships between
267, 11057-11063.
homologous protein families, Biol. Direct., 12, 29.
10.
Zharova, T.V., and Vinogradov, A.D. (2004) Energy depen
20. Finn, R.D., Clements, J., and Eddy, S.R. (2011) HMMER
dent transformation of FOF1 ATPase in Paracoccus denitri(
web server: interactive sequence similarity searching,
ficans plasma membranes, J. Biol. Chem., 279, 12319-12324.
Nucleic Acids Res., 39, W29-W37.
11.
Fischer, S., Graber, P., and Turina, P. (2000) The activity of
21. Edgar, R.C. (2004) MUSCLE: multiple sequence align
the ATP synthase from Escherichia coli is regulated by the
ment with high accuracy and high throughput, Nucleic
transmembrane proton motive force, J. Biol. Chem., 275,
Acids Res., 32, 1792-1797.
30157-30162.
22. Waterhouse, A.M., Procter, J.B., Martin, D.M.A., Clamp, M.,
12.
Lapashina, A.S., and Feniouk, B.A. (2018) ADP inhibi
and Barton, G.J. (2009) Jalview Version 2 - a multiple
tion of H+ FOF1 ATP synthase, Biochemistry (Moscow),
sequence alignment editor and analysis workbench,
10, 1141-1160.
Bioinformatics, 25, 1189-1191.
13.
Zharova, T.V., and Vinogradov, A.D. (2006) Energy linked
23. Ishmukhametov, R.R., Galkin, M.A., and Vik, S.B. (2005)
binding of Pi is required for continuous steady state pro
Ultrafast purification and reconstitution of His tagged cys
ton translocating ATP hydrolysis catalyzed by FOF1 ATP
teine less Escherichia coli F1FO ATP synthase, Biochim.
synthase, Biochemistry, 45, 14552-14558.
Biophys. Acta, 1706, 110-116.
14.
Feniouk, B.A., Suzuki, T., and Yoshida, M.
(2007)
24. Nishimura, M., Ito, T., and Chance, B. (1962) Studies on
Regulatory interplay between proton motive force, ADP,
bacterial photophosphorylation. III. A sensitive and rapid
phosphate, and subunit ε in bacterial ATP synthase, J. Biol.
method of determination of photophosphorylation, Biochim.
Chem., 282, 764-772.
Biophys. Acta, 59, 177-182.
15.
D’Alessandro, M., Turina, P., and Melandri, B.A. (2008)
25. Casadio, R., and Melandri, B.A. (1985) Calibration of the
Intrinsic uncoupling in the ATP synthase of Escherichia
response of 9 amino acridine fluorescence to transmem
coli, Biochim. Biophys. Acta, 1777, 1518-1527.
brane pH differences in bacterial chromatophores, Arch.
16.
Feniouk, B.A., Wakabayashi, C., Suzuki, T., and Yoshida, M.
Biochem. Biophys., 238, 219-228.
(2012) A point mutation, betaGln259Leu, relieves
26. Dibrova, D.V., Galperin, M.Y., and Mulkidjanian, A.Y.
MgADP inhibition in Bacillus PS3 ATP synthase, Biochim.
(2010) Characterization of the N ATPase, a distinct, late
Biophys. Acta, 1817, S13.
rally transferred Na+ translocating form of the bacterial
17.
Prikhodko, A., Lapashina, A., Zinovkin, R., Vitushkina, M.,
F type membrane ATPase, Bioinformatics, 26, 1473-1476.
and Feniouk, B. (2012) The effect of mutations γM23K
27. Hards, K., Robson, J.R., Berney, M., Shaw, L., Bald, D.,
and βL249Q on ADP inhibition of H+ FOF1 ATP syn
Koul, A., Andries, K., and Cook, G.M. (2015) Bactericidal
thase in Escherichia coli, Biochim. Biophys. Acta, 1817, S22.
mode of action of bedaquiline, J. Antimicrob. Chemother.,
18.
Galperin, M.Y., Makarova, K.S., Wolf, Y.I., and Koonin, E.V.
70, 2028-2037.
(2015) Expanded microbial genome coverage and impro
28. Koul, A., Dendouga, N., Vergauwen, K., Molenberghs, B.,
ved protein family annotation in the COG database,
Vranckx, L., Willebrords, R., Ristic, Z., Lill, H., Dorange, I.,
Nucleic Acids Res., 43, D261-D269.
Guillemont, J., Bald, D., and Andries, K.
(2007)
19.
Dibrova, D.V., Konovalov, K.A., Perekhvatov, V.V., Skula
Diarylquinolines target subunit c of mycobacterial ATP
chev, K.V., and Mulkidjanian, A.Y. (2017) COGcollator:
synthase, Nat. Chem. Biol., 3, 323-324.
AMINO ACID RESIDUES β139, β189, AND β319 MODULATE
ADP INHIBITION IN Escherichia coli H+ FOF1 ATP SYNTHASE
A. S. Lapashina1,2, T. E. Shugaeva1, K. M. Berezina1, T. D. Kholina1, and B. A. Feniouk1,2*
1 Lomonosov Moscow State University, Faculty of Bioengineering and Bioinformatics, 119991 Moscow, Russia
2 Belozersky Institute of Physico(Chemical Biology, Lomonosov Moscow State University,
119991 Moscow, Russia; E(mail: feniouk@fbb.msu.ru
Received October 9, 2018
Revised November 6, 2018
Accepted November 6, 2018
Proton translocating FOF1 ATP synthase (F type ATPase, F ATPase or FOF1) performs ATP synthesis/hydrolysis coup
led to proton transport across the membrane in mitochondria, chloroplasts, and most eubacteria. The ATPase activity of
the enzyme is suppressed in the absence of protonmotive force by several regulatory mechanisms. The most conserved
of these mechanisms is noncompetitive inhibition of ATP hydrolysis by the MgADP complex (ADP inhibition) which
has been found in all the enzymes studied. When MgADP binds without phosphate in the catalytic site, the enzyme goes
into inactive state, and MgADP is locked in the catalytic site and does not exchange with the medium. The degree of
ADP inhibition varies in FOF1 enzymes from different organisms. In the Escherichia coli enzyme, ADP inhibition is rela
tively weak and, in contrast to other organisms, is enhanced rather than suppressed by phosphate. In this study, we used
site directed mutagenesis to investigate the role of amino acid residues β139, β158, β189, and β319 of E. coli FOF1 ATP
synthase in the mechanism of ADP inhibition and its modulation by the protonmotive force. These amino acid residues
differ in the enzymes from beta and gammaproteobacteria (including E. coli) and FOF1 ATP synthases from other
eubacteria, mitochondria, and chloroplasts. The βN158L substitution produced no effect on the enzyme activity, while
substitutions βF139Y, βF189L, and βV319T only slightly affected ATP (1 mM) hydrolysis. However, in a mixture of ATP
and ADP, the activity of the mutants was less suppressed than that of the wild type enzyme. In addition, mutations
βF189L and βV319T weakened the ATPase activity inhibition by phosphate in the presence of ADP. We suggest that
residues β139, β189, and β319 are involved in the mechanism of ADP inhibition and its modulation by phosphate.
Keywords: ATP synthase, F ATPase, ADP inhibition, regulation, Escherichia coli, bioenergetics, FOF1
БИОХИМИЯ том 84 вып. 4 2019