БИОХИМИЯ, 2019, том 84, вып. 5, с. 648 - 667
УДК 577.344.2
РЕГУЛЯЦИЯ БИОСИНТЕЗА ХЛОРОФИЛЛА
ФИТОХРОМОМ A
Обзор
© 2019 В.А. Синещеков*, О.Б. Беляева*
Московский государственный университет им. М.В. Ломоносова,
биологический факультет, 119234 Москва, Россия;
электронная почта: vsineshchekov@gmail.com;
belyaeva0104@gmail.com
Поступила в редакцию 06.12.2018
После доработки 29.01.2019
Принята к публикации 29.01.2019
Посвящается профессору Ф.Ф. Литвину в связи с его 90+летием.
Фотосинтетический аппарат выполняет две основные функции в растениях - преобразование солнечной
энергии и защиту растений от фотодеструкции. Формирование фотосинтетического аппарата включает
скоординированный биосинтез хлорофилла и белков хлорофилл!связывающей матрицы. Свет играет здесь
центральную роль, управляя как метаболическими, так и регуляторными процессами. Регулирование дос!
тигается за счет работы сложного фоторецепторного аппарата с фитохромной системой в качестве основно!
го компонента. Обзор посвящен биосинтезу хлорофилла и роли фитохрома А в регуляции этого процесса.
Рассмотрены основные темновые и световые этапы биосинтеза нативных форм хлорофилла. Описан меха!
низм действия фитохрома А и специфика его состояния в растении, в частности, наличие двух его нативных
типов с разными способами действия. Обсуждается специфичность регуляторного влияния фитохрома A на
биосинтез предшественника хлорофилла - протохлорофиллида в зависимости от ткани/органа растения,
его вида, генетических модификаций и гормонального статуса.
КЛЮЧЕВЫЕ СЛОВА: биосинтез, хлорофилл(ид), протохлорофилл(ид), регуляция, фотоморфогенез, фи!
тохром А, фитогормоны.
DOI: 10.1134/S032097251905004X
Будучи ограниченными в движении орга!
ких и фотохимических процессов и, прежде все!
низмами, автотрофные растения обладают жиз!
го, миграции энергии возбуждения, которая
ненно важной способностью приспосабливать
увеличивает сечение поглощения и способность
свой рост и развитие к условиям окружающей
собирать свет и направляет избыточную энер!
среды. Стратегия такой адаптации заключается
гию возбуждения на специализированные фор!
в максимальном преобразовании солнечной
мы хлорофилла и каротиноидов, рассеивающие
энергии и минимизации их фотохимического
ее в тепло. На стадии формирования фотосинте!
повреждения. Эти две цели достигаются уже на
тического аппарата, когда механизм переноса и
молекулярном уровне с участием фотофизичес!
диссипации энергии не работает в полной мере,
Принятые сокращения: ABA - абсцизовая кислота; ALA - δ!аминолевулиновая кислота; ALAD - ALA дегидротаза;
BR - брассиностероиды; Сhl - хлорофилл; Chlide - хлорофиллид; CS - хлорофиллсинтаза; ERS - сигналы эндогенной
регуляции (endogenous regulation signals); ET - этилен; FHY1, FHL3 и FHL - белки!партнеры фитохрома А (far!red elon!
gated hypocotyl 1 и 3, FHY1!like); FR - дальний красный свет; FRc - непрерывный дальний красный свет; FRp - преры!
вистый дальний красный свет; Glu TR - глутамил!тРНК!редуктаза; HIR (high irradiance responses) - высокоэнергетичес!
кие фотоответы; JA - жасмоновая кислота; LFR - низкоэнергетические фотоответы (low fluorescence responses); MC - цик!
лаза монометилового эфира; MgCh - Mg!хелатаза; MgPPMT - Mg!протопорфирина IX метилтрансфераза; Mg!Proto IX -
Mg!протопорфирин IX; Mg!Proto IX MME - монометиловый эфир Mg!протопорфирина IX; NTE - N!терминальный ко!
нец молекулы (N!terminal extension); PBG - порфобилиноген; Pchl - протохлорофилл; Pchlide - протохлорофиллид; phyA
(B, C) - фитохром A (B, C); phyA' и phyA'' - нативные пулы phyA; PIFs - фитохром!взаимодействующие факторы (phy!
tochrome!interacting factors); PLB - проламеллярные тела; PORA (B, C) - протохлорофиллид!оксидоредуктаза A (B, C);
Proto IX - протопорфирин IX; Pr и Pfr - формы фитохрома, поглощающие красный и дальний красный свет соответ!
ственно; PSI - фотосистема I; PSII - фотосистема II; PT - протилакоиды; R - красный свет; RS - ретроградный сигнал;
VLFR - сверхнизкоэнергетические фотоответы.
* Адресат для корреспонденции.
648
ФИТОХРОМ А В БИОГЕНЕЗЕ ХЛОРОФИЛЛА
649
может иметь место фотодеструкция, связанная с
бот по фотобиофизике фотосинтеза и спектро!
появлением фотодинамически активных моле!
скопии растительных пигментов (см. ниже). Это
кул коротковолновых форм (прото)хлорофил!
обстоятельство и ограниченный объем обзора
ла(!ида).
не позволили нам адекватно представить весь
Растения сводят к минимуму этот негатив!
спектр относящихся к его тематике работ, и чи!
ный эффект путем подавления их накопления и
тателю можно порекомендовать обратиться к
стимулирования их включения в фотосинтети!
недавним обзорам [13-20], связанным с более
ческие структуры с использованием сложного
широкой проблематикой фотоморфогенеза и
механизма восприятия света. Ключевая роль в
регуляции фотосинтеза у растений.
этом регулировании принадлежит фитохромной
системе с фитохромами A и B (phyA и phyB) в
качестве основных действующих компонентов.
БИОГЕНЕЗ СВЕТОСОБИРАЮЩЕГО
Они координируют скорости синтеза как хлоро!
АППАРАТА ФОТОСИНТЕЗА.
филла (Chl), так и связывающих его белков при
СПЕКТРАЛЬНЫЕ ФОРМЫ
образовании стехиометрически организованных
ПРОТОХЛОРОФИЛЛИДА
светособирающих комплексов [1]. Фитохром А
И ХЛОРОФИЛЛА(ИДА)
играет ведущую роль в раннем фотоморфогене!
зе проростков и экспрессии генов, тогда как
Биогенез нативных форм Chl разделен на два
phyB доминирует в зрелых растениях. В услови!
этапа: темновую стадию - образование Pchlide
ях преобладания дальнего красного света (FR)
из его предшественника - δ!аминолевулиновой
только phyA обеспечивает регуляцию фотомор!
кислоты (ALA) (см. ниже), и световую стадию -
фогенеза растений, в частности, в глубокой тени
фотопревращение Pchlide в Chlide и далее в Chl
от плотного лесного полога. Считается, что этот
и его различные формы. Pchlide представляет
процесс способствовал эволюционным преиму!
собой Mg!содержащий циклический тетрапир!
ществам высших растений [2, 3].
рол, который отличается от Chl отсутствием
При освещении светом, обогащенным FR!ком!
двух атомов водорода в положении 17-18 чет!
понентом, когда индуцированное светом пре!
вертого пиррольного кольца (кольца D). Таким
вращение протохлорофиллида (Pchlide) в хлоро!
образом, световая стадия в биосинтезе Chl пред!
филлид (Chlide) замедляется из!за низкой аб!
ставляет собой фотохимическое гидрирование
сорбции Pchlide в этой спектральной области,
полуизолированной двойной связи С17=С18 в
phyA подавляет накопление активного Pchlide,
молекуле Pchlide. Световая стадия характерна
который может подвергаться фотопревращению
для высших растений и некоторых споровых
в Chlide [4-6]. В то же время были получены
растений и голосеменных. У цианобактерий, зе!
данные о позитивном регулирующем влиянии
леных водорослей, споровых и голосеменных
phyA на содержание активного Pchilde в услови!
превращение Pchlide в Chlide происходит в тем!
ях FR!освещения [7-9]. Представляет интерес
ноте.
также тот факт, что знак влияния FR на образо!
Во время темновой стадии образуется не!
вание активного PChlide - стимулирующий или
сколько различных форм Pchl(!ide), что было вы!
ингибирующий - зависит от гормонального
явлено при спектроскопических исследованиях
статуса растения [10]. Кроме того, существова!
этиолированных листьев in vivo. Было иденти!
ние двух молекулярных видов phyA (phyA' и
фицировано приблизительно десять спектро!
phyA'') с разными типами фотоответа на FR!об!
скопически различных форм Pchl(!ide): P633/628,
лучение - сверхнизкоэнергетическими (very low
P643/637, P655/650, P669/657, P682/670, P686-690/676, P697/686,
fluence responses, VLFR) и высокоэнергетичес!
P728/696 (максимум флуоресценции/максимум поглощения) [21-23].
кими фотоответами (high irradiance responses,
Однако максимальное количество пигмента
HIR) [11, 12] - делает эти регуляторные процес!
сосредоточено в трех формах: Pchlide633/628,
сы еще более сложными. Большое значение
Pchlide655/650 и Pchlide643/637 (рис. 1, а). Pchlide643/637
приобретает проблема регуляторного взаимо!
практически неразличим в спектрах флуорес!
действия между phyA и гормональными и други!
ценции благодаря высокоэффективной миграции
ми сигнальными системами растений. Все это в
энергии с этой формы на Pchlide655/650.
совокупности побудило нас попытаться проана!
Pchlide655/650 и Pchlide643/637 превращаются в
лизировать фитохромную регуляцию биосинте!
Chlide при кратковременном освещении даже
за Chl с акцентом на уникальную роль phyA в
при очень низких температурах (до 190 К). Ко!
этом процессе. Тематика обзора и его рамки бы!
ротковолновая форма Pchlide633/628 считается не!
ли неизбежно предопределены научными инте!
активной, т.к. не превращается в Chl(ide) при
ресами авторов, сформировавшимися под влия!
кратковременном освещении, ее более медлен!
нием проф. Ф.Ф. Литвина и его новаторских ра!
ное фотопревращение наблюдается в листьях
4 БИОХИМИЯ том 84 вып. 5 2019
650
СИНЕЩЕКОВ, БЕЛЯЕВА
растений, обогащенных этой формой, только
и Pchlide682/672 участвуют в биосинтезе реакци!
при температуре выше 5 °С [24-27]. По!видимо!
онных центров фотосистем II (PSII) и I (PSI)
му, Pchlide633/628 является предшественником ос!
[31, 32]. Таким образом, пигментно!белковые
новной активной формы Pchlide655/650 [28, 29].
комплексы предшественника Chl демонстриру!
Возможно, эта форма не защищена от фото!
ют высокую степень пластичности, которая, ве!
окисления по причине ее мономерной природы
роятно, предназначена для оптимизации адап!
или из!за отсутствия защитного каротиноидно!
тации к изменяющимся условиям окружающей
го окружения. Доминирующая активная форма
среды, в частности к условиям освещения.
Pchlide655/650 служит основным предшественни!
Образование нативных форм Chl включает
ком хлорофилльных форм светособирающих
ряд световых и темновых реакций, последова!
комплексов двух фотосистем. Она включает два
тельных и разветвленных, а также параллельных
подпула: Pchlide653/648 и Pchlide657/650. Pchlide653/648
и пересекающихся через идентичные интерме!
связана с протилакоидами или тилакоидами,
диаты. Эти реакции приводят к образованию
тогда как Pchlide657/650 связана с проламелляр!
всех пигмент!белковых комплексов реакцион!
ными телами (PLB) [29]. Pchlide655/650 представ!
ных центров и светособирающих комплексов
ляет собой димер или тетрамер, а более длинно!
двух фотосинтетических систем [33]. Преобра!
волновые формы Pchlide предположительно яв!
зование Pchlide655/650 в формы Chlide (рис. 1, б)
ляются более крупными агрегатами пигмента [30].
включает в себя две последовательные фоторе!
Эти формы могут поглощать избыточную свето!
акции и несколько последующих темных ста!
вую энергию, получаемую от более коротковол!
дий. Первая фотореакция приводит к образова!
новых форм предшественника, таким образом
нию Chlide684/676, который представляет собой
уменьшая их фотодинамическую активность.
смешанный димер Pchlide-Chlide. Вторая фото!
Представляет интерес тот факт, что второ!
реакция завершает фотовосстановление этого
степенные длинноволновые формы Pchlide686/676
агрегата путем образования димера (или тетра!
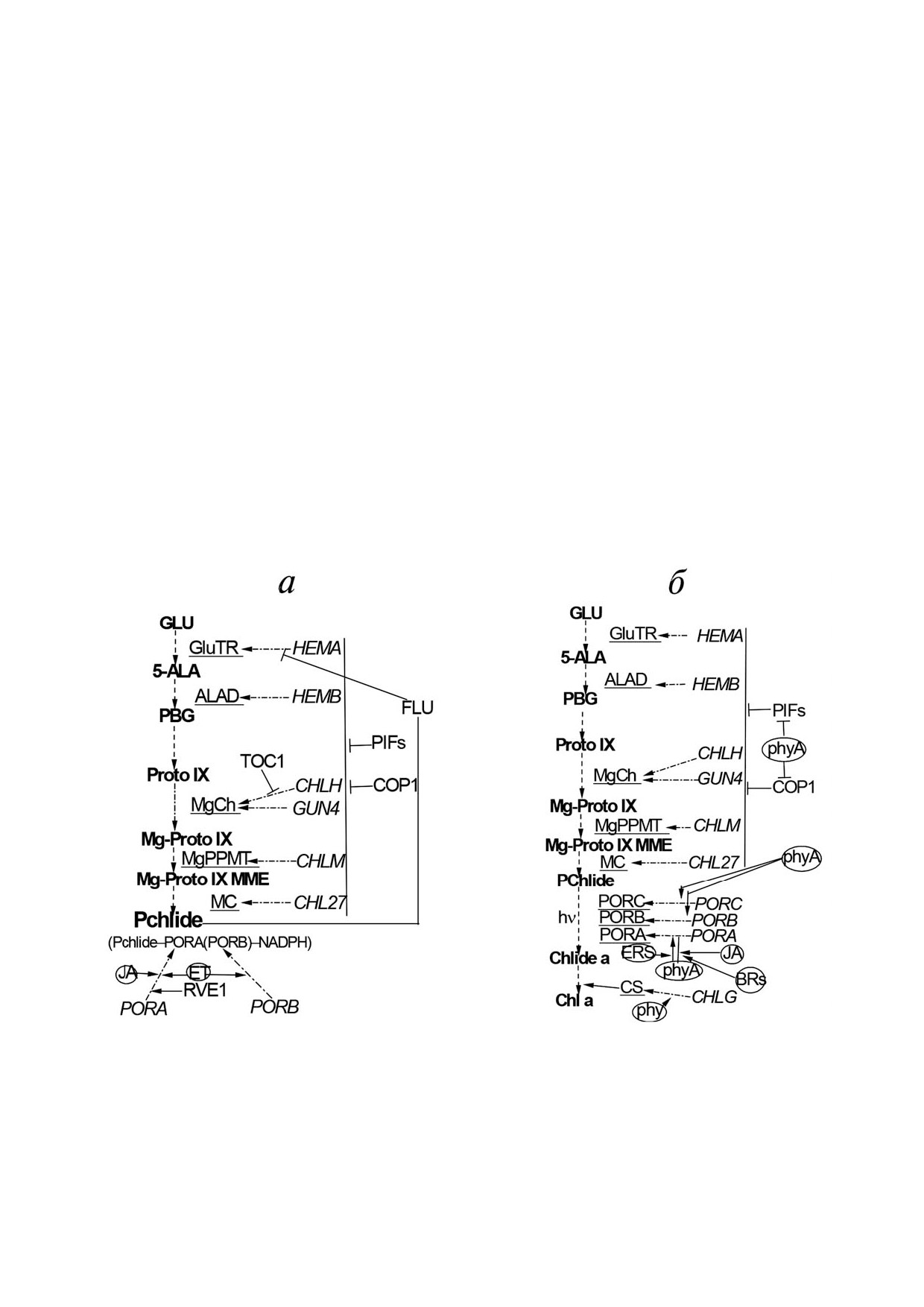
Рис. 1. Упрощенная схема темнового биогенеза протохлорофиллида (а) и превращения пигментных форм в ходе световой
стадии биосинтеза хлорофилла (б) у высших растений. Разделенные чертой числа здесь и в тексте обозначают положение
максимумов в спектрах флуоресценции/поглощения при низкой температуре для различных пигментных форм. Модифи!
цировано из монографии Беляевой О.Б. [33]
БИОХИМИЯ том 84 вып. 5 2019
ФИТОХРОМ А В БИОГЕНЕЗЕ ХЛОРОФИЛЛА
651
мера) Chlide690/680. Зависимый от температуры
центров) являются формы Chl695/690 и Chl703/698
спектральный сдвиг Chlide690/680 → Chlide695/685
(в бобовых растениях). Существует также эф!
(реакция 3 на схеме) не зависит от света и связан
фективная обратная передача энергии между
с изменениями пигмент!белкового комплекса,
формами Chl680/676 и Chl686/682 и пути миграции
включающими восстановление NADP+ до NADPH.
энергии, пропускающие одну или две ступени
Реакция 4 - это так называемый коротковолно!
энергетической лестницы. Передача энергии от
вый «сдвиг Шибаты» с образованием Chl683/670,
каротиноидов к Chl a происходит в комплексе
во время которого происходит дезагрегация про!
двух пигментов. Таким образом, нативные фор!
тохлорофиллид!оксидоредуктазы (POR, см. ни!
мы Chl и сложные взаимодействия между ними
же) и Chlide и присоединение фитола с образо!
обеспечивают направленный поток энергии к
ванием Chl с участием хлорофиллсинтазы. Мо!
реакционным центрам.
лекула хлорофилла покидает POR и перемеща!
ется на другие белки, образуя тилакоидные
структуры. Далее, более длинноволновые формы
БИОСИНТЕЗ ПРОТОХЛОРОФИЛЛИДА
Chl образуются с использованием белков, син!
И ЕГО ТЕМНОВАЯ РЕГУЛЯЦИЯ
тезируемых на темной стадии развития. В точке
взаимодействия двух фотореакций (при образо!
Образование Pchlide осуществляется в тем!
вании Chlide684/676) обнаруживается боковой
ноте как многоступенчатый процесс, который
путь, ведущий к более коротковолновой форме
является общим для всех тетрапирролов расте!
хлорофилла Chl675/670. Таким образом, этерифи!
ний. Универсальным предшественником всех
кация хлорофилла происходит не только на ста!
циклических (Chl, гем, корриноиды) и линей!
дии «сдвига Шибаты», но и с существенно (на
ных (билины) тетрапирролов является δ!амино!
порядок) большей скоростью в темной реакции
левулиновая кислота (ALA). У высших расте!
образования Chl675/670 из продукта первой фото!
ний, водорослей и ряда фотосинтезирующих
реакции. Боковая реакция образования Chl675/670
бактерий ALA образуется из глутаминовой кис!
протекает со значительной скоростью только при
лоты. Метаболизм растительных тетрапирролов
температурах выше 273 К, и этот путь превраще!
локализуется в пластидах, и все ферменты цепи
ния Pchlide доминирует над основным при низ!
биосинтеза кодируются ядерными генами. Пер!
кой интенсивности света. Все вышеперечислен!
вый ключевой этап в биосинтезе тетрапирролов,
ные реакции происходят в течение первых 30 ми!
синтез ALA, включает в себя три последователь!
нут освещения.
ные реакции, которые катализируются фермен!
В течение первых 2-4 ч после начала осве!
тами глутамил!тРНКглу!синтетазой, глутамил!
щения накопление Chl очень низкое. Однако
тРНКглу!редуктазой и глутамат!1!полуальде!
активность фотосинтетических систем наблю!
гид!аминотрансферазой.
дается уже в первые минуты освещения этиоли!
Второй ключевой этап, образование прото!
рованных листьев, т.е. формирование реакцион!
порфирина IX, является точкой разветвления
ных центров и их непосредственного окружения
путей биосинтеза гемов и хлорофиллов. Вклю!
происходит в этиопластах раньше, чем накопле!
чение магния в порфириновый цикл с образова!
ние основной массы хлорофилла. В этот период
нием Mg!протопорфирина IX (Mg!Proto IX)
происходят критические перестройки пластид!
служит началом цепи хлорофилльной ветви
ных мембран, в т.ч. образование гран [34, 35],
синтеза тетрапирролов. АТP!зависимая реакция
и появляется несколько промежуточных форм
хелатирования катализируется хелатазой маг!
Chl, отличающихся от форм светособирающих
ния. Mg!протопорфирин IX превращается в мо!
комплексов взрослых зеленых растений [36].
нометиловый эфир Mg!Proto IX (Mg!Proto!IX!
Практически все формы Chl, характерные для
MME) с помощью Mg!протопорфирин IX!ме!
зеленого листа, появляются на 4-6!й час после
тилтрансферазы.
начала освещения. К 16!му часу достигается
Третий ключевой момент в этом процессе -
постоянная относительная концентрация пиг!
образование Pchlide из Mg!Proto!IX!MME. Син!
мента в формах Chl, характерная для взрослого
тез молекулы Pchlide синхронизирован с синте!
зеленого растения (бобовые).
зом пигмент!связывающих белков. Образуется
В зрелом пигментном аппарате существует
проламеллярная структура этиопластов - про!
энергетическая лестница, образованная уровня!
ламеллярные тела (prolammellar bodies, PLB) и
ми энергии возбуждения форм хлорофилла [37,
протиллакоиды (prothylokoids, PT), - которая
38]. Это обеспечивает 80-100% потока погло!
включает в себя белки POR, содержащие Pchlide
щенных квантов к форме Ch738/698 в PSI, тогда
и функционирующие в качестве фотоферментов
как в PSII терминальными акцепторами энер!
в реакции фотовосстановления Pchlide до Chlide
гии (в случае блокированных реакционных
[39]. Важно отметить, что существует три вида
БИОХИМИЯ том 84 вып. 5 2019
4*
652
СИНЕЩЕКОВ, БЕЛЯЕВА
POR: PORA, PORB и PORC (см. ниже). Кроме
ществляется на метаболическом уровне посред!
того, POR являются донорами протонов в реак!
ством ретроингибирования конечными продук!
ции фотовосстановления Pchlide [40]. Третий
тами, главным образом, активной формой
компонент, который необходим для фотовос!
Pchlide, Chlide и гемом [41]. Механизм метабо!
становления Pchlide до Chlide, - это донор гид!
лического сигнала недостаточно изучен, однако
рид!иона - NADPH [39]. Образование тройного
было показано, что регуляторный белок FLU
фотоактивного пигмент!белкового комплекса,
участвует в этом процессе, модулируя активность
включающего Pchlide, NADPH и фотофермент
фермента глутамил!тРНК!редуктазы 1 посред!
POR, завершает темновую стадию биосинтеза
ством взаимодействия с его геном HEMA1 [41]
Chl. На этом этапе должны быть сбалансирова!
(рис. 2, a). McCormac и Terry [42] показали важ!
ны, и соответственно отрегулированы, три клю!
ную роль регуляторных белков GUN1 и GUN5 в
чевых момента, три линии биосинтеза компо!
независимых путях регуляции с обратной связью
нентов активного пигмент!белкового комплек!
генов HEMA1 и Lhcb. GUN1 является важным
са: хромофора Pchlide, фотофермента POR и до!
ингибитором экспрессии HEMA1 в темноте и
нора водорода NADPH.
при насыщающем белом свете. Кроме того, рет!
Регуляция стехиометрически сбалансиро!
роградный сигнал (RS) подавляет транскрип!
ванного тройного комплекса Pchlide-POR-
цию фактора GLK1, одного из основных регуля!
NADPH происходит на ключевых этапах био!
торов транскрипции фотомофогенеза [17, 43].
синтеза тетрапирролов: при образовании 1) ALA,
Этот метаболический сигнал участвует в цепи
2) протопорфирина IX и 3) при накоплении
передачи сигнала от пластид к ядру, чтобы регу!
комплекса Pchlide-POR-NADPH. Регуляция
лировать экспрессию ядерного гена в соответ!
биосинтеза ALA в значительной степени осу!
ствии с функциональным состоянием пластид.
Рис. 2. Схема пути биосинтеза хлорофилла и его регуляции у высших растений в темноте (а) и на свету с участием фито!
хрома (б). Реакционные субстраты даны жирным шрифтом, ферменты ключевых реакций подчеркнуты, их соответствую!
щие гены показаны курсивом, рецепторы - гормоны и фитохромы - представлены в овалах, белковые факторы, участву!
ющие в регуляции, обозначены заглавными буквами. Прерывистые линии соответствуют метаболическим шагам, линии
с точкой!тире - экспрессии генов, непрерывные линии - регуляции (позитивной со стреловидным концом и негативной
с тупым концом). Позитивная или негативная регуляция PORA фитохромом А определяется гормонами (JA и BR) и внут!
ренними регуляторными сигналами (ERS), зависящими от вида растения и его органа/ткани
БИОХИМИЯ том 84 вып. 5 2019
ФИТОХРОМ А В БИОГЕНЕЗЕ ХЛОРОФИЛЛА
653
Эти обратные сигнальные процессы от пластид
СВЕТОВАЯ РЕГУЛЯЦИЯ БИОСИНТЕЗА
к ядру играют важную роль не только у этиоли!
ХЛОРОФИЛЛА. ФИТОХРОМЫ
рованных растений, но и у зеленых растений для
регуляции экспрессии ядерных генов, где RS яв!
Механизмы действия фитохрома А (phyA). Два
ляется антагонистом фитохрома в регуляции
нативных типа phyA. При переходе из темноты
GLK1 [43]. Существует несколько пластидных
на свет у растения происходит существенная ре!
цепей передачи сигнала, которые взаимодейству!
организация всей его биологии, включая регу!
ют друг с другом и образуют сигнальную сеть,
ляторный механизм со всеми его светозависи!
обеспечивающую взаимосвязь между пластида!
мыми генами, кодирующими ключевые фер!
ми и ядром [44].
менты биосинтеза пигментов и связывающих их
Переход от ското! к фотоморфогенезу (деэ!
белков (рис. 2, б). Среди систем фоторецепторов
тиоляция) является наиболее уязвимым момен!
разной природы, образующих совершенный ап!
том для растения, т.к. накопление избыточного
парат восприятия светового сигнала у растений,
Pchlide, не связанного с POR, или других проме!
фитохром занимает центральное место из!за его
жуточных продуктов биосинтеза, может привес!
функциональной значимости и более продвину!
ти к фотодеструкции клеток из!за образования
того изучения.
активных форм кислорода или свободных ради!
Фитохромы представляют собой продукты
калов [45, 46]. Поэтому основные гены биосин!
небольшого семейства генов с phyA и phyB, яв!
теза тетрапирролов в темновой период развития
ляющимися наиболее важными ее членами.
(скотоморфогенез) регулируются негативно [14,
phyA содержится в относительно больших коли!
17, 18, 20, 47]. Решающую роль в этой регуляции
чествах в этиолированных тканях, что позволи!
играют белки PIF (phytochrome!interacting fac!
ло провести глубокие исследования in vitro его
tor), транскрипционные факторы с основным
молекулярной структуры и физико!химических
мотивом спираль!петля!спираль, вовлеченные
свойств. Этот пигмент представляет собой раст!
в клеточные процессы в качестве сигнального
воримый в воде билипротеин, молекула которо!
узла, объединяющего свет, гормоны и другие
го является гомодимером с мономерами, состо!
множественные сигналы развития [16, 48]. Не!
ящими из трех главных доменов (рис. 3) [53]:
гативные фитохром!взаимодействующие фак!
1) N!концевого фоторецепторного домена (70 кДа),
торы PI - PIF1, PIF3, PIF4 и PIF5 - накаплива!
2) C!концевого домена (55 кДа), ответственного
ются в ядре в темноте и подавляют фотоморфо!
за димеризацию и трансдукцию сигнала, и 3) гиб!
генные реакции, включая биосинтез Chl.
кой области связи между этими двумя доменами.
Другим ключевым регулятором экспрессии
Важное значение для свойств phyA имеет также
генов биосинтеза тетрапирролов (tetrapyrrole
крайний участок размером 10 кДа в N!конце мо!
biosynthesis, TPB) является белок COP1, кото!
лекулы (N!terminal extension, NTE), ответствен!
рый негативно регулирует HY5 - фактор, стиму!
ный за его функциональную активность [54],
лирующий транскрипцию практически всех ге!
киназные свойства и световую стабильность [55],
нов, кодирующих ферменты биосинтеза тетра!
а также дифференциацию пигмента на два на!
пирролов [49]. Кроме того, транскрипционный
тивных его подтипа (phyA' и phyA'') [11, 56].
фактор TOC1 репрессирует ген CHLH, кодиру!
Пигмент может находиться в одном из двух
ющий одну из трех субъединиц Mg!хелатазы
фотообратимых состояний - в исходном, мак!
путем прямого связывания с промотором ге!
симально поглощающим красный (R) свет (сос!
нов [50]. Гиббереллины, накопленные в темно!
тояние или форма Pr), в котором он синтезиру!
те, способствуют активации PIF путем деграда!
ется и находится в цитоплазме в темноте, а так!
ции белков DELLA и освобождения PIF от ин!
же в физиологически активном состоянии (Pfr)
гибирования этими белками [51]. Таким обра!
с максимальным поглощением в FR!области.
зом, активация негативных регуляторов и инак!
Цикл превращения фитохрома Pr ↔ Pfr запус!
тивация позитивных регуляторов могут поддер!
кается реакциями фотоизомеризации хромофо!
живать низкую экспрессию ключевых генов
ра в этих состояниях [57, 58]. При освещении
TPB в темноте. С другой стороны, накопление
фоторецептор в активной форме Pfr переносит!
достаточного количества POR, которая связыва!
ся из цитоплазмы в ядро, где индуцирует фото!
ет свободные молекулы Pchlide, обеспечивает
регулируемые гены и инициирует таким обра!
защиту растения от фотодеструкции. Это явля!
зом фотоморфогенез [59].
ется причиной позитивной регуляции генов
phyA не гомогенен, он представлен в этиоли!
PORA и PORB в этиолированных проростках, что
рованных тканях одно! и двудольных растений
происходит при участии фитогормона этилена и
двумя нативными пулами — phyA' and phyA'' [11,
факторов транскрипции COP1, EIN3, ABI4 и
56]. phyA' является основным и светолабиль!
RVE1 [18, 52].
ным, тогда как phyA'' - минорный, насыщаемый
БИОХИМИЯ том 84 вып. 5 2019
654
СИНЕЩЕКОВ, БЕЛЯЕВА
Рис. 3. Схема молекулы фитохрома А. Она состоит из двух мономеров, включающих в себя три домена: 1) фоторецептор!
ный N!домен (70 кДа), образованный четырьмя консервативными подчастями: хромофорный участок GAF с фитохромо!
билином (phytochromobilin, PФB), PAS и PHY, определяющие спектральные и фотохимические свойства, а также 10!кДа
N!концевой участок (N!terminal extension, NTE), ответственный за ряд ключевых свойств фоторецептора; 2) гибкий шар!
нирный участок, связывающий N! и C!домены; 3) регуляторный C!домен (55 кДа) с поддоменами PAS1 и PAS2, участву!
ющими в димеризации и трансдукции сигнала, а также поддоменом со свойствами гистидинкиназы (HKRD), функции
которого не определены
по концентрации и относительно светостабиль!
[59] (рис. 5), поскольку сигнал ядерной локали!
ный. Они различаются по спектральным и фо!
зации (nuclear localization signal, NLS) у него от!
тохимическим свойствам: phyA' и phyA'' являют!
сутствует. В ядре активация позитивных фото!
ся, соответственно, длинноволновым и корот!
морфогенетических факторов (HY5, HYH,
коволновым типами, способными (Pr') и неспо!
собными (Pr'') к фотоконверсии в первичный
фотопродукт (Pr → lumi!R) при криогенных
температурах (рис. 4). Последнее свойство поз!
воляет осуществлять количественные определе!
ния их концентрации и описывать их свойства в
1
3
растительных тканях in vivo с использованием
2
флуоресцентной спектроскопии и фотохимии.
Важно отметить, что при комнатной температу!
ре глубина превращения Pr → Pfr у двух пулов
4
мало отличается (0,80-0,85 у phyA' против 0,75 у
phyA''). Исследование этих пулов в трансгенных
растениях и в гетерологических системах (Pichia
pastoris и Escherichia coli) показали, что они явля!
ются продуктами одного и того же гена и разли!
Длина волны, нм
чаются состоянием фосфорилирования: phyA'
является фосфорилиованной формой, а phyA'' -
дефосфорилированной. Кроме этого, phyA'
Рис. 4. Спектры излучения флуоресценции (85 K, λex = 632,8 нм)
водорастворим, тогда как phyA'' - мембрано!
фитохрома в кончиках корней (положение максимума,
λmax = 680 нм) (1, 2) и кончиках колеоптилей (λmax = 685 нм)
связанный пигмент. Эти феноменологические
(3, 4) этиолированных проростков пшеницы, измеренные
и физико!химические различия между двумя
сразу после замораживания в темноте, когда весь пигмент
пулами phyA с определенностью указывают
находится в форме Pr (1, 3), и после насыщающего красно!
на возможное их функциональное различие
го освещения (λa = 632,8 нм), частично превращающего Pr
(см. ниже). Следует отметить, что phyB, в отли!
в lumi!R, первый стабильный при низкой температуре фо!
топродукт (состояние фоторавновесия между Pr и lumi!R)
чие от phyA, представлен в растениях только од!
(2, 4). Обращает на себя внимание разница в положении
ним типом, сходным по феноменологическим
спектра (λmax) и глубина фотопревращения Pr → lumi!R (γ1),
свойствам с phyA''.
определяемая как относительное падение интенсивности в
Трансдукция светового сигнала с участием
максимуме, 680 нм и 0,05, соответственно, для корней и 685 нм
и 0,46 - для колеоптилей. Эти спектры кончиков колеоп!
phyA включает в себя его перенос в форме Pfr из
тилей и корней представляют собой, соответственно, два
цитоплазмы в ядро, который происходит после
нативных типа phyA, phyA' и phyA''. Спектры не исправлены
его ассоциации с белками!партнерами FHY1
на спектральную чувствительность спектрофлуориметра.
(far!red elongated hypocotyl1) и FHL (FHY1!like)
Адаптировано из статьи Sineshchekov V.A. [56]
БИОХИМИЯ том 84 вып. 5 2019
ФИТОХРОМ А В БИОГЕНЕЗЕ ХЛОРОФИЛЛА
655
его исключительная ответственность за опосре!
дование атипичных необратимых VLFR и HIR,
инициируемых FR!светом. VLFR могут быть
индуцированы кратким прерывистым освеще!
нием и насыщаться при очень низких относи!
тельных концентрациях Pfr ([Pfr]
0,1%), тогда
как эффекты HIR достигаются при освещении
постоянным светом или светом относительно вы!
сокой частоты [3]. Максимум в спектре действия
фотоответов HIR расположен между максиму!
мами поглощения форм Pr и Pfr (~710 нм) в об!
ласти, где достигается максимальная концент!
рация Pfr в ядре в процессе челночного движе!
ния phyA из цитоплазмы в ядро с помощью
Рис. 5. Упрощенная схема механизма действия phyA. phyA
FHY1 и FHL [65]. Наряду с этими типами фото!
в своем состоянии Pr претерпевает фотоизомеризацию при
ответов phyA осуществляет также классические,
освещении, превращающем его в состояние Pfr. Это сопро!
индуцированные красным светом и обратимые
вождается ассоциацией фоторецептора с партнером!проте!
дальним красным светом, низкоэнергетические
ином FHY1 (или его аналогом FHL) и их переносом в ядро.
фотответы (low fluence responses, LFR), которые
Pfr-FHY1 взаимодействует там с комплексом COP1/SPA,
дезактивируя его, и образует комплексы с факторами тран!
характерны для phyB [9, 66].
скрипции (HY5, PIF3, HFR1, LAF1), которые в темноте
Проявление фотоответов VLFR и HIR зави!
разрушаются под действием COP1/SPA, но накапливаются
сит от состояния фосфорилирования пигмента в
на свету. Эти комплексы регулируют экспрессию широко!
области NTE, на что указывают исследования
го спектра генов. Другая ветвь сигнала Pfr включает дест!
рукцию взаимодействующих с фитохромом факторов PIF,
мутантов phyA табака, риса и арабидопсис,
которые препятствуют экспрессии светорегулируемых ге!
экспрессированных в трансгенный арабидоп!
нов в темноте. В цитоплазме phyA в форме Pfr модифици!
сис: делеционных и с заменой серина на аланин
рует фото! и гравитропизм и опосредует быстрые биохи!
(Ser/Ala) [66-68]. Исходя из того, что замена
мические процессы
Ser/Ala препятствует фосфорилированию моле!
кулы phyA в области NTE, было сделано пред!
HFR1, CIP7 и LAF1) осуществляется путем по!
положение о роли фосфорилирования в опреде!
давления формой Pfr негативной регуляции со
лении того или иного phyA!зависимого типа
стороны комплексов COP1/SPA (constitutive
фотоответов [66]. Мутация в домене PAS2 с за!
photomorphogenetic 1/suppressor of phyA!105) и
меной глутамина на лизин (Glu777Lys) предот!
замедления работы комплекса E3 (убиквитин),
вращает фотоoтветы HIR, но не влияет на ответы
который в темноте разрушает факторы транс!
VLFR, что свидетельствует об участии этого мо!
крипции, необходимые для фотоморфогенеза [60].
лекулярного участка в определении функцио!
В соответствии с работами Yang et al. и Chen
нальной специфичности phyA [69]. Различия
et al. [61, 62], FHY1 может играть значительную
между двумя типам фотоответов локализованы
роль в этом процессе, образуя различные сложные
также ниже по цепи трансдукции светового сиг!
факторы транскрипции - комплексы phyA-FHY1
нала [3]. Таким образом, phyA оказывается спо!
с HY5, PIF3, HFR1 и LAF1. Молекулярный ме!
собным передавать световой стимул по различ!
ханизм инактивации комплекса COP1/SPA под
ным путям. С другой стороны, в наших экспери!
действием phyA и phyB включает прямое взаи!
ментах было показано, что замена Ser/Ala в NTE
модействие их формы Pfr с SPA1 и другими SPA!
и доминирование вследствие этого HIR [66]
белками, что приводит к их разрушению и реор!
коррелируют с исчезновением пула 3, и на осно!
ганизации [60]. С другой стороны, phyA ингиби!
вании этого HIR был отнесен к phyA'', тогда как
рует PIF [63] и родственные белки HFR1 и PIL1 [64]
VLFR - к phyA' [11, 12]. Таким образом, мы
путем их фосфорилирования, сопровождающе!
должны принимать во внимание эту функцио!
гося убиквитированием и деградацией [48]. Ак!
нальную гетерогенность phyA в нашем анализе
тивизация фитохромом А факторов транскрип!
фоторегулирования биосинтеза Chl и формиро!
ции в результате этих двух процессов - актива!
вания фотосинтетического аппарата.
ции позитивных и ингибирования негативных
Опосредованное фитохромом А регулирование
факторов - приводит к экспрессии более тыся!
биосинтеза хлорофилла. Изучение проблемы ре!
чи генов, участвующих в фотоморфогенезе
гуляции биосинтеза Chl с участием phyA встре!
(см. выше, а также [3, 16]).
чает трудности, связанные с разделением эф!
Наиболее выраженным функциональным
фектов от светоиндуцированного превращения
отличием phyA от других фитохромов является
Pchlide655 в Chlide от таковых, связанных с акти!
БИОХИМИЯ том 84 вып. 5 2019
656
СИНЕЩЕКОВ, БЕЛЯЕВА
вацией фитохрома. Методология, направленная
После конверсии Pchlide в Chlide происхо!
на преодоление этой трудности, включает три
дит ряд последовательных реакций, связанных с
основных подхода: во!первых, использование
изменением пигмент!белкового комплекса
традиционной для фотофизиологии фитохрома
(см. выше и рис. 1). На стадии «сдвига Шибаты»
обратимости эффектов на действие R/FR света;
осуществляется дезагрегация Chlide и POR и
во!вторых, использование фитохромных мутан!
этерификация Сhlide. Скорости этерификации
тов и мутантов с нарушениями цепи трансдук!
Chlide [80, 81] и «сдвига Шибаты» [82] могли быть
ции сигнала; и в!третьих, эксперименты при
увеличены с помощью предосвещения этиоли!
действии дальнего красного света неактивного в
рованных проростков импульсами красного света,
фотоконверсии PChlide → Chlide, но эффектив!
при этом эффект обращался импульсом дальне!
ного в активации phyA.
го красного света. Однако глубина эффектов
Первый ключевой регуляторный шаг в
была различна для скорости двух процессов
биосинтезе Chl связан с формированием ALA
(спектрального сдвига и этерификации Сhlide).
(см. выше и рис. 2, а). При переносе проростка
Исходя из этого, авторы пришли к выводу, что
из темноты на свет обнаруживается стимуляция
фитохром (наиболее вероятно phyB, судя по их
накопления ALA [70, 71]. В позитивной свето!
R/FR!обратимому характеру, хотя phyA не мо!
вой регуляции накопления хлорофилла на этом
жет быть исключен) независимо контролирует
начальном участке его биосинтеза принимает
этерификацию Chlide и «сдвиг Шибаты». Было
участие фитохром [72]. Позднее Terry et al. про!
также показано, что фитохром значительно сти!
следили координированный синтез хлорофилла
мулирует регенерацию Pсhlide, ингибированного
и хлорофилл а/b!связывающего белка и показа!
с помощью обратной негативной связи [72, 83],
ли, что экспрессия HEMA1 и Lhcb регулируется
а также увеличивает скорость образования апо!
фитохромами, действующими по типу фотоот!
протеинов и количества рецепторных сайтов для
ветов HIR и LFR [42, 73, 74] (рис. 2, б). Недавно
связывания молекул хлорофилла [84] (рис. 2, б).
Tang et al. идентифицировали два транскрипци!
Следует отметить, что экспрессия ядерных ге!
онных фактора
- FHY3 (far!red elongated
нов, кодирующих различные белки хлороплас!
hypocotyl 3) и FAR1 (far!red impaired response 1) -
тов, может негативно регулироваться уровнем
в качестве позитивных регуляторов биосинтеза
накопления Chl или его предшественника [85].
хлорофилла в Arabidopsis [75]. FHY3 связывается
Мутации с нарушением регуляции развития
непосредственно с промотором и активирует
растений в темноте (scotomorphogenesis), сопро!
экспрессию гена HEMB1, который кодирует де!
вождающиеся частичным переходом к светово!
гидратазу δ!аминолевулиновой кислоты (amino!
му развитию (photomorphognenesis), были осо!
levulinic acid dehydratase, ALAD) на пути био!
бенно полезным инструментом в раскрытии ме!
синтеза хлорофилла. FHY3 физически взаимо!
ханизмов трансдукции светового сигнала от фи!
действует с негативным транскрипционным ре!
тохромов [86, 87]. Эти мутанты (cop, det, fus, lip)
гулятором PIF1 для координиции синтеза Pchlide
имели нарушения в системе подавления фото!
и зеленения проростка.
синтетических генов, включающей комплексы
Другая ключевая регуляторная точка связана
COP1/SPA. Продукты мутировавших генов (COP,
с образованием конечного продукта темновой
DET, FUS, LIP) в соответствующих растениях
стадии биосинтеза — комплекса Pchlide-POR-
дикого типа подавляют фотоморгенетический
NADPH (рис. 2, а). Установлено, что фитохром
тип развития в темноте, включая накопление
опосредует уменьшение содержания мРНК POR
тетрапирролов. Sperling et al. исследовали такой
при освещении этиолированных листьев [76].
мутант (Arabidopsis cop1+18, ранее det340) на
Были обнаружены две изоформы POR, PORA и
предмет определения роли PORA и PORB в фор!
PORB [77], одна из которых (PORA) негативно
мировании проламеллярных тел (PLB) и обра!
регулируется светом, а другая (PORB) относи!
зования Pchlide655/650 во время скотоморфогене!
тельно светонезависима. Третья изоформа POR,
за и показали, что гены PORA и PORB взаимоза!
PORC, была обнаружена в зеленых тканях Arabi+
меняемы в этих процессах [88]. В контексте дан!
dopsis, эта форма проявляла позитивную зависи!
ного обсуждения представляет интерес мутант
мость от интенсивности действующего света
гороха с независимым от света фотоморфогене!
[78, 79]. Число генов POR варьирует в различных
зом lip1 [89], т.к. горох имеет менее сложную
видах растений, хотя некоторые растения имеют
систему фитохромов (только phyA и phyB) [90] и
только один ген POR (см. ссылки в монографии
один тип POR [91]. У этого мутанта присутству!
Беляевой [33]). При определенном световом ре!
ют агранальные пластиды с протилакоидами,
жиме растения могут использовать преимущест!
PLB не сформированы (в отличие от проростков
венно один из трех ферментов для поддержания
дикого типа с этиопластами и PLB), доминирует
оптимального уровня синтеза Chl.
форма Pchlide632/628 и активная форма Pchlide655/650
БИОХИМИЯ том 84 вып. 5 2019
ФИТОХРОМ А В БИОГЕНЕЗЕ ХЛОРОФИЛЛА
657
подавлена [26, 89]. На основе аналаза этого му!
phyA, оказались полностью нечувствительными
танта Seyyedi et al. [26] пришли к выводу, что на!
к ингибированию роста гипокотиля под FR [4].
копление POR (у гороха) не является достаточ!
Проростки мутантов fri и дикого типа, выра!
ным условием для образования PLB и Pchlide655/650,
щенные в темноте, зеленели при переносе на бе!
и для этого необходимы другие неустановлен!
лый свет. Однако, при выращивании под FR
ные регуляторные факторы. Мутант был также
растения дикого типа теряли способность в
охарактеризован по состоянию phyA в нем [89,
дальнейшем зеленеть под действием белого све!
92]. Его содержание в мутантных растениях бы!
та, тогда как мутанты fri зеленели нормально.
ло ниже, чем в растениях дикого типа в 3-10 раз
Сходную картину наблюдали Barnes et al. на
в зависимости от органа/ткани и возраста расте!
мутантах Arabidopsis, дефицитных по phyA и по
ний, но без изменения соотношения phyA'/phyA''.
компонентам цепи трансдукции сигнала от
Эти эффекты в мутантных растениях рассмат!
phyA (fhy1), что подразумевает эволюционное
риваются как результат активации цепи транс!
сохранение между разными видами phyA!зави!
дукции фитохромного сигнала в темноте. Пред!
симого механизма регулирования этих процес!
ставляет интерес тот факт, что мутация lip1 не
сов [5]. Было также установлено, что phyA после
затрагивает фитохром в корнях, что указывает
освещения проростков FR не только ингибиро!
на органо/тканевую специфику регуляции экс!
вал накопление Chl при их последующем осве!
прессии гена PHYA [92].
щении красным или белым светом, но и вызы!
Дальнейший генетический анализ мутантов
вал их гибель после такой предварительной об!
с нарушением в цепи трансдукции фитохромного
работки FR [4, 5]. У растений гороха, подвергну!
сигнала выявил взаимодействующие с фитохро!
тых постоянному освещению FR, наблюдали
мом факторы (PIF) в качестве негативного регу!
повышенное накопление пластидных РНК и
лятора биосинтеза хлорофилла. Было показано,
ДНК [95]. Опосредованное phyA подавление гена
что PIF1 подавляет ключевые регуляторные ге!
POR, а также накопление большой субъединицы
ны биосинтеза хлорофилла в темноте и прорас!
Rubisco под FR было продемонстрировано на
тание семян под дальним красным светом [16,
растениях табака (Nicotiana tabacum L.) [96]. Эти
48, 93]. Уровни Pchlide и POR в темноте также
стимулированные светом FR ответы относятся к
контролируются факторами PIF, и этот эффект
опосредованному phyA типу HIR [97].
подавления обращается светом посредством
Все эти данные дают основание заключить,
протеолиза PIF [16]. Было установлено, что PIF1
что ингибирование биосинтеза Chl под красным
играет аналогичную роль в синтезе каротинои!
и белым светом является следствием регулятор!
дов (скоординированном с биосинтезом хлоро!
ной активности phyA в проростках во время их
филла и развитием хлоропластов), подавляя в
роста под дальним красным светом. Barnes et al.
темноте ген фитоенсинтазы (phytoene synthase,
интерпретировали этот эффект как результат
PSY) - основного фермента, определяющего
жесткого подавления экспрессии генов POR под
скорость биосинтеза каротиноидов и ускоряю!
FR, сопряженного с необратимым повреждени!
щего его при освещении [94].
ем пластид, что приводило к разделению скоор!
Специфика биосинтеза Chl и его регулироваF
динированного в норме и опосредованного фи!
ния фитохромом А под действием дальнего красF
тохромом подавления POR и светозависимого
ного света. Фотофизиология растений, расту!
восстановления протохлорофиллида [5]. Дейст!
щих под пологом леса в условиях глубокой тени
вительно, проростки дикого типа Arabidopsis,
при освещении светом с преобладанием в нем
выращенные под постоянным дальним крас!
дальнего красного компонента, может быть оха!
ным светом (FRc) [5, 98, 99], а также выращен!
рактеризована тремя существенными чертами:
ные в темноте проростки фотоморгенетическо!
замедленным накоплением Chl, разбалансиро!
го мутанта det340 [100], не имеют PORA, мРНК
ванностью двух фотосистем фотосинтеза в
PORA, фотоактивного Pchlide655/650 и PLB и не
пользу PSI и доминированием phyA в качестве
способны зеленеть нормально на белом свету.
фоторецептора. Тем не менее высшие растения
В то же время оверэкспрессия PORA или PORB
преодолели эти трудности путем скоордирован!
в Arabidopsis позволяет преодолеть индуциро!
ного действия ряда факторов, оптимизирующих
ванный FRc блок зеленения, вызванный фото!
их физиологию даже в этих неблагоприятных
окислительным повреждением пластид на бе!
естественных условиях. Однако в условиях лабо!
лом свету [88]. Таким образом, блокирование зе!
ратории при строгом дальнем красном освещении
ленения объясняется отсутствием продуктов ге!
(постоянном или прерывистом при λa
700-720 нм)
нов POR и Pchlide655/650 и избыточным накопле!
превращение Pchlide в Chlide невозможно, и эф!
нием свободных молекул Pchlide633/628, потенци!
фект действия phyA может быть исследован per se
ального сенсибилизатора фотоокислительного
[4, 5, 88]. Мутанты (томатов fri), дефицитные по
повреждения [5, 88, 98, 99, 101].
БИОХИМИЯ том 84 вып. 5 2019
658
СИНЕЩЕКОВ, БЕЛЯЕВА
Проводя исследования в этом направлении,
дующее зеленение под белым светом, эффекты,
McCormac и Terry проследили экспрессию гена
относящиеся преимущественно к HIR. Однако
HEMA1 в ходе опосредованного phyA и индуци!
это может быть не универсальным феноменом:
рованного FR блока зеленения под белым све!
он хорошо задокументирован у однодольных
том у Arabidopsis [74]. Этот эффект состоял из
[76, 104], но у двудольных он менее четко опре!
двух раздельных ответов: один был вызван поте!
делен [105, 106]. В соответствии с данными
рей экспрессии генов HEMA1 и Lhcb (тран!
Meyer et al. [7], предложенная негативная регу!
скрипционно!связанный ответ), а другой ответ
ляция светом образования хлорофилла и актив!
оказался транскрипционно!несвязанным. Пос!
ности POR не может быть принята как общее
ледний коррелировал с дерегуляцией синтеза
положение для всех высших растений. Были об!
тетрапирролов и фотоокислительным повреж!
наружены разнообразные эффекты действия
дением пластид. Оба эффекта приводили к по!
света на POR у различных видов растений, что
тере экспрессии ядерных генов и были ингиби!
интерпретировано как проявление суперпози!
рованы оверэкспрессией POR. Исходя из этого,
ции негативной регуляции PORA и конститутив!
авторы выдвинули положение о роли пластид!
ной экспрессии PORB [78]. Однако ситуация мо!
ного сигнала в индуцированных FR процессах.
жет быть более сложной. Эта гипотеза не объяс!
Дальнейшие исследования [42] показали, что
няет, в частности, сложной динамики POR: не!
регуляторный механизм с обратной связью от
гативное действие света сменялось позитивным
функционирующих пластид необходим для нор!
в развивающихся листьях гороха [107], содержа!
мального развития хлоропластов. Эти авторы
щих только один тип POR [91].
проследили экспрессию трех ядерных генов,
В наших экспериментах знак и глубина
Lhcb, HEMA1 и GSA, под действием предосвеще!
действия FRc на накопление Pchlide655/650 зави!
ния FR и показали, что Lhcb был в наибольшей
сели от вида растения, а также от использован!
степени подавлен, и белок GUN1 был домини!
ных органов/тканей [8]. В семядолях томата и
рующим в пластидном регулировании (с обрат!
Arabidopsis, выращенных под FRc, наблюдали
ной связью) гена HEMA1. Следует отметить, что
падение содержания Pchlide655/650 в соответствии
Terry et al. недавно предложили новую модель, в
с данными Runge et al. [98] и Barnes et al. [5] (рис. 6).
которой сигнал от химически активного синг!
Эти эффекты, полученные на двудольных расте!
летного кислорода, генерированного предшест!
ниях, были подтверждены экспериментами на
венником хлорофилла, ингибирует экспрессию
однодольном рисе (Oryza sativa L. cv. Nipponbare)
ключевых фотосинтетических генов и генов
и его мутантах, дефицитных по phyA, phyB или
синтеза хлорофилла с целью предотвращения
phyAphyB [108]. FRc вызывал резкое падение
фотоокислительного повреждения в ходе деэти!
как Pchlide633/628, так и Pchlide655/650 у растений
оляции [102].
дикого типа и у мутанта по phyB, укорочение
Говоря о фотопревращении Pсhlide в Chlide
колеоптиля и появление первого листа, тогда
под действием света, обогащенного по компо!
как прерывистый дальний красный свет (FRp)
ненту FR, следует отметить что эти световые ус!
той же дозы был малоэффективен. Это позволи!
ловия соответствуют специфическому типу фо!
ло отнести эти ответы к типу HIR в согласии с
топревращения, которое происходит под дейст!
Yanovsky et al. [69]. Однако на семядолях табака
вием света низкой интенсивности (см. выше и
и листьях гороха, а также верхних частях стеблей
рис. 1). Существует побочный путь образования
всех исследованных растений (табака, гороха,
Chl - образование коротковолновой формы
томата и Arabidopsis) наблюдали положительный
Chl675/670, которая становится основной при
эффект действия FRc разной интенсивности на
низких интенсивностях света [103]. Это должно
накопление Pchlide655/650 (рис. 6). Следует отме!
соответствовать условиям роста растений под
тить, что разный знак действия FRc на Pchlide655/650
светом, богатым FR и с относительно неболь!
не связан с доступностью хромофора Pchlide [109].
шим вкладом фотохимически активного света в
Эти вариации эффекта света FRc напомина!
области 650 нм (например, в глубокой тени от
ют световую регуляцию мРНК phyA [110]. Авто!
лиственного покрова). В этих условиях эта по!
ры обнаружили три транскрипта PHYA, синтез
бочная ветвь превращения Pсhlide может стано!
которых по!разному регулируется в зависимос!
виться основной, что требует эксперименталь!
ти от их локализации в растении. Это было ин!
ной проверки.
терпретировано как проявление того факта, что
Изменение знака регуляции фитохромом А биоF
ген PHYA является объектом регуляции различ!
синтеза хлорофилла. Функциональное взаимодейF
ными сигналами: сигналами от окружения и
ствие phyA и гормонов. Как обсуждалось выше,
сигналами, связанными с развитием растений и
FR подавляет накопление POR и Pchlide655/650,
зависимыми от органа/ткани. Можно предпола!
вызывает деструкцию PLB и ингибирует после!
гать существование сходных свойств и в случае
БИОХИМИЯ том 84 вып. 5 2019
ФИТОХРОМ А В БИОГЕНЕЗЕ ХЛОРОФИЛЛА
659
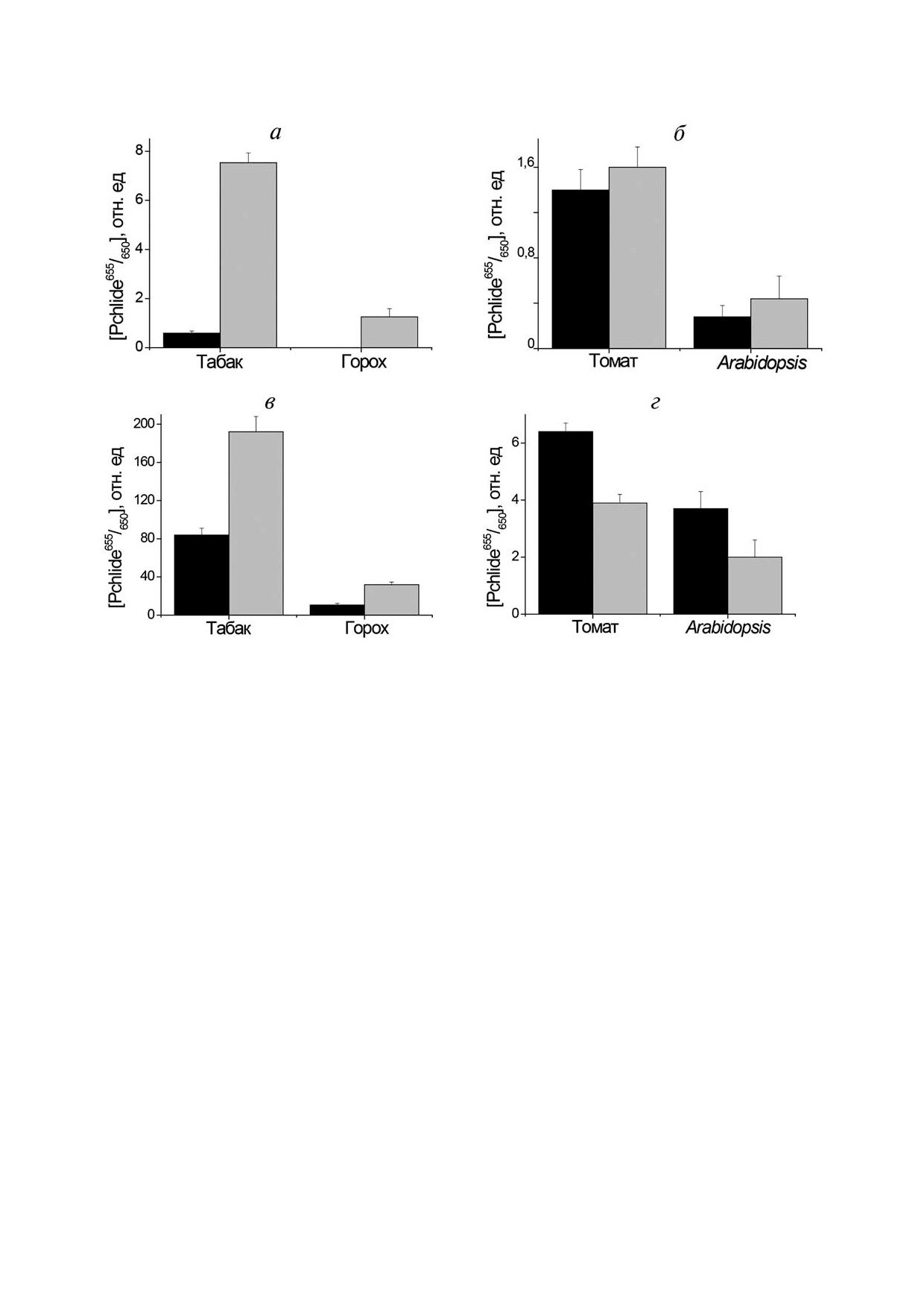
Рис. 6. Содержание активного протохлорофиллида Pchlide655/650 в этиолированных (левые темные столбцы) и выращен!
ных под дальним красным светом (правые серые столбцы) проростках табака, гороха, и Arabidopsis: (а, б) - их гипокоти!
ли и (в, г) - их семядоли, а также первичные листья гороха. Адаптировано из статьи Sineshchekov et al. [8]
гена POR. Armstrong et al. [78] отмечают также
дается для phyA. Эти результаты согласуются с
аналогию между PORA, негативно регулируе!
данными Takano et al. [9, 111], которые наблюда!
мой светом, и конститутивно экспрессирован!
ли положительную регуляцию FRc в отношении
ной PORB, соответственно, со светорегулируе!
светозависимых генов, кодирующих хлорофилл
мым phyA и относительно светостабильным
a/b!связывающий белок (CAB) у phyA!дефи!
phyB. Существует, по!видимому, общий меха!
цитного мутанта риса и отсутствие его в двой!
низм, позволяющий различать два типа свето!
ном мутанте phyAphyC. Таким образом, знак
вой регуляции. Таким образом, мы можем за!
эффекта FRc в отношении биосинтеза активно!
ключить, что знак действия phyA на экспрессию
го протохлорофиллида зависит также и от фото!
гена POR (т.е. его индукция или репрессия) и его
рецептора - фитохрома phyA или phyC в нашем
глубина модулируются сигналами, специфич!
случае.
ными в отношении вида растения, а также его
В современных исследованиях фитохрома
органа/ткани.
взаимосвязь между световым и другими сигна!
Обращает на себя внимание следующее наб!
лами становится одной из центральных тем [15,
людение на мутантном растении, дефицитном
87, 112, 113]. В частности, фитогормоны непо!
по phyA
[108]. Содержание Pchlide633/628 и
средственно вовлечены в регуляторные процессы
Pchlide655/650 было таким же, что и у дикого типа
с участием phyA, определяя знак действия света
в темноте и не изменялось под действием FRp.
на биосинтез Chl. Kobayashi et al. [18] наблюдали
Однако при освещении FRc концентрация
противоположное влияние ауксина/цитокини!
Pchlide655/650 увеличивалась на 100%, что указы!
на на регуляцию накопления Chl в корнях
вает на возможное участие phyC в этой регуля!
Arabidopsis: репрессию ауксином и стимуляцию
ции (по типу HIR), но ее знак иной: индукция
цитокинином. В экспериментах Roy et al. [114]
накопления вместо подавления, как это наблю!
фитохром индуцировал подавление биосинтеза
БИОХИМИЯ том 84 вып. 5 2019
660
СИНЕЩЕКОВ, БЕЛЯЕВА
Chl в этиолированных листьях (риса) при осве!
В случае биосинтеза Pchlide роль JA в регуля!
щении красным светом высокой интенсивности
торном процессе с участием phyA проявляется
основания побега, что было вызвано снижением
даже более явно. Общее содержание Pchlide633/628
накопления ALA. Авторы приписали наблюдае!
и Pchlide655/650 было выше в мутанте, что говорит
мый эффект phyA и R!индуцированному типу
о подавлении этим гормоном синтеза протохло!
HIR. Возможное участие гормонов могло бы
рофиллида в диком типе. Однако наиболее вы!
объяснить пространственно!разобщенный ха!
раженное влияние JA на сигнал phyA было обна!
рактер эффекта. Cheminant et al. [51] показали
ружено в случае биосинтеза Pchlide655/650. В про!
решающую роль регулируемых гибберелинами
ростке дикого типа FRp стимулировал биосин!
(gibberellin, GA) белков DELLA в формирова!
тез пигмента, тогда как FRc той же дозы был ин!
нии функционирующих хлоропластов в ходе де!
гибирующим (рис. 7). Напротив, в мутантном
этиоляции. Эти белки регулируют уровень POR,
растении оба типа освещения FRp и FRc акти!
Pchlide и каротиноидов в темноте путем репрес!
вировали биосинтез Pchlide655/650, т.е. знак эф!
сирования PIF. Регуляция с участием гормона
фекта FRc менялся с негативного у растений ди!
этилена интегрируется с регуляцией фитохро!
кого типа на позитивный у hebiba. Принимая во
мом в результате взаимодействия PIF и факто!
внимание тот факт, что у Arabidopsis HIR отнесен
ров транскрипции EIN3/EIL1 в сигнальной це!
к phyA'', а VLFR - к phyA' [11, 12], мы можем
пи от этилена. Последний индуцирует экспрес!
высказать предположение, что воздействие FRc
сию генов PORA и PORB, подавляет накопление
и FRp на накопление Pchlide655 в диком типе ри!
Pchlide и в общем интенсифицирует зеленение
са и его мутанте hebiba опосредуются phyA'' и
проростков [115]. Этилен активирует также PIF3
phyA' соответственно. Эти наблюдения согласу!
посредством фактора EIN3, что приводит к сти!
ются с данными по подавлению PORA в пророст!
муляции роста растения на свету и его ингибиро!
ках, выращиваемых в темноте [118]. Можно также
ванию в темноте. Свет, таким образом, обращает
отметить, что блок зеленения светом FR, по
знак действия этилена [113].
крайней мере частично, регулируется JA [118, 119].
В наших экспериментах [10] связь между сиг!
В общем, сигналы от JA и фитохрома взаим!
налом от phyA и действием гормонов была уста!
но антагонистичны [15]. Гены биосинтеза JA ин!
новлена в результате обращения знака регулятор!
дуцируются phyA, однако присутствует и нега!
ного действия phyA на накопление Pchlide655/650
тивная обратная связь, в которой сигнал от JA
в мутанте риса (Oryza sativa L. Japonica cv. Ni!
ингибируется сигналом от фитохрома. С другой
honmasari) hebiba, дефицитного по жасмоно!
стороны, JA запускает фосфорилирование
вой кислоте (jasmonic acid, JA) - гормону, кото!
phyA [119], возможно, по Ser598 [15], что снижа!
рый вовлечен в ответы на биотические и абио!
ет активность phyA за счет его взаимодействия с
тические стрессы, такие как ранения и защита
от них [116]. В темноте этот мутант имел длин!
ный мезокотиль и короткий колеоптиль, тогда
как ситуация была обратная под действием FRc
(λa > 720 нм) - проросток обладал коротким ме!
зокотилем и длинным колеоптилем. Активность
FRc доказывает участие в этих световых эффек!
тах phyA, но со знаком, отличным от наблюдае!
мого на диком типе риса: короткий колеоптиль
и даже появление первого листа под действием
FRc [10, 116]. В темноте содержание phyA' и
phyA'' было одинаковым в диком типе и в hebiba,
что указывает на отсутствие влияния JA на ско!
рость синтеза phyA и его дифференциацию на
подпулы. При освещении FRc концентрация
phyA уменьшалась в диком типе и отношение
phyA'/phyA'' смещалось в сторону phyA''. Однако
у hebiba светоиндуцированное падение содержа!
ния phyA было менее выражено и отношение
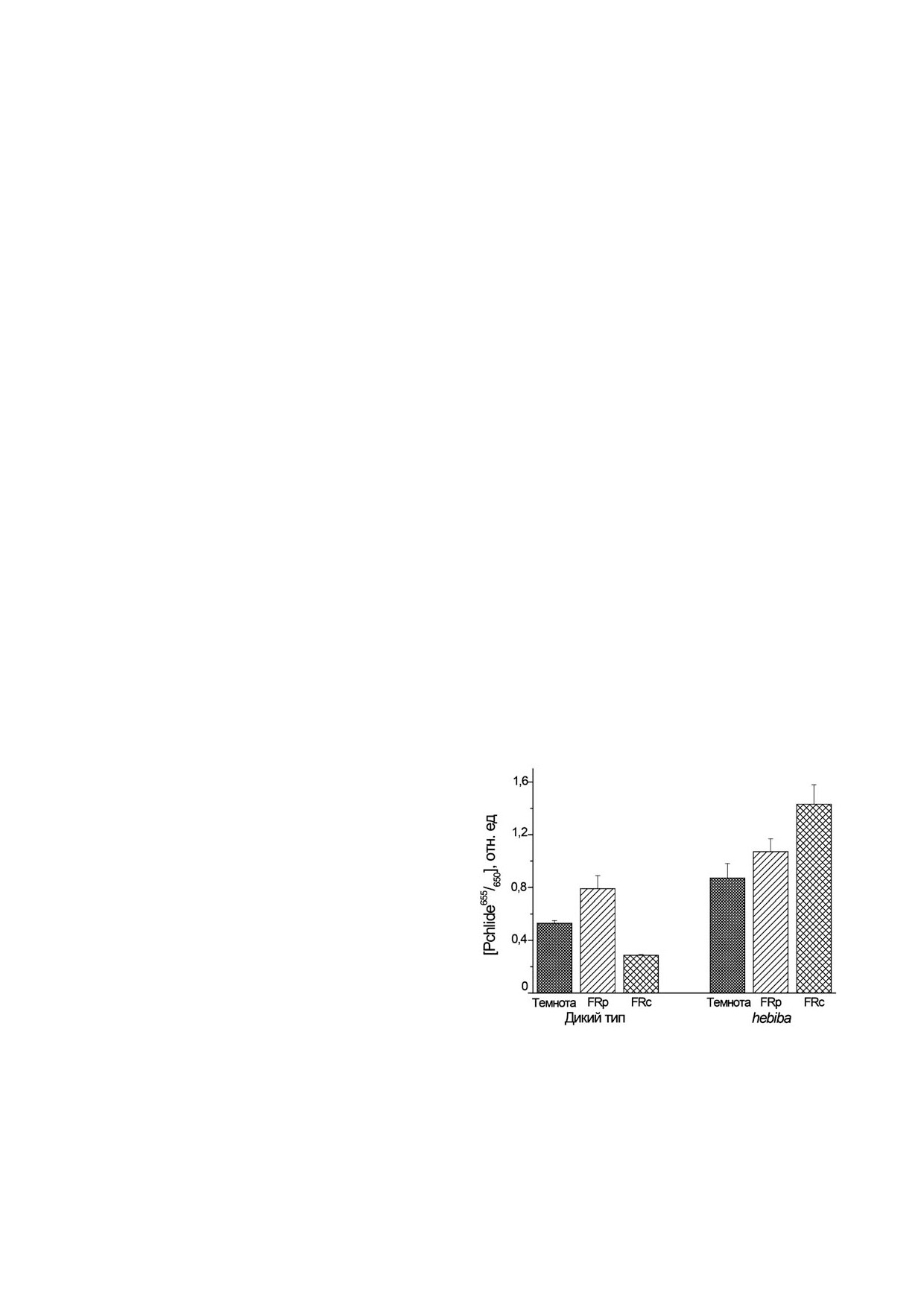
Рис.
7. Содержание активного протохлорофиллида
между phyA' и phyA'' не нарушалось. Это указы!
(Pchlide655/650) в кончиках колеоптилей дикого типа риса и
его мутанта hebiba, дефицитного по гормону жасмоновой
вает на негативное влияние JA на phyA под
кислоте. Проростки выращивали 5 дней в темноте или под
действием FRc (HIR) и вовлечение, таким обра!
прерывистым (FRp) или постоянным (FRc) дальним крас!
зом, этого гормона в светоиндуцированный
ным светом, FR (λa
720 нм) одинаковой дозы. Адаптиро!
оборот phyA в растении [10, 117].
вано из статьи Sineshchekov et al. [10]
БИОХИМИЯ том 84 вып. 5 2019
ФИТОХРОМ А В БИОГЕНЕЗЕ ХЛОРОФИЛЛА
661
партнерами по цепи трансдукции сигнала [120].
тазно/киназного равновесия в цитоплазме и ее
Активность phyA может уменьшаться под влияни!
pH [123].
ем JA путем стимуляции его разрушения [10, 117].
Следует отметить, что по нашим данным [124],
В фитохромную регуляцию вовлечены и дру!
фосфорилирование phyA в области NTE, предпо!
гие растительные гормоны. Обнаружены сложные
ложительно конвертирующее phyA'' в phyA' [11, 12],
регуляторные взаимосвязи между фитохромом,
происходит, по!видимому, как трансфосфори!
гиббереллинами (gibberellin, GA) и абсцизовой
лирование и по иным серинам (серину), чем из!
кислотой (abscisic acid, ABA) [121]. Luccioni et al.
вестный процесс автофосфорилирования фото!
[122] наблюдали подавление HIR и LFR в мутанте
рецептора по Ser8 и Ser18 у овса, который, сог!
Arabidopsis (eve1) с нарушенным синтезом брази!
ласно Han et al. [55], делает phyA более светола!
ностероидов (brassinosteroid, BR), что свидетель!
бильным и менее функционально активным.
ствует о включении бразиностероидов в фито!
Фосфорилирование phyA в области NTE может,
хромный сигнал в качестве позитивных факторов.
таким образом, достигать двух целей - диффе!
Становится все более определенным, что ключе!
ренцирования phyA на phyA'' и phyA' (активных,
вые сигнальные компоненты (PIF, HY5 и др.) осу!
соответственно, в HIR и VLFR) и модификации
ществляют связь между световыми и фитогормо!
чувствительности phyA за счет изменения его
нальными сигналами в регуляции прорастания се!
световой лабильности.
мян и фотоморфогенеза проростков [16, 87, 112].
Эти эффекты по изменению содержания и
Представленные выше эффекты JA, BR и
баланса phyA' и phyA'' могут иметь прямое отно!
других гормонов, модифицирующие сигнал
шение к регуляции биосинтеза Chl с помощью
phyA, могут рассматриваться как еще один спо!
phyA, поскольку VLFR и HIR, опосредованные
соб настройки фитохромной системы и приспо!
этими пулами phyA (см. выше), вовлечены в
собления растений к изменяющимся световым
этот процесс. В соответствии с Kneissl et al. [66]
условиям окружающей среды.
phyA дикого типа риса и его мутант phyA SA
Тонкая настройка действия phyA. Регуляция
(с заменой 10 серинов аланинами в NTE),
баланса phyA'/phyA''. Регуляция активности phyA
экспрессированные в трансгенном Arabidopsis,
включает в себя хорошо известный феномен его
дефицитном по собственному phyA, проявляли
деструкции и подавления биосинтеза на свету.
свойства эндогенного phyA Arabidopsis в отно!
Адаптация функционирования phyA к окружа!
шении эффектов FRc - подавления биосинтеза
ющим световым условиям может быть более
Chl и гибели проростков (FR block of greening,
сложной, если принять во внимание существо!
«far!red light killing effect») (тип фотоответа -
вание двух нативных типов фоторецептора (phyA'
HIR). Под действием FRp (условия VLFR) му!
и phyA'') с различными способами действия [11,
тантный phyA SA был менее эффективным, чем
56]. Наши исследования выявили четыре раз!
phyA дикого типа в этих процессах. Поскольку
личных эффекта действия света на их содержа!
мутантный phyA SA риса представлен phyA'',
ние и равновесие. Во!первых, опосредованное
а phyA дикого типа включает в себя оба типа,
красным светом разрушение phyA преимущест!
phyA' и phyA'' [12], мы можем заключить, что
венно в его светолабильной форме phyA'. Во!
phyA'' является доминирующим видом фоторе!
вторых, негативная регуляция биосинтеза phyA
цептора, участвующим в этих индуцированных
под действием FR без нарушения равновесия
FRc эффектах ингибирования биосинтеза Chl
phyA'/phyA''. В!третьих, в этиолированных про!
(по типу HIR). Это согласуется с отнесением
ростках (Arabidopsis) соотношение phyA'/phyA''
HIR к phyA'' и VLFR - к phyA' [11, 12]. Наблюде!
регулируется индуцирующим прорастание се!
ние Kneissl et al. [66], что экспрессия phyA SA
мян освещением белым светом, смещая его в
приводит к гиперчувствительности под действи!
сторону светолабильного phyA' [11, 12]. И в!чет!
ем FRc в реакции ингибирования удлинения ги!
вертых, предшествующая деструкции phyA кон!
покотиля и к незначительному ответу под
версия phyA' в phyA'', индуцированная красным
действием R, тогда как линии, экспрессирующие
предосвещением этиолированных колеоптилей
phyA дикого типа, были гиперчувствительны к
(ячменя) (В. Синещеков и Л. Коппель, неопубли!
воздействию R в этом эффекте, а не к FRc, под!
кованные результаты). Специфичность действия
тверждает это заключение. В его пользу можно
phyA в зависимости от органа/ткани растения
отнести также тот факт, что при освещении FRp
и/или его стадии развития может также реализо!
(VLFR) ингибирование удлинения гипокотиля
ваться путем изменения в содержании двух пулов
было сильнее в линиях Arabidopsis, экспрессиру!
phyA в растении в темновых условиях. В этой
ющих phyA риса дикого типа, чем в тех, где
связи представляет интерес тот факт, что со!
экспрессирован мутантный phyA SA. Таким об!
отношение phyA'/phyA'' зависит от двух основ!
разом, накапливаются экспериментальные до!
ных регуляторных факторов в клетке - фосфа!
казательства, которые подчеркивают необходи!
БИОХИМИЯ том 84 вып. 5 2019
662
СИНЕЩЕКОВ, БЕЛЯЕВА
мость учитывать структурную и функциональ!
тельность phyA, которая может становиться вред!
ную гетерогенность phyA при анализе световой
ной для растения из!за избыточной стимуляции
регуляции биогенеза Chl и формирования фото!
де!этиоляции (в частности, повышенного накоп!
синтетического аппарата.
ления Pchlide), снижается за счет негативной ре!
гуляции биосинтеза phyA, его деструкции и по!
Переход от ското! к фотоморфогенeтическому
нижения уровня передачи светового сигнала.
способу жизни осуществляется у растений при
Еще большую сложность этой картине при!
участии двух основных явлений - фотопревра!
дает тот факт, что phyA представлен в растениях
щения Pchlide в Chlide и далее в Chl, и активации
двумя его нативным типами - phyA' и phyA''. Они
фотоиндуцибельных генов, кодирующих фото!
различаются по спектральным и фотохимичес!
синтетические белки. В процессе скотоморфоге!
ким свойствам, ассоциации с мембраной (бел!
неза сигнальные системы подавляют экспрессию
ком), световой стабильности и, что наиболее
генов, кодирующих ферменты биосинтеза тетра!
важно, по способу действия - VLFR в случае
пирролов, результатом чего является исключение
phyA' и HIR, а также возможно LFR - в случае
их потенциально опасного избыточного накоп!
phyA''. Их общее содержание и пропорция и, та!
ления, а также стимулируют экспрессию генов
ким образом, их активность изменяются в зави!
ферментов PORA и PORB, которые связывают фо!
симости от вида растения, его органа и ткани,
тодеструктивные молекулы свободного Pchlide.
стадии развития, условий освещения и других
Под освещением сигнальные системы способ!
факторов. Регуляция содержания phyA' и phyA''
ствуют накоплению (прото)хлорфилл(ида) и свя!
является еще одной гранью тонкой настройки
зывающих их белков. Это достигается преимуще!
работы phyA. При этом фосфорилирование phyA
ственно за счет действия phyA, который отвечает
играет важную роль как механизм его дифферен!
за регуляцию более чем тысячи генов раннего от!
циации на два нативных вида, phyA' and phyA'',
вета на освещение, включая гены, регулирующие
а также повышения световой лабильности и ин!
биосинтез Chl.
гибирования взаимодействия с партнерами. Все
Физико!химические механизмы превраще!
это приложимо и к теме регуляции фитохро!
ния Pchlidе → Chlide и Pr → Pfr становятся все
мом А биосинтеза Chl и развития фотосинтети!
более понятными, также как компоненты в ходе
ческого аппарата - процесса, всецело зависимо!
превращения Pchlide в Chl и трансдукции сигна!
го от взаимодействия световой и гормональной
ла от phyA. В то же время вся сеть фоторецепто!
сигнальных систем. Обнадеживающим знаком в
ров, воспринимающих и передающих внешние
разрешении этой сложной ситуации является
сигналы и взаимодействующих с внутренними
открытие у растений существования централь!
регуляторными системами (в частности, с гор!
ного регулировочного узла: взаимодействующих
монами), обнаруживает крайне сложный харак!
с фитохромом белков!партнеров (PIFs), функ!
тер своей организации. Динамика, глубина и
ционально тесно связанных с семейством гормо!
тип действия (VLFR, LFR и HIR) и даже знак
нальных и других транскрипционных факторов
фотоответов с участием phyA сильно зависят от
(EIN3/EIL1 и др.). В дальнейшем это обещает
видовой/органной/тканевой специфики сигна!
структурирование наших знаний о световых,
ла, а также его связи со стадией развития расте!
гормональных и других регуляторных факторах
ния. Другими словами, они сильно зависят от
и процессах вокруг таких интеграционных точек.
физиологического состояния конкретного ис!
следуемого растения, включая его генетический
фон. Специфичность и сложность действия
Благодарности. Авторы благодарны своему
phyA связаны с тем фактом, что он является ос!
учителю - профессору Ф.Ф. Литвину за его
новным фоторецептором у высших растений,
постоянный интерес к их исследованиям и под!
опосредующим сигналы как красного, так и
держку, а также профессорам P. Galland, T. Lam!
дальнего красного света, что является жизненно
parter и М. Terry за критический анализ работы и
важным для выживания растения особенно в ус!
ценные советы.
ловиях глубокого затенения под плотным лес!
Конфликт интересов. Авторы заявляют об от!
ным пологом. Этот фоторецептор обладает так!
сутствии конфликта интересов.
же исключительно высокой чувствительностью к
Соблюдение этических норм. Настоящая
восприятию света, что необходимо для индукции
статья не содержит описания каких!либо иссле!
прорастания семян и фотоморфогенеза. По ходу
дований с участием людей и использованием
развития растения эта экстремальная чувстви!
животных в качестве объектов.
БИОХИМИЯ том 84 вып. 5 2019
ФИТОХРОМ А В БИОГЕНЕЗЕ ХЛОРОФИЛЛА
663
СПИСОК ЛИТЕРАТУРЫ
1.
Armstrong, G.A., Apel, K., and Rudiger, W. (2000) Does a
plants and algae, Biochim. Biophys. Acta, 1847, 968-985,
light!harvesting protochlorophyllide a/b!binding protein
doi: 10.1016/j.bbabio.2015.05.007.
complex exist? Trends Plant Sci., 5, 40-44, doi: 10.1016/
18.
Kobayashi, K., and Masuda, T. (2016) Transcriptional regu!
S1360!1385(99)01513!7.
lation of tetrapyrrole biosynthesis in Arabidopsis thaliana,
2.
Mathews, S. (2010) Evolutionary studies illuminate the
Front. Plant Sci., 7, 1811-1828, doi: 10.3389/fpls.2016.
structural!functional model of plant phytochromes, Plant
01811.
Cell, 22, 4-16, doi: 10.1105/tpc.109.072280.
19.
Kreslavski, V.D., Los, D.A., Schmitt, F.J., Zharmu!
3.
Casal, J.J., Candia, A.N., and Sellaro, R. (2013) Light per!
khamedov, S.K., Kuznetsov, V.V., and Allakhverdiev, S.I.
ception and signalling by phytochrome A, J. Exp. Bot., 65,
(2018) The impact of the phytochromes on photosynthetic
2835-2845, doi: 10.1093/jxb/ert379.
processes, Biochim. Biophys. Acta, 1859, 400-408, doi: 10.
4.
Van Tuinen, A., Kerckhoffs, L.H.J., Nagatani, A.R.,
1016/j.bbabio.2018.03.003.
Kendrick, E., and Koornneef, M. (1995) Far!red light!
20.
Mochizuki, N., Tanaka, R., Grimm, B., Masuda, T.,
insensitive, phytochrome A!deficient mutants of tomato,
Moulin, M., Smith, A.G., Tanaka, A., and Terry, M.J.
Mol. Gen. Genet., 246, 133-141, doi: 10.1007/BF0029!
(2010) The cell biology of tetrapyrroles: a life and death
4675.
struggle, Trends Plant Sci., 15, 488-498, doi: 10.1016/
5.
Barnes, S.A., Nishizawa, N.K., Quaggio, R.B., White!
j.tplants.2010.05.012.
lam, G.C., and Chua, N.H. (1996) Far!red light blocks
21.
Литвин Ф.Ф., Стадничук И.Н. (1980) Длинноволно!
greening of Arabidopsis seedlings via a phytochrome A!me!
вые предшественники хлорофилла в этиолированных
diated change in plastid development, Plant Cell, 8,
листьях и система нативных форм протохлорофилла,
601-615, doi: 10.1105/tpc.8.4.601.
Физиол. растений, 27, 1024-1031.
6.
McCormac, A.C., and Terry, M.J. (2002) Loss of nuclear
22.
Boddi, B., Ryberg, M., and Sundqvist, C.
(1992)
gene expression during the phytochrome A!mediated far!
Identification of four universal protochlorophyllide forms
red block of greening response, Plant Physiol., 130,
in dark!grown leaves by analyses of the 77 K fluorescence
402-414, doi: 10.1104/pp.003806.
emission spectra, J. Photochem. Photobiol., 12, 389-401,
7.
Meyer, G., Bliedung, H., and Kloppstech, K. (1983)
doi: 10.1016/1011!1344(92)85043!T.
NADPH!protochlorophyllide oxidoreductase: reciprocal
23.
Stadnichuk, I.N., Amirjani, M.R., and Sundqvist, C.
regulation in mono!and dicotyledonean plants, Plant Cell
(2005) Identification of spectral forms of protochlorophyl!
Rep., 2, 26-29, doi: 10.1007/BF00269229.
lide in the region 670-730 nm, Photochem. Photobiol. Sci.,
8.
Sineshchekov, V., Belyaeva, O., and Sudnitsin, A. (2004)
4, 230-238, doi: 10.1039/B403170A.
Phytochrome A positively regulates biosynthesis of the
24.
Вальтер Г., Беляева О.Б., Игнатов Н.В., Красновский А.А.,
active protochlorophyllide in dicots under far!red light,
Литвин Ф.Ф. (1982) Способность к фотопревращению
J. Photochem. Photobiol. B: Biol., 74, 47-54, doi: 10.1016/
различных форм протохлорофилла (ида) в Phaseolus
j.jphotobiol.2004.02.001.
coccineus, Биологический науки, 9, 35-39.
9.
Takano, M., Inagaki, N., Xie, X., Yuzurihara, N., Hihara, F.,
25.
Franck, F., and Strzalka, K. (1992) Detection of the pho!
Ishizuka, T., and Shinomura, T. (2005) Distinct and coope!
toactive protochlorophyllide-protein complex in the light
rative functions of phytochromes A, B, and C in the con!
during the greening of barley, FEBS Lett., 309, 73-77,
trol of deetiolation and flowering in rice, Plant Cell, 17,
doi: 10.1016/0014!5793(92)80742!Y.
3311-3325, doi: 10.1105/tpc.105.035899.
26.
Seyyedi, M., Timko, M.P., and Sundqvist, C. (1999)
10.
Sineshchekov, V.A., Loskovich, A.V., Riemann, M., and
Protochlorophyllide, NADPH!protochlorophyllide oxi!
Nick, P. (2004) The jasmonate!free rice mutant hebiba is
doreductase, and chlorophyll formation in the lip1 mutant
affected in the response of phyA’/phyA’’ pools and pro!
of pea, Plant Cell Physiol., 106, 344-354, doi: 10.1034/
tochlorophyllide biosynthesis to far!red light, Photochem.
j.1399!3054.1999.106313.x.
Photobiol. Sci., 3, 1058-1062, doi: 10.1039/B406795A.
27.
Amirjani, M.R., Sundqvist, K., and Sundqvist, C. (2006)
11.
Sineshchekov, V. (2019) Two molecular species of phy!
Protochlorophyllide and POR development in dark!grown
tochrome A with distinct modes of action, Funct. Plant
plants with different proportions of short!wavelength and
Biol., 46, 118-135, doi: 10.1071/FP18156.
long!wavelength protochlorophyllide spectral forms,
12.
Sineshchekov, V.A., Koppel, L.A., and Bolle, C. (2018)
Physiol. Plant, 128, 751-762, doi: 10.1111/j.1399!3054.
Two native types of phytochrome A, phyA' and phyA'', dif!
2006.00789.x.
fer by the state of phosphorylation at the N!terminus as
28.
Sundqvist, C., and Dahlin, C. (1997) With chlorophyll pig!
revealed by fluorescence investigations of the Ser/Ala
ments from prolamellar bodies to light!harvesting comp!
mutant of rice phyA expressed in transgenic Arabidopsis,
lexes, Physiol. Plant., 1000, 748-759, doi: 10.1111/j.1399!
Funct. Plant Biol., 45, 150-159, doi: 10.1071/FP16261.
3054.1997.tb00002.x.
13.
Terry, M.J., and Smith, A.G. (2013) A model for tetrapyr!
29.
Schoefs, B., and Franck F. (2008) The photoenzymatic
role synthesis as the primary mechanism for plastid!to!
cycle of NADPH: protochlorophyllide oxidoreductase in
nucleus signaling during chloroplast biogenesis, Front.
primary bean leaves (Phaseolus vulgaris) during the first
Plant Sci., 4, 1-14, doi: 10.3389/fpls.2013.00014.
days of photoperiodic growth, Photosynth. Res., 96, 15-26,
14.
Jarvis, P., and Lopez!Juez, E. (2013) Biogenesis and
doi: 10.1007/s11120!007!9274!x.
homeostasis of chloroplasts and other plastids, Nat. Rev.
30.
Sundqvist, C., Ryberg, H., Boddi, B., and Lang, F. (1980)
Mol. Cell Biol., 14, 787-802, doi: 10.1038/nrm3702.
Spectral properties of a long!wavelength absorbing form of
15.
Hsieh, H.L., and Okamoto, H. (2014) Molecular interac!
protochlorophyll in seeds of Cyclanthera explodens,
tion of jasmonate and phytochrome A signaling, J. Exp.
Physiol. Plant, 48, 297-301, doi: 10.1111/j.1399!3054.
Bot., 65, 2847-2857, doi: 10.1093/jxb/eru230.
1980.tb03258.x.
16.
Leivar, P., and Quail, P.H. (2011) PIFs: pivotal compo!
31.
Ignatov, N.V., and Litvin, F.F. (1996) Photoconvertion
nents in a cellular signaling hub, Trends Plant Sci., 16,
of longer!wavelength protochlorophyll native form
19-28, doi: 10.1016/j.tplants.2010.08.003.
Pchlide 682/672 into chlorophyll Chl715/696 in Chlorella
17.
Brzezowski, P., Richter, A.S., and Grimm, B.
(2015)
vulgaris B!15, Photosynthesis Res., 50, 271-283, doi: 10.1007/
Regulation and function of tetrapyrrole biosynthesis in
BF00033125.
БИОХИМИЯ том 84 вып. 5 2019
664
СИНЕЩЕКОВ, БЕЛЯЕВА
32.
Ignatov, N.V., and Litvin, F.F. (2002) A new pathway of
profiling of the tetrapyrrole metabolic pathway in
chlorophyll biosynthesis from long!wavelength pro!
Arabidopsis with a mini!array system, Plant Physiol., 135,
tochlorophyllide Pchlide 686/676 in juvenile etiolated
2379-2391, doi: 10.1104/pp.104.042408
plants, Photosynth. Res., 71, 195-207, doi: 10.1023/A:
48.
Huq, E., Al!Sady, B., Hudson, M., Kim, C., Apel, K., and
1015595426181.
Quail, P.H. (2004) Phytochrome!interacting factor 1 is a
33.
Беляева О.Б. (2009) Светозависимый биосинтез хлоро+
critical bHLH regulator of chlorophyll biosynthesis,
филла, БИНОМ, Лаборатория знаний, Москва.
Science, 305, 1937-1941, doi: 10.1126/science.1099728.
34.
Artus, N.N., Ryberg, M., Lindsten, A., Ryberg, H., and
49.
Zhu, X., Chen, J., Xie, Z., Gao, J., Ren, G., Gao, S.,
Sundqvist, C. (1992) The Sibata shift and the transforma!
Zhou, X., and Kuai, B. (2015) Jasmonic acid promotes
tion of etioplasts to chloroplasts in wheat with clomazone
degreening via MYC 2/3/4!and ANAC 019/055/072!
(FMC 57020) and amiprofos!methyl (Tokunol M), Plant
mediated regulation of major chlorophyll catabolic genes,
Physiol., 98, 253-263, doi: 10.1104/pp.98.1.253.
Plant J., 84, 597-610, doi: 10.1111/tpj.13030.
35.
Kowalewska, L., Mazur, R., Suski, S., Garstka, M., and
50.
Gendron, J.M., Pruneda!Paz, J.L., Doherty, C.J., Gross, A.M.,
Mostowska, A. (2016) Three!dimensional visualization of
Kang, S.E., and Kay, S.A. (2012) Arabidopsis circadian
the tubular-lamellar transformation of the internal plastid
clock protein, TOC1, is a DNA!binding transcription fac!
membrane network during runner bean chloroplast bio!
tor, Proc. Natl. Acad. Sci. USA, 109, 3167-3172, doi: 10.
genesis, Plant Cell, 28, 875-891, doi: 10.1105/tpc.15.
1073/pnas.1200355109.
01053.
51.
Cheminant, S., Wild, M., Bouvier, F., Pelletier, S., Re!
36.
Беляева О.Б., Карнеева Н.В., Стадничук И.Н., Лит!
nou, J.P., Erhardt, M., Hayes, S., Terry, M.J., Genschik, P.,
вин Ф.Ф. (1975) Динамика биосинтеза нативных
and Achard, P. (2011) DELLAs regulate chlorophyll and
форм хлорофилла от начальных стадий до завершения
carotenoid biosynthesis to prevent photooxidative damage
процесса зеленения этиолированных листьев, Биохи+
during seedling deetiolation in Arabidopsis, Plant Cell, 23,
мия, 40, 951-961.
1849-1860, doi: 10.1105/tpc.111.085233.
37.
Litvin, F.F., and Sineshchekov, V.A. (1975) In Energetics of
52.
Xu, X., Paik, I., Zhu, L., and Huq, E. (2015) Illuminating
Photosynthesis (Govindjee ed.), Academic Press, New York,
progress in phytochrome!mediated light signaling path!
San Francisco, London, pp. 619-661.
ways, Trends Plant Sci., 20, 641-650, doi: 10.1016/j.
38.
Литвин Ф.Ф., Синещеков В.А. и Шубин В.В. (1976)
tplants.2015.06.010.
Исследование миграции энергии между нативными
53.
Rockwell, N.C., Su, Y.S., and Lagarias, J.C.
(2006)
формами хлорофилла при -196 °С методом сенсиби!
Phytochrome structure and signaling mechanisms, Annu.
лизированной флуоресценции, Биофизика, 21, 669-675.
Rev. Plant Biol., 57, 837-858, doi: 10.1146/annurev.
39.
Griffiths, W.T. (1978) Reconstitution of chlorophyllide for!
arplant.56.032604.144208.
mation by isolated etioplast membranes, Biochem. J., 174,
54.
Cherry, J.R., Hondred, D., Walker, J.M., and Vierstra, R.D.
681-692, doi: 10.1042/bj1740681.
(1992) Phytochrome requires the 6!kDa N!terminal
40.
Wilks, H.M., and Timko, M.P. (1995) A light!dependent
domain for full biological activity, Proc. Natl. Acad. Sci.
complementation system for analysis of NADPH: pro!
USA, 89, 5039-5043, doi: 10.1073/pnas.89.11.5039.
tochlorophyllide oxidoreductase: identification and muta!
55.
Han, Y.J., Kim, H.S., Kim, Y.M., Shin, A.Y., Lee, S.S.,
genesis of two conserved residues that are essential for
Bhoo, S.H., Song, P.S., and Kim, J.I. (2010) Functional
enzyme activity, Proc. Natl. Acad. Sci. USA, 92, 724-728,
characterization of phytochrome autophosphorylation in
doi: 10.1073/pnas.92.3.724.
plant light signaling, Plant Cell Physiol., 51, 596-609,
41.
Meskauskiene, R., Nater, M., Goslings, D., Kessler, F., op
doi: 10.1093/pcp/pcq025.
den Camp, R., and Apel, K. (2001) FLU: a negative regu!
56.
Sineshchekov, V.A. (2010) Fluorescence and photochemi!
lator of chlorophyll biosynthesis in Arabidopsis thaliana,
cal investigations of phytochrome in higher plants, J. Botany,
Proc. Natl. Acad. Sci. USA, 98, 12826-12831, doi: 10.1073/
1-15, doi: 10.1155/2010/358372.
pnas.221252798.
57.
Sineshchekov, V.A. (1995) Photobiophysics and photobio!
42.
McCormac, A.C., and Terry, M.J. (2004) The nuclear
chemistry of the heterogeneous phytochrome system,
genes Lhcb and HEMA1 are differentially sensitive to plas!
Biochim. Biophys. Acta, 1228, 125-164, doi: 10.1016/
tid signals and suggest distinct roles for the GUN1 and
0005!2728(94)00173!3.
GUN5 plastid!signalling pathways during de!etiolation,
58.
Gartner, W., and Braslavsky, S.E. (2004) In Photoreceptors
Plant J., 40, 672-685, doi: 10.1111/j.1365!313X.2004.
and light signaling (Comprehensive series in photochemical
02243.x.
and photobiological sciences), Vol. 3 (Batschauer, A. ed.),
43.
Martin, G., Leivar, P., Ludevid, D., Tepperman, J.M.,
RSC Publishing, pp. 136-180.
Quail, P.H., and Monte, E. (2016) Phytochrome and ret!
59.
Helizon, H., Rosler!Dalton, J., Gasch, P., von Horsten, S.,
rograde signalling pathways converge to antagonistically
Essen, L.!O., and Zeidler, M. (2018) Arabidopsis phy!
regulate a light!induced transcriptional network, Nat.
tochrome A nuclear translocation is mediated by a far red
Commun., 7, 11431, doi: 10.1038/ncomms11431.
elongated hypocotyl 1 - importin complex, Plant J., 96,
44.
Beck, C.F. (2005) Signaling pathways from the chloroplast
1255-1268, doi: 10.1111/tpj.14107.
to the nucleus, Planta, 222, 741-756, doi: 10.1007/
60.
Sheerin, D.J., Menon, C., zur Oven!Krockhaus, S.,
s00425!005!0021!2.
Enderle, B., Zhu, L., Johnen, P., Schleifenbaum, F.,
45.
Krasnovsky, A.A. (1994) Singlet molecular oxygen and pri!
Stierhof, Y.D., Huq, E., and Hiltbrunner, A. (2015) Light!
mary mechanisms of photo!oxidative damage of chloro!
activated phytochrome A and B interact with members of
plasts. Studies based on detection of oxygen and pigment
the SPA family to promote photomorphogenesis in
phosphorescence, Proc. Roy. Soc. Edinb. B Biol., 102,
Arabidopsis by reorganizing the COP1/SPA complex, Plant
219-235, doi: 10.1017/S0269727000014147.
Cell, 27, 189-201, doi: 10.1105/tpc.114.134775.
46.
Reinbothe, S., Reinbothe, C., Apel, K., and Lebedev, N.
61.
Yang, S.W., Jang, I.C., Henriques, R., and Chua, N.H.
(1996) Evolution of chlorophyll biosynthesis - the chal!
(2009) Far!red elongated hypocotyl1 and FHY1!like asso!
lenge to survive photooxidation, Cell, 86, 703-705, doi:
ciate with the Arabidopsis transcription factors LAF1 and
10.1016/S0092!8674(00)80144!0.
HFR1 to transmit phytochrome A signals for inhibition of
47.
Matsumoto, F., Obayashi, T., Sasaki!Sekimoto, Y., Ohta, H.,
hypocotyl elongation, Plant Cell, 21, 1341-1359, doi: 10.
Takamiya, K., and Masuda, T. (2004) Gene expression
1105/tpc.109.067215.
БИОХИМИЯ том 84 вып. 5 2019
ФИТОХРОМ А В БИОГЕНЕЗЕ ХЛОРОФИЛЛА
665
62.
Chen, F., Shi, X., Chen, L., Dai, M., Zhou, Z., Shen, Y.,
77.
Armstrong, G.A., Runge, S., Frick, G., Sperling, U., and
Li, J., Li, G., Wei, N., and Deng, X.W.
(2012)
Apel, K. (1995) Identification of NADPH: protochloro!
Phosphorylation of far!red elongated hypocotyl1 is a key
phyllide oxidoreductases A and B: a branched pathway for
mechanism defining signaling dynamics of phytochrome A
light!dependent chlorophyll biosynthesis in Arabidopsis
under red and far!red light in Arabidopsis, The Plant Cell,
thaliana, Plant Physiol., 108, 1505-1517, doi: 10.1104/pp.
24, 1907-1920, doi: 10.1105/tpc.112.097733.
108.4.1505.
63.
Castillon, A., Shen, H., and Huq, E. (2007) Phytochrome
78.
Oosawa, N., Masuda, T., Awai, K., Fusada, N., Shimada, H.,
interacting factors: central players in phytochrome!medi!
Ohta, H., and Takamiya, K. (2000) Identification and
ated light signaling networks, Trends Plants Sci., 12,
light!induced expression of a novel gene of NADPH!pro!
514-521, doi/: 10.1016/j.tplants.2007.10.001.
tochlorophyllide oxidoreductase isoform in Arabidopsis
64.
Fairchild, C.D., Schumaker, M.A., and Quail, P.H. (2000)
thaliana, FEBS Lett., 474, 133-136, doi: 10.1016/S0014!
HFR1 encodes an atypical bHLH protein that acts in phy!
5793(00)01568!4.
tochrome A signal transduction, Genes Dev.,
14,
79.
Su, Q., Frick, G., Armstrong, G., and Apel, K. (2001)
2377-2391, doi: 10.1101/gad.828000.
POR C of Arabidopsis thaliana: a third light! and NADPH!
65.
Rausenberger, J., Tscheuschler, A., Nordmeier, W., Wust, F.,
dependent protochlorophyllide oxidoreductase that is dif!
Timmer, J., Schafer, E., Fleck, C., and Hiltbrunner, A.
ferentially regulated by light, Plant Mol. Biol., 47,
(2011) Photoconversion and nuclear trafficking cycles
805-813, doi: 10.1023/A:1013699721301.
determine phytochrome A’s response profile to far!red
80.
Kasemir, H. (1979) Control of chloroplast formation by
light, Cell, 146, 813-825, doi: 10.1016/j.cell.2011.07.023.
light, Cell Biol. Int. Rep., 3, 197-214, doi: 10.1016/0309!
66.
Kneissl, J., Shinomura, T., Furuya, M., and Bolle, C.
1651(79)90033!X.
(2008) A rice phytochrome A in Arabidopsis: the role of the
81.
Kasemir, H., and Prehm, G. (1976) Control of chlorophyll
N!terminus under red and far!red ligh, Mol. Plant, 1,
synthesis by phytochrome: III. Does phytochrome regulate
84-102, doi: 10.1093/mp/ssm010.
the chlorophyllide esterification in mustard seedlings?
67.
Casal, J.J., Davis, S.J., Kirchenbauer, D., Viczian, A.,
Planta, 132, 291-295, doi: 10.1007/BF00399729.
Yanovsky, M.J., Clough, R.C., Kircher, S., Jordan!
82.
Jabben, M., and Mohr, H. (1975) Stimulation of the
Beebe, E.T., Schafer, E., Nagy, F., and Vierstra, R.D.
Shibata shift by photochrome in the cotyledons of the mus!
(2002) The serine!rich N!terminal domain of oat phyto!
tard seedling Sinapis alba L., Photochem. Photobiol., 22,
chrome a helps regulate light responses and subnuclear
55-58, doi: 10.1111/j.1751!1097.1975.tb06721.x.
localization of the photoreceptor, Plant Physiol., 129,
83.
Masoner, M., and Kasemir, H. (1975) Control of chloro!
1127-1137, doi: 10.1104/pp.010977.
phyll synthesis by phytochrome, Planta, 126, 111-117,
68.
Trupkin, A., Debrieux, D., Hiltbrunner, A., Fankhauser, C.,
doi: 10.1007/BF00380614.
and Casal, J.J. (2007) The serine!rich N!terminal region of
84.
Rajasekhar, V.K., Guha!Mukherjee, S., and Sopory, S.K.
Arabidopsis phytochrome A is required for protein stability,
(1983) Time dependence of phytochrome!mediated
Plant Mol. Biol., 63, 669-678, doi: 10.1007/s11103!006!
carotenoid and chlorophyll synthesis in Sorghum bicolor L.,
9115!x.
Ann. Bot. (London), 52, 159-163, doi: 10.1093/oxfordjour!
69.
Yanovsky, M.J., Whitelam, G.C., and Casal, J.J. (2000)
nals.aob.a086561.
Fhy3!1 retains inductive responses of phytochrome A,
85.
Wu, Z., Zhang, X., He, B., Diao, L., Sheng, S. , Wang, J.,
Plant Physiol., 123, 235-242, doi: 10.1104/pp.123.1.235.
Guo, X., Su, N., Wang, L., Jiang, L., Wang, C., Zhai, H.,
70.
Beale, S.I. (1990) Biosynthesis of the tetrapyrrole pigment
and Wan, J. (2007) A chlorophyll!deficient rice mutant
precursor, д!aminolevulinic acid, from glutamate, Plant
with impaired chlorophyllide esterification in chlorophyll
Physiol., 93, 1273-1279, doi: 10.1104/pp.93.4.1273.
biosynthesis, Plant Physiol., 145, 29-40, doi: 10.1104/pp.
71.
Ilag, L.L., Kumar, A.M., and Soll, D. (1994) Light regula!
107.100321.
tion of chlorophyll biosynthesis at the level of 5!aminole!
86.
Chory, J. (1993) Out of darkness: mutants reveal pathways
vulinate formation in Arabidopsis, Plant Cell, 6, 265-275,
controlling light!regulated development in plants, Trends
doi: 10.1105/tpc.6.2.265.
Genet., 9, 167-172, doi: 10.1016/0168!9525(93)90163!C.
72.
Masoner, M., Unser, G., and Mohr, H.
(1972)
87.
Lau, O.S., and Deng, X.W. (2010) Plant hormone signaling
Accumulation of protochlorophyll and chlorophyll a as
lightens up: integrators of light and hormones, Curr. Opin.
controlled by photomorphogenically effective light, Planta,
Plant Biol., 13, 571-577, doi: 10.1016/j.pbi.2010.07.001.
105, 267-272, doi: 10.1007/BF00385398.
88.
Sperling, U., Cleve, B., Frick, G., Apel, K., and
73.
McCormac, A.C., Fischer, A., Kumar, A.M., Soll, D., and
Armstrong, G.A. (1997) Overexpression of light!depen!
Terry, M.J. (2001) Regulation of HEMA1 expression by
dent PORA or PORB in plants depleted of endogenous
phytochrome and a plastid signal during de!etiolation in
POR by farred light enhances seedling survival in white
Arabidopsis thaliana, Plant J., 25, 549-561, doi: 10.1046/
light and protects against photooxidative damage, Plant J.,
j.1365!313x.2001.00986.x.
12, 649-658, doi: 10.1046/j.1365!313X.1997.00649.x.
74.
McCormac, A.C., and Terry, M.J. (2002) Light!signalling
89.
Frances, S., White, M.J., Edgerton, M.D., Jones, A.M.,
pathways leading to the coordinated expression of HEMA1
Elliott, R.C., and Thompson, W.F. (1992) Initial charac!
and Lhcb during chloroplast development in Arabidopsis
terization of a pea mutant with light!independent photo!
thaliana, Plant J., 32, 549-559, doi: 10.1046/j.1365!313X.
morphogenesis, Plant Cell, 4, 1519-1530, doi: 10.1105/
2002.01443.x.
tpc.4.12.1519.
75.
Tang, W., Wang, W., Chen, D., Ji, Q., Jing, Y., Wang, H.,
90.
Weller, J.L., Murfet I.C., and Reid, J.B. (1997) Pea
and Lin, R. (2012) Transposase!derived proteins FHY3/
mutants with reduced sensitivity to far!red light define an
FAR1 interact with phytochrome!interacting factor 1 to
important role for phytochrome A in day!length detection,
regulate chlorophyll biosynthesis by modulating HEMB1
Plant Physiol., 114, 1225-1236, doi: 10.1104/pp.114.4.
during deetiolation in Arabidopsis, Plant Cell,
24,
1225.
1984-2000, doi: 10.1105/tpc.112.097022.
91.
Martin, G.E.M., Timko, M.P., and Wilks, H.M. (1997)
76.
Forreiter, C., van Cleve, B., Schmidt, A., and Apel, K.
Purification and kinetic analysis of pea (Pisum sativum L.)
(1991) Evidence for a general light!dependent negative
NADPH: protochlorophyllide oxidoreductase expressed as
control of NADPH!protochlorophyllide oxidoreductase in
a fusion with maltose!binding protein in Escherichia coli,
angiosperms, Planta, 183, 126-132, doi: 10.1007/BF00197576.
Biochem. J., 325, 139-145, doi: 10.1042/bj3250139.
5 БИОХИМИЯ том 84 вып. 5 2019
666
СИНЕЩЕКОВ, БЕЛЯЕВА
92. Sineshchekov, V.A., Frances, S., and White, M.J. (1995)
107. He, Z.H., Li, J., Sundqvist, C., and Timko, M.P. (1994)
Fluorescence and photochemical characterization of phy!
Leaf developmental age controls expression of genes
tochrome in de!etiolated pea mutant lip, J. Photochem.
encoding enzymes of chlorophyll and heme biosynthesis in
Photobiol. B, 28, 47-51, doi: 10.1016/1011!1344(94)07093!4.
pea (Pisum sativum L.), Plant Physiol., 106, 537-546,
93. Oh, E., Yamaguchi, S., Kamiya, Y., Bae, G., Chung W.!I.,
doi: 10.1104/pp.106.2.537.
and Choi, G. (2006) Light activates the degradation of
108. Sineshchekov, V.A., Loskovich, A., Inagaki, N., and
PIL5 protein to promote seed germination through gib!
Takano, M. (2006) Two native pools of phytochrome a in
berellin in Arabidopsis, Plant J., 47, 124-139, doi: 10.
monocots: evidence from fluorescence investigations of
1111/j.1365!313X.2006.02773.x.
phytochrome mutants of rice, Photochem. Photobiol., 82,
94. Toledo!Ortiz, G., Huq, E., and Rodriguez!Concepcion, M.
1116 -1122, doi: 10.1562/2005!12!10!RA!749.
(2010) Direct regulation of phytoene synthase gene expres!
109. Schendel, R., Dornemann, D., Rudiger, W., and
sion and carotenoid biosynthesis by phytochrome!inter!
Sineshchekov, V. (1996) Comparative investigations of the
acting factors, Proc. Natl. Acad. Sci. USA,
107,
effect of 5!aminolevulinate feeding on phytochrome and
11626-11631, doi: 10.1073/pnas.0914428107.
protochlorophyll (ide) content in dark!grown seedlings of
95. DuBell, A.N., and Mullet, J.E. (1995) Differential tran!
barley, cucumber and cress, J. Photochem. Photobiol. B, 36,
scription of pea chloroplast genes during light!induced leaf
245-253, doi: 10.1016/S1011!1344(96)07390!3.
development (continuous far!red light activates chloroplast
110. Canton, F.R., and Quail, P.H. (1999) Both phyA and phyB
transcription), Plant Physiol., 109, 105-112, doi: 10.1104/
mediate light!imposed repression of PHYA gene expres!
pp.109.1.105.
sion in Arabidopsis, Plant Physiol., 121, 1207-1215, doi: 10.
96. Антипова Т.В., Гапеева Т.А. Волотовский И.Д. (2004)
1104/pp.121.4.1207.
Фоторегуляция накопления протохлорофиллидокси!
111.
Takano, M., Kanegae, H., Shinomura, T., Miyao, A.,
доредуктазы и большой субъединицы РБФК/О в клет!
Hirochika, H., and Furuya, M. (2001) Isolation and cha!
ках трансгенного табака, дефицитного по фитохрому А,
racterization of rice phytochrome A mutants, Plant Cell,
Физиология растений, 51, 170-174.
13, 521-534, doi: 10.1105/tpc.13.3.521.
97. Parks, B.M., and Quail, P.H. (1993) hy8, a new class of
112. Lucas, M., and Prat, S. (2014) PIFs get BRright: phy!
Arabidopsis long hypocotyl mutants deficient in functional
tochrome interacting factors as integrators of light and hor!
phytochrome A, Plant Cell, 5, 39-48, doi: 10.1105/tpc.
monal signals, New Phytol., 202, 1126-1141, doi: 10.1111/
5.1.39.
nph.12725.
98. Runge, S., Sperling, U., Frick, G., Apel, K., and
113. Jeong, J., Kim, K., Kim, M.E., Kim, H.G., Heo, G.S.,
Armstrong, G.A. (1996) Distinct roles for light!dependent
Park, O.K., Park, Y.I., Choi, G., and Oh, E. (2016)
NADPH: protochlorophyllide oxidoreductases (POR) A
Phytochrome and ethylene signaling integration in
and B during greening in higher plants, Plant J., 9,
Arabidopsis occurs via the transcriptional regulation of
513-523, doi: 10.1046/j.1365!313X.1996.09040513.x.
genes co!targeted by PIFs and EIN3, Front. Plant Sci., 7,
99. Frick, G., Apel, K., and Armstrong, G.A. (1995) in
1055, 1-14, doi: 10.3389/fpls.2016.01055.
Photosynthesis: from light to biosphere, Vol. 3 (Mathis, P. ed.),
114. Roy, A., Sahoo, D., and Tripathy, B.C. (2013) Involvement
Kluwer Academic Publishers, Dordrecht, The Nether!
of phytochrome A in suppression of photomorphogenesis
lands, pp. 893-898.
in rice seedling grown in red light, Plant Cell Environ., 36,
100. Lebedev, N., van Cleve, B., Armstrong, G., and Apel, K.
2120-2134, doi: 10.1111/pce.12099.
(1995) Chlorophyll synthesis in a deetiolated (det340)
115. Zhong, S., Zhao, M., Shi, T., Shi, H., An, F., Zhao, Q.,
mutant of Arabidopsis without NADPH!Protochloro!
and Guo, H. (2009) EIN3/EIL1 cooperate with PIF1 to
phyllide (PChlide) Oxidoreductase (POR) A and photoac!
prevent photo!oxidation and to promote greening of
tive PChlide!F655, Plant Cell, 7, 2081-2090, doi: 10.1105/
Arabidopsis seedlings, Proc. Natl. Acad. Sci. USA, 106,
tpc.7.12.2081.
21431-21436, doi: 10.1073/pnas.0907670106.
101. Sperling, U., Franck, F., van Cleve, B., Frick, G., Apel, K.,
116. Riemann, M., Muller, A., Korte, A., Furuya, M., Weiler, E.W.,
and Armstrong, G.A. (1998) Etioplast differentiation in
and Nick, P. (2003) Impaired induction of the jasmonate
Arabidopsis: both PORA and PORB restore the prolamellar
pathway in the rice mutant hebiba, Plant Physiol., 133,
body and photoactive protochlorophyllide-F655 to the
1820-1830, doi: 10.1104/pp.103.027490.
cop1 photomorphogenic mutant, Plant Cell, 10, 283-296,
117. Riemann, M., Bouyer, D., Hisada, A., Muller, A., Yatou, O.,
doi: 10.1105/tpc.10.2.283.
Weiler, E. W., Takano, M., Furuya, M., and Nick, P. (2009)
102. Page, M.T., McCormac, A.C., Smith, A.G., and Terry, M.J.
Phytochrome A requires jasmonate for photodestruction,
(2017) Singlet oxygen initiates a plastid signal controlling
Planta, 229, 1035-1045, doi: 10.1007/s00425!009!0891!9.
photosynthetic gene expression, New Phytol.,
213,
118. Robson, F., Okamoto, H., Patrick, E., Harris, S.R.,
1168-1180, doi: 10.1111/nph.14223.
Wasternack, C., Brearley, C., and Turner, J.G. (2010)
103. Litvin, F.F, and Belyaeva, O.B. (1971) Sequence of photo!
Jasmonate and phytochrome A signaling in Arabidopsis
chemical and dark reactions in the terminal stage of
wound and shade responses are integrated through JAZ1
chlorophyll biosynthesis, Photosynthetica, 5, 200-209.
stability, Plant Cell, 22, 1143-1160, doi: 10.1105/tpc.
104. Schulz, R., and Senger, H. (1993) In Pigment+protein com+
109.067728.
plexes in plastids: synthesis and assembly (Sundqvist, C., and
119. Ritsema, T., van Zanten, M., Leon!Reyes, A., Voesenek, L.A.,
Ryberg, M. eds), Academic Press, Inc., San Diego, Cali!
Millenaar, F.F., Pieterse, C.M., and Peeters, A.J.
(2010)
fornia, pp. 179-218.
Kinome profiling reveals an interaction between jasmo!
105. Kittsteiner, U., Paulsen, H., Schendel, R., and Rudiger, W.
nate, salicylate and light control of hyponastic petiole
(1990) Lack of light regulation of NADPH: protochloro!
growth in Arabidopsis thaliana, PLoS One, 5, e14255,
phyllide oxido!reductase mRNA in cress seedlings
(Lepidium sativum L.), Zeitschrift fur Naturforschung C, 45,
120. Kim, J.I., Shen, Y., Han, Y.J., Park, J.E., Kirchenbauer, D.,
1077-1079, doi: 10.1515/znc!1990!9!1024.
Soh, M.S., Nagy, F., Schafer, E., and Song, P.S. (2004)
106. Spano, A.J., He, Z., Michel, H., Hunt, D.F., and Timko, M.P.
Phytochrome phosphorylation modulates light signaling by
(1992) Molecular cloning, nuclear gene structure, and
influencing the protein-protein interaction, Plant Cell, 16,
developmental expression of NADPH: protochlorophyl!
2629-2640, doi: 10.1105/tpc.104.023879.
lide oxidoreductase in pea (Pisum sativum L.), Plant Mol.
121. Seo, M., Nambara, E., Choi, G., and Yamaguchi, S.
Biol., 18, 967-972, doi: 10.1007/BF00019210.
(2009) Interaction of light and hormone signals in germi!
БИОХИМИЯ том 84 вып. 5 2019
ФИТОХРОМ А В БИОГЕНЕЗЕ ХЛОРОФИЛЛА
667
nating seeds, Plant Mol. Biol., 69, 463, doi: 10.1007/
the state of phytochrome A and its two native pools in the
s11103!008!9429!y.
plant cell, Photochem. Photobiol., 89, 83-96, doi: 10.1111/
122. Luccioni, L.G., Oliverio, K.A., Yanovsky, M.J.,
j.1751!1097.2012.01226.x.
Boccalandro, H.E., and Casal, J.J. (2002) Brassinosteroid
124. Sineshchekov, V., Koppel, L., and Kim, J.!I. (2019) The
mutants uncover fine tuning of phytochrome signaling,
dephosphorylated S8A and S18A mutants of (oat) phy!
Plant Physiol., 128, 173-181, doi: 10.1104/pp.010668.
tochrome A comprise its two species, phyA' and phyA'',
123. Sineshchekov, V., Koppel, L., Shor, E., Kochetova, G.,
suggesting that autophosphorylation at these sites is not
Galland, P., and Zeidler, M. (2013) Protein phosphatase
involved in the phyA differentiation, Photochem. Photobiol.
activity and acidic/alkaline balance as factors regulating
Sci., doi: 10.1039/C8PP00574E.
REGULATION OF THE CHLOROPHYLL BIOGENESIS
BY PHYTOCHROME A
V. A. Sineshchekov* and O. B. Belyaeva*
Lomonosov Moscow State University, Faculty of Biology, 119234 Moscow, Russia;
E+mail: vsineshchekov@gmail.com; belyaeva0104@gmail.com
Received December 6, 2018
Revised January 29, 2019
Accepted January 29, 2019
Dedicated to Professor F. F. Litvin in connection with his 90th birthday
The photosynthetic apparatus accomplishes two major functions in plants - solar energy conversion and plant pro!
tection from photodestruction. Its formation includes coordinated biosynthesis of chlorophyll (Chl) and matrix pro!
teins binding Chl. Light plays here the central role driving both metabolic and regulatory processes. The regulation is
achieved via operation of the sophisticated photoreceptor machinery with the phytochrome system as its main com!
ponent. The review concentrates on Chl biosynthesis and the regulation of this process by phytochrome A (phyA).
The main dark and light stages of the biosynthesis of Chl native forms are considered. The mechanism of phyA action
with emphasis on the existence of its two native types with different modes of action is described. The specificity of
the regulatory effect of phyA on biosynthesis of chlorophyll precursor, protochlorophyllide, depending on plant tis!
sue/organ, plant species, genetic modifications and hormonal status is discussed.
Keywords: biosynthesis, chlorophyll(ide), protochlorophyll(ide), regulation, photomorphogenesis, phytochrome A,
phytohormones
БИОХИМИЯ том 84 вып. 5 2019
5*