БИОХИМИЯ, 2019, том 84, вып. 5, с. 668 - 681
УДК 579.22
ПОЛИСАХАРИД ГАЛАКТАН ПОДАВЛЯЕТ ОБРАЗОВАНИЕ
БИОПЛЕНОК Pseudomonas aeruginosa, НО ЗАЩИЩАЕТ
СФОРМИРОВАННЫЕ БИОПЛЕНКИ ОТ ДЕЙСТВИЯ
АНТИБИОТИКОВ*,**
© 2019 А.В. Гришин1,2***, А.С. Карягина1,2,3***
1 Национальный исследовательский центр эпидемиологии и микробиологии
им. Н.Ф. Гамалеи Минздрава России, 123098 Москва, Россия;
электронная почта: grishin(a1@yandex.ru, akaryagina@gmail.com
2 Всероссийский научно(исследовательский институт сельскохозяйственной
биотехнологии, 127550 Москва, Россия
3 НИИ физико(химической биологии им. А.Н. Белозерского,
Московский государственный университет им. М.В. Ломоносова,
119991 Москва, Россия
Поступила в редакцию 09.10.2018
После доработки 21.01.2019
Принята к публикации 28.01.2019
Существуя в форме биопленок, микроорганизмы приобретают повышенную устойчивость к антибиотикам
и другим неблагоприятным воздействиям. В связи с этим формирование биопленок патогенными бактери#
ями представляет собой актуальную проблему здравоохранения. Одним из перспективных подходов для
борьбы с бактериальными биопленками является использование полисахаридов, подавляющих их образо#
вание. Ранее нами была продемонстрирована способность полисахарида картофеля галактана ингибировать
образование биопленок клиническим изолятом Pseudomonas aeruginosa. В данной работе более подробно ис#
следовано действие галактана картофеля на биопленки, образуемые P. aeruginosa. Микроскопический ана#
лиз указывает на то, что галактан не препятствует адгезии бактериальных клеток к субстрату, но предотвра#
щает дальнейшее накопление бактериальной биомассы. Кроме того, галактан способен не только ингиби#
ровать образование биопленок, но также может частично разрушать сформированные биопленки. Предпо#
ложительно, действие галактана обусловлено излишней агрегацией бактериальных клеток, препятствую#
щей формированию и поддержанию нормальной архитектуры биопленки, либо каким#то иным механиз#
мом ремодуляции структуры биопленок, что приводит к неожиданному эффекту: после применения к
сформированным биопленкам P. aeruginosa антибиотиков совместно с галактаном количество жизнеспо#
собных бактерий в биопленках оказывается выше по сравнению с применением только антибиотиков. Га#
лактан является первым полисахаридом, продемонстрировавшим подобный эффект в отношении бактери#
альных биопленок.
КЛЮЧЕВЫЕ СЛОВА: биопленки, галактан, Pseudomonas aeruginosa, полисахарид, антибиотики, устойчи#
вость.
DOI: 10.1134/S0320972519050051
Биопленки представляют собой сложные со#
диями: первичным прикреплением клеток мик#
общества микроорганизмов, погруженных в
роорганизмов к поверхности, их агрегацией и
синтезированный ими внеклеточный матрикс,
образованием микроколоний, ростом и созрева#
обычно прикрепленные к какой#либо поверх#
нием биопленки и, наконец, дисперсией био#
ности [1]. Процесс формирования биопленки,
пленки, способствующей дальнейшему распрост#
как правило, характеризуется несколькими ста#
ранению микроорганизмов [1]. Важной особен#
Принятые сокращения: МИК - минимальная ингибирующая концентрация; МБК - минимальная бактерицидная
концентрация; МКЭБ - минимальная концентрация эрадикации биопленки; CBD - Calgary biofilm device; РАО1 - Pseudo(
monas aeruginosa PAO1.
* Первоначально английский вариант рукописи опубликован на сайте «Biochemistry» (Moscow) http://protein.bio. msu.ru/
biokhimiya, в рубрике «Papers in Press», BM18#282, 25.03.2019.
** Приложение к статье на английском языке опубликовано на сайте журнала «Biochemistry» (Moscow) и на сайте издатель#
ства Springer (Link.springer.com), том 84, вып. 5, 2019.
*** Адресат для корреспонденции.
668
ГАЛАКТАН ПРОТИВ БИОПЛЕНОК P. aeruginosa
669
ностью биопленок является повышенная устой#
ти бактериальных клеток и/или субстрата за счет
чивость к воздействию антибиотиков, дезин#
взаимодействия с полисахаридами.
фектантов и факторов иммунной системы [2-5].
Наиболее вероятным способом применения
Формирование биопленок патогенными бакте#
соединений, воздействующих на бактериальные
риями в организме человека может приводить к
биопленки, является их использование в качест#
развитию хронических инфекций, таких как эн#
ве дополнения к традиционной антибиотикоте#
докардит, хронические раневые инфекции, хро#
рапии. Тем не менее только в одной работе опи#
нический отит, кариес и периодонтит, остеоми#
сывается совместное применение антибиотиков
елит, инфекции мочевыводящих путей, хрони#
и полисахарида, разрушающего биопленки. Эк#
ческая пневмония у больных муковисцидозом.
зополисахарид A101, выделенный из культуры
Кроме того, субстратом для образования био#
Vibrio spp. QY101, повышал эффективность дей#
пленок (т.е. поверхностью, на которой они фор#
ствия нескольких аминогликозидных антибио#
мируются) часто становятся различные имплан#
тиков в отношении биопленок P. aeruginosa в
таты и катетеры [2, 3, 6]. В связи с этим интен#
32 раза [8].
сивно развивается направление исследований,
Ранее нами было показано, что полисахарид
связанное с поиском соединений, способных
картофеля галактан подавляет образование био#
разрушать бактериальные биопленки или пре#
пленок клиническим изолятом P. aeruginosa 216
пятствовать их образованию.
при культивировании в течение 5 ч [22]. Целью
Одним из перспективных классов подобных
данной работы являлось более подробное иссле#
соединений являются полисахариды. В 2006 г.
дование влияния галактана картофеля на био#
было впервые показано, что некоторые капсуль#
пленки P. aeruginosa, в т.ч. совместного действия
ные полисахариды Escherichia coli способны по#
галактана и традиционных антибиотиков, приме#
давлять образование биопленок несколькими
няемых при инфекциях, вызванных P. aeruginosa.
видами патогенных бактерий [7]. После этого
подобные свойства были продемонстрированы
и для других полисахаридов, преимущественно
МЕТОДЫ ИССЛЕДОВАНИЯ
бактериального происхождения [8-21]. Способ#
ность подавлять образование биопленок была
Штаммы и среды. В работе использовали ла#
также обнаружена у растительных полисахари#
бораторный штамм P. aeruginosa PAO1 и клини#
дов галактана и галактоманнана [22] и полисаха#
ческий изолят P. aeruginosa 216, ранее выделен#
ридов, продуцируемых дрожжами [23] и диато#
ный от больного муковисцидозом сотрудниками
мовыми водорослями [24]. Полисахариды обла#
лаборатории проф. И.А. Шагиняна (НИЦЭМ
дают такими преимуществами, как потенциаль#
им. Н.Ф. Гамалеи). Штаммы хранили в 40%#ном
но низкая стоимость, биодеградируемость и био#
глицерине при -80 °C. Во время работы штаммы
совместимость [25, 26], и дальнейшее исследо#
поддерживали пересевом на агаризованной
вание полисахаридов, оказывающих влияние на
(1,5% агара) питательной среде Difco Nutrient
образование или разрушение биопленок, явля#
Broth («Becton Dickinson», США). Для подсчета
ется важной задачей.
КОЕ и определения минимальной бактерицид#
Характер воздействия различных полисаха#
ной концентрации (МБК) использовали агари#
ридов на биопленки неодинаков. Некоторые из
зованную среду Difco Nutrient Broth с добавле#
них, такие как PAM галактан, выделенный из
нием 1% NaCl, для культивирования биопленок
культуры Kingella kingae, или полисахарид, про#
и других экспериментов - среду M63 (3 г/л KH2PO4,
дуцируемый Pseudoalteromonas haloplanktis, а так#
7 г/л K2HPO4 и 2 г/л (NH4)2SO4) с добавлением
же экзополисахарид EPS273 Pseudomonas stutzeri,
1 мМ MgSO4, 0,5% казаминовых кислот и 0,2%
способны частично или полностью разрушать
глюкозы [29], если не указано иначе.
сформированные бактериальные биопленки [12,
Культивирование, ингибирование и разруше7
14, 20]. Другие полисахариды подавляют образо#
ние биопленок. Полисахариды галактан карто#
вание новых биопленок, но не оказывают влия#
феля (P#GALPOT) и глюкан ячменя (P#BGBL)
ние на уже сформированные биопленки [7, 19, 21].
были приобретены в компании «Megazyme» (Ир#
По#видимому, механизм действия полисахари#
ландия). Полисахариды растворяли в стериль#
дов чаще всего связан с предотвращением пер#
ной воде в концентрации 10 мг/мл. Для этого к
воначальной адгезии бактериальных клеток к
навеске галактана добавляли часть объема воды
субстрату [10, 14, 19-21]. В ряде случаев полиса#
и непрерывно перемешивали суспензию при
хариды также препятствовали агрегации бакте#
температуре ~60 °C до полного растворения по#
риальных клеток друг с другом [7, 8, 27, 28]. Как
лисахарида. Аналогичным образом к навеске
правило, авторы объясняют это изменением
глюкана добавляли часть объема воды и доводи#
физико#химических характеристик поверхнос#
ли суспензию до кипения при непрерывном пе#
БИОХИМИЯ том 84 вып. 5 2019
670
ГРИШИН, КАРЯГИНА
ремешивании, после чего нагрев отключали и
измерения оптической плотности. Поглощение
продолжали перемешивать до полного раство#
измеряли при длине волны 550 нм на планшет#
рения полисахарида. После остывания растворы
ном ридере Multiscan FC («Thermo Fischer
доводили водой до финального объема и цент#
Scientific», США). Для экспериментов с разру#
рифугировали в течение 10 мин при 12 000 g для
шением сформированных биопленок биоплен#
того, чтобы осадить все нерастворившиеся при#
ки P. aeruginosa культивировали в 96#луночных
меси, после чего супернатант отбирали и инку#
планшетах в течение 24 ч и отмывали. В лунки
бировали в течение 2 ч при 80 °C. Стерильность
планшета, содержавшие биопленки, вносили по
растворов полисахаридов подтверждали высе#
90 мкл свежей среды M63 с добавлением маг#
вом на агаризованные среды Difco Nutrient
ния, казаминовых кислот и глюкозы, а также по
Broth («Becton Dickinson», США) и BHI («Sifin
10 мкл раствора полисахарида или воды (конт#
Diagnostics», Германия), а также инокуляцией в
роль). Лунки с контрольными 24#часовыми био#
жидкую тиогликолевую среду («HiMedia Labora#
пленками оставляли пустыми. Планшет запеча#
tories», Индия).
тывали парафильмом и инкубировали при 36 °C
В данной работе биопленки P. aeruginosa
в течение 24 ч, после чего биопленки отмывали,
культивировали либо на стенках лунок 96#лу#
окрашивали и измеряли оптическую плотность,
ночных планшетов, либо на полипропиленовых
как описано выше.
купонах. Для культивирования биопленок на
Для культивации биопленок P. aeruginosa на по#
стенках лунок 96#луночных планшетов P. aerugi(
липропиленовых купонах из листа полипропиле#
nosa PAO1 или изолят P. aeruginosa 216 выращи#
на толщиной 0,5 мм (Trans G03, «Carolex», Фран#
вали на агаризованной среде Difco Nutrient
ция) вырезали купоны размером ~10,0 × 6,5 мм,
Broth в течение 20-24 ч, культуру бактерий сус#
стерилизовали 70%#ным этанолом и высушива#
пендировали в жидкой среде M63 с добавлением
ли в стерильных условиях. Купоны помещали
магния, казаминовых кислот и глюкозы до оп#
вертикально в лунки 96#лучного планшета, со#
тической плотности, соответствующей стандар#
державшие 100 мкл суспензии бактерий в среде
ту 0,5 по МакФарланду, и разводили до итоговой
M63 с магнием, казаминовыми кислотами и
концентрации ~3-5 × 107 КОЕ/мл. Получившу#
глюкозой, с добавлением или без добавления га#
юся бактериальную суспензию вносили в лунки
лактана. Планшет запечатывали парафильмом и
96#лучного планшета (Costar 3599 tissue culture
инкубировали при 36 °C в течение 24 ч. После ин#
treated flat bottom plates, «Corning», США) в объ#
кубации купоны вынимали из планшета с помощью
еме 90 мкл, после чего в лунки добавляли по 10 мкл
пинцета, аккуратно промывали средой M63,
раствора полисахарида, моносахарида или воды
высушивали, окрашивали в течение 20-30 мин
(контроль). Планшет запечатывали парафиль#
0,1%#ным кристаллвиолетом, отмывали водой и
мом и инкубировали при 36 °C в течение 24 ч.
снова высушивали. Для экспериментов с разру#
После инкубации биопленки аккуратно отмы#
шением сформированных биопленок биоплен#
вали следующим образом. К содержимому лу#
ки культивировали на полипропиленовых купо#
нок планшета добавляли по 100 мкл среды M63,
нах в течение 24 ч, отмывали стерильной средой
содержимое лунок пипетировали и отбирали с
M63 и снова помещали в лунки 96#луночного
помощью многоканальной пипетки. Затем в лун#
планшета, содержавшие 100 мкл свежей среды
ки вносили по 200 мкл M63, и содержимое план#
с добавлением или без добавления галактана.
шета вытряхивали в автоклавируемый контей#
Планшет запечатывали парафильмом и инкуби#
нер. Последнюю процедуру повторяли 3 раза.
ровали в течение 24 ч, после чего купоны извле#
Остатки жидкости вытряхивали за счет отстуки#
кали, промывали и окрашивали. Поскольку био#
вания планшета о бумажную салфетку, и план#
пленка формируется на обеих сторонах поли#
шет оставляли сушиться в перевернутом поло#
пропиленовых купонов, перед фотографирова#
жении в течение суток. Для окрашивания био#
нием и микроскопией со стороны, обращенной
пленок лунки планшета заполняли 200 мкл
вниз при высушивании купона, биопленку сти#
0,1%#ного раствора кристаллвиолета, планшет
рали 70%#ным этанолом.
инкубировали в течение 20-30 мин, промывали
Подсчет количества жизнеспособных бакте#
водой и высушивали в перевернутом положе#
рий проводили в биопленках, культивирован#
нии. Для растворения связавшегося с биоплен#
ных на полипропиленовых купонах. Купоны с
ками красителя в лунки планшета вносили по
биопленками помещали в 1,5#мл микроцентри#
100 мкл 30%#ной уксусной кислоты, после чего
фужные пробирки, содержавшие ~500 мкл стек#
планшет инкубировали в течение 20-30 мин.
лянных шариков диаметром 0,6-0,8 мм и 400 мкл
Содержимое лунок перемешивали с помощью
среды M63 (в случае PAO1) или PBS (в случае
пипетирования, и по 90 мкл из каждой лунки
изолята 216), после чего подвергали интенсивно#
переносили в новый 96#луночный планшет для
му перемешиванию в течение 15 с (3500 об/мин,
БИОХИМИЯ том 84 вып. 5 2019
ГАЛАКТАН ПРОТИВ БИОПЛЕНОК P. aeruginosa
671
Microspin FV#2400; «Biosan», Латвия). Количест#
культивирования биопленок CBD помещали на
во жизнеспособных бактерий, снятых таким об#
планшет, содержавший по 150 мкл суспензии
разом с полипропиленовых купонов, определя#
бактерий в концентрации ~3-5 × 107 КОЕ/мл, и
ли путем высева на агаризованную питательную
инкубировали при 36 °C в течение 24 ч. После
среду и подсчета КОЕ. Необходимо отметить,
этого биопленки дважды промывали с помощью
что применение подобной процедуры к планк#
переноса CBD на новый планшет, содержавший
тонным клеткам приводило к снижению коли#
по 200 мкл стерильной среды M63, и инкубиро#
чества КОЕ на ~40-50% для PAO1 и ~10% для
вали с качанием (250 об/мин) в течение 1 мин.
изолята 216. Однако это снижение было сущест#
Затем CBD переносили на планшет, содержав#
венно меньшим, чем разница в количестве жиз#
ший по 200 мкл серийных двукратных разведе#
неспособных клеток между разными варианта#
ний антибиотиков в среде M63 с магнием, каза#
ми биопленок, в особенности после обработки
миновыми кислотами и глюкозой, а также с до#
антибиотиками.
бавлением или без добавления галактана, и ин#
Определение МИК, МБК и МКЭБ. Растворы
кубировали при 36 °C в течение 24 ч. После об#
цефтазидима и амикацина сульфата (ОАО «Син#
работки антибиотиками биопленки снова дваж#
тез», Россия) из сухих навесок, а также рабочие
ды промывали, CBD переносили на планшет,
растворы ципрофлоксацина («Elfa Laboratories»,
содержавший по 200 мкл среды Difco Nutrient
Индия) из стокового раствора (2 мг/мл) готови#
Broth, и инкубировали в течение 24 ч для того,
ли заново перед каждым экспериментом.
чтобы дать возможность возобновить бактери#
Бактерии выращивали на агаризованной
альный рост биопленкам, сохранившим жиз#
среде Difco Nutrient Broth в течение 20-24 ч,
неспособные бактерии. Возобновление роста
культуру бактерий суспендировали в жидкой
выявляли по наличию видимой мутности в лун#
среде M63 с добавлением магния, казаминовых
ках планшета, а также с помощью посева содер#
кислот и глюкозы до оптической плотности, со#
жимого лунок на агаризованную питательную
ответствующей стандарту 0,5 по МакФарланду,
среду. МКЭБ определяли как минимальную
и разводили до итоговой концентрации ~5 × 105
концентрацию антибиотика, после обработки
или ~5 × 107 КОЕ/мл (см. раздел «Результаты ис#
которой биопленка не может возобновить бак#
следования»). Получившуюся бактериальную сус#
териальный рост.
пензию вносили в лунки 96#лучного планшета в
Подсчет количества жизнеспособных бактерий
объеме 90 мкл, после чего в лунки добавляли по
в биопленках после обработки антибиотиками.
10 мкл серийных двукратных разведений анти#
Количество бактерий, сохраняющих жизнеспо#
биотиков в той же среде. Планшет запечатывали
собность после обработки антибиотиками, оп#
парафильмом и инкубировали при 36 °C в тече#
ределяли в биопленках, культивированных на
ние 24 ч. Минимальную ингибирующую концент#
полипропиленовых купонах. Биопленки куль#
рацию (МИК) определяли как наименьшую
тивировали на купонах в течение 24 ч, после че#
концентрацию антибиотика, приводящую к от#
го промывали и помещали в 1,5#мл микроцент#
сутствию видимой мутности в лунках планшета.
рифужные пробирки, содержавшие 700 мкл
После определения МИК на чашки Петри с ага#
раствора антибиотика в среде M63 с магнием,
ризованной питательной средой переносили по
казаминовыми кислотами и глюкозой, с добав#
3 мкл содержимого лунок планшета, чашки ин#
лением или без добавления галактана. Пробир#
кубировали при 36 °C в течение 24 ч. МБК опре#
ки инкубировали при 36 °C в течение 24 ч. Пос#
деляли как наименьшую концентрацию антибио#
ле этого количество жизнеспособных бактерий
тика, приводящую к отсутствию бактериального
в биопленках определяли по методике, описан#
роста на агаризованной питательной среде. Та#
ной выше. Поскольку для подсчета колоний на
кая методика определения МБК несколько от#
агаризованную среду переносили по 10 мкл сус#
личается от стандартной и основана на методи#
пензии бактерий, теоретический предел обнару#
ке, описанной T.#F. Mah [30].
жения соответствует ~100 КОЕ/мл или 40 КОЕ/ку#
Для определения минимальных концентра#
пон (1,6 log10 КОЕ/купон). Для того чтобы опре#
ций эрадикации биопленок (МКЭБ, MBEC,
делить, остаются ли в биопленке жизнеспособ#
Minimal Biofilm Eradicating Concentration) ис#
ные бактерии в количестве ниже предела обна#
пользовали Calgary Biofilm Device (CBD, MBEC
ружения, в пробирки, в которых проводили сня#
Biofilm Inoculator; «Innovotech», Канада). CBD
тие биопленок с купонов, добавляли по 400 мкл
представляет собой крышку для 96#луночного
среды Difco Nutrient Broth, пробирки инкубиро#
планшета, снабженную колышками, которые
вали при 36 °C в течение 24 ч. Бактериальный
погружаются в лунки планшета при закрытии
рост определяли по наличию мутности, а также
крышки. При использовании CBD биопленки
с помощью посева на агаризованную питатель#
образуются на поверхности колышков. Для
ную среду.
БИОХИМИЯ том 84 вып. 5 2019
672
ГРИШИН, КАРЯГИНА
Флуоресцентная микроскопия. Биопленки
данных к нормальному распределению оценива#
PAO1 культивировали на полипропиленовых ку#
ли тестом Шапиро-Уилка. Для определения ста#
понах и обрабатывали амикацином (256 мкг/мл)
тистической значимости различий между вари#
с добавлением или без добавления 1 мг/мл га#
антами использовали двусторонний t#критерий
лактана. После обработки биопленки промыва#
Стьюдента для неравных дисперсий либо двусто#
ли водой и окрашивали красителями FilmTracer
ронний критерий Манна-Уитни. Различия счи#
LIVE/DEAD Biofilm Viability Kit («Molecular
тали статистически значимыми при p < 0,05 с
Probes», США) в течение 15 мин в соответствии
учетом поправки Данна-Шидака на множест#
с рекомендациями производителя. Окрашенные
венные сравнения. В экспериментах с подсчетом
биопленки визуализировали с помощью флуо#
КОЕ все статистические параметры и критерии
ресцентного микроскопа EVOS FLoid Cell
вычисляли после логарифмического преобразо#
Imaging Station («Thermo Fischer Scientific»,
вания данных. На всех рисунках, кроме рис. 3,
США). Для повышения контрастности изобра#
представлены результаты одного эксперимента,
жения обрабатывали с использованием прог#
однако все эксперименты, за исключением раз#
раммы Fiji [31]. Сначала использовали функцию
рушения 48#часовых биопленок (рис. 1, в), были
«subtract background» с опцией «create back#
выполнены как минимум дважды. На рис. 3 для
ground» для подсчета средних значений интен#
увеличения количества повторностей и мощнос#
сивности фона для красного и зеленого каналов
ти статистического анализа совмещены результа#
по отдельности. Затем нормировали интенсив#
ты двух независимых экспериментов. Данные
ность красного и зеленого каналов всех изобра#
экспериментов представлены в Приложении.
жений таким образом, чтобы интенсивность
фона во всех случаях была одинаковой. После
этого использовали функцию «subtract back#
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
ground» для удаления фона и совмещали крас#
ный и зеленый каналы для получения итогового
Галактан картофеля ингибирует образование
изображения.
биопленок и частично разрушает сформированные
Статистический анализ. Статистический ана#
биопленки. Ранее нами было показано, что га#
лиз результатов проводили в программе Microsoft
лактан картофеля способен ингибировать на#
Excel с помощью дополнения Real Statistics
чальную стадию образования биопленок клини#
Resource Pack Excel add#on (Release 4.7, Charles
ческим изолятом P. aeruginosa 216 [22]. Для даль#
нейшего исследования галактана был выбран
Рис. 1. Влияние галактана на образование и разрушение биопленок P. aeruginosa PAO1 в 96#луночных планшетах. а - Об#
разование биопленок PAO1 в присутствии 1 мг/мл галактана картофеля (Галактан), 1 мг/мл глюкана ячменя (Глюкан) или
без полисахаридов (Контроль) в течение 24 ч; б - разрушение биопленок PAO1, предварительно культивированных в те#
чение 24 ч (24 ч), под воздействием 1 мг/мл галактана картофеля (Галактан), 1 мг/мл глюкана ячменя (Глюкан) или без по#
лисахарида (48 ч); в - разрушение биопленок PAO1, предварительно культивированных в течение 48 ч (48 ч), под воздей#
ствием 1 мг/мл галактана картофеля (Галактан), 1 мг/мл глюкана ячменя (Глюкан) или без полисахарида (72 ч); г - обра#
зование биопленок PAO1 в присутствии 1,0; 0,5 и 0,1 мг/мл галактана картофеля или без него (Контроль) в течение 24 ч.
Данные представлены в виде диаграммы типа «ящик с усами», где границы «ящика» обозначают 25#й и 75#й процентили,
линия в середине - медианное значение, «усы» - минимальное и максимальное значения. Статистическую значимость
отличий между группами определяли с помощью двустороннего критерия Стьюдента (t#тест) с неравными дисперсиями.
Значимыми считали различия при p < 0,05 с учетом поправки на множественные сравнения
БИОХИМИЯ том 84 вып. 5 2019
ГАЛАКТАН ПРОТИВ БИОПЛЕНОК P. aeruginosa
673
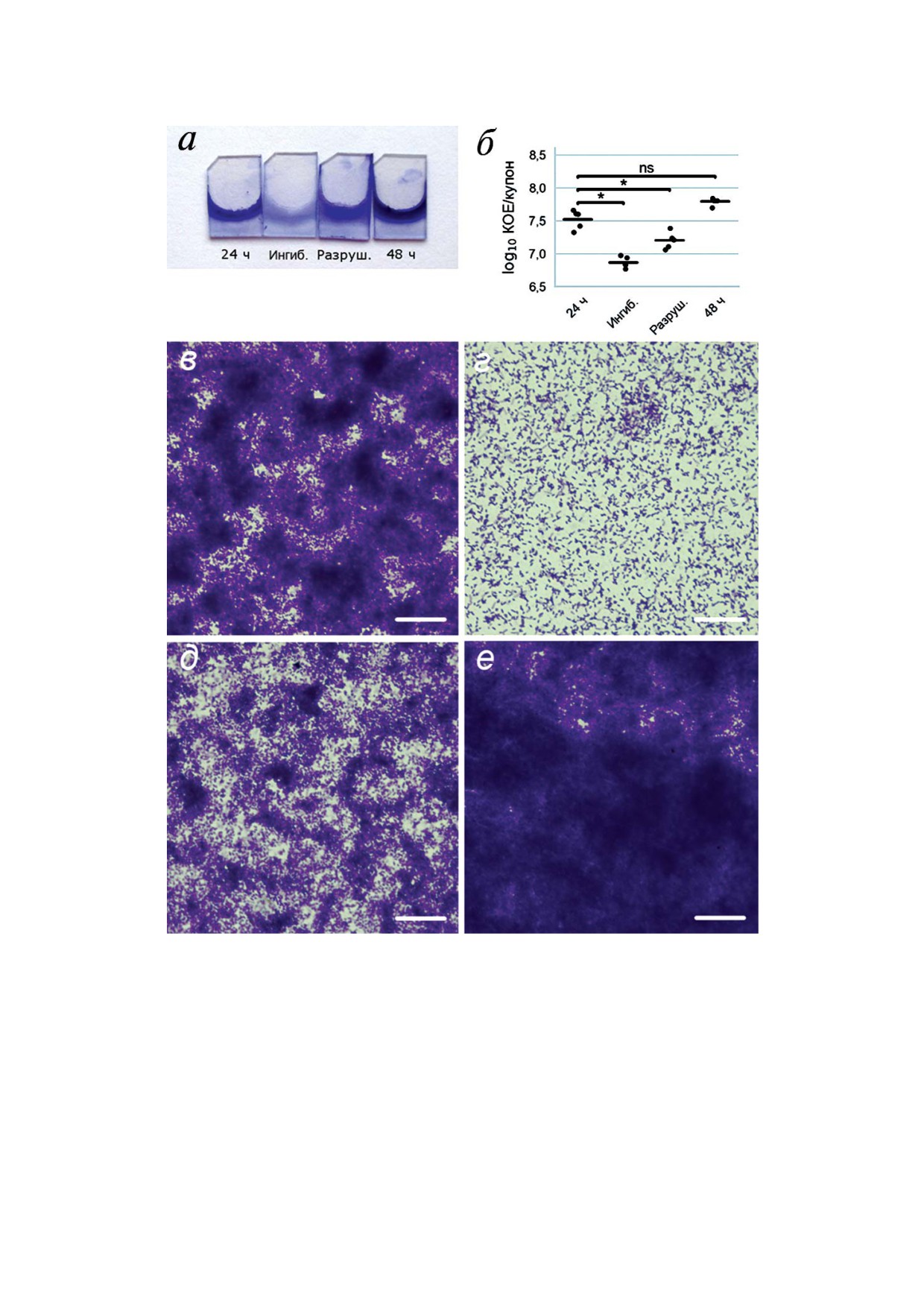
Рис. 2. Влияние галактана на образование и разрушение биопленок P. aeruginosa PAO1 на полипропиленовых купонах.
а - Фотографии полипропиленовых купонов с биопленками, окрашенными кристаллвиолетом: контрольной биопленкой,
культивированной в течение 24 ч (24 ч); биопленкой, культивированной в течение 24 ч в присутствии 1 мг/мл галактана
картофеля (Ингиб.); 24#часовой биопленкой, дополнительно обработанной в течение 24 ч 1 мг/мл галактана картофеля
(Разруш.); контрольной 48#часовой биопленкой (48 ч); б - количество жизнеспособных бактерий в биопленках, культи#
вированных на полипропиленовых купонах (обозначения как на фрагменте а). Данные представлены отдельными точка#
ми (n = 5), средние значения показаны горизонтальными линиями. Статистическую значимость отличий между группа#
ми определяли с помощью двустороннего критерия Стьюдента (t#тест) с неравными дисперсиями. Значимыми считали
различия при p < 0,05 с учетом поправки на множественные сравнения; в-е - микрофотографии биопленок, культивиро#
ванных на полипропиленовых купонах: в - контрольная 24#часовая биопленка; г - биопленка, культивированная в при#
сутствии 1 мг/мл галактана картофеля; д - 24#часовая биопленка, дополнительно обработанная 1 мг/мл галактана карто#
феля; е - контрольная 48#часовая биопленка. Длина масштабного отрезка - 25 мкм.
С цветным вариантом рис. 2 можно ознакомиться в электронной версии статьи на сайте: www.elibrary.ru
БИОХИМИЯ том 84 вып. 5 2019
674
ГРИШИН, КАРЯГИНА
лабораторный штамм P. aeruginosa PAO1, широко
галактана, слизистые агрегаты в планктонной
используемый при изучении биопленок P. aeru(
фракции были заметны невооруженным глазом.
ginosa.
Подобные агрегаты не были обнаружены в
Галактан картофеля в концентрации 1 мг/мл
контрольных лунках или лунках, содержащих
практически полностью подавлял образование
глюкан.
биопленок PAO1 при культивировании в тече#
При обработке галактаном картофеля в кон#
ние 24 ч: количество биомассы в биопленках,
центрации 1 мг/мл биопленок, предварительно
культивированных в присутствии галактана, бы#
культивированных в течение 24 ч, наблюдалось
ло в 3,5 раза меньше, чем в контроле (рис. 1, а).
их частичное разрушение: количество биомассы
Глюкан ячменя, взятый в качестве контрольного
в них снижалось почти на 40% (рис. 1, б). Конт#
полисахарида, не оказывал значимого влияния
рольный полисахарид глюкан ячменя не оказы#
на формирование биопленок (рис. 1, а). Было
вал влияния на сформированные биопленки PAO1
отмечено, что галактан вызывает сильную агре#
(рис. 1, б). Похожая картина наблюдалась при об#
гацию бактериальных клеток: при отмывании
работке галактаном биопленок, предварительно
биопленок, культивированных в присутствии
культивированных в течение 48 ч (рис. 1, в).
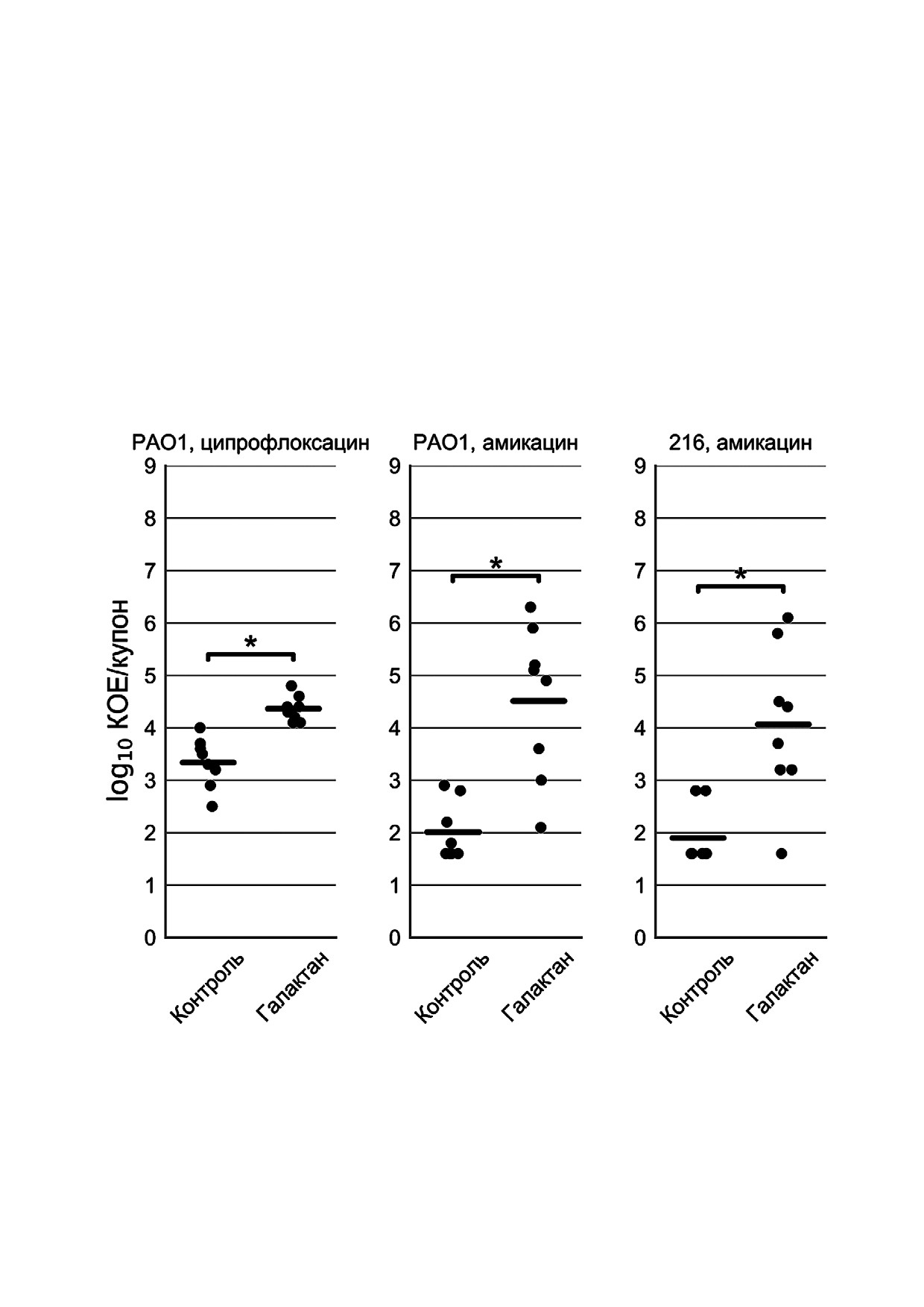
Рис. 3. Количество жизнеспособных бактерий в биопленках P. aeruginosa PAO1 и 216 после обработки антибиотиками
(Контроль) или антибиотиками совместно с галактаном картофеля (Галактан). Данные представлены отдельными точка#
ми (n = 8), средние значения показаны горизонтальными линиями. Значения ниже порога определения были приравне#
ны к 1,6 log10 КОЕ/купон, поскольку, несмотря на отсутствие колоний при высеве на агаризованную среду, при добавле#
нии жидкой питательной среды к разрушенным биопленкам они давали бактериальный рост. Статистическую значимость
отличий между группами определяли с помощью двустороннего критерия Манна-Уитни. Значимыми считали различия
при p < 0,05 с учетом поправки на множественные сравнения
БИОХИМИЯ том 84 вып. 5 2019
ГАЛАКТАН ПРОТИВ БИОПЛЕНОК P. aeruginosa
675
Для исследования влияния концентрации га#
вых купонах, хорошо соответствовало результа#
лактана картофеля на оказываемый им эффект,
там измерения количества биомассы в 96#лу#
биопленки PAO1 культивировали в присутствии
ночных планшетах. Биопленка, культивирован#
0,5 и 0,1 мг/мл галактана. Интересно, что, хотя
ная в присутствии галактана, содержала в ~4,5
концентрация 0,5 мг/мл оказывала действие, ана#
раза меньше жизнеспособных бактерий по срав#
логичное исходно взятой концентрации 1 мг/мл,
нению с контролем. Аналогичным образом био#
в 10 раз меньшая концентрация галактана 0,1 мг/мл
пленка, обработанная галактаном после предва#
не только не подавляла образование биопленок
рительного культивирования в течение 24 ч, со#
PAO1, но наоборот, приводила к статистически
держала в 2 раза меньшее количество жизнеспо#
значимому увеличению их биомассы (рис. 1, г).
собных бактерий, чем биопленка до обработки
В дальнейшем для всех опытов была использо#
(рис. 2, б).
вана концентрация 1 мг/мл.
Галактан картофеля защищает бактерии внут7
Полимерная структура галактана оказалась
ри биопленки от антибиотиков. Наиболее вероят#
необходимой для его активности, поскольку мо#
ный сценарий применения соединений, воздей#
номерная галактоза, взятая в той же концентра#
ствующих на бактериальные биопленки, пред#
ции, не оказывала никакого действия на форми#
полагает их использование в качестве дополне#
рование биопленок PAO1 (данные не приведены).
ния к стандартной антибактериальной терапии.
Далее влияние галактана картофеля на био#
Поэтому далее было изучено совместное действие
пленки P. aeruginosa было исследовано с по#
антибиотиков и галактана на биопленки P. aeru(
мощью микроскопии. Для этого биопленки
ginosa. В рамках данной работы было выбрано
культивировали на полипропиленовых купонах,
три антибиотика, относящихся к разным клас#
помещенных в лунки 96#луночных планшетов в
сам и используемых в клинической практике
вертикальной ориентации, высушивали и окра#
для лечения инфекций, вызванных P. aeruginosa:
шивали кристаллвиолетом. Характер воздей#
цефалоспориновый антибиотик цефтазидим,
ствия галактана на биопленки PAO1 на поли#
фторхинолон ципрофлоксацин и аминоглико#
пропиленовых купонах визуально соответствовал
зид амикацин.
результатам, полученным в 96#луночных план#
Определенные нами МИК и МБК этих анти#
шетах. В частности, рост биопленок в присут#
биотиков в отношении PAO1 представлены в таб#
ствии галактана был практически полностью
лице. Известно, что некоторые антибиотики могут
подавлен, а обработка галактаном сформиро#
проявлять так называемый «эффект инокулюма»,
ванных биопленок приводила к их частичному
заключающийся в том, что при более высокой
разрушению (рис. 2, а, б). При микроскопичес#
концентрации бактерий в исходной суспензии
ком анализе контрольная биопленка, культиви#
по сравнению со стандартной (5 × 105 КОЕ/мл)
рованная в течение 24 ч без галактана, представ#
МИК такого антибиотика существенно возрас#
ляла собой крупные плотные агрегаты бактери#
тает. Поскольку количество бактерий в биоплен#
альных клеток, перемежающиеся менее плот#
ке существенно выше, чем 5 × 105 КОЕ/мл
ными скоплениями или даже участками поли#
(рис. 2, б), наблюдаемая устойчивость биоплен#
пропилена, свободными от бактерий (рис. 2, в).
ки к антибиотику может быть связана именно с
Биопленка, культивированная в присутствии
«эффектом инокулюма», а не со специфически#
галактана, значительно отличалась от контроль#
ми механизмами устойчивости, присущими био#
ной и была представлена равномерно распреде#
пленкам. В связи с этим МИК всех антибиоти#
ленными по поверхности субстрата бактериаль#
ков были определены не только для стандартной
ными клетками, не образующими выраженных
концентрации бактерий, но также для концент#
скоплений (рис. 2, г). Биопленка, сформирован#
рации 5 × 107 КОЕ/мл (таблица). В случае цефта#
ная в отсутствии галактана, а затем обработан#
зидима наблюдался выраженный «эффект иноку#
ная галактаном, была схожа с контрольной, но
люма», т.е. МИК этого антибиотика при стандарт#
более «разрежена»: агрегаты бактерий были
ной исходной концентрации бактерий составля#
меньшего размера и занимали меньшую пло#
ла 2 мкг/мл, а при повышенной - более 16 мкг/мл.
щадь (рис. 2, д). Наконец, контрольная био#
В связи с этим цефтазидим был исключен из ис#
пленка, культивированная в течение 48 ч без га#
следования. Два других антибиотика не показали
лактана, представляла собой чрезвычайно плот#
выраженной зависимости МИК от исходной кон#
ный мат, состоящий из бактериальной биомас#
центрации бактерий. Необходимо отметить, что
сы, морфологические черты которой было труд#
МИК амикацина оказалась достаточно высокой -
но различить с помощью световой микроскопии
32 мкг/мл, что связано с использованием среды
(рис. 2, е).
M63, поскольку тестирование дисковым мето#
Количество жизнеспособных бактерий в био#
дом на стандартном агаре Мюллер-Хинтон вы#
пленках, культивированных на полипропилено#
явило чувствительность PAO1 к амикацину.
БИОХИМИЯ том 84 вып. 5 2019
676
ГРИШИН, КАРЯГИНА
Значения МИК, МБК и МКЭБ антибиотиков в отношении P. aeruginosa PAO1 и изолята P. aeruginosa 216
Исходная
МИК, мкг/мл
МБК, мкг/мл
МКЭБ, мкг/мл
Штамм
концентрация
бактерий,
ципрофлок#
амикацин
цефтазидим
ципрофлок#
амикацин
ципрофлок#
амикацин
КОЕ/мл
сацин
сацин
сацин
5
PAO1
5 × 10
0,125
32
2
0,25
64
-
-
7
5 × 10
0,125
64
>16
0,25
256
>32
256
5
216
5 × 10
-
32
-
-
64
-
–
5 × 107
-
64
-
-
256
-
512
Для определения МКЭБ биопленки вначале
кацином количество жизнеспособных бактерий
культивировали на колышках CBD, после чего
зачастую оказывалось ниже порога детекции
инкубировали в растворе антибиотиков. Затем
(~40 КОЕ/купон), то при добавлении галактана
биопленки помещали в свежую питательную
это количество возрастало вплоть до 2,0 × 106 КОЕ/
среду для возобновления роста бактерий, сохра#
купон при среднем значении 3,2 × 104 КОЕ/
нивших жизнеспособность после обработки ан#
купон.
тибиотиками. Минимальная концентрация ами#
Наблюдаемый эффект может быть объяснен
кацина, после обработки которой биопленка PAO1
двумя способами. С одной стороны, галактан
не способна возобновить рост, оказалась равной
может способствовать повышению устойчивос#
256 мкг/мл. МКЭБ ципрофлоксацина превыси#
ти бактерий к антибиотикам. С другой стороны,
ла максимальную из протестированных концент#
возможно, часть бактерий не погибает под воз#
раций - 32 мкг/мл, которая в 256 раз превыша#
действием антибиотика, а переходит в некульти#
ет МИК, и, таким образом, не была определена
вируемое состояние, и галактан препятствует та#
(таблица).
кому переходу, что приводит к кажущемуся уве#
Несмотря на то, что галактан картофеля час#
личению количества жизнеспособных бактерий
тично разрушал биопленку PAO1, добавление
при высеве на агаризованную питательную сре#
1 мг/мл галактана одновременно с антибиоти#
ду. Для того чтобы понять, какое из этих объяс#
ками не изменило МКЭБ ни одного из антибио#
нений более вероятно, биопленки PAO1, обра#
тиков.
ботанные амикацином или амикацином в соче#
Далее мы предположили, что, хотя добавле#
тании с галактаном, были исследованы с по#
ние галактана не влияет на МКЭБ антибиоти#
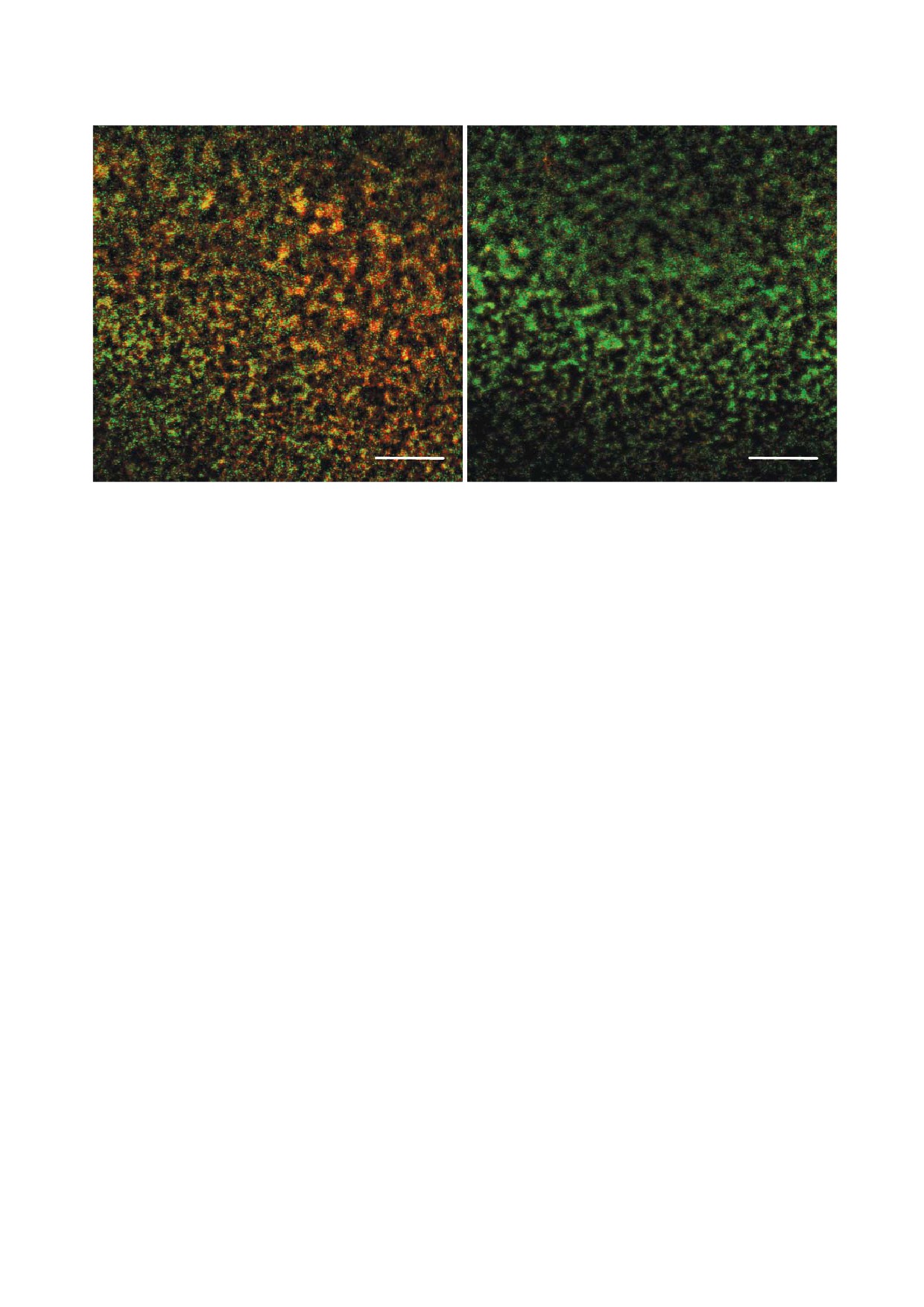
мощью флуоресцентной микроскопии (рис. 4).
ков, возможно, галактан позволяет снизить ко#
Для различения жизнеспособных и мертвых
личество жизнеспособных бактерий в биоплен#
бактерий биопленки окрашивали красителями
ке по сравнению с применением только анти#
LIVE/DEAD. При использовании этих красите#
биотиков. Чтобы проверить это предположение,
лей живые бактерии окрашиваются зеленым,
биопленки культивировали на полипропилено#
мертвые бактерии и внеклеточная ДНК - крас#
вых купонах, после чего инкубировали в раство#
ным. Как видно на рис. 4, после обработки ами#
ре ципрофлоксацина (1 мкг/мл) или амикацина
кацином в сочетании с галактаном картофеля в
(256 мкг/мл) с добавлением или без добавления
биопленке остается существенно больше жиз#
1 мг/мл галактана картофеля. Результаты опре#
неспособных клеток по сравнению с биоплен#
деления количества жизнеспособных бактерий
кой, обработанной только амикацином. Таким
в обработанных таким образом биопленках
образом, галактан, по#видимому, каким#то об#
представлены на рис. 3.
разом защищает биопленки PAO1 от действия
Вопреки ожиданиям, добавление галактана
антибиотиков. Интересно, что при инкубации
не только не уменьшило количество жизнеспо#
планктонных клеток с антибиотиками и галак#
собных бактерий в обработанных антибиотика#
таном в тех же концентрациях подобного за#
ми биопленках, но наоборот, значительно увели#
щитного эффекта не наблюдалось.
чило его. Так, количество жизнеспособных бак#
Далее мы решили проверить, оказывает ли
терий в биопленках, обработанных 1 мкг/мл ципро#
галактан подобное воздействие на другие штам#
флоксацина, в среднем составляло 2,2 × 103 КОЕ/ку#
мы P. aeruginosa, а именно на клинический изо#
пон, а в случае применения антибиотика в соче#
лят P. aeruginosa 216, использованный в преды#
тании с галактаном - 2,3 × 104 КОЕ/купон. Для
дущей работе [22]. Для тестирования совместно#
амикацина эта разница оказалась еще более за#
го действия с галактаном на изолят 216 был выб#
метной. Если после обработки биопленок ами#
ран амикацин, поскольку он проявлял наиболее
БИОХИМИЯ том 84 вып. 5 2019
ГАЛАКТАН ПРОТИВ БИОПЛЕНОК P. aeruginosa
677
а
б
Рис. 4. Биопленки P. aeruginosa PAO1, обработанные амикацином (а) или амикацином совместно с галактаном картофеля (б)
и окрашенные флуоресцентными красителями LIVE/DEAD. Длина масштабного отрезка - 100 мкм.
С цветным вариантом рис. 4 можно ознакомиться в электронной версии статьи на сайте: www.elibrary.ru
выраженный эффект в случае PAO1. МИК и МБК
танные 256 мкг/мл амикацина, способны возоб#
амикацина в отношении изолята 216 оказались
новить бактериальный рост в свежей питатель#
такими же, как и для PAO1, т.е. 32 и 64 мкг/мл при
ной среде после физического разрушения их
исходной концентрации бактерий 5 × 105 КОЕ/мл
структуры с помощью обработки стеклянными
и 64 и 256 мкг/мл при исходной концентрации
шариками. Иначе говоря, наблюдаемое значе#
бактерий 5 × 107 КОЕ/мл (таблица). Биопленки
ние МКЭБ амикацина не является в действи#
изолята 216 оказались чуть более устойчивыми к
тельности минимальной концентрацией, необ#
амикацину, значение МКЭБ составило 512 мкг/мл
ходимой для эрадикации биопленок. Эрадика#
(таблица). Как и в случае PAO1, галактан не пов#
ция биопленок в данном случае лишь видимая,
лиял на МКЭБ амикацина. Аналогичным обра#
обусловленная переходом оставшихся жизнеспо#
зом при обработке амикацином биопленок изо#
собных бактерий в некультивируемое состоя#
лята 216, культивированных на полипропилено#
ние. При этом не только физическое нарушение
вых купонах, добавление 1 мг/мл галактана при#
структуры биопленок, но также и их обработка
водило к существенному увеличению количест#
1 мг/мл галактана способствовала возобновле#
ва жизнеспособных клеток по сравнению с ис#
нию бактериального роста в условиях, в которых
пользованием только антибиотика (рис. 3).
клетки в неразрушенных биопленках оставались
Разрушение биопленок галактаном картофеля
в некультивируемом состоянии. Этот эффект не
способствует возобновлению бактериального рос7
мог сказаться на результатах подсчета количест#
та после обработки амикацином. Необходимо за#
ва жизнеспособных бактерий в обработанных
метить, что хотя биопленки PAO1, обработан#
амикацином биопленках, поскольку в этом слу#
ные амикацином в концентрации 256 мкг/мл
чае биопленки подвергаются физическому раз#
(МКЭБ), не могли возобновить свой рост после
рушению. Кроме того, результаты микроскопии
помещения в свежую питательную среду, флуо#
свидетельствуют в пользу того, что галактан
ресцентная микроскопия показала, что живые
картофеля действительно защищает бактерии в
бактерии в таких биопленках сохраняются. По#
составе биопленок от действия антибиотиков.
видимому, эти бактерии находятся в некульти#
Тем не менее тот факт, что обработанные амика#
вируемом состоянии, что и приводит к наблю#
цином биопленки одинаково возобновляют
даемому отсутствию бактериального роста пос#
рост как после физического разрушения, так и
ле обработки амикацином.
под действием галактана, еще раз демонстриру#
Оказалось, что биопленки, культивирован#
ет влияние галактана на структуру биопленок
ные на полипропиленовых купонах и обрабо# P. aeruginosa.
БИОХИМИЯ том 84 вып. 5 2019
678
ГРИШИН, КАРЯГИНА
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ствует формированию биопленок. Наличие же
функционального варианта bipA предотвращает
В данной работе было продемонстрировано,
чрезмерную агрегацию и позволяет B. holmesii
что галактан картофеля способен эффективно
образовывать нормальные биопленки [32]. Та#
подавлять образование биопленок P. aeruginosa
ким образом, хотя белок BipA, в отличие от га#
на различных поверхностях, а также частично
лактана, препятствует агрегации, а не вызывает
разрушать сформированные биопленки. Однако
ее, общий механизм ингибирования формиро#
при применении совместно с антибиотиками
вания биопленок за счет чрезмерной агрегации
галактан не повысил их эффективность. Напро#
бактериальных клеток может быть в этих двух
тив, количество жизнеспособных бактерий в био#
случаях схожим.
пленках, обработанных антибиотиками в соче#
Молекулярным рецептором галактана, воз#
тании с галактаном, было существенно выше по
можно, является лектин LecA. LecA представля#
сравнению с биопленками, обработанными
ет собой секретируемый лектин, связывающий
только антибиотиками.
мономерную галактозу, а также остатки галакто#
Галактан картофеля в концентрации 1 мг/мл
зы в составе олиго# и полисахаридов. Наряду с
эффективно препятствовал образованию био#
лектином LecB, связывающим маннозу и фу#
пленок P. aeruginosa на разных субстратах. Ранее
козу, LecA участвует в образовании биопленок
нами было показано, что галактан способен по#
P. aeruginosa, а также способствует адгезии к
давлять начальную стадию (5 ч) формирования
эпителиальным клеткам и, вероятно, является
биопленок клиническим изолятом P. aeruginosa
фактором вирулентности [33, 34]. Оба этих лек#
216. В данной работе продемонстрировано, что
тина являются мишенями для разработки сое#
эффект подавления образования биопленок
динений, подавляющих образование биопленок
воспроизводится также для лабораторного
[34, 35]. Ранее мы показали, что галактан спосо#
штамма P. aeruginosa PAO1 и при более длитель#
бен ингибировать гемагглютинацию, вызван#
ном времени культивирования (24 ч). Кроме то#
ную рекомбинантным LecA [22]. Интересно, что
го, галактан оказался способен частично разру#
один из описанных в литературе ингибиторов
шать сформированные биопленки P. aeruginosa.
LecA - галактозилированный гликокластер на
При этом галактан, по#видимому, не препят#
основе каликс[4]арена - вызывал агрегацию
ствует первоначальной адгезии бактерий, но
планктонных клеток при применении в опреде#
предотвращает образование микроколоний и
ленном диапазоне концентраций, причем этот
накопление биомассы (рис. 2). Мы предполага#
эффект не проявлялся в отношении штамма,
ем, что эффект ингибирования образования био#
мутантного по гену lecA [36]. Это соединение
пленок галактаном обусловлен тем, что галактан
также подавляло образование биопленок PAO1.
вызывает излишнюю либо неправильную агре#
Однако данный эффект, по всей видимости, не
гацию бактерий, препятствуя формированию
был связан с ингибированием LecA и был обус#
нормальной архитектуры биопленки. Действи#
ловлен иным механизмом действия [36]. С дру#
тельно, при отмывании биопленок, культивиро#
гой стороны, наши предварительные экспери#
ванных в присутствии галактана, было замечено
менты показывают, что галактан картофеля спо#
наличие в планктонной фракции крупных агре#
собствует агрегации планктонных клеток и мо#
гатов. Кроме того, в пользу предположения о
дификации структуры биопленок Stenotropho(
чрезмерной агрегации как механизме ингибиро#
monas maltophilia (данные не приведены). При
вания образования биопленок говорит тот факт,
этом лектин LecA у этого вида бактерий пока не
что более низкие концентрации галактана, на#
был обнаружен.
оборот, стимулируют накопление биомассы в био#
Несмотря на то, что галактан способен инги#
пленке. По#видимому, меньшие концентрации
бировать образование биопленок и частично
галактана вызывают меньшую степень агрега#
разрушать уже сформированные биопленки,
ции, совместимую с образованием биопленки.
этот полисахарид защищает бактериальные
Подобный механизм действия не был описан
клетки внутри биопленок от действия антибио#
для полисахаридов. В тех случаях, когда влияние
тиков при их совместном применении. Меха#
полисахаридов на агрегацию бактериальных
низм подобной защиты неясен. Учитывая то,
клеток было исследовано, полисахариды, по#
что на планктонные клетки подобный защит#
давляющие образование биопленок, всегда пре#
ный эффект галактана не распространяется, на#
пятствовали такой агрегации [7, 8, 27, 28]. Одна#
иболее вероятным представляется механизм,
ко схожий эффект описан для белка BipA
связанный с частичным ремоделированием
Bordetella holmesii [32]. Изоляты B. holmesii, мутант#
структуры биопленки за счет галактана. Подоб#
ные по гену bipA, при культивировании образу#
ное ремоделирование может затруднять про#
ют крупные агрегаты, и этот процесс препят#
никновение антибиотиков к бактериальным
БИОХИМИЯ том 84 вып. 5 2019
ГАЛАКТАН ПРОТИВ БИОПЛЕНОК P. aeruginosa
679
клеткам либо вызывать изменение физиологи#
взаимодействия с галактаном. Однако галактан
ческого состояния части клеток, что, в свою
не повышает эффективность антибиотиков в от#
очередь, может способствовать их повышенной
ношении биопленок P. aeruginosa при их сов#
устойчивости к антибиотикам. Интересно отме#
местном применении. Напротив, галактан защи#
тить, что похожий эффект в отношении биопле#
щает бактерии в составе биопленки от действия
нок P. aeruginosa был недавно описан для белка
антибиотиков. По всей видимости, это связано
А Staphylococcus aureus (SpA) [37]. Показано, что
с ремоделированием структуры биопленки га#
SpA взаимодействует с полисахаридом матрикса
лактаном. Похожий эффект в отношении био#
биопленок psl и пилями IV типа [38]. При добав#
пленок P. aeruginosa был ранее показан для бел#
лении SpA к уже сформированным биопленкам
ка A S. aureus. Таким образом, маловероятно,
подобное взаимодействие приводило к измене#
что галактан картофеля может быть использо#
нию нормальной структуры биопленки и фор#
ван для дальнейшей разработки на его основе
мированию крупных и плотных клеточных агре#
препаратов, предназначенных для борьбы с бак#
гатов. Важно, такое изменение структуры био#
териальными биопленками. Тем не менее полу#
пленки повышало ее устойчивость к обработке
ченный результат представляет интерес с точки
тобрамицином - антибиотиком, относящимся,
зрения исследования влияния структуры био#
как и амикацин, к классу аминогликозидов [37].
пленки на ее устойчивость к антибиотикам, по#
Можно предположить, что, хотя механизмы ре#
казывая тесную взаимосвязь этих характеристик.
моделирования структуры биопленок галакта#
ном картофеля и SpA различны, подобное ремо#
Финансирование. Работа выполнена в рамках
делирование, заключающееся, вероятно, в более
государственного задания Минздрава России
плотной агрегации бактериальных клеток, при#
(НИОКР № 115030470038).
водит к повышению устойчивости бактерий к
Благодарности. Авторы выражают благодар#
антибиотикам.
ность И.Г. Тигановой за штамм P. aeruginosa PAO1,
О.Ю. Добрыниной за изолят P. aeruginosa 216,
В данной работе было исследовано действие
а также Ю.М. Романовой, любезно предоставив#
галактана картофеля на биопленки P. aeruginosa,
шей красители LIVE/DEAD.
в т.ч. эффект совместного применения галакта#
Конфликт интересов. Авторы заявляют об от#
на и антибиотиков ципрофлоксацина и амика#
сутствии конфликта интересов в финансовой
цина против биопленок P. aeruginosa. Галактан
или в какой#либо иной сфере.
ингибирует образование биопленок P. aeruginosa
Соблюдение этических норм. Настоящая
и частично разрушает сформированные биоплен#
статья не содержит описания каких#либо иссле#
ки. Предположительно, этот эффект связан с чрез#
дований с участием людей или использованием
мерной агрегацией бактериальных клеток за счет
животных в качестве объектов исследований.
СПИСОК ЛИТЕРАТУРЫ
1.
Hall#Stoodley, L., Costerton, J.W., and Stoodley, P. (2004)
Proc. Natl. Acad. Sci. USA, 103, 12558-12563, doi: 10.
Bacterial biofilms: from the natural environment to infec#
1073/pnas.0605399103.
tious diseases, Nat. Rev. Microbiol., 2, 95-108, doi: 10.
8. Jiang, P., Li, J., Han, F., Duan, G., Lu, X., Gu, Y., and Yu, W.
1038/nrmicro821.
(2011) Antibiofilm activity of an exopolysaccharide from
2.
Hall#Stoodley, L., and Stoodley, P. (2009) Evolving con#
marine bacterium Vibrio sp. QY101, PLoS One, 6, e18514,
cepts in biofilm infections, Cell Microbiol., 11, 1034-1043,
doi: 10.1371/journal.pone.0018514.
doi: 10.1111/j.1462#5822.2009.01323.x.
9. Kanmani, P., Satish Kumar, R., Yuvaraj, N., Paari, K.A.,
3.
Hoiby, N., Bjarnsholt, T., Givskov, M., Molin, S., and
Pattukumar, V., and Arul, V. (2011) Production and purifi#
Ciofu, O. (2010) Antibiotic resistance of bacterial biofilms,
cation of a novel exopolysaccharide from lactic acid bac#
Int. J. Antimicrob. Agents, 35, 322-332, doi: 10.1016/j.ijan#
terium Streptococcus phocae PI80 and its functional charac#
timicag.2009.12.011.
teristics activity in vitro, Bioresour. Technol.,
102,
4.
Jensen, P.O., Givskov, M., Bjarnsholt, T., and Moser, C.
4827-4833, doi: 10.1016/j.biortech.2010.12.118.
(2010) The immune system vs. Pseudomonas aeruginosa
10. Sayem, S.M.A., Manzo, E., Ciavatta, L., Tramice, A.,
biofilms, FEMS Immunol. Med. Microbiol., 59, 292-305,
Cordone, A., Zanfardino, A., De Felice, M., and Varca#
doi: 10.1111/j.1574#695X.2010.00706.x.
monti, M. (2011) Anti#biofilm activity of an exopolysac#
5.
Mah, T#F. (2010) Biofilm#specific antibiotic resistance,
charide from a sponge#associated strain of Bacillus licheni(
Future Microbiol., 7, 1061-1072, doi: 10.2217/fmb.12.76.
formis, Microb. Cell. Fact., 10, 74, doi: 10.1186/1475#2859#
6.
Costerton, J.W. (1999) Bacterial biofilms: a common cause
10#74.
of persistent infections, Science, 284, 1318-1322, doi: 10.
11. Spano, A., Lagana, P., Visalli, G., Maugeri, T.L., and
1126/science.284.5418.1318.
Gugliandolo, C. (2016) In vitro antibiofilm activity of an
7.
Valle, J., Da Re, S., Henry, N., Fontaine, T., Balestrino, D.,
exopolysaccharide from the marine thermophilic Bacillus
Latour#Lambert, P., and Ghigo, J#M. (2006) Broad#spec#
licheniformis T14, Curr. Microbiol., 72, 518-528, doi: 10.
trum biofilm inhibition by a secreted bacterial polysaccharide,
1007/s00284#015#0981#9.
БИОХИМИЯ том 84 вып. 5 2019
680
ГРИШИН, КАРЯГИНА
12.
Wu, S., Liu, G., Jin, W., Xiu, P., and Sun, C. (2016)
an axenic culture of the intertidal mudflat Navicula
Antibiofilm and anti#infection of a marine bacterial
phyllepta diatom affect biofilm formation by benthic bacte#
exopolysaccharide against Pseudomonas aeruginosa, Front.
ria, J. Appl. Phycol., 29, 165-177, doi: 10.1007/s10811#
Microbiol., 7, 102, doi: 10.3389/fmicb.2016.00102.
016#0943#z.
13.
Brian#Jaisson, F., Molmeret, M., Fahs, A., Guentas#
25.
Bernal, P., and Llamas, M.A. (2012) Promising biotechnolo#
Dombrowsky, L., Culioli, G., Blache, Y., Cerantola, S.,
gical applications of antibiofilm exopolysaccharides, Microb.
and Ortalo#Magne, A. (2016) Characterization and anti#
Biotechnol., 5, 670-673, doi: 10.1111/j.1751#7915.2012.00359.x.
biofilm activity of extracellular polymeric substances pro#
26.
Rendueles, O., Kaplan, J.B., and Ghigo, J.#M. (2013)
duced by the marine biofilm#forming bacterium Pseudo(
Antibiofilm polysaccharides, Environ. Microbiol., 15,
alteromonas ulvae strain TC14, Biofouling, 32, 547-560,
334-346, doi: 10.1111/j.1462#2920.2012.02810.x.
doi: 10.1080/08927014.2016.1164845.
27.
Kim, Y., Oh, S., and Kim, S.H. (2009) Released
14.
Papa, R., Parrilli, E., Sannino, F., Barbato, G., Tutino, M.L.,
exopolysaccharide (r#EPS) produced from probiotic bac#
Artini, M., and Selan, L. (2013) Anti#biofilm activity of the
teria reduce biofilm formation of enterohemorrhagic
Antarctic marine bacterium Pseudoalteromonas haloplanktis
Escherichia coli O157:H7, Biochem. Biophys. Res.
TAC125, Res. Microbiol., 164, 450-456, doi: 10.1016/j.
Commun., 379, 324-329, doi: 10.1016/j.bbrc.2008.12.053.
resmic.2013.01.010.
28.
Karwacki, M.T., Kadouri, D.E., Bendaoud, M., Izano, E.A.,
15.
Kanmani, P., Suganya, K., Satish Kumar, R., Yuvaraj, N.,
Sampathkumar, V., Inzana, T.J., and Kaplan, J.B. (2013)
Pattukumar, V., Paari, K.A., and Arul, V. (2013) Synthesis
Antibiofilm activity of Actinobacillus pleuropneumoniae
and functional characterization of antibiofilm exopolysac#
serotype 5 capsular polysaccharide, PLoS One, 8, e63844,
charide produced by enterococcus faecium MC13 isolated
doi: 10.1371/journal.pone.0063844.
from the gut of fish, Appl. Biochem. Biotechnol., 169,
29.
O’Toole, G.A. (2011) Microtiter dish biofilm formation
1001-1015, doi: 10.1007/s12010#012#0074#1.
assay, J. Vis. Exp., 47, 2437, doi: 10.3791/2437.
16.
Kavita, K., Singh, V.K., Mishra, A., and Jha, B. (2014)
30.
Mah, T.#F. (2014) Establishing the minimal bactericidal
Characterisation and anti#biofilm activity of extracellular
concentration of an antimicrobial agent for planktonic
polymeric substances from Oceanobacillus iheyensis, Carbo(
cells (MBC#P) and biofilm cells (MBC#B), J. Vis. Exp., 83,
hydr. Polym., 101, 29-35, doi: 10.1016/j.carbpol.2013.08.099.
e50854, doi: 10.3791/50854.
17.
Li, Y., Li, Q., Hao, D., Jiang, D., Luo, Y., Liu, Y., and
31.
Schindelin, J., Arganda#Carreras, I., Frise, E., Kaynig, V.,
Zhao, Z. (2015) Production, purification, and antibiofilm
Longair, M., Pietzsch, T., Preibisch, S., Rueden, C.,
activity of a novel exopolysaccharide from Arthrobacter sp.
Saalfeld, S., Schmid, B., Tinevez, J#Y., White, D.J.,
B4, Prep. Biochem. Biotechnol., 45, 192-204, doi: 10.1080/
Hartenstein, V., Eliceiri, K., Tomancak, P., and Cardona, A.
10826068.2014.907180.
(2012) Fiji: an open#source platform for biological#image
18.
Pradeepa, Shetty, A.D., Matthews, K., Hegde, A.R.,
analysis, Nat. Meth., 9, 676-682, doi: 10.1038/nmeth.2019.
Akshatha, B., Mathias, A.B., Mutalik, S., and Vidya, S.M.
32.
Hiramatsu, Y., Saito, M., Otsuka, N., Suzuki, E.,
(2016) Multidrug resistant pathogenic bacterial biofilm
Watanabe, M., Shibayama, K., and Kamachi, K. (2016)
inhibition by Lactobacillus plantarum exopolysaccharide,
BipA is associated with preventing autoagglutination and
Bioact. Carbohydrates. Diet. Fibre, 8, 7-14, doi: 10.1016/
promoting biofilm formation in Bordetella holmesii, PLoS
j.bcdf.2016.06.002.
One, 11, e0159999, doi: 10.1371/journal.pone.0159999.
19.
Rendueles, O., Travier, L., and Latour#Lambert, P. (2011)
33.
Imberty, A., Wimmerova, M., Mitchell, E.P., and Gilboa#
Screening of Escherichia coli species biodiversity reveals
Garber, N. (2004) Structures of the lectins from Pseudo(
new biofilm#associated antiadhesion polysaccharide,
monas aeruginosa: insights into the molecular basis for host
MBio, 2, e00043#11, doi: 10.1128/mBio.00043#11.
glycan recognition, Microbes. Infect., 6, 221-228, doi: 10.
20.
Bendaoud, M., Vinogradov, E., Balashova, N.V., Kado#
1016/j.micinf.2003.10.016.
uri, D.E., Kachlany, S.C., and Kaplan, J.B. (2011) Broad#
34.
Grishin, A.V., Krivozubov, M.S., Karyagina, A.S., and
spectrum biofilm inhibition by Kingella kingae exopolysac#
Gintsburg, A.L. (2015) Pseudomonas aeruginosa lectins as
charide, J. Bacteriol., 193, 3879-3886, doi: 10.1128/JB.
targets for novel antibacterials, Acta Naturae, 7, 29-41.
00311#11.
35.
Titz, A. (2014) Carbohydrate#based anti#virulence com#
21.
Dos Santos Goncalves, M., Delattre, C., Balestrino, D.,
pounds against chronic Pseudomonas aeruginosa infections
Charbonnel, N., Elboutachfaiti, R., Wadouachi, A., Badel, S.,
with a focus on small molecules, in Carbohydrates as drugs.
Bernardi, T., Michaud, P., and Forestier, C. (2014) Anti#
Topics in medicinal chemistry, vol. 12 (Seeberger, P., and
biofilm activity: a function of Klebsiella pneumoniae capsu#
Rademacher, C., eds), Springer, Chambridge, pp. 169-186,
lar polysaccharide, PLoS One, 9, e99995, doi: 10.1371/
doi: 10.1007/7355_2014_44.
journal.pone.0099995.
36.
Boukerb, A.M., Rousset, A., Galanos, N., Mear, J#B.,
22.
Grishin, A., Karyagina, A.S., Tiganova, I.G., Dobrynina, O.Y.,
Thepaut, M., Grandjean, T., Gillon, E., Cecioni, S.,
Bolshakova, T.N., Boksha, I.S., Alexeyeva, N.V.,
Abderrahmen, C., Faure, K., Redelberger, D., Kipnis, E.,
Stepanova, T.V., Lunin, V.G., Chuchalin, A.G., and
Dessein, R., Havet, S., Darblade, B., Matthews, S.E.,
Ginzburg, A.L. (2013) Inhibition of Pseudomonas aerugi(
de Bentzmann, S., Guery, B., Cournoyer, B., Imberty, A.,
nosa biofilm formation by LecA#binding polysaccharides,
and Vidal, S. (2014) Antiadhesive properties of glycoclus#
Int. J. Antimicrob. Agents, 42, 471-472, doi: 10.1016/j.ijan#
ters against Pseudomonas aeruginosa lung infection, J. Med.
timicag.2013.07.003.
Chem., 57, 10275-10289, doi: 10.1021/jm500038p.
23.
Vazquez#Rodriguez, A., Vasto#Anzaldo, X.G., Barboza
37.
Beaudoin, T., Yau, Y.C.W., Stapleton, P.J., Gong, Y.,
Perez, D., Vazquez#Garza, E., Chapoy#Villanueva, H.,
Wang, P.W., Guttman, D.S., and Water, V.
(2017)
Garcia#Rivas, G., Garza#Cervantes, J., Gomez#Lugo, J.J.,
Staphylococcus aureus interaction with Pseudomonas aerugi(
Gomez#Loredo, A.E., Gonzalez, M.T.G., Zarate, X., and
nosa biofilm enhances tobramycin resistance, NPJ Biofilms
Morones#Ramirez, J.R. (2018) Microbial competition of
Microbiomes, 3, 25, doi: 10.1038/s41522#017#0035#0.
Rhodotorula mucilaginosa UANL#001L and E. coli increase
38.
Armbruster, C.R., Wolter, D.J., Mishra, M., Hayden, H.S.,
biosynthesis of non#toxic exopolysaccharide with applica#
Radey, M.C., Merrihew, G., Maccoss, M.J., Burns, J.,
tions as a wide#spectrum antimicrobial, Sci. Rep., 8, 798,
Wozniak, D.J., Parsek, M.R., and Hoffman, L.R. (2016)
doi: 10.1038/s41598#017#17908#8.
Staphylococcus aureus protein A mediates interspecies
24.
Doghri, I., Lavaud, J., Dufour, A., Bazire, A., Lanneluc, I.,
interactions at the cell surface of Pseudomonas aeruginosa,
and Sable, S. (2017) Cell#bound exopolysaccharides from
MBio, 7, e00538#16, doi: 10.1128/mBio.00538#16.
БИОХИМИЯ том 84 вып. 5 2019
ГАЛАКТАН ПРОТИВ БИОПЛЕНОК P. aeruginosa
681
POLYSACCHARIDE GALACTAN INHIBITS Pseudomonas aeruginosa
BIOFILM FORMATION BUT PROTECTS PRE7FORMED
BIOFILMS FROM ANTIBIOTICS
A. V. Grishin1,2* and A. S. Karyagina1,2,3*
1 Gamaleya National Research Center of Epidemiology and Microbiology,
Ministry of Health of the Russian Federation, 123098 Moscow,
Russia; E(mail: grishin(a1@yandex.ru, akaryagina@gmail.com
2 All(Russia Research Institute of Agricultural Biotechnology,
127550 Moscow, Russia
3 Belozersky Institute of Physico(Chemical Biology, Lomonosov
Moscow State University, 119991 Moscow, Russia
Received October 9, 2018
Revised January 21, 2019
Accepted January 28, 2019
Microorganisms residing within a biofilm become more tolerant to antibiotics and other types of adverse impact, and
biofilm formation by pathogenic bacteria is an important problem of current medicine. Polysaccharides that prevent
biofilm formation are among the promising candidates to help tackle this problem. Earlier we demonstrated the ability
of galactan polysaccharide to inhibit biofilm formation by a Pseudomonas aeruginosa clinical isolate. Here we investi#
gate the effect of galactan on P. aeruginosa biofilms in more detail. Microscopic analysis indicates that galactan does
not interfere with adhesion of bacterial cells to the substrate but prevents the build#up of bacterial biomass. Moreover,
galactan not only inhibits biofilm formation but partially destroys pre#formed biofilms. Presumably, this activity of
galactan is due to excessive aggregation of bacterial cells, which prohibits the formation and maintenance of proper
biofilm architecture, or due to some other mechanisms of biofilm structure remodeling. This leads to an unexpected
effect, i.e., P. aeruginosa biofilms treated with an antibiotic and galactan retain more viable bacterial cells compared
to biofilms treated with the antibiotic alone. Galactan is the first polysaccharide demonstrated to have such effect on
bacterial biofilms.
Keywords: biofilm, galactan, Pseudomonas aeruginosa, polysaccharide, antibiotics, tolerance
6 БИОХИМИЯ том 84 вып. 5 2019