БИОХИМИЯ, 2019, том 84, вып. 5, с. 682 - 691
УДК 577.355.2
ВЛИЯНИЕ ЗАМЕНЫ ЛЕЙЦИНА M196 НА ГИСТИДИН
НА ЭЛЕКТРОННУЮ СТРУКТУРУ ПЕРВИЧНОГО ДОНОРА
ЭЛЕКТРОНА И ПЕРЕНОС ЭЛЕКТРОНА В РЕАКЦИОННЫХ
ЦЕНТРАХ Rhodobacter sphaeroides*
© 2019
А.А. Забелин, Т.Ю. Фуфина, А.М. Христин, Р.А. Хатыпов,
В.А. Шкуропатова, В.А. Шувалов, Л.Г. Васильева, А.Я. Шкуропатов**
Институт фундаментальных проблем биологии РАН, ФИЦ «Пущинский научный
центр биологических исследований» РАН, 142290 Пущино Московской обл.,
Россия; электронная почта: ashkur@mail.ru
Поступила в редакцию 13.11.2018
После доработки 27.12.2018
Принята к публикации 27.12.2018
Недавние рентгеноструктурные исследования выявили, что замена природного остатка лейцина M196 на
гистидин в реакционном центре (РЦ) Rhodobacter (Rba.) sphaeroides приводит к образованию близкого кон
такта между генетически введенным гистидином и первичным донором электрона P (димером молекул бак
териохлорофилла (БХл) PA и PB) и формированию нового пигмент белкового взаимодействия, не наблюда
емого в нативных РЦ. В настоящей работе возможная природа нового взаимодействия и его влияние на
электронные свойства P и фотохимическое разделение зарядов в изолированных мутантных РЦ L(M196)H
исследованы методами стационарной абсорбционной спектроскопии, фотоиндуцированной дифференци
альной ИК Фурье спектроскопии и фемтосекундной абсорбционной спектроскопии при комнатной тем
пературе. Результаты сравниваются с данными, полученными для РЦ Rba. sphaeroides псевдодикого типа.
Показано, что мутация L(M196)H приводит к уменьшению интенсивности и уширению длинноволновой
Qy полосы поглощения Р при ~865 нм. Следствием мутации является также ослабление электронного соп
ряжения между молекулами БХл в катион радикале димера P+ и увеличение локализации положительного
заряда на молекуле PA. Сравнение полученных результатов с литературными данными позволяет предполо
жить, что имидазольная группа гистидина M196 образует π водородную связь с π электронной системой
молекулы PB димера P. Несмотря на значительные возмущения электронной структуры P, мутантные РЦ
сохраняют высокие скорости переноса электрона и квантовый выход состояния P+Q– (QA - первичный хи
нонный акцептор), близкий к наблюдаемому в нативных РЦ. По видимому, специфическая (Т образная)
пространственная организация π водородного взаимодействия и ее потенциальная гетерогенность в отно
шении энергии связи могли бы быть, по крайней мере частично, причинами того, что взаимодействие та
кого типа не реализуется между белком и пигментными и хинонными кофакторами в нативных РЦ.
КЛЮЧЕВЫЕ СЛОВА: бактериальный реакционный центр, аминокислотные замещения, первичный донор
электрона, электронная структура, перенос электрона, Rhodobacter sphaeroides.
DOI: 10.1134/S0320972519050063
Реакционные центры (РЦ) бактериального
быстрых реакций переноса электрона. Уникаль
фотосинтеза являются высокоспециализиро
ной особенностью РЦ как природных фотопре
ванными кофактор белковыми комплексами,
образующих систем является их способность
в которых происходит первичное преобразование
осуществлять разделение зарядов с предельно
энергии световых квантов в электрохимическую
высоким квантовым выходом (~100%) и высо
энергию разделенных зарядов с помощью серии
кой энергетической эффективностью (десятки
Принятые сокращения: ΔA - изменение поглощения; БХл - бактериохлорофилл; БФео - бактериофеофитин;
ИК Фурье спектроскопия - инфракрасная спектроскопия с Фурье преобразованием; BA - мономерный БХл в активной
ветви кофакторов; EADS - дифференциальные спектры, связанные с эволюцией состояний (evolution associated decay spectra);
HA и HB - молекулы БФео в активной и неактивной ветвях кофакторов соответственно; P - первичный донор электрона,
димер молекул БХл; PA, PB - молекулы БХл, составляющие P; РЦ - реакционный центр; psWt - псевдодикий тип;
Rba. sphaeroides - Rhodobacter sphaeroides; QA - первичный хинонный акцептор; QB - вторичный хинонный акцептор.
* Первоначально английский вариант рукописи опубликован на сайте «Biochemistry» (Moscow) http://protein.bio.
msu.ru/biokhimiya, в рубрике «Papers in Press», BM18 318, 18.02.2019.
** Адресат для корреспонденции.
682
ЗАМЕНА ЛЕЙЦИНА M196 НА ГИСТИДИН В РЦ БАКТЕРИЙ
683
процентов) в молекулярной донорно акцептор
роскопия обладает чрезвычайно высокой чув
ной системе, включающей лишь несколько пиг
ствительностью к молекулярным изменениям,
ментных (бактериохлориновых) молекул, по
сопровождающим разделение зарядов, позволяя,
груженных в специфически организованный
в частности, получать сведения об электронной
белковый матрикс. Ключевое значение для
структуре первичного донора электрона P в его
функционирования этой системы имеют, оче
функционально важной катион радикальной
видно, как базовые физико химические свой
форме P+ [3, 4]. Фемтосекундная абсорбцион
ства индивидуальных пигментных молекул, так
ная спектроскопия является наиболее адекват
и их взаимодействия между собой и с локаль
ным методом для изучения быстрых реакций
ным окружением. Одним из подходов к иссле
переноса электрона, протекающих в бактери
дованию роли межмолекулярных взаимодействий
альных РЦ на (суб)пикосекундной временной
в структурной и электронной организации пиг
шкале. Результаты работы обсуждаются на ос
ментных кофакторов и их функциональной ак
нове анализа ключевых сходств и различий с
тивности является введение точечных амино
аналогичными данными, полученными в иден
кислотных замен в структуру белка РЦ с целью
тичных экспериментальных условиях для РЦ
устранения существующих и(или) создания но
псевдодикого типа Rba. sphaeroides (psWt).
вых контактов/взаимодействий и детальные ис
следования их последствий методом рентгено
структурного анализа в сочетании с методами
МЕТОДЫ ИССЛЕДОВАНИЯ
оптической спектроскопии. В частности, одной
из перспективных замен, влияющих на межмо
Конструирование рекомбинантного штамма
лекулярные взаимодействия в РЦ, является за
Rba. sphaeroides, не имеющего светособирающих
мещение природных аминокислотных остатков
антенн, но содержащего мутантные РЦ с амино
остатком гистидина. Гистидин в составе белков
кислотной заменой лейцина на гистидин в по
способен участвовать во взаимодействиях раз
ложении M196, было описано ранее [5]. В каче
личной природы: координационных связях с ка
стве РЦ psWt использовали реакционные цент
тионами металлов, водородных связях, π кати
ры, выделенные из puf/дефицитного штамма,
онном, π водородном и π π стэкинг взаимо
трансформированного плазмидой, содержав
действиях [1].
шей puf/оперон дикого типа [5]. РЦ выделяли по
Недавно на основе данных рентгенострук
стандартной методике путем обработки хромато
турного анализа в совокупности с результатами
форов лаурилдиметиламино N оксидом (ЛДАО)
низкотемпературных абсорбционных измере
с последующей очисткой на ДЭАЭ целлюлозе [5].
ний и редокс титрования было показано, что за
Замену детергента ЛДАО на Triton Х 100 прово
мена лейцина на гистидин в позиции M196 в РЦ
дили на мембране с отсекаемой массой 30 кДа
Rhodobacter (Rba.) sphaeroides, по видимому, при
(«Millipore», США) в ячейке для ультраконцент
водит к образованию нового взаимодействия
рирования под давлением газообразного аргона.
между молекулой бактериохлорофилла (БХл) PB,
Электронные спектры поглощения РЦ в об
входящей в состав димера первичного донора
ласти 650-1000 нм записывали на спектрофото
электрона P, и имидазолом вновь введенного гис
метре Shimadzu UV1800 («Shimadzu», Япония).
тидина M196 [2]. Было предположено, что такое
Фотоиндуцированные дифференциальные
взаимодействие может иметь характер π π стэ
ИК спектры P+Q-/PQ измеряли на инфракрас
кинга или π водородного взаимодействия [2].
ном Фурье спектрометре Equinox 55 («Bruker»,
С целью дальнейшего выяснения природы
Германия) с детектором DTGS и светоделителем
обнаруженного взаимодействия и его влияния
из KBr. Для получения образцов несколько мик
на электронные свойства P и первичное разде
ролитров концентрированной суспензии РЦ, со
ление зарядов в настоящей работе изолирован
любилизированных в 20 мМ Tris HCl буфере
ные РЦ L(M196)H исследованы методами ста
(pH 8,0), содержавшем 0,1% Triton Х 100, наноси
ционарной абсорбционной спектроскопии в
ли на подложку из CaF2, частично дегидратирова
ближнем и среднем (ИК Фурье спектроскопия)
ли под струей газообразного аргона и накрывали
ИК диапазонах и кинетической абсорбционной
второй подложкой из CaF2 [6]. Дифференциаль
спектроскопии с фемтосекундным временным
ные ИК спектры измеряли при освещении об
разрешением в видимой/ближней ИК областях.
разцов постоянным светом (1000 нм > λ > 620 нм).
Измерения электронных спектров поглощения
Спектральное разрешение составляло 4 см-1.
интенсивно используются для получения ин
Циклы освещения повторяли сотни раз для дос
формации о влиянии мутаций на электронные
тижения приемлемого соотношения сигнал/шум.
свойства бактериальных РЦ. Фотоиндуциро
Измерение дифференциальных спектров с
ванная дифференциальная ИК Фурье спект
фемтосекундным временным разрешением про
БИОХИМИЯ том 84 вып. 5 2019
6*
684
ЗАБЕЛИН и др.
водили при помощи лазерного спектрометра,
оценивали для обоих исследованных спектраль
как описано ранее [7], с некоторыми модифика
ных диапазонов величиной ~35-40 фс.
циями. Титан сапфировый лазер MaiTai («Spectra
Physics», США) с оптическим регенеративным
усилителем Spitfire Ace («Spectra Physics», США)
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
использовали для получения фундаментальных
(800 нм) импульсов длительностью 35-40 фс
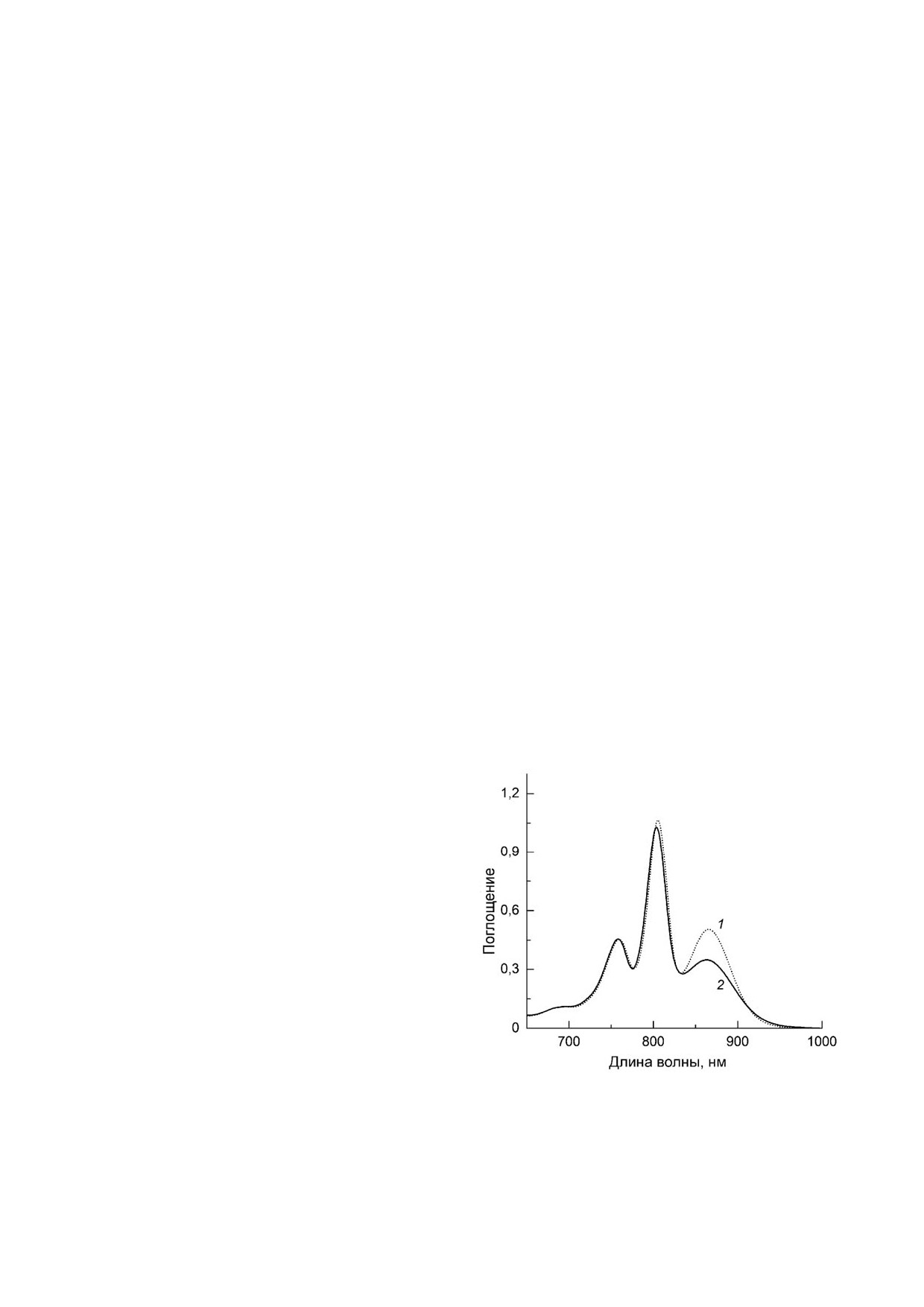
На рис. 1 показаны электронные спектры
с энергией 3 мДж/импульс. Выходящий из усили
поглощения РЦ Rba. sphaeroides psWt и L(M196)H,
теля пучок ослабляли и делили на два луча. Пер
измеренные в области Qy оптических переходов
вый луч использовали для генерации контину
(650-1000 нм) при комнатной температуре.
ума на пластине из сапфира толщиной ~2 мм.
Спектры нормированы в максимуме полосы
Спектральные компоненты континуума с дли
бактериофеофитина (БФео) при 759 нм, исходя
ной волны >850 нм выделяли с помощью свето
из предположения, что мутация не вносит зна
фильтра RG850 («Newport», США), полученные
чительных возмущений в электронную структу
импульсы использовали для возбуждения РЦ в
ру молекул БФео в РЦ и не оказывает сильного
длинноволновую полосу поглощения P. Второй
влияния на их оптические свойства, поскольку
луч проходил через линию задержки M531.DD
локус мутации удален от мест связывания как
(«Physik Instrumente», Германия), фокусировал
БФео HA, так и БФео HB.
ся в кварцевой кювете с водой толщиной 5 мм
Из рис. 1 видно, что полоса поглощения низ
для генерации континуума, который затем де
коэнергетического экситонного перехода Qy
лился на зондирующий и опорный лучи в про
первичного донора электрона Р при ~865 нм
центном соотношении 50 : 50. Спектры зонди
сохраняется в мутантных РЦ, однако она слегка
рующего и опорного импульсов модифицирова
уширяется и значительно уменьшается по ин
ли при помощи спектральной и пространствен
тенсивности по отношению к аналогичной по
ной фильтрации для выделения спектрального
лосе в РЦ psWt. Контрольные эксперименты с
диапазона в видимой или ближней ИК области.
добавками к образцам мутантных РЦ восстано
Поляризацию импульса возбуждения устанав
вителей (аскорбата натрия или дитионита нат
ливали параллельно по отношению к зондирую
рия) выявили, что наблюдаемое уменьшение
щему импульсу. После кюветы с образцом зон
интенсивности полосы P при ~865 нм не связа
дирующий и опорный импульс направляли на
но с окислением P (данные не приведены). Та
входную щель спектрографа SpectraPro 2300i
ким образом, хотя общая димерная природа P
(«Acton Research Corporation», США). Спектры
сохраняется в мутантных РЦ, электронная
излучения импульсов регистрировали с по
структура димера подвергается, по видимому,
мощью CCD камеры Pixis 400BR («Princeton
значительной модификации. Для мутанта ха
Instruments», США). Образец РЦ (А865 ~0,5) по
мещали во вращающуюся кварцевую кювету с
длиной оптического пути 1 мм («CDP Systems»,
Россия). Частота вращения кюветы и частота
возбуждения (10 Гц) были подобраны таким об
разом, чтобы каждый возбуждающий импульс
освещал новую порцию РЦ. Дифференциальные
спектры регистрировали в видимой (500-720 нм)
или ближней (750-1000 нм) ИК области во вре
менном интервале между 2 пс до фотовозбужде
ния РЦ и ~2 нс после него, при каждой задерж
ке времени усредняли 500 спектров. Интенсив
ность возбуждающих импульсов была ослаблена
таким образом, чтобы возбуждались <20% реак
ционных центров в образце.
Все измерения проводили при комнатной тем
пературе.
Фемтосекундные данные анализировали с
помощью глобального анализа [8], используя
программу Glotaran [9]. Программа включает
Рис. 1. Электронные спектры поглощения РЦ Rba. sphae/
математическое описание спектральной дис
roides psWt (1) и L(M196)H (2), измеренные при комнатной
персии максимума аппаратной функции. Полу
температуре. Спектры нормированы в максимуме погло
ширину на полувысоте аппаратной функции
щения молекул бактериофеофитина при 759 нм
БИОХИМИЯ том 84 вып. 5 2019
ЗАМЕНА ЛЕЙЦИНА M196 НА ГИСТИДИН В РЦ БАКТЕРИЙ
685
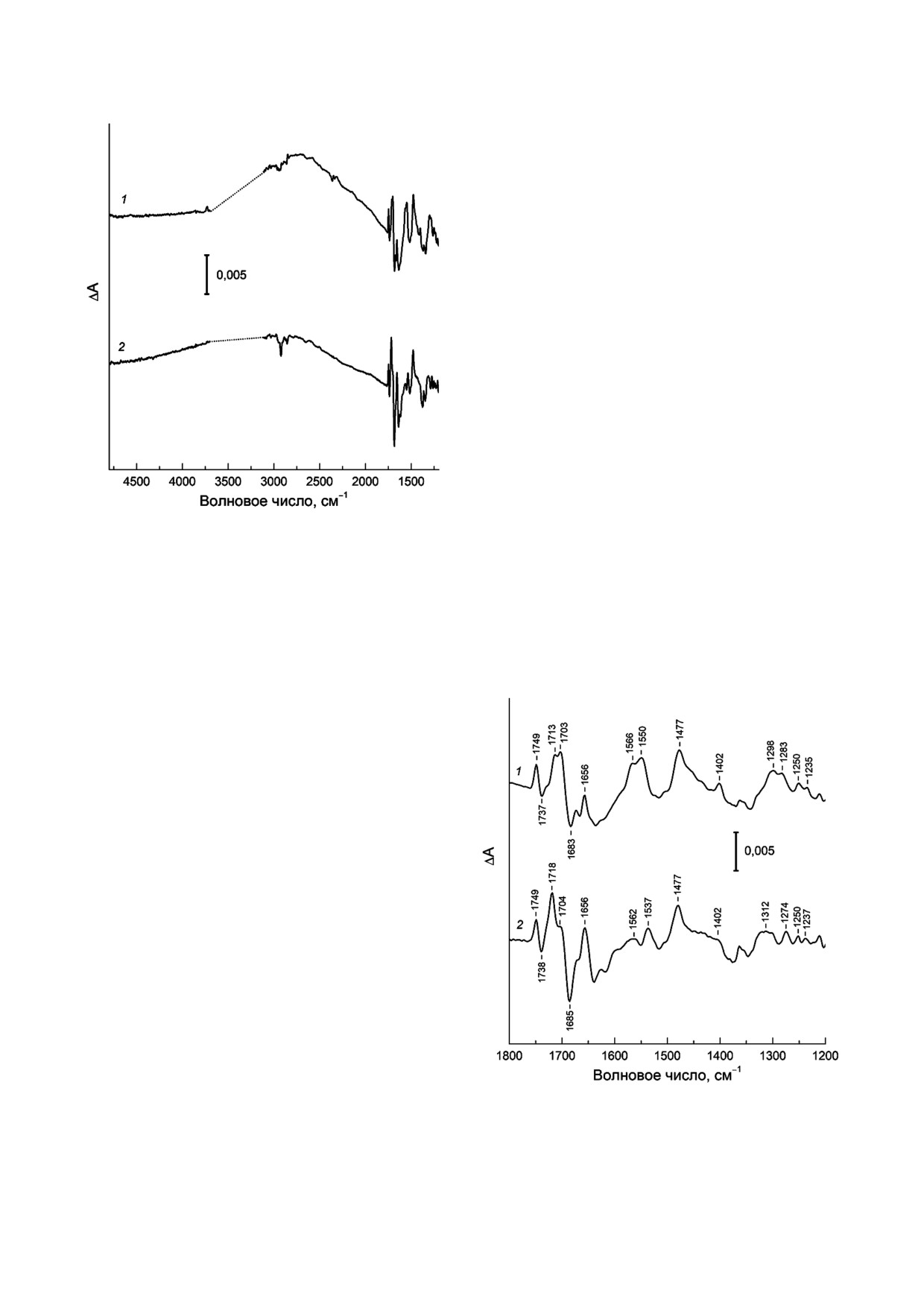
области (+)1750/(-)1740 см-1, отнесенного к
сдвигу валентных колебаний 133 эфирных групп
БХл [6, 12]. В соответствии с опубликованными
ранее данными
[6,
12], ИК Фурье спектр
P+Q-/PQ для РЦ psWt (рис. 2, кривая 1; рис. 3,
кривая 1) включает широкую полосу низкоэнер
гетического электронного перехода при ~2700 см-1,
отражающего перенос положительного заряда
(«дырки») внутри димерного катион радикала P+,
и три фазово фононные ИК полосы при ~1550,
1477 и ~1290 см-1. Полоса при ~2700 см-1 не
наблюдается для мономерного катион радикала
БХл+ [12], являясь уникальной характеристикой
димерной структуры окисленного первичного
донора электрона в РЦ пурпурных бактерий [4].
Колебательные моды фазово фононного типа
формально запрещены по симметрии в моно
мерном БХл, однако они усиливаются благода
ря сопряжению с электронным переходом пере
носа «дырки», также являясь маркерами димер
ной структуры P+ [13]. Интенсивность всех ука
занных полос сильно зависит от степени элект
ронного сопряжения между молекулами РA и PB
Рис. 2. Фотоиндуцированные дифференциальные (свет
минус темнота) ИК Фурье спектры P+Q-/PQ для РЦ
в димере Р [4, 13].
Rba. sphaeroides psWt (1) и L(M196)H (2), измеренные при
ИК Фурье спектр P+Q-/PQ для РЦ L(M196)H
комнатной температуре в области 4800-1200 см-1. Спектры
также содержит полосу переноса «дырки» в об
нормированы по амплитуде дифференциального сигнала в
ласти ~ 2700 см-1 (рис. 2, кривая 2) и фазово фо
области (+)1750/(-)1740 см-1. Область при ~3700-3100 см-1
нонные полосы при 1537, 1477 и ~1300 см-1 (рис. 3,
насыщена из за сильного поглощения образца и воды и
исключена из рисунка
кривая 2), что согласуется с сохранением в му
танте димерной структуры первичного донора
рактерны также минорные коротковолновые
сдвиги полос поглощения молекул мономерного
БХл при ~805 нм и молекул БФео при ~760 нм
(рис. 1). Уменьшение интенсивности Qy полосы P
и ее спектральное уширение в РЦ L(M196)H по
сравнению с РЦ psWt наблюдалось ранее также
в низкотемпературных (90 K) спектрах погло
щения [2]. Интересно, что в этом случае макси
мум Qy полосы поглощения P в спектре РЦ
L(M196)H испытывал более сильное длинновол
новое смещение, чем в спектре РЦ psWt (894 про
тив 888 нм). Хорошо известно, что спектральное
положение длинноволновой Qy полосы P может
зависеть от ряда факторов, включая, в частнос
ти, образование водородных связей [10] и изме
нение энергии состояний с переносом заряда
между молекулами PA и PB в димере P [11].
На рис. 2 и 3 представлены фотоиндуциро
ванные дифференциальные ИК Фурье спектры
P+Q-/PQ (Q - хинонный акцептор) реакцион
ных центров psWt и L(M196)H. Положительные
и отрицательные пики в спектрах отражают по
явление состояния P+Q- и исчезновение состоя
ния PQ соответственно. ИК Фурье спектры
Рис. 3. Низкочастотная (1800-1200 см-1) область ИК Фурье
psWt и L(M196)H (рис. 2 и 3) были нормированы
спектров P+Q-/PQ для РЦ Rba. sphaeroides psWt (1) и
по амплитуде дифференциального сигнала в
L(M196)H (2), взятая из рис. 2
БИОХИМИЯ том 84 вып. 5 2019
686
ЗАБЕЛИН и др.
электрона P [2] (рис. 1). Однако выраженное
в мутантных РЦ L(M196)H с использованием фем
уменьшение интенсивности полосы переноса
тосекундной дифференциальной абсорбцион
«дырки» и сильные изменения интенсивности и
ной спектроскопии. Полученные данные анали
частот фазово фононных полос в спектре мутант
зировались с помощью глобального анализа [8].
ных РЦ указывают на ослабление электронного
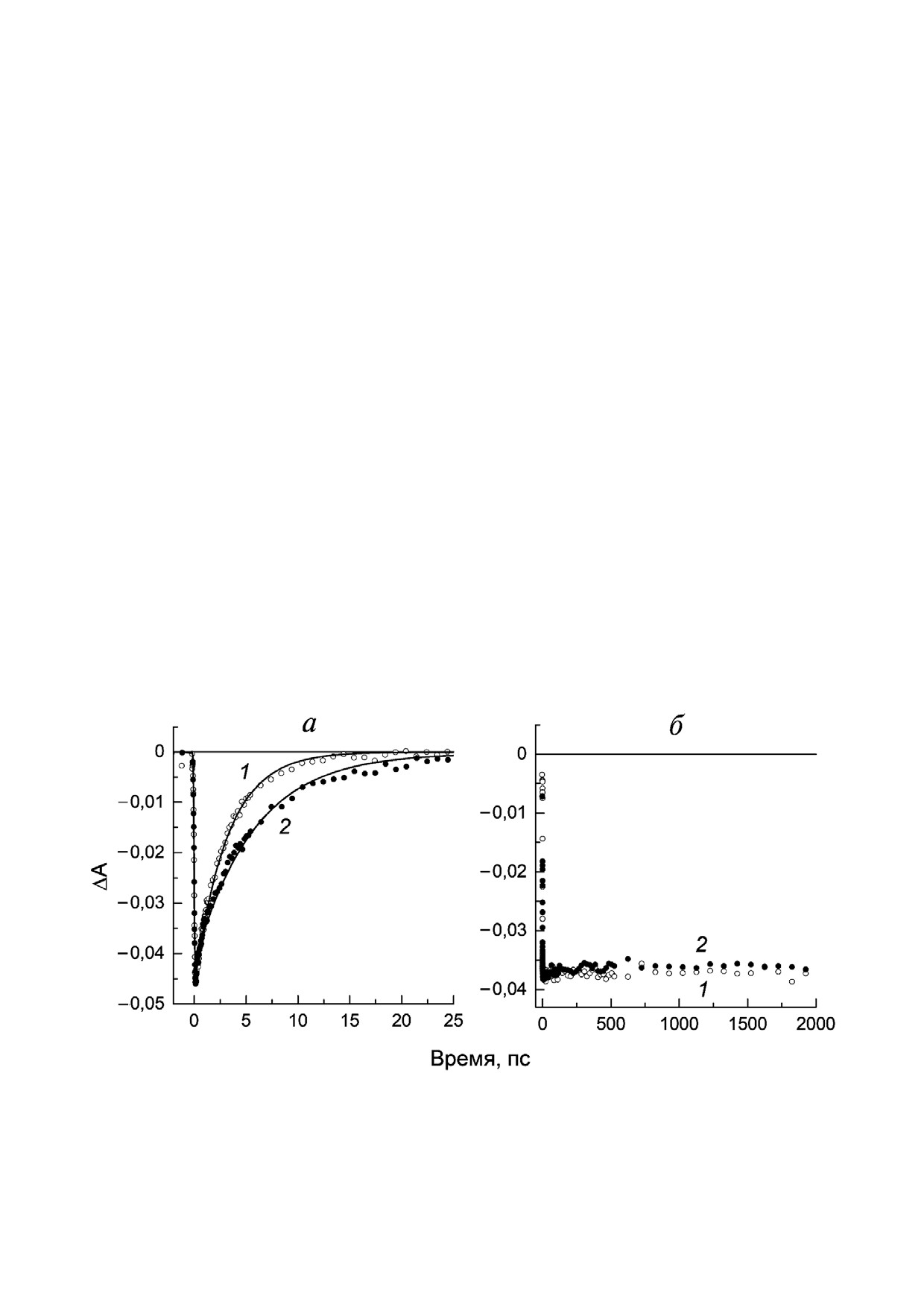
На рис. 4, а сравниваются кинетики затуха
сопряжения и усиление асимметрии распреде
ния стимулированного излучения из возбуж
ления положительного заряда между молекула
денного состояния первичного донора P*, отра
ми БХл в катион радикале димера P+ [13].
жающие перенос электрона с P* на БФео HA в
В области 1710-1650 см-1 в ИК спектре РЦ
РЦ psWt (кривая 1) и мутантных РЦ (кривая 2).
psWt (рис. 3, кривая 1) наблюдаются сигналы,
Моноэкспоненциальный анализ кинетики по
преимущественно связанные со сдвигами 131 ке
казал, что время жизни P* (т.е. временная кон
то С=О групп молекул PA и PB при фотоокис
станта реакции P* → P+H–) в РЦ psWt составля
лении P [12]. Эти группы находятся в электрон
ет 3,2 пс, что хорошо согласуется с данными для
ном сопряжении с π электронной системой
РЦ дикого типа, известными в литературе. Вре
макроцикла и являются чувствительными к из
мя жизни P* в РЦ L(M196)H увеличивается до
менениям электронной структуры димера P+.
5,7 пс. Исследование кинетики выцветания на
Относительное увеличение интенсивности по
коротковолновом склоне полосы поглощения P
+
лосы валентных колебаний 131
кето группы PA
при ~830-840 нм (в области, где вклад стимули
при 1718 см-1 по сравнению с аналогичной по
рованного излучения минимален) позволяет по
лосой 131 кето группы P+ при 1704 см-1 в
лучить информацию о квантовом выходе разде
спектре мутантных РЦ L(M196)H (рис. 3, кри
ления зарядов в РЦ. Рис. 4, б (кривая 1) показы
вая 2) может быть интерпретировано как увели
вает, что в РЦ psWt амплитуда выцветания в этой
чение локализации положительного заряда на
области спектра остается практически неизмен
молекуле PA [14]. Перераспределение положи
ной на временной шкале 2 нс. Это означает, что
тельного заряда в пользу P+ вследствие ослабле
разделение зарядов не сопровождается возвра
ния электронного сопряжения между молеку
щением P* и P+ в основное состояние, и кванто
лами PA и PB, вероятно, вызвано взаимодей
вый выход состояния P+Q– близок к 100%. Из
ствием введенного гистидина M196 с π элект
сравнения кинетик 1 и 2 на рис. 4, б следует, что
ронной системой P.
в пределах точности наших измерений анало
На рис. 4-6 приведены результаты исследова
гичный вывод может быть сделан также в отно
ний динамики и механизма разделения зарядов шении РЦ L(M196)H.
Рис. 4. а - Нормированные кинетики затухания стимулированного излучения из возбужденного состояния P* при 936 нм
для РЦ Rba. sphaeroides psWt (1) и при 930 нм для РЦ L(M196)H (2). Сплошными линиями показана моноэкспоненциаль
ная аппроксимация кинетик; б - нормированные кинетики изменения поглощения при 836 нм для РЦ psWt (1) и 830 нм
для РЦ L(M196)H (2)
БИОХИМИЯ том 84 вып. 5 2019
ЗАМЕНА ЛЕЙЦИНА M196 НА ГИСТИДИН В РЦ БАКТЕРИЙ
687
На рис. 5 и 6 приведены дифференциальные
меренных при различных временных задержках
спектры, связанные с эволюцией состояний,
между возбуждающим и зондирующим лазерны
вовлеченных в перенос электрона с P* на QA
ми импульсами, с использованием последователь
(EADS) [8] в РЦ psWt (рис. 5) и РЦ L(M196)H
ной кинетической модели с увеличивающимися
(рис. 6). EADS были получены из глобального
временами жизни состояний (1 → 2 → 3 →… ).
анализа полных наборов экспериментальных
Из рис. 5 и 6 следует, что спектральные профили
дифференциальных спектров поглощения, из
EADS и соответствующие времена жизни близ
Рис. 5. Дифференциальные спектры, связанные с эволюцией состояний P* (1), P+HA (2) и P+Q– (3), полученные из гло
бального анализа спектрально временных данных в областях Qx (а) и Qy (б) для РЦ Rba. sphaeroides psWt. Времена жизни
состояний P* и P+HA составляют 3,2 и 190 пс соответственно. Состояние P+Q– не спадает на исследованной временной
шкале (2 нс)
Рис. 6. Дифференциальные спектры, связанные с эволюцией состояний P* (1), P+HA- (2) и P+Q– (3), полученные из гло
бального анализа спектрально временных данных в областях Qx (а) и Qy (б) для РЦ Rba. sphaeroides L(M196)H. Времена
жизни состояний P* и P+HA составляют 5,7 и 219 пс соответственно. Состояние P+Q– не спадает на исследованной вре
менной шкале (2 нс)
БИОХИМИЯ том 84 вып. 5 2019
688
ЗАБЕЛИН и др.
ки для двух типов РЦ и согласуются с данными,
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
опубликованными для РЦ дикого типа (см., на
пример, работу Sun et al. [15]). EADS, связанные
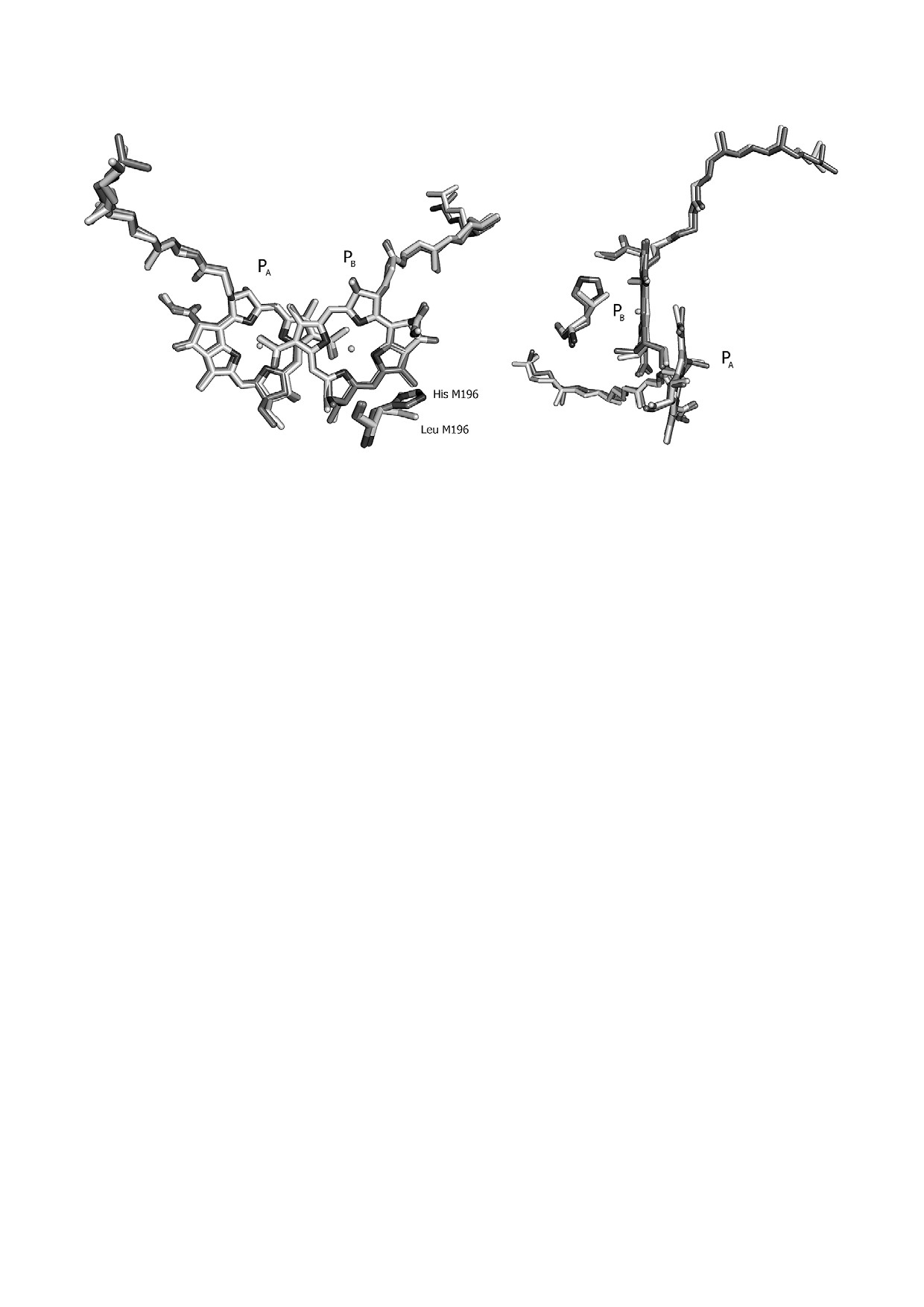
Согласно данным рентгеноструктурного
с временами жизни 3,2 и 5,7 пс, показывают
анализа мутантных РЦ L(M196)H [2], угол меж
спектральные особенности, типичные для воз
ду имидазольной группой гистидина M196 и
бужденного состояния P* (рис. 5 и 6, кривые 1).
плоскостью макроцикла PB оценивается вели
В Qy области обоих спектров наблюдается ши
чиной (103 ± 10)°, что соответствует Т образной
рокая отрицательная полоса, включающая вкла
геометрии взаимного расположения остатка
ды от выцветающей полосы поглощения Р при
гистидина и БХл. Расстояние между атомом азо
~865 нм и стимулированного излучения из P* в
та ND1 гистидина и кольцом C молекулы PB
области ~920 нм, а также характерный положи
составляет (3,8 ± 0,15) Å. Таким образом, вве
тельный пик при 810 нм. В спектральной облас
денный гистидин и молекула PB находятся в
ти Qx присутствует отрицательная полоса при
достаточно близком контакте друг с другом,
600 нм на фоне слабоструктурированного пог
чтобы обеспечить их взаимодействие.
лощения P* в интервале 500-720 нм. Состояние
Из кристаллографической структуры РЦ
P* эволюционирует в состояние с разделенными
L(M196)H видно (рис. 7), что мутация не вызы
зарядами P+H–, для EADS которого характерны
вает глобальных изменений в геометрии димера P.
сохраняющаяся отрицательная полоса при 600 нм,
Наблюдаемые незначительные расхождения в
выцветание Qx полосы поглощения БФео HA
структурах РЦ мутанта и psWt, по видимому, не
при 545 нм и появление полос поглощения ани
выходят за пределы их разрешения. Следова
он радикала H– при ~670 и 960 нм. В Qy облас
тельно, можно заключить, что эксперименталь
ти наблюдаются выцветание полосы поглоще
но наблюдаемые изменения электронной струк
ния Р при ~865 нм и электрохромный сдвиг в
туры P и P+ (рис. 1-3) вызваны взаимодействи
области ~800 нм (рис. 5 и 6, кривые 2). Амплиту
ем между гистидином M196 и π электронной
да выцветания при ~865 нм в EADS для мутант
системой молекулы БХл PB. Согласно литера
ных РЦ уменьшена по отношению к амплитуде
турным данным [1], Т образная ориентация
в EADS для РЦ psWt в соответствии с различия
имидазольного кольца по отношению к плос
ми, наблюдаемыми в спектрах поглощения РЦ
кости ароматической молекулы характерна для
(рис. 1). В течение нескольких сотен пикосекунд
π водородного взаимодействия. Образование
(τ ~ 200 пс) состояние P+HA в обоих типах РЦ
π водородного взаимодействия в мутантных РЦ
переходит в терминальное состояние P+Q–, ко
согласовывалось бы с тем фактом, что мутация
торое не спадает на временной шкале наших из
L(M196)H повышает редокс потенциал пары
мерений (рис. 5 и 6, кривые 3).
P+/P на ~60 мВ по сравнению с РЦ psWt [2].
Таким образом, совокупность результатов
Формирование водородной связи между гисти
фемтосекундных измерений позволяет заключить,
дином и сопряженной системой P, очевидно, де
что последовательность P* → P+H– → P+Q– и
стабилизирует состояние P+ по сравнению с нейт
динамика реакций переноса электрона, вовле
ральным состоянием, затрудняя окисление P и
ченных в разделение зарядов, а также общий
смещая редокс потенциал пары P+/P в положи
выход процесса, наблюдаемые для РЦ psWt, со
тельную область, как это наблюдалось в мутант
храняются практически неизменными в РЦ
ных РЦ при образовании водородных связей
L(M196)H.
между карбонильными группами P и гистидина
Отметим, что в данной работе в глобальном
ми [23, 24]. В связи с этим отметим, что длинно
анализе не учитывалось образование промежу
волновое смещение полосы P в низкотемпера
точного состояния P+B– [16-18], которое в на
турном спектре РЦ L(M196)H [2] согласуется с
тивных РЦ спадает быстрее, чем образуется, что
теоретически рассчитанным влиянием образо
определяет малую степень его заселения и за
вания водородной связи на энергию Qy перехо
трудняет его экспериментальное обнаружение [19].
да P [10].
Однако предварительный анализ дифференци
Интересным в этом контексте является тот
альных спектров для образцов РЦ L(M196)H с
факт, что сходное влияние на низкотемператур
восстановленным QA выявил присутствие сла
ный спектр поглощения РЦ, редокс потенциал P,
бой полосы поглощения при ~1025 нм, которая
электронную структуру P+ и первичную фотохи
может быть отнесена к анион радикалу B– [16,
мию наблюдалось ранее для мутантных РЦ
18] (данные не приведены). Вероятно, двухсту
Rba. sphaeroides L(M160)H, в которых водородная
пенчатый механизм начального переноса элект
связь обычного типа была введена между гисти
рона P* → P+B– → P+H–, характерный для натив
дином M160 и 131 кетокарбонильной группой
ных РЦ (см., например, работу Khatypov et al. [20]),
молекулы БХл PB [12, 25]. В низкотемператур
сохраняется также в мутантных препаратах.
ном (20 К) спектре поглощения РЦ мутанта
БИОХИМИЯ том 84 вып. 5 2019
ЗАМЕНА ЛЕЙЦИНА M196 НА ГИСТИДИН В РЦ БАКТЕРИЙ
689
Рис 7. Наложение кристаллографических структур РЦ Rba. sphaeroides psWt (PDB: 3V3Y; [21]) и мутанта L(M196)H [2] в об
ласти димера первичного донора электрона P в двух проекциях. Отмечены соответствующие аминокислотные остатки в
положении M196. Разрешение структур psWt и L(M196)H составляло 2,8 и 2,4 Å соответственно. Рисунок выполнен в
программе PyMOL [22]
L(M160)H наблюдалось смещение полосы P в
рованными хинонами с короткими боковыми
длинноволновую область и уменьшение ее ин
цепями, семихинонная форма хинонного ак
тенсивности [25]. Потенциал пары P+/P в мутант
цептора A1 может стабилизироваться за счет пе
ных РЦ увеличился на 55 мВ по сравнению с РЦ
реориентации молекулы хинона с последующим
дикого типа [25]. В ИК Фурье спектре P+Q–/PQA
образованием π водородной связи с триптофа
мутанта L(M160)H полоса переноса «дырки» и
ном [26]. На основе квантово химических рас
одна из фазово фононных полос смещались в
четов было предположено также, что CH π вза
высокочастотную область до ~2800 и ~1300 см-1
имодействия между β каротином и хлорофил
соответственно и уменьшались по интенсивнос
лом наряду с π π стэкингом играют важную
ти [12]. Существенно, однако, что падение ин
роль в связывании молекул β каротина в ФС 1
тенсивности ИК полос в спектре L(M160)H [12]
из Synechococcus elongatus [27]. Мутантные РЦ
проявлялось в заметно меньшей степени, чем в
Rba. sphaeroides L(M196)H, по видимому, явля
РЦ L(M196)H (рис. 2, кривая 2; рис. 3, кривая 2),
ются первым примером образования π водород
не затрагивая, в частности, фазово фононную
ной связи между белком и одним из кофакторов
полосу при 1550 см-1. Эти данные могут быть
переноса электрона в бактериальных РЦ. На
объяснены тем, что при образовании обычной
сколько нам известно, кофактор белковые свя
водородной связи в РЦ L(M160)H атом водоро
зи такого типа не были обнаружены в нативных
да N H группы имидазола взаимодействует с
фотосинтетических РЦ, в то время как образо
электронной плотностью кислорода 131 кето
вание обычных водородных связей между бел
карбонильной группы PB, в то время как в слу
ком и редокс активными пигментными и хи
чае π водородной связи атом водорода взаимо
нонными кофакторами играет важную роль в
действует непосредственно с π электронным
оптимизации функции (и, возможно, в поддержа
облаком макроцикла БХл PB, вызывая более
нии структуры) нативных РЦ комплексов [28-30].
сильное возмущение электронной структуры P+
Согласно литературным данным, наиболее бла
в РЦ L(M196)H. Временные константы перено
гоприятной ориентацией для π водородной связи
са электрона с P* на HA и c H– на QA в РЦ мутан
является перпендикулярное расположение связи
та L(M160)H (5,7 и 210 пс соответственно) [25]
X-H донора (Х - атом N, O или С) и плоскости
фактически совпадали с наблюдаемыми в РЦ
π акцептора [1, 31, 32]. Показано также, что в
L(M196)H (5,7 и 219 пс соответственно; настоя
отличие от обычной водородной связи, π водо
щая работа).
родное взаимодействие характеризуется более
Ранее квантово химические расчеты и дан
«мягкой» геометрией, что делает вероятным об
ные ЭПР показали, что в комплексах фотосис
разование большего числа конформаций в более
темы 1 (ФС 1), реконструированных модифици
широком диапазоне энергии связи [32]. Воз
БИОХИМИЯ том 84 вып. 5 2019
690
ЗАБЕЛИН и др.
можно, π водородные связи не обладают замет
Финансирование. Работа выполнена в рамках
ными функциональными преимуществами пе
госзадания № АААА А17030110140 5 и при час
ред обычными водородными связями (напри
тичной поддержке РФФИ (грант № 17 00 00207
мер, в отношении влияния на редокс свойства
КОМФИ - ИК Фурье измерения, фемтосекунд
кофакторов), в то время как достаточно специ
ные измерения; грант № 17 44 500828 - получе
фическая пространственная организация π во
ние образцов РЦ).
дородного взаимодействия и ее потенциальная
Конфликт интересов. Авторы заявляют об от
гетерогенность в отношении энергии связи мог
сутствии конфликта интересов.
ли бы быть, по крайней мере частично, причи
Соблюдение этических норм. Настоящая
нами того, что взаимодействие такого типа не
статья не содержит описания каких либо иссле
реализуется между белком и пигментными и хи
дований с участием людей или использованием
нонными кофакторами в нативных РЦ.
животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Liao, S.M., Du, Q.S., Meng, J.Z., Pang, Z.W., and
12.
Naberdyk, E., Allen, J.P., Taguchi, A.K.W., Williams, J.C.,
Huang, R.B. (2013) The multiple roles of histidine in pro
Woodbury, N.W., and Breton, J. (1993) Fourier transform
tein interactions, Chem. Cent. J., 7, 44-55, doi: 10.1186/
infrared study of the primary electron donor in chroma
1752 153X 7 44.
tophores of Rhodobacter sphaeroides with reaction centers
2.
Fufina, T.Y., Vasilieva, L.G., Gabdulkhakov, A.G., and
genetically modified at residues M160 and L131, Bioche/
Shuvalov, V.A.
(2015) The L(M196)H mutation in
mistry, 32, 13879-13885, doi: 10.1021/bi00213a017.
Rhodobacter sphaeroides reaction center results in new
13.
Reimers, J.R., and Hush, N.S. (2003) Modeling the bacte
electrostatic interactions, Photosynth. Res., 125, 23-29,
rial photosynthetic reaction center. VII. Full simulation of
doi: 10.1007/s11120 014 0062 0.
the intervalence hole transfer absorption spectrum of the
3.
Lutz, M., and Mantele, W. (1991) In Chlorophylls
special pair radical cation, J. Chem. Phys., 119, 3262-3277,
(Scheer, H., ed.), CRC Press, Boca Raton, FL, pp. 855-902.
doi: 10.1063/1.1589742.
4.
Breton, J., Nabedryk, E., and Parson, W.W. (1992) A new
14.
Malferrari, M., Turina, P., Francia, F., Mezzetti, A., Leibl, W.,
infrared electronic transition of the oxidized primary elec
and Venturoli, G. (2015) Dehydration affects the electronic
tron donor in bacterial reaction centers: a way to assess
structure of the primary electron donor in bacterial photo
resonance interactions between the bacteriochlorophylls,
synthetic reaction centers: evidence from visible NIR and
Biochemistry, 31, 7503-7510, doi: 10.1021/bi00148a010.
light induced difference FTIR spectroscopy, Photochem.
5.
Gabdulkhakov, A.G., Fufina, T.Y., Vasilieva, L.G.,
Photobiol. Sci., 14, 238-251, doi: 10.1039/c4pp00245h.
Mueller, U., and Shuvalov, V.A. (2013) Expression, purifi
15.
Sun, C., Carey, A. M., Gao B. R., Wraight, C.A.,
cation, crystallization and preliminary X ray structure
Woodbury, N.W., and Lin, S. (2016) Ultrafast electron
analysis of wild type and L(M196)H mutant Rhodobacter
transfer kinetics in the lm dimer of bacterial photosynthetic
sphaeroides reaction centres, Acta. Crystallogr. Sect. F, 69,
reaction center from Rhodobacter sphaeroides, J. Phys.
506-509, doi: 10.1107/S1744309113006398.
Chem. B, 120, 5395-5404, doi: 10.1021/acs.jpcb.6b05082.
6.
Zabelin, A.A., Fufina, T.Y., Vasilieva, L.G., Shkuropatova, V.A.,
16.
Arlt, T., Schmidt, S., Kaiser, W., Lauterwasser, C., Meyer, M.,
Zvereva, M.G., Shkuropatov, A.Y., and Shuvalov, V.A. (2009)
Scheer, H., and Zinth, W. (1993) The accessory bacteri
Mutant reaction centers of Rhodobacter sphaeroides I(L177)H
ochlorophyll: a real electron carrier in primary photosyn
with strongly bound bacteriochlorophyll a: structural pro
thesis, Proc. Natl. Acad. Sci. USA, 90, 11757-11761, doi: 10.
perties and pigment-protein interactions, Biochemistry
1073/pnas.90.24.11757.
(Moscow), 74, 68-74, doi: 10.1134/S0006297909010106.
17.
Shkuropatov, A.Ya., and Shuvalov, V.A. (1993) Electron
7.
Khatypov, R.A., Khristin, A.M., Fufina, T.Yu., and
transfer in pheophytin a modified reaction centers from
Shuvalov, V.A. (2017) An alternative pathway of light
Rhodobacter sphaeroides (R 26), FEBS Lett., 322, 168-172,
induced transmembrane electron transfer in photosynthetic
doi: 10.1016/0014 5793(93)81561 D.
reaction centers of Rhodobacter sphaeroides, Biochemistry
18.
Kennis, J.T.M., Shkuropatov, A.Ya., van Stokkum, I.H.M.,
(Moscow), 82, 692-697, doi: 10.1134/S0006297917060050.
Gast, P., Hoff, A.J., Shuvalov, V.A., and Aartsma, T.J.
8.
Van Stokkum, I.H.M., Larsen, D.S., and van Grondelle, R.
(1997) Formation of a long lived P+BA- state in plant
(2004) Global and target analysis of time resolved spectra,
pheophytin exchanged reaction centers of Rhodobacter
Biochim. Biophys. Acta, 1657, 82-104, doi: 10.1016/j.
sphaeroides R26 at low temperature, Biochemistry, 36,
bbabio.2004.04.011.
16231-16238, doi: 10.1021/bi9712605.
9.
Snellenburg, J.J., Laptenok, S.P., Seger, R., Mullen, K.M.,
19.
Zinth, W., and Wachtveitl, J. (2005) The first picoseconds
and van Stokkum, I.H.M. (2012) Glotaran: a Java based
in bacterial photosynthesis - ultrafast electron transfer for
graphical user interface for the R package TIMP, J. Stat.
the efficient conversion of light energy, Chem. Phys. Chem.,
Soft., 49, 1-22, doi: 10.18637/jss.v049.i03.
6, 871-880, doi: 10.1002/cphc.200400458.
10.
Thompson, M.A., Zerner, M.C., and Fajer, J. (1991) A theo
20.
Khatypov, R.A., Khmelnitskiy, A.Yu., Khristin, A.M.,
retical examination of the electronic structure and excited
Fufina, T.Yu., Vasilieva, L.G., and Shuvalov, V.A. (2012)
states of the bacterlochlorophyll b dimer from Rhodo/
Primary charge separation within P870* in wild type and
pseudomonas viridis, J. Phys. Chem., 95, 5693-5700, doi: 10.
heterodimer mutants in femtosecond time domain,
1021/j100167a058.
Biochim. Biophys. Acta, 1817, 1392-1398, doi: 10.1016/j.
11.
Parson, W.W., and Warshel, A. (1987) Spectroscopic proper
bbabio.2011.12.007.
ties of photosynthetic reaction centers. 2. Application of
21.
Vasilieva, L.G., Fufina, T.Y., Gabdulkhakov, A.G., Leo
the theory to Rhodopseudomonas viridis, J. Am. Chem. Soc.,
nova, M.M., Khatypov, R.A., and Shuvalov, V.A. (2012)
109, 6152-6163, doi: 10.1021/ja00254a040.
The site directed mutation I(L177)H in Rhodobacter
БИОХИМИЯ том 84 вып. 5 2019
ЗАМЕНА ЛЕЙЦИНА M196 НА ГИСТИДИН В РЦ БАКТЕРИЙ
691
sphaeroides reaction center affects coordination of PA and
tum chemical analysis, Biophys. J., 86, 3097-3111, doi: 10.
BB bacteriochlorophylls, Biochim. Biophys. Acta, 1817,
1016/S0006 3495(04)74358 1.
1407-1417, doi: 10.1016/j.bbabio.2012.02.008.
28. Allen, J.P., and Williams, J.C. (2006) In Chlorophylls and
22. DeLano, W.L. (2002) The PyMOL molecular graphics sys
bacteriochlorophylls: biochemistry, biophysics, functions and
applications (Grimm, B., Porra, R.J., Rudiger, W., and
23. Lin, X., Murchison, H.A., Nagarajan, V., Parson, W.W.,
Scheer, H., eds), Springer, The Netherlands, pp. 283-295.
Allen, J.P., and Williams, J.C. (1994) Specific alteration of
29. Bylina, E.J., Kirmaer, C., McDowell, L., Holten, D., and
the oxidation potential of the electron donor in reaction
Youvan, D.C. (1988) Influence of an aminoacid residue on
centers from Rhodobacter sphaeroides, Proc. Natl. Acad. Sci.
the optical properties and electron transfer dynamics of a
USA, 91, 10265-10269, doi: 10.1073/pnas.91.22.10265.
photosynthetic reaction centre complex, Nature, 336,
24. Allen, J.P., and Williams, J.C. (1995) Relationship between
182-184, doi: 10.1038/336182a0.
the oxidation potential of the bacteriochlorophyll dimer
30. Flores, M., Isaacson, R., Abresch, E., Calvo, R., Lubitz, W.,
and electron transfer in photosynthetic reaction centers,
and Feher, G. (2007) Protein-cofactor interactions in bac
J. Bioenerg. Biomembr., 27, 275-283, doi: 10.1007/BF02110097.
terial reaction centers from Rhodobacter sphaeroides R 26:
25. Williams, J.C., Alden, R.G., Murchison, H.A., Pelo
II. Geometry of the hydrogen bonds to the primary
quin, J.M., Woodbury, N.W., and Allen, J.P. (1992) Effects
quinone Q– by 1H and 2H ENDOR spectroscopy, Biophys. J.,
of mutations near the bacteriochlorophylls in reaction cen
92, 671-682, doi: 10.1529/biophysj.106.092460.
ters from Rhodobacter sphaeroides, Biochemistry, 31,
31. Steiner, T., and Koellner, G. (2001) Hydrogen bonds with
11029-11037, doi: 10.1021/bi00160a012.
π acceptors in proteins: frequencies and role in stabilizing
26. Kaupp, M. (2002) The function of photosystem I. Quan
local 3D structure, J. Mol. Biol., 305, 535-557, doi: 10.
tum chemical insight into the role of tryptophan-quinone
1006/jmbi.2000.4301.
interactions, Biochemistry, 41, 2895-2900, doi: 10.1021/
32. Du, Q. S., Wang, Q. Y., Du, L. Q., Chen, D., and
bi0159783.
Huang, R. B. (2013) Theoretical study on the polar hydro
27. Wang, Y., Mao, L., and Hu, X. (2004) Insight into the
gen р (Hp р) interactions between protein side chains,
structural role of carotenoids in the photosystem I: a quan
Chem. Cent. J., 7, 92-99, doi: 10.1186/1752 153X 7 92.
EFFECTS OF SUBSTITUTION OF LEUCINE M196
BY HISTIDINE ON THE ELECTRONIC STRUCTURE
OF THE PRIMARY ELECTRON DONOR AND ELECTRON
TRANSFER IN REACTION CENTERS FROM
Rhodobacter sphaeroides
A. A. Zabelin, T. Yu. Fufina, A. M. Khristin, R. A. Khatypov,
V. A. Shkuropatova, V. A. Shuvalov, L. G. Vasilieva,
and A. Ya. Shkuropatov*
Institute of Basic Biological Problems of the Russian Academy of Sciences,
Pushchino Scientific Center for Biological Research of the Russian Academy of Sciences,
142290 Pushchino, Moscow Region, Russia; E/mail: ashkur@mail.ru
Received November 13, 2018
Revised December 27, 2018
Accepted December 27, 2018
In our recent X ray study, we demonstrated that substitution of the natural leucine residue M196 with histidine in the
reaction center (RC) from Rhodobacter (Rba.) sphaeroides leads to formation of a close contact between the geneti
cally introduced histidine and the primary electron donor P, a dimer of bacteriochlorophylls (BChls) PA and PB, cre
ating a novel pigment-protein interaction that is not observed in native RCs. In the present work, the possible nature
of this novel interaction and its effects on the electronic properties of P and the photochemical charge separation in
isolated mutant RCs L(M196)H are investigated at room temperature using stationary absorption spectroscopy, light
induced difference FTIR spectroscopy, and femtosecond transient absorption spectroscopy. The results are compared
with the data obtained for RCs from Rba. sphaeroides pseudo wild type strain. It is shown that the L(M196)H muta
tion results in a decrease of intensity and broadening of the long wavelength Qy absorption band of P at ~865 nm. Due
to the mutation, there is also weakening of the electronic coupling between BChls in the radical cation P+ and increase
in the positive charge localization on the PA molecule. Despite the significant perturbations of the electronic structure
of P, the mutant RCs retain high electron transfer rates and quantum yield of the P+Q– state (QA is the primary
quinone acceptor), which is close to the one observed in the native RCs. Comparison of our results with the literature
data suggests that the imidazole group of histidine M196 forms a π hydrogen bond with the π electron system of the
PB molecule in the P dimer. It is likely that the specific (T shaped) spatial organization of the π hydrogen interaction
and its potential heterogeneity in relation to the bonding energy is, at least partially, the reason that this type of
interaction between the protein and the pigment and quinone cofactors is not realized in the native RCs.
Keywords: bacterial reaction center, amino acid replacement, primary electron donor, electronic structure, electron
transfer, Rhodobacter sphaeroides
БИОХИМИЯ том 84 вып. 5 2019