БИОХИМИЯ, 2019, том 84, вып. 5, с. 704 - 718
УДК 577.124
ЧУВСТВИТЕЛЬНЫЙ К L АРАБИНОЗЕ ФАКТОР
ТРАНСКРИПЦИИ AraR ОТРИЦАТЕЛЬНО РЕГУЛИРУЕТ
УСТОЙЧИВОСТЬ Mycobacterium smegmatis К ИЗОНИАЗИДУ*
© 2019 L. Zhou1, Z. G. He1, W. Li1,2**
1 National Key Laboratory of Agricultural Microbiology, College of Life
Science and Technology, Huazhong Agricultural University,
Wuhan 430070, China; E mail: lwhlbx@163.com
2 State Key Laboratory for Conservation and Utilization of Subtropical
Agro bioresources, College of Life Science and Technology,
Guangxi University, Nanning 530004, China
Поступила в редакцию 09.09.2018
После доработки 06.01.2019
Принята к публикации 24.01.2019
L Арабиноза является важным компонентом клеточной стенки микобактерий. Она участвует в синтезе ара
биногалактана и арабинозы, маннозы и других сахаров, что оказывает влияние на проницаемость клеточ
ной стенки и лекарственную устойчивость. Однако до сих пор неясно, может ли L арабиноза действовать в
качестве эффективной молекулы, влияющей на устойчивость микобактерий к антибиотикам. Также не вы
яснен регуляторный механизм, определяющий ее действие. В настоящей работе нами был охарактеризован
новый транскрипционный фактор AraR из Mycobacterium smegmatis, который реагирует на L арабинозу и ре
гулирует чувствительность микобактерий к изониазиду (INH). Было показано, что AraR специфически рас
познает два консервативных мотива длиной 15 п.н. в вышележащем регуляторном участке арабинозного
оперона, обозначаемого как araR оперон. AraR функционирует как репрессор транскрипции и осуществля
ет отрицательную регуляцию экспрессии оперона. В отличие от действия AraR, сверхэкспрессия araR опе
рона способствует развитию устойчивости микобактерий к INH. Поразительно, что L арабиноза может
действовать в качестве эффективной молекулы и приводить к дерепрессии ингибирования транскрипции
AraR. Штамм с нокаутом AraR был более устойчив к INH, чем штамм дикого типа, в то время как штамм со
сверхэкспрессией AraR был более чувствителен к препарату. Добавление в среду L арабинозы может значи
тельно повышать устойчивость штамма дикого типа, но не оказывает влияние на штамм с нокаутом гена
AraR. Таким образом, в настоящей работе был выявлен новый фактор транскрипции, чувствительный к
L арабинозе, и установлена регуляция его активности при возникновении устойчивости бактерий к анти
биотикам. Эти результаты дают ключ к дальнейшему пониманию механизма регуляции с участием молекул
сахаров и ее взаимосвязи с лекарственной устойчивостью микобактерий.
КЛЮЧЕВЫЕ СЛОВА: AraR, микобактерии, L арабиноза, устойчивость к антибиотикам.
DOI: 10.1134/S0320972519050087
В последние годы широкое распространение
востью [2]. Необходимо как можно скорее выя
различных бактерий, устойчивых к антибиоти
вить регуляторные механизмы, лежащие в осно
кам, продолжает угрожать здоровью человека.
ве бактериальной лекарственной устойчивости,
По данным на 2016 г., в мире от туберкулеза,
для последующей разработки новых противоту
вызванного Mycobacterium tuberculosis, страдали
беркулезных препаратов.
10,4 млн человек [1]. Ситуация с туберкулезной
Ранее были опубликованы работы, посвя
инфекцией усложнилась в связи с тем, что пос
щенные исследованию механизмов, обусловли
тоянно образуются новые штаммы возбудителя
вающих возникновение устойчивости микобак
со множественной лекарственной устойчи
терий к действию антибиотиков. У бактерий
Принятые сокращения: AG - арабиногалактан; AraR - транскрипционный фактор из Mycobacterium smegmatis;
CFU - колониеобразующие единицы; EMSA - анализ сдвига электрофоретической подвижности; FITC - флуоресцеин
изотиоцианат; INH - изониазид; LAM - липоарабиноманнан; RT PCR - полимеразная цепная реакция с обратной транс
крипцией; qRT PCR - количественная полимеразная цепная реакция в реальном времени с обратной транскрипцией;
WT - дикий тип.
* Приложение к статье на английском языке опубликовано на сайте журнала «Biochemistry» (Moscow) и на сайте издатель
ства Springer (Link.springer.com), том 84, вып. 5, 2019.
** Адресат для корреспонденции.
704
AraR РЕГУЛИРУЕТ УСТОЙЧИВОСТЬ МИКОБАКТЕРИЙ К АНТИБИОТИКАМ
705
широко распространены клеточные стенки, ас
ное влияние на проницаемость клеточной стен
социированные с природными насосами и
ки и лекарственную устойчивость [16, 17].
транспортерами. Эти насосы поддерживают
В целом метаболизм L арабинозы у многих
клеточный гомеостаз и регулируют трансмемб
видов бактерий регулируется арабинозным опе
ранный транспорт лекарственных препаратов [3].
роном [18, 19]. У Bacillus subtilis гены araA, araB и
Показано, что у микобактерий некоторые из
araC кодируют изомеразу L арабинозы, L рибу
этих транспортеров или откачивающих насосов
локиназу, регулятор и L рибулоза 5 фосфат 4 эпи
способствуют повышению устойчивости к изо
меразу соответственно. Продукты генов araN,
ниазиду (INH), рифампицину, тетрациклину и
araP и araQ представляют собой транспортные
другим токсичным соединениям [4-6]. В част
системы, зависимые от связывания с белками [18].
ности, миколовые кислоты являются основны
У Escherichia coli арабинозный оперон включает
ми компонентами клеточной стенки микобак
в себя: AraA (изомераза), AraB (рибулокиназа),
терий, в значительной степени обеспечивающи
AraC (регулятор), AraD (эпимераза) и AraEFGH
ми непроницаемость и устойчивость к антибио
(транспортер для поглощения L арабинозы) [19].
тикам [7, 8]. Изменения компонентов клеточ
В большинстве случаев у бактерий экспрессия
ной стенки могут приводить к снижению про
арабинозного оперона используется для утили
ницаемости для препаратов, поступающих в
зации L арабинозы. Однако нет ответа на воп
клетку. Примером может служить virS регулиру
рос о том, связан ли арабинозный оперон с устой
емая монооксигеназа MymA клеточной стенки,
чивостью к антибиотикам.
которая поддерживает синтез миколовой кисло
В последние годы выявлена взаимосвязь
ты и повышает целостность клеточной стенки.
между регуляцией транскрипции генов, связан
Мутации в virS-mymA приводят к увеличению
ных с синтезом клеточной стенки, и лекарствен
проницаемости клеточной стенки и диффузии
ной устойчивостью микобактерий [20, 21]. Од
препаратов внутрь клетки [9, 10]. У Mycobacterium
нако оставалось неизвестным, может ли L ара
smegmatis фосфатаза фосфолипидов Ms6402 ре
биноза выступать в качестве эффективной мо
гулирует синтез D арабинозы, а также арабино
лекулы, и каким образом она играет роль в ини
галактана (AG). Изменение уровня экспрессии
циировании механизма регуляции лекарствен
Ms6402 влияет на устойчивость микобактерий
ной устойчивости микобактерий. В настоящей ра
или чувствительность к противотуберкулезным
боте нами был охарактеризован в клетках M. smeg
препаратам [11]. Кроме того, блокирование взаи
matis новый отвечающий на L арабинозу фактор
модействий лекарств и белков мишеней и мо
транскрипции AraR, который регулирует экс
дификация самого препарата либо его непосред
прессию арабинозного оперона и чувствитель
ственной мишени также приводят к формирова
ность к антибиотикам. Полученные нами ре
нию лекарственной устойчивости [12, 13]. На
зультаты могут способствовать пониманию ме
пример, метилтрансфераза Rv0560c может на
ханизма формирования устойчивости микобак
прямую модифицировать лекарственные препа
терий к действию антибиотиков.
раты, что, в конечном итоге, приводит к возник
новению устойчивости M. tuberculosis к антибио
тикам [14].
МЕТОДЫ ИССЛЕДОВАНИЯ
В качестве модельного штамма для исследо
вания механизмов регуляции транскрипции ви
Штаммы, плазмиды, ферменты, реагенты.
рулентных видов микобактерий была использо
Штамм Escherichia coli BL21 и вектор pET28a
вана М. smegmatis, являющаяся непатогенной
были приобретены у компании «Novagen», Гер
микобактерией. Уникальная структура клеточ
мания (табл. S1 Приложения); ДНК лигаза Т4,
ной стенки микобактерий наделяет их способ
ДНК полимераза, dNTP и все ферменты рест
ностью противостоять суровым условиям окру
рикции - у «TaKaRa Biotech», Япония. Прайме
жающей среды и, в то же время, обеспечивает их
ры для ПЦР были синтезированы в компании
устойчивость к различным антибиотикам [15].
«Tsingke», Китай (табл. S2 Приложения).
L Арабиноза является второй по распростра
Клонирование гена, экспрессия и очистка ре
ненности альдопентозой после ксилозы у расте
комбинантного белка AraR. Ген araR и другие
ний, а также важным компонентом клеточной
родственные гены из геномной ДНК M. smeg
стенки различных микроорганизмов, влияю
matis mc2155 были амплифицированы с по
щим на широкий спектр физиологических про
мощью ПЦР с использованием эффективных
цессов бактерий. В качестве важного компонен
праймеров (табл. S2 Приложения). Эти гены были
та клеточной стенки микобактерий L арабиноза
клонированы в экспрессионные векторы pET28a
участвует в синтезе AG, липоарабиноманнана
и pMV261. Для экспрессии рекомбинантного
(LAM) и других сахаров, оказывает существен
белка плазмидой pET28a araR трансформирова
БИОХИМИЯ том 84 вып. 5 2019
706
ZHOU и др.
ли клетки штамма BL21 Е. coli. Экспрессионные
вали в 100 мкл ТЕ буфера (20 мМ Tris HCl, рН 7,8;
штаммы культивировали в среде LB при 37 °C до
10 мМ ЭДТА; 0,5% SDS). Затем комплексы раз
достижения OD600 0,6. Затем в культуру добавля
рушали в течение 6 ч при 65 °С. Образцы ДНК
ли 0,3 мМ изопропил в D 1 тиогалактопирано
исходных образцов и преципитированных анти
зида, и штаммы культивировали в течение 6 ч
телами комплексов хроматина очищали и ана
при 25 °С. Клетки собирали, белки очищали на
лизировали с помощью ПЦР.
Ni2+ аффинных колонках, как описано ранее [22].
Футпринтинг с использованием ДНКазы I. Про
Элюат диализовали в течение ночи и хранили
моторную область araR оперона длиной 399 п.н.
при -80 °С.
амплифицировали методом ПЦР с использова
Бактериальный одногибридный анализ. Бакте
нием эффективных праймеров, меченных FITC.
риальный одногибридный анализ проводили,
Амплифицированный продукт очищали с по
как описано ранее [23]. Комбинированный про
мощью набора для очистки ДНК («BioFlux») и
мотор аraR клонировали в вектор pBXcmT, аraR -
затем подвергали связыванию с белком, как и в
в вектор pTRG («Stratagene», США). Селектив
случае EMSA. Более подробно этот метод был
ная среда для скрининга методом бактериально
описан ранее [25] и выполнен с некоторыми из
го одногибридного анализа в планшете содер
менениями. Все реакционные смеси были под
жала 16 мкг/мл стрептомицина, 15 мкг/мл тет
вергнуты расщеплению ДНКазой I (1 ед; «Fer
рациклина, 34 мкг/мл хлорамфеникола, 30 мкг/мл
mentas China Co.», Китай) в течение 3 мин при
канамицина и 20 мМ 3 АТ (3 амино 1,2,4 триа
37 °C. Полученные данные анализировали с ис
зол).
пользованием ДНК анализатора 37030XL фир
Анализ сдвига электрофоретической подвиж
мы «Applied Biosystems» (произведен компанией
ности (EMSA). Субстраты ДНК для проведения
«Tsingke», Китай).
анализа амплифицировали с помощью ПЦР с
Количественная ПЦР в реальном времени с
геномной ДНК M. smegmatis mc2155 с использо
обратной транскрипцией (RT qPCR). Выделение
ванием эффективных праймеров или прайме
мРНК из клеток Msm/pMV261, Msm/pMV261 araR,
ров, синтезированных в компании «Tsingke»,
Msm/WT и Msm/araR::hyg проводили с по
Китай (табл. S2 Приложения). Фрагмент ДНК
мощью набора RNApure Kit («Zomanbio», Китай)
метили FITC для проведения конкурентного
согласно инструкции производителя. При про
анализа ДНК. Реакционная смесь (20 мкл) со
ведении ПЦР с обратной транскрипцией (RT
держала Tris HCl (рН 8,0), 10 мм MgСl2, 50 мм
PCR - reverse transcription polymerase chain reac
NaСl; белок; фрагмент ДНК; ddH2O и 2,5% гли
tion) использовали геноспецифичные праймеры
церина. Субстраты ДНК инкубировали совмест
(табл. S2 Приложения), кДНК первой цепи син
но с белком при комнатной температуре в тече
тезировали с помощью набора RT PCR Kit
ние 25 мин. Затем смеси подвергали нативному
(«Aidlab», Китай) согласно инструкции произ
электрофорезу в 5% ном ПААГ. Результаты
водителя. Количественную ПЦР в реальном вре
электрофореза визуализировали с помощью
мени (qPCR - quantitative real time PCR) прово
сканера Typhoon («GE Healthcare»).
дили, используя 20 мкл реакционной смеси,
Иммунопреципитация хроматина. Анализ им
состоявшей из 10 мкл 2× SYBR qPCR Mix Kit
мунопреципитации хроматина (ChIP) проводи
(«Aidlab», Китай), 200 нM каждого праймера и
ли, как описано ранее, с некоторыми изменени
2 мкл образца кДНК из RT PCR. Каждую реак
ями [24]. Клетки M. smegmatis mc2155 выращива
цию проводили 3 раза. Амплификацию и обна
ли до достижения OD600 ~ 1,0…1,2 в 100 мл сре
ружение продуктов осуществляли с помощью
ды 7H9. Затем клетки фиксировали в 1% ном
прибора CFX96 («Bio Rad», США) согласно
формальдегиде в течение 30 мин. Процесс фик
следующему протоколу: 95 °C - 5 мин, затем
сации останавливали добавлением 0,125 М гли
40 циклов: 95 °C - 15 с, 60 °С - 15 с, 72 °C - 45 с;
цина на 5 мин. Клетки собирали и ресуспенди
кривая плавления 55-99 °С, шаг 0,5 °С за 10 с;
ровали в 1 мл Tris буфера (20 мм Tris HCl, рН 7,5;
25 °С - 5 мин. Полученные данные анализиро
150 мМ NaCl; 0,1% Tween 20; 0,1% Triton Х 100).
вали с помощью CFX Manager, версия 2.1 («Bio
Затем клетки подвергали обработке ультразву
Rad», США). Специфичность амплификации
ком на льду, центрифугировали и собирали су
оценивали путем анализа кривой плавления.
пернатант. К образцам добавляли специфичес
Уровни экспрессии генов нормализовали отно
кие антитела или преиммунную сыворотку при
сительно уровня транскриптов гена sigA [26].
покачивании в течение 3 ч при 4 °С. Иммунопре
Степень изменения уровня экспрессии рассчи
ципитацию образовавшихся комплексов прово
тывали с помощью метода 2-ΔΔCt [27]. Для ста
дили с помощью 20 мкл 50% ной белок А агаро
тистической обработки полученных результа
зы в течение 1 ч при 4 °С. Иммунные комплексы
тов использовали двусторонний критерий Стью
осаждали центрифугированием и ресуспендиро
дента.
БИОХИМИЯ том 84 вып. 5 2019
AraR РЕГУЛИРУЕТ УСТОЙЧИВОСТЬ МИКОБАКТЕРИЙ К АНТИБИОТИКАМ
707
Анализ активности β галактозидазы. Опреде
выявлено каких либо заметных различий в кри
ление активности β галактозидазы проводили с
вых роста этих штаммов. В то же время при до
целью выявления регуляторной активности AraR.
бавлении 6 мкг INH в культуральную среду рост
Нами были сконструированы рекомбинантные
штамма со сверхэкспрессией araR замедлялся в
плазмиды pMV261 Ms1712p lacZ и pMV261
сравнении с контрольным штаммом дикого типа,
Ms6769p lacZ, которыми были трансформиро
тогда как в этих условиях рост мутантного штамма
ваны штаммы дикого типа и мутантный штамм
с делецией гена araR (Msm araR::hyg/pMV261)
ΔaraR. Все штаммы выращивали в среде 7H9
значительно улучшался (рис. 1, b).
при 37 °C до достижения OD600 0,8-1,2. Измере
ние активности β галактозидазы проводили, как
описано ранее [28].
Построение кривых роста микобактерий и изу
а
чение влияния антибиотиков на рост микобакте
×1
×10
×100
×1000
рий. Штаммы с рекомбинантным геном araR
выращивали в среде 7H9 при 37 °C до значений
OD600 1,5-1,7. Затем каждую культуру разводили
Msm/pMV261
no dgug
в 100 мл свежеприготовленной среды 7H9, со
державшей INH и L арабинозу. Исходное значе
Msm/
ние OD600 составляло 0,1. Далее культуры инку
pMV261 araR
бировали при 37 °C и покачивании (160 об/мин).
В различные моменты времени на планшеты на
×1
×10
×100
×1000
носили последовательные разведения образцов
для определения CFU (colony forming units).
Msm/pMV261
Аликвоты отбирали в указанные моменты вре
2 μg/ml INH
мени.
Msm/
pMV261 araR
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
b
Msm/pMV261
AraR осуществляет отрицательную модуляцию
Msm araR::hyg/pMV261
чувствительности M. smegmatis к изониазиду. Ис
Msm/pMV261 araR
пользуя стратегию, сходную с опубликованной
8,8
Msm araR::hyg/pMinD araR
ранее [29], нами был проведен скрининг библио
8,4
теки экспрессируемых регуляторных факторов
6 μg/ml INH
M. smegmatis. Эта библиотека содержит ~500 фак
8,0
торов транскрипции, каждый из которых повы
шенно экспрессируется под сильным промото
7,6
ром hsp60 [29]. Был успешно выделен фактор
7,2
транскрипции, входящий в семейство LacI и ко
дируемый геном Ms1708, и обозначен как AraR
6,8
(рис. S1 Приложения). Как показано на рис. 1, a,
0
8
16
24
32
40
48
56
штамм со сверхэкспрессией araR при помеще
Time, h
нии на планшет был более чувствителен к INH в
сравнении со штаммом дикого типа, содержа
Рис. 1. AraR опосредует чувствительность M. smegmatis к
щим пустую плазмиду pMV261 (рис. 1, a, ниж
изониазиду (INH). a - Чувствительность к INH штамма со
няя панель). Поэтому можно предположить, что
сверхэкспрессией araR. Клетки штамма со сверхэкспрес
сверхэкспрессия araR вызывает ингибирование
сией araR и штамма дикого типа разводили последователь
роста рекомбинантного штамма микобактерий
но в 10 раз с получением четырех концентраций, равные
на планшете, содержащем INH.
количества клеточной культуры помещали в ячейки план
шета 7H10 в отсутствии (верхняя панель) или в присут
Далее мы построили кривые роста микобак
ствии 2 мкг/мл INH (нижняя панель); b - определение
терий и получили подтверждение регуляторного
влияния AraR на чувствительность клеток M. smegmatis к
влияния AraR на чувствительность M. smegmatis
INH. Штаммы M. smegmatis с повышенной экспрессией araR,
к INH. Так, были впервые получены мутантный
с удаленным геном araR и его комплементарные штаммы
культивировали в среде 7H9 и определили кривые их роста.
штамм с делецией гена araR (Msm araR::hyg/
Столбики ошибок представляют собой стандартное откло
pMV261) и комплементарный ему штамм (Msm
нение (SD) при трех биологических повторах; * p
0,05
araR::hyg/pMinD araR). Как показано на рис. S2
(статистически значимые различия между рекомбинант
Приложения, в отсутствии препарата не было
ными штаммами и штаммами дикого типа)
БИОХИМИЯ том 84 вып. 5 2019
708
ZHOU и др.
Таким образом, эти результаты свидетель
(рис. 2, b, правая панель). В то же время не было
ствуют о том, AraR осуществляет отрицательную
обнаружено различий в росте этих двух штам
модуляцию чувствительности клеток M. smeg
мов при культивировании в отсутствии INH
matis к INH.
(рис. 2, b, левая панель).
Экспрессия araR оперона вносит вклад в ус
В целом повышенная экспрессия araR опе
тойчивость микобактерий к изониазиду. Ген аraR
рона вносит вклад в устойчивость микобактерий
локализован в вышележащем участке кластера
к INH, что прямо противоположно действию
генов Ms1708-1715 генома M. smegmatis, кото
AraR.
рый обозначается как araR оперон (рис. 2, a),
AraR специфически связывается с вышележа
кодирующий оперон арабинозы. Чтобы проана
щей последовательностью araR оперона. Обрат
лизировать регуляторный путь, с помощью ко
ный эффект регулятора AraR на его оперон
торого AraR оказывает влияние на устойчивость
предполагает, что AraR оказывает прямое регу
к INH, нами был сконструирован штамм со
лирующее действие на экспрессию araR оперо
сверхэкспрессией araR оперона кластера генов
на. Чтобы проверить это предположение, мы
(Msm/pMV261 Ms1709-1715) и проведено срав
сначала с помощью метода бактериального од
нение роста клеток этого штамма и штамма ди
ногибридного анализа изучили возможность
кого типа в присутствии и в отсутствии препара
связывания AraR с вышележащей регуляторной
та. Как показано на рис. 2, b, число колоний
последовательностью длиной 399 п.н. (Ms1712p)
штамма со сверхэкспрессией кластера генов
между Ms1712 и Ms1713. Как показано на рис. 3, a,
превышало (статистически значимые различия)
штамм, служащий в качестве положительного
число колоний штамма дикого типа в три раз
контроля, продемонстрировал активный рост,
личных момента времени (28, 32 или 36 ч) при
однако штамм, использующийся в качестве от
добавлении в культуральную среду 6 мкг INH
рицательного контроля, и самоактивирующий
а
Regulatory sequence (Ms1712p)
399 bp
AraR
Ms1709 Ms1710 Ms1711 Ms1712
Ms1713
Ms1714 Ms1715
b
Msm/pMV261
Msm/pMV261
Msm/pMV261 Ms1709-1715
Msm/pMV261 Ms1709-1715
9,0
9,0
no dgug
6 μg/ml INH
8,5
8,5
8,0
8,0
7,5
7,5
28
32
36
28
32
36
Time, h
Рис. 2. Влияние генов araR оперона на чувствительность микобактерий к изониазиду (INH). a - Распределение araR и со
седних к нему генов в геноме M. smegmatis; b - влияние сверхэкспрессии генов araR оперона на устойчивость клеток
M. smegmatis к действию INH. Число колоний определяли в три определенных момента времени (28, 32 и 36 ч) в присут
ствии 6 мкг/мл INH и в его отсутствии. Столбики ошибок представляют разброс значений, полученных в результате трех
биологических повторов. Значения p были рассчитаны с использованием непарного двухвыборочного t критерия Стью
дента с помощью программы GraphPad Prism 5; ** p < 0,01 (статистически значимые различия между двумя группами)
БИОХИМИЯ том 84 вып. 5 2019
AraR РЕГУЛИРУЕТ УСТОЙЧИВОСТЬ МИКОБАКТЕРИЙ К АНТИБИОТИКАМ
709
ся контрольный штамм, содержащий либо
арабинозного оперона. Затем мы подтвердили
AraR, либо только ДНК, не росли на среде, ис
это наблюдение in vivo на клетках M. smegmatis с
пользованной для проведения скрининга. Это
помощью метода иммунопреципитации хрома
указывает на то, что репортерная система рабо
тина (ChIP). Как показано на рис. 3, b, мишень
тает хорошо. Удивительно, но репортерный
для действия белка AraR, промотор (Ms1712p),
штамм, который содержал AraR и его ДНК ми
может специфически быть возвращена в натив
шень (Ms1712p), продемонстрировали хороший
ное состояние с помощью антител против AraR
рост на той же среде, что указывает на наличие
(левая панель, дорожка 2). Напротив, промотор
взаимодействия AraR с промотором (Ms1712p)
отрицательного контроля (Ms6769p) не может
а
b
CK+
CK-
pTRG araR/
pBX Ms1712p
Lanes
1
2
3
Lanes
1
2
3
pTRG/
pBX Ms1712p
Ms1712p
Ms1712p
pTRG araR/
pBX
Ms6769p
Ms6769p
pTRG araR/
pBX Ms6769p
ChIP in M. smegmatis
ChIP in araR deleted strains
pTRG/
pBX Ms6769p
c
AraR (0,15 μM)
Unlabelled
Unlabelled
AraR (0-0,2 μМ)
Ms6769p
Ms1712p
Ms6769p
Lanes
1
2
3
4
5
6
7
8
9
10
11
12
13
DNA/Protein complex
DNA substrate
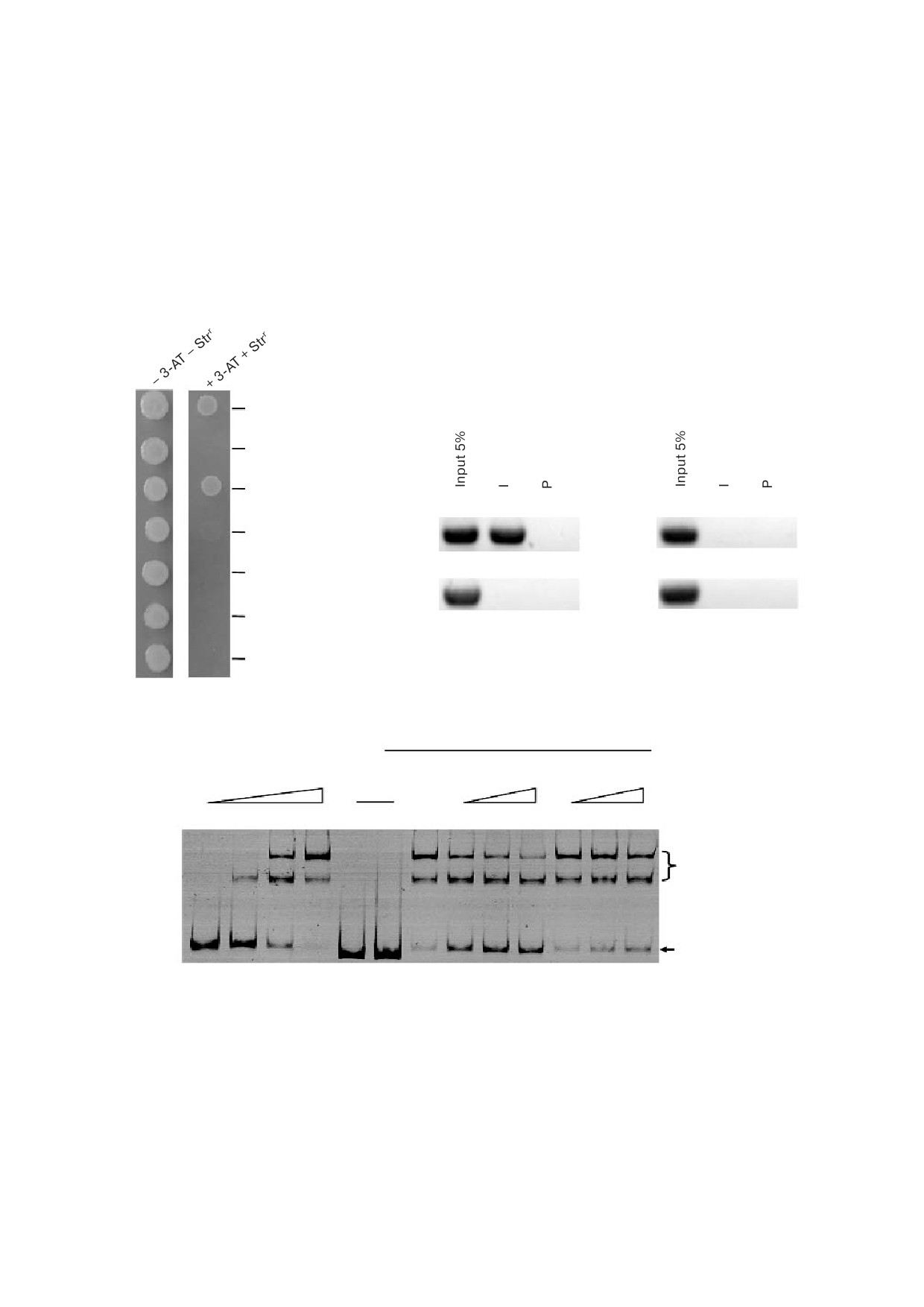
Рис. 3. Определение взаимодействия между AraR и Ms1712p. a - Бактериальный одногибридный анализ. Котрансфор
манты, содержащие плазмиды pTRG araR/pBX Ms1712p, продемонстрировали хороший рост на культуральной среде, ис
пользованной для проведения скрининга. Котрансформанты, содержащие плазмиды pTRG Rv3133/pBX Rv2031p (поло
жительный контроль, СК+), также хорошо росли на этой среде, однако штамм, содержащий плазмиды pTRG/pBX, рос
плохо (отрицательный контроль, СК-); b - иммунопреципитация хроматина (ChIP) с использованием преиммунной (P)
или иммунной сыворотки (I), полученной против AraR. В качестве отрицательных контролей использовали штамм с де
лецией гена araR (правая панель) и промотор Ms6769p; c - определение сдвига электрофоретической подвижности
(EMSA). Специфическая ДНК связывающая активность AraR относительно промоторной ДНК Ms1712p наблюдалась
при инкубации Ms1712p ДНК субстрата с увеличивающимися количествами AraR (дорожки 2-4). Немеченый Ms1712p
(дорожки 8-10) конкурировал с меченым Ms1712p за связывание с белком AraR, в то время как немеченый Ms6769p кон
курировать не смог (дорожки 11-13)
БИОХИМИЯ том 84 вып. 5 2019
710
ZHOU и др.
быть восстановлен в таких условиях. Кроме то
CACA), локализованный в вышележащем регу
го, специфичность действия антител против
ляторном участке арабинозного оперона.
AraR была подтверждена с помощью штамма с
AraR осуществляет отрицательную регуляцию
делецией AraR (правая панель).
экспрессии арабинозного оперона. Обратный эф
Далее мы провели эксперименты по опреде
фект регуляторного белка AraR на его оперон
лению сдвига электрофоретической подвиж
означает, что AraR осуществляет отрицательную
ности (EMSA), чтобы подтвердить связывание
регуляцию экспрессии araR оперона. Чтобы
очищенного белка AraR с Ms1712p in vitro. Как
подтвердить это предположение, мы сначала
показано на рис. 3, c, при инкубации увеличива
сконструировали ряд плазмид, экспрессирую
ющихся количеств AraR (0; 0,05; 0,1; 0,2 мкM) с
щих только lacZ или промотор lacZ, и измерили
промотором мишенью в геле наблюдается уве
активность β галактозидазы. Плазмида с силь
личение количества комплексов белка и ДНК
ным промотором hsp60 была использована в ка
(дорожки 1-4). Напротив, не наблюдалось об
честве положительного контроля (CK+). Как
разования комплексов белка с ДНК в случае не
показано на рис. 5, a в сравнении с беспромо
гативного промотора Ms6769p (дорожка 6). Спе
торной плазмидой (CK-), экспрессия lacZ была
цифичность связывания AraR с Ms1712p также
сильной, что указывает на хорошую работу ре
была подтверждена с помощью конкурентного
портерной системы. Интересно, что экспрессия
метода. Удивительно, что немеченый Ms1712p
lacZ была значительно повышена в мутантном
может конкурентно ингибировать связывание
штамме M. smegmatis с делецией гена araR в
AraR с меченым Ms1712p (дорожки 8-10), в то
сравнении со штаммом дикого типа, который
время как немеченый Ms6769p не ингибировал
содержал целевой промотор (Ms1712p). Не было
взаимодействие между AraR и его промотором
выявлено значимых различий между штаммом
(Ms1712p; дорожки 11-13).
дикого типа M. smegmatis и мутантным штаммом
В целом эти результаты свидетельствуют о
с делецией гена araR, содержащим неродствен
том, что AraR может специфически связываться
ный промотор (Ms6769p). Эти результаты свиде
с вышележащим регуляторным участком араби
тельствуют в пользу того, что AraR осуществляет
нозного оперона.
отрицательную регуляцию экспрессии araR опе
AraR распознает консервативный мотив после
рона. Дальнейшие подтверждения этого вывода
довательности. Метод футпринтинга с использо
получены с помощью RT qPCR. Как показано
ванием ДНКазы I был использован для карти
на рис. 5, b, уровень экспрессии арабинозного
рования ДНК мотива, с которым связывается
оперона (Ms1707, Ms1709-1714) был значитель
AraR. Когда возрастающие количества белка
но повышен (p < 0,05) в мутантном штамме с де
AraR (0; 0,1; 0,2 мкM) инкубировали с ДНКазой I
лецией гена araR в сравнении со штаммом дико
и ДНК субстратами (Ms1712p), два участка, со
го типа.
держащие последовательности GAATGTTAAC
В целом AraR функционирует в качестве инги
GATCACATCT и TTCTGTGAGCGTTAACATCA,
битора и осуществляет отрицательную регуляцию
эффективно защищались белком AraR (рис. 4, a).
экспрессии арабинозного оперона у M. smegmatis.
Защищенные участки ДНК включали области
L Арабиноза ингибирует активность AraR. AraR
-270…-289 и -125…-144 в цепи ДНК (рис. 4, b).
регулирует экспрессию генов, ассоциированных
Удивительно, но два связывающих участка со
с метаболизмом арабинозы, что подразумевает
держали обратную комплементарную последо
способность AraR к ответу на сигнал, опосредо
вательность (ATGTTAACGCTCACA и TGTGA
ванный арабинозой. Для проверки этого пред
GCGTTAACAT). Это указывает на то, что AraR
положения нами методом EMSA была изучена
распознает специфически повторяющийся мо
возможность L арабинозы оказывать влияние
тив последовательности в разных цепях ДНК.
на ДНК связывающую активность AraR. Как
Дальнейшие исследования методом EMSA
показано на рис. 6, a, при добавлении возраста
подтверждают значимость этого мотива для спе
ющих количеств L арабинозы (0, 1, 2 и 4 мМ) в
цифического распознавания белком AraR. Как
реакционные смеси при проведении EMSA от
показано на рис. 4, c, AraR не может связывать
четливо наблюдается соответствующее сниже
ся с укороченными фрагментами ДНК, в кото
ние количества сместившихся ДНК субстратов
рых отсутствуют обратные комплементарные
(дорожки 6-8), что указывает на то, что L ара
мотивы последовательности (дорожки 5-8 и
биноза может ингибировать ДНК связываю
17-20). Напротив, AraR может связываться с
щую активность AraR. В то же время не наблю
укороченными фрагментами ДНК, которые со
далось изменений в количестве сместившихся
держат эти мотивы (дорожки 9-16 и 21-24).
ДНК субстратов (дорожки 10-12), когда в ка
В целом AraR может распознавать повторяю
честве потенциально эффективной молекулы
щийся мотив длиной 15 п.н. (ATGTTAACGCT
использовалась D ксилоза.
БИОХИМИЯ том 84 вып. 5 2019
AraR РЕГУЛИРУЕТ УСТОЙЧИВОСТЬ МИКОБАКТЕРИЙ К АНТИБИОТИКАМ
711
а
100
120
140
160
180
200
220
240
260
280
300
2000
1000
AraR (0 μM)
0
2000
1000
AraR (0,1 μM)
0
2000
AraR (0,2 μM)
1000
0
b
Ms1712 start codon
Ms1713 start codon
c
1
100
200
300
399
Ms1712
S1 100 bp
S2 100 bp
S3 100 bp
S4 100 bp
S5 200 bp
Ms1712p
S1
S2
S3
S4
S5
DNA substrates
AraR (0-0,2 μM)
Lanes 1
2
3
4
5
6
7
8
9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24
DNA/Protein
complex
DNA substrate
Рис. 4. Определение связывающего мотива последовательности для AraR внутри вышележащего участка оперона. а - Экс
перименты по футпринтингу с ДНКазой I. Определяли степень защиты промотора Ms1712 от расщепления ДНКазой с
помощью увеличивающихся количеств AraR (0-0,2 мкМ). Защищенные участки выделены красными рамками; b - харак
теристика последовательности и структуры защищаемого участка ДНК. Стартовый трансляционный кодон Ms1712 выде
лен жирным шрифтом; c - определение ДНК связывающей активности AraR по отношению к ДНК субстратам по сдвигу
электрофоретической подвижности (EMSA) в присутствии или отсутствии мотива.
С цветным вариантом рис. 4 можно ознакомиться в электронной версии статьи на сайте: www.elibrary.ru
БИОХИМИЯ том 84 вып. 5 2019
712
ZHOU и др.
а
Reporter cassette
β galactosidase activity
(Miller Unit)
Msm/WT
Msm/araR::hyg
657,8 ± 48,8
706,5 ± 17,4
15,3 ± 0,2
13,0 ± 2,1
330,6 ± 5,9
150,8 ± 53,0
13,6 ± 9,2
11,3 ± 10,0
0
200
400
600
800
b
(folds)
Expression level in Msm/WT
Expression level in Msm/araR::hyg
20
15
10
5
0
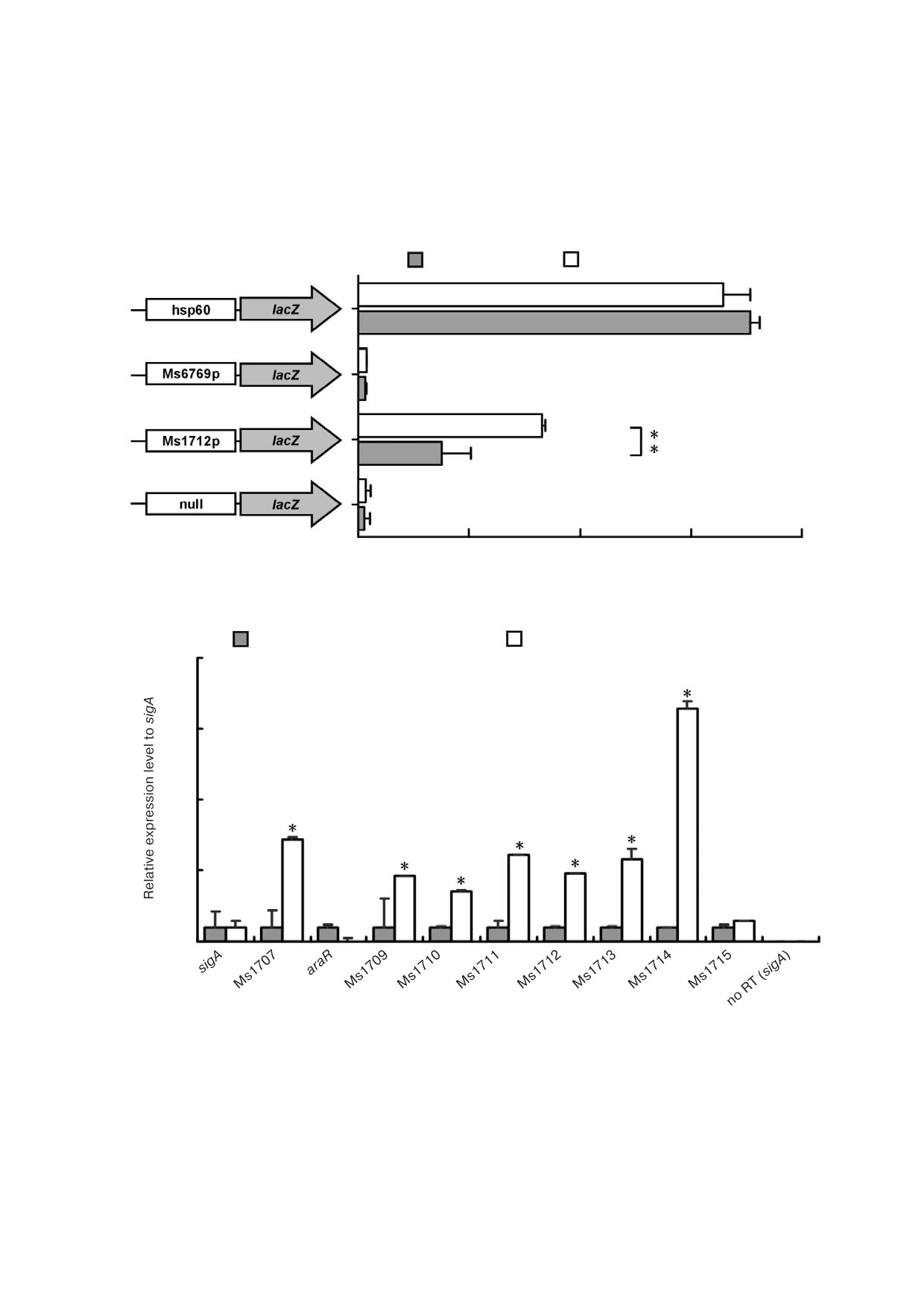
Рис. 5. Регуляторное влияние AraR на экспрессию araR оперона. а - Определение активности β галактозидазы. В качест
ве положительного контроля использовали hsp60 lacZ, в качестве отрицательных контролей - нулевой промотор lacZ
(null) и Ms6769p lacZ. Для штамма дикого типа и штамма с делецией гена araR была определена активность β галактози
дазы, которая приведена в виде единиц Миллера (правая панель). Столбики ошибок представляют разброс значений, по
лученных в результате трех биологических повторов; ** p < 0,01; b - результаты RT qPCR. Уровни экспрессии генов нор
мализовали против гена sigA как инвариантного транскрипта. Столбики ошибок представляют разброс значений, полу
ченных в результате трех биологических повторов; * p
0,05 (статистически значимые различия между двумя группами)
БИОХИМИЯ том 84 вып. 5 2019
AraR РЕГУЛИРУЕТ УСТОЙЧИВОСТЬ МИКОБАКТЕРИЙ К АНТИБИОТИКАМ
713
AraR (0,15 μМ)
а
AraR (0-0,15 μM)
L AraR (0-4 mM) D Xyl (0-4 mM)
Lanes
1
2
3
4
5
6
7
8
9
10
11
12
DNA/Protein complex
DNA substrate
b
Reporter cassette
β galactosidase activity
(Miller Unit)
Msm/WT
Msm/WT + 10 mM L Ara
Msm/WT + 10 mM D Xyl
828,7 ± 33,6
816,3 ± 109,0
793,9 ± 84,9
15,8 ± 3,0
19,4 ± 0,8
11,3 ± 2,2
218,3 ± 2,7
387,7 ± 10,7
226,6 ± 4,4
18,9 ± 1,4
22,6 ± 1,9
8,4 ± 1,8
0
200
400
600
800
1000
Expression level in Msm/pMV261
c
Expression level in Msm/pMV261 araR
Expression level in Msm/pMV261 araR + 10 mM L Ara
300
250
200
150
2,0
1,5
1,0
0,5
0
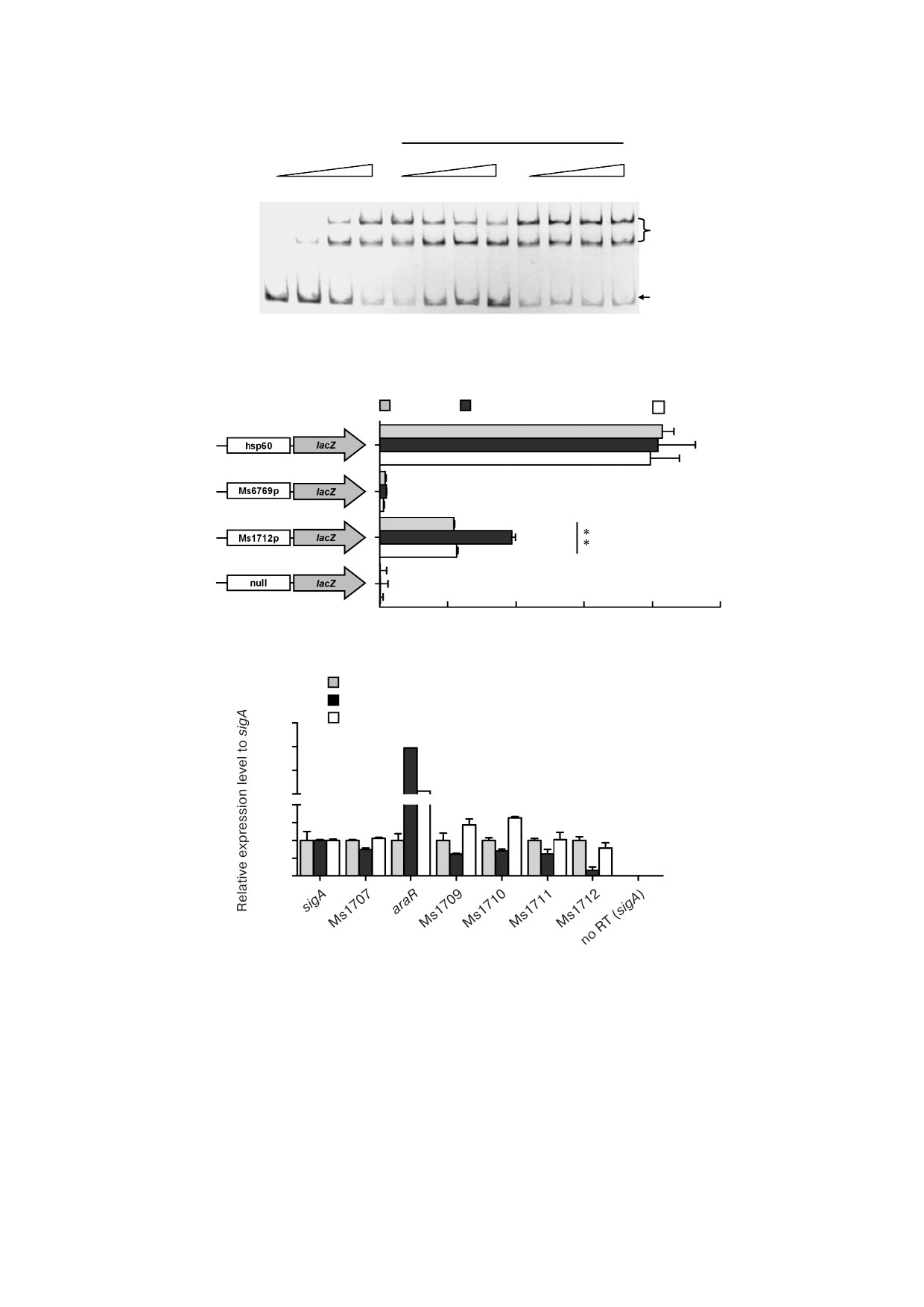
Рис. 6. Влияние L арабинозы на ДНК связывающую активность и регуляцию AraR. а - Определение сдвига электрофо
ретической подвижности (EMSA). FITC меченный Ms1712p инкубировали с AraR (0,15 мкM) в присутствии L арабино
зы (L Ara; 0-4 мM; дорожки 5-8) или D ксилозы (D Xyl; дорожки 9-12). Свободный ДНК субстрат и комплекс
«ДНК-белок» обозначены в правой части; b - определение активности β галактозидазы в присутствии 10 мМ L Ara или
D Xyl. В качестве положительного контроля использовали hsp60 lacZ, в качестве отрицательных контролей - нулевой
промотор lacZ и Ms6769p lacZ. Для штамма дикого типа и штамма с делецией гена araR была определена активность β га
лактозидазы, которая приведена в виде единиц Миллера (правая панель). Столбики ошибок представляют разброс значе
ний, полученных в результате трех биологических повторов; ** p
0,01 (статистически значимые различия между двумя
группами); с - результаты RT qPCR. Штамм со сверхэкспрессией гена аraR выращивали в среде 7H9 в присутствии 10 мМ
L Ara. Уровни экспрессии генов нормализовали против гена sigA как инвариантного транскрипта. Столбики ошибок
представляют разброс значений, полученных в результате трех биологических повторов. ** p < 0,05 (статистически значи
мые различия между двумя группами)
8 БИОХИМИЯ том 84 вып. 5 2019
714
ZHOU и др.
Далее нами были получено подтверждение
Таким образом, L арабиноза может высту
ингибирования L арабинозой активности AraR
пать в качестве эффективного ингибитора ак
с использованием метода определения актив
тивности фактора транскрипции AraR.
ности β галактозидазы. Как показано на рис. 6, b,
L Арабиноза нейтрализует отрицательную ре
рекомбинантные штаммы, содержащие плазми
гуляцию фактором транскрипции AraR чувстви
ды, экспрессирующие только lacZ или совмест
тельности микобактерий к изониазиду. AraR осу
но промотор и lacZ, культивировались в трех
ществляет отрицательную модуляцию чувстви
различных средах в присутствии и в отсутствии
тельности клеток M. smegmatis к INH, а L араби
L арабинозы. Следует обратить внимание, что
ноза ингибирует активность AraR, что предпо
при культивировании клеток в среде с 10 мМ
лагает способность L арабинозы к нейтрализа
L арабинозой экспрессия lacZ была значитель
ции регуляторой роли AraR в устойчивости к
но повышена в штамме дикого типа, но не в му
INH. Как показано на рис. 7, a, при добавлении
тантном штамме с удаленным геном araR (рис. S3
INH штамм дикого типа растет лучше (статисти
Приложения). При росте в среде с добавлением
чески значимые различия) в присутствии 10 мM
10 мM D ксилозы изменений не наблюдалось
L арабинозы, чем в присутствии D ксилозы. В то
(рис. 6, b). Эти результаты свидетельствуют о
же время не было обнаружено заметных разли
том, что арабиноза специфически ингибирует
чий в росте мутантного штамма с делецией гена
активность AraR.
araR в присутствии или в отсутствии L арабино
Этот вывод далее был подтвержден с помощью
зы при добавлении INH (рис. 7, b).
метода RT qPCR. Как показано на рис. 6, c, уро
Эти результаты означают, что L арабиноза мо
вень экспрессии генов araR оперона был значи
жет нейтрализовать отрицательную регуляцию фак
тельно снижен у Msm/pMV261 araR в сравне
тором транскрипции AraR чувствительности мико
нии с Msm/pMV261. Однако снижение экспрес
бактерий к INH, что согласуется с нашей моделью.
сии генов мишеней у Msm/pMV261 araR возвра
щалось в норму, когда в культуральную среду до
бавляли 10 мМ L арабинозу. Эти результаты
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
указывают на то, что арабиноза может нейтра
лизовать ингибиторную активность AraR. Напро
L Арабиноза является важным компонентом
тив, D ксилоза не проявляет такой регулятор
клеточной стенки микобактерий, вовлеченным
ной роли в тех же условиях.
в синтез AG и LAM [17, 30]. Однако до сих пор
а
b
Msm/pMV261
Msm araR::hyg/pMV261
Msm/pMV261 + 10 mМ L Ara
Msm araR::hyg/pMV261 + 10 mМ L Ara
Msm/pMV261 + 10 mМ D Xyl
Msm araR::hyg/pMV261 + 10 mМ D Xyl
ns
8,5
8,5
6 μg/mI INH
6 μg/mI INH
ns
ns
ns
8,0
8,0
ns
ns
7,5
7,5
16
20
24
16
20
24
Time, h
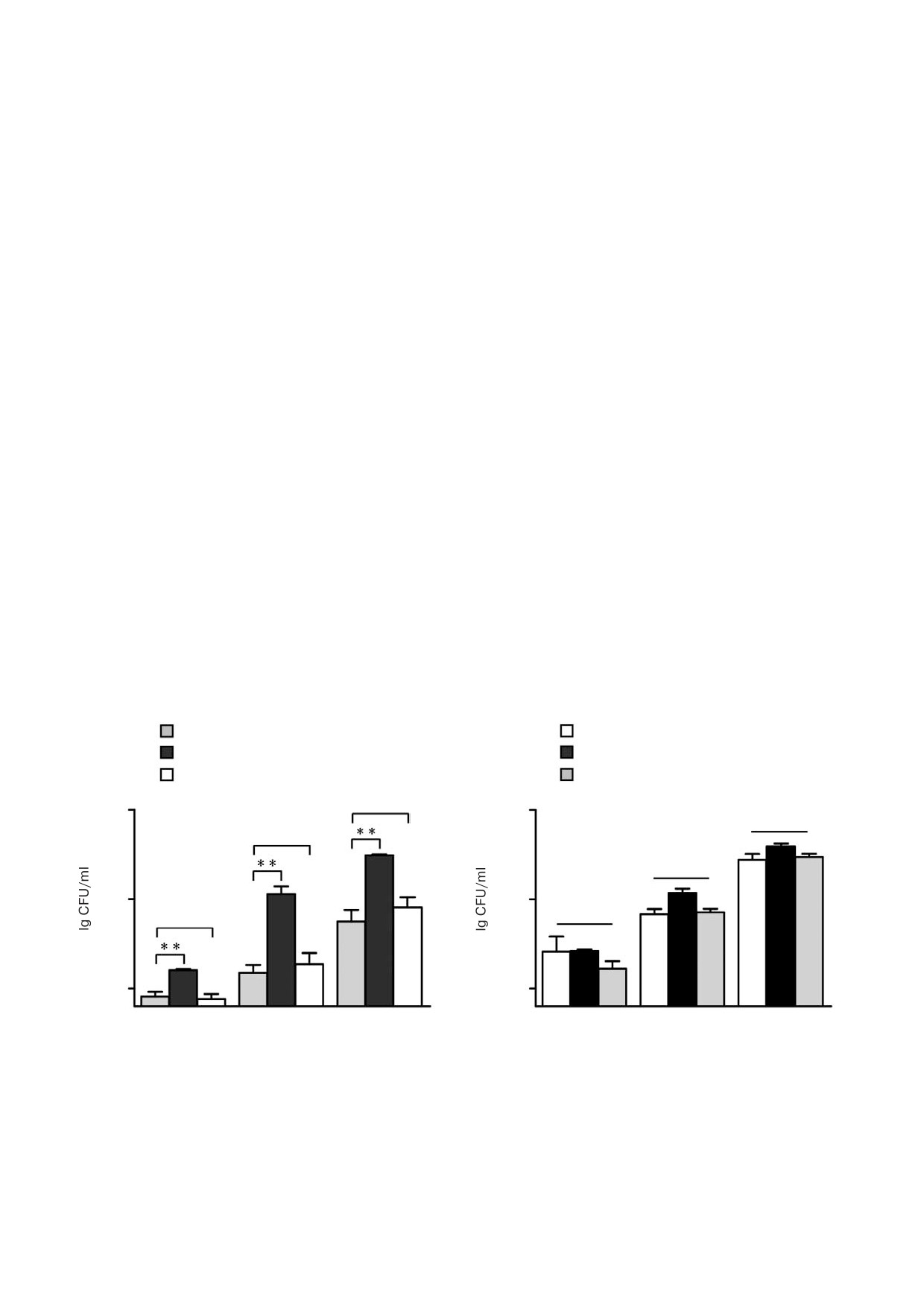
Рис. 7. Влияние L арабинозы на чувствительность M. smegmatis к изониазиду (INH). Штамм дикого типа (a) и штамм с де
лецией гена araR (b) выращивали на среде 7H9 с добавлением 6 мкг/мл INH в присутствии 10 мМ L арабинозы (L Ara)
или D ксилозы (D Xyl). Число колоний определяли в три момента времени (16, 20 и 24 ч). Столбики ошибок представля
ют разброс значений, полученных в результате трех биологических повторов. ** p < 0,01 (статистически значимые разли
чия между двумя группами); ns - отсутствие статистически значимых различий между двумя группами
БИОХИМИЯ том 84 вып. 5 2019
AraR РЕГУЛИРУЕТ УСТОЙЧИВОСТЬ МИКОБАКТЕРИЙ К АНТИБИОТИКАМ
715
неясно, способна ли L арабиноза действовать в
Другим интересным результатом данной ра
качестве эффективной молекулы, и может ли
боты является тот факт, что запускаемый араби
запускаемая сахарами регуляция оказывать вли
нозой механизм регуляции связан с формирова
яние на лекарственную устойчивость микобак
нием устойчивости микобактерий к действию
терий. В настоящей работе нами был охаракте
антибиотиков. Как важный компонент клеточ
ризован белок AraR как новый отвечающий на
ной стенки, L арабиноза участвует в процессе
L арабинозу фактор транскрипции в клетках
синтеза AG и LAM, что может влиять на прони
M. smegmatis. L Арабиноза может действовать в
цаемость клеточной мембраны у микобактерий.
качестве эффективной молекулы, способной
В настоящей работе нами было показано, что
отменять подавление ингибирования фактором
L арабиноза может целенаправленно оказывать
транскрипции AraR экспрессии арабинозного
воздействие на активность AraR и далее регули
оперона, принимающего участие в регуляции
ровать экспрессию кластера генов транспорта
чувствительности микобактерий к INH. Полу
ABC (Ms1709-1712), который включает в себя
ченные в настоящей работе результаты предос
гены, ассоциированные с транспортом и мета
тавляют новую информацию, необходимую для
болизмом L арабинозы. AraR функционирует
понимания взаимосвязей между запускаемым
как репрессор транскрипции и осуществляет от
арабинозой механизмом регуляции и формиро
рицательную регуляцию экспрессии оперона.
ванием у микобактерий устойчивости к действию
Удивительно, что L арабиноза способна подав
антибиотиков.
лять транскрипционное ингибирование AraR.
В последние годы во многих работах было
У Corynebacterium glutamicum AraR также действу
показано, что сахара могут служить в качестве
ет как репрессор транскрипции генов araBDA,
сигнальных молекул, участвующих в регуляции
araE и galM araR, а L арабиноза снижает ДНК
внутриклеточного метаболизма у различных ви
связывающую активность AraR [34]. Эти резуль
дов бактерий. Например, в случае штамма E. coli
таты согласуются с нашими экспериментальны
O157:H7 в качестве сигнальной молекулы, участ
ми данными. Кроме того, полученные нами ре
вующей в процессе регуляции luxS ассоци
зультаты также показывают, что регуляция в ря
ированной экспрессии генов и влияющей на ви
ду «арабиноза - AraR - арабинозный оперон»
рулентность бактерий, выступает глюкоза [31].
связана с формированием устойчивости мико
У Bacillus subtilis и Caulobacter crescentus опосре
бактерий к действию антибиотиков. До сих пор
дованный ксилозой сигнал может регулировать
о подобных результатах для других бактерий не
экспрессию многих генов через направленное
сообщалось.
воздействие на фактор транскрипции XylR [32, 33].
Изониазид - один из препаратов первой ли
Интересно, что L арабиноза может также высту
нии при лечении туберкулеза. Фактически он
пать в качестве сигнальной молекулы, осущест
является предшественником лекарственного
вляющей положительную регуляцию экспрес
средства, активируемым пероксидазой KatG.
сии генов метаболизма и транспорта L арабино
В результате активации образуется комплекс
зы у Corynebacterium glutamicum, E. сoli и Bacillus
«INH-NAD», который ингибирует InhA, еноил
subtilis [19, 34, 35]. В то же время имеется лишь
ACP редуктазу системы синтазы жирных кислот
небольшое количество работ, посвященных
II типа. Это приводит к ингибированию био
функциям простых сахаров как сигнальных мо
синтеза миколовой кислоты в клеточной стенке
лекул в клетках микобактерий, и возможные
и к гибели бактериальной клетки [37]. К настоя
сигнальные пути до сих пор не охарактеризова
щему времени предложено несколько основных
ны. Несмотря на предположение о действии
механизмов устойчивости микобактерий к дейст
AraR в качестве вероятного отрицательного ре
вию INH [38]. Например, было показано, что
гулятора арабинозного оперона у M. smegmatis [36],
мутации в генах katG и inhA ассоциированы с
необходимы дополнительные эксперименталь
устойчивостью к INH [39, 40]. Оперон iniBAC
ные доказательства того, действительно ли AraR
кодирует у микобактерий гены, ассоциирован
напрямую осуществляет регуляцию соответ
ные с выкачивающим насосом, и обеспечивает
ствующих генов и ответ на L арабинозу. В насто
их устойчивость к INH [41]. Он также имеет от
ящей работе был выявлен новый фактор транс
ношение к инактивации цитохрома P450, что
крипции AraR, который в клетках M. smegmatis
приводит к возникновению устойчивости к
отвечает на опосредованный L арабинозой сиг
действию INH [42, 43]. Однако в настоящей ра
нал и осуществляет отрицательную регуляцию
боте не было обнаружено различий в уровне
экспрессии арабинозного оперона. Это первая
экспрессии генов, таких как katG, inhA, iniBAC, и
работа, в которой продемонстрирована роль
цитохрома P450 у штамма со сверхэкспрессией
L арабинозы в качестве сигнальной молекулы у
гена araR и штамма дикого типа (рис. S4 Прило
микобактерий.
жения). На этом основании можно предполо
БИОХИМИЯ том 84 вып. 5 2019
8*
716
ZHOU и др.
жить, что AraR осуществляет отрицательную ре
механизма возникновения устойчивости к анти
гуляцию устойчивости клеток M. smegmatis к
биотикам у микобактерий.
INH без участия описанных выше механизмов.
Таким образом, результаты нашей работы могут
Финансирование. Работа выполнена при под
способствовать пониманию механизма форми
держке Национальной R&D программы Китая
рования устойчивости к антибиотикам у мико
(National Key R&D Program of China;
бактерий.
2017YFD0500300), Национального фонда естест
В целом полученные нами данные свиде
венных наук Китая (National Natural Science
тельствуют в пользу модели, согласно которой
Foundation of China;
31730005,
31670075 и
AraR в ответ на сигнал L арабинозы способству
31870036) и Программы стажировок Chang Jiang
ет экспрессии арабинозного оперона и синтезу
(Chang Jiang Scholars Program; предоставлена
компонентов клеточной стенки, таких как AG и
Z. G. He).
LAM [17, 30], вызывая тем самым изменения
Вклад авторов. W. Li спланировал и коорди
проницаемости клеточной стенки. В конечном
нировал выполнение работы; L. Zhou и W. Li
итоге, все это влияет на устойчивость бактерий к
проводили эксперименты. Все авторы внесли
изониазиду. Очевидно, что в будущем необходи
вклад в интерпретацию результатов и формули
мо провести дополнительные исследования для
ровку выводов. W. Li, Z. G. He и L. Zhou интер
выявления механизма, лежащего в основе регу
претировали результаты и написали текст статьи.
ляции формирования устойчивости к действию
Конфликт интересов. Авторы заявляют об от
антибиотиков, запускаемой арабинозой. Тем не
сутствии конфликта интересов.
менее полученные в настоящей работе результа
Соблюдение этических норм. Настоящая статья
ты могут быть использованы в дальнейших ра
не содержит описания выполненных авторами
ботах, направленных на изучение запускаемого
исследований с участием людей или использо
арабинозой процесса регуляции и выявление
ванием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. World Health Organization (WHO) (2017) Global tuber
and Biqi, F. (2013) Virulence factors of the Mycobacterium
culosis report 2017, World Health Organization, Geneva,
tuberculosis complex, Virulence, 4, 3-66.
p. 1.
11. Jiang, T., Cai, L., Zhao, X., He, L., Ma, Y., Zang, S.,
2. Fonseca, J.D., Knight, G.M., and McHugh, T.D. (2015)
Zhang, C., Li, X., and Xin, Y. (2014) Functional identifi
The complex evolution of antibiotic resistance in
cation of MSMEG_6402 protein from Mycobacterium
Mycobacterium tuberculosis, Int. J. Infect. Dis., 32, 94-100.
smegmatis in decaprenylphosphoryl D arabinose biosyn
3. Nguyen, L. (2016) Antibiotic resistance mechanisms in
thesis, Microb. Pathog., 76, 44-50.
M. tuberculosis: an update, Arch. Toxicol., 90, 1585-1604.
12. Andriole, V.T. (2005) The quinolones: past, present, and
4. Li, X.Z., Zhang, L., and Nikaido, H. (2004) Efflux pump
future, Clin. Infect. Dis., 15, 113-119.
mediated intrinsic drug resistance in Mycobacterium smeg
13. Vetting, M.W., Hegde, S.S., Fajardo, J.E., Fiser, A.,
matis, Antimicrob. Agents. Chemother., 48, 2415-2423.
Roderick, S.L., Takiff, H.E., and Blanchard, J.S. (2006)
5. De Rossi, E., Ainsa, J.A., and Riccardi, G. (2006) Role of
Pentapeptide repeat proteins, Biochemistry, 45, 1-10.
mycobacterial efflux transporters in drug resistance, FEMS
14. Warrier, T., Kapilashrami, K., Argyrou, A., Ioerger, T.R.,
Microbiol., 30, 36-52.
Little, D., Murphy, K.C., Nandakumar, M., Park, S.,
6. Louw, G.E., Warren, R.M., Gey van Pittius, N.C.,
Gold, B., Mi, J., Zhang, T., Meiler, E., Rees, M.,
McEvoy, C.R., Van Helden, P.D., and Victor, T.C. (2009)
Somersan Karakaya, S., Porras De Francisco, E., Mar
A balancing act: efflux/influx in mycobacterial drug resis
tinez Hoyos, M., Burns Huang, K., Roberts, J., Ling, Y.,
tance, Antimicrob. Agents. Chemother., 53, 3181-3189.
Rhee, K.Y., Mendoza Losana, A., Luo, M., and Nathan, C.F.
7. Barry, C.E., and Mdluli, K. (1996) Drug sensitivity and
(2016) N methylation of a bactericidal compound as a
environmental adaptation of mycobacterial cell wall com
resistance mechanism in Mycobacterium tuberculosis, Proc.
ponents, Trends Microbiol., 4, 275-281.
Natl. Acad. Sci. USA, 113, 4523-4530.
8. Ojha, A.K., Baughn, A.D., Sambandan, D., Hsu, T.,
15. Johnson, R., Streicher, E.M., Louw, G.E., Warren, R.M.,
Trivelli, X., Guerardel, Y., Alahari, A., Kremer, L., Ja
van Helden, P.D., and Victor, T.C. (2006) Drug resistance
cobs, W.R., Jr., and Hatfull, G.F. (2008) Growth of
in Mycobacterium tuberculosis, Curr. Issues Mol. Biol., 8, 97.
Mycobacterium tuberculosis biofilms containing free mycolic
16. Belanger, A.E., Besra, G.S., Ford, M.E., Mikusova, K.,
acids and harbouring drug tolerant bacteria, Mol.
Belisle, J.T., Brennan, P.J., and Inamine, J.M. (1996)
Microbiol., 69, 164-174.
The embAB genes of Mycobacterium avium encode an
9. Singh, A., Jain, S., Gupta, S., Das, T., and Tyagi, A.K.
arabinosyl transferase involved in cell wall arabinan
(2003) mymA operon of Mycobacterium tuberculosis: its
biosynthesis that is the target for the antimycobacte
regulation and importance in the cell envelope, FEMS
rial drug ethambutol, Proc. Natl. Acad. Sci. USA, 93,
Microbiol. Lett., 227, 53-63.
11919-11924.
10. Forrellad, M.A., Klepp, L.I., Gioffre, A., Sabio Garcia, J.,
17. Bhat, Z.S., Rather, M.A., Maqbool, M., Lah, H.U.,
Morbidoni, H.R., de la Paz Santangelo, M., Cataldi, A.A.,
Yousuf, S.K., and Ahmad, Z. (2017) Cell wall: a versatile
БИОХИМИЯ том 84 вып. 5 2019
AraR РЕГУЛИРУЕТ УСТОЙЧИВОСТЬ МИКОБАКТЕРИЙ К АНТИБИОТИКАМ
717
fountain of drug targets in Mycobacterium tuberculosis,
virulence gene expression of Escherichia coli O157:H7,
Biomed. Pharmacother., 95, 1520-1534.
J. Food. Prot., 75, 748.
18.
Sa Nogueira, I., and Mota, L.J. (1997) Negative regula
32.
Gartner, D., Degenkolb, J., Ripperger, J.A., Allmans
tion of L arabinose metabolism in Bacillus subtilis: charac
berger, R., and Hillen, W. (1992) Regulation of the Bacillus
terization of the araR (araC) gene, J. Bacteriol., 179,
subtilis W23 xylose utilization operon: interaction of the
1598-1608.
Xyl repressor with the xyl operator and the inducer xylose,
19.
Schleif, R. (2000) Regulation of the L arabinose operon of
Mol. Gen. Genet., 232, 415-422.
Escherichia coli, Trends. Genet., 16, 559-565.
33.
Stephens, C., Christen, B., Watanabe, K., Fuchs, T., and
20.
Sharma, K., Gupta, M., Pathak, M., Gupta, N., Koul, A.,
Jenal, U. (2007) Regulation of D xylose metabolism in
Sarangi, S., Baweja, R., and Singh, Y. (2006) Transcrip
Caulobacter crescentus by a LacI type repressor, J. Bacte
tional control of the mycobacterial embCAB operon by
riol., 189, 8828-8834.
PknH through a regulatory protein, EmbR, in vivo, J. Bac
34.
Kuge, T., Teramoto, H., Yukawa, H., and Inui, M. (2014)
teriol., 188, 2936-2944.
The LacI type transcriptional regulator AraR acts as an
21.
Li, W., and He, Z.G. (2012) LtmA, a novel cyclic di
L arabinose responsive repressor of L arabinose utiliza
GMP responsive activator, broadly regulates the expres
tion genes in Corynebacterium glutamicum ATCC 31831,
sion of lipid transport and metabolism genes in
J. Bacteriol., 196, 2242-2254.
Mycobacterium smegmatis, Nucleic Acids Res.,
40,
35.
Mota, L.J., Tavares, P., and Sa Nogueira, I. (1999) Mode
11292-11307.
of action of AraR, the key regulator of L arabinose metabo
22.
Wang, Y., Huang, Y., Xue, C., He, Y., and He, Z.G. (2011)
lism in Bacillus subtilis, Mol. Microbiol., 33, 476-489.
A ClpR like regulator specifically recognizes a RecA inde
36.
Takata, G., Poonperm, W., Rao, D., Souda, A., Nishizaki, T.,
pendent promoter motif and broadly regulates expression
Morimoto, K., and Izumori, K. (2007) Cloning, expres
of DNA damage inducible genes in mycobacteria, J. Biol.
sion, and transcription analysis of L arabinose isomerase
Chem., 286, 31159-31167.
gene from Mycobacterium smegmatis SMDU, Biosci. Bio
23.
Guo, M., Feng, H., Zhang, J., Wang, W., Wang, Y., Li, Y.,
technol. Biochem., 71, 2876-2885.
Gao, C., Chen, H., Feng, Y., and He, Z.G. (2009)
37.
Vilcheze, C., and Jacobs, W.R., Jr. (2007) The mechanism
Dissecting transcription regulatory pathways through a new
of isoniazid killing: clarity through the scope of genetics,
bacterial one hybrid reporter system, Genome Res., 19,
Annu. Rev. Microbiol., 61, 35-50.
1301-1308.
38.
Hazbon, M.H., Brimacombe, M., Bobadilla, del Valle, M.,
24.
Frank, S.R., Schroeder, M., Fernandez, P., Taubert, S.,
Cavatore, M., Guerrero, M.I., Varma Basil, M., Billman
and Amati, B. (2001) Binding of c Myc to chromatin
Jacobe, H., Lavender, C., Fyfe, J., Garcia Garcia, L.,
mediates mitogen induced acetylation of histone H4 and
Leon, C.I., Bose, M., Chaves, F., Murray, M., Eisenach, K.D.,
gene activation, Genes Dev., 15, 2069-2082.
Sifuentes Osornio, J., Cave, M.D., Ponce, de Leon, A.,
25.
Li, W., Li, M., Hu, L., Zhu, J., Xie, Z., Chen, J., and
and Alland, D. (2006) Population genetics study of isoni
He, Z.G. (2018) HpoR, a novel c di GMP effective trans
azid resistance mutations and evolution of multidrug resis
cription factor, links the second messenger’s regulatory
tant Mycobacterium tuberculosis, Antimicrob. Agents Chemo
function to the mycobacterial antioxidant defense, Nucleic
ther., 50, 2640-2649.
Acids Res., 46, 3595-3611.
39.
Zhang, Y., Heym, B., Allen, B., Young, D., and Cole, S.T.
26.
Moker, N., Brocker, M., Schaffer, S., Kramer, R.,
(1992) The catalase peroxidase gene and isoniazid resis
Morbach, S., and Bott, M. (2004) Deletion of the genes
tance of Mycobacterium tuberculosis, Nature, 358, 591-593.
encoding the MtrA MtrB two component system of
40.
Banerjee, A., Dubnau, E., Quemard, A., Balasubrama
Corynebacterium glutamicum has a strong influence on cell
nian, V., Um, K.S., Wilson, T., Collins, D., de Lisle, G.,
morphology, antibiotics susceptibility and expression of
and Jacobs, W.R., Jr. (1994) inhA, a gene encoding a target
genes involved in osmoprotection, Mol. Microbiol., 54,
for isoniazid and ethionamide in Mycobacterium tuberculo
420-438.
sis, Science, 263, 227-230.
27.
Livak, K.J., and Schmittgen, T.D. (2001) Analysis of rela
41.
Colangeli, R., Helb, D., Sridharan, S., Sun, J., Varma
tive gene expression data using real time quantitative PCR
Basil, M., Hazbon, M.H., Harbacheuski, R., Megjugorac, N.J.,
and the 2-ΔΔCT, Methods, 25, 402-408.
Jacobs, W.R., Jr, Holzenburg, A., Sacchettini, J.C., and
28.
Stover, C.K., de la Cruz, V.F., Fuerst, T.R., Burlein, J.E.,
Alland, D. (2005) The Mycobacterium tuberculosis iniA
Benson, L.A., Bennett, L.T., Bansal, G.P., Young, J.F.,
gene is essential for activity of an efflux pump that confers
Lee, M.H., and Hatfull, G.F. (1991) New use of BCG for
drug tolerance to both isoniazid and ethambutol, Mol.
recombinant vaccines, Nature, 351, 456-460.
Microbiol., 55, 1829-1840.
29.
Rao, M., Liu, H., Yang, M., Zhao, C., and He, Z.G.
42.
Magliozzo, R.S., and Marcinkevicience, J.A.
(1996)
(2012) A copper responsive global repressor regulates
Evidence for isoniazid oxidation by oxyferrous mycobacte
expression of diverse membrane associated transporters
rial catalase peroxidase, J. Am. Chem. Soc.,
118,
and bacterial drug resistance in mycobacteria, J. Biol.
11303-11304.
Chem., 287, 39721-39731.
43.
Wengenack, N.L., Lopes, H., Kennedy, M.J., Tavares, P.,
30.
Brennan, P.J. (2003) Structure, function, and biogenesis of
Pereira, A.S., Moura, I., Moura, J.J., and Rusnak, F.
the cell wall of Mycobacterium tuberculosis, Tuberculosis
(2000) Redox potential measurements of the Mycobacterium
(Edinb), 83, 91-97.
tuberculosis heme protein KatG and the isoniazid resistant
31.
Delcenserie, V., Lapointe, G., Charaslertrangsi, T.,
enzyme KatG (S315T): insights into isoniazid activation,
Rabalski, A., and Griffiths, M.W. (2012) Glucose decreases
Biochemistry, 39, 11508-11513.
БИОХИМИЯ том 84 вып. 5 2019
718
ZHOU и др.
AraR, an L ARABINOSE RESPONDING
TRANSCRIPTION FACTOR, NEGATIVELY
REGULATES THE ISONIAZID RESISTANCE
OF Mycobacterium smegmatis
L. Zhou1, Z. G. He1, and W. Li1,2*
1 National Key Laboratory of Agricultural Microbiology,
College of Life Science and Technology, Huazhong
Agricultural University, Wuhan 430070, China;
E mail: lwhlbx@163.com
2 State Key Laboratory for Conservation and Utilization
of Subtropical Agro bioresources, College of Life Science
and Technology, Guangxi University, Nanning 530004, China
Received September 9, 2018
Revised January 6, 2019
Accepted January 24, 2019
L Arabinose is an important component of mycobacterial cell wall. It participates in synthesis of arabinogalactan and
arabinose, mannose, and other sugars, which has a potential important influence on bacterial cell wall permeability
and drug resistance. However, it remains unclear, whether L arabinose can effectively modulate the mycobacterial
antibiotic resistance, and what is the underlying regulatory mechanism. In this study, we characterized a new transcrip
tion factor AraR in Mycobacterium smegmatis, which responds to L arabinose and regulates the mycobacterial isoni
azid (INH) sensitivity. AraR was shown to specifically recognize two conserved 15 bp motifs within upstream regula
tory region of an arabinose operon, designated as araR operon. AraR functions as a transcriptional repressor and nega
tively regulates expression of the operon. In contrast to the effect of AraR, the overexpression of araR operon con
tributes to the mycobacterial INH resistance. Strikingly, L arabinose can act as an effective molecule and reverse the
transcriptional inhibition caused by AraR. The araR knockout strain was more resistant to INH than wildtype strain,
whereas the araR overexpressing strain was more sensitive to the drug. Addition of L arabinose in culture medium can
significantly enhance the INH resistance of the wildtype strain but not the araR knockout strain. Therefore, our study
identified a new L arabinose responding transcription factor and elucidated its role in regulation of bacterial antibiotic
resistance. These findings provide clues for further understanding of the regulatory role of sugar molecules in relation
with drug resistance in mycobacteria.
Keywords: AraR, mycobacteria, L arabinose, antibiotic resistance
БИОХИМИЯ том 84 вып. 5 2019