БИОХИМИЯ, 2019, том 84, вып. 6, с. 747 - 758
УДК 576.32/.36
БИОЛОГИЧЕСКАЯ РОЛЬ ИЗОФОРМ АКТИНА
В КЛЕТКАХ МЛЕКОПИТАЮЩИХ
Обзор
© 2019 В.Б. Дугина1, Г.С. Шагиева1, П.Б. Копнин2*
1 НИИ физико химической биологии им. А.Н. Белозерского
Московского государственного университета им. М.В. Ломоносова,
119991 Москва, Россия
2 НИИ канцерогенеза ФГБУ «НМИЦ онкологии им. Н.Н. Блохина»
Минздрава России, 115478 Москва, Россия;
электронная почта: pbkopnin@mail.ru
Поступила в редакцию 15.11.2018
После доработки 12.02.2019
Принята к публикации 13.02.2019
Актин играет важную роль в ключевых клеточных процессах, таких как адгезия, мышечная и немышечная
сократимость, миграция, поляризация, митоз и мейоз. Исследование лежащих в их основе специфических
механизмов важно для понимания фундаментальных процессов, происходящих в нормальных клетках и
тканях, а также при различных патологиях. Данный обзор посвящен исследованию функций изоформ ак%
тина, связанных с подвижностью и делением нормальных и опухолевых клеток, адгезионными структура%
ми, а также с изменением экспрессии и структурной организации актиновых изоформ в нормальных и опу%
холевых клетках. Селективное изменение экспрессии β% или γ%цитоплазматического актина позволило оп%
ределить функциональные различия между β% и γ%актинами: преимущественную роль β%актина в сокраще%
нии и межклеточной адгезии, а γ%актина - в клеточной пластичности и подвижности. Похожие данные бы%
ли получены в разных экспериментальных системах на культурах неопластических клеток эпителиального
и мезенхимального происхождения, а также при иммуноморфологическом сравнении срезов тканей чело%
века в норме и при неопластических заболеваниях. Реорганизация компонентов актинового цитоскелета и
межклеточных контактов является важным шагом в изменении пролиферативных характеристик и приоб%
ретении инвазивности эпителиальными опухолями.
КЛЮЧЕВЫЕ СЛОВА: цитоплазматические изоформы актина, β%актин, γ%актин, неопластическая транс%
формация, опухолевые клетки, цитоскелет.
DOI: 10.1134/S0320972519060010
АКТИН: ОБЩИЕ СВЕДЕНИЯ
ция актина (~20% от общего количества белка)
О СТРУКТУРЕ И СВОЙСТВАХ
обнаруживается в виде системы микрофиламен%
тов, собранных в миофибриллы - сократимые
Клетки высших позвоночных содержат три
структуры поперечнополосатых мышц. Помимо
системы цитоскелета, различные по биохими%
уникальной роли в сокращении скелетных
ческому составу, морфологическим характерис%
мышц, актин присутствует во всех мышечных и
тикам и функциям: актиновые микрофиламенты,
немышечных клетках и выполняет разнообраз%
микротрубочки и промежуточные филаменты.
ные функции в зависимости от тканевой и кле%
Система актиновых микрофиламентов обладает
точной специализации. Система актиновых фи%
присущими ей специфическими механически%
ламентов играет важную роль в поддержании
ми свойствами и динамическим поведением.
архитектурной целостности клетки и отвечает за
Эта система играет важную роль в ключевых
выполнение механических функций, клеточную
клеточных процессах, таких как адгезия, мы%
сократимость или натяжение, а также обеспечи%
шечная и немышечная сократимость, миграция,
вает клеточную подвижность. Динамика акти%
поляризация, эндо% и экзоцитоз, митоз и мейоз [1].
нового цитоскелета поддерживается двумя фак%
Основным структурным белком данной систе%
торами: 1) способностью актина к обратимому
мы является актин. Самая высокая концентра%
переходу из мономерного (G%актина, глобуляр%
ного) в полимерное (F%актин, филаментозное)
* Адресат для корреспонденции.
состояние; 2) взаимодействием актина с актин%
747
748
ДУГИНА и др.
связывающими белками (ABPs), которые могут
При созревании молекул цитоплазматичес%
ингибировать/стимулировать актиновую поли%
ких актинов (β% или γ%) происходит удаление
меризацию, разрезать полимеры, связывать ак%
концевого метионина [9], а при созревании мо%
тиновые филаменты в пучки или трехмерные
лекул мышечных актинов - удаление метиони%
сети, а также обеспечивать прикрепление к кле%
на и цистеина, с последующим ацетилировани%
точной мембране.
ем N%концевого остатка. Недавно был иденти%
Мономер актина (G%актин) имеет нуклео%
фицирован фермент, особая N%терминальная
тид%связывающий карман между двумя больши%
ацетилтрансфераза, которая осуществляет аце%
ми доменами, каждый из которых разделен на
тилирование N%конца цитоплазматического ак%
два субдомена. Снаружи одного из них, субдо%
тина после удаления предшествующего метио%
мена 1, расположен N%конец молекулы. Поли%
нина [10, 11]. Отсутствие этого фермента меняет
мер актина (F%актин) образует двойную спи%
структуру и динамику актинового цитоскелета.
раль, в которой субдомен 1 также расположен на
Необходимо отметить, что только четыре ами%
внешней стороне филамента. Это положение
нокислотных остатка на N%конце отличаются в
позволяет N%концевому участку актиновой мо%
белковых молекулах β% и γ%актинов, но эти от%
лекулы взаимодействовать с миозином и други%
личия вызывают небольшие изменения в разме%
ми ABPs и регуляторными белками.
ре и плотности заряда, которые могут приводить
Изменения в архитектуре микрофиламентов
к изменению уровня полимеризации, что, с
приводят к реорганизации клеточной морфоло%
большой вероятностью, может быть использо%
гии и ориентации, изменениям пролифератив%
вано при выполнении различных клеточных
ных свойств, а также перестройкам взаимодей%
функций [12].
ствий с окружающим внеклеточным матриксом
N%концевой домен молекулы актина может
и другими клетками.
участвовать во взаимодействиях с ABPs [13]. В экс%
периментах in vitro было показано селективное
взаимодействие несаркомерных изоформ мио%
РАЗНООБРАЗИЕ ИЗОФОРМ АКТИНА
зина с изоформами актина [14]. Было выявлено
У ВЫСШИХ ПОЗВОНОЧНЫХ
преимущественное, по сравнению с α%скелет%
ным актином, взаимодействие цитоплазмати%
В тканях высших позвоночных экспрессиру%
ческих изоформ актина с профилином [15, 16],
ется шесть изоформ актина [2], первичная
тимозином β4 [17], L%пластином [18], эзрином
структура которых очень консервативна [3]. Ге%
[19, 20], βCAP73 [21], дистрофином и утрофи%
ны актина у человека локализованы на разных
ном [22]. При сравнении взаимодействия ABPs с
хромосомах [4]: α%скелетный (ACTA1) - на хро%
β% или γ%актином обнаружено преимуществен%
мосоме
1; α%кардиальный или сердечный
ное связывание γ%актина с аннексином V [23].
(ACTC1) - на хромосоме 15; α%гладкомышечный
Эти данные позволили предположить, что в
(ACTA2) - на хромосоме 10; γ%гладкомышечный
клетке, в которой одновременно экспрессиру%
(ACTG2) - на хромосоме 2; β%цитоплазматичес%
ются разные изоформы актина, присутствие
кий (ACTB) - на хромосоме 7; и γ%цитоплазма%
ABPs может приводить к образованию структур,
тический (ACTG1) - на хромосоме 17. Изофор%
селективно обогащенных одной из изоформ ак%
мы актина кодируются структурно родственны%
тина. После локальной трансляции изоформы
ми генами с высокогомологичными нуклеотид%
актина могут быть распределены внутри различ%
ными последовательностями [5]. Основные отли%
ных цитоплазматических доменов изоформ%
чия между изоформами локализованы на N%кон%
специфическими ABPs.
це [2]. Эта вариабельность вносит вклад в общий
Во взрослом организме α%скелетный и α%сер%
заряд молекул, который определяют с помощью
дечный актины, как правило, ограничены ске%
изо%электрофокусирования. Небольшие разли%
летными и сердечными мышцами, а экспрессия
чия в изо%электрических точках (5,40; 5,42 и
α% и γ%гладкомышечных актинов происходит, в
5,44) легли в основу классификации на α%, β% и
основном, в гладких мышцах сосудов и внутрен%
γ%изоформы актина [6, 7]. Несмотря на сходные
них органов. Цитоплазматические β% и γ%акти%
трехмерные структуры, несколько аминокислот%
ны обнаружены во всех клетках, мышечных и
ных замен, локализованных в субдоменах 1 и 3,
немышечных, в соотношениях, регулируемых
могут вызывать значительные изменения в кон%
во времени и пространстве [6].
формации актина. Изоформы могут отличаться
Разные изоформы актина могут избиратель%
как по общему положению малого домена от%
но входить в состав разных структур актинового
носительно большого домена, так и по локаль%
цитоскелета, таких как миофибриллы, стресс%
ным конформациям на N%конце и, возможно,
фибриллы, ламеллиподии или филоподии [24].
на C%конце [8].
Морфофункциональное разнообразие актино%
БИОХИМИЯ том 84 вып. 6 2019
ИЗОФОРМЫ АКТИНА У МЛЕКОПИТАЮЩИХ
749
вых структур в немышечных клетках возможно
новых филаментов [33, 34]. Локализация мРНК
благодаря специфическому взаимодействию
позволяет клеткам пространственно регулиро%
изоформ актина, миозина и тропомиозина [25].
вать трансляцию и, тем самым, создавать функ%
С помощью криоэлектронной микроскопии не%
ционально разные компартменты. Известно,
давно была получена структура комплекса акто%
что мРНК β%актина специфически локализова%
миозина%тропомиозина с высоким разрешени%
на на ведущем крае фибробластов [35, 36]. Лока%
ем [26] для цитоплазматического γ%актина, не%
лизация белка β%актина на ведущем крае фиб%
мышечных миозина%2С и тропомиозина 3.1 че%
робластов зависит от локализации его мРНК [37].
ловека.
Взаимодействие мРНК β%актина с zip%код%свя%
зывающим белком (ZBP1, [38]) необходимо для
ее локализации в ламеллиподии, что играет оп%
РЕГУЛЯЦИЯ ЭКСПРЕССИИ
ределяющую роль в клеточной полярности и
ИЗОФОРМ АКТИНА
движении [34, 39], особенно для неметастазиру%
ющих клеток.
Различия в экспрессии и распределении изо%
Низкий уровень ZBP1 коррелирует с инвази%
форм могут происходить либо на уровне генов
ей и метастазированием, как было показано для
(через промоторные элементы), и/или на уров%
клеток рака молочной железы человека и крысы
не мРНК (через UTRs), и/или на уровне белка
[40]. Более того, ZBP1 был экзогенно экспрес%
(через специфические взаимодействия с ABPs).
сирован в крысиной линии метастазирующей
мРНК изоформ актина различаются гораздо
аденокарциномы молочной железы (MTLn3), в
сильнее, чем кодируемые ими белки [24]. Во
которой эндогенный уровень ZBP1 низок и
многих случаях 5'% и/или 3'%UTRs мРНК акти%
мРНК β%актина де%локализована. Оказалось,
новых изоформ отличаются не только по после%
что заново синтезированный актин вносит не%
довательности, кодирующей белок. Эволюци%
значительный вклад во фракцию мономерного
онная сохранность некоторых из изоформ%спе%
актина на ведущем крае [41]. Методом трекинга
цифических UTRs означает, что они, по всей ве%
одиночных мРНК β%актина было показано, что
роятности, обладают функциональной значи%
ZBP1 транспортирует мРНК β%актина в места
мостью [27, 28]. Целый комплекс взаимодей%
фокальных контактов, где он задерживается на
ствующих между собой регуляторных элементов
некоторое время, приводя к стабилизации фо%
был обнаружен в промоторном районе актино%
кальных контактов и регулируя направленность
вых генов. Отдельные сигнальные молекулы
движения фибробластов [42].
воздействуют на гены всех изоформ, но сущест%
В качестве дополнения к транскрипционно%
вуют и другие, специфичные для каждой изо%
му и трансляционному контролю конкуренция
формы актина. Такие элементы избирательно
между изоформами за включение в специфичес%
модулируют экспрессию изоформ актина: напря%
кие структуры и разное сродство к ABPs может
мую или через взаимодействие с другими регу%
определять внутриклеточную локализацию изо%
ляторными элементами. Наиболее интересная
форм актина. Так как распределение изоформ
регуляция экспрессии происходит через инду%
актина часто отличается от распределения соот%
цирующие экспрессию актина сывороточные
ветствующих мРНК [43], изоформ%специфичес%
респонсивные факторы (SRF, serum response fac
кий сортинг мРНК скорее определяет сайты
tor) [29]. Все промоторные области актиновых
синтеза и сборки, чем локализацию актиновых
генов содержат в своей последовательности не%
изоформ в клетке [44].
сколько SRF%связывающих элементов, которые
Существует гипотеза регуляции сегрегации
могут оказывать регуляторное действие на экс%
изоформ актина путем N%концевого аргинили%
прессию изоформ актина [30]. G%актин может
рования. Обнаружено, что β% (но не γ%актин) в
ингибировать экспрессию генов, связываясь с
иммортализованных SV%40 фибробластах под%
транскрипционными факторами MRTF%A (MAL)
вержен N%концевому аргинилированию [45]. По
и MRTF%B. Полимеризация актина уменьшает
мнению авторов, это индуцировало образование
цитоплазматический пул G%актина, вызывая
«слабой» β%актиновой сети на ведущем крае
высвобождение транскрипционных факторов,
клетки [46]. По результатам масс%спектроско%
что приводит к последовательной экспрессии
пии предполагалось, что этот тип модификации
генов%мишеней [30].
случается в 20-40% β%актина. Позднее было по%
Механизм внутриклеточного распределения
казано, что аргинилирование может происхо%
изоформ актина может работать как на уровне
дить на любом N%концевом остатке, включая не
белка, так и на уровне мРНК [31, 32]. Асиммет%
только актины, но и Arp3, филамин, спектрин,
ричный сортинг транскрипта β%актина достига%
немышечный миозин 1 и талин [47]. Тем не ме%
ется транспортом вдоль микротрубочек и акти%
нее, строго доказано, что созревание изоформ
БИОХИМИЯ том 84 вып. 6 2019
750
ДУГИНА и др.
актина стартует с N%концевого кислого АК ос%
цифических антител к изоформам позволило
татка N%концевым ацетилированием. Созрева%
существенно продвинуться в изучении распре%
ние молекулы актина важно для эффективного
деления и функций изоформ.
взаимодействия с ABPs, особенно, c миозином
[48, 49].
Проверка активности рекомбинантной аце%
ЦИТОПЛАЗМАТИЧЕСКИЕ АКТИНЫ:
тилтрансферазы NAT6 человека [50] выявила
ВНУТРИКЛЕТОЧНАЯ ОРГАНИЗАЦИЯ
специфическую активность данного фермента
И ФУНКЦИИ
по отношению к пептидам, соответствующим
N%концевой последовательности аминокислот
Цитоплазматические актины (β и γ) играют
разных изоформ актина млекопитающих. В ре%
определяющие роли в таких ключевых процес%
зультате нокаута NAT6 в двух линиях клеток че%
сах, как клеточная адгезия, миграция, поляриза%
ловека не происходило ацетилирование первых
ция и цитокинез. В большинстве немышечных
аминокислотных остатков зрелого β% и γ%акти%
клеток позвоночных около половины актиново%
на. Ацетилирование этих двух изоформ актина
го пула присутствует в мономерном состоянии,
полностью восстанавливалось при экзогенной
что означает активную динамику полимериза%
экспрессии NAT6, а также после инкубации
ции%деполимеризации. Немышечные клетки,
экстрактов NAT6%дефицитных клеток с низкими
такие как эпителиальные, экспрессируют толь%
концентрациями рекомбинантного NAT6. Ка%
ко β% и γ%актины, в различных пропорциях [51].
талитическая субъединица другой N%ацетил%
β% и γ%Актины отличаются только по четырем
трансферазы, NatA (NAA10), которая ацетили%
аминокислотным остаткам в положении 1, 2, 3,
рует многие внутриклеточные белки, такой ак%
и 9. По данным мутационных и нокаутных ис%
тивностью не обладала или показывала гораздо
следований на мышиных моделях специфичес%
меньшую активность в подобных эксперимен%
кие функции для α%мышечных изоформ оче%
тах. Скелетный актин, экспрессируемый в
видны [52, 53]. Данные генетических экспери%
NAT6%дефицитных клетках, не был ацетилиро%
ментов с β% и γ%актинами неоднозначны, но ско%
ван по N%концу, что говорит о необходимости
рее указывают на различия функций цитоплаз%
NAT6 и для ацетилирования этой изоформы
матических актинов [52, 54-57].
мышечного актина. Таким образом, показана
Локализация белков β% и γ%актина в различ%
необходимость NAT6 для последнего этапа соз%
ных внутриклеточных компартментах была ра%
ревания актинов путем переноса ацетила на
нее описана [51, 54], но результаты были до%
N%концевой аминокислотный остаток
[50].
вольно противоречивы, вероятно, из%за вариа%
Предыдущие этапы созревания молекул актина
бельности экспериментальных условий и мето%
осуществляются другими ферментами.
дических подходов. Использование поликло%
нальных антител к γ%актину, не распознающих
β%актин, но реагирующих с гладкомышечными
ФУНКЦИИ ИЗОФОРМ АКТИНА
актинами, по%видимому, благодаря общей ами%
нокислотной последовательности AcEEE на
Изоформы актина, в основном, тканеспеци%
N%конце, усложняло интерпретацию результа%
фичны. Их клеточные функции подтверждают%
тов [51]. Мезенхимальные клетки в культуре,
ся с помощью различных взаимодополняющих
например, фибробласты, помимо цитоплазма%
исследовательских подходов: 1) экспрессия изо%
тических актинов экспрессируют α%гладкомы%
форм актина в нормальных клетках и тканях в
шечный актин. Тщательно отобранные монокло%
процессе развития организма и при различных
нальные антитела (mAbs), высокоспецифичные
патологических ситуациях; 2) мышиные модели
для γ%актина, т.е. не реагирующие с β%актином
(нокаутные и трансгенные), в которых изофор%
и гладкомышечными актинами, были использо%
мы были избирательно удалены, эксперимен%
ваны для изучения распределения цитоплазма%
тально восстановлены или гиперэкспрессирова%
тических изоформ актина и функциональных
ны; 3) структурные и функциональные дефек%
исследований [58]. Несмотря на то, что mAbs к
ты; 4) эффекты ингибирования экспрессии или
β%актину существовали ранее, отсутствие спе%
организации изоформ в клетках методом малых
цифических mAb к γ%актину не давало возмож%
интерферирующих РНК или ингибирующими
ности проводить сравнительное изучение расп%
пептидами.
ределения этих двух изоформ в клетках. Отсут%
Важным этапом в выяснении специфичес%
ствие окрашивания β%актина в стресс%фибрил%
ких биологических ролей актиновых изоформ
лах ошибочно характеризовало эти структуры
было описание их тканевого распределения и
как образованные из γ%актиновых филаментов.
внутриклеточной локализации. Получение спе%
Даже с подходящими антителами окраска отсут%
БИОХИМИЯ том 84 вып. 6 2019
ИЗОФОРМЫ АКТИНА У МЛЕКОПИТАЮЩИХ
751
ствовала, по%видимому, из%за недоступности
ных немышечных клеток, что указывало на уни%
эпитопа, так как для демаскировки N%концевой
версальность данного феномена (рис. 1, а-в;
последовательности актина необходимы специ%
рис. 4, а, б).
фические условия фиксации [58, 59].
Исследования функциональных ролей β и
В основе способности клеток к делению,
γ%актинов проводили с помощью метода РНК%
движению, генерации натяжения и сократимос%
интерференции для избирательного уменьше%
ти и поддержанию формы лежат специализиро%
ния экспрессии изоформ. В результате было по%
ванные актин%содержащие структуры. С по%
казано, что каждая изоформа играет свою роль в
мощью высокоспецифичных моноклональных
организации клеточной морфологии, полярнос%
антител была исследована внутриклеточная ло%
ти и подвижности [58]. Метод РНК%интерфе%
кализация β и γ%цитоплазматических актинов в
ренции также подтвердил сегрегацию изоформ
стабильно поляризованных клетках и на различ%
актина в разные структуры актинового цитоске%
ных моделях индуцированных реорганизаций:
лета (рис. 3).
в условиях распластывания, миграции, деления и
Данные о сравнительной структуре и белко%
сократимости. Результаты были получены с по%
вой композиции кортикальных γ%актиновых се%
мощью одновременной специфической имму%
тей, а также β%актиновых пучков и контактных
нодетекции β и γ%актинов в одной и той же клет%
структур в нормальных и неопластически транс%
ке (рис. 1-4). Оказалось, что эти изоформы мо%
формированных клетках были получены на ли%
гут формировать разные актиновые структуры в
ниях эпителиальных клеток различного орган%
цитоплазме мезенхимальных (рис. 1-3) и эпите%
ного происхождения [58, 60, 61]. Анализ трех%
лиальных клеток (рис. 4) в состоянии покоя, а
мерной взаимной организации β% и γ%актина в
также при движении и делении [58]. Для срав%
интерфазе и на разных стадиях митоза был про%
нительного изучения цитоплазматических изо%
веден с использованием лазерной конфокаль%
форм актина были протестированы разные ли%
ной микроскопии. Было показано, что β%актин
нии и первичные культуры клеток животных и
преимущественно локализован в филоподиях,
человека. Особое внимание было уделено лини%
стресс%фибриллах, кольцевых пучках и адгези%
ям клеток нормального эпителия, так как в
онных межклеточных контактах, что позволило
клетках этого типа экспрессируются только две
предположить роль этой изоформы в клеточной
изоформы актина, β и γ. Сегрегацию изоформ
адгезии и сокращении [58, 61]. γ%Актин органи%
наблюдали во всех изученных типах нормаль%
зован по%разному в зависимости от клеточной
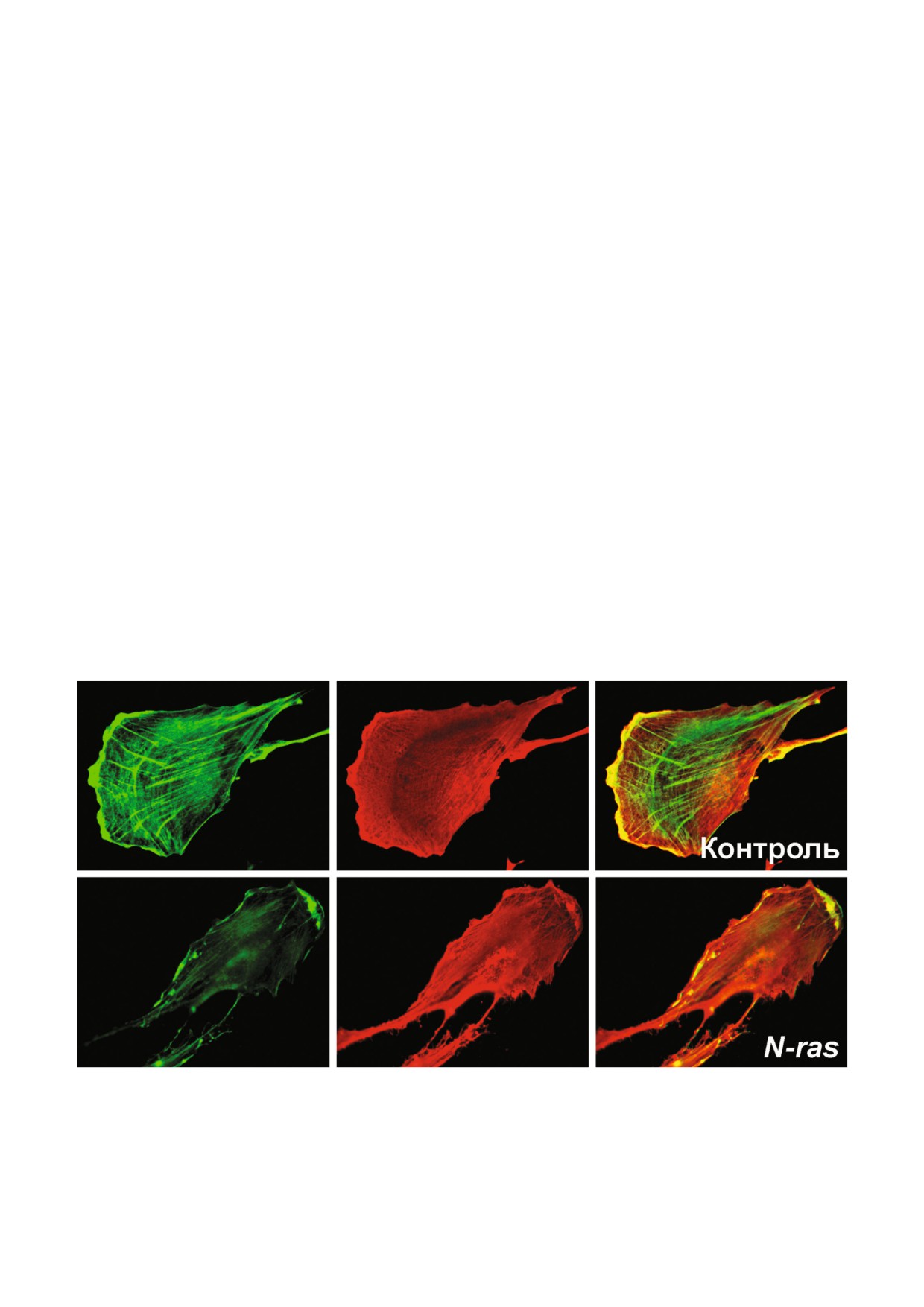
а
б
в
г
д
е
Рис. 1. Реорганизация актинового цитоскелета фибробластов при неопластической трансформации. Нормальный (а-в) и
трансформированный онкогеном N%RAS (г-е) подкожные фибробласты человека, окрашивание антителами к β%актину
(зеленый) и γ%актину (красный). В трансформированной клетке не выявляются β%актиновые стресс%фибриллы, но сохра%
няется сеть γ%актина
БИОХИМИЯ том 84 вып. 6 2019
752
ДУГИНА и др.
активности, но преимущественно - в виде кор%
том в пользу роли β%актина в клеточной сокра%
тикальных и ламеллярных сетей в движущихся
тимости является четкая локализация этой изо%
клетках, что предполагает, что он играет важную
формы в сократимом кольце при цитокинезе, в
роль в клеточной подвижности (рис. 2). Локали%
то время как γ%актин концентрируется, в основ%
зация β%актина в миозин II%зависимых сократи%
ном, в субмембранном домене в течение всех
мых пучках (стресс%фибриллах, кольцевых пуч%
митотических фаз. Данные об образовании
ках) свидетельствует о роли этой изоформы в
большого количества двуядерных клеток в не%
клеточной сократимости. Еще одним аргумен%
трансформированных эпителиальных β%актин%
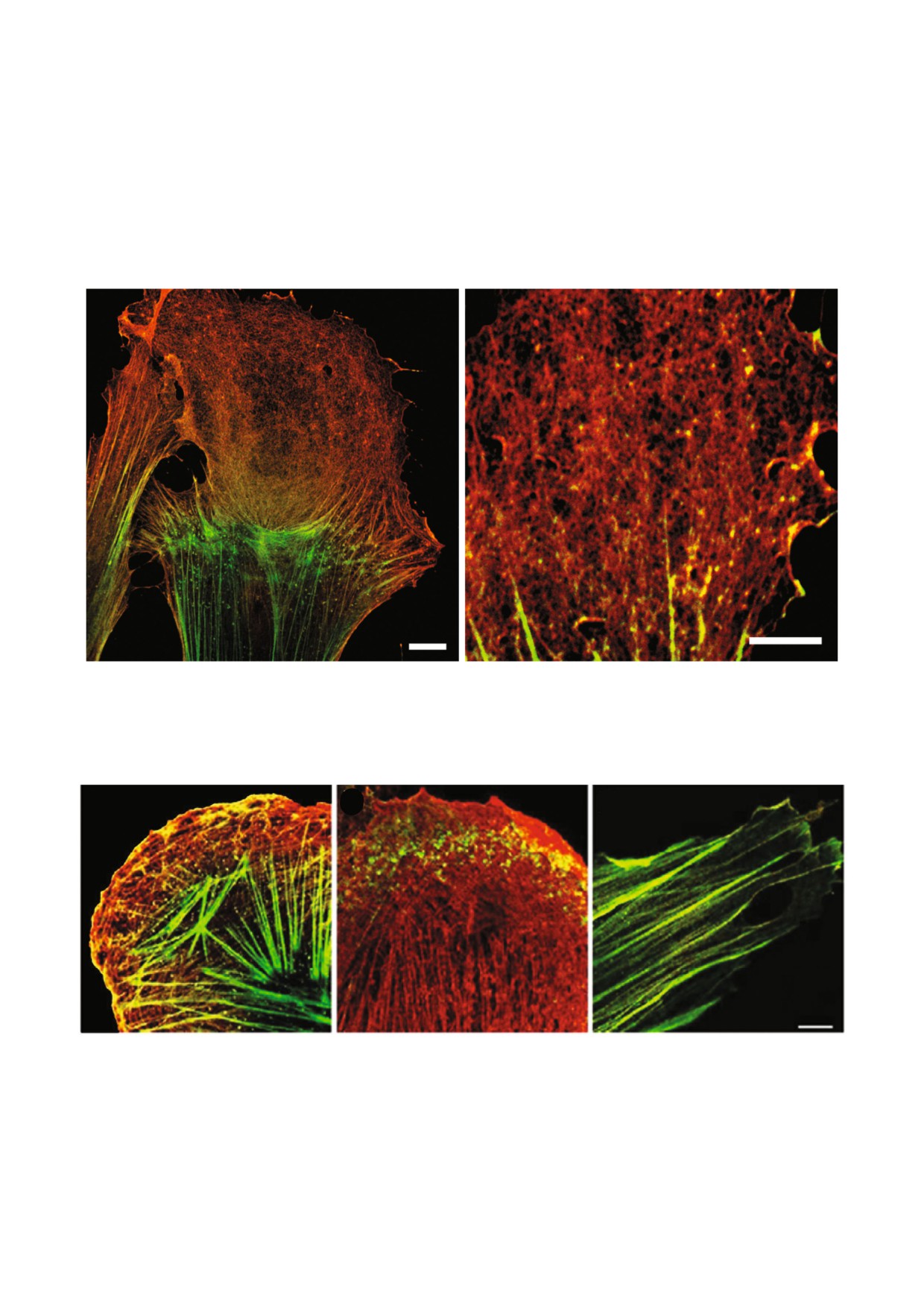
а
б
Рис. 2. Различия в распределении β% и γ%актина на ведущем крае клеток при движении в рану. Экспериментальная рана
сделана методом удаления части монослоя культуры нормальных подкожных фибробластов человека. Через 3 ч после на%
несения раны клетки были зафиксированы и окрашены антителами к β%актину (зеленый) и γ%актину (красный). Выявля%
ются β%актиновые пучки (стресс%фибриллы), сеть γ%актина ярко выражена в протрузиях движущихся клеток. Лазерная
сканирующая конфокальная микроскопия. Масштаб 10 мкм (а), 5 мкм (б)
а
б
в
Рис. 3. Реорганизация актинового цитоскелета фибробласта при избирательном уменьшении экспрессии цитоплазмати%
ческих изоформ актина. Фрагменты ведущего края клетки в контроле (а) и после уменьшения экспрессии β%актина (б)
или γ%актина (в) в клетках подкожных фибробластов человека. Окрашивание антителами к β%актину (зеленый) и γ%акти%
ну (красный). При уменьшении экспрессии β%актина (б) в клетках не выявляются β%актиновые стресс%фибриллы, но со%
храняется сеть γ%актина. При уменьшении экспрессии γ%актина (в) в клетках выявляются β%актиновые стресс%фибриллы.
Лазерная сканирующая конфокальная микроскопия. Масштаб 5 мкм
БИОХИМИЯ том 84 вып. 6 2019
ИЗОФОРМЫ АКТИНА У МЛЕКОПИТАЮЩИХ
753
дефицитных клетках полностью согласуется с
районе межклеточных контактов [58, 62], но ре%
участием β%актина в образовании сократимого
гулируют разные адгезионные комплексы в эпи%
кольца при клеточном делении.
телии: β%актин функционально связан с адгези%
Обе изоформы локализованы в апикальной
онными контактами, а γ%актин - с плотными
части поляризованных эпителиальных клеток в контактами [61]. Исследования организации и
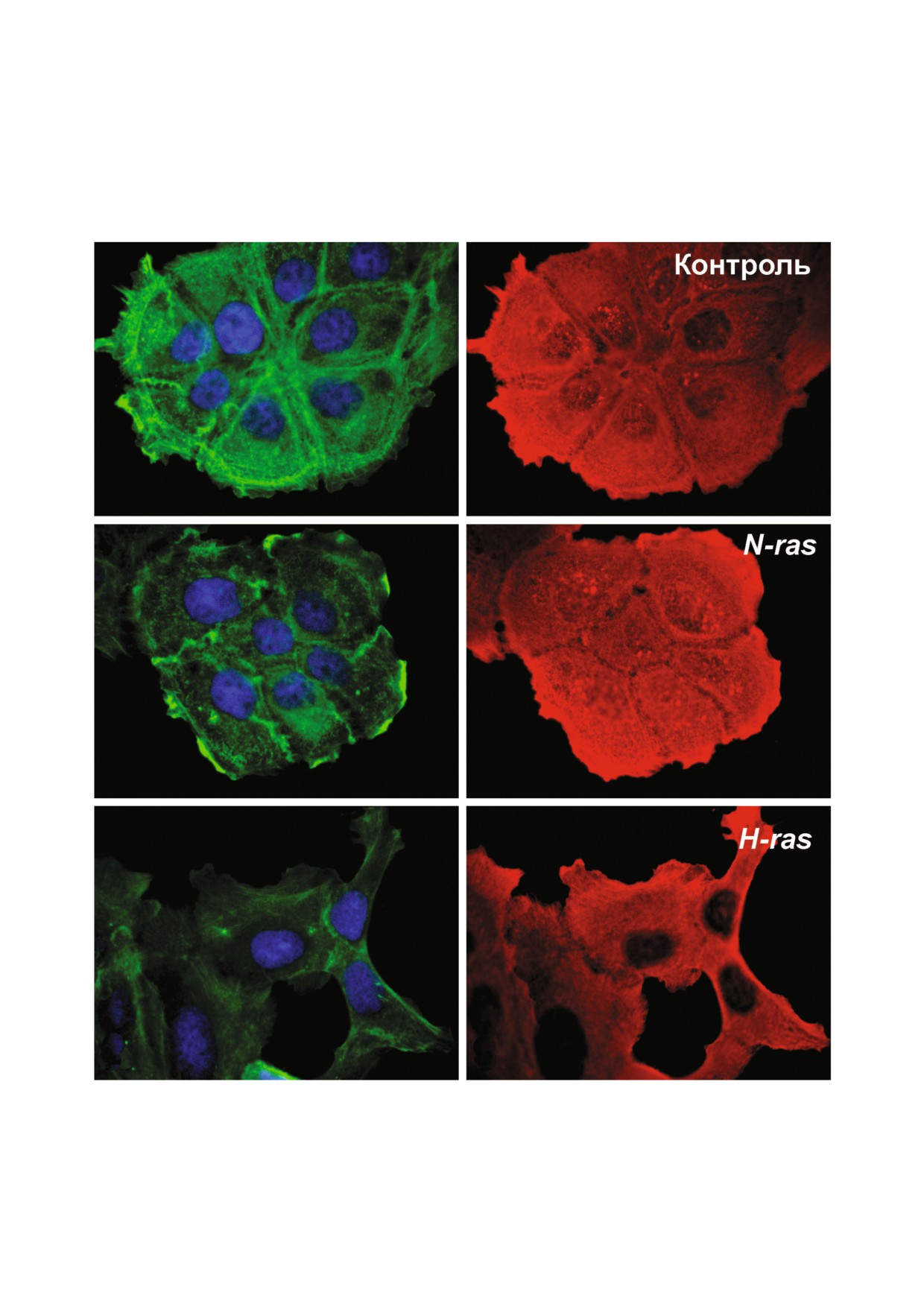
а
б
г
в
е
д
Рис. 4. Реорганизация цитоплазматических актинов в кератиноцитах при трансформации онкогенами RAS. Контрольные
(а, б), N RAS (в, г) и H RAS (д, е) трансформированные клетки были окрашены антителами к β% (зеленый) и γ%актину
(красный). DRAQ5 (ДНК, синий)
БИОХИМИЯ том 84 вып. 6 2019
754
ДУГИНА и др.
распределения изоформ актина в митозе [58, 63],
Показано, что локализация мРНК β%актина
мейозе и ранних эмбриональных делениях [64]
на ведущем крае фибробластов, эндотелиаль%
выявили существенные морфофункциональные
ных клеток и миобластов связана с направлен%
различия. Изменение функции γ%актина с по%
ным движением нормальных клеток, а делока%
мощью микроинъекции изоформ%специфичес%
лизация - с потерей стабильной клеточной по%
ких антител показало, что γ%актин выполняет
ляризации и направленного движения [41]. Вза%
основную и специфическую функцию в уста%
имодействие ZBP1, необходимое для локализа%
новлении и/или поддержании асимметрии в
ции мРНК β%актина на ведущем крае фибро%
первом делении мейоза и поддержании корти%
бластов, вызывает стабильный поляризованный
кальной целостности. Возможно, различие в
фенотип у опухолевых клеток, но редуцирует их
экспрессии γ%актина является одним из ранних
хемотактически%зависимую подвижность, инва%
маркеров, определяющих клеточную судьбу при
зивность и метастатический потенциал [73].
эмбриональном развитии.
Частичная супрессия γ%актина в клетках SH%EP
нейробластомы методом РНК%интерференции
значительно угнетала миграцию, а также снижа%
РЕОРГАНИЗАЦИЯ АКТИНОВЫХ
ла полярность и скорость движения одиночных
СТРУКТУР ПРИ НЕОПЛАСТИЧЕСКОЙ
клеток [74]. Недавно было показано, что ген
ТРАНСФОРМАЦИИ
γ%актина (ACTG1) отвечает за усиление проли%
ферации и миграции клеток рака кожи [75].
В настоящее время известно об изменениях
Генетические эксперименты выявили угне%
экспрессии специфических мышечных и немы%
тение миграционного потенциала мышиных
шечных изоформ актина при различных патоло%
эмбриональных фибробластов с выключенным
гиях человека [52, 57].
геном ACTB, но причиной таких изменений бы%
При опухолевой трансформации происходит
ла компенсаторная экспрессия α%гладкомышеч%
реорганизация актинового цитоскелета, веду%
ного актина [76].
щая к изменению клеточной подвижности, ин%
Функциональные роли цитоплазматических
вазии и метастазированию. Отмечена корреля%
актинов были также определены при исследова%
ция между исчезновением стресс%фибрилл и по%
нии регуляции β% и γ%актинов в нормальных и
вышением миграционной активности или ме%
опухолевых клетках. При неопластической транс%
тастатического потенциала опухолевых клеток
формации происходит реорганизация акто%ми%
[65, 66]. Исчезновение α%гладкомышечного ак%
озиновой системы с изменением специфичес%
тина происходит при спонтанной, вирусной и
кой изоформы актина - β%актина (рис. 1, 4) [58,
канцерогенной трансформации [67-69]. Мута%
60, 62, 77], что приводит к повышению клеточ%
ции в гене ACTB β%актина вызывают неопласти%
ной подвижности и инвазии [78-81]. Иммуно%
ческую трансформацию фибробластов человека
морфологические исследования клинического
[70, 71], а также злокачественную прогрессию
материала подтверждают данные, полученные
мышиной меланомы [72]. Подвижность фиб%
на клеточных культурах [60, 62, 82].
робластов, лишенных β%актина или, особенно,
Фенотипическая нормализация трансфор%
γ%актина, отличается от подвижности их нор%
мированных фибробластов, а также опухолевых
мальных предшественников, что указывает на
клеток мезенхимального и эпителиального про%
разные роли изоформ актина в движении клеток
исхождения под действием митохондриально%
[58]. Лазерная конфокальная микроскопия выя%
направленных антиоксидантов приводит к вос%
вила колокализацию β% и γ%актина в ламеллипо%
становлению системы пучков β%актина и сопря%
дии, но обе изоформы присутствуют в ламелле
женных с ними фокальных контактов у фибро%
фибробластов: β%актин локализован в пучках
бластов и адгезионных межклеточных контак%
микрофиламентов, концы которых соединены с
тов у эпителиальных клеток [77, 83, 84].
фокальными контактами [58], а γ%актин образу%
Уменьшение экспрессии цитоплазматичес%
ет сеть кортикального актина. В нормальных
ких изоформ актина с помощью РНК%интерфе%
фибробластах мРНК β%актина концентрируется
ренции, а также экзогенная экспрессия β% и
во фронтальной части ламеллы, но заново син%
γ%актина в опухолевых клетках выявили функ%
тезированный актин вносит незначительный
циональную разницу между изоформами. Инду%
вклад во фракцию мономерного актина на веду%
цированные модуляции экспрессии β% или γ%ак%
щем крае клетки [41]. Методом трекинга оди%
тина вызывали различные изменения морфоло%
ночных мРНК β%актина было показано, что
гии, подвижности, пролиферации, инвазивных
транспортировка этих мРНК в места фокальных
и опухолеродных свойств изучаемых культур.
контактов приводит к стабилизации контакт%
Была показана роль β%актина в поддержании
ных структур [42].
нормального фенотипа и противоположная
БИОХИМИЯ том 84 вып. 6 2019
ИЗОФОРМЫ АКТИНА У МЛЕКОПИТАЮЩИХ
755
роль γ%актина в усилении неопластических
ференции и экзогенного увеличения экспрес%
свойств клеток карцином легкого, кишки и мо%
сии продемонстрировано существование функ%
лочной железы [85, 86]. Положительная взаимо%
ционально разных актиновых систем в клетке.
зависимость экспрессии γ%актина и активации
Преобладание γ%актина приводит к ускоренной
ERK1/2, наряду с преобладанием этой изофор%
пролиферации и инвазии опухолевых клеток, а
мы во всех исследованных опухолевых образцах,
увеличение экспрессии β%актина, напротив,
указывает на универсальный характер измене%
супрессирует эти свойства.
ний немышечных актинов при развитии неко%
Таким образом, морфофункциональные ис%
торых часто встречающихся опухолей. По%види%
следования изоформ актина выявили качест%
мому, прямое или опосредованное взаимодей%
венно новые закономерности организации ак%
ствие γ%актина с ERK1/2 важно и при измене%
тинового цитоскелета в нормальных и неоплас%
нии характеристик клеточного цикла у клеток
тически трансформированных клетках. Изуче%
карцином [87]. В нормальных фибробластах и
ние изменений соотношения экспрессии изо%
эпителиальных клетках происходит сегрегация
форм актина, а также тонких изменений струк%
цитоплазматических изоформ актина, наиболее
туры и локализации изоформ может быть удоб%
ярко выраженная при реорганизациях актино%
ным экспериментальным подходом при иссле%
вого цитоскелета. В нормальных немышечных
довании новых методов диагностики [88], мони%
клетках β% и γ%актины образуют различные
торинга и лечения различных заболеваний чело%
структуры (пучки и кортикальную сеть микро%
века и животных.
филаментов соответственно), и существуют
функциональные различия между цитоплазма%
Финансирование. Работа выполнена при фи%
тическими изоформами актина. Показана связь
нансовой поддержке Российского научного
неопластической трансформации клетки с ре%
фонда (14%15%00467).
организациями изоформ актина и модуляциями
Соблюдение этических норм. Настоящая
в их экспрессии. На культивируемых клетках, а
статья не содержит описания каких%либо иссле%
также тканевых срезах, выявлено нарушение
дований, где в качестве моделей были использо%
системы β%актиновых пучков при сохранении
ваны люди или животные.
кортикальной сети γ%актина при неопластичес%
Конфликт интересов. Авторы заявляют об от%
кой трансформации. С помощью РНК%интер% сутствии конфликта интересов.
СПИСОК ЛИТЕРАТУРЫ
1.
Pollard, T.D., and Cooper, J.A. (2009) Actin, a central
10. Drazic, A., Aksnes, H., Marie, M., Boczkowska, M.,
player in cell shape and movement, Science,
326,
Varland, S., Timmerman, E., Foyn, H., Glomnes, N.,
1208-1212, doi: 10.1126/science.1175862.
Rebowski, G., Impens, F., Gevaert, K., Dominguez, R.,
2.
Vandekerckhove, J., and Weber, K. (1978) At least six dif%
and Arnesen, T. (2018) NAA80 is actin’s N%terminal
ferent actins are expressed in a higher mammal: an analysis
acetyltransferase and regulates cytoskeleton assembly and
based on the amino acid sequence of the amino%terminal
cell motility, Proc. Natl. Acad. Sci. USA, 115, 4399-4404,
tryptic peptide, J. Mol. Biol., 126, 783-802, doi: 10.1016/
doi: 10.1073/pnas.1718336115.
0022%2836(78)90020%7.
11. Goris, M., Magin, R.S., Foyn, H., Myklebust, L.M.,
3.
Kabsch, W., and Vandekerckhove, J. (1992) Structure and
Varland, S., Ree, R., Drazic, A., Bhambra, P., Stove, S.I.,
function of actin, Annu. Rev. Biophys. Biomol. Struct., 21,
Baumann, M., Haug, B.E., Marmorstein, R., and
49-76, doi: 10.1146/annurev.bb.21.060192.000405.
Arnesen, T. (2018) Structural determinants and cellular
4.
Gunning, P., Ponte, P., Kedes, L., Eddy, R., and Shows, T.
environment define processed actin as the sole substrate
(1984) Chromosomal location of the coexpressed human
of the N%terminal acetyltransferase NAA80, Proc. Natl.
skeletal and cardiac actin genes, Proc. Natl. Acad. Sci. USA,
Acad. Sci. USA, 115, 4405-4410, doi: 10.1073/pnas.
81, 1813-1817, doi: 10.1073/pnas.81.6.1813.
1719251115.
5.
Hightower, R.C., and Meagher, R.B. (1986) The molecu%
12. Bergeron, S.E., Zhu, M., Thiem, S.M,, Friderici, K.H.,
lar evolution of actin, Genetics, 114, 315-332.
and Rubenstein, P.A. (2010) Ion%dependent polymeriza%
6.
Garrels, J.I., and Gibson, W. (1976) Identification and
tion differences between mammalian beta% and gamma%
characterization of multiple forms of actin, Cell, 9,
nonmuscle actin isoforms, J. Biol. Chem.,
285,
793-805, doi: 10.1016/0092%8674(76)90142%2.
16087-16095, doi 10.1074/jbc.M110.110130.
7.
Rubenstein, P.A. (1990) The functional importance of
13. Sheterline, P., Clayton, J., and Sparrow, J. (1995) Actin,
multiple actin isoforms, Bioessays, 12, 309-315, doi:
Protein Profile, 2, 1-103.
10.1002/bies.950120702.
14. Muller, M., Diensthuber, R.P., Chizhov, I., Claus, P.,
8.
Schutt, C.E., Myslik, J.C., Rozycki, M.D., Goonesekere, N.C.,
Heissler, S.M., Preller, M., Taft, M.H., and Manstein, D.J.
and Lindberg, U. (1993) The structure of crystalline profilin%
(2013) Distinct functional interactions between actin iso%
beta%actin, Nature, 365, 810-816, doi: 10.1038/365810a0.
forms and nonsarcomeric myosins, PLoS One, 8, e70636,
9.
Rubenstein, P.A., and Martin, D.J. (1983) NH2%terminal
doi: 10.1371/journal.pone.0070636.
processing of actin in mouse L%cells in vivo, J. Biol. Chem.,
15. Larsson, H., and Lindberg, U. (1988) The effect of divalent
258, 3961-3966.
cations on the interaction between calf spleen profilin and
БИОХИМИЯ том 84 вып. 6 2019
756
ДУГИНА и др.
different actins, Biochim. Biophys. Acta, 953, 95-105, doi:
transcript accumulation during human myogenesis, Mol.
10.1016/0167%4838(88)90013%1.
Cell. Biol., 197, 4100-4114, doi: 10.1128/MCB.7.11.4100.
16.
Ohshima, S., Abe, H., and Obinata, T. (1989) Isolation of
33.
Latham, V.M., Kislauskis, E.H., Singer, R.H., and Ross, A.F.
profilin from embryonic chicken skeletal muscle and evalua%
(1994) Beta%actin mRNA localization is regulated by signal
tion of its interaction with different actin isoforms, J. Bio
transduction mechanisms, J. Cell Biol., 126, 1211-1219,
chem., 5, 855-857.
doi: 10.1083/jcb.126.5.1211.
17.
Weber, A., Nachmias, V.T., Pennise, C.R., Pring, M., and
34.
Oleynikov, Y., and Singer, R.H. (2003) Real%time visuali%
Safer, D. (1992) Interaction of thymosin beta 4 with muscle
zation of ZBP1 association with beta%actin mRNA during
and platelet actin: implications for actin sequestration in
transcription and localization, Curr. Biol., 13, 199-207,
resting platelets, Biochemistry, 31, 6179-6185, doi: 10.
doi: 10.1016/S0960%9822(03)00044%7.
1021/bi00142a002.
35.
Kislauskis, E.H., Li, Z., Singer, R.H., and Taneja, K.L.
18.
Namba, Y., Ito, M., Zu, Y., Shigesada, K., and Maruyama, K.
(1993) Isoform%specific 3’%untranslated sequences sort
(1992) Human T cell L%plastin bundles actin filaments in a
alpha%cardiac and beta%cytoplasmic actin messenger
calcium%dependent manner, J. Biochem., 112, 503-507.
RNAs to different cytoplasmic compartments, J. Cell Biol.,
19.
Shuster, C.B., and Herman, I.M. (1995) Indirect associa%
123, 165-172, doi: 10.1083/jcb.123.1.165.
tion of ezrin with F%actin: isoform specificity and calcium
36.
Lawrence, J.B., and Singer, R.H. (1986) Intracellular
sensitivity, J. Cell Biol., 128, 837-848, doi: 10.1083/jcb.
localization of messenger RNAs for cytoskeletal proteins,
128.5.837.
Cell, 45, 407-415, doi: 10.1016/0092%8674(86)90326%0.
20.
Yao, X., Cheng, L., and Forte, J.G. (1996) Biochemical
37.
Shestakova, E.A., and Singer, R.H., Condeelis, J. (2001)
characterization of ezrin%actin interaction, J. Biol. Chem.,
The physiological significance of beta%actin mRNA locali%
271, 7224-7229, doi: 10.1074/jbc.271.12.7224.
zation in determining cell polarity and directional motility,
21.
Shuster, C.B., Lin, A.Y., Nayak, R., and Herman, I.M.
Proc. Natl. Acad. Sci. USA, 98, 7045-7050, doi: 10.1073/
(1996) Beta cap73: a novel beta actin%specific binding pro%
pnas.121146098.
tein, Cell. Motil. Cytoskeleton, 35,175-187, doi: 10.1002/
38.
Ross, A.F., Oleynikov, Y., Kislauskis, E.H., Taneja, K.L.,
(SICI)1097%0169(1996)35:3<175::AID%CM1>3.0.CO;2%8.
and Singer, R.H. (1997) Characterization of a beta%actin
22.
Winder, S.J., Hemmings, L., Maciver, S.K., Bolton, S.J.,
mRNA zipcode%binding protein, Mol. Cell. Biol., 17,
Tinsley, J.M., Davies, K.E., Critchley, D.R., and Kend%
2158-2165, doi: 10.1128/MCB.17.4.2158.
rick%Jones, J. (1995) Utrophin actin binding domain:
39.
Kislauskis, E.H., Zhu, X., and Singer, R.H. (1997) Beta%
analysis of actin binding and cellular targeting, J. Cell Sci.,
actin messenger RNA localization and protein synthesis
63-71.
augment cell motilit, J. Cell Biol., 136, 1263-1270, doi: 10.
23.
Tzima, E., Trotter, P.J., Orchard, M.A., and Walker, J.H.
1083/jcb.136.6.1263.
(2000) Annexin V relocates to the platelet cytoskeleton upon
40.
Wang, W., Goswami, S., Lapidus, K., Wells, A.L., Wyckoff, J.B.,
activation and binds to a specific isoform of actin, Eur. J.
Sahai, E., Singer, R.H., Segall, J.E., and Condeelis, J.S.
Biochem., 267, 4720-4730, doi: 10.1006/excr.1999.4553.
(2004) Identification and testing of a gene expression sig%
24.
Gunning, P., Weinberger, R., Jeffrey, P., and Hardeman, E.
nature of invasive, carcinoma cells within primary mam%
(1998) Isoform sorting and the creation of intracellular
mary tumors, Cancer Res., 64, 8585-8594, doi: 10.1158/
compartments, Annu. Rev. Cell Dev. Biol., 14, 339-372,
0008%5472.CAN%04%1136.
doi: 10.1146/annurev.cellbio.14.1.339.
41.
Condeelis, J., and Singer, R.H. (2005) How and why does
25.
Manstein, D.J., and Mulvihill, D.P. (2016) Tropomyosin%
beta%actin mRNA target? Biol. Cell, 97, 97-110, doi: 10.
mediated regulation of cytoplasmic myosins, Traffic, 17,
1042/BC20040063.
872-877, doi: 10.1111/tra.12399.
42.
Katz, Z.B., Wells, A.L., Park, H.Y., Wu, B., Shenoy, S.M.,
26.
Von der Ecken, J., Heissler, S.M., Pathan%Chhatbar, S.,
and Singer, R.H. (2012) β%Actin mRNA compartmental%
Manstein, D.J., Raunser, S., and Cryo, E.M.
(2016)
ization enhances focal adhesion stability and directs cell
Structure of a human cytoplasmic actomyosin complex at
migration, Genes Dev., 26,1885-1890, doi: 10.1101/gad.
near%atomic resolution, Nature, 534, 724-728, doi: 10.
190413.112.
1038/nature18295.
43.
Hill, M.A., and Gunning, P. (1993) Beta and gamma actin
27.
Gunning, P., Mohun, T., Ng, S.Y., Ponte, P., and Kedes, L.
mRNAs are differentially located within myoblasts, J. Cell
(1984) Evolution of the human sarcomeric%actin genes:
Biol., 122, 825-832, doi: 10.1083/jcb.122.4.825.
evidence for units of selection within the 3'%untranslated
44.
Hannan, A.J., Gunning, P., Jeffrey, P.L., and Weinber%
regions of the mRNAs, J. Mol. Evol., 20, 202-214, doi: 10.
ger, R.P. (1998) Structural compartments within neurons:
1007/BF02104727.
developmentally regulated organization of microfilament
28.
Yaffe, D., Nudel, U., Mayer, Y., and Neuman, S. (1985)
isoform mRNA and protein, Mol. Cell. Neurosci., 11,
Highly conserved sequences in the 3’ untranslated region of
289-304, doi: 10.1006/mcne.1998.0693.
mRNAs coding for homologous proteins in distantly related
45.
Karakozova, M., Kozak, M., Wong, C.C.L., Bailey, A.O.,
species, Nucleic Acids Res., 13, 3723-3737, doi: 10.1093/
Yates, J.R., Mogilner, A., Zebroski, H., and Kashina, A.
nar/13.10.3723.
(2006) Arginylation of beta%actin regulates actin cytoskele%
29.
Treisman, R., Alberts, A.S., and Sahai, E. (1998) Regula%
ton and cell motility, Science, 313, 192-196, doi: 10.1126/
tion of SRF activity by Rho family GTPases, Cold Spring
science.1129344.
Harb. Symp. Quant. Biol., 63, 643-651, doi:10.1101/sqb.
46.
Kashina, A.S. (2006) Differential arginylation of actin iso%
1998.63.643.
forms: the mystery of the actin N%terminus, Trends Cell
30.
Posern, G., and Treisman, R. (2006) Actin’ together: serum
Biol., 16, 610-615, doi: 10.1016/j.tcb.2006.10.001.
response factor, its cofactors and the link to signal transduc%
47.
Wong, C.C.L., Xu, T., Rai, R., Bailey, A.O., Yates, J.R.,
tion, Trends Cell Biol., 16: 588-596, doi: 10.1016/j.tcb.
Wolf, Y.I., Zebroski, H., and Kashina, A. (2007) Global
2006.09.008.
analysis of posttranslational protein arginylation, PLoS
31.
Singer, R.H. (1992) The cytoskeleton and mRNA localiza%
Biol., 5, e258, doi: 10.1371/journal.pbio.0050258.
tion, Curr. Opin. Cell Biol., 4, 15-19, doi: 10.1016/0955%
48.
Behrmann, E., Muller, M., Penczek, P.A., Mannherz, H.G.,
0674(92)90053%F.
Manstein, D.J., and Raunser, S. (2012) Structure of the
32.
Gunning, P., Hardeman, E., Wade, R., Ponte, P., Bains, W.,
rigor actin-tropomyosin-myosin complex, Cell, 150,
Blau, H.M., and Kedes, L. (1987) Differential patterns of
327-338, doi: 10.1016/j.cell.2012.05.037.
БИОХИМИЯ том 84 вып. 6 2019
ИЗОФОРМЫ АКТИНА У МЛЕКОПИТАЮЩИХ
757
49.
Abe, A., Saeki, K., Yasunaga, T., and Wakabayashi, T.
64.
Brockmann, C., Huarte, J., Dugina, V., Challet, L., Rey, E.,
(2000) Acetylation at the N%terminus of actin strengthens
Conne, B., Swetloff, A., Nef, S., Chaponnier, C., and
weak interaction between actin and myosin, Biochem.
Vassalli, J.%D. (2011) Beta% and gamma%cytoplasmic actins
Biophys. Res. Commun., 268, 14-19, doi: 10.1006/bbrc.
are required for meiosis in mouse oocytes, Biol. Reprod.,
1999.2069.
85, 1025-1039, doi: 10.1095/biolreprod.111.091736.
50.
Wiame, E., Tahay, G., Tyteca, D., Vertommen, D.,
65.
Pokorna, E., Jordan, P.W., O’Neill, C.H., Zicha, D.,
Stroobant, V., Bommer, G.T., and van Schaftingen, E.
Gilbert, C.S., and Vesely, P. (1994) Actin cytoskeleton and
(2018) NAT6 acetylates the N%terminus of different forms of
motility in rat sarcoma cell populations with different
actin, FEBS J., 285, 3299-3316, doi: 10.1111/febs. 14605.
metastatic potential, Cell Motil. Cytoskeleton, 28, 25-33,
51.
Otey, C.A., Kalnoski, M.H., and Bulinski, J.C. (1987)
doi: 10.1002/cm.970280103.
Identification and quantification of actin isoforms in verte%
66.
Sahai, E., and Marshall, C.J. (2003) Differing modes of
brate cells and tissues, J. Cell. Biochem., 34, 113-124,
tumour cell invasion have distinct requirements for
doi: 10.1002/jcb.240340205.
Rho/ROCK signalling and extracellular proteolysis, Nat.
52.
Chaponnier, C., and Gabbiani, G. (2004) Pathological sit%
Cell Biol., 5, 711-719, doi: 10.1038/ncb1019.
uations characterized by altered actin isoform expression,
67.
Leavitt, J., Gunning, P., Kedes, L., and Jariwalla, R.
J. Pathol., 204, 386-395, doi: 10.1002/path.1635.
(1985) Smooth muscle alpha%action is a transformation%
53.
Ampe, C., and van Troys, M. (2017) Mammalian actins:
sensitive marker for mouse NIH 3T3 and Rat%2 cells,
isoform%specific functions and diseases, Handb. Exp.
Nature, 316, 840-842.
Pharmacol., 235, 1-37, doi: 10.1007/164_2016_43.
68.
Okamoto%Inoue, M., Taniguchi, S., Sadano, H., Kawano, T.,
54.
Perrin, B.J., and Ervasti, J.M. (2010) The actin gene family:
Kimura, G., Gabbiani, G., and Baba, T. (1990) Alteration
function follows isoform. Cytoskeleton (Hoboken), 67,
in expression of smooth muscle alpha%actin associated with
630-634, doi: 10.1002/cm.20475.
transformation of rat 3Y1 cells, J. Cell Sci., 96, 631-637.
55.
Belyantseva, I.A., Perrin, B.J., Sonnemann, K.J., Zhu, M.,
69.
Witt, D.P., Brown, D.J., and Gordon, J.A.
(1983)
Stepanyan, R., McGee, J., Frolenkov, G.I., Walsh, E.J.,
Transformation%sensitive isoactin in passaged chick
Friderici, K.H., Friedman, T.B., and Ervasti, J.M. (2009)
embryo fibroblasts transformed by Rous sarcoma virus,
Gamma%actin is required for cytoskeletal maintenance but
J. Cell. Biol., 96, 1766--1771, doi: 10.1083/jcb.96.6.1766.
not development, Proc. Natl. Acad. Sci. USA, 106,
70.
Vandekerckhove, J., Leavitt, J., Kakunaga, T., and Weber, K.
9703-9708, doi: 10.1073/pnas.0900221106.
(1980) Coexpression of a mutant beta%actin and the two
56.
Bunnell, T.M., and Ervasti, J.M. (2010) Delayed embryonic
normal beta% and gamma%cytoplasmic actins in a stably
development and impaired cell growth and survival in
transformed human cell line, Cell, 22, 893-899. doi:
Actg1 null mice, Cytoskeleton (Hoboken), 67, 564-572,
10.1016/0092%8674(80)90566%8.
doi: 10.1002/cm.20467.
71.
Leavitt, J., Ng, S.Y., Aebi, U., Varma, M., Latter, G.,
57.
Latham, S.L., Ehmke, N., Reinke, P.Y.A., Taft, M.H.,
Burbeck, S., Kedes, L., and Gunning, P. (1987) Expression
Eicke, D., Reindl, T., Stenzel, W., Lyons, M.J., Friez, M.J.,
of transfected mutant beta%actin genes: alterations of cell
Lee, J.A., Hecker, R., Fruhwald, M.C., Becker, K., et al.
morphology and evidence for autoregulation in actin pools,
(2018) Variants in exons 5 and 6 of ACTB cause syndromic
Mol. Cell. Biol., 7, 2457-2466, doi: 10.1128/MCB.7.7.
thrombocytopenia, Nat. Commun., 9, 4250, doi: 10.1038/
2457.
s41467%018%06713%0.
72.
Sadano, H., Taniguchi, S., Kakunaga, T., and Baba, T.
58.
Dugina, V., Zwaenepoel, I., Gabbiani, G., Clement, S.,
(1988) cDNA cloning and sequence of a new type of
Chaponnier, C., Clement, S., and Chaponnier, C. (2009)
actin in mouse B16 melanoma, J. Biol. Chem., 263,
Beta and gamma%cytoplasmic actins display distinct distri%
15868-15871.
bution and functional diversity, J. Cell Sci.,
122,
73.
Lapidus, K., Wyckoff, J., Mouneimne, G., Lorenz, M.,
2980-2988, doi: 10.1242/jcs.041970.
Soon, L., Condeelis, J.S., and Singer, R.H. (2007) ZBP1
59.
Franke, W.W., Stehr, S., Stumpp, S., Kuhn, C., Heid, H.,
enhances cell polarity and reduces chemotaxis, J. Cell Sci.,
Rackwitz, H.R., Schnolzer, M., Baumann, R., Holz%
120, 3173-3178, doi: 10.1242/jcs.000638.
hausen, H.J., and Moll, R. (1996) Specific immunohisto%
74.
Shum, M.S.Y., Pasquier, E., Po’uha, S.T., O’Neill, G.M.,
chemical detection of cardiac/fetal alpha%actin in human
Chaponnier, C., and Gunning, P.W., and Kavallaris, M.
cardiomyocytes and regenerating skeletal muscle cells.
(2011) γ%Actin regulates cell migration and modulates the
Differentiation, 60, 245-250, doi: 10.1046/j.1432%0436.
ROCK signaling pathway, FASEB J., 25, 4423-4433,
1996.6040245.x.
doi: 10.1096/fj.11%185447.
60.
Shagieva, G.S., Domnina, L.V., Chipysheva, T.A.,
75.
Dong, X., Han, Y., Sun, Z., and Xu, J. (2018) Actin
Ermilova, V.D., Chaponnier, C., and Dugina, V.B. (2012)
Gamma 1, a new skin cancer pathogenic gene, identified
Actin isoforms and reorganization of adhesion junctions in
by the biological feature%based classification, J. Cell.
epithelial%to%mesenchymal transition of cervical carcinoma
Biochem., 119, 1406-1419, doi: 10.1002/jcb.26301.
cells, Biochemistry (Moscow), 77, 1266—1276, doi: 10.1134/
76.
Tondeleir, D., Lambrechts, A., Muller, M., Jonckheere, V.,
S0006297912110053.
Doll, T., Vandamme, D., Bakkali, K., Waterschoot, D.,
61.
Baranwal, S., Naydenov, N.G., Harris, G., Dugina, V.,
Lemaistre, M., Debeir, O., Decaestecker, C., Hinz, B.,
Morgan, K.G., Chaponnier, C., and Ivanov, A.I. (2012)
Staes, A., Timmerman, E., Colaert, N., Gevaert, K.,
Nonredundant roles of cytoplasmic β% and γ%actin isoforms
Vandekerckhove, J., and Ampe, C. (2012) Cells lacking
in regulation of epithelial apical junctions, Mol. Biol. Cell.,
β%actin are genetically reprogrammed and maintain condi%
23, 3542-3553, doi: 10.1091/mbc.E12%02%0162.
tional migratory capacity, Mol. Cell. Proteomics, 11,
62.
Dugina, V.B., Chipysheva, T.A., Ermilova, V.D., Gabbiani, D.,
255-271, doi: 10.1074/mcp.M111.015099.
Chaponnier, C., and Vasil’ev, Iu.M. (2008) Distribution of
77.
Shagieva, G., Domnina, L., Makarevich, O., Chernyak, B.,
actin isoforms in normal, dysplastic, and tumorous human
Skulachev, V., and Dugina, V. (2017) Depletion of mito%
breast cells, Arkh Patol., 70, 28-31.
chondrial reactive oxygen species downregulates epithelial%
63.
Dugina, V., Arnoldi, R., Janmey, P.A., and Chaponnier, C.
to%mesenchymal transition in cervical cancer cells,
(2012) Actin, in The cytoskeleton and human disease (Ca%
Oncotarget, 8, 4901-4913, doi: 10.18632/oncotarget. 13612.
vallaris, M., ed.), Humana Press-Springer, 3-28, doi: 10.
78.
Pawlak, G., and Helfman, D.M. (2001) Cytoskeletal
1007/978%1%61779%788%0.
changes in cell transformation and tumorigenesis, Curr.
БИОХИМИЯ том 84 вып. 6 2019
758
ДУГИНА и др.
Opin. Genet. Dev., 11, 41-47, doi: 10.1016/S0959%
84. Titova, E., Shagieva, G., Ivanova, O., Domnina, L.,
437X(00)00154%4.
Domninskaya, M., Strelkova, O., Khromova, N., Kopnin, P.,
79. Pollack, R., Osborn, M., and Weber, K. (1975) Patterns of
Chernyak, B., Skulachev, V., and Dugina, V.
(2018)
organization of actin and myosin in normal and trans%
Mitochondria%targeted antioxidant SkQ1 suppresses
formed cultured cells, Proc. Natl. Acad. Sci. USA, 72,
fibrosarcoma and rhabdomyosarcoma tumour cell growth,
994-998.
Cell Cycle, 17, 1797-1811, doi: 10.1080/15384101.2018.
80. Rubin, R.W., Warren, R.H., Lukeman, D.S., and Cle%
1496748.
ments, E. (1978) Actin content and organization in normal
85. Dugina, V., Khromova, N., Rybko, V., Blizniukov, O.,
and transformed cells in culture, J. Cell Biol., 78, 28-35.
Shagieva, G., Chaponnier, C., Kopnin, B., and Kopnin, P.
81. Verderame, M., Alcorta, D., Egnor, M., Smith, K., and
(2015) Tumor promotion by γ and suppression by β non%
Pollack, R. (1980) Cytoskeletal F%actin patterns quantitated
muscle actin isoforms, Oncotarget, 6, 14556-14571,
with fluorescein isothiocyanate%phalloidin in normal and
doi: 10.18632/oncotarget.3989.
transformed cells, Proc. Natl. Acad. Sci. USA,
77,
86. Dugina, V., Alieva, I., Khromova, N., Kireev, I., Gunning, P.W.,
6624-6628, doi: 10.1073/pnas.77.11.6624.
and Kopnin, P. (2016) Interaction of microtubules with the
82. Dugina, V.B., Ermilova, V.D., Chemeris, G.Iu., and
actin cytoskeleton via cross%talk of EB1%containing +TIPs
Chipysheva, T.A. (2010) Actins and keratins in the diagno%
and γ%actin in epithelial cells, Oncotarget, 7, 72699-72715,
sis of human basal%like breast cancer, Arkh. Patol.,72,12-15.
doi: 10.18632/oncotarget.12236.
83. Agapova, L.S., Chernyak, B.V., Domnina, L.V., Dugina, V.B.,
87. Dugina, V., Shagieva, G., Khromova, N., and Kopnin, P.
Efimenko, A.Y., Fetisova, E.K., Ivanova, O.Y., Kalinina, N.I.,
(2018) Divergent impact of actin isoforms on cell cycle regu%
Khromova, N.V., Kopnin, B.P., Kopnin, P.B., Korotet%
lation, Cell Cycle, 17, 2610-2621, doi: 10.1080/15384101.
skaya, M.V., Lichinitser, M.R., Lukashev, A.L., Pletjush%
2018.1553337.
kina, O.Y., Popova, E.N., Skulachev, M.V., Shagieva, G.S.,
88. Novikova, M.V., Rybko, V.A., Kochatkov, A.V., Khro%
Stepanova, E.V., Titova, E.V., Tkachuk, V.A., Vasiliev, J.M.,
mova, N.V., Bogomazova, S.Y., Dugina, V.B., Lyadov, V.K.,
and Skulachev, V.P. (2008) Mitochondria%targeted plasto%
and Kopnin, P.B. (2017) A change in the expression of
quinone derivatives as tools to interrupt execution of the
membrane%associated proteins and cytoplasmic actin iso%
aging program. 3. Inhibitory effect of SkQ1 on tumor
forms in the progression of human colon tumors, Arkh.
development from p53%deficient cells, Biochemistry
Patol., 79, 15-21, doi: 10.17116/patol201779215%21.
(Moscow), 73, 1300-1316, doi: 10.1134/S0006297908120031.
MORPHOLOGICAL AND FUNCTIONAL IMPORTANCE
OF ACTIN ISOFORMS IN NORMAL AND NEOPLASTIC
CELLS IN MAMMALS
V. B. Dugina1, G. S. Shagieva1, and P. B. Kopnin2*
1 Belozersky Institute of Physico Chemical Biology, Lomonosov
Moscow State University, 119991 Moscow, Russia
2 Institute of Carcinogenesis, Blokhin National Medical Research
Centre of Oncology, Public Health Ministry of Russian Federation,
115478 Moscow, Russia; E mail: pbkopnin@mail.ru
Received November 15, 2018
Revised February 12, 2019
Accepted February 13, 2019
Actin plays an important role in key cellular processes, such as adhesion, muscular and non%muscular contractility,
migration, polarization, mitosis and meiosis. This review is devoted to the study of the functions of actin isoforms
associated with the motility and division of normal and tumor cells, adhesion structures, as well as changes in their
expression and structural organization. The understanding of their specific underlying mechanisms would be of major
relevance not only for fundamental research but also for clinical applications, since modulations of actin isoforms are
directly or indirectly correlated with severe pathologies. Selective changes in the expression of β% or γ%cytoplasmic
actin enabled identification of functional differences between β% and γ%actin, i.e., the predominant role of β%actin in
contraction and intercellular adhesion and that of γ%actin in cell plasticity and motility. Similar data were obtained in
different experimental systems on neoplastic cell cultures of epithelial and mesenchymal origin, as well as in the
immunomorphological comparison of sections of normal and pathological human tissues. The reorganization of the
components of actin cytoskeleton and of cell-cell contacts is an important step in the changing proliferative charac%
teristics and the acquisition of invasiveness by epithelial tumors.
Keywords: cytoplasmic actin isoforms, β%actin, γ%actin, neoplastic transformation, tumor cells, cytoskeleton
БИОХИМИЯ том 84 вып. 6 2019