БИОХИМИЯ, 2019, том 84, вып. 6, с. 759 - 775
УДК 577.352.4
ТРАНСПОРТ ИОНОВ Са2+ МИТОХОНДРИЯМИ:
МЕХАНИЗМЫ, МОЛЕКУЛЯРНЫЕ СТРУКТУРЫ
И ЗНАЧЕНИЕ ДЛЯ КЛЕТКИ
Обзор
© 2019
К.Н. Белослудцев1,2*, М.В. Дубинин2,
Н.В. Белослудцева1, Г.Д. Миронова1
1 Институт теоретической и экспериментальной биофизики
Российской академии наук, 142290 Московская обл., Пущино;
электронная почта: bekonik@gmail.com
2 Марийский государственный университет,
424000 Республика Марий Эл
Поступила в редакцию 19.02.2019
После доработки 18.03.2019
Принята к публикации 19.03.2019
Митохондрии являются одним из важнейших элементов клетки, участвующих в регуляции внутриклеточ!
ного Са2+ гомеостаза. В последнее десятилетие был идентифицирован ряд структур, ответственных за каль!
циевый транспорт в митохондриях. Среди них митохондриальный Са2+ унипортер (MCU). Na+/Ca2+ обмен!
ник (NCLX), Са2+/H+ антипортер (Letm1). В обзоре представлены сведения об их строении, регуляции и
физиологической роли. Обсуждаются данные о таком патофизиологическом механизме Са2+ транспорта,
как циклоспорин!чувствительная митохондриальная пора. Также обсуждается альтернативный механизм
порообразования в митохондриях - липидная пора, индуцированная насыщенными жирными кислотами и
ее роль в транспорте Са2+ в органеллах.
КЛЮЧЕВЫЕ СЛОВА: митохондрии, транспорт Са2+, Са2+ унипортер, Na+/Ca2+ обменник, митохондриаль!
ная пора, липидная пора.
DOI: 10.1134/S0320972519060022
Способность митохондрий поглощать и удер!
для физиологии и патологии клетки. Однако,
живать ионы кальция известна уже почти 60 лет
несмотря на достаточно интенсивное изучение
[1, 2]. Из пионерских исследований 1960!х гг. сфор!
транспорта ионов Са2+ через внутреннюю мемб!
мировалось целое направление в клеточной би!
рану митохондрий, долгое время молекулярная
ологии, посвященное изучению роли митохонд!
структура систем, ответственных за эти процес!
рий в регуляции кальциевого гомеостаза в нор!
сы, оставалась неизвестной. Последнее десяти!
ме и патологии клетки. За этот период проведе!
летие ознаменовалось важными открытиями в
ны многочисленные исследования, которые
этой области митохондриологии - были уста!
позволили предсказать и охарактеризовать сис!
новлены молекулярные структуры многих Са2+!
темы входа и выхода кальция из митохондрий,
транспортирующих систем. Так, в 2009 г. был
найти ингибиторы входа кальция в митохонд!
идентифицирован Са2+/Н+ обменник (Letm1,
рии, понять термодинамику процесса транспор!
также являющийся К+/H+ обменником) [3], год
та иона через внутреннюю митохондриальную
спустя Na+/Ca2+ обменник (NCLX) [4], опосре!
мембрану и доказать важность этого процесса
дующий выброс Са2+ из митохондрий и MiCU1,
регулирующий вход иона Са2+ в органеллы [5].
В 2011 г. сразу в двух лабораториях была иденти!
Принятые сокращения: MCU - митохондриальный
Са2+ унипортер; Letm1 - Са2+/Н+ обменник; NCLX - фицирована канальная субъединица Са2+ уни!
Na+/Ca2+ обменник; MiCU - регуляторная воротная субъ! портера (MCU) - белок, который осуществляет
единица Са2+ унипортера; MPT пора - митохондриальная
рутений!чувствительный вход ионов Са2+ мито!
белковая циклоспорин А!чувствительная пора; МАМ -
мембраны, ассоциированные с митохондриями, ЭР !
хондрии [6, 7]. В следующие два года были иден!
эндоплазматический ретикулум.
тифицированы и охарактеризованы еще несколь!
* Адресат для корреспонденции.
ко регуляторов Са2+ входа в митохондрии: MCUb,
759
760
БЕЛОСЛУДЦЕВ и др.
MiCU2, MCUR1, EMRE, SLC25A23 (Mg2+/ATP!Pi
кратковременный резкий выброс Са2+ из ретику!
переносчик) [8-12]. Эти открытия позволили
лума может приводить к увеличению локальной
установить, что за поглощение Са2+ митохонд!
концентрации Са2+ до микромолярного уровня.
риями в живых клетках ответственна макромо!
Это, в свою очередь, будет активировать Са2+
лекулярная структура (митохондриальный Са2+
унипортер и поглощение Са2+ митохондриями.
унипортер), количественное содержание тех
Установлено, что мембрана ЭР и внешняя
или иных белков в которой зависит от типа тка!
мембрана расположенных рядом митохондрий
ни, а также от внешних и внутренних факторов.
образуют общие участки, т.н. МАМ контакты,
Параллельно с открытием специфических
в которых Ca2+, высвобождаемый из ЭР, может
Са2+ транспортирующих систем были проведе!
быть легко поглощен митохондриями [18, 19].
ны идентификация и уточнение структуры не!
ЭР и митохондрии в этих контактных сайтах со!
специфических Са2+!зависимых систем выхода
единены белковыми линкерами (расстояние
ионов Са2+ из митохондрий - митохондриаль!
между мембранами 10 или 20 нм в зависимости
ных пор. В настоящее время можно говорить о
от того, гладкий или шероховатый ретикулум
том, что выброс Са2+ из органелл помимо
взаимодействует с митохондриями) [19]. МАМ
Na+/Ca2+ обменника могут осуществлять цик!
контакты являются динамическими структура!
лоспорин А!чувствительная белковая пора и
ми, которые чувствительны к изменениям усло!
циклоспорин А!нечувствительная липидная
вий внутри клетки. Эта динамическая природа
пора, индуцированная жирными кислотами и
обуславливает высокую вариабельность состава
Са2+ [13, 14]. Благодаря этому, появилась воз!
МАМ контактов - согласно протеомным иссле!
можность по!новому оценить механизмы воз!
дованиям, более 1000 белков входят в состав этой
никновения и развития многих патофизиологи!
структуры [20]. Однако обязательными, всегда
ческих процессов, связанных с митохондриями,
присутствующими в МАМ контактах, можно счи!
и понять, как их можно регулировать.
тать ~70 белков [18]. За высвобождение ионов
Данный обзор посвящен анализу современ!
Са2+ из ретикулума в МАМ контактах отвечает,
ных литературных данных о структуре Са2+!транс!
в основном, IP3 рецептор (рецептор инозитол!
портирующих и Са2+!индуцируемых систем ми!
1,4,5!трифосфата) (в меньшей степени риано!
тохондрий и их физиологической и патологи!
диновый рецептор (RyR)) (рис. 1). Вышедший
ческой роли для клетки.
из ретикулума Са2+ свободно проникает в мито!
хондрии через VDAC канал (порин) внешней
митохондриальной мембраны. Стоит отметить,
ТРАНСПОРТ Са2+ ИЗ ЦИТОПЛАЗМЫ
что МАМ контакты обогащены IP3R и VDAC.
В МИТОХОНДРИИ. МАМ КОНТАКТЫ
Более того, взаимодействие IP3R и VDAC обес!
печивается белком - шапероном GRP75 (glu)
В настоящее время общепринято, что мито!
cose)regulated protein 75), который не только фи!
хондрии, наряду с эндоплазматическим ретику!
зически связывает IP3R с VDAC1 в комплекс, но
лумом (ЭР), являются важным элементом внут!
также необходим для их функционального со!
риклеточного кальциевого гомеостаза и одной
пряжения, облегчающего поступление Са2+ в ми!
из основных буферных систем клетки для ионов
тохондрии [21]. Помимо этих белков необходи!
кальция. Они обладают способностью транспор!
мо упомянуть еще два, которые могут быть ответ!
тировать высокие концентрации кальция в ми!
ственны за формирование MAM контактов и
тохондриальный матрикс, где этот ион форми!
регулировать Са2+ транспорт между органелла!
рует комплексы с неорганическими и другими
ми - это митофузин 2 (MFN2) и белок 8, содер!
фосфатами. Однако роль митохондрий в регуля!
жащий домен PDZ (PDZD8 - PDZ domain!con)
ции внутриклеточного кальциевого гомео!стаза
taining protein 8) [22, 23].
долгое время подвергали сомнению. Связано это
Транспорт Са2+ из ретикулума в митохонд!
с тем, что несмотря на достаточно высокую ско!
рии определяется не только непосредственным
рость транспорта ионов Са2+ по кальциевому
контактом кальциевых переносчиков ретикулу!
унипортеру, in vitro сродство переносчика к это!
ма и VDAC внешней митохондриальной мемб!
му иону очень низкое (полумаксимальная эф!
раны, но и окислительно!восстановительным
фективная концентрация ∼10 мкМ). Это значе!
состоянием этих белков. Митохондрии и ЭР -
ние намного превышает концентрацию иона в
две органеллы, ответственные за продукцию ак!
цитоплазме клеток (10-7 М) [15, 16]. Позднее бы!
тивных форм кислорода. Поэтому неудивитель!
ло показано, что митохондрии и ЭР способны
но, что многие регуляторы окислительного состо!
образовывать микродомены [17]. Содержание
яния, среди которых шапероны (кальнексин и
Са2+ в ЭР может достигать 0,5 мМ, что в 1000 раз
кальретикулин) и редокс!активные белки (ERp57,
больше, чем в цитоплазме клетки [18]. Поэтому
ERp44, ERO1α, NADPH оксидаза 4 (NOX4), се!
БИОХИМИЯ том 84 вып. 6 2019
МИТОХОНДРИАЛЬНЫЙ Сa2+ ТРАНСПОРТ
761
ленопротеин N1 (SEPN1), тиоредоксин!связан!
стве возможной структуры, ответственной за
ный трансмембранный белок 1 (TMX1) и ERdj5)
транспорт ионов Са2+ в митохондрии, рассмат!
локализованы в МАМ контактах [18, 24]. Риано!
ривали молекулы от 2 до 75 кДа [30]. В частности,
диновый и IP3 рецепторы содержат достаточно
в нашей лаборатории из митохондрий сердца
большое количество цистеиновых остатков, ко!
быка был выделен белок (мол. масса ~40 кДа),
торые в нормальных условиях (при закрытом
который формировал в мембране БЛМ Са2+!се!
состоянии канала) находятся в восстановлен!
лективные рутений!чувствительные каналы [31, 32].
ном состоянии. Поэтому активация оксидаз
Лишь в 2011 г. идентификация гена, кодирую!
NOX4 или ERO1α (ER oxidoreductin!1 α) с после!
щего порообразующую субъединицу Са2+!уни!
дующим увеличением активных форм кислоро!
портера - MCU, позволила охарактеризовать
да в зоне МАМ контактов приводит к окисле!
структуру, ответственную за транспорт Са2+ в
нию как рианодинового рецептора, так и IP3 ре!
митохондрии [6, 7]. Согласно современным
цептора [24]. Это, в свою очередь, будет приво!
представлениям, митохондриальный Са2+!уни!
дить к активации этих каналов, выбросу Са2+ из
портер млекопитающих представляет из себя
ретикулума и поглощению его митохондриями.
комплекс белков, сформированный из мемб!
Следует отметить, что помимо ретикулума,
ранных порообразующих компонентов (MCU,
митохондрии могут образовывать контакты с
MCUb) и связанных с MCU регуляторов -
плазматической мембраной клеток (PAM - plas)
MiCU1,2, EMRE, MCUR1 и др. (рис. 2). Вместе
ma membrane associated mitochondria). При этом,
с тем, по!видимому, лишь MCU и MiCU1 явля!
вследствие активации Са2+ каналов плазмати!
ются существенными компонентами для мито!
ческой мембраны концентрация ионов кальция
хондриального транспорта Са2+, поскольку толь!
в таких контактах может быть значительно вы!
ко они присутствуют во всех живых организмах,
ше, чем в случае MAM контактов [25].
у которых был обнаружено поглощение Са2+
митохондриями [33].
MCU. Ген MCU (CCDC109a) (mitochondrial cal)
Са2+ УНИПОРТЕР ВНУТРЕННЕЙ
cium uniporter) является высоко!консервативным
МИТОХОНДРИАЛЬНОЙ МЕМБРАНЫ
Основным путем транспорта иона Са2+ через
внутреннюю мембрану митохондрий является
Са2+!унипортер. Несмотря на то, что долгое вре!
мя молекулярная структура этого переносчика
была не определена, его функциональные, ки!
нетические и термодинамические характерис!
тики были известны довольно давно (см. обзоры
[26, 27]). Процесс поглощения Са2+ через Са2+
унипортер зависит от концентрации иона в сре!
де и происходит по градиенту электрохимичес!
кого потенциала, который может генерировать!
ся как при окислении субстратов дыхания, так и
активации ATPазной активности митохондрий.
Поглощение Са2+ митохондриями стимулируется
в присутствии проникающих катионов (Pi, аце!
тата и др). Помимо этого Са2+ унипортер способен
транспортировать и другие двухвалентные катио!
ны - Sr2+, Mn2+, Ba2+, лантаноиды, но не Mg2+ [26].
Однако концентрация в клетке этих ионов на!
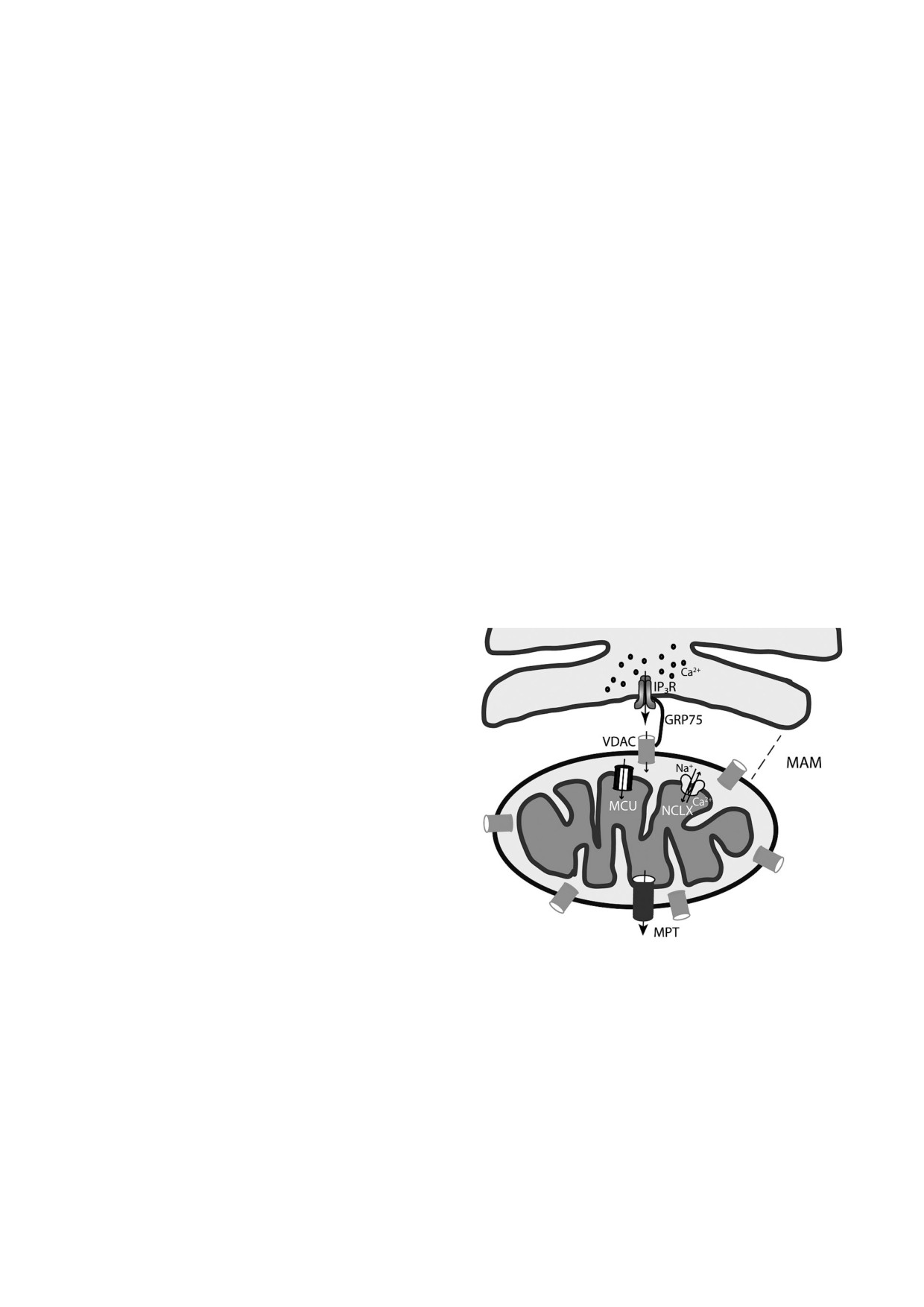
Рис. 1. МАМ!контакты между ЭР и митохондриями. Акку!
столько мала, что унипортер в норме вряд ли пе!
мулированный в ЭР Са2+ при стимуляции IP3 рецептора
реносит другие катионы, помимо Ca2+.
выходит из ретикулума в зону МАМ контакта, что приво!
дит к образованию в этой области микродоменов с повы!
Еще в 1970!х гг. был обнаружен селективный
шенной концентрацией Са2+ (10!кратное увеличение). Из
неконкурентный ингибитор Са2+!унипортера -
области микродоменов Са2+ через VDAC внешней митохонд!
рутений красный, а позднее и его производное -
риальной мембраны попадает в межмембранное простран!
Ru360. Кроме этого, поглощение Са2+ подавля!
ство митохондрий и транспортируется в матрикс органелл
по Са2+ унипортеру. На рисунке показаны также Na+/Са2+
ется лантаноидами, Mg2+ и другими двухвалент!
обменник митохондрий (NCLX) и митохондриальная пора
ными металлами, а также ATP [27-29].
(MPT), индуцирующие выброс Са2+ из органелл. VDAC
Попытки выделить и очистить Са2+!унипор!
митохондрий и IP3 рецептор ретикулума физически сое!
тер предпринимали, начиная с 1970!х гг. В каче!
динены белком GRP75
2 БИОХИМИЯ том 84 вып. 6 2019
762
БЕЛОСЛУДЦЕВ и др.
и присутствует практически во всех эукариоти!
функционального канала в митохондриальной
ческих организмах за исключением некоторых
мембране происходит олигомеризация субъеди!
простейших и грибов [33]. Он кодирует 40 кДа
ниц. DIME мотив разных субъединиц формиру!
белок (активным является 35 кДа белок после
ет вход в пору канала и образует селективный
отщепления в митохондриях сигнальной после!
фильтр для ионов Са2+. На основе методов моле!
довательности), который формирует пору Са2+!
кулярной динамики предположили, что канал
канала в митохондриях. Этот белок состоит из
может быть сформирован четырьмя субъедини!
двух сверхспирализованных доменов (cc)domains))
цами MCU [8]. С помощью криоэлектронной
(N! и С!концы белка, экспонированные в мат!
микроскопии это предположение было подтверж!
рикс митохондрий) и двух трансмембранных до!
дено несколькии исследованиями на различных
менов, соединенных друг с другом короткой
организмах [34-36]. Вместе с тем, еще в 2016 г.
петлей (9 а.о.), несущей в себе высококонсерва!
с помощью ЯМР и криоэлектронной микроско!
тивный DIME мотив (аспарагиновая к!та260!изо!
пии было показано, что MCU нематоды Caenor)
лейцин261!метионин262!глутаминовая к!та263 в
habditis elegans представляет собой пентамер [37].
MCU человека) [6, 7]. Эта петля, экспонирован!
Следует отметить, что при установлении архи!
ная в межмембранное пространство митохонд!
тектуры канала MCU из C. elegans был использо!
рий, ответственна как за кальций!транспорти!
ван не весь белок, а его часть без N)концевого
рующую функцию (глутаминовая к!та257, аспа!
домена (∼160 а. о.), не обладающего канальной
рагиновая к!та260 и глутаминовая к!та264), так и
активностью. Тем не менее, можно предполо!
за связывание с унипортером ингибитора руте!
жить, что это все же внесло какие!то изменения
ния красного (серин259) [6-8, 29]. Мутации по
в общую структуру порового канала. Таким об!
этим аминокислотным остаткам нарушают ион!
разом, точная стехиометрия порового канала
транспортирующие свойства унипортера и сни!
MCU все еще требует уточнения, и идентифика!
жают чувствительность белка к рутению красно!
ция архитектуры у различных организмов помо!
му. Важно отметить, что MCU не содержит в
жет решить этот вопрос.
своем составе классический Са2+!связывающий
Анализ нуклеотидной последовательности
домен, поэтому он не способен сам по себе регу!
гена MCU также позволил идентифицировать
лировать свою активность [6, 7].
ген CCDC109b. Ген присутствует во всех позво!
Поскольку MCU имеет всего лишь два транс!
ночных, но отсутствует в других организмах, где
мембранных домена, то для формирования присутствует MCU. Этот ген кодирует 33 кДа бе!
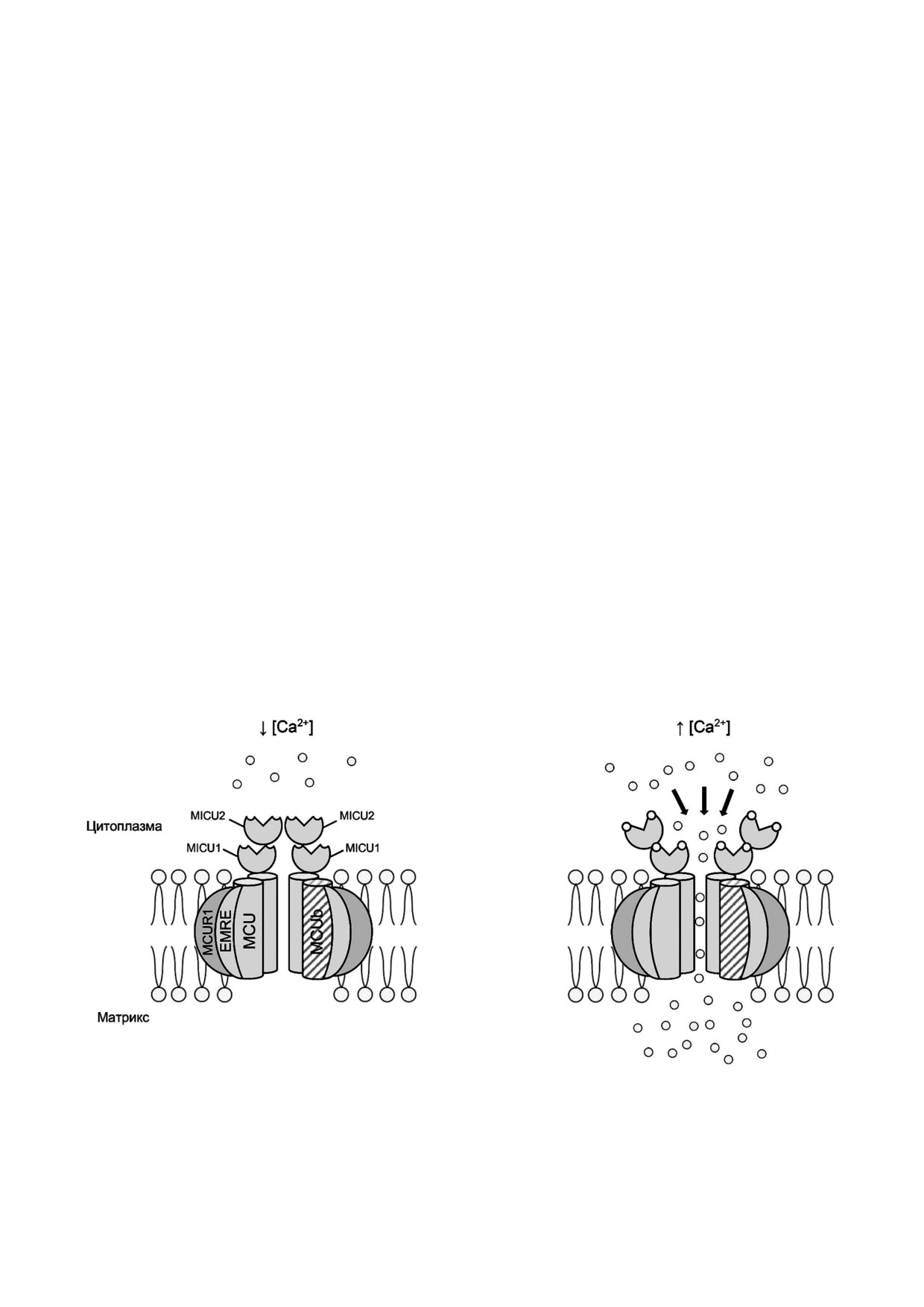
а
б
Рис. 2. Схематическое изображение Са2+ унипортера. а - При низкой концентрации Са2+ в цитоплазме белки MiCU в ка!
честве воротного механизма Са2+ унипортера препятствуют входу Са2+ в митохондрии, тем самым, защищая митохондрии
от перегрузки по этому иону; б - увеличение концентрации Са2+ в цитоплазме приводит к связыванию иона с MiCU и их
конформационным перестройкам, это приводит к открытию канала MCU для транспорта иона в митохондрии
БИОХИМИЯ том 84 вып. 6 2019
МИТОХОНДРИАЛЬНЫЙ Сa2+ ТРАНСПОРТ
763
лок MCUb, который на 50% гомологичен MCU.
модействие между поровыми компонентами
Данный белок обладает похожей на MCU топо!
MCU комплекса и его регуляторными воротны!
логией и имеет два сс)домена и два трансмемб!
ми субъединицами MiCU1 и MiCU2 [40].
ранных домена, соединенными короткой пет!
Семейство MiCU. Исследования, посвящен!
лей с DIME мотивом [8]. MCUb достаточно лег!
ные кинетике поглощения ионов Са2+ в мито!
ко взаимодействует с MCU в комплексе (проис!
хондрии, позволили выявить одну из важнейших
ходит образование гетероолигомера). Вместе с
особенностей этого процесса - сигмоидальный
тем, присутствие MCUb (и его повышенная
характер зависимости скорости поглощения ио!
экспрессия) в мембранном поровом комплексе
нов Са2+ от его концентрации в среде (цитоплаз!
MCU нарушает ион!транспортирующие свой!
ме). Эта положительная кооперативность с на!
ства комплекса [8, 11]. Таким образом, MCUb
сыщением при высоких концентрациях Са2+
принято рассматривать в качестве доминант!не!
позволила еще на начальных этапах этих иссле!
гативной формы MCU. Связано это с модифи!
дований предположить наличие регуляторного
кацией короткой петли с DIME мотивом, в ко!
аллостерического центра переносчика, находя!
тором одна из трех отрицательно!заряженных
щегося на цитоплазматической стороне внут!
аминокислот (глутаминовая к!та) замещена на
ренней мембраны митохондрий, который при
валин. Отношение MCU/MCUb в мембране
взаимодействии с Са2+ «переключал» унипортер
очень сильно варьирует в разных тканях. Так, в
в активное ион!транспортирующее состояние
сердце и печени это отношение низко (3 : 1 и 4 : 1),
[15, 26, 27, 29]. Как было сказано выше, сам
в то время как в скелетных мышцах отношение
MCU не имеет в своей структуре классический
экспрессии генов этих белков очень высоко (40 : 1).
Са2+!связывающий домен (EF!hand домен) и
В то же время отношение в лейкоцитах близко
поэтому, не способен к саморегуляции своей ак!
к 1 : 5 [8, 29]. Вполне возможно, что соотноше!
тивности [6, 7]. Анализ митохондриальных бел!
ние этих субъединиц в разных тканях является
ков по двум особенностям в структуре, а именно:
одним из важных механизмов регулирования
локализация во внутренней митохондриальной
транспорта ионов Са2+ в митохондриях.
мембране и наличие Са2+!связывающего доме!
EMRE. Несмотря на то, что в модельных
на, позволил идентифицировать регуляторный
бислойных липидных мембранах для индукции
белок, которым оказался MiCU1 (mitochondrial
Са2+ проводимости достаточно встраивания од!
calcium uptake 1 (CBARA1, EFHA3)) (54 кДа) [5].
ного MCU [38], во внутренней мембране мито!
Именно белки семейства MiCU являются клю!
хондрий животных клеток присутствует важный
чевыми регуляторами поглощения ионов каль!
трансмембранный регуляторный белок, без ко!
ция митохондриями, тем самым контролируя
торого не будет происходить вход Са2+ через
митохондриальный Са2+ гомеостаз и метабо!
MCU. EMRE (essential MCU regulatory element) -
лизм.
10 кДа белок, обладающий одним трансмемб!
В настоящее время общепризнано, что
ранным сегментом, который присутствует лишь
MiCU1 является частью воротного механизма
у многоклеточных животных, но не в других
Са2+!унипортера, и в состоянии покоя (при низ!
эукариотических таксонах - растениях, грибах,
кой концентрации внутриклеточного Са2+) он
простейших [11]. Нокаут клеток по гену Smdt1,
препятствует доступу иона к каналу MCU (рис. 2).
кодирующему EMRE, полностью устраняет воз!
Это предотвращает массивный вход Са2+ в орга!
можность митохондрий клеток животных
неллы, перегрузку митохондрий этим ионом, а
транспортировать ионы Са2+, даже при условии
также падение мембранного потенциала. Действи!
оверэкспрессии гена MCU [11]. С другой сторо!
тельно, в митохондриях клеток с нокаутом по
ны, увеличение уровня EMRE в митохондриях
гену MICU1 наблюдалась увеличенная концент!
может приводить к неконтролируемому входу
рация митохондрильного Са2+, повышенная
Са2+ в органеллы, их перегрузке и неминуемой
чувствительность к открытию MPT поры и по!
клеточной гибели. В то же время точная тополо!
ниженный уровень ATP [41].
гия EMRE в мембране митохондрий не известна.
Как сказано выше, Са2+!унипортер способен
Поэтому роль этого белка до конца не ясна.
транспортировать различные двухвалентные ка!
Предположено, что высоко!консервативный
тионы через внутреннюю митохондриальную
полиаспартатный С!конец EMRE может слу!
мембрану [26, 27]. Однако, сами по себе каналь!
жить сенсором Са2+ с матриксной стороны
ные субъединицы MCU (их DIME фильтр) не
внутренней митохондриальной мембраны [39].
участвуют в селективном отборе тех или иных
Между тем в других исследованиях предполага!
ионов. Недавно было показано, что за такую се!
ется иная топология, при которой в матрикс ми!
лективность (по крайней мере, для Mn2+) отве!
тохондрий обращен N!конец этого белка. Было
чает MiCU1, который предотвращает поглоще!
предположено, что EMRE устанавливает взаи!
ние марганца митохондриями [42].
БИОХИМИЯ том 84 вып. 6 2019
2*
764
БЕЛОСЛУДЦЕВ и др.
Как и в случае с соотношением MCU/MCUb,
Что касается MiCU3, то он является актива!
стехиометрия MCU/MiCU1 в различных тканях
тором транспорта Са2+, образовывая димеры с
важна для транспорта Са2+ в органеллах. Так, мень!
MiCU1, но не MiCU2 [44, 50]. Показано, что
шее количество белка MiCU1 в сердце по сравне!
экспрессия гена MICU3 в клетках линии HeLa,
нию с печенью объясняет более низкий порог акти!
где он обычно не экспрессируется, вызывает
вации транспорта Са2+ и более низкую максималь!
значительное увеличение скорости поглощения
ную емкость поглощения Са2+ митохондриями [43].
Са2+ [9]. Таким образом, можно рассматривать
Помимо MiCU1 также были идентифициро!
MiCU3 в качестве регуляторного компонента,
ваны белки MiCU2 (EFHA1) (45 кДа) и MiCU3
который определяет также кинетику транспорта
(EFHA2) (55 кДа), которые являются паралога!
Са2+ в митохондриях и модулирует общую дина!
ми MiCU1 и на 41, и 34% ему идентичны [9, 43].
мику концентрации кальция в клетке.
В митохондриях MICU2 образует гетеродимер с
MCUR1 и SLC25A23. Еще одним активатором
MiCU1 (посредством дисульфидных связей).
комплекса MCU является 40 кДа белок MCUR1
Именно димер является активным воротным
(MCU regulator 1) внутренней мембраны мито!
механизмом, выполняя две важные функции в
хондрий, кодируемый геном CCDC90A (Mcur1)
качестве регулятора. При низкой концентрации
[10, 51]. Было показано, что MCUR1 необходим
Са2+ в клетке (0,1 мкМ) воротный механизм за!
для поглощения митохондриями Са2+, посколь!
щищает митохондрии от перегрузки ионом [41, 44]
ку его нокдаун подавлял вход Са2+ в митохонд!
(рис. 2, а). При увеличении концентрации кальция
рии, а оверэкспрессия усиливала поглощение
в цитоплазме происходит связывание Са2+ с
иона. Нокдаун гена Mcur1 в клетках млекопита!
EF!hand доменами MiCU1!MiCU2, вызывая кон!
ющих придает им устойчивость к Са2+ перегрузке
формационные изменения димера, который дей!
митохондрий и открытию в них MPT поры [10].
ствует как молекулярный переключатель, снима!
В то же время показано, что эффект MCUR1 на
ющий ингибирование MCU и открывая канал для
Са2+ транспорт может быть связан с поддержа!
транспорта Са2+ в митохондрии [41, 45] (рис. 2, б).
нием мембранного потенциала митохондрий,
Как было сказано ранее, взаимодействие ди!
поскольку MCUR1 участвует в сборке комплек!
мера MiCU1!MiCU2 c MCU происходит посред!
са IV дыхательной цепи митохондрий [52]. Не!
ством EMRE [40]. Однако недавно было показа!
смотря на то, что прямое взаимодействие MCU
но, что MiCU1 (аргинин440/443) может непосред!
с MCUR1 не установлено, было предположено,
ственно взаимодействовать с DIME мотивом
что MCUR1 может быть ответственен за взаимо!
MCU, что, помимо регуляции входа Са2+ в ми!
действие MCU и EMRE. Так, в митохондриях мы!
тохондрии, приводит к ингибированию взаимо!
шей, нокаутированных по гену Mcur1, наблюда!
действия MCU с рутением красным и Ru360 [46].
лось уменьшение количества собранных комп!
В отсутствии MiCU1 MiCU2 не способен обра!
лексов кальциевого унипортера и снижение
зовывать комплекс с MCU, воротный механизм
скорости транспорта Ca2+ в митохондрии [53].
будет разрушен и произойдет перегрузка мито!
Одновременно с MCUR1 был идентифици!
хондрий по иону Са2+ [9, 38].
рован еще один белок внутренней мембраны
Соотношение субъединиц MiCU1!MiCU2, а
митохондрий, имеющий EF!hand домен. Им
также их взаимодействие друг с другом и MCU
оказался белок SLC25A23, относящийся к се!
определяет кинетику транспорта Са2+ в митохонд!
мейству переносчиков, транспортирующих че!
рии. Так, с конца 1980!х гг. было установлено,
рез мембраны Mg!ATP/Pi (Mg!ATP/Pi перенос!
что преинкубация деэнергизованных митохонд!
чик) [12]. Мутация EF!hand домена этого белка
рий с низкими концентрациями Са2+ (2-5 мкМ)
приводит к снижению скорости входа ионов
приводила к более чем 10!кратному увеличению
Са2+ в митохондрии. Но, как и в случае с
скорости поглощения добавленного иона мито!
MCUR1, связано ли это с непосредственным
хондриями. При этом зависимость скорости вхо!
влиянием на комплекс унипортера или с влия!
да Са2+ от концентрации иона изменялась с сиг!
нием белка на митохондриальную энергетику,
моидальной на гиперболическую [47, 48]. В ос!
до конца не определено.
нове этого явления, по!видимому, лежит Са2+!
Другие структуры, ответственные за воз
индуцированная диссоциация MiCU1 и MiCU2
можный транспорт Са2+ в митохондрии. Иссле!
от MCU, что приводит к значительному увели!
дования механизмов поглощения ионов Са2+ на
чению скорости поглощения Са2+ даже при низ!
изолированных митохондриях позволили еще в
ких концентрациях иона. Оверэкспрессия гена
1990!х гг. выделить два режима поглощения
MICU1 также приводила к значительному уско!
Са2+ [54]. Оба зависят от присутствия мембран!
рению входа Са2+ в митохондрии, в то время как
ного потенциала, но проявляют различную чув!
повышенная экспрессия гена MiCU2, наоборот,
ствительность к рутению красному/Ru360. Пер!
подавляла этот процесс [49].
вый режим активируется при относительно вы!
БИОХИМИЯ том 84 вып. 6 2019
МИТОХОНДРИАЛЬНЫЙ Сa2+ ТРАНСПОРТ
765
сокой концентрации цитоплазматического
кальция обеспечивает поддержание внутрикле!
Са2+, он высокочувствителен к рутению красно!
точного кальциевого гомеостаза и функциони!
му и позволяет поглощать достаточно большое
рование митохондрий в норме и при патологиях.
количество иона. Считается, что этот путь опо!
Начиная с 1970!х гг., выброс Са2+ из митохонд!
средован работой Са2+ унипортера [54, 55]. Вто!
рий рассматривали через призму двух систем -
рой режим, названный RaM (rapid uptake mode),
Na+!зависимого и Na+!независимого выхода
активируется при низких концентрациях каль!
(обмен Са2+ на Na+ и H+ соответственно). Счи!
ция (50-100 нМ против 500 нМ для Са2+ уни!
тается, что эти системы функционируют в зави!
портера), ингибируется лишь высокими концент!
симости от типа ткани: в возбудимых тканях
рациями рутения красного и способен с высо!
(мозг, сердце) функционирует система Na+/Ca2+
кой скоростью транспортировать небольшое ко!
обмена, а в невозбудимых (печень) - H+/Ca2+
личество иона [54]. Предположено, что этот ре!
обмена. Показано, что это системы медленного
жим может модулировать окислительное фос!
выброса кальция из митохондрий, скорость
форилирование физиологическими концентра!
транспорта ионов через которые значительно
циями Са2+, в то время как поглощение ионов
уступает скорости поглощения кальция через
Са2+, опосредуемое Са2+ унипортером, приводит
кальциевый унипортер [60, 61]. Обмен ионов
к внутриклеточному забуфериванию иона мито!
Са2+ на Na+ считается электрогенным со стехио!
хондриями. Молекулярная структура, ответ!
метрией 3Na+ на 1Са2+, в то время как обмен
ственная за RaM, до сих пор не обнаружена. Бо!
Са2+ на протон является электро!нейтральным
лее того, есть веские данные говорить о том, что
(стехиометрия 2H+ на 1Са2+) [62, 63].
это другой режим работы Са2+ унипортера, пос!
Переносчик, ответственный за Na+/Ca2+ об!
кольку при нокауте MCU режим RaM также не
мен (60 кДа), был идентифицирован в 2010 г. как
наблюдался [6, 7].
антипортер внутренней мембраны митохонд!
Предполагается, что помимо Са2+ унипорте!
рий, способный выбрасывать ион Са2+ в обмен
ра, транспортировать Са2+ в митохондрии могут
на ионы Na+ или Li+ (NCLX - Na+/Li+/Ca2+
и другие белки. К ним можно отнести Letm1
exchanger) [4]. Он принадлежит к суперсемей!
(leucine zipper!, EF!hand)containing transmembrane
ству Ca2+/катион+ антипортеров, которые обес!
protein 1) [3], рианодиновый рецептор (mRyR)
печивают обмен ионов Са2+ на какой!либо од!
[56] и разобщающий белок (UCP2 и 3) [57]. Сто!
новалентный катион (Na+, Li+, K+ или H+) [64].
ит отметить, что роль этих белков в Са2+ транс!
Способность обменивать ион Са2+ не только на
порте митохондрий до сих пор обсуждается. Так,
Na+, но и Li+ является уникальной особен!
Letm1 (70 кДа), который осуществляет электро!
ностью митохондриального переносчика [65],
нейтральный обмен Са2+ на 2H+, также осущест!
но не переносчиков плазматической мембраны
вляет электро!нейтральный обмен К+ на H+.
NCX и NCKX). NCLX обнаружен лишь на внут!
При этом молекулярный механизм работы
риклеточных мембранах, особенно им богата
Letm1 до сих пор далек от понимания [58].
внутренняя мембрана митохондрий. NCLX бло!
В 2000 гг. во внутренней мембране митохо!
кируется классическим ингибитором NCX плаз!
ндрий был обнаружен 600 кДа белок, транспор!
матической мембраны клеток - CGP37157 и его
тирующий Са2+, похожий на рианодиновый ре!
ингибирование приводит к подавлению выбро!
цептор RyR1 [56]. Однако в настоящее время су!
са Са2+ из органелл [66]. Сродство антипортера к
ществование этого белка в митохондриях под!
иону Na+ ~7 мМ, что достаточно близко к внут!
вергается сомнению. Также, недавно были пред!
риклеточной концентрации этого иона. Поэто!
ставлены достаточно убедительные доказатель!
му даже небольшое изменение концентрации
ства против участия UCP2 и 3 в Са2+ транспорте
Na+ в клетке будет приводить к значительному
в митохондриях [59]. Все это позволяет говорить
увеличению скорости обменной активности и
о том, что основным, если не единственным ус!
снижению концентрации Са2+ внутри митохо!
тановленным механизмом транспорта Са2+ в
ндрий [67]. Интересно, что при деполяризации
митохондрии является Са2+!унипортер.
митохондрий в клетке может происходить обра!
щение переносчика и поглощение ионов Са2+ в
митохондрии [68].
СИСТЕМЫ СПЕЦИФИЧЕСКОГО
Трехмерная структура NCLX до сих пор не
ВЫБРОСА Са2+ ИЗ МИТОХОНДРИЙ
определена. С другими белками суперсемейства
у NCLX не очень высокая степень гомологии
Способность митохондрий не только погло!
(~20%) [69]. Однако, учитывая сходство функ!
щать, но и выбрасывать Са2+ является важной
ций, трехмерная структура Na+/Ca2+!антипор!
функцией этих органелл. Именно баланс в рабо!
тера внутренней мембраны митохондрий долж!
те митохондриальных систем входа и выхода
на быть похожа на структуру других транспорте!
БИОХИМИЯ том 84 вып. 6 2019
766
БЕЛОСЛУДЦЕВ и др.
ров этого семейства. Так, согласно кристалли!
мое увеличение проницаемости для гидрофиль!
ческой структуре NCX из археобактерии Methano)
ных соединений и ионов. Такое увеличение про!
caldococcus jannaschii, белок обладает 10 транс!
ницаемости внутренней митохондриальной
мембранными доменами, где 12 ион!координи!
мембраны сопровождается нарушением ионно!
рующих остатков на доменах TM2, 3, 7 и 8 фор!
го гомеостаза по обе стороны мембраны, кол!
мируют 4 сайта связывания (Sext, Smid, Sint и SCa)
лапсом мембранного потенциала, набуханием
[70]. Показано, что 3 иона Na+ способны зани!
органелл, разрушением внешней митохондри!
мать сайты Sext, Sint и SCa, в то время как ион Са2+
альной мембраны и самих митохондрий. Позд!
связывается в белке с сайтом SCa. Таким обра!
нее, это явление было названо митохондриаль!
зом, сайты Sint и Sext являются высокоселектив!
ный переход проницаемости (mitochondrial per)
ными по Na+, в то время как сайт связывания
meability transition (MPT)) или митохондриаль!
SCa может взаимодействовать как с ионом Na+,
ная пора (MPT пора) [72]. Показано, что размер
так и с ионом Са2+ [62, 71]. Следует отметить,
поры может достигать 3 нм в диаметре (через по!
что 11 из 12 ион!координирующих остатков
ру способны проникать соединения до 1,5 кДа),
идентичны в про! и эукариотических белках
а процесс ее закрытия-открытия регулируется
NCX [70]. Вместе с тем, как было сказано выше,
рядом физиологических модуляторов. Так было
NCLX обладает не очень большой степенью го!
показано, что регуляторами MPT поры являют!
мологии с остальными белками данного семей!
ся: неорганический фосфат, окисляющие агенты
ства, и 9 из 12 ион!координирующих остатков в
(и окислительный стресс в целом), разобщители,
нем отличаются от ион!координирующих остат!
снижение пула адениновых нуклеотидов и др.
ков в NCX из M. jannaschii [4, 69].
Ингибиторами поры являются адениновые нук!
В отличие от Na+!зависимого пути выброса
леотиды, SH!восстанавливающие агенты, вос!
ионов Са2+ из митохондрий, не существует еди!
становленные пиридиновые нуклеотиды и др.
ного мнения о структуре, ответственной за
(см. обзоры [73, 74]).
Ca2+/H+ обмен. Роль этого обменника может
Начиная с 1970!х гг. считали, что MPT пора
выполнять Letm1 [58]. Таким образом, предпо!
имеет белковую природу [72]. Особенно это
ложено, что этот белок в зависимости от усло!
представление утвердилось с момента открытия
вий может транспортировать Са2+ как в мито!
высокоселективного ингибитора поры циклоспо!
хондрии, так и из них. Исходно предполагалось,
рина А. Циклоспорин А полностью ингибиро!
что стехиометрия обмена Са2+ на H+ 1 : 1 [3].
вал MPT в субмикромолярных концентрациях,
Вместе с тем, недавно на протеолипосомах, со!
что стало ясно: речь в данном случае идет о его
держащих Letm1, было показано, что этот белок
связывании с каким!то белком [75]. Между тем,
способен обменивать ионы Са2+ и H+ со стехио!
точная структура поры до сих пор не определена.
метрией 1 : 2 [63]. Это действительно позволяет
Сейчас можно говорить о том, что MPT пора -
рассматривать Letm1 как один из основных кан!
это комплекс белков внешней и внутренней
дидатов на данный механизм Na+!независимого
мембраны митохондрий [74]. При этом, един!
выброса ионов Са2+ из митохондрий. Как было
ственным, точно установленным компонентом,
сказано выше, молекулярный механизм работы
входящим в эту структуру, является циклофи!
Letm1 далек от понимания. Поэтому необходи!
лин Д - мишень циклоспорина А [76]. Цикло!
мо проведение дополнительных экспериментов
филины - это семейство белков, проявляющих
по определению его трехмерной структуры и
пептидил!пролил цис)транс изомеразную ак!
точной идентификации механизма работы.
тивность и катализирующих взаимопревраще!
ние цис и транс конформаций пептидных связей
белков, расположенных рядом с остатками про!
СИСТЕМЫ
лина [77]. Таким образом, циклофилин Д явля!
НЕСПЕЦИФИЧЕСКОГО
ется, в первую очередь, регуляторным белком,
ВЫБРОСА Са2+ ИЗ МИТОХОНДРИЙ
который в присутствии ионов Са2+ стимулирует
перестройку в белках, ответственных за форми!
MPT пора. Одним из наиболее интригующих
рование канала MPT поры.
и до сих пор до конца не изученных Са2+!зави!
Ответ на вопрос, какая структура формирует
симых явлений в митохондриях является откры!
канал MPT поры во внутренней мембране мито!
тие во внутренней мембране органелл митохонд!
хондрий, до сих пор не известен (рис. 3, а). Дол!
риальной поры. Начиная с середины прошлого
гое время превалировала гипотеза о том, что ос!
века было известно, что в присутствии ионов
новным компонентом MPT поры, формирую!
Са2+ во внутренней мембране митохондрий раз!
щим канал во внутренней митохондриальной
личных тканей большинства эукариотических
мембране, является аденилат!транслокатор [73].
организмов может происходить неконтролируе!
Это предположение было связано с тем, что
БИОХИМИЯ том 84 вып. 6 2019
МИТОХОНДРИАЛЬНЫЙ Сa2+ ТРАНСПОРТ
767
непроникающие ингибиторы аденилат!транс!
нию открытия MPT поры в митохондриях [81].
локатора - атрактилозид и карбоксиатрактилат
При встраивании в липосомы димеров ATP!син!
стимулировали образование поры, а бонгреко!
тазы также была обнаружена Са2+!зависимая ка!
вая кислота ингибировала ее открытие. Более
нальная проводимость, похожая на таковую для
того, адениновые нуклеотиды, переносимые
MPT поры [80]. Подобная канальная активность
транслокатором в нормальных условиях, также
наблюдалась и в митохондриях дрожжей, при!
подавляли открытие поры. Однако, в середине
чем она сильно ослаблялась в мутантах, у кото!
2000!х гг. было показано, что аденилат!трансло!
рых отсутствовали e! и g!субъединицы ATP!син!
катор не является столь существенным компо!
тазы, необходимые для формирования димеров
нентом MPT поры. В митохондриях, нокаутиро!
[82]. С другой стороны, с помощью молекуляр!
ванных по генам ANT1 и ANT2, также происхо!
ной динамики и нокаутов генов различных
дило открытие MPT поры, чувствительной к
субъединиц было продемонстрировано, что
циклоспорину А [78].
данные структуры вряд ли могут формировать
Поиск новых канальных компонентов MPT
MPT пору. Так, показано, что внутреннее прост!
поры привел сначала к фосфатному переносчи!
ранство с кольца ATP!синтазы настолько гидро!
ку, а потом к ATP!синтазе митохондрий [79, 80].
фобно, что вряд ли может быть ответственно за
Все эти белки объединяет то, что они способны
формирование поры [83]. При нокауте генов,
взаимодействовать с циклофилином Д. В пос!
кодирующих эту субъединицу, в митохондриях,
леднее время в качестве канального компонента
также можно индуцировать образование MPT
MPT поры принято считать ATP!синтазу. Было
поры [84]. Нарушение синтеза белков, ответ!
высказано несколько предположений, как она
ственных за формирование димеров также не
может «работать» в качестве MPT поры - начи!
препятствует формированию в митохондриях
ная от формирования поры различными белка!
поры [85]. Кроме того, димеризация ATP!синта!
ми, входящими в мембранный F0 комплекс
зы усиливается ингибитором ATP!азы - белком
ATP!синтазы и заканчивая тем, что пора может
IF1, который ингибирует открытие MPT поры и
образовываться на стыке димера ATP!синтазы
защищает клетку от ишемических повреждений
[80, 81]. Так, нокдаун гена, кодирующего c субъ!
[86]. Вместе с тем, необходимо отметить, что
единицу ATP!синтазы, приводил к ингибирова!
удаление различных субъединиц ATP!синтазы
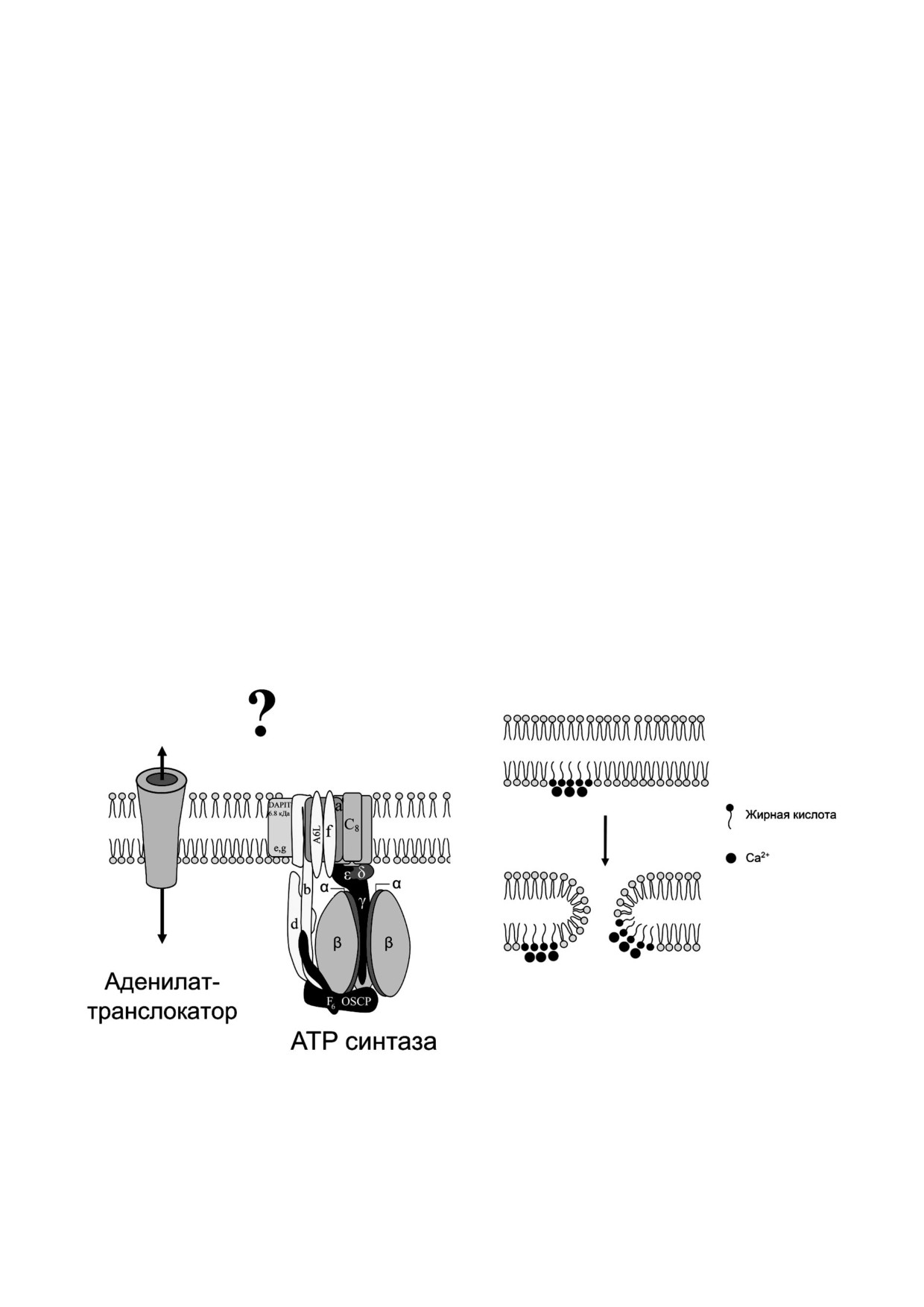
а
б
Рис. 3. Митохондриальные поры. а - Аденилаттранслокатор и ATP!синтаза митохондрий как возможные канал!образу!
ющие компоненты MPT поры внутренней мембраны митохондрий; б - образование липидной поры, индуцированной
пальмитиновой кислотой и Са2+. Взаимодействие Са2+ с жирной кислотой приводит к формированию твердокристалли!
ческих мембранных доменов с последующим образованием липидной поры по механизму ламелярного (хемотропного)
фазового перехода
БИОХИМИЯ том 84 вып. 6 2019
768
БЕЛОСЛУДЦЕВ и др.
влечет за собой и снижение уровня энергетичес!
Митохондриальная липидная Са2+ зависимая
кого метаболизма, подавление дыхательной ак!
пора, индуцированная жирными кислотами. Изу!
тивности и генерации мембранного потенциала
чение структуры MPT поры и поиск ее модуля!
[84, 85]. Безусловно, это может являться допол!
торов позволили показать, что можно подобрать
нительным фактором, облегчающим формиро!
условия, когда циклоспорин А не блокирует на!
вание поры в митохондриях даже при отсут!
бухание органелл. В настоящее время известен
ствии тех или иных субъединиц.
ряд соединений, способных индуцировать от!
Таким образом, в настоящее время можно
крытие Ca2+!зависимой поры по механизму, не!
говорить о том, что структура поры до сих пор не
чувствительному к циклоспорину. К ним отно!
установлена. Проведенное в 2015 г. исследова!
сятся экзогенные амфипатические пептиды
ние с применением технологии Crispr/Cas9 по!
(например, сигнальные белки), некоторые про!
казало, что из 14!ти белков, которые могут
оксиданты, гормоны (тироксин), и др. [93]. К та!
участвовать в формировании MPT поры, неотъ!
ким соединениям также относятся и свободные
емлемым компонентном является циклофилин Д
жирные кислоты.
(также рассматривается SPG7) [76]. Потеря цик!
Способность насыщенных жирных кислот в
лофилина Д приводит к значительному увеличе!
умеренных концентрациях в присутствии ионов
нию пороговой концентрации Са2+ для откры!
Са2+ индуцировать открытие циклоспорин А!не!
тия поры, однако не к устранению самого отк!
чувствительной митохондриальной поры была
рытия. Можно предположить, что в зависимос!
продемонстрирована в начале 2000 гг. [94]. Про!
ти от тех или иных условий канальным компо!
веденные нами исследования позволили сделать
нентом внутренней мембраны митохондрий мо!
вывод о новом типе митохондриальной поры -
жет быть любой из белков, взаимодействующих
липидной поре. Показано, что насыщенная
с циклофилином Д.
пальмитиновая кислота связывает Са2+ с высо!
Несмотря на то, что структура MPT поры так и
ким сродством и в присутствии этого иона спо!
не определена, ее роль в физиологии и патологии
собна пермеабилизовать как природные мемб!
хорошо установлена. Так, еще в начале 1990!х гг.
раны (митохондрии разных тканей и плазмати!
показано, что ингибитор MPT поры циклоспо!
ческая мембрана эритроцитов), так и искусствен!
рин А способен значительно увеличивать пог!
ные мембраны (БЛМ и липосомы) [95-99].
лощение Са2+ и снижать его выброс изолиро!
Последнее исключило возможное участие бел!
ванными кардиомиоцитами без влияния на
ков в образовании порового компонента. О том,
клеточную морфологию и жизнеспособность.
что пора, индуцируемая пальмитиновой кисло!
Установлено, что этот эффект был опосредован
той и Са2+ не является MPT порой говорит и со!
митохондриями [87]. Подобные результаты бы!
вершенно другой тип регуляции и, в первую
ли получены на клетках, нокаутированных по
очередь, нечувствительность к циклоспорину А
гену Ppif, кодирующему циклофилин Д [88].
и возможность замены Са2+ на Sr2+ [94, 99]. По!
Bernardi и Patronilli предположили в 1996 г., что
казано, что в основе механизма образования
именно открытие MPT поры ответственно за
пальмитат/Ca2+!индуцированной поры лежит
выброс ионов Са2+ из органелл, т.е. MPT пора
способность анионов насыщенных жирных
может быть неспецифической системой выбро!
кислот образовывать прочные комплексы с Са2+
са ионов Са2+ из органелл [13]. Гипотеза «MPT
в липидном бислое с последующей их сегрега!
пора как система выброса Са2+» основана на
цией в твердо!кристаллические мембранные до!
возможном кратковременном открытии MPT
мены и появлением гидрофильных липидных
поры. Многочисленными исследованиями по!
пор [96, 99] (рис. 3, б). Следует отметить важную
казано, что MPT пора может существовать в
особенность этой поры (как и любой липидной
двух состояниях - высоко! и низко!проводи!
поры): она способна самопроизвольно «залечи!
мом. Режим открывания MPT поры: («постоян!
ваться», если ее размер не превышает критичес!
ный» или «кратковременный») зависит от кон!
кого значения (для жидкокристаллического би!
центрации индуцирующих ее агентов, прежде
слоя - это 9 нм) [100]. Именно поэтому в экспе!
всего, Са2+ [89]. В поддержку данного предпо!
риментах на митохондриях мы со временем наб!
ложения получены результаты о Ca2+!индуци!
людали восстановление мембранного митохонд!
рованных осцилляциях («Ca2+ волны») в изоли!
риального потенциала после индукции поры.
рованных митохондриях и культуре клеток, ко!
Способность пальмитат/Ca2+!зависимой по!
торые были ингибированы циклоспорином А
ры к самопроизвольному закрытию легла в ос!
[90, 91]. Необходимо отметить, что описанные
нову нашего предположения, что данная пора
осцилляции индуцировались также ионами
может являться системой выброса ионов Са2+ из
Sr2+, что предполагает участие в этих процессах
органелл. Показано, что в присутствии пальми!
поры иного типа [92].
тиновой кислоты происходит выброс иона Са2+
БИОХИМИЯ том 84 вып. 6 2019
МИТОХОНДРИАЛЬНЫЙ Сa2+ ТРАНСПОРТ
769
из митохондрий, что сопровождается как депо!
Регуляция внутриклеточной концентрации
ляризацией органелл, так и защелачиванием
Са2+ является важным механизмом во внутри!
среды инкубации (т.е. наблюдался своего рода
клеточной сигнализации. Она достигается взаи!
неспецифический Са2+/Н+ обмен). Добавление
модействием нескольких органелл, которые
рутения красного в этих условиях приводило к
поглощают и выбрасывают кальций, что и обес!
остановке выброса Са2+ и практически полному
печивает согласованную и быструю передачу
восстановлению мембранного потенциала [14, 101].
кальциевого сигнала. Митохондрии играют
Это свидетельствует о том, что в данном случае
важную роль в этом процессе, являясь основной
деполяризация митохондрий была связана,
буферной системой для ионов кальция, своего
прежде всего, с рециркуляцией Са2+ через внут!
рода «файерволом» от избыточного увеличения
реннюю мембрану, а не с постоянным открыти!
этих ионов в цитоплазме. Они обладают способ!
ем поры.
ностью быстро поглощать высокие концентра!
Возможность участия липидной поры в ре!
ции кальция из цитоплазмы в митохондриаль!
циркуляции ионов Са2+(Sr2+) через митохондри!
ный матрикс, где этот ион формирует комплек!
альную мембрану была продемонстрирована на!
сы с неорганическим и другими фосфатами.
ми и в отсутствии экзогенной жирной кислоты.
Многочисленными исследованиями, проведен!
Известно, что ионы Са2+ и Sr2+ являются актива!
ными на разных типах клеток, показано, что ми!
торами митохондриальной Са2+!зависимой фос!
тохондрии способны изменять внутриклеточ!
фолипазы А2 (β3 изоформа), которая способна
ную концентрацию Са2+ как локально, так и во
гидролизовать фосфолипиды как по sn)2, так и
всей цитоплазме [29]. Показано, что при выбро!
по sn)1 положению (в sn)1 положении фосфоли!
се Са2+ из ретикулума при стимуляции IP3 ре!
пидов находятся преимущественно насыщен!
цепторов пиковая внутриклеточная концентра!
ные жирные кислоты) [102]. Нами было проде!
ция Са2+ ниже в тех клетках, в которых была по!
монстрировано, что в гипотонических условиях
вышенная экспрессия MCU [6]. При этом нали!
Са2+(Sr2+) запускают циклические циклоспо!
чие активного митохондриального кальциевого
рин!нечувствительные колебания как ионных
унипортера не является обязательным условием
потоков через внутреннюю мембрану митохонд!
выживания млекопитающих, поскольку нокаут
рий, так и колебания объема митохондриально!
гена канального белка MCU в печени или серд!
го матрикса. Эти колебания подавлялись инги!
це мышей не приводил к каким!либо сущест!
биторами Са2+!зависимой фосфолипазы А2 -
венным дефектам этих органов [103]. В то же
AACOCF3, аристолоховой кислотой и трифтор!
время животные, нокаутированные по гену
перазином, но не ингибиторами Са2+!независи!
Slc8b1 (NCLX), были нежизнеспособны и поги!
мой фосфолипазы А2. Добавление в этих усло!
бали в течение первых дней после нокаута, что
виях экзогенной пальмитиновой кислоты при!
было связано с увеличенным содержанием Са2+
водило к восстановлению колебаний ионных
в митохондриях и индукцией MPT поры [104].
потоков через внутреннюю митохондриальную
Способность митохондрий участвовать в
мембрану [14]. Таким образом, полученные ре!
Са2+!сигнализации в большой степени зависит от
зультаты послужили доказательством того, что
типа клеток. Так, во взрослых кардиомиоцитах
липидная пора, индуцированная насыщенными
Са2+ из цитоплазмы убирается, в основном, с по!
жирными кислотами и Са2+, может являться
мощью Са2+ ATPазы саркоплазматического рети!
системой выброса двухвалентного иона из ми!
кулума SERCA и обменника NCX плазматичес!
тохондрий.
кой мембраны, которые выбрасывают Са2+ из ци!
топлазмы в 20-60 раз быстрее, чем Са2+!унипор!
тер митохондрий [105]. В то же время в других не!
ЗНАЧЕНИЕ МИТОХОНДРИАЛЬНОГО
мышечных клетках именно поглощение Са2+ ми!
ТРАНСПОРТА ИОНОВ Са2+ ДЛЯ
тохондриями может играть основную роль в регу!
ФУНКЦИОНИРОВАНИЯ КЛЕТКИ
ляции концентрации иона в цитоплазме. Напри!
мер, в клетках поджелудочной железы митохонд!
Исследования, посвященные роли Са2+ транс!
рии способны предотвращать избыточное увели!
порта в жизнедеятельности клетки, проводят во
чение концентрации Са2+ в апикальной части ци!
многих лабораториях мира. Между тем, можно
топлазмы, вызванное инозитол (1,3,5) трифосфа!
выделить три основных функции, которые вы!
том и, тем самым, регулировать секрецию инсу!
полняют Са2+!транспортирующие системы мито!
лина [106]. Показано также, что митохондрии яв!
хондрий в клетке - это обеспечение внутрикле!
ляются активным участником кальциевых волн в
точного Са2+ гомеостаза, регуляция энергети!
нервных клетках и молодых кардиомиоцитах, из!
ческого метаболизма митохондрий и запуск
меняя концентрацию иона локально на ограни!
процессов клеточной гибели.
ченном пространстве цитоплазмы [107, 108].
БИОХИМИЯ том 84 вып. 6 2019
770
БЕЛОСЛУДЦЕВ и др.
Аккумуляция кальция митохондриями явля!
ции и митохондриальной деполяризации с по!
ется важным процессом в регуляции митохонд!
следующей клеточной гибелью. Данные процес!
риальной и клеточной энергетики. В митохонд!
сы не всегда подавляются циклоспорином А и
риях ионы Са2+ активируют три матриксных
могут быть индуцированы при замене Са2+ на
фермента - пируватдегидрогеназу, цитратдегид!
Sr2+ [110, 111]. Эти свойства позволили нам пред!
рогеназу и α!кетоглутарат дегидрогеназу, и не!
положить участие в данном механизме липид!
которые комплексы дыхательной цепи [109].
ной поры, индуцированной жирными кислота!
Активация этих систем приводит к увеличению
ми. Показано, что AACOCF3, ингибитор Са2+!
продукции ATP в митохондриях. Это подтверж!
зависимой фосфолипазы А2, препятствуя появ!
дается наблюдением, что нокаут мышей по гену
лению жирных кислот в мембране митохондрий
MCU приводил к переключению энергетическо!
и, соответственно, формированию липидной
го метаболизма нейронов головного мозга на
поры, подавлял как циклоспорин А!нечувстви!
гликолиз и подавлению активности I комплекса
тельный выброс Са2+/Sr2+ из изолированных
дыхательной цепи.
митохондрий мозга, так и развитие глутамат!
Как было сказано выше, избыточное накоп!
индуцированной отсроченной Са2+ дисрегуля!
ление Са2+ в митохондриях приводит к откры!
ции и митохондриальной деполяризации ней!
тию в органеллах двух типов пор - MPT поры и
ронов мозжечка [99, 112].
липидной, индуцированной жирными кислота!
ми. Неконтролируемая и длительная пермеаби!
За долгую историю изучения митохондри!
лизация митохондриальной мембраны будет
ального транспорта ионов Са2+ достигнут значи!
приводить к коллапсу мембранного потенциала,
тельный прогресс в понимании механизмов это!
разрушению митохондрий, появлению в цитоп!
го процесса и расшифровки молекулярных
лазме проапоптотических белков и гибели клет!
структур, ответственных за него. Очевидно, что
ки. Участие циклоспорин А!чувствительной
системы, транспортирующие Са2+ через внут!
MPT поры было продемонстрировано в разви!
реннюю митохондриальную мембрану, важны
тии многих патологий, таких как инфаркт, мы!
не только для физиологии клетки (регуляция
шечные дистрофии, нейродегенеративные забо!
Са2+ гомеостаза или клеточной энергетики), но
левания (болезнь Альцгеймера, рассеянный
и в развитии патологических процессов и кле!
склероз и боковой амиотрофический склероз),
точной гибели. Следует отметить, что перед ис!
инсульт и др. Показано, что фармакологическая
следователями в данной области стоит еще дос!
или генетическая модуляция циклофилина Д
таточно много задач, к которым можно отнести
придавала не только устойчивость митохондрий
определение архитектуры Са2+ транспортиру!
к открытию MPT поры, но и толерантность к
щих систем митохондрий и MPT поры, а также
вышеперечисленным патологиям: снижались
выявление механизмов регуляции и управления
размеры инфаркта и инсульта, увеличивалась
этими системами при различных заболеваниях.
обучаемость животных и т.д. [74].
Подобно негативному влиянию MPT поры
Финансирование. Работа выполнена при фи!
на клетки и органы животных, липидная пора
нансовой поддержке Российского фонда фунда!
также может участвовать в развитии патологи!
ментальных исследований (гранты 18!315!20011
ческих процессов. Она способствует не только
(главы 1, 5), 19!015!00117 (глава 4)), РНФ (грант 18!
выбросу проапоптотических белков из митохо!
75!00011 (главы 2, 3)), и Министерства образо!
ндрий [98, 99], но также участвует в развитии
вания и науки РФ (госзадание 6.5170.2017/8.9).
глутамат!индуцированной деградации нервных
Конфликт интересов. Авторы заявляют об от!
клеток, которая наблюдается при гипоксичес!
сутствии конфликта интересов.
ких повреждениях мозга. В этих условиях дли!
Соблюдение этических норм. Настоящий об!
тельное поступление Са2+ в клетку через активи!
зор не содержит описания каких!либо исследо!
руемые глутаматом NMDA рецепторы приводит
ваний с использованием людей или животных в
к развитию отсроченной кальциевой дисрегуля!
качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Deluca, H.F., and Engstrom, G.W. (1961) Calcium uptake
3.
Jiang, D., Zhao, L., and Clapham, D.E. (2009) Genome!
by rat kidney mitochondria, Proc. Natl. Acad. Sci. USA, 47,
wide RNAi screen identifies Letm1 as a mitochondrial
1744-1750, doi: 10.1073/pnas.47.11.1744.
Ca2+/H+ antiporter, Science, 326, 144-147, doi: 10.1126/
2.
Vasington, F.D., and Murphy, J.V. (1962) Ca ion uptake by
science.1175145.
rat kidney mitochondria and its dependence on respiration
4.
Palty, R., Silverman, W.F., Hershfinkel, M., Caporale, T.,
and phosphorylation, J. Biol. Chem., 237, 2670-2677.
Sensi, S.L., Parnis, J., Nolte, C., Fishman, D., Shoshan!
БИОХИМИЯ том 84 вып. 6 2019
МИТОХОНДРИАЛЬНЫЙ Сa2+ ТРАНСПОРТ
771
Barmatz, V., Herrmann, S., Khananshvili, D., and Sekler, I.
and role of Ca2+ efflux, Biochemistry, 16, 5618-5625,
(2010) NCLX is an essential component of mitochondrial
doi: 10.1021/bi00644a036.
Na+/Ca2+ exchange, Proc. Natl. Acad. Sci. USA, 107,
17.
Rizzuto, R., Brini, M., Murgia, M., and Pozzan, T. (1993)
436-441, doi: 10.1073/pnas.0908099107.
Microdomains with high Ca2+ close to IP(3)!sensitive
5. Perocchi, F., Gohil, V.M., Girgis, H.S., Bao, X.R.,
channels that are sensed by neighboring mitochondria,
McCombs, J.E., Palmer A.E., and Mootha, V.K. (2010)
Science, 262, 744-747, doi: 10.1126/science.8235595.
MICU1 encodes a mitochondrial EF hand protein
18.
Raturi, A., and Simmen, T. (2013) Where the endoplasmic
required for Ca2+ uptake, Nature, 467, 291-296, doi: 10.
reticulum and the mitochondrion tie the knot: the mito!
1038/nature09358.
chondria!associated membrane (MAM), Biochim. Biophys.
6. De Stefani, D., Raffaello, A., Teardo, E., Szabo, I., and
Acta, 1833, 213-24, doi: 10.1016/j.bbamcr.2012.04.013.
Rizzuto, R. (2011) A forty!kilodalton protein of the inner
19.
Giorgi, C., Missiroli, S., Patergnani, S., Duszynski, J.,
membrane is the mitochondrial calcium uniporter, Nature,
Wieckowski, M.R., and Pinton, P. (2015) Mitochondria!
476, 336-340, doi: 10.1038/nature10230.
associated membranes: composition, molecular mecha!
7. Baughman, J.M., Perocchi, F., Girgis, H.S., Plovanich, M.,
nisms, and physiopathological implications, Antioxid.
Belcher!Timme, C.A., Sancak, Y., Bao, X.R., Strittmatter, L.,
Redox. Signal., 22, 995-1019, doi: 10.1089/ars.2014.6223.
Goldberger, O., Bogorad, R.L., Koteliansky, V., and
20.
Poston, C.N., Krishnan, S.C., and Bazemore!Walker, C.R.
Mootha, V.K. (2011) Integrative genomics identifies MCU
(2013) In depth proteomic analysis of mammalian mito!
as an essential component of the mitochondrial calcium
chondria!associated membranes (MAM), J. Proteomics,
uniporter, Nature, 476, 341-345, doi: 10.1038/nature10234.
79, 219-230, doi: 10.1016/j.jprot.2012.12.018.
8. Raffaello, A., De Stefani, D., Sabbadin, D., Teardo, E.,
21.
Szabadkai, G., Bianchi, K., Varnai, P., De Stefani, D.,
Merli, G., Picard, A., Checchetto, V., Moro, S., Szabo, I.,
Wieckowski, M.R., Cavagna, D., Nagy, A.I., Balla, T., and
and Rizzuto, R. (2013) The mitochondrial calcium uni!
Rizzuto, R. (2006) Chaperone!mediated coupling of
porter is a multimer that can include a dominant!negative
endoplasmic reticulum and mitochondrial Ca2+ channels,
pore!forming subunit, EMBO J., 32, 2362-2376, doi: 10.
J. Cell Biol., 175, 901-911, doi: 10.1083/jcb.200608073.
1038/emboj.2013.157.
22.
De Brito, O.M., and Scorrano, L. (2008) Mitofusin 2
9. Plovanich, M., Bogorad, R.L., Sancak, Y., Kamer, K.J.,
tethers endoplasmic reticulum to mitochondria, Nature,
Strittmatter, L., Li, A.A., Girgis, H.S., Kuchimanchi, S.,
456, 605-610, doi: 10.1038/nature07534.
De Groot, J., Speciner, L., Taneja, N., Oshea, J.,
23.
Hirabayashi, Y., Kwon, S.K., Paek, H., Pernice, W.M.,
Koteliansky, V., and Mootha, V.K. (2013) MICU2, a para!
Paul, M.A., Lee, J., Erfani, P., Raczkowski, A., Petrey, D.S.,
log of MICU1, resides within the mitochondrial uniporter
Pon, L.A., and Polleux, F. (2017) ER!mitochondria tethering
complex to regulate calcium handling, PLoS One 8,
by PDZD8 regulates Ca2+ dynamics in mammalian neurons,
e55785, doi: 10.1371/journal.pone.0055785.
Science, 358, 623-630, doi: 10.1126/science.aan6009.
10. Mallilankaraman, K., Cardenas, C., Doonan, P.J.,
24.
Chernorudskiy, A.L., and Zito, E. (2017) Regulation of
Chandramoorthy, H.C., Irrinki, K.M., Golenar, T.,
сalcium homeostasis by ER redox: a close!up of the
Csordas, G., Madireddi, P., Yang, J., Muller, M., Miller, R.,
ER/mitochondria connection, J. Mol. Biol.,
429,
Kolesar, J.E., Molgo, J., Kaufman, B., Hajnoczky, G.,
620-632, doi: 10.1016/j.jmb.2017.01.017.
Foskett, J.K., and Madesh, M. (2012) MCUR1 is an
25.
Giacomello, M., Drago, I., Bortolozzi, M., Scorzeto, M.,
essential component of mitochondrial Ca2+ uptake that
Gianelle, A., Pizzo, P., and Pozzan, T. (2010) Ca2+ hot
regulates cellular metabolism, Nat. Cell Biol.,
14,
spots on the mitochondrial surface are generated by Ca2+
1336-1343, doi: 10.1038/ncb2622.
mobilization from stores, but not by activation of store!
11. Sancak, Y., Markhard, A.L., Kitami, T., Kovacs!Bogdan, E.,
operated Ca2+ channels, Mol. Cell, 38, 280-290, doi: 10.
Kame, K.J., Udeshi, N.D., Carr, S.A., Chaudhuri, D.,
1016/j.molcel.2010.04.003.
Clapham, D.E., Li, A.A., Calvo, S.E., Goldberger, O., and
26.
Gunter, T., and Pfeiffer, D. (1990) Mechanisms by which
Mootha, V.K. (2013) EMRE is an essential component of
mitochondria transport calcium, Am. J. Physiol., 258,
the mitochondrial calcium uniporter complex, Science,
755-786, doi: 10.1152/ajpcell.1990.258.5.C755.
342, 1379-1382, doi: 10.1126/science.1242993.
27.
Deryabina, Y.I., Isakova, E.P., and Zvyagilskaya, R.A.
12. Hoffman, N.E., Chandramoorthy, H.C., Shanmughap!
(2004) Mitochondrial calcium transport systems: proper!
riya, S., Zhang, X.Q., Vallem, S., Doonan, P.J., Mallian!
ties, regulation, and taxonomic features, Biochemistry
karaman, K., Guo, S., Rajan, S., Elrod, J.W., Koch, W.J.,
(Moscow), 69, 91-102.
Cheung, J.Y., and Madesh, M. (2014) SLC25A23 aug!
28.
Rossi, C.S., Vasington, F.D., and Carafoli, E. (1973) The
ments mitochondrial Ca2+ uptake, interacts with MCU,
effect of ruthenium red on the uptake and release of Ca2+ by
and induces oxidative stress!mediated cell death, Mol. Biol.
mitochondria, Biochem. Biophys. Res. Commun., 50, 846-852.
Cell, 25, 936-947, doi: 10.1091/mbc.E13!08!0502.
29.
De Stefani, D., Rizzuto, R., and Pozzan, T. (2016) Enjoy
13. Bernardi, P., and Petronilli, V. (1996) The permeability
the trip: calcium in mitochondria back and forth, Annu.
transition pore as a mitochondrial calcium release channel:
Rev. Biochem., 85, 161-192, doi: 10.1146/annurev!
a critical appraisal, J. Bioenerg. Biomembr., 28, 131-138,
biochem!060614!034216.
doi: 10.1007/BF02110643.
30.
Saris, N.E., and Karafoli, E. (2005) A historical review of
14. Mironova, G.D., Saris, N.!E.L., Belosludtseva, N.V.,
cellular calcium handling, with emphasis on mitochondria,
Agafonov, A.V., Elantsev, A.B., and Belosludtsev, K.N.
Biochemistry (Moscow), 70, 187-194.
(2015) Involvement of palmitate/Ca2+(Sr2+)!induced pores
31.
Mironova, G.D., Sirota, T.V., Pronevich, L.A., Trofi!
in the cycling of ions across the mitochondrial membrane,
menko, N.V., Mironov, G.P., Grigorjev, P.A., and Kondra!
Biochim. Biophys. Acta, 1848, 488-495, doi: 10.1016/j.
shova, M.N. (1982) Isolation and properties of Ca2+!trans!
bbamem.2014.10.027.
porting glycoprotein and peptide from beef heart mito!
15. Bragadin, M., Pozzan, T., and Azzone, G. (1979) Kinetics
chondria, J. Bioenerg. Biomembr., 14, 213-225.
of Ca2+ carrier in rat liver mitochondria, Biochemistry, 18,
32.
Saris, N.E., Sirota, T.V., Virtanen, I., Niva, K., Penttila, T.,
5972-5978, doi: 10.1021/bi00593a033.
Dolgachova, L.P., and Mironova, G.D. (1993) Inhibition
16. Pozzan, T., Bragadin, M., and Azzone, G.F.
(1977)
of the mitochondrial calcium uniporter by antibodies
Disequilibrium between steady!state Ca2+ accumulation
against a 40!kDa glycoprotein T, J. Bioenerg. Biomembr.,
ratio and membrane potential in mitochondria. Pathway
25, 307-312, doi: 10.1007/BF00762591.
БИОХИМИЯ том 84 вып. 6 2019
772
БЕЛОСЛУДЦЕВ и др.
33.
Bick, A.G., Calvo, S.E., and Mootha, V.K.
(2012)
Ru360, Mol. Cell, 72, 778-785, doi: 10.1016/j.mol!
Evolutionary diversity of the mitochondrial calcium uni!
cel.2018.09.008.
porter, Science, 336, 886, doi: 10.1126/science.1214977.
47.
Kroner, H. (1986) Ca2+ ions, an allosteric activator of cal!
34.
Baradaran, R., Wang, C., Siliciano, A.F., and Long, S.B.
cium uptake in rat liver mitochondria, Arch. Biochem.
(2018) Cryo!EM structures of fungal and metazoan mito!
Biophys., 251, 525-535, doi: 10.1016/0003!9861(86)90360!7.
chondrial calcium uniporters, Nature, 559, 580-584,
48.
Kasparinsky, F.O., and Vinogradov, A.D. (1996) Slow
doi: 10.1038/s41586!018!0331!8.
Ca2+!induced inactive/active transition of the energy!
35.
Yoo, J., Wu, M., Yin, Y, Herzik, M.A., Lander, G.C., and
dependent Ca2+ transporting system of rat liver mitochond!
Lee, S.Y. (2018) Cryo!EM structure of a mitochondrial
ria: clue for Ca2+ influx cooperativity, FEBS Lett., 389,
calcium uniporter, Science, 361, 506-511, doi: 10.1126/
293-296, doi: 10.1016/0014!5793(96)00606!0.
science.aar4056.
49.
Basso, E., Rigotto, G., Zucchetti, A.E., and Pozzan, T.
36.
Fan, C., Fan, M., Orlando, B.J., Fastman, N.M., Zhang, J.,
(2108) Slow activation of fast mitochondrial Ca2+ uptake
Xu, Y., Chambers, M.G., Xu, X., Perry, K., Liao, M., and
by cytosolic Ca2+, J. Biol. Chem., 293, 17081-17094, doi: 10.
Feng, L. (2018) X!ray and cryo!EM structures of the mito!
1074/jbc.RA118.002332.
chondrial calcium uniporter, Nature, 559, 575-579,
50.
Patron, M., Granatiero, V., Espino, J., Rizzuto, R., and
doi: 10.1038/s41586!018!0330!9.
De Stefani, D. (2019) MICU3 is a tissue!specific enhancer
37.
Oxenoid, K., Dong, Y., Cao, C., Cui, T., Sancak, Y.,
of mitochondrial calcium uptake, Cell Death Differ., 26,
Markhard, A.L., Grabarek, Z., Kong, L., Liu, Z., Ouyang, B.,
179—195, doi: 10.1038/s41418!018!0113!8.
Cong, Y., Mootha, V.K., and Chou, J.J.
(2016)
51.
Ren, T., Wang, J., Zhang, H., Yuan, P., Zhu, J., Wu, Y.,
Architecture of the mitochondrial calcium uniporter,
Huang, Q., Guo, X., Zhang, J., Ji, L., Li, J., Zhang, H.,
Nature, 533, 269-273, doi: 10.1038/nature17656.
Yang, H., and Xing, J. (2018) MCUR1!mediated mito!
38.
Patron, M., Checchetto, V., Raffaello, A., Teardo, E.,
chondrial calcium signaling facilitates cell survival of hepa!
Vecellio Reane, D., Mantoan, M., Granatiero, V., Szabo, I.,
tocellular carcinoma via reactive oxygen species!depen!
De Stefani, D., and Rizzuto, R. (2014) MICU1 and
dent P53 degradation, Antioxid. Redox Signal.,
28,
MICU2 finely tune the mitochondrial Ca2+ uniporter by
1120-1136, doi: 10.1089/ars.2017.6990.
exerting opposite effects on MCU activity, Mol. Cell, 53,
52.
Paupe, V., Prudent, J., Dassa, E.P., Rendon, O.Z., and
726-773, doi: 10.1016/j.molcel.2014.01.013.
Shoubridge, E.A. (2015) CCDC90A (MCUR1) is a
39.
Yamamoto, T., Yamagoshi, R., Harada, K., Kawano, M.,
cytochrome c oxidase assembly factor and not a regulator
Minami, N., Ido, Y., Kuwahara, K., Fujita, A., Ozono, M.,
of the mitochondrial calcium uniporter, Cell. Metab., 21,
Watanabe, A., Yamada, A., Terada, H., and Shinohara, Y.
109-116, doi: 10.1016/j.cmet.2014.12.004.
(2016) Analysis of the structure and function of EMRE in
53.
Tomar, D., Dong, Z., Shanmughapriya, S., Koch, D.A.,
a yeast expression system, Biochim. Biophys. Acta, 1857,
Thomas, T., Hoffman N.E., Timbalia, S.A., Goldman, S.J.,
831-839, doi: 10.1016/j.bbabio.2016.03.019.
Breves, S.L., Corbally, D.P., Nemani, N., Fairweather, J.P.,
40.
Vais, H., Mallilankaraman, K., Mak, D., Hoff, H., Payne, R.,
Cutri, A.R., Zhang, X., Song, J., Jana, F., Huang, J.,
Tanis, J.E., and Foskett, J.K. (2016) EMRE is a matrix
Barrero, C., Rabinowitz, J.E., Luongo, T.S., Schuma!
Ca2+ sensor that governs gatekeeping of the mitochondrial
cher, S.M., Rockman, M.E., Dietrich, A., Merali, S.,
Ca2+ uniporter, Cell Rep., 14, 403-410, doi: 10.1016/j.cel!
Caplan, J., Stathopulos, P., Ahima, R.S., Cheung, J.Y.,
rep.2015.12.054.
Houser, S.R., Koch, W.J., Patel, V., Gohil, V.M., Elrod, J.W.,
41.
Csordas, G., Golenar, T., Seifert, E.L., Kamer, K.J.,
Rajan, S., and Madesh, M. (2016) MCUR1 is a scaffold
Sancak, Y., Perocchi, F., Moffat, C., Weaver, D., de la
factor for the MCU complex function and promotes mito!
Fuente Perez, S., Bogorad, R., Koteliansky, V., Adijanto, J.,
chondrial bioenergetics, Cell. Rep., 15, 1673-1685, doi: 10.
Mootha, V.K., and Hajnoczky, G. (2013) MICU1 controls
1016/j.celrep.2016.04.050.
both the threshold and cooperative activation of the mito!
54.
Sparagna, G.C., Gunter, K.K., Sheu, S.S., and Gunter, T.E.
chondrial Ca2+ uniporter, Cell Metab., 17, 976-987,
(1995) Mitochondrial calcium uptake from physiological!
doi: 10.1016/j.cmet.2013.04.020.
type pulses of calcium. A description of the rapid uptake
42.
Kamer, K.J., Sancak, Y., Fomina, Y., Meisel, J.D.,
mode, J. Biol. Chem., 270, 27510-27515, doi: 10.1074/
Chaudhuri, D., Grabarek, Z., and Mootha, V.K. (2018)
jbc.270.46.27510.
MICU1 imparts the mitochondrial uniporter with the abi!
55.
Wei, A.C., Liu, T., Winslow, R.L., and O’Rourke, B. (2012)
lity to discriminate between Ca2+ and Mn2+, Proc. Natl.
Dynamics of matrix!free Ca2+ in cardiac mitochondria:
Acad. Sci. USA, 115, 7960-7969, doi: 10.1073/pnas.
two components of Ca2+ uptake and role of phosphate
1807811115.
buffering, J. Gen. Physiol., 139, 465-478, doi: 10.1085/
43.
Paillard, M., Csordas, G., Szanda, G., Golenar, T.,
jgp.201210784.
Debattisti, V., Bartok, A., Wang, N., Moffat, C., Seifert, E.L.,
56.
Beutner, G., Sharma, V.K., Giovannucci, D.R., Yule, D.I.,
Spat, A., and Hajnoczky, G. (2017) Tissue!specific mito!
and Sheu, S.S. (2001) Identification of a ryanodine recep!
chondrial decoding of cytoplasmic Ca2+ signals is con!
tor in rat heart mitochondria, J. Biol. Chem., 276,
trolled by the stoichiometry of MICU1/2 and MCU, Cell
21482-21488, doi: 10.1074/jbc.M101486200.
Rep., 18, 2291-2300, doi: 10.1016/j.celrep.2017.02.032.
57.
Waldeck!Weiermair, M., Jean!Quartier, C., Rost, R.,
44.
Kamer, K.J., Grabarek, Z., and Mootha, V.K. (2017)
Khan, M.J., Vishnu, N., Bondarenko. A.I., Imamura, H.,
High!affinity cooperative Ca2+ binding by MICU1!
Malli, R., and Graier, W.F. (2011) Leucine zipper EF
MICU2 serves as an on!off switch for the uniporter, EMBO
hand!containing transmembrane protein 1 (Letm1) and
Rep., 18, 1397-1411, doi: 10.15252/embr.201643748.
uncoupling proteins 2 and 3 (UCP2/3) contribute to two
45.
Payne, R., Hoff, H., Roskowski, A., and Foskett, J.K.
distinct mitochondrial Ca2+ uptake pathways, J. Biol.
(2017) MICU2 restricts spatial crosstalk between InsP3R
Chem., 286, 28444-28455, doi: 10.1074/jbc.M111.244517.
and MCU channels by regulating threshold and gain of
58.
Lin, Q.T., and Stathopulos, P.B. (2019) Molecular mecha!
MICU1!mediated inhibition and activation of MCU, Cell
nisms of leucine zipper EF!hand containing transmem!
Rep., 21, 3141-3154, doi: 10.1016/j.celrep.2017.11.064.
brane protein!1 function in health and disease, Int. J. Mol.
46.
Paillard, M., Csordas, G., Huang, K.T., Varnai, P., Joseph, S.K.,
Sci., 20, 286, doi: 10.3390/ijms20020286.
and Hajnoczky, G. (2018) MICU1 interacts with the D!ring
59.
Brookes, P.S., Parker, N., Buckingham, J.A., Vidal!Puig, A.,
of the MCU pore to control its Ca2+ flux and sensitivity to
Halestrap, A.P., Gunter, T.E., Nicholls, D.G., Bernardi, P.,
БИОХИМИЯ том 84 вып. 6 2019
МИТОХОНДРИАЛЬНЫЙ Сa2+ ТРАНСПОРТ
773
Lemasters, J.J., and Brand, M.D. (2008) UCPs!unlikely
75.
Crompton, M., Ellinger, H., and Costi A.
(1988)
calcium porters, Nat. Cell Biol., 10, 1235-1237, doi: 10.
Inhibition by cyclosporin A of a Ca2+!dependent pore in
1038/ncb1108!1235.
heart mitochondria activated by inorganic phosphate and
60.
Wingrove, D.E., and Gunter, T.E. (1986) Kinetics of mito!
oxidative stress, Biochem J., 255, 357-360.
chondrial calcium transport. I. Characteristics of the sodi!
76.
Shanmughapriya, S., Rajan, S., Hoffman, N.E., Higgins, A.M.,
um!independent calcium efflux mechanism of liver mito!
Tomar, D., Nemani, N., Hines, K.J., Smith, D.J., Eguchi, A.,
chondria, J. Biol. Chem., 261, 15159-15165.
Vallem, S., Shaikh, F., Cheung, M., Leonard, N.J.,
61.
Wingrove, D.E., and Gunter, T.E. (1986) Kinetics of mito!
Stolakis., R.S., Wolfers, M.P., Ibetti, J., Chuprun, J.K.,
chondrial calcium transport. II. A kinetic description of the
Jog, N.R., Houser, S.R., Koch, W.J., Elrod, J.W., and
sodium!dependent calcium efflux mechanism of liver
Madesh, M. (2015) SPG7 is an essential and conserved
mitochondria and inhibition by ruthenium red and by tet!
component of the mitochondrial permeability transition
raphenylphosphonium, J. Biol. Chem., 261, 15166-15171.
pore, Mol. Cell, 60, 47-62, doi: 10.1016/j.molcel.2015.
62.
Marinelli, F., Almagor, L., Hiller, R., Giladi, M.,
08.009
Khananshvili, D., and Faraldo Gomez, J.D.
(2014)
77.
Galat, A. (1993) Peptidyleproline cis!trans!isomerases:
Sodium recognition by the Na+/Ca2+ exchanger in the out!
immunophilins, Eur. J. Biochem., 216, 689-707, doi: 10.
ward!facing conformation, Proc. Natl. Acad. Sci. USA, 111,
1111/j.1432!1033.1993.tb18189.x.
5354-5362, doi: 10.1073/pnas.1415751111.
78.
Kokoszka, J., Waymire, K., Levy, S., Sligh, J., Gai, J.,
63.
Tsai, M.F., Jiang, D., Zhao, L., Clapham, D., and Miller, C.
Jones, D., MacGregor, G., and Wallace, D. (2004) The
(2014) Functional reconstitution of the mitochondrial
ADP/ATP translocator is not essential for the mitochond!
Ca2+/H+ antiporter Letm1, J. Gen. Physiol., 143, 67-73,
rial permeability transition pore, Nature, 427, 461-465,
doi: 10.1085/jgp.201311096.
doi: 10.1038/nature02229.
64.
Khananshvili, D. (2013) The SLC8 gene family of sodium!
79.
Leung, A.W., Varanyuwatana, P., and Halestrap, A.P.
calcium exchangers (NCX): structure, function, and regu!
(2008) The mitochondrial phosphate carrier interacts with
lation in health and disease, Mol. Aspects Med., 34,
cyclophilin D and may play a key role in the permeability
220-235, doi: 10.1016/j.mam.2012.07.003.
transition, J. Biol. Chem., 283, 26312-26323, doi: 10.1074/
65.
Palty, R., Ohana, E., Hershfinkel, M., Volokita, M.,
jbc.M805235200.
Elgazar, V., Beharier, O., Silverman, W.F., Argaman, M.,
80.
Giorgio, V., von Stockum, S., Antoniel, M., Fabbro, A.,
and Sekler, I. (2004) Lithium-calcium exchange is medi!
Fogolari, F., Forte, M., Glick, G.D., Petronilli, V., Zoratti, M.,
ated by a distinct potassium!independent sodium-calcium
Szabo, I., Lippe, G., and Bernardi, P. (2013) Dimers of
exchanger, J. Biol. Chem., 279, 25234-25240, doi: 10.1074/
mitochondrial ATP synthase form the permeability tran!
jbc.M401229200.
sition pore, Proc. Natl. Acad. Sci. USA, 110, 5887-5892,
66.
Zhang, Y.L., and Lipton, P. (1999) Cytosolic Ca2+ changes
doi: 10.1073/pnas.1217823110.
during in vitro ischemia in rat hippocampal slices: major
81.
Bonora, M., Bononi, A., De Marchi, E., Giorgi, C.,
roles for glutamate and Na+!dependent Ca2+ release from
Lebiedzinska, M., Marchi, S., Patergnani, S., Rimessi, A.,
mitochondria, J. Neurosci., 19, 3307-3315, doi: 10.1523/
Suski, J.M., Wojtala, A., Wieckowski, M.R., Kroemer, G.,
JNEUROSCI.19!09!03307.1999.
Galluzzi, L., and Pinton, P. (2013) Role of the c!subunit of
67.
Kim, B., and Matsuoka, S. (2008) Cytoplasmic Na+!
the FO ATP synthase in mitochondrial permeability tran!
dependent modulation of mitochondrial Ca2+ via electro!
sition, Cell Cycle, 12, 674-683, doi: 10.4161/cc.23599.
genic mitochondrial Na+/Ca2+ exchange, J. Physiol.
82.
Carraro, M., Giorgio, V., Рileikytл, J., Sartori, G., Forte, M.,
(Lond.), 586, 1683-1697, doi: 10.1113/jphysiol.2007.
Lippe, G., Zoratti, M., Szabo, I., and Bernardi, P. (2014)
148726.
Channel formation by yeast F!ATP synthase and the role
68.
Samanta, K., Mirams, G.R., and Parekh, A.B. (2018)
of dimerization in the mitochondrial permeability transi!
Sequential forward and reverse transport of the Na+/Ca2+
tion, J. Biol. Chem., 289, 15980-15985, doi: 10.1074/jbc.
exchanger generates Ca2+ oscillations within mitochond!
C114.559633.
ria, Nat. Commun., 9, 156, doi: 10.1038/s41467!017!
83.
Zhou, W., Marinelli, F., Nief, C., and Faraldo!Gomez, J.D.
02638!2.
(2017) Atomistic simulations indicate the c!subunit ring of
69.
Palty, R., and Sekler, I. (2012) The mitochondrial
the F1Fo ATP synthase is not the mitochondrial perme!
Na+/Ca2+ exchanger, Cell Calcium, 52, 9-15, doi: 10.1016/
ability transition pore, Elife, 6, e23781, doi: 10.7554/eLife.
j.ceca.2012.02.010.
23781.
70.
Liao, J., Li, H., Zeng, W., Sauer, D.B., Belmares, R., and
84.
He, J., Ford, H.C., Carroll, J., Ding, S., Fearnley, I.M.,
Jiang, Y. (2012) Structural insight into the ion!exchange
and Walker, J.E. (2017) Persistence of the mitochondrial
mechanism of the sodium/calcium exchanger, Science,
permeability transition in the absence of subunit c of
335, 686-690, doi: 10.1126/science.1215759
human ATP synthase, Proc. Natl. Acad. Sci. USA, 114,
71.
Liao, J., Marinelli, F., Lee, C., Huang, Y., Faraldo!
3409-3414, doi: 10.1073/pnas.1702357114.
Gomez, J.D., and Jiang, Y. (2016) Mechanism of extracel!
85.
He, J., Carroll, J., Ding, S., Fearnley, I.M., and Walker, J.E.
lular ion exchange and binding!site occlusion in a sodium/
(2017) Permeability transition in human mitochondria
calcium exchanger, Nat. Struct. Mol. Biol., 23, 590-599,
persists in the absence of peripheral stalk subunits of ATP
doi: 10.1038/nsmb.3230.
synthase, Proc. Natl. Acad. Sci. USA, 114, 9086-9091,
72.
Hunter, D., and Haworth, R. (1979) The Ca2+!induced
doi: 10.1073/pnas.1711201114.
membrane transition in mitochondria. I. The protective
86.
Campanella, M., Casswell, E., Chong, S., Farah, Z.,
mechanisms, Arch. Biochem. Biophys., 195, 453-459,
Wieckowski, M.R., Abramov, A.Y., Tinker, A., and Du!
doi: 10.1016/0003!9861(79)90371!0.
chen, M.R. (2008) Regulation of mitochondrial structure
73.
Zoratti, M., and Szabo, I. (1995) Mitochondrial perme!
and function by the F1Fo!ATPase inhibitor protein, IF1,
ability transition, Biochim. Biophys. Acta, 1241, 139-76,
Cell Metab., 8, 13-25, doi: 10.1016/j.cmet.2008.06.001.
doi: 10.1016/0304!4157(95)00003!A.
87.
Altschuld, R.A., Hohl, C.M., Castillo, L.C., Garleb, A.A.,
74.
Briston, T., Selwood, D.L., Szabadkai, G., and Duchen, M.R.
Starling, R.C., and Brierley, G.P. (1992) Cyclosporin
(2019) Mitochondrial permeability transition: a molecular
inhibits mitochondrial calcium efflux in isolated adult rat
lesion with multiple drug targets, Trends Pharmacol. Sci.,
ventricular cardiomyocytes, Am. J. Physiol., 262, 1699-1704,
40, 50-70, doi: 10.1016/j.tips.2018.11.004.
doi: 10.1152/ajpheart.1992.262.6.H1699.
БИОХИМИЯ том 84 вып. 6 2019
774
БЕЛОСЛУДЦЕВ и др.
88.
Elrod, J.W., Wong, R., Mishra, S., Vagnozzi, R.J.,
100. Антонов В.Ф., Шевченко Е.В. (1995) Липидные поры
Sakthievel, B., Goonasekera, S.A., Karch, J., Gabel, S.,
и стабильность клеточных мембран, Вестн. РАМН, 10,
Farber, J., Force, T., Brown, J.H., Murphy, E., and
48-255.
Molkentin, J.D. (2010) Cyclophilin D controls mitochond!
101. Mironova, G.D., Belosludtsev, K.N., Belosludtseva, N.V.,
rial pore!dependent Ca2+ exchange, metabolic flexibility,
Gritsenko, E.N., Khodorov, B.I., and Saris, N.!E. (2007)
and propensity for heart failure in mice, J. Clin. Invest.,
Mitochondrial Ca2+ cycle mediated by the palmitate!
120, 3680-3687, doi: 10.1172/JCI43171.
activated cyclosporine A!insensitive pore, J. Bioenerg.
89.
Petronilli, V., Miotto, G., Canton, M., Brini, M.,
Biomembr., 39, 167-174, doi: 10.1007/s10863!007!
Colonna, R., Bernardi, P., and Di Lisa, F. (1999) Transient
9079!9.
and long!lasting openings of the mitochondrial permeabil!
102. Murakami, M., Taketomi, Y., Miki, Y., Sato, H.,
ity transition pore can be monitored directly in intact cells
Hirabayashi, T., and Yamamoto, K. (2011) Recent progress
by changes in mitochondrial calcein fluorescence, Biophys.
in phospholipase A2 research: from cells to animals to
J., 76, 725-734, doi: 10.1016/S0006!3495(99)77239!5.
humans, Prog. Lipid. Res., 50, 152-192, doi: 10.1016/
90.
Ichas, F., Jouaville, L.S., Sidash, S.S., Mazat, J.!P., and
j.plipres.2010.12.001.
Holmuhamedov, E.L. (1994) Mitochondrial calcium spiking:
103. Holmstrom, K.M., Pan, X., Liu, J.C., Menazza, S.,
a transduction mechanism based on calcium!induced permea!
Liu, J., Nguyen, T.T., Pan, H., Parks, R.J., Anderson, S.,
bility transition involved in cell calcium signaling, FEBS
Noguchi, A., Springer, D., Murphy, E., and Finkel, T.
Lett., 348, 211-215, doi: 10.1016/0014!5793(94)00615!6.
(2015) Assessment of cardiac function in mice lacking the
91.
Evtodienko, Yu.V., Teplova, V., Khawaja, J., and Saris, N.!E.L.
mitochondrial calcium uniporter, J. Mol. Cell Cardiol., 85,
(1994) The Ca2+!induced permeability transition pore is
178-182, doi: 10.1016/j.yjmcc.2015.05.022.
involved in Ca2+!induced mitochondrial oscillations. A study
104. Luongo, T.S., Lambert, J.P., Gross, P., Nwokedi, M.,
on permeabilised Ehrlich ascites tumour cells, Cell
Lombardi, A.A., Shanmughapriya, S., Carpenter, A.C.,
Calcium, 15, 143-152, doi: 10.1016/0143!4160(94)90053!1.
Kolmetzky, D., Gao, E., van Berlo, J.H., Tsai, E.J.,
92.
Холмухамедов Э.Л., Теплова В.В., Чухлова Э.А. (1991)
Molkentin, J.D., Chen, X., Madesh, M., Houser, S.R.,
Возбудимость внутренней мембраны митохондрий. II.
and Elrod, J.W. (2017) The mitochondrial Na+/Ca2+
Обратимый Sr2+!индуцированный выход Sr2+ из мито!
exchanger is essential for Ca2+ homeostasis and viability,
хондрий, Биологические мембраны, 8, 612-2620.
Nature, 545, 93-97, doi: 10.1038/nature22082.
93.
Zoratti, M., Szabo, I., and De Marchi, U.
(2005)
105. Bers, D.M. (2002) Cardiac excitation-contraction coup!
Mitochondrial permeability transitions: how many doors
ling, Nature, 415, 198-205, doi: 10.1038/415198a.
to the house? Biochim. Biophys. Acta, 1706, 40-252, doi: 10.
106. Tinel, H., Cancela, J.M., Mogami, H., Gerasimenko, J.V.,
1016/j.bbabio.2004.10.006.
Gerasimenko, O.V., Tepikin, A.V., and Petersen, O.H.
94.
Sultan, A., and Sokolove, P. (2001) Palmitic acid opens a
(1999) Active mitochondria surrounding the pancreatic
novel cyclosporin A!insensitive pore in the inner mito!
acinar granule region prevent spreading of inositol trispho!
chondrial membrane, Arch. Biochem. Biophys., 386,
sphate!evoked local cytosolic Ca2+ signals, EMBO J., 18,
31-21, doi: 10.1006/abbi.2000.2194.
4999-5008, doi: 10.1093/emboj/18.18.4999.
95.
Mironova, G.D., Gateau!Roesch, O., Levrat, C.,
107. Billups, B., and Forsythe, I.D. (2002) Presynaptic mito!
Gritsenko, E., Pavlov, E., Lazareva, A.V., Limarenko, E.,
chondrial calcium sequestration influences transmission at
Rey, P., Louisot, P., and Saris, N.!E.L. (2001) Palmitic and
mammalian central synapses, J. Neurosci., 22, 5840-5847,
stearic acids bind Ca2+ with high affinity and form nonspe!
doi: 20026597.
cific channels in black!lipid membranes. Possible relation
108. Drago, I., De Stefani, D., Rizzuto, R., and Pozzan, T.
to Ca2+!activated mitochondrial pores, J. Bioenerg.
(2012) Mitochondrial Ca2+ uptake contributes to buffering
Biomembr., 33, 319-331, doi: 10.1023/A:1010659323937.
cytoplasmic Ca2+ peaks in cardiomyocytes, Proc. Natl.
96.
Agafonov, A., Gritsenko, E., Belosludtsev, K., Kovalev, A.,
Acad. Sci. USA, 109, 12986-12991, doi: 10.1073/pnas.
Gateau!Roesch, O., Saris, N.!E.L., and Mironova, G.D.
1210718109.
(2003) A permeability transition in liposomes induced by
109. Denton, R.M. (2009) Regulation of mitochondrial dehy!
the formation of Ca2+/palmitic acid complexes, Biochim.
drogenases by calcium ions, Biochim. Biophys. Acta, 1787,
Biophys. Acta, 1609, 153-160, doi: 10.1016/S0005!2736
1309-1316, doi: 10.1016/j.bbabio.2009.01.005.
(02)00666!1.
110. Khodorov, B. (2004) Glutamate!induced deregulation of
97.
Belosludtsev, K. N., Trudovishnikov, A.S., Belosludtseva, N.V.,
calcium homeostasis and mitochondrial dysfunction in
Agafonov, A.V., and Mironova, G.D. (2010) Palmitic acid
mammalian central neurons, Prog. Biophys. Mol. Biol., 86,
induces the opening of a Ca2+!dependent pore in the plas!
279-351, doi: 10.1016/j.pbiomolbio.2003.10.00.
ma membrane of red blood cells: the possible role of the
111.
Bolshakov, A.P., Mikhailova, M.M., Szabadkai, G.,
pore in erythrocyte lysis, J. Membr. Biol., 237, 13-19,
Pinelis, V.G., Brustovetsky, N., Rizzuto, R., and
doi: 10.1007/s00232!010!9302!1.
Khodorov, B.I. (2008) Measurements of mitochondrial pH
98.
Belosludtsev, K., Saris, N.!E., Andersson, L., Belo!
in cultured cortical neurons clarify contribution of mito!
sludtseva, N., Agafonov, A., Sharma, A. Moshkov, D.A.,
chondrial pore to the mechanism of glutamate!induced
and Mironova, G.D. (2006) On the mechanism of palmitic
delayed Ca2+ deregulation, Cell Calcium, 43, 602-614,
acid!induced apoptosis: role of pore induced by palmitic
doi: 10.1016/j.ceca.2007.10.005.
acid and Ca2+ in mitochondria, J. Bioenerg. Biomembr., 38,
112. Mironova, G.D., Belosludtsev, K.N., Surin, A.M.,
113-120, doi: 10.1007/s10863!006!9010!9
Trudovishnikov, A.S., Belosludtseva, N.V., Pinelis, V.G.,
99.
Белослудцев К.Н., Миронова Г.Д. (2012) Митохонд!
Krasilnikova, I.A., and Khodorov, B.I. (2012) Mitochond!
риальная липидная пальмитат/Са2+!индуцированная
rial lipid pore in the mechanism of glutamate!induced cal!
пора и еe возможная роль в деградации нервных кле!
cium deregulation of brain neurons, Biologicheskie
ток, Патологическая физиология и экспериментальная
Membrany, 6, 45-55, doi: 10.1134/S1990747811060080.
терапия, 3, 20-232.
БИОХИМИЯ том 84 вып. 6 2019
МИТОХОНДРИАЛЬНЫЙ Сa2+ ТРАНСПОРТ
775
MITOCHONDRIAL Ca2+ TRANSPORT: MECHANISMS,
MOLECULAR STRUCTURES, AND A SIGNIFICANCE
FOR CELLS
K. N. Belosludtsev1,2*, M. V. Dubinin1, N. V. Belosludtseva2,
and G. D. Mironova2
1 Institute of Theoretical and Experimental Biophysics, Russian Academy
of Sciences, 142290 Pushchino, Moscow Region, Russia;
E)mail: bekonik@gmail.com
2 Mari State University, 424000 Yoshkar)Ola, Russia
Received February 19, 2019
Revised March 18, 2019
Accepted March 19, 2019
Mitochondria are one of the most important cell organelles involved in the regulation of intracellular calcium homeo!
stasis. In the past decade, a number of molecular structures that are responsible for the mitochondrial calcium trans!
port and the formation of mitochondrial pores have been identified, including mitochondrial Ca2+ uniporter,
Na+/Ca2+ exchanger, and Ca2+/H+ antiporter. This review considers data on their structure, regulation, and physio!
logical role. The pathophysiological mechanism of Ca2+ transport provided by the cyclosporin A!sensitive mitochon!
drial permeability transition pore is discussed. An alternative mechanism for the formation of mitochondrial pore,
namely the lipid pore induced by fatty acids, as well as its role in Ca2+ transport, is described in detail.
Keywords: mitochondria, Ca2+ transport, MCU, NCLX, MPT pore, mitochondrial lipid pore
БИОХИМИЯ том 84 вып. 6 2019