БИОХИМИЯ, 2019, том 84, вып. 6, с. 795 - 807
УДК 577.27
ПОСЛЕДСТВИЯ СНИЖЕНИЯ ИММУННОЙ
ТОЛЕРАНТНОСТИ ПОД ВОЗДЕЙСТВИЕМ ВЫСОКИХ
ДОЗ D ГАЛАКТОЗЫ ПОХОЖИ НА ВОЗРАСТНЫЕ
ИЗМЕНЕНИЯ ИММУННОЙ СИСТЕМЫ*
© 2019 H.M. Du1,2, Y.J. Wang1, X. Liu1, S.L. Wang2,
S.M. Wu3, Z. Yuan3, X.K. Zhu1**
1 Research Center, Shengjing Hospital of China Medical University, 7 Mulan Road,
Economic Development Zone, Benxi 117000, China; E mail: zhuxk@sj hospital.org
2 Department of Oncology, Shengjing Hospital of China Medical University,
Shenyang 110022, China
3 Department of Blood Transfusion, Shengjing Hospital of China Medical University,
Shenyang 110022, China
Поступила в редакцию 04.12.2018
После доработки 12.02.2019
Принята к публикации 12.02.2019
D галактоза (D Gal) вызывает накопление реактивных форм кислорода и образование полноценных ко
нечных продуктов гликирования, приводящих к окислительному стрессу. D Gal широко используется для
индукции ускоренного старения и в медицинских исследованиях по задержке старения. Несмотря на то, что
эпителиальные клетки тимуса особенно чувствительны к окислительному стрессу, есть несколько исследо
ваний, посвященных изменениям в тимусе у D Gal обработанных мышей. Для изучения влияния D Gal на
тимус грызунов, мы исследовали степень атрофии тимуса и связанное с этим падение относительного ти
мусного индекса (мг/10 г массы тела) у мышей линии C57BL/6J после подкожного введения D Gal в дозах
200, 500 и 1000 мг/кг/день в течение 60 дней. По сравнению с мышами, обработанными 0,9% ной солью, и
с необработанными юными животными, инъекция 500 и 1000 мг D Gal/кг/день приводила к значительной
атрофии тимуса; подкожная инъекция 1000 мг D Gal/кг/день приводила к такой же атрофии тимуса, кото
рая наблюдалась у старых животных в возрасте 18-20 месяцев. У мышей, обработанных D Gal в высоких
дозах, было отмечено старческое изменение иммунной системы, нарушение иммунной толерантности, по
вышение уровня активированных иммунных клеток в селезенке и небольшое хроническое воспаление - ре
зультаты аналогичные тем, что наблюдаются при естественном старении мышей. Результаты проведенного
исследования свидетельствовали о том, что мыши, обработанные D Gal в высоких дозах, могут служить в
качестве модели для изучения индуцированной атрофии тимуса и старческого изменения иммунной системы.
КЛЮЧЕВЫЕ СЛОВА: D галактоза (D Gal), окислительный стресс, старение тимуса, общая иммунная то
лерантность, негативная селекция.
DOI: 10.1134/S0320972519060058
Мировая человеческая популяция стареет; до
дается разнообразными заболеваниями, такими,
ля людей в возрасте >60 лет возросла с 9,2% в 1990 г.
как сердечно сосудистые, инсульт, диабет 2 типа,
до 11,7% в 2013 г и в перспективе увеличится до
рак и другие. Многие исследователи пытались ус
21,1% (>2 млрд) к 2050 г [1]. Старение сопровож
тановить факторы, которые поддерживают здо
ровье в старости и/или защищают организм от
Принятые сокращения: РФК - реактивные формы возрастных заболеваний и дисфункций.
кислорода, TEC - эпителиальные клетки тимуса, tTreg - ре
Результаты многочисленных исследований
гуляторные Т клетки тимуса, MDA - малоновый диальде
гид, SOD - супероксиддисмутаза, RBC - буфер для лизиса
свидетельствовали о том, что реактивные фор
эритроцитов, AIRE - аутоиммунный регулятор, HRP -
мы кислорода (РФК) играют важную роль в
коньюгат пероксидазы хрена, TCR - Т клеточный рецеп
процессе старения
[2-4]. Окислительный
тор, TRA - тканеспецифичный антиген.
стресс, нарушающий сигнальные и контроль
* Первоначально английский вариант рукописи опублико
ные окислительно восстановительные механиз
мы, приводит к старческим болезням, индуци
msu.ru/biokhimiya, в рубрике «Papers in Press», BM 18 334,
29.04.2019.
рует не только прогрессирующее накопление
** Адресат для корреспонденции.
повреждений структуры макромолекул, но так
795
4*
796
DU и др.
же прогрессирующий сдвиг редокс статуса кле
вали, что TEC являются дефицитными в отно
ток, что выражается в снижении функциональ
шении H2O2 редуцирующего фермента - ката
ной эффективности различных клеточных мета
лазы, что предполагает наличие другого меха
болических путей [3]. Окислительно восстано
низма для объяснения ускоренной деградации
вительная теория старения, разработанная на
тимуса [20]. В соответствии с некоторыми наб
основе все возрастающего понимания механиз
людениями, TEC очень чувствительны к пов
мов окислительного стресса [5-7], предполага
реждениям, связанным с аэробным метаболиз
ет, что возрастные изменения в структурах ре
мом; дегенерация TEC протекает быстрее у лю
докс сети наблюдаются при многих заболевани
дей с избыточным весом или устойчивых к леп
ях, включая диабет 2 типа, неалкогольный цир
тину [21]. Более того, Mohammad et al. [16] пока
роз печени, мерцательную аритмию и провоспа
зали, что у мышей, обработанных D Gal, в кор
лительные/фиброзные заболевания [3]. Для
тикальном и мозговом слоях тимуса развивают
постановки экспериментов в рамках этой тео
ся гистологические изменения, сходные с изме
рии и для изучения потенциальных изменений в
нениями, появляющимися при старении.
резистентности организма с возрастом была
Поскольку эпителий тимуса играет ключе
разработана модель D Gal индуцированного
вую роль в удалении клонов аутореактивных
ускоренного старения мышей [8].
Т клеток, постнатальное нарушение гомеостаза
По сравнению с моделью естественного ста
в TEC или естественная возрастная атрофия ти
рения мышей или моделью предрасположен
муса приводят к снижению системной иммун
ности к ускоренному старению мышей (Senes
ной толерантности. Это происходит частично
cence Accelerated Mice Prone, SAMP) [9, 10], мо
путем негативной селекции тимоцитов и образо
дель с D Gal индуцируемым старением является
ванием кластера дифференцировки CD4+ регу
более удобной, дешевой, стабильной и уже ши
ляторных Т клеток тимуса (tTreg) [22]. В свою
роко используемой. При обычных уровнях пот
очередь, нарушение общей иммунной толерант
ребления D Gal для здоровых людей (50 г/день)
ности может приводить к развитию хроническо
[11] она может метаболизировать в организме; бо
го воспаления из за выхода из тимуса аутореак
лее высокое ее количество превращается в спирт
тивных Т клеток, способных инфильтрировать в
галактитол, который может накапливаться в клет
нелимфоидную ткань и индуцировать воспали
ках и приводить к осмотическому стрессу/форми
тельную реакцию. Эти события могут сопровож
рованию РФК [8]. Длительная экспозиция мышей
даться увеличением продукции фактора некроза
с D Gal в упомянутой выше модели приводит к
опухоли (TNF) α и интерлейкина (IL) 6. Этот
неврологическим расстройствам, снижению ак
тип индуцированного хронического воспаления
тивности ферментов антиоксидантной системы,
получил название «inflamm aging» [23, 24].
снижению иммунного ответа, что напоминает
Таким образом, с возрастом атрофия тимуса
признаки течения естественного процесса старе
может сопровождаться хроническим воспале
ния. Поэтому эта модель может быть использова
нием, вызванным снижением системной им
на при изучении старения мозга и в фармакологи
мунной толерантности. Хотя D Gal может инду
ческих исследованиях при поиске лекарств для за
цировать эту атрофию и влиять на иммунную
держки старения [8], при изучении старения тка
толерантность организма путем, который ка
ней сердца [12], печени [13], почек [14] и кожи [15].
жется похожим на процесс естественного старе
На сегодняшний день существует лишь несколько
ния, экспериментально это пока еще не было
сообщений об изменениях в иммунной системе,
подтверждено. В представленном исследовании
индуцированных D Gal у стареющих организмов,
была изучена взаимосвязь между атрофией ти
в частности, у мышей [16, 17].
муса и окислительным стрессом, индуцирован
Старение затрагивает все ткани и органы ор
ным введением D Gal. Кроме того, влияние D Gal
ганизма, но тимус является особым органом,
на общую толерантность иммунной системы ор
поскольку он претерпевает возрастную дегене
ганизма была оценена, чтобы установить, могут
рацию, начиная с наступления периода половой
ли мыши, обработанные D Gal, служить в ка
зрелости [18]. Однако важным является также
честве адекватной модели для изучения атрофии
то, что тимус постепенно атрофируется с воз
тимуса и эффектов старения.
растом при критическом снижении уровня по
ловых гормонов [19]. Действительно, эпители
альные клетки тимуса (TEC) могут быть особен
МЕТОДЫ ИССЛЕДОВАНИЯ
но чувствительными к повреждению, индуци
рованному воспалением, а также рядом повреж
Животные и лечение. Мышей линии C57BL/6
дающих молекул, таких как РФК [20]. Прове
(самки [25] массой 19-21 г в возрасте 6 недель)
денные недавно исследования продемонстриро
(«Huafukang Bioscience Co.», Китай) содержали
БИОХИМИЯ том 84 вып. 6 2019
D ГАЛАКТОЗА СНИЖАЕТ ОБЩУЮ ИММУННУЮ ТОЛЕРАНТНОСТЬ
797
в стерильных условиях в Экспериментальном ис
ванные кроличьи антитела против мышиных
следовательском центре Госпиталя в г. Шенгд
маркеров клеточной поверхности («Biolegend»,
жинг. Мышам был обеспечен доступ ad libitum к
США). Они включали в себя: флуоресцеинизо
стандартной еде для грызунов и фильтрованной
тиоционат (FITC) анти CD4 (клон GK1.5;
воде, они содержались в условиях нормального
коньюгат использовался в зависимости от спе
цикла день/ночь = 12/12 ч при 22 °С и 50% ной
цифики эксперимента), FITC анти CD8 (клон
влажности. После двух недель адаптации мы
536.7), фикоэритрин (PE) анти CD28 (клон
шей в возрасте 2 месяца разделили на пять групп
37.51), алекса флуор (AF) 647 анти CD44 (клон
по 16 особей в каждой (n = 16): мышам первой
IM7), PE анти Ki67 (клон 16A8), аллофикоциа
группы ежедневно вводили подкожно (в тече
нин (APC) анти TNFα (клон MP6 XT22), PE
ние 60 дней) по 0,1 мл изотонического солевого
анти CD25 (клон PC61), PE анти CD3 (клон
раствора (NS; n = 16); мышам следующих трех
17A2) и AF 647 анти Foxp3 (клон 150D). Пер
групп ежедневно вводили подкожно (в течение
вичные кроличьи антитела («Proteintech», США)
60 дней) по 0,1 мл раствора D Gal (свежеприго
были куплены для использования при анализе
товленного на NS каждую неделю) в дозах 200,
методом вестерн блоттинга, они включали в се
500 или 1000 мг/кг/день (n = 16 в каждой груп
бя антитела против аутоиммунного регулятора
пе); одновременно, группу из 16 необработан
(AIRE) (поликлональные, 22517 1 AP) и против
ных мышей в возрасте 2 месяца использовали
глицеральдегид 3 фосфатдегидрогеназы (GAPDH)
как контрольных «юных», ничем не обработан
(моноклональные, 60004 1 Ig). Коньюгат пе
ных животных (Con; n = 16). Старые самки в
роксидазы хрена (HRP) с козьими анти кро
возрасте 16-18 месяцев (n = 16) были закуплены
личьими IgG использовали в качестве вторич
в Нанкинском медицинском университете, их
ных антител.
ничем не обрабатывали и использовали, как
Проточная цитометрия. После вскрытия каж
контроль из «очень старых» животных (Aged).
дый тимус и каждую селезенку от различных
В день после последней обработки NS обрабо
мышей разрезали на две части и использовали,
танные контрольные, все D Gal обработанные
как описано ниже. Для получения клеточной
(уже в возрасте 4 месяца), «юные» необработан
суспензии из образцов каждой селезенки и ти
ные контрольные (уже в возрасте 4 месяца) и
муса, использовали сетчатый фильтр (∅ 70 мкм).
«очень старые» необработанные контрольные
Клетки крови в присутствии антикоагулянта
(теперь в возрасте 18-20 месяцев) мыши были
ЭДТА и клетки селезенки очищали от эритро
усыплены путем внутрибрюшинной инъекции
цитов с использованием лизирующего буфера
пентабарбитала. Кровь забирали из сердца, сы
RBC и промывали клеточный осадок буфером
воротку из каждого образца получали центри
для окрашивания. После определения концент
фугированием при 3000 об/мин в течение 15 мин
рации клеток с помощью гемоцитометра, алик
при 4 °С в системе Micro 2R («Thermo Scien
воты из каждого образца, содержащие по 106 кле
tific», Германия), и далее хранили при -80 °С.
ток, окрашивали индивидуальными специфи
Сразу после этого тимус и селезенку у каждой
ческими антителами против заданных маркеров
мыши вырезали, взвешивали и обрабатывали,
CD поверхности клеток (на льду в темноте в те
как указано ниже.
чение 20 мин c использованием рекомендован
Реагенты и антитела. В работе использовали
ного производителем количества антител). Па
следующие реактивы: D Gal («Sigma», Герма
раллельные аликвоты (по 106 клеток) фиксиро
ния); малоновый диальдегид (MDA) и набор для
вали и пермеабилизовали 75% ным этанолом в
определения супероксиддисмутазы (SOD) пре
течение 1 ч и затем подвергали внутриклеточно
доставил Нанкинский институт биоинженерии
му окрашиванию с помощью антител к Ki 67 (на
им. Цзяньчэна (Китай); набор для определения
льду, в темноте, в течение 30 мин с использова
IL 6 мышей методом ИФА («BD Biosciences»,
нием рекомендованного количества антител).
США); буфер для лизиса эритроцитов (RBC),
Оставшиеся образцы клеток также фиксирова
набор для определения белка бицинхониновым
ли, пермеабилизовали с использованием буфера
методом, реактивы для Ds Na ПААГ электро
для истинного ядерного фактора транскрипции
фореза («Beyotime», Китай); среда для получе
и проводили внутриклеточное окрашивание с
ния лимфоцитов 1Х мыши («Dakewe Biosciences»,
помощью антител к Foxp3 (процедура аналогич
Китай); коктейль для активации клеток, содер
на окрашиванию Ki 67).
жащий антибиотик брефельдин А (2,5 мг/мл) и
Для окраски клеток TNFα половину каждой
буфер для истинного ядерного фактора транскрип
селезенки помещали в 5 мл среды для сепарации
ции (True NuclearTranscription Factor), («Biolegend»,
лимфоцитов мыши (1,081 г/мл) и продавливали
США). Для проточных цитометрических анали
через сетчатый фильтр (∅ 70 мкм). Полученную
зов были приобретены флуорохром конъюгиро
клеточную суспензию немедленно помещали в
БИОХИМИЯ том 84 вып. 6 2019
798
DU и др.
центрифужные пробирки объемом 15 мл и осто
пературе. После тщательной промывки каждую
рожно наслаивали бессывороточную среду
мембрану инкубировали с первичными антите
RPMI 1640. Образцы центрифугировали при 800 g
лами (разведении 1 : 2000) в течении ночи при
в течение 30 мин при 4 °С и собирали суперна
4 °С. После тщательной промывки буфером
тант, содержащий лимфоциты. После промывки
TBST мембраны инкубировали со вторичными
клеток фосфатным буфером, лимфоциты сус
антителами, коньюгированными с HRP (разве
пендировали в коктейле для активации клеток,
дение 1 : 40 000) в течение 2 ч при комнатной
содержащем 2,5 мг/мл брефелдина А, подсчи
температуре. Во всех случаях в качестве внут
тывали на гемоцитометре, и аликвоты (по 106
реннего контроля была использована GAPDH.
клеток) инкубировали в течение 6 ч при 37 °С в
После повторной отмывки буфером TBST мем
атмосфере 5% CO2. Затем образцы клеток соби
браны обрабатывали реагентом для хемолюми
рали, промывали при центрифугировании буфе
несцентного анализа («Thermo Scientific», США)
ром PBS и окрашивали с помощью анти CD3
и оценивали результаты анализа в системе для
или анти CD8 антител (на льду в темноте, в те
получения изображения C300 («Azure», США);
чение 20 мин с использованием рекомендован
результаты обрабатывали с использованием
ного количества антител). Затем клетки осажда
программы Image J (Национальный институт
ли, фиксировали 2% ным параформальдегидом,
ментального здоровья, Вашингтон, D.C.).
пермеабилизовали 0,1% (v/v) Triton Х 100 и ок
Статистический анализ. Данные для каждого
рашивали анти TNFα антителами (на льду, в
параметра из каждой группы были представле
темноте, в течение 30 мин с рекомендованным
ны как средние значения ± SD. Анализ разли
количеством антител).
чий между группами D Gal обработанных и
Для каждого описанного выше случая окра
контрольных животных выполняли с использо
шивания клеток выполняли процедуру проточ
ванием однонаправленного дисперсионного
ной цитофлуорометрии с использованием FACS
анализа (ANOVA). Различия считали значимы
calibur («BD Biosciences», США). Все получен
ми при p < 0,05. Все полученные данные анали
ные данные анализировали с использованием
зировали с использованием программы Prism v.5.0
прилагаемой к прибору программы FlowJo. Ми
(«GraphPad», США).
нимальное количество событий на один образец
составляло 10000.
Биохимический анализ сыворотки SOD и МDА.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Активность SOD и количество MDA в сыворот
ке крови определяли спектрофотометрически с
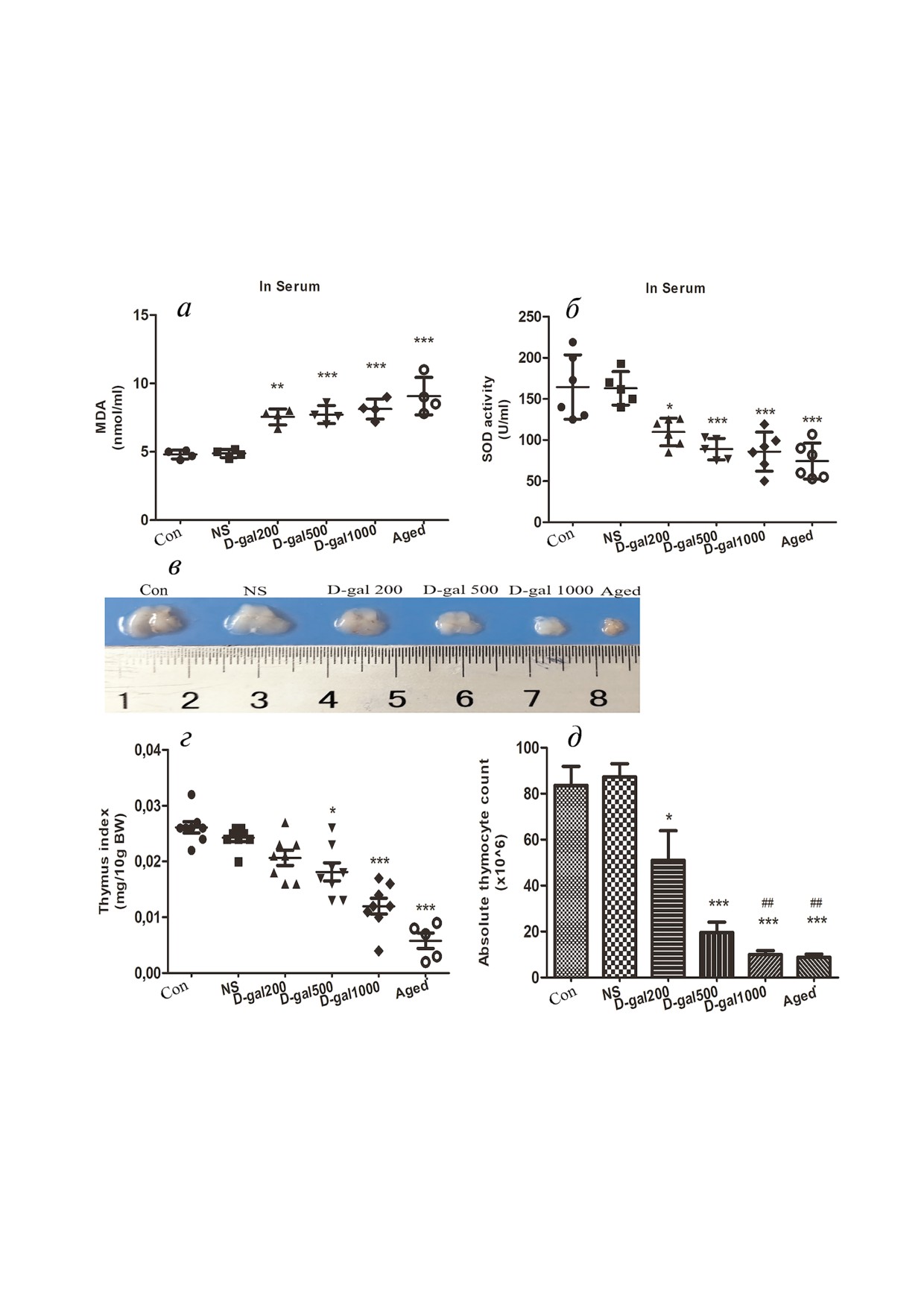
D Gal вызывает окислительный стресс и атро
помощью коммерческих наборов. Поглощение
фию тимуса у мышей, сходные с тем, что имеют мес
определяли с использованием ридера для микро
то при старении. Для оценки уровня окислитель
планшетов Synergy H1 («BioTek», США). Уровни
ного стресса и атрофии тимуса при подкожной
IL 6 в сыворотке определяли методом иммуно
инъекции D Gal мы определяли активность SOD
ферментного анализа с использованием соответ
и содержание MDA в сыворотке мышей четырех
ствующего набора ELISA kit («BD Biosciences»,
групп (см. «Методы исследования»), а также изме
США) в соответствии с прилагаемой инструк
ряли тимусы и рассчитывали тимусные индексы у
цией. Чувствительности метода
3,8 пг/мл.
D Gal обработанных и контрольных животных.
Вестерн блот анализ. Для проведения вес
Для предварительного анализа были использова
терн блоттинга общий белок каждой из остав
ны невысокие дозы D Gal: 50 и 200 мг/кг/день.
шихся неиспользованными частей тимуса был
Несмотря на то, что при обработке животных
экстрагирован с использованием буфера для ра
D Gal в любой из этих доз содержание MDA в сы
диоиммунопреципитации (RIPA) (1 мл буфера
воротке несколько повышалось, а активность
на 100 мг ткани); («Beyotime», Китай) в соответ
SOD снижалась (данные не приводятся), сущест
ствии с инструкцией производителя. Общую
венной атрофии тимуса при этом не происходило.
концентрацию белка определяли бицинхонино
Поэтому в дальнейшем мы вводили мышам D Gal
вым методом с помощью соответствующего на
в дозах 200, 500 или 1000 мг/кг/день. Как показано
бора; аликвоты (по 30 мкг белка) фракциониро
на рис. 1, а и б, уровни MDA были значительно по
вали методом Ds Na ПААГ электрофореза.
вышены, а активности SOD понижены в крови у
После проведения электрофореза белки перено
животных в возрасте 4 месяца, обработанных D Gal,
сили на поливинилидендифторидные (PVDF)
по сравнению с контрольными, обработанными
мембраны («Millipore», США). Мембраны бло
лишь солью (NS), или ничем не обработанными
кировали 5% ным обезжиренным молоком в
«юными» мышами (Con) в том же возрасте. При
Tris буфере, содержащем 0,1% (v/v) Tween 20
инъекции D Gal в двух наивысших дозах (500 и
(TBST, pH 7,5) в течение 2 ч при комнатной тем
1000 мг/кг/день) уровни активности SOD достига
БИОХИМИЯ том 84 вып. 6 2019
D ГАЛАКТОЗА СНИЖАЕТ ОБЩУЮ ИММУННУЮ ТОЛЕРАНТНОСТЬ
799
ли активностей в контрольной группе, состоящей
чем, в дозе 1000 мг/кг/день воздействие было бо
из старых (18-20 месяцев) не обработанных мы
лее сильным. Соответственно, относительные ти
шей (Aged); концентрации MDA при всех трех тес
мусные индексы (вес тимуса, мг/10 г массы тела)
тируемых дозах D Gal достигали того же уровня,
(рис. 1, г) и абсолютные количества тимоцитов
как и в контроле Aged. Что касается атрофии ти
(рис. 1, д) снижались в максимальной степени в
муса, то инъекция D Gal в двух наивысших дозах
группе мышей, обработанных D Gal в наивыс
оказывала значительный эффект (рис. 1, в), при
шей дозе.
Рис. 1. Окислительный стресс и атрофия тимуса, индуцированные инъекцией D Gal (ежедневно, 60 дней) у мышей
линии C57/BL6. а - Содержание MDA в сыворотке мышей в возрасте 4 месяца, обработанных D Gal (200, 500,
1000 мг/кг/день), «юных» необработанных мышей (4 месяца, Con), мышей в возрасте 4 месяца, обработанных 0,9% NaCl
(NS) и старых (18-20 месяцев) мышей. б - Активность SOD в сыворотке мышей различных групп. в - Типичные виды ти
муса. г - Тимусные индексы. д - Абсолютное количество тимоцитов. (Здесь и далее: *p < 0,05, **p < 0,001, ***p < 0,0001
относительно Con и NS; ##p < 0,001 относительно 200 мг D Gal/кг/день).
biokhsm/
БИОХИМИЯ том 84 вып. 6 2019
800
DU и др.
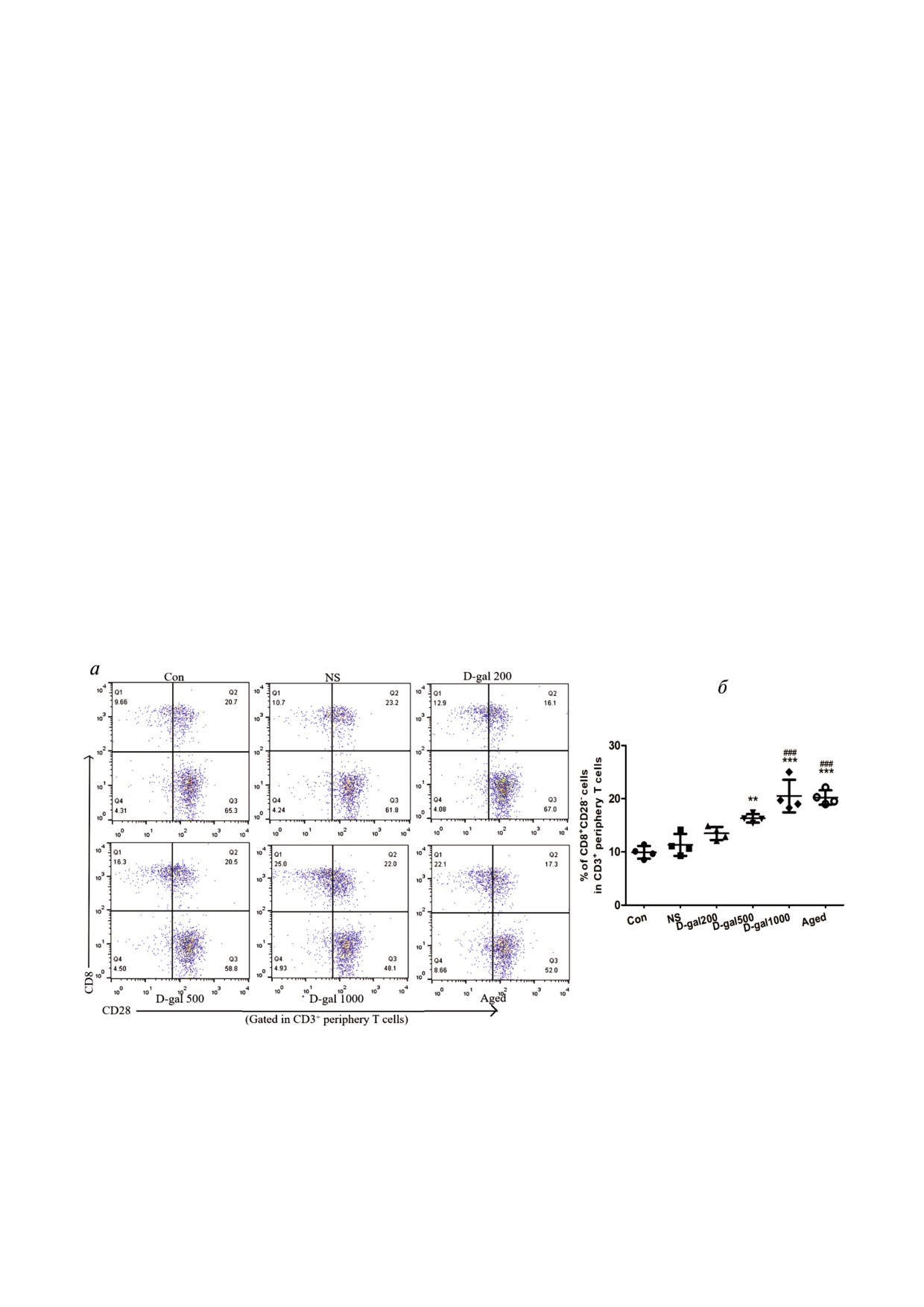
Старение иммунной системы, индуцирован
Увеличение активированных иммунных клеток
ное D Gal, похоже на то, что имеет место при ес
и небольшое хроническое воспаление у D Gal об
тественном старении. Признаком старческих
работанных и естественно стареющих мышей.
изменений иммунной системы является на
Сниженные уровни мигрирующих из тимуса
копление высоко дифференцированных Т кле
клеток (recent thymic emigrants, RTE); высокая доля
ток CD8+, несущих на своей поверхности бел
Т клеток CD44hi (отражает количество Т кле
ковый антиген CD8, но лишенных антигена
ток, контактирующих с собственными антиге
CD28, одной из молекул, необходимых для ре
нами); наличие Т клеток Ki67+ (клетки RTE с
цептор опосредованной активации Т клеток.
повышенной пролиферативной способностью);
Накопление этих Т клеток, называемых
присутствие клеток CD4+/CD8+ RTE (клетки из
CD8+CD28- («дряхлеющие клетки») связано с
атрофированного тимуса с активированным им
высоким уровнем воспаления и повышенным
мунным фенотипом, являющиеся потенциаль
риском старческих заболеваний и смерти. Ме
но аутореактивными) - все это может отражать
тодом проточной цитофлуорометрии мы уста
изменения in situ, приводящие к снижению им
новили, что у «очень старых» (18-20 месяцев)
мунитета. Мы установили, что под действием
мышей в крови сильно повышено процентное
D Gal в высоких дозах у мышей наблюдалось
содержание «дряхлеющих клеток» по сравне
повышение уровня активированных Т клеток:
нию с контрольными «юными» (4 месяца) жи
CD4+CD44hiKi67+ и CD8+CD44hiKi67+ (рис. 3, а-г).
вотными (рис. 2, а и б). Уровни содержания
Такое же высокое содержание этих Т клеток
этих клеток положительно регулировались в
наблюдалось у животных, состарившихся есте
крови мышей, обработанных D Gal в дозах 500
ственным путем.
или 1000 мг/кг/день, по сравнению с контроль
Для ответа на вопрос: обусловлены ли какие
ными, обработанными солью или необрабо
либо изменения в системной воспалительной
танными «юными» животными. Полученные
реакции у мышей действием D Gal или самим
нами данные означали, что обработка мышей
старением - мы оценили уровни цитокина вос
D Gal в высоких дозах индуцирует такие же из
паления IL 6 в сыворотке, а также доли среди
менения в их иммунной системе, которые наб
спленоцитов Т клеток CD4+, содержащих TNFα.
людаются при естественном старении.
Было установлено, что уровни IL 6 в сыворотке
Рис. 2. Старческие изменения иммунной системы, индуцированные введением D Gal (ежедневно, 60 дней), у мышей ли
нии C57/BL6. а - Типичные точковые диаграммы иммунофлуоресценции клеток CD3+CD8+CD28- (левые верхние квад
ранты) на общем фоне иммунофлуоресценции фракции всех периферических Т клеток CD3+ в образцах крови, получен
ных от D Gal обработанных и контрольных животных. б - Процентное содержание клеток CD8+CD28- во фракциях пе
риферических Т клеток CD3+.
biokhsm/
БИОХИМИЯ том 84 вып. 6 2019
D ГАЛАКТОЗА СНИЖАЕТ ОБЩУЮ ИММУННУЮ ТОЛЕРАНТНОСТЬ
801
Рис. 3. Активированные иммунные клетки и хроническое воспаление низкой степени, индуцированное ежедневным вве
дением D Gal (60 days) у мышей линии C57/BL6. а - Типичные точковые диаграммы иммунофлуоресценции клеток
CD44hiKi67+ (правый верхний квадрант) на общем фоне иммунофлуоресценции периферических Т клеток CD4+ (сплено
циты), полученных от D Gal обработанных и контрольных животных. б - Типичные точковые диаграммы иммунофлуо
ресценции клеток CD44hiKi67+ (правый верхний квадрант) на общем фоне флуоресценции периферических Т клеток
CD8+ (спленоциты), полученных от D Gal обработанных и контрольных животных. в и г - Процентное содержание кле
ток CD44hiKi67+ во фракциях периферических Т клеток CD4+ и CD8+. д - Концентрация интерлейкина IL 6 в сыворотке.
е - Типичные точковые диаграммы иммунофлуоресценции клеток TNFα+ на общем фоне флуоресценции периферичес
ких Т клеток CD4+ (спленоциты). (Примечание. В процессе TNFα активации коктейль для активации клеток может от
рицательно регулировать экспрессию антигена CD4, поэтому в этом исследовании мы использовали подмножество Т кле
ток CD3+CD8- как представителя субпопуляции клеток CD4+). ж - Процентное содержание клеток CD4+TNFα+ во
фракциях Т клеток CD4+.
biokhsm/
БИОХИМИЯ том 84 вып. 6 2019
802
DU и др.
были повышены как у мышей, обработанных
sue restricted antigens; TRA (TSA, которые синте
D Gal (в зависимости от введенной дозы D Gal),
зируются не в периферических клетках, а в ти
так и у контрольных состарившихся животных
мусе)) для того, чтобы развились тимоциты,
(рис. 3, д). Доли клеток CD4+ TNFα+ среди Т лим
способствующие делеции клонов Т клеток, ре
фоцитов селезенки также значительно возраста
активных по отношению к собственным антиге
ли у мышей, обработанных D Gal в дозе 500 или
нам. AIRE является фактором транскрипции,
1000 мг/кг/день, и у состарившихся необрабо
экспрессируемым эпителиальными клетками
танных животных, по сравнению с контрольны
мозгового слоя тимуса (mTEC) в целях стимуля
ми образцами клеток селезенки, полученными
ции эктопической экспрессии TRA; подмноже
от «юных» мышей, которым вводили солевой
ство клеток mTEC, экспрессирующих фактор
раствор, и от необработанных «юных» живот
AIRE, является ключевым для негативной се
ных (рис. 3, е и ж). Таким образом, уровни ци
лекции клонов аутореактивных Т клеток. В сво
токинов воспаления в сыворотке и спленоцитах
ем исследовании мы наблюдали снижение нега
мышей, обработанных D Gal в высоких дозах,
тивной селекции в тимусе мышей, получавших
были такими же, как и у необработанных старых
большие дозы D Gal (смотри выше), и, как
животных.
представляется, это снижение может быть час
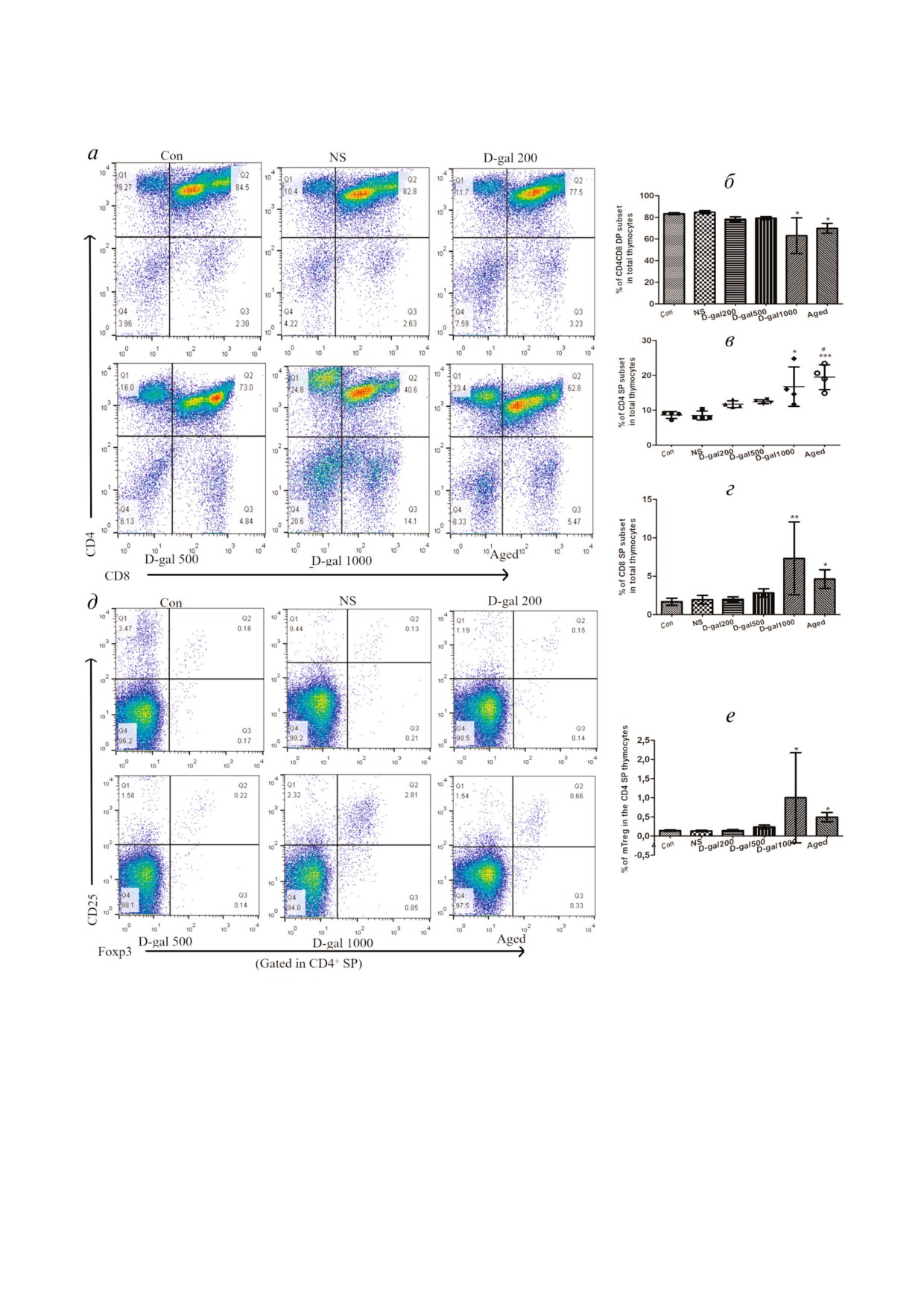
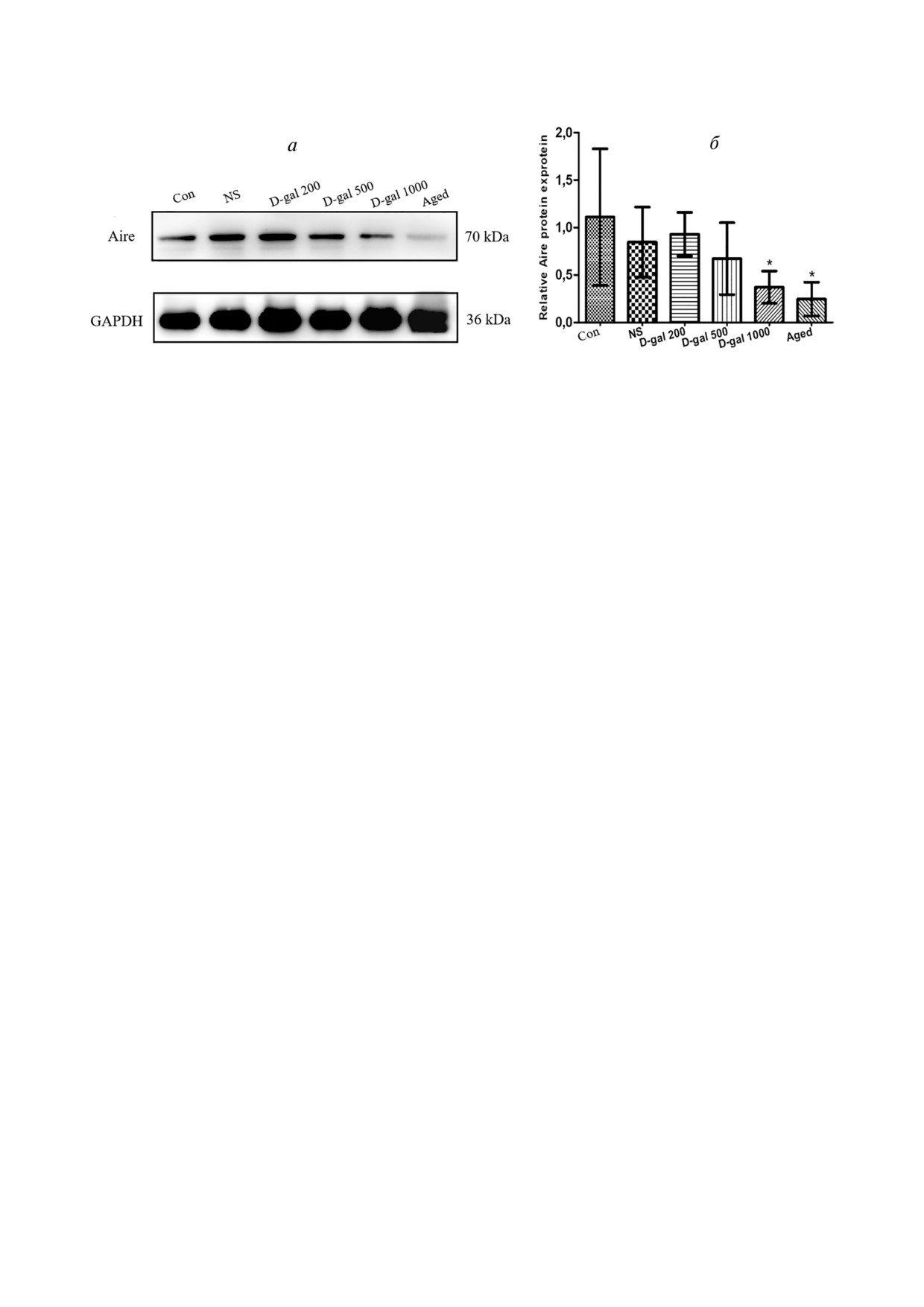
D Gal обработанные мыши показывают нару
тично обусловлено дефицитом фактора AIRE
шенное клональное удаление single positive тимо
(рис. 5, а и б). Относительная экспрессия AIRE в
цитов (SP), приводящее к дефектам и негативной
клетках тимуса обработанных D Gal мышей на
селекции, что сходно с теми процессами, которые
ходилась на том же уровне, что и у состаривших
имеют место при старении мышей. Нами была
ся естественным образом животных (хотя кар
оценена способность тимуса, атрофирующегося
тина вестерн блоттинга, кажется, свидетель
в результате воздействия D Gal, осуществлять
ствовала о более низком уровне экспрессии этого
негативную селекцию клонов моно позитивных
фактора у необработанных старых мышей). В лю
(single positive, SP) и ди позитивных (double po
бом случае, все эти значения были существенно
sitive, DP) Т лимфоцитов. Было установлено,
понижены у обработанных D Gal в высокой до
что доля тимоцитов CD4CD8 DP (CD4+CD8+)
зе и у старых животных по сравнению с «юны
была достоверно снижена в тимусах, получен
ми» (Con), обработанными раствором соли (NS)
ных от мышей, обработанных 1000 мг/кг/день
или D Gal в низких дозах.
D Gal, и от старых мышей, в сравнении с тиму
сами, полученными от «юных» мышей, и мышей,
обработанных D Gal в меньших дозах (рис. 4, а
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
и б). Напротив, доли CD4 SP (CD4+CD8-) или
CD8 SP (CD4-CD8+) субпопуляций тимоцитов
В представленном исследовании была изуче
были повышены в атрофирующих тимусах мы
на степень атрофии тимуса животных с исполь
шей, обработанных 1000 мг/кг/день D Gal и в
зованием в качестве модели мышей, ускоренное
тимусах старых животных (рис. 4, а, в и г). Это
старение которых было индуцировано D Gal.
означало, что атрофированный тимус не столь
Мы установили, что при ежедневной инъекции
эффективно выполняет делецию (негативную
мышам D Gal по 500 или 1000 мг/кг/день, в те
селекцию) SP клонов.
чение 60 дней наблюдалась значительная атро
Ухудшение негативной селекции не связано
фия тимуса, в той же степени, как и у старых
с дефицитом клеток tTreg в тимусе. Действитель
мышей в возрасте 18-20 месяцев. В соответ
но, доли этих клеток в составе субпопуляции
ствии с нашими наблюдениями у таких живот
CD4 SP даже возрастала в тимусах старых мышей
ных происходило снижение тимусного индекса,
и мышей, обработанных 1000 мг D Gal/кг/день
количества тимоцитов и прогрессирующее стар
по сравнению с содержанием этих клеток у жи
ческое изменение иммунной системы. Из за ат
вотных двух контрольных групп (рис. 4, д и е).
рофии тимуса у обработанных D Gal молодых и
Это означало, что мыши, обработанные D Gal,
у старых животных наблюдалось снижение не
также, как и старые мыши, имеющие ослаблен
гативной селекции клонов потенциально ауто
ную иммунную толерантность и нарушенную
реактивных клеток и повышение количества ак
негативную селекцию, были сбалансированы
тивированных иммунных клеток, а также разви
благодаря увеличению уровня тимусных регуля
тие хронического воспаления.
торных Т клеток (tTreg).
D Gal является редуцирующим моносахари
Снижение AIRE в mTEC D Gal обработанных
дом, который метаболизирует под действием
мышей напоминает процесс старения. Для индук
D галактокиназы или галактозо 1 фосфатури
ции иммунной толерантности в тимусе необхо
дилтрансферазы при обычной физиологической
димо участие тканеспецифичных антигенов (tis
концентрации в организме. Любой избыток
БИОХИМИЯ том 84 вып. 6 2019
D ГАЛАКТОЗА СНИЖАЕТ ОБЩУЮ ИММУННУЮ ТОЛЕРАНТНОСТЬ
803
Рис. 4. Влияние D Gal (ежедневно, 60 дней) на общую иммунную толерантность у мышей. а - Типичные точковые диа
граммы иммунофлуоресценции популяций клеток CD4CD8 DP (CD4+CD8+, правый верхний квадрант), CD4 SP (CD4+CD8-,
левый верхний квадрант) и CD8 SP (CD4-CD8+, правый нижний квадрант) среди всей популяции тимоцитов мышей.
б-г - Процентное содержание клеток CD4CD8 DP, CD4 SP и CD8 SP в общих фракциях тимоцитов. д - Типичные точ
ковые диаграммы иммунофлуоресценции клеток CD25+Foxp3+ на фоне общей флуоресценции тимоцитов CD4 SP. е - Про
центное содержание регулирующих клеток CD4+CD25+Foxp3+ (mTreg) во фракциях тимоцитов CD4 SP. *p < 0,05, **p < 0,001
и ***p < 0,0001 относительно Con и NS; #p < 0,05 относительно 200 и 500 мг D Gal/кг/день. DP - ди позитивные, SP -
моно позитивные.
biokhsm/
БИОХИМИЯ том 84 вып. 6 2019
804
DU и др.
Рис. 5. Влияние D Gal на экспрессию фактора Aire в тимусе. а - Типичная картина вестерн блоттинга экстракта из тимуса,
демонстрирующая экспрессию Aire и GAPDH. б - Относительные уровни экспрессии Aire у мышей, обработанных D Gal,
и у контрольных животных. * p < 0,05 относительно Con, NS и 200 мг D Gal/кг/день
D Gal превращается в спирт галактитол, накоп
факторов, включая гормоны, лекарства на основе
ление которого в клетках может индуцировать
глюкокортикоидов, хемо /радиотерапию и/или
осмотический стресс и продукцию РФК [8].
окислительный стресс [28]. В отличие от естест
Также D Gal реагирует со свободными амино
венных факторов, глюкокортикоиды и лекар
группами аминокислот с образованием полно
ственная терапия воздействуют на развивающи
ценных конечных продуктов гликирования
еся Т клетки [22, 29] и оказывают воздействие
(advanced glycation end products; AGE), стимули
на TEC опосредованным образом, благодаря
рующих продукцию свободных радикалов (со
снижению перекрестного влияния, например,
бытия, связанные со старением и старческими
CD40 и/или RANK стимулов. Напротив, окис
заболеваниями) [26]. Накопление РФК и фор
лительный стресс мог влиять на TEC непосред
мирование AGE приводят, в конечном счете, к
ственно [20] и приводить к острой или хрони
окислительному стрессу. В настоящее время об
ческой атрофии тимуса с возрастом; этим мож
щепризнаны два главных последствия окисли
но объяснить, почему атрофия тимуса с возрас
тельного стресса: во первых, повреждения мак
том продолжалась даже когда уровень половых
ромолекул и, во вторых, разрушение окисли
гормонов заметно снижался [19].
тельно восстановительных сигнальных и конт
Строение сформировавшегося тимуса отра
рольных механизмов, что приводит к развитию
жает условия специализации внутритимусного
связанных с возрастом заболеваний [3]. «Ре
микроокружения, которое обеспечивает процесс
докс» теория старения подразумевает, что разви
созревания Т клеток [22]. В корковом слое тиму
тие организмов в богатой кислородом среде по
са трехмерная сеть взаимодействующих эпите
рождает возникновение ключевых окислитель
лиальных клеток (cTEC) делает возможным осу
но восстановительных взаимодействий между
ществлять множественные взаимосвязи с незре
организмом и окружающей средой. По сравне
лыми CD4-CD8- (ди негативными, DN) и
нию с постоянным прижизненным контактом с
CD4+CD8+ (ди позитивными, DP) тимоцитами.
кислородом в период роста/старения, эпизоди
В мозговом слое тимуса субпопуляция mTEC
ческая, относительно кратковременная (в тече
взаимодействует с более зрелыми клеточными
ние 60 дней) экспозиция животных с D Gal мо
субпопуляциями, такими как CD4+/CD8- (мо
жет значительно ускорить процесс старения.
но позитивные, SP) и регуляторные Т клетки
Многие исследователи показали, что обрабо
CD4+Foxp3+ (mTreg). Кортикальные DP тимоци
танные D Gal животные (мыши) демонстриру
ты, регулируемые под воздействием сигнала от
ют такую же степень старения, как и контроль
Т клеточного рецептора (TCR) в ответ на
ные в возрасте 16-20 месяцев [16, 27]. Эта мо
собственные пептиды организма, представлены
дель ускоренного старения под действием D Gal
главным комплексом гистосовместимости (MHC)
уже продемонстрировала, что способна надежно
и могут претерпевать позитивную селекцию,
имитировать процесс естественного старения
приводящую к их созреванию по пути клеток
животных.
CD4 или CD8 [30]. Только что претерпевшие се
Прогрессирующая с возрастом атрофия (ин
лекцию тимоциты SP еще не являются пол
волюция) тимуса является одной из характер
ностью зрелыми и не способны начинать проли
ных черт процесса старения. Эта атрофия может
ферацию по сигналу TCR [31]. Такая задержка в
быть объяснена участием нескольких ключевых
приобретении функциональных свойств компе
БИОХИМИЯ том 84 вып. 6 2019
D ГАЛАКТОЗА СНИЖАЕТ ОБЩУЮ ИММУННУЮ ТОЛЕРАНТНОСТЬ
805
тентных клеток позволяет запускать в этих не
путем увеличения количества клеток tTreg для
полностью зрелых клетках апоптоз под действи
поддержания общей толерантности Т клеток;
ем сигнала от TCR, то есть выполнять негатив
нарушение этого баланса может приводить к по
ную селекцию и элиминацию аутореактивных
явлению возрастных заболеваний.
тимоцитов из всего созревающего клеточного
ассортимента [32]. Так происходит развитие им
Таким образом, представленное исследова
мунотолерантности к собственным антигенам.
ние продемонстрировало, что атрофия тимуса у
AIRE является фактором транскрипции, ко
мышей может быть индуцирована повторным
торый экспрессируется клетками mTEC и спо
введением (ежедневно, в течение 60 дней) D Gal
собствует эктопической экспрессии тканеспе
в высокой дозе, и что это связано, главным об
цифичных антигенов (TRA) [33, 34]. Особые
разом, с окислительным стрессом. Введение D Gal
субпопуляции mTEC, экспрессирующие AIRE и
не только имитировало, но, по видимому, уси
способные к презентации TRA, чрезвычайно
ливало процессы естественного старения в орга
важны для негативной селекции. Мыши с дефи
низме животного. Следствием D Gal обработки
цитом AIRE демонстрируют пониженную экспрес
явилось снижение системной иммунной толерант
сию TRA, аутоиммунный фенотип, продуциру
ности, выразившееся в нарушении негативной
ют аутоиммунные антитела, характеризуются
селекции, повышении уровней активированных
инфильтрацией воспалительных клеток в раз
иммунных клеток в селезенке и в индукции вос
личные ткани, особенно в поджелудочную же
палительного процесса, то же происходит и во
лезу и слезные железы [35, 36]. В принципе,
время естественного старения. Трудно сказать,
AIRE может предотвращать аутоиммунизацию,
явилось ли старение причиной атрофии тимуса
поддерживая как рецессивный, так и доминант
или наоборот. В настоящее время ясно, что ка
ный механизмы иммунотолерантности, стиму
кая либо задержка атрофии тимуса или увеличе
лируя удаление тимоцитов, реактивных по от
ние содержания антиоксидантов в организме
ношению к случайно экспрессирующимся TRA
животного, может явиться эффективной контр
или путем индукции дифференцировки таких
мерой против старческих воспалительных про
тимоцитов в клетки типа tTreg [34].
цессов и способом отсрочить будущие возраст
Мы предположили, что атрофия тимуса у
ные изменения иммунной системы.
мышей при естественном старении или при ус
коренном старении, вызванном D Gal, может
Финансирование. Эта работа была поддержа
также сопровождаться снижением общей им
на Национальным фондом по естественным на
мунной толерантности у организма. Фактичес
укам (грант № 81270430).
ки, ослабление системной иммунной толерант
Благодарности. Авторы выражают свою бла
ности, обусловленное дефектом негативной се
годарность международному научному редактору
лекции, наблюдалось при обоих случаях старе
ния и, по видимому, было частично связано с
internationalscienceediting.com).
дефицитом фактора AIRE. В своем исследова
Конфликт интересов. Авторы констатируют
нии мы установили, что атрофия тимуса пози
отсутствие конфликта интересов. Авторы сами
тивно связана с генерацией клеток tTreg. Как по
отвечают за содержание рукописи.
казали Oh et al. [37], повышение количества пе
Соблюдение этических норм. Со всеми жи
риферических Treg клеток у старых мышей не
вотными обращались гуманно, как было одоб
приводит к их обратному транспорту в старею
рено Экспериментальным центром животных
щий тимус для усиления ингибирования генера
Китайского медицинского университета в соот
ции новых клеток tTreg. На основании этого мы
ветствии с рекомендациями Руководства по ухо
заключили, что атрофированный тимус может
ду и использованию лабораторных животных
пытаться сбалансировать негативную селекцию
Национального института здоровья.
СПИСОК ЛИТЕРАТУРЫ
1.
Sander, M., Oxlund, B., Jespersen, A., Krasnik, A.,
3.
Go, Y., and Jones, D. (2017) Redox theory of aging:
Mortensen, E., Westendorp, R., and Rasmussen, L. (2015)
Implications for health and disease, Clin. Sci., 131,
The challenges of human population ageing, Age Ageing,
1669-1688, doi: 10.1042/CS20160897.
44, 185-187, doi: 10.1093/ageing/afu189.
4.
Guzik, T., and Cosentino, F. (2018) Epigenetics and
2.
Martinez de Toda, I., and De la Fuente, M. (2015) The
immunometabolism in diabetes and aging, Antioxid. Redox
role of Hsp70 in oxi inflamm aging and its use as a poten
Signal., 29, 257-274, doi: 10.1089/ars.2017.7299.
tial biomarker of lifespan, Biogerontology, 16, 709-721,
5.
Jones, D., and Sies, H. (2015) The redox code, Antioxid.
doi: 10.1007/s10522 015 9607 7.
Redox Signal., 23, 734-746, doi: 10.1089/ars.2015.6247.
БИОХИМИЯ том 84 вып. 6 2019
806
DU и др.
6.
Jones, D. (2016) Hydrogen peroxide and central redox the
22.
Abramson, J., and Anderson, G. (2017) Thymic epithelial
ory for aerobic life: a tribute to Helmut Sies: scout, trail
cells, Annu. Rev. Immunol., 35, 85-118, doi: 10.1146/
blazer, and redox pioneer, Arch. Biochem. Biophys., 595,
annurev immunol 051116 052320.
13-18, doi: 10.1016/j.abb.2015.10.022.
23.
Franceschi, C., and Campisi, J. (2014) Chronic inflamma
7.
Sies, H. (2017) Hydrogen peroxide as a central redox sig
tion (inflammaging) and its potential contribution to age
naling molecule in physiological oxidative stress: oxidative
associated diseases, J. Gerontol. A Biol. Sci. Med. Sci., 69
eustress, Redox Biol., 11, 613-619, doi: 10.1016/j.redox.
(S1), S4-S9, doi: 10.1093/gerona/glu057.
2016.12.035.
24.
Coder, B., Wang, H., Ruan, L., and Su, D. (2015) Thymic
8.
Shwe, T., Pratchayasakul, W., Chattipakorn, N., and
involution perturbs negative selection leading to autoreac
Chattipakorn, S. (2018) Role of D galactose induced
tive T cells that induce chronic inflammation, J. Immunol.,
brain aging and its potential used for therapeutic interven
194, 5825-5837, doi: 10.4049/jimmunol.1500082.
tions, Exp. Gerontol., 101, 13-36, doi: 10.1016/j.exger.
25.
Markle, J., and Fish, E. (2014) SeXX matters in immunity,
2017.10.029.
Trends Immunol., 35, 97-104, doi: 10.1016/j.it.2013.
9.
Li, M., Guo, K., Adachi, Y., and Ikehara, S. (2016)
10.006.
Immune dysfunction associated with abnormal bone mar
26.
Rehman, S., Shah, S., Ali, T., Chung, J., and Kim, M.
row derived mesenchymal stroma cells in senescence
(2017) Anthocyanins reversed D galactose induced oxida
accelerated mice, Intl. J. Mol. Sci., 17, E183, doi: 10.3390/
tive stress and neuroinflammation mediated cognitive
ijms17020183.
impairment in adult rats, Mol. Neurobiol., 54, 255-271,
10.
Currais, A., Farrokhi, C., Dargusch, R., Armando, A.,
doi: 10.1007/s12035 015 9604 5.
Quehenberger, O., Schubert, D., and Maher, P. (2018)
27.
Cebe, T., Yanar, K., Atukeren, P., Ozan, T., Kuruc, A.,
Fisetin reduces the impact of aging on behavior and physi
Kunbaz, A., Sitar, M., Mengi, M., Aydin, M., and
ology in the rapidly aging SAMP8 mouse, J. Gerontol. A
Esrefoglu, M. (2014) Comprehensive study of myocardial
Biol. Sci. Med. Sci., 73, 299-307, doi: 10.1093/gerona/
redox homeostasis in naturally and mimetically aged rats,
glx104.
Age (Dordr.), 36, 9728, doi: 10.1007/s11357 014 9728 y.
11.
Morava, E. (2014) Galactose supplementation in phospho
28.
Majumdar, S., and Nandi, D. (2018) Thymic atrophy:
glucomutase 1 deficiency: review and outlook for a novel
experimental studies and therapeutic interventions, Scand.
treatable CDG, Mol. Genet. Metab., 112, 275-279, doi: 10.
J. Immunol., 87, 4-14, doi: 10.1111/sji.12618.
1016/j.ymgme.2014.06.002.
29.
Purton, J., Monk, J., Liddicoat, D., Kyparissoudis, K.,
12.
Bo Htay, C., Palee. S., Apaijai, N., Chattipakorn, S., and
Sakkal, S., Richardson, S., Godfrey, D., and Cole, T.
Chattipakorn, N. (2018) Effects of D galactose induced
(2004) Expression of the glucocorticoid receptor from the
aging on the heart and its potential interventions, J. Cell.
1A promoter correlates with T lymphocyte sensitivity to
Mol. Med., 22, 1392-1410, doi: 10.1111/jcmm.13472.
glucocorticoid induced cell death, J. Immunol., 173,
13.
Wang, H., Hu, L., Li, L., Wu, X., Fan, Z., Zhang, C.,
3816-3824, doi: 10.4049/jimmunol.173.6.3816
Wang, J., Jia, J., and Wang, S. (2018) Inorganic nitrate
30.
Kurd, N., and Robey, E. (2016) T cell selection in the thy
alleviates the senescence related decline in liver function,
mus: a spatial and temporal perspective, Immunol. Rev.,
Sci. China Life Sci., 61, 24-34, doi: 10.1007/s11427 017
271, 114-126, doi: 10.1111/imr.12398.
9207 x.
31.
Xing, Y., Wang, X., Jameson, S., and Hogquist, K. (2016)
14.
Mo, Z., Liu, Y., Li, C., Xu, L., Wen, L., Xian, Y., Lin, Z.,
Late stages of T cell maturation in the thymus involve NF кB
Zhan, J., Chen, J., and Xu, F. (2017) Protective effect of
and tonic type I interferon signaling, Nat. Immunol., 17,
SFE CO2 of Ligusticum chuanxiong hort against D galac
565-573, doi: 10.1038/ni.3419.
tose induced injury in the mouse liver and kidney,
32.
Klein, L., Kyewski, B., Allen, P., and Hogquist, K. (2014)
Rejuvenation Res., 20, 231-243, doi: 10.1089/rej.2016.
Positive and negative selection of the T cell repertoire:
1870.
what thymocytes see (and don’t see), Nat. Rev. Immunol.,
15.
Li, W., Li, N., Sui, B., and Yang, D. (2017) Anti aging
14, 377-391, doi: 10.1038/nri3667.
effect of fullerenol on skin aging through derived stem cells
33.
Malchow, S., Leventhal, D., Lee, V., Nishi, S., Socci, N.,
in a mouse model, Exp. Ther. Med., 14, 5045-5050, doi: 10.
and Savage, P. (2016) Aire enforces immune tolerance by
3892/etm.2017.5163.
directing autoreactive T cells into the regulatory T cell lin
16.
Uddin, M., Nishio, N., Ito, S., Suzuki, H., and Isobe, K.
eage, Immunity, 44, 1102-1113, doi: 10.1016/j.immuni.
(2010) Toxic effects of D galactose on thymus and spleen
2016.02.009.
that resemble aging, J. Immunotoxicol., 7, 165-173, doi: 10.
34.
Takaba, H., and Takayanagi, H. (2017) The mechanisms of
3109/15476910903510806.
T cell selection in the thymus, Trends Immunol., 38,
17.
Li, M., Ouyang, W., Li, J., Si, L., Li, X., Guo, J., and Li, H.
805-816, doi: 10.1016/j.it.2017.07.010.
(2016) Effects of kinetin on thymus and immune function
35.
DeVoss, J., LeClair, N., Hou, Y., Grewal, N., Johannes, K.,
of aging rats, Pakistan Vet. J., 36, 356-362.
Lu, W., Yang, T., Meagher, C., Fong, L., Strauss, E., and
18.
Chaudhry, M., Velardi, E., Dudakov, J., and van den Brink, M.
Anderson, M. (2010) An autoimmune response to odorant
(2016) Thymus: the next (re)generation, Immunol. Rev.,
binding protein 1a is associated with dry eye in the Aire
271, 56-71, doi: 10.1111/imr.12418.
deficient mouse, J. Immunol., 184, 4236-4246, doi: 10.
19.
Cepeda, S., and Griffith, A. (2018) Thymic stromal cells:
4049/jimmunol.0902434.
roles in atrophy and age associated dysfunction of the thy
36.
Hubert, F., Kinkel, S., Crewther, P., Cannon, P., Webster, K.,
mus, Exp. Gerontol., 105, 113-117, doi: 10.1016/j.exger.
Link, M., Uibo, R., O’Bryan, M., Meager, A., Forehan, S.,
2017.12.022.
Smyth, G., Mittaz, L., Antonarakis, S., Peterson, P.,
20.
Griffith, A., Venables, T., Shi, J., Farr, A., van Remmen, H.,
Heath, W., and Scott, H. (2009) Aire deficient C57BL/6
Szweda, L., Fallahi, M., Rabinovitch, P., and Petrie, H.
mice mimicking the common human 13 base pair deletion
(2015) Metabolic damage and premature thymus aging
mutation present with only a mild autoimmune phenotype,
caused by stromal catalase deficiency, Cell. Rep., 12,
J. Immunol., 182, 3902-3918, doi: 10.4049/jimmunol.0802124.
1071-1079, doi: 10.1016/j.celrep.2015.07.008.
37.
Oh, J., Wang, W., Thomas, R., and Su, D. (2017) Capacity
21.
Dixit, V. (2010). Thymic fatness and approaches to
of tTreg generation is not impaired in the atrophied thymus,
enhance thymopoietic fitness in aging, Curr. Opin.
PLoS Biol., 15, e2003352, doi: 10.1371/journal.pbio.
Immunol., 22, 521-528, doi: 10.1016/j.coi.2010.06.010.
2003352.
БИОХИМИЯ том 84 вып. 6 2019
D ГАЛАКТОЗА СНИЖАЕТ ОБЩУЮ ИММУННУЮ ТОЛЕРАНТНОСТЬ
807
DEFECTIVE CENTRAL IMMUNE TOLERANS INDUCED
BY HIGH DOSE D GALACTOSE RESEMBLES AGING
H. M. Du1,2, Y. J. Wang1, X. Liu1, S. L. Wang2,
S. M. Wu3, Z. Yuan3, and X. K. Zhu1*
1 Research Center, Shengjing Hospital of China Medical University,
7 Mulan Road, Economic Development Zone, Benxi 117000,
China; E mail: zhuxk@sj hospital.org
2 Department of Oncology, Shengjing Hospital of China Medical
University, Shenyang 110022, China
3 Department of Blood Transfusion, Shengjing Hospital of China
Medical University, Shenyang 110022, China
Received December 4, 2018
Revised February 12, 2019
Accepted February 12, 2019
D Galactose (D Gal) causes accumulation of reactive oxygen species and the formation of advanced glycation end
products, ultimately resulting in oxidative stress. D Gal has been widely used to induce accelerated aging in anti aging
medical research. Although thymic epithelial cells are particularly sensitive to oxidative stress, there are few reports
on the thymus changes in D Gal induced aging mice. To study the effect of D Gal on rodent thymus, we investigated
the degree of thymus atrophy and the atrophy relative index change in C57BL/6J mice following subcutaneous injec
tion of D Gal at different doses (200, 500, and 1000 mg/kg daily) for 60 days. Compared with vehicle (0.9% saline)
treatment and young controls, D Gal at a dose of 500 and 1000 mg/kg daily led to significant thymic atrophy; the
1000 mg/kg daily dose caused an atrophy similar to that observed in naturally aged (18-20 month old) mice.
In high dose D Gal treated mice, greater immuno senescence, defective central immune tolerance, an increase
in activated splenic immune cell levels, and chronic low grade inflammation were noted, i.e., the outcomes similar
to what occurs as a result of natural aging in mice. Taken together, the results of these studies indicate that high dose
D Gal treated mice may be a valid model for studies of inducible thymic atrophy and effects of aging on immune
system.
Keywords: D galactose, oxidative stress, thymic aging, central immune tolerance, negative selection
БИОХИМИЯ том 84 вып. 6 2019