БИОХИМИЯ, 2019, том 84, вып. 6, с. 808 - 818
УДК 577.29
НОВЫЙ ЭФФЕКТИВНЫЙ СПОСОБ ПОЛУЧЕНИЯ
РЕКОМБИНАНТНОГО ПРОТИВООПУХОЛЕВОГО
ЦИТОКИНА TRAIL И ЕГО РЕЦЕПТОР СЕЛЕКТИВНОГО
ВАРИАНТА DR5 B*
© 2019
А.В. Яголович1,2, А.А. Артыков1,2, Д.А. Долгих1,2,
М.П. Кирпичников1,2, М.Э. Гаспарян1**
1 Институт биоорганической химии им. академиков М.М. Шемякина
и Ю.А. Овчинникова РАН, 117997 Москва, Россия;
электронная почта: marine_gasparian@yahoo.com
2 Московский государственный университет им. М.В. Ломоносова,
биологический факультет, 119991 Москва, Россия
Поступила в редакцию 19.12.2018
После доработки 25.02.2019
Принята к публикации 26.02.2019
Цитокин TRAIL индуцирует апоптоз в опухолевых клетках различного происхождения, не затрагивая нор
мальные клетки. Клинические испытания агонистов рецепторов смерти DR4 и DR5 (рекомбинантный
TRAIL или антитела к рецепторам смерти) в основном потерпели неудачу, поскольку большинство опухо
лей человека оказались к ним устойчивы. В настоящее время разрабатываются агенты второго поколения,
нацеленные на TRAIL R с повышенной биологической активностью. С этой целью нами был разработан
вариант TRAIL DR5 B, избирательно взаимодействующий только с рецептором DR5. Мы разработали но
вый эффективный способ получения TRAIL и DR5 B, используя экспрессию этих белков в штамме
Escherichia coli SHuffle B. Белки были выделены из цитоплазматической фракции клеток и очищены до вы
сокой степени гомогенности с помощью металл аффинной и ионообменной хроматографии. Выход белков
составил 211 мг и 173 мг из одного литра культуры клеток для DR5 B и TRAIL соответственно, что значи
тельно превышало результаты, полученные с помощью других методик. Препарат DR5 B эффективнее и
быстрее убивал опухолевые клетки различного происхождения по сравнению с TRAIL. Полученные препа
раты можно использовать как для исследования сигнальных путей TRAIL, так и в доклинических и клини
ческих испытаниях их противоопухолевой активности.
КЛЮЧЕВЫЕ СЛОВА: цитокин TRAIL, мутантный вариант DR5 B, штамм E. coli SHuffle B, терапия рака.
DOI: 10.1134/S032097251906006X
Природный цитокин TRAIL (TNF related
(«рецепторы смерти»), проводят сигнал апопто
apoptosis inducing ligand) является потенциаль
за, а DcR1, DcR2 и OPG (остеопротегерин) яв
ным средством для терапии опухолевых заболе
ляются рецепторами «ловушками» и не имеют
ваний, поскольку он способен селективно инду
функционального цитоплазматического «доме
цировать апоптоз в опухолевых клетках, не за
на смерти» (death domain, DD), который необ
трагивая нормальные клетки [1]. Однако клини
ходим для индукции апоптоза [2]. На основе
ческие испытания показали его низкую эффек
экспериментов по оверэкспрессии DcR1 и
тивность в связи с тем, что многие типы опухо
DcR2 предполагается, что эти рецепторы инги
лей резистентны к TRAIL. Один из механизмов
бируют индукцию апоптоза TRAIL вследствие
резистентности связан с наличием пяти рецеп
захвата лиганда [3, 4]. Кроме того, была предло
торов TRAIL, из которых лишь два, DR4 и DR5
жена версия, по которой DcR2 ингибирует
TRAIL индуцированный апоптоз, образуя ли
Принятые сокращения: МТТ - (3 [4,5 диметилтиа
ганд независимые неактивные комплексы с ре
зол 2] 2,5 дифенил тетразолия бромид; OPG - остеопроте
цептором DR5, или вызывает индукцию сигналь
герин, IPTG - изопропил_β D 1 тиогалактопиранозид.
ных путей, препятствующих апоптозу, в част
* Первоначально английский вариант рукописи опублико
ности, активацию NF κB и MAPK/ERK [5-7].
Функции этих рецепторов могут различаться в
msu.ru/biokhimiya, в рубрике «Papers in Press», BM 18 359,
29.04.2019.
различных типах клеток и остаются до конца не
** Адресат для корреспонденции.
исследованными.
808
СПОСОБ ПОЛУЧЕНИЯ ПРОТИВООПУХОЛЕВЫХ БЕЛКОВ TRAIL И DR5 B
809
До сих пор не выяснен относительный вклад
ления слитного белка с последующей очисткой
двух отдельных рецепторов смерти в индукцию
целевого белка увеличивал трудоемкость очист
апоптоза в различных типах опухолевых клеток.
ки, а также влиял на выход и себестоимость пре
С помощью рецептор селективных мутантных
парата из за высокой стоимости протеиназы.
вариантов TRAIL было показано, что гибель
В данной работе мы описываем новый спо
клеток хронической лимфоцитарной лейкемии,
соб получения рекомбинантных белков TRAIL
острых миелоидных лейкозов и опухоли подже
и DR5 B, основанный на прямой экспрессии в
лудочной железы происходит путем активации
штамме E. coli SHuffle B с последующей очист
рецептора DR4, тогда как DR5 является основ
кой целевого белка методами аффинной и ионо
ным источником индукции апоптоза в других
обменной хроматографии. Относительно новый
опухолевых клетках эпителиального происхож
штамм продуцент E. coli SHuffle B был разрабо
дения [8]. Эта дифференциальная проапоптоти
тан компанией «New England Biolabs» для улуч
ческая эффективность DR4 и DR5 в зависимос
шения рефолдинга белков в цитоплазме и, соот
ти от типа клетки/рака может быть использова
ветственно, увеличения растворимой формы
на в терапии.
белков при экспрессии [16]. Данная технология
Для получения рекомбинантного TRAIL
позволяет получить высокоочищенные и гомо
преимущественно используются штаммы E. coli,
генные тримерные препараты с высокими выхо
где он имеет тенденцию к образованию телец
дами и низким уровнем эндотоксинов. Полу
включения [9-11]. Получение белковых препа
ченный этим методом препарат DR5 B проде
ратов из телец включения предполагает стадии
монстрировал повышенную, по сравнению с
солюбилизации и рефолдинга, для которых не
TRAIL, цитотоксическую активность на линиях
обходимы большие количества денатурирую
опухолевых клеток различного происхождения.
щих и восстанавливающих реагентов, что требу
Высокий выход белка и чистота препарата по
ет значительного времени и имеет высокую сто
зволят применить разработанную технологию
имость. Ранее сообщалось об экспрессии раст
при исследовании препарата DR5 B в клинике.
воримого TRAIL в E. coli [11, 12], однако описа
ние методик было неполным, а выход продукта
был невысок. Для получения TRAIL в раствори
МЕТОДЫ ИССЛЕДОВАНИЯ
мой форме использовалась экспрессия слитных
белков, включающих мальтозосвязывающий бе
Реактивы и материалы. Линии клеток острой
лок (MBP), b'a' домен дисульфид изомеразы
T лимфобластной лейкемии Jurkat и фиброблас
(PDIb'a') или тиоредоксин [13, 14]. Этот подход
тов крайней плоти человека (HFF) были получе
облегчает получение целевого белка, но плохо
ны из Института Цитологии РАН (Санкт Петер
согласуется с требованиями к клиническим пре
бург, Россия). Линии клеток колоректальной
паратам.
карциномы НСТ116 и Caco 2 были получены из
Ранее нами был получен рецептор специ
АТСС (США). Питательные среды для культи
фичный вариант TRAIL DR5 B с заменами ами
вирования клеток (DMEM, EMEM, RPMI1640),
нокислотных остатков (Tyr189Asn, Arg191Lys,
0,05% ный раствор трипсина с ЭДТА, фосфат
Gln193Arg, His264Arg, Ile266Leu и Asр269His).
но солевой буфер и MTT («ПанЭко», Россия),
Он связывается с рецептором DR5 так же эф
бычья эмбриональная сыворотка («HyClone La
фективно, как и TRAIL, но не связывается с ре
boratories, Inc.», США), остальные реактивы
цептором DR4 и, в отличие от других рецептор
(«PanReac AppliChem», Германия).
селективных мутантных вариантов, не взаимо
Получение плазмидного вектора pET32a/sdr5 b
действует с рецепторами ловушками DcR1, DcR2
и pET32a/strail для прямой экспрессии. В после
и OPG [14]. Исследования показали, что му
довательность ДНК, кодирующую слитный бе
тантный вариант DR5 B значительно эффектив
лок Trx/DR5 B в составе плазмидного вектора
нее чем TRAIL дикого типа индуцирует апоптоз
pET32a/dr5 b, ранее полученного авторами [14],
в различных линиях опухолевых клеток [15]. Ва
были введены три точечные мутации Gly469Cys,
риант DR5 B был получен путем экспрессии в
Cys471Thr, Ala473Thr методом сайт специфи
штамме E. coli BL21(DE3) в виде слитного белка
ческого мутагенеза с использованием олигонук
с тиоредоксином с последующей очисткой пос
леотидных праймеров gggtaccgacgacgaccatatggt
ле расщепления слитного белка энтеропептида
gagagaaagaggtcctc (прямой) и agggacctctttctctcac
зой [9, 14]. Этот способ позволил получить зна
catatggtcgtcgtcggtaccc (обратный) («Евроген»,
чительные количества растворимого белка, од
Россия).
нако по ряду причин он не подходил для ис
Амплификацию проводили при следующих
пользования в клинических исследованиях. До
условиях: 30 с при 95 °С, 30 с при 55 °С, 14,5 мин
полнительный этап ферментативного расщеп
при 72 °С, 30 циклов. Синтез амплифицирован
5 БИОХИМИЯ том 84 вып. 6 2019
810
ЯГОЛОВИЧ и др.
ной ДНК проверяли с помощью электрофореза
ствии додецилсульфата натрия. После этого
в 1% ном агарозном геле. Реакционную смесь
клетки осаждали центрифугированием при 5000 g
обрабатывали рестриктазой Dpn I («Thermo
(«Beckman Coulter», США) при 4 °С в течение
Fisher Scientific», США) в течение 1 ч при 37 °С.
10 мин, ресуспендировали в буфере, содержа
Для наработки ДНК реакционную смесь транс
щем 300 мM NaCl, 50 мМ Tris HCl (pH 8,0), и
формировали в бактериальный штамм E. coli
разрушили под давлением 2000 psi на установке
XL 1 Blue («Евроген», Россия), клетки выращи
«French press» («Spectronic Instruments, Inc.»,
вали в среде LB с ампициллином (100 мкг/мл)
США). Разрушенную клеточную массу осажда
при 37 °С при перемешивании 250 об/мин
ли центрифугированием при 75 000 g («Beckman
(«Thermo Fisher Scientific», США) в течение 18 ч,
Coulter», США) в течение 30 мин. В раствори
после чего выделяли плазмидную ДНК из кле
мую клеточную фракцию добавляли 0,05% (v/v)
точной биомассы с помощью набора GeneJET
Triton X 100 и наносили на хроматографическую
Plasmid MiniPrep kit («Thermo Fisher Scientific»,
колонку с сорбентом Ni NTA агарозой («Qiagen»,
США). Наличие мутаций в гене DR5 B подтверж
США). Целевые белки элюировали в буфере, со
дали автоматическим секвенированием в ком
держащем 300 мM NaCl, 50 мM NaH2PO4, 250 мM
пании «Евроген» (Россия).
имидазол (pH 8,0). Очищенный препарат диали
Полученную плазмиду с дополнительным
зовали против буфера, содержащего 45 мМ
сайтом рестрикции NdeI обрабатывали рестрик
NaCl, 50 мM Tris HCl, 5 мM β меркаптоэтанола
тазами XhoI и NdeI, что приводило к образова
(pH 7,5), при комнатной температуре в течение
нию 4 х фрагментов: линеаризованный плаз
18 ч. Далее к раствору белка добавляли 0,05%
мидный вектор (5445 п.н.), фрагмент гена DR5
(v/v) Triton X 100 и очищали на сорбенте SP Se
B (504 п.н.), фрагмент с геном тиоредоксина
pharose («GE Healthcare», Швеция) в 0-500 мM
(345 п.н.) и фрагмент тагов (129 п.н.), в котором
линейном градиенте NaCl на установке AKTA
находился дополнительный сайт рестрикции
FPLC («GE Healthcare», Швеция). Белковые
NdeI. После разделения в 1% ном агарозном ге
препараты диализовали против буфера, содер
ле фрагменты ДНК линеаризованного плазмид
жащего 150 мM NaCl (pH 7,5), в течение 18-20 ч
ного вектора и гена DR5 B элюировали из геля с
при 4 °С, стерилизовали фильтрацией через сте
помощью набора QIAQuick Gel Extrac tion kit
рильный фильтр для шприцов («Millipore»,
(«Qiagen», США) и лигировали с помощью T4
США) с порами 0,2 мкм c мембраной из поли
ДНК лигазы при 10 °C в течение 16 ч. Реакцион
винилдифторида (PVDF) и хранили при 4 °С.
ную смесь трансформировали в штамм
Пробы после каждой стадии очистки анализи
Escherichia coli XL 1 Blue и выделили плазмид
ровали в 15% ном полиакриламидном геле при
ную ДНК pET 32a/sdr5 b. Правильную вставку
окрашивании краской Кумасси бриллиантовый
гена в плазмиду подтвердили определением
синий R250 или нитратом серебра [16, 17]. Кон
нуклеотидной последовательности встроенного
центрацию белка во время очистки определяли
гена. Аналогичную процедуру провели с плаз
по методу Бредфорда [18]. Концентрацию очи
мидным вектором pET 32a/TRAIL, предназна
щенных препаратов определяли при длине вол
ченным для экспрессии TRAIL дикого типа.
ны 280 нм на спектрофотометре Ultraspec 2100
Экспрессия и очистка рекомбинантных белков
(«Bio Rad», США) с использованием молярных
TRAIL и DR5 В. Экспрессию белков TRAIL и
коэффициентов экстинкции 25 520 М-1 см-1 для
DR5 В (а.о. 114-281) проводили в бактериаль
TRAIL и 24 180 М-1 см-1 для DR5 B, определен
ном штамме E. coli SHuffle B («New England Bio
ных по аминокислотной последовательности с
labs», Англия). Клетки трансформировали плаз
помощью программы ProtParam на сервере
мидными векторами pET 32a/sdr5 b и pET 32a/
sTRAIL и выращивали в жидкой питательной
Оценку содержания белка в полиакриламид
среде LB с ампициллином (100 мкг/мл) при 37 °С
ных гелях проводили путем денситометрии с ис
при интенсивном перемешивании (250 об/мин)
пользованием соответствующей опции про
в течение 17 ч. После этого ночную культуру
разбавляли (1 : 100) в жидкой среде LВ с ампи
программа позволяет рассчитать интенсивность
циллином (100 мкг/мл), инкубировали при 37 °С
серого цвета в выделенной области черно бело
до значения ОД600
= 0,6 и индуцировали
го изображения полиакриламидного геля, что
экспрессию целевых белков добавлением ин
позволяет сравнить содержание белка в геле.
дуктора T7 промотора 0,1 мМ IPTG (изопро
Очистка препаратов от эндотоксинов. Препа
пил_β D 1 тиогалактопиранозид). Культуры кле
раты DR5 B и TRAIL дополнительно очищали
ток выращивали при 28 °С в течение 20 ч. Уро
на аффинном сорбенте Pierce High Capacity En
вень экспрессии целевого белка анализировали
dotoxin Removal Resin («Thermo Fisher Scientific»,
в 15% ном полиакриламидном геле в присут
США). Очищенные белковые препараты инку
БИОХИМИЯ том 84 вып. 6 2019
СПОСОБ ПОЛУЧЕНИЯ ПРОТИВООПУХОЛЕВЫХ БЕЛКОВ TRAIL И DR5 B
811
бировали с 10 мл сорбента в течение 2 ч при
бромид) в конечной концентрации 0,5 мг/мл и
комнатной температуре при медленном переме
инкубировали в течение 3 ч при 37 °C. Планшеты
шивании. Затем смесь белков с сорбентом нано
центрифугировали при 3000 об/мин («ELMI»,
сили на колонку и собирали белковую фракцию.
Латвия ) в течение 5 мин, удаляли надосадочную
Содержание эндотоксинов оценивали с по
жидкость, в каждую лунку добавляли диметил
мощью набора ToxinSensorTM Chromogenic LAL
сульфоксид (ДМСО), оптическую плотность со
Endotoxin Assay Kit («GenScript», США).
держимого лунок измеряли с помощью план
Аналитическое ультрацентрифугирование. Для
шетного спектрофотометра iMark («Bio Rad»,
определения гомогенности очищенных препа
США) при длине волны 450 нм с вычитанием
ратов DR5 B и TRAIL проводили аналитичес
фона при 655 нм.
кое ультрацентрифугирование на центрифуге
Beckman Model E («Beckman Coulter», США)
при концентрации белков 1 мг/мл в стандарт
РЕЗУЛЬТАТЫ ИCCЛЕДОВАНИЯ
ных пробирках по 0,4 мл при 60 000 об/мин. Ко
эффициент седиментации s20, w вычисляли с по
Экспрессия и очистка белков TRAIL и DR5 B
мощью программного обеспечения SEDFIT.
в штамме E. coli SHuffle B. Для прямой экспрес
Исследование биологической активности пре
сии белков TRAIL и DR5 B полученные плазмид
парата на линиях опухолевых клеток. Линии кле
ные векторы pET 32a/sdr5 b и pET 32a/sTRAIL
ток колоректальной карциномы НСТ116, Caco 2,
трансформировали в высокопроизводительный
а также клетки фибробластов крайней плоти че
штамм E. coli SHuffle B. Этот штамм E. coli, бла
ловека HFF культивировали в питательной сре
годаря сниженной активности редуктаз gor и
де DMEM, содержащей 10% (v/v) бычьей эм
trxB наряду с повышенной экспрессией изоме
бриональной сыворотки. Суспензионные клетки
разы дисульфидных связей DsbC, позволяет по
линии Т лимфобластной лейкемии Jurkat куль
лучить высокий уровень цитоплазматической
тивировали в питательной среде RPMI1640, со
экспрессии активных белков с правильно обра
держащей 10% (v/v) бычьей эмбриональной сы
зованными дисульфидными связями [19]. Клет
воротки. Все линии клеток культивировали при
ки культивировали с различными концентраци
37 °С в атмосфере 5% CO2. Клетки переносили в
ями индуктора T7 промотора IPTG, и содержа
стерильные 96 луночные планшеты (1 × 105 кле
ние целевого белка анализировали в 15% ном
ток на лунку для НСТ116 и Caco 2, 5 × 105 кле
полиакриламидном геле (рис. 1). Экспрессию
ток для Jurkat) и инкубировали с препаратами
TRAIL и DR5 B наблюдали и в отсутствии IPTG,
TRAIL и DR5 B в течение 24 ч. Для определе
но в присутствии индуктора она существенно
ния жизнеспособности клеток добавляли МТТ
повышалась. В дальнейших экспериментах для
(3 [4,5 диметилтиазол 2] 2,5 дифенил тетразолия
очистки белков клетки выращивали в присут
кДа
кДа
1
2
3
4
5
6
7
8
1
2
3
4
5
6
7
8
Рис. 1. Экспрессия белков TRAIL (а) и DR5 B (б) в штамме E. coli SHuffle B при индукции IPTG в различных концентра
циях. Пробы, содержащие по 10 мкл ночной культуры, центрифугировали при 5000 g в течение 5 мин, растворяли в бу
фере для проб и анализировали в 15% ном Tris глициновом Ds Na ПААГ. Дорожки: 1 - маркеры молекулярных масс;
2 - культуры клеток, выращенные без индуктора; 3-7 - культуры клеток, выращенные в присутствии 0,02, 0,05, 0,1, 0,25
и 0,5 мМ IPTG соответственно; 8 - 10 мкг белка из растворимой фракции цитоплазматических белков при индукции
экспрессии 0,1 мМ IPTG
БИОХИМИЯ том 84 вып. 6 2019
5*
812
ЯГОЛОВИЧ и др.
ствии 0,1 мМ IPTG. Уровень экспрессии DR5 B
диализовали против буфера, содержащего 45 мМ
был выше по сравнению с TRAIL и составлял
NaCl, 50 мM Tris HCl, 5 мM β меркаптоэтанола
~25% от общего количества белка. Оценка со
и наносили на колонку с 10 мл SP Sepharose.
держания белка в полиакриламидных гелях,
Элюировали белок линейным градиентом NaCl
проводимая при помощи денситометрии с ис
(0-500 мМ). Белок выходил из колонки при
пользованием соответствующей опции про
концентрациях соли 150-250 мМ. В результате
были получены белковые растворы, практичес
ла, что уровень экспрессии при индукции 0,1 мМ
ки не содержащие примесей нецелевых поли
IPTG составил примерно 676 мг для TRAIL и
пептидов (рис. 3). Разработанная технология
782 мг для DR5 B в 1 литре культуры клеток, и
позволила получить высокоочищенные белки
белки на 45-50% находились в растворимой
TRAIL и DR5 B в количестве 173 и 211 мг из од
форме (рис. 1, дорожка 8).
ного литра клеточной культуры соответственно.
На первом этапе экспрессированные белки
Выходы белковых препаратов TRAIL и DR5 B в
из растворимой фракции клеточного лизата
ходе очистки приведены в табл. 1.
очищали с помощью металл аффинной хрома
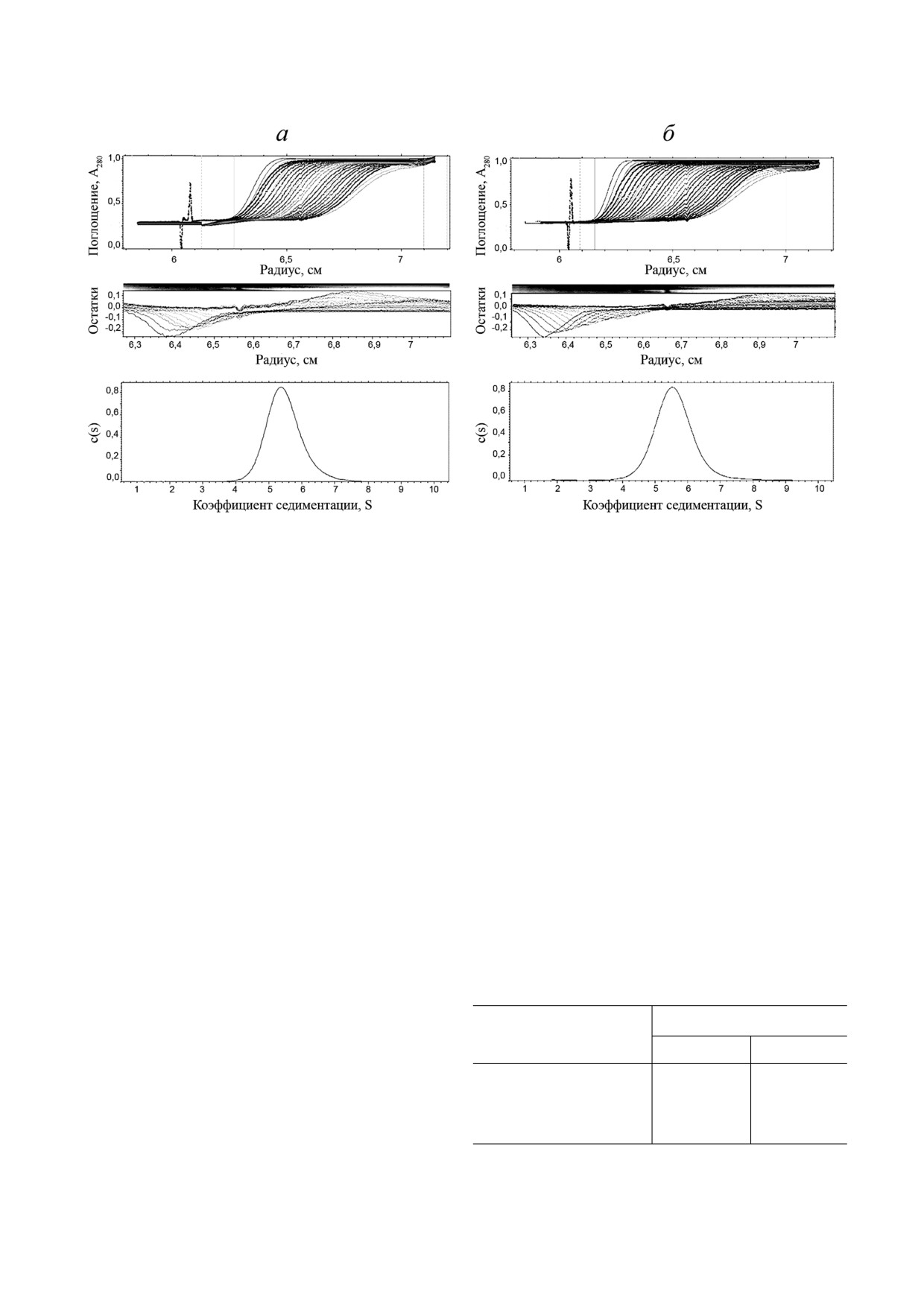
Гомогенность и степень тримеризации полу
тографии на сорбенте Ni NTA. Благодаря нали
ченных препаратов исследовали методом анали
чию нескольких гистидиновых остатков в ами
тического ультрацентрифугирования (рис. 4). Бы
нокислотной последовательности TRAIL проч
ли определены коэффициенты седиментации s20,
но связывался с сорбентом Ni NTA даже в отсут
w = 5,49 ± 0,03 и s20, w = 5,61 ± 0,03, что соответ
ствие полигистидинового тага. В результате ре
ствует молекулярными массами Mw = 59 105 Да
комбинантные белки TRAIL и DR5 B были эф
и Mw = 59 156 Да для TRAIL и DR5 B соответ
фективно очищены, и чистота препаратов состав
ственно. Молекулярные массы мономеров TRAIL
ляла ~85% (рис. 2).
и DR5 B, рассчитанные на основе их аминокис
Для получения высокоочищенных белковых
лотных последовательностей, составляют 19 624,04
препаратов был проведен второй этап очистки с
и 19 616,11 Да соответственно, так что молеку
помощью катионообменной хроматографии на
лярные массы обоих препаратов, определенные
сорбенте SP Sepharose, который способен свя
с помощью аналитического ультрацентрифуги
зывать 50-100 мг белка на мл сорбента. Очи
рования, соответствуют их тримерам. Исходя из
щенные на Ni NTA агарозе белковые растворы
формы кривых на рис. 4 можно сказать, что пре
1
2
3
4
5
1
2
3
4
5
Рис. 2. Очистка белков TRAIL и DR5 B с помощью металл аффинной хроматографии на Ni NTA агарозе. Пробы, содер
жащие 15 мкг белка, анализировали на 15% ном Ds Na ПААГ. Дорожки: 1 - маркеры молекулярных масс; 2 - раствори
мая фракция цитоплазматических белков; 3 - фракция белков, не связавшихся с Ni NTA агарозой; 4 - фракция белков,
отмытых с помощью буфера, содержащего 20 мМ имидазола; 5 - фракция белков, отмытых буфером, содержащим 250 мМ
имидазола
БИОХИМИЯ том 84 вып. 6 2019
СПОСОБ ПОЛУЧЕНИЯ ПРОТИВООПУХОЛЕВЫХ БЕЛКОВ TRAIL И DR5 B
813
1
2
3
4
5
6
7
1
2
3
Рис. 3. Очистка белка DR5 B с помощью ионообменной хроматографии на сорбенте SP Sepharose. Пробы, содержащие
10-15 мкг белка, анализировали на 15% ном Ds Na ПААГ. а - Дорожки: 1 - маркеры молекулярных масс; 2 - белковая
фракция после очистки на первом этапе на Ni NTA агарозе; 3 - фракция белков, не связавшихся с SP Sepharose; 4 - фрак
ция белков, вышедших с колонки при 100 мМ хлорида натрия; 5-7 - фракции белков после очистки на сорбенте SP
Sepharose. б - Анализ чистоты полученных препаратов при окрашивании полиакриламидного геля нитратом серебра. До
рожки: 1 - маркеры молекулярных масс; 2 -TRAIL (500 нг); 3 -DR5 B (500 нг)
параты являются высокогомогенными и состоят
Capacity Endotoxin Removal Resin с ковалентно
из тримерных молекул.
связанным ε поли L лизином для удаления эн
Очистка препаратов TRAIL и DR5 B от эндо
дотоксинов. Итоговое содержание эндотокси
токсинов. Содержание эндотоксинов в очищен
нов в очищенных препаратах TRAIL и DR5 B не
ных препаратах оценивали с помощью набора
превышало 0,5 ед/мг (табл. 2). Надо отметить,
ToxinSensorTM Chromogenic LAL Endotoxin Assay
что в ходе очистки препаратов от эндотоксинов
Kit по инструкции производителя. При очистке
потери белков были незначительны (1-2%).
белков без добавления детергента Triton Х 100
Цитотоксическая активность препаратов
уровень эндотоксинов составлял >35 ед/мг (дан
TRAIL и DR5 B. Цитотоксическая активность
ные не показаны), что является довольно низ
полученных препаратов TRAIL и DR5 B была
ким показателем для рекомбинантных белков,
исследована на линиях клеток колоректальной
очищенных из штаммов E. coli. Относительно
карциномы HCT116 и Caco 2, а также Т лим
низкое содержание эндотоксинов, возможно,
обусловлено использованием стадии катион об
Таблица 1. Выходы белков TRAIL и DR5 B из 1 л клеточ
менной хроматографии [20]. Было исследовано
ной культуры в ходе очистки
влияние детергента Triton Х 100 в ходе очистки
на содержание эндотоксинов в препарате. При
Стадии очистки
DR5 B, мг
TRAIL, мг
добавлении низкой концентрации Triton Х 100
(0,05%) на стадиях очистки уровень эндотокси
Растворимая фракция
нов снизился в 5 раз и составил 8 ± 0,8 ед/мг
цитоплазматических белков*
1544
1523
(табл. 2). Такое содержание эндотоксинов по
зволяет применять препарат в биологических и
Очистка на Ni NTA*
348
275
доклинических исследованиях, однако превы
Очистка на SP Sepharose**
211
173
шает предельно допустимую дозу для использо
вания в клинических испытаниях ( 5 ед/кг/ч).
* Количество белка, определенное по методу Бредфорда.
Поэтому препараты были дополнительно очи
** Количество белка, определенное по поглощению при
щены на аффинном сорбенте Pierce High
280 нм с учетом коэффициента экстинкции.
БИОХИМИЯ том 84 вып. 6 2019
814
ЯГОЛОВИЧ и др.
Рис. 4. Результаты аналитического ультрацентрифугирования препаратов TRAIL (а) и DR5 B (б). Препараты центрифу
гировали при 60 000 об/мин в стандартных ячейках 0,4 мл при концентрации 1 мг/мл. Профили седиментации белков ре
гистрировались при поглощении 280 нм. Параметр c(s) является коэффициентом непрерывного распределения седимен
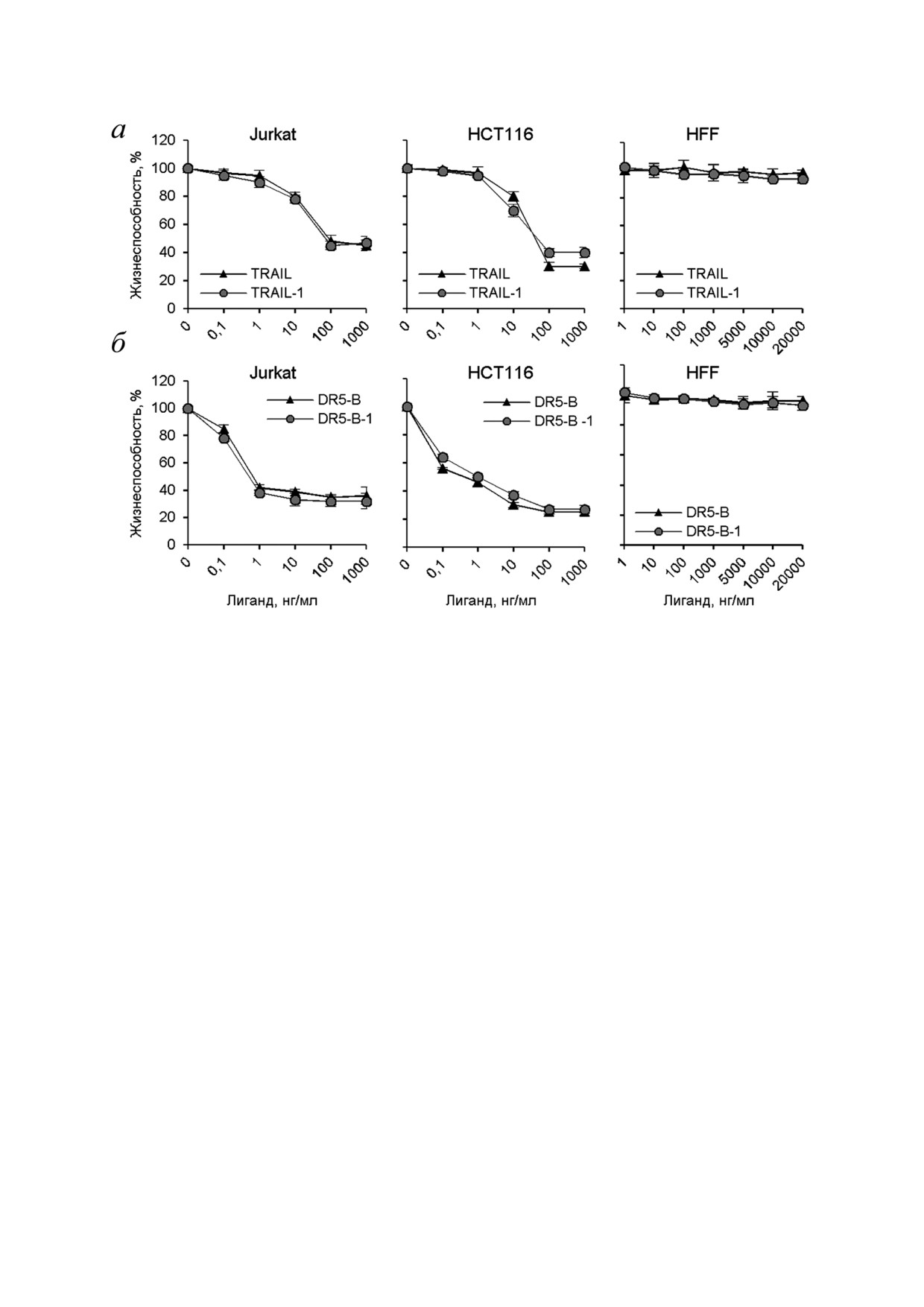
фобластной лейкемии Jurkat (рис. 5). Белок
теризация рецепторов в высокоорганизованную
DR5 B эффективно убивал клетки HCT116 и
сеть, которая требуется, чтобы вызвать эффек
Jurkat при концентрациях 0,1-1 нг/мл, тогда как
тивный апоптоз [23]. Интересно, что димерный
TRAIL проявлял цитотоксическую активность
пептид, который связывается с рецептором DR5,
при концентрациях >10 нг/мл. Кроме того, пре
вызывал апоптоз в клетках BJAB, но не убивал
парат DR5 B намного быстрее убивал клетки
клетки Jurkat и HCT116 из за отличия уровня
линии Jurkat по сравнению с TRAIL (рис. 5, б).
олигомеризации DR5 на поверхности клетки
За 6 ч под действием DR5 B погибло всего на
перед добавлением лиганда [24].
10% меньше клеток по сравнению с инкубацией
Надо отметить, что препараты DR5 B и
24 ч, тогда как TRAIL был неэффективен при
TRAIL, полученные в данной работе при пря
инкубации 6 ч. Клетки линии Caco 2 были
мой экспрессии и полученные в ходе экспрес
практически резистентны к TRAIL, тогда как
сии в виде слитного белка с тиоредоксином
DR5 B вызывал гибель этих клеток на 80%. Ра
(TRAIL 1 и DR5 B 1) [15], демонстрировали
нее на клетках линии Colo205 было показано,
одинаковую цитотоксическую активность на
что рецептор селективный вариант TRAIL
клетках HCT116 и Jurkat (рис. 6). Как препараты
D269H/E195R усиливал кинетику активации ре
TRAIL, так и DR5 B не проявили цитотоксич
цептора DR5, так как обходил лиганд индуци
рованную гетероолигомеризацию рецептора
DR5 c рецепторами ловушек, в ходе чего увели
Таблица 2. Содержание липополисахаридов (ЛПС) в про
чивался апоптоз [21]. Однако в клетках Jurkat и
бах препаратов TRAIL и DR5 B до и после очистки на
аффинном сорбенте для удаления эндотоксинов
Caco 2 уровень поверхностной экспрессии ре
цепторов ловушек крайне низок [15, 22] для су
Содержание ЛПС, ед/мг
щественного ингибирования TRAIL опосредо
Стадии очистки
ванного апоптоза. Мы полагаем, что степень
TRAIL
DR5 B
олигомеризации рецептора DR5 при связыва
нии с DR5 B выше по сравнению с TRAIL, что
До очистки
8,7 ± 0,8
8,2 ± 0,80
усиливает сигнала апоптоза. Ранее было показа
но, что при связывании TRAIL на предвари
После очистки
0,48 ± 0,03
0,45 ± 0,03
тельно димеризованных DR5 происходит клас
БИОХИМИЯ том 84 вып. 6 2019
СПОСОБ ПОЛУЧЕНИЯ ПРОТИВООПУХОЛЕВЫХ БЕЛКОВ TRAIL И DR5 B
815
Рис. 5. Цитотоксическая активность рекомбинантных белковых препаратов TRAIL и DR5 B на различных линиях опухо
левых клеток. Жизнеспособность клеток определяли с помощью МТТ теста. а - Клетки колоректальной карциномы
HCT116 и Caco 2 инкубировали с препаратами в течение 24 ч. б - Клетки острой T лимфобластной лейкемии Jurkat инку
бировали с препаратами в течение 6 ч и 24 ч. Значения представлены как средние ± среднеквадратичное отклонение (n = 3)
ности по отношению к нетрансформированным
очисткой целевого белка [13]. Выход белка, по
клеткам фибробластов крайней плоти человека
данным этой работы, составил 36 мг из 1 литра
(HFF) (рис. 6), что указывает на то, что разрабо
культуры клеток. Известен также способ цито
танный новый способ получения DR5 B не по
плазматической экспрессии цитокина TRAIL с
влиял на его специфическую активность.
тагом Fh8 ΔI CM, где Fh8 - полипептид (8 кДа)
низкомолекулярного антигена печеночной
двуустки (Fasciola hepatica), который улучшает
ОБCУЖДЕНИЕ PЕЗУЛЬТАТОВ
растворимость белка, а ΔI CM - кальмодулин
связывающий полипептид, способный рас
Гибридная экспрессия рекомбинантных бел
щепляться при низких значениях pH [25]. Вы
ков, слитных с доменом «несущего» белка, явля
ход белка в данной работе составил 77,5 мг бел
ется удобным способом получения белков для
ка из 1 литра культуры клеток с чистотой 89%.
молекулярно биологических исследований. К при
В нашей лаборатории ранее был разработан
меру, ранее был разработан способ цитоплазма
способ получения вариантов TRAIL путем
тической экспрессии цитокина TRAIL в виде
экспрессии в штамме E. coli BL21(DE3) гиб
слитного белка с мальтоз связывающим белком
ридного белка с тиоредоксином, где раствори
(MBP), где слитный белок расщепляют протеи
мость слитного белка составила 20% от общей
назой вируса гравировки табака с последующей
экспрессии [9, 14].
БИОХИМИЯ том 84 вып. 6 2019
816
ЯГОЛОВИЧ и др.
Рис. 6. Сравнительный анализ цитотоксической активности препаратов TRAIL и DR5 B, полученные способами прямой
экспрессии в штамме E. coli SHuffle B и при экспрессии в составе слитного белка c тиоредоксином в штамме BL23(DE3)
(TRAIL 1 и DR5 B 1). Клетки HCT116, Jurkat и HFF инкубировали с препаратами TRAIL (а) и DR5 B (б) в течение 24 ч,
и жизнеспособность клеток определяли с помощью МТТ теста. Значения представлены как средние ± среднеквадратич
ное отклонение (n = 3)
Однако белки терапевтического назначения,
лена задача: разработать новый способ получе
полученные гибридным способом, имеют ряд
ния цитокина с высоким выходом и низкой се
ограничений по использованию в качестве ле
бестоимостью. Для этого была разработана но
карственных препаратов. Гибридная экспрессия
вая стратегия для экспрессии и очистки цитоки
подразумевает применение специфических про
на TRAIL. Белок был впервые экспрессирован в
теиназ для отщепления «несущего» белка. Нес
штамме E. coli SHuffle B без несущих белков и та
мотря на то, что эти протеазы расщепляют слит
гов в растворимой форме. Это позволило облег
ные белки по специфическому сайту, располо
чить процедуру очистки и увеличить выход целе
женному между несущим и целевым белком,
вого белка. В ходе двух этапов очистки (аффин
при расщеплении образуются следовые количе
ной и ионообменной хроматографии) получили
ства продуктов неспецифического расщепле
173 и 211 мг препаратов TRAIL и DR5 B соответ
ния, от которых трудно избавляться. Кроме то
ственно с чистотой 98%. Более высокий выход
го, процесс очистки целевого белка включает
DR5 B, возможно, связан с высокой раствори
дополнительный этап удаления протеиназ. Ис
мостью белка, обусловленной заменами гидро
пользование препаратов протеиназ значительно
фобных и незаряженных аминокислотных ос
повышает стоимость итогового продукта в связи
татков на гидрофильные и заряженные остатки
с большой трудозатратностью и высокой стои
(такие как Tyr189Asp, Gln193Arg, His264Arg) [14].
мостью фермента, что затрудняет задачу масш
Благодаря применению детергента Triton Х 100
табирования производства препарата для кли
в низких концентрациях (0,05%) на стадиях
нических испытаний.
очистки удалось снизить уровень бактериаль
ных эндотоксинов в препарате в 3-4 раза (с 35
Поскольку противоопухолевый цитокин
до 8,2 ед/мг), что все равно выше допустимой
TRAIL является потенциальным средством для
нормы (5 ед/кг веса) для клинических испы
терапии опухолевых заболеваний, была постав
таний препарата [26]. Так как терапевтические
БИОХИМИЯ том 84 вып. 6 2019
СПОСОБ ПОЛУЧЕНИЯ ПРОТИВООПУХОЛЕВЫХ БЕЛКОВ TRAIL И DR5 B
817
дозы препаратов TRAIL достаточно высоки
DR5 B по сравнению с TRAIL, что способствует
(5-10 мг/кг веса), необходимо, чтобы уровень
формированию активных индуцирующих смерть
эндотоксинов в препарате TRAIL или DR5 B не
сигнальных комплексов и усилению сигнала
превышал 0,5 ед/кг [27]. Препараты были до
апоптоза.
полнительно очищены от эндотоксинов на спе
Таким образом, разработанная технология по
циальном эндотоксин связывающем сорбенте,
лучения противоопухолевого цитокина TRAIL и
что позволило снизить уровень до допустимой
его мутантного варианта DR5 B позволяет по
концентрации (<0,5 ед/мл).
лучить относительно недорогие препараты с вы
Рецептор селективный мутантный вариант
сокой степенью очистки и может быть применена
DR5 B эффективнее убивал опухолевые клетки
для наработки препаратов для терапии онкологи
HCT116 по сравнению с TRAIL, что было пока
ческих заболеваний различного происхождения.
зано нами ранее с препаратами, полученными
путем экспрессии слитных белков с тиоредокси
ном в штамме E. coli BL23(DE3) [15, 28]. Кроме
Финансирование. Работа была выполнена
того, DR5 B убивал клетки линии Jurkat не
при финансовой поддержке Российского фонда
только эффективнее, но и быстрее по сравне
фундаментальных исследований (грант № 18 34
нию с TRAIL, что не менее важно, так как пре
00812 и № 16 04 00668) и гранта Президиума
парат TRAIL довольно быстро вымывается из кро
РАН «Молекулярная и клеточная биология».
ви человека (период полувыведения ~30 мин) [29].
Соблюдение этических норм. Настоящая
Резистентные к TRAIL клетки Caco 2 были
статья не содержит описания каких либо иссле
весьма чувствительны к DR5 B. Возможно, из за
дований с участием людей или животных в каче
высокой поверхностной экспрессии рецептора
стве объектов.
DR5 [22] лиганд индуцированная олигомериза
Конфликт интересов. Авторы заявляют об от
ция этого рецептора выше при связывании с сутствии конфликта интересов.
СПИСОК ЛИТЕРАТУРЫ
1.
Guicciardi, M.E., and Gores, G.J. (2009) Life and death
8. Van Roosmalen, I.A., Quax, W.J., and Kruyt, F.A. (2014)
by death receptors, FASEB J., 23, 1625-1637, doi: 10.
Two death inducing human TRAIL receptors to target in
1096/fj.08 111005.
cancer: similar or distinct regulation and function?
2.
Pan, G., O’Rourke, K., Chinnaiyan, A.M., Gentz, R.,
Biochem. Pharmacol., 91, 447-456, doi: 10.1016/j.bcp.
Ebner, R., Ni, J., and Dixit, V.M. (1997) The receptor for
2014.08.010.
the cytotoxic ligand TRAIL, Science, 276, 111-113, doi: 10.
9. Gasparian, M.E., Ostapchenko, V.G., Yagolovich, A.V.,
1126/science.276.5309.111.
Tsygannik, I.N., Chernyak, B.V., Dolgikh, D.A., and
3.
Degli Esposti, M.A., Smolak, P.J., Walczak, H., Waugh, J.,
Kirpichnikov, M.P. (2007) Overexpression and refolding of
Huang, C.P., DuBose, R.F., Goodwin, R.G., and Smith, C.A.
thioredoxin/TRAIL fusion from inclusion bodies and fur
(1997) Cloning and characterization of TRAIL R3, a novel
ther purification of TRAIL after cleavage by enteropepti
member of the emerging TRAIL receptor family, J. Exp.
dase, Biotechnol. Lett., 29, 1567-1573, doi: 10.1007/
Med., 186, 1165-1170, doi: 10.1084/jem.186.7.1165.
s10529 007 9446 y.
4.
Degli Esposti, M.A., Dougall, W.C., Smolak, P.J., Waugh, J.Y.,
10. Lin, Z., Lei, H., and Cao, P. (2007) Expression, purifica
Smith, C.A., and Goodwin, R.G. (1997) The novel recep
tion, and in vitro refolding of soluble tumor necrosis fac
tor TRAIL R4 induces NF kappaB and protects against
tor related apoptosis inducing ligand (TRAIL), Protein
TRAIL mediated apoptosis, yet retains an incomplete
Expr. Purif., 51, 276-282, doi: 10.1016/j.pep.2006.07.026.
death domain, Immunity, 7, 813-820, doi: 10.1016/S1074
11. Wang, D., and Shi, L. (2009) High level expression, purifi
7613(00)80399 4.
cation, and in vitro refolding of soluble tumor necrosis fac
5.
Merino, D., Lalaoui, N., Morizot, A., Schneider, P.,
tor related apoptosis inducing ligand (TRAIL), Appl.
Solary, E., and Micheau, O. (2006) Differential inhibition
Biochem. Biotechnol., 157, 1-9, doi: 10.1007/s12010 007
of TRAIL mediated DR5 DISC formation by decoy
8079 x.
receptors 1 and 2, Mol. Cell. Biol., 26, 7046-7055, doi: 10.
12. Ashkenazi, A., Pai, R.C., Fong, S., Leung, S., Lawrence, D.A.,
1128/MCB.00520 06.
Marsters, S.A., Blackie, C., Chang, L., McMurtrey, A.E.,
6.
Clancy, L., Mruk, K., Archer, K., Woelfel, M.,
Hebert, A., DeForge, L., Koumenis, I.L., Lewis, D.,
Mongkolsapaya, J., Screaton, G., Lenardo, M.J., and
Harris, L., Bussiere, J., Koeppen, H., Shahrokh, Z., and
Chan, F.K. (2005) Preligand assembly domain mediated
Schwall, R.H. (1999) Safety and antitumor activity of
ligand independent association between TRAIL receptor 4
recombinant soluble Apo2 ligand, J. Clin. Invest., 104,
(TR4) and TR2 regulates TRAIL induced apoptosis, Proc.
155-162, doi: 10.1172/JCI6926.
Natl. Acad. Sci. USA, 102, 18099-18104, doi: 10.1073/
13. Do, B.H., Nguyen, M.T., Song, J.A., Park, S., Yoo, J., and
pnas.0507329102.
Jang, J. (2017) Soluble prokaryotic expression and purifi
7.
Nguyen, P.T., Nguyen, D., Chea, C., Miyauchi, M., Fujii, M.,
cation of bioactive tumor necrosis factor related apoptosis
and Takata, T. (2018) Interaction between N cadherin and
inducing ligand, J. Microbiol. Biotechnol., 27, 2156-2164,
decoy receptor 2 regulates apoptosis in head and neck can
doi: 10.4014/jmb.1705.05070.
cer, Oncotarget, 9, 31516-31530, doi: 10.18632/oncotar
14. Gasparian, M.E., Chernyak, B.V., Dolgikh, D.A.,
get.25846.
Yagolovich, A.V., Popova, E.N., Sycheva, A.M.,
БИОХИМИЯ том 84 вып. 6 2019
818
ЯГОЛОВИЧ и др.
Moshkovskii, S.A., and Kirpichnikov, M.P.
(2009)
23. Valley, C.C., Lewis, A.K., Mudaliar, D.J., Perlmutter, J.D.,
Generation of new TRAIL mutants DR5 A and DR5 B
Braun, A.R., Karim, C.B., Thomas, D.D., Brody, J.R.,
with improved selectivity to death receptor 5, Apoptosis, 14,
and Sachs, J.N. (2012) Tumor necrosis factor related
778-787, doi: 10.1007/s10495 009 0349 3.
apoptosis inducing ligand (TRAIL) induces death receptor
15.
Gasparian, M.E., Bychkov, M.L., Yagolovich, A.V., Dol
5 networks that are highly organized, J. Biol. Chem., 287,
gikh, D.A., and Kirpichnikov, M.P. (2015) Mutations enhan
21265-21278, doi: 10.1074/jbc.M111.306480.
cing selectivity of antitumor cytokine TRAIL to DR5 recep
24. Chekkat, N., Lombardo, C.M., Seguin, C., Lechner, M.C.,
tor increase its cytotoxicity against tumor cells, Biochemistry
Dufour, F., Nomine, Y., De Giorgi, M., Frisch, B.,
(Moscow), 80, 1080-1091, doi: 10.1134/S0006297915080143.
Micheau, O., Guichard, G., Altschuh, D., and Fournel, S.
16.
Simpson, R.J. (2010) Rapid coomassie blue staining of
(2018) Relationship between the agonist activity of syn
protein gels, Cold Spring Harb. Protoc., 2010, pdb.prot5413,
thetic ligands of TRAIL R2 and their cell surface binding
doi: 10.1101/pdb.prot5413.
modes, Oncotarget, 9, 15566-15578, doi: 10.18632/onco
17.
Switzer, R.C. 3rd, Merril, C.R., and Shifrin, S. (1979)
target.24526.
A highly sensitive silver stain for detecting proteins and
25. Zhang, M., Wang, Z., Chi, L., Sun, J., and Shen, Y. (2018)
peptides in polyacrylamide gels, Anal. Biochem., 98,
Enhanced production of soluble tumor necrosis factor
231-237, doi: 10.1016/0003 2697(79)90732 2.
related apoptosis inducing ligand in Escherichia coli using
18.
Bradford, M.M. (1976) A rapid and sensitive method for
a novel self cleavable tag system Fh8 ΔI CM, Protein Expr.
the quantitation of microgram quantities of protein utili
Purif., 148, 16-23, doi: 10.1016/j.pep.2018.03.005.
zing the principle of protein dye binding, Anal. Biochem.,
26. Malyala, P., and Singh, M. (2008) Endotoxin limits in for
72, 248-254, doi: 10.1016/0003 2697(76)90527 3.
mulations for preclinical research, J. Pharm. Sci., 97,
19.
Lobstein, J., Emrich, C.A., Jeans, C., Faulkner, M., Riggs, P.,
2041-2044, doi: 10.1002/jps.21152.
and Berkmen, M. (2012) SHuffle, a novel Escherichia coli
27. Herbst, R.S., Eckhardt, S.G., Kurzrock, R., Ebbinghaus, S.,
protein expression strain capable of correctly folding disul
O’Dwyer, P.J., Gordon, M.S., Novotny, W., Goldwasser, M.A.,
fide bonded proteins in its cytoplasm, Microb. Cell Fact.,
Tohnya, T.M., Lum, B.L., Ashkenazi, A., Jubb, A.M., and
11, 56, doi: 10.1186/1475 2859 11 56.
Mendelson, D.S. (2010) Phase I dose escalation study of
20.
Reichelt, P., Schwarz, C., and Donzeau, M. (2006) Single
recombinant human Apo2L/TRAIL, a dual proapoptotic
step protocol to purify recombinant proteins with low
receptor agonist, in patients with advanced cancer, J. Clin.
endotoxin contents, Protein Expr. Purif., 46, 483-488,
Oncol., 28, 2839-2846, doi: 10.1200/JCO.2009.25.1991.
doi: 10.1016/j.pep.2005.09.027.
28. Gasparian, M.E., Bychkov, M.L., Yagolovich, A.V.,
21.
Szegezdi, E, van der Sloot, A.M., Mahalingam, D.,
Kirpichnikov, M.P., and Dolgikh, D.A. (2017) The effect
O’Leary, L., Cool, R.H., Munoz, I.G., Montoya, G.,
of cisplatin on cytotoxicity of anticancer cytokine TRAIL
Quax, W.J., de Jong, S., Samali, A., and Serrano, L. (2012)
and its receptor selective mutant variant DR5 B, Dokl.
Kinetics in signal transduction pathways involving promis
Biochem. Biophys.,
477,
385-388, doi:
10.1134/
cuous oligomerizing receptors can be determined by recep
S1607672917060114.
tor specificity: apoptosis induction by TRAIL, Mol. Cell.
29. Soria, J.C., Smit, E., Khayat, D., Besse, B., Yang, X., Hsu, C.P.,
Proteomics, 11, doi: 10.1074/mcp.M111.013730.
Reese, D. Wiezorek, J., and Blackhall, F. (2010) Phase 1b
22.
Van Geelen, C.M., de Vries, E.G., Le, T.K., van Weeghel, R.P.,
study of dulanermin (recombinant human Apo2L/TRAIL)
and de Jong, S. (2003) Differential modulation of the
in combination with paclitaxel, carboplatin, and beva
TRAIL receptors and the CD95 receptor in colon carcino
cizumab in patients with advanced non squamous non
ma cell lines, Br. J. Cancer, 89, 363-373, doi: 10.1038/
small cell lung cancer, J. Clin. Oncol., 28, 1527-1533,
sj.bjc.6601065.
doi: 10.1200/JCO.2009.25.4847.
A NEW EFFICIENT METHOD FOR PRODUCTION OF THE RECOMBINANT
ANTITUMOR CYTOKINE TRAIL AND ITS RECEPTOR SELECTIVE
VARIANT DR5 B
A. V. Yagolovich1,2, A. A. Artykov1,2, D. A. Dolgikh1,2, M. P. Kirpichnikov1,2, and M. E. Gasparian1*
1 Shemyakin-Ovchinnikov Institute of Bioorganic Chemistry, Russian Academy of Sciences,
117997 Moscow, Russia; E=mail: marine_gasparian@yahoo.com
2 Lomonosov Moscow State University, Faculty of Biology, 119991 Moscow, Russia
Received December 19, 2018
Revised February 25, 2019
Accepted February 26, 2019
Cytokine TRAIL induces apoptosis in tumor cells of various origins, without affecting normal cells. Clinical trials of
TRAIL receptors’ (DR4 and DR5) agonists (recombinant TRAIL or death receptors antibodies) have largely failed
because most human tumors were resistant to them. Currently, a second generation of agents targeted at TRAIL R
with increased efficiency has been developed. To this end, we have developed DR5 B, a version of TRAIL selectively
interacting with DR5. We have developed a new efficient method for production of TRAIL and DR5 B using expres
sion of these proteins in Escherichia coli strain SHuffle B. The proteins were isolated from the cytoplasmic fraction of
cells and purified to a high degree of homogeneity using metal affinity and ion exchange chromatography. The pro
tein yield was 211 and 173 mg from one liter of cell culture for DR5 B and TRAIL, respectively, which significantly
exceeded the results obtained using other methods. The DR5 B more efficiently and rapidly killed tumor cells of dif
ferent origin compared with TRAIL. The resulting preparations can be used for the study of TRAIL signaling path
ways and in preclinical and clinical trials as antitumor agents.
Keywords: cytokine TRAIL, mutant variant DR5 B, strain E. coli SHuffle B, cancer therapy
БИОХИМИЯ том 84 вып. 6 2019