БИОХИМИЯ, 2019, том 84, вып. 6, с. 819 - 826
УДК 577.12
ЗАЩИТНОЕ ВЛИЯНИЕ ПЕРОКСИРЕДОКСИНА 6
НА БЕТА КЛЕТКИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
RIN m5F ПРИ ТОКСИЧЕСКИХ ВОЗДЕЙСТВИЯХ
ГЛЮКОЗЫ И ЦИТОКИНОВ*
© 2019 Е.Г. Новоселова**, О.В. Глушкова, С.Б. Парфенюк,
М.О. Хренов, С.М. Лунин, Т.В. Новоселова, М.Г. Шарапов,
И.А. Шаев, В.И. Новоселов
Институт биофизики клетки ФИЦ ПНЦБИ РАН, 142290 Пущино,
Московская обл., Россия; электронная почта: elenanov_06@mail.ru
Поступила в редакцию 14.01.2019
После доработки 18.03.2019
Принята к публикации 18.03.2019
С учетом особой роли бета клеток поджелудочной железы при развитии сахарного диабета было проведено
исследование влияния пероксиредоксина 6 (Prx6) на жизнеспособность и функциональную активность бе
та клеток инсулиномы крыс (линия RIN m5F) в условиях, моделирующих диабет. С этой целью клетки
культивировали при повышенных концентрациях глюкозы в среде или в присутствии провоспалительных
цитокинов (TNF α и IL 1), известных своей особой ролью в цитотоксических аутоиммунных реакциях при
диабете. Было установлено, что повышение концентрации глюкозы в пределах 23-43 мМ вызывает гибель
20-60% бета клеток. Добавление Prx6 вызывает снижение уровня активных форм кислорода и защищает
бета клетки от гипергликемии, снижая гибель клеток RIN m5F в несколько раз. Исследование секреции
инсулина бета клетками RIN m5F показало значительный стимулирующий эффект пероксиредоксина 6 на
инсулин продуцирующую активность бета клеток поджелудочной железы. Интересно, что стимулирующая
активность Prx6 была обнаружена как при культивировании бета клеток в нормальных условиях, так и в
неблагоприятных условиях, вызывающих гибель клеток. Было показано, что в качестве одного из механиз
мов действия пероксиредоксина 6 на бета клетки может быть регуляция активности сигнального каскада
NF κB, в частности, через активацию фосфорилирования RelA/p65 по Ser536.
КЛЮЧЕВЫЕ СЛОВА: пероксиредоксин 6, гипергликемия, цитокины, бета клетки RIN m5F, продукция
инсулина, сигнальный каскад NF κB.
DOI: 10.1134/S0320972519060071
Нарушение функций бета клеток поджелу
большинство панкреатических бета клеток че
дочной железы является общим признаком са
рез механизм активации аутореактивных Т лим
харного диабета 1 и 2 типа. Сахарный диабет 1
фоцитов, что приводит к накоплению глюкозы в
типа является аутоиммунным заболеванием, ко
крови и вызывает необходимость регулярного
торое возникает из за разрушения инсулин
пожизненного применения инсулина больным с
продуцирующих бета клеток поджелудочной
диабетом первого типа [1]. Для сахарного диабе
железы в результате атаки аутореактивных кло
та 2 типа, который является серьезным метабо
нов цитотоксических Т лимфоцитов. Это забо
лическим заболеванием, основным критерием
левание проявляется в том случае, когда гибнет
является не разрушение, а дисфункция бета
клеток, а также нарушение инсулиновой резис
тентности. Этот процесс называют «токсич
Принятые сокращения: Prx6 - пероксиредоксин 6;
клетки линии RIN m5F - клетки инсулиномы крыс; SОD -
ностью глюкозы» [2]. Окислительный стресс,
супероксиддисмутаза; GPx - глутатионпероксидаза; IL - ин
который возникает при развитии диабета 1 и 2
терлейкин; АФК - активные формы кислорода; NF κB - ядер
типа, считается главным патофизиологическим
ный фактор каппа Би; TNF α фактор некроза опухолей.
фактором сахарного диабета [3]. В мировой ли
* Первоначально английский вариант рукописи опублико
тературе имеются сведения о применении анти
оксидантов, в основном низкомолекулярных
msu.ru/biokhimiya, в рубрике «Papers in Press», BM 19 011,
29.04.2019.
природных и синтетических веществ, для лече
** Адресат для корреспонденции.
ния различных патологий, сопряженных с са
819
820
НОВОСЕЛОВА и др.
харным диабетом [4, 5]. Между тем имеются все
Санкт Петербург, Россия) выращивали во фла
основания считать, что ферменты антиокси
конах для культивирования в среде, состоящей
данты могут быть более эффективными по сво
из смеси RPMI 1640 и DMEM («ПанЭко», Рос
ей способности нейтрализовать активные фор
сия) в соотношении 1 : 1, с добавлением 10% ной
мы кислорода (АФК) по сравнению с низкомо
эмбриональной телячьей сыворотки («Thermo»,
лекулярными антиоксидантами. Ранее мы пока
Великобритания) и смеси антибиотиков (пени
зали терапевтический эффект рекомбинантного
циллин - 100 мкг/мл, стрептомицин - 100 мкг/мл,
пероксиредоксина 6 (Prx6) при различных пато
гентамицин - 50 мкг/мл), с низким содержани
логиях, связанных с окислительным стрессом,
ем глюкозы (8,0 мМ) при 37 °C, в атмосфере 5%
например, механических и термических травмах
CO2. В экспериментах были использованы клет
кожи, химических ожогах дыхательных путей,
ки после 3-7 пассажей. Для индукции гипер
гипоксии реперфузии кишечника [6-8]. При
гликемии добавляли глюкозу в диапазоне кон
этом было доказано, что антиокислительная ак
центраций 15-35 мМ, конечная концентрация
тивность Prx6 значительно превышает актив
глюкозы составляла 23-43 мМ. Для индукции
ность известных белков антиоксидантов - супер
цитокин индуцированного апоптоза добавляли
оксиддисмутазы (SОD), каталазы и глутатион
смесь провоспалительных цитокинов: фактор
пероксидазы (GPx). Полагаем, что Prx6 может
некроза опухолей (TNF α) (30 нг/мл) и интер
быть эффективным в качестве агента, подавля
лейкин (IL 1β) (15 нг/мл). Пероксиредоксин 6 в
ющего уровень окислительного стресса при са
концентрации 150 мкг/мл добавляли за 30 мин
харном диабете. Действительно, в сравнении с
до внесения глюкозы/цитокинов. В пределах
другими тканями млекопитающих, в бета клет
каждого независимого эксперимента характе
ках поджелудочной железы содержатся более
ристики образцов измеряли параллельно в 9-12
низкие уровни ферментов антиоксидантов, та
повторах, получая среднее значение. Усреднен
ких как SOD, каталаза и GPx, что делает эти
ные значения по четырем экспериментам ис
клетки более чувствительными к повреждающе
пользовали для определения достоверности раз
му действию АФК [9]. В условиях дефицита эн
личий между группами (n = 4). В качестве конт
догенных ферментов антиоксидантов возраста
ролей использовали клетки, не подвергавшиеся
ет интерес к использованию новых белков, об
дополнительной обработке глюкозой, цитоки
ладающих антиокислительной активностью и
нами или Prx6.
способных защитить бета клетки поджелудоч
Тест на выживаемость (цитотоксический тест).
ной железы при развитии диабета. В нашей ра
Клетки RIN m5F культивировали в 96 луноч
боте впервые изучали эффективность Prx6 для
ных планшетах («TPP», Швейцария) по 100 мкл
снижения повреждающих эффектов в отноше
(2 × 104 клеток) в лунку в среде RPMI 1640 («Пан
нии панкреатических бета клеток инсулиномы
Эко», Россия), содержащей 10% эмбриональной
крыс (линии RIN m5F), культивируемых в усло
телячьей сыворотки, 2,04 мМ L глютамина
виях, вызывающих апоптоз и подавление инсу
(«ПанЭко», Россия), 100 мкг/мл стрептомицина
лин продуцирующей активности этих клеток.
при 37 °С, в атмосфере 5% CO2. Через 24 ч куль
Ранее мы показали, что в развитии диабета у
тивирования к образованному монослою клеток
животных участвует система сигнальной транс
RIN m5F добавляли 1 мкг/мл актиномицина D
дукции иммунных клеток, при этом особая роль
(«Sigma», США), затем добавляли глюкозу,
принадлежит каскаду NF κB [10]. Действитель
и/или цитокины и Prx6. Через 24 ч культивиро
но, мы установили, что использование ингиби
вания промытый три раза PBS монослой кле
тора этого сигнального пути значительно снижа
ток мишеней окрашивали в течение 10 мин
ет уровень иммунного дисбаланса в клетках мы
0,05% кристаллвиолетом («Sigma», США), лунки
шей с аллоксан индуцированным диабетом [11].
тщательно промывали проточной дистиллиро
В настоящей работе в условиях in vitro важно бы
ванной водой, и в каждую лунку добавляли по
ло изучить влияние Prx6 в бета клетках на ак
100 мкл 1% ного додецилсульфата натрия. Пог
тивность NF κB, как одного из ключевых путей,
лощение измеряли через 10 мин при 546 нм на
участвующих в регуляции провоспалительного
спектрофотометре для планшетов Titertek
ответа при окислительном стрессе.
Multiscan MCC/340 («Flow Laboratories», Фин
ляндия).
Измерение концентрации инсулина. Клетки
МЕТОДЫ ИССЛЕДОВАНИЯ
RIN m5F культивировали в 24 луночных план
шетах («TPP», Швейцария) по 1 мл (1,5 × 106 кле
Культивирование клеток линии RIN m5F. Клет
ток) на каждую лунку в среде RPMI 1640, содер
ки инсулиномы крыс (линия RIN m5F) (ЦКП
жащей 10% эмбриональной телячьей сыворот
«Коллекция культур клеток позвоночных»,
ки, 2,04 мМ L глютамина, 100 мкг/мл стрепто
БИОХИМИЯ том 84 вып. 6 2019
ВЛИЯНИЕ Prx6 НА БЕТА КЛЕТКИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
821
мицина при 37 °С, в атмосфере 5% CO2. Через 24 ч
Для выявления белков использовали систе
культивирования к образованному монослою
му ECL («GE Healthcare», Швеция). Фотогра
клеток RIN m5F добавляли глюкозу или цито
фии полос были получены с помощью транс
кины и/или Prx6 в концентрациях, указанных
иллюминатора TFX 35.WL («Vilber Lourmat»,
выше. Затем через 24 ч клетки разрушали 3× за
Франция). Количественную оценку белков пос
мораживанием оттаиванием. Образцы центри
ле денситометрии проводили с использованием
фугировали («ELMI», Латвия) при 3000 g в тече
программы Qapa (Ver. 3.7). Было проведено по
ние 10 мин, супернатант использовали для даль
3 независимых эксперимента (используя клетки
нейшего анализа. Для определения концентра
от разных пассажей) для каждого белка. Полу
ции инсулина были использованы коммерчес
ченные цифровые данные нормировали к соот
кие наборы для определения инсулина крысы с
ветствующему контролю нагрузки (полосам
помощью иммуноферментного анализа Rat
GAPDH) и выражали в относительных единицах.
Insulin,INS ELISA Kit («Cloud Clone Corp.», Ки
Статистический анализ проводили с исполь
тай). Все последующие манипуляции были про
зованием t критерия Стьюдента.
ведены в соответствии с протоколами проведе
ния анализа, которые были приложены к набо
ру. Поглощение измеряли при 450 нм на спект
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
рофотометре для планшетов Titertek Multiscan
MCC/340.
Влияние пероксиредоксина 6 на жизнеспо
Определение активных форм кислорода с ис
собность панкреатических бета клеток изучали
пользованием карбокси Н2DCFDA. Клетки RIN
в системе in vitro с использованием линии кле
m5F предварительно культивировали в течение
ток инсулиномы RIN m5F. Известно, что про
24 ч в 96 ти луночном планшете (2,5 × 104 клеток
лиферативная и регенерационная способности
на лунку в 100 мкл среды DMEM), отмывали
панкреатических бета клеток тесно связаны с ко
PBS и добавляли свежеприготовленный раствор
личеством высвобождаемого инсулина; действи
карбокси Н2DCFDA («Invitrogen», США) в сте
тельно, существует обратная связь между секре
рильном DMSO в конечной концентрации 2,5 мкM
цией инсулина и концентрацией глюкозы в кро
в среде с обедненной эмбриональной телячьей
ви [14]. Бета клетки линии RIN m5F использо
сывороткой (2%). Клетки инкубировали с кар
вали в качестве модели сахарного диабета, при
бокси Н2DCFDA в темноте 1 ч, затем добавляли
этом исследовали жизнеспособность этих кле
Prx6 и глюкозу и инкубировали еще 1 ч. В качестве
ток при их культивировании в неблагоприятных
контроля использовали клетки без добавок Prx6
условиях (повышенное содержание глюкозы и
и глюкозы. Зеленую флуоресценцию измеряли с
провоспалительных цитокинов), а также опре
помощью флуоресцентного планшет ридера Infi
деляли секрецию инсулина, уровень апоптоза,
nite 200 («Tecan», Австрия) при длине волны воз
активность сигнального каскада NF κB и эф
буждения 480 нм и длине волны поглощения 530 нм
фективность защитного действия Prx6. Кроме
(Ex/Em = 485/535 nm), как описано ранее [12].
того, тестировали антиоксидантную активность
Ds Na ПААГ электрофорез и иммуноблотинг.
Prx6 в клетках c использованием зонда карбокси
Для приготовления образцов 2 × 106 клеток ли
H2DCFDA. Результаты показали, что добавле
зировали с помощью ультразвукового дезинтег
ние Prx6 достоверно снижает уровень АФК в
ратора («UZDN 2T», Россия) на льду при посто
клетках RIN m5F, культивируемых в присут
янном помешивании в течение 2 мин. Белок
ствии 33 мМ глюкозы (таблица).
осаждали с помощью ацетона и добавляли 2×
солюбилизирующий буфер (50 мМ Тris НCl, 2%
Ds Na, 25% (v/v) глицерина, 5% β меркаптоэта
Влияние Prx6 на уровень АФК в клетках RIN m5F в присут
нола и 0,1% бромфенолового синего, рН 6,8) в
ствии повышенного содержания глюкозы
соотношении 1 : 1. Образцы кипятили в течение
Контроль
Prx 6
Глюкоза
Глюкоза + Prx6
5 мин. Конечная концентрация белка в образцах
составляла 1 мг/мл (белок определяли по методу
Бредфорда [13]), образцы наносились по 10 мкл
100 ± 10,5
115,6 ± 8,52
* 182,8 ± 14,6
# 137,5 ± 20,8
в каждую лунку. Наличие белков в образцах оп
ределяли методом Вестерн блот анализа с ис
Примечание. Клетки инкубировали 1 ч в присутствии флуо
пользованием наборов следующих антител: кро
ресцентного красителя карбокси H2DCFDA и 33 мМ глю
козы и/или Prx6 (150 мг/мл). Каждое значение - уровень
личьи антитела к ph NF κB (Ser276) («Santa
зеленой флуоресценции, средний от 9-12 повторов, рас
Cruz», США); кроличьи антитела к ph NF κB
считанный в % от контроля.
(Ser536) и кроличьи антитела к caspase 3 («Cell
* Достоверное отличие от контроля, р < 0,01; # - достовер
Signaling», США).
ное отличие от группы «глюкоза», р < 0,05.
БИОХИМИЯ том 84 вып. 6 2019
822
НОВОСЕЛОВА и др.
экспозиции клеток в этих же условиях погибало
более 60% клеток.
Влияние пероксиредоксина 6 на выживаемость
бета клеток в условиях гипергликемии. В следую
щей серии экспериментов исследовали выжива
емость бета клеток RIN m5F при повышении
концентрации глюкозы в среде культивирова
ния, при этом изучали эффект добавления в сре
ду культивирования клеток Prx6. Результаты
этих исследований представлены на рис. 2. По
казано, что повышение концентрации глюкозы
в пределах 23-43 мМ вызывает гибель 20-60%
бета клеток. Добавление Prx6 достоверно защи
щает бета клетки от гипергликемии, снижая
число погибших клеток 5× (при концентрации
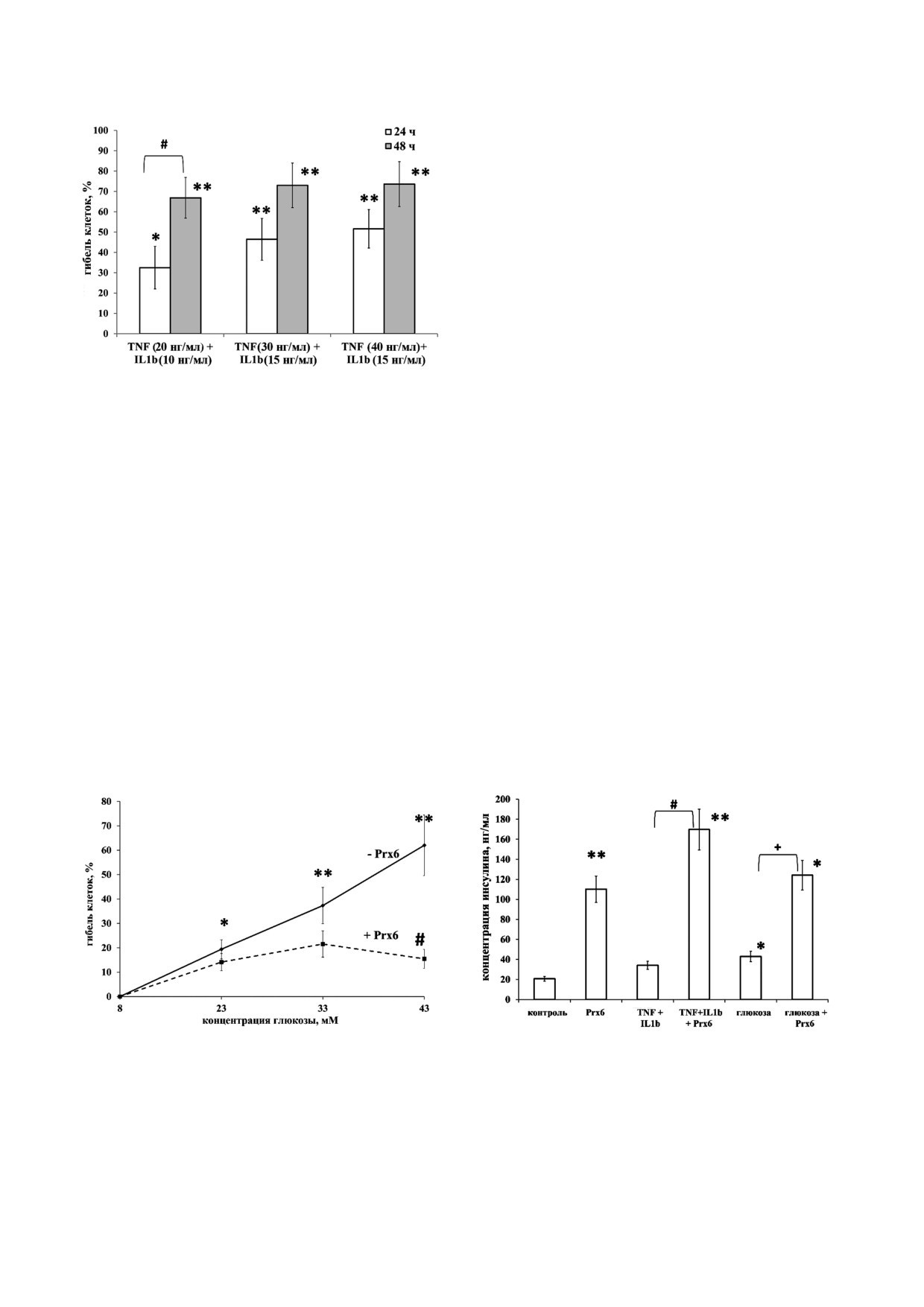
Рис. 1. Гибель бета клеток RIN m5F при их культивирова
глюкозы 43 мМ). Полученные результаты ка
нии в течение 24 и 48 ч в присутствии цитокинов. * Досто
верное отличие от контроля, р < 0,05; ** достоверное отли
жутся очень важными, поскольку прямая защи
чие от контроля, р < 0,01
та бета клеток поджелудочной железы от гибели
в условиях гипергликемии с применением пе
Исследование влияния провоспалительных
роксиредоксина 6 позволяет предположить эф
цитокинов на выживаемость клеток. На рис. 1 по
фективность этого фермента антиоксиданта и в
казаны результаты измерения выживаемости
условиях in vivo. Сохранение бета клеток в неб
бета клеток в присутствии провоспалительных
лагоприятных условиях гипергликемии при до
цитокинов TNF α и IL 1β. Показано, что до
бавлении Prx6 ставит вопрос о том, какова
бавление смеси двух провоспалительных цито
функциональная активность этих клеток, ос
кинов индуцирует гибель бета клеток поджелу
новная роль которых связана с секрецией инсу
дочной железы при времени культивирования
лина.
клеток в течение 24 и 48 ч. При этом цитотокси
Влияние пероксиредоксина 6 на секрецию ин
ческий эффект провоспалительных цитокинов
сулина бета клетками RIN m5F. Результаты, по
увеличивался, как при увеличении длительно
казанные на рис. 3, демонстрируют значитель
сти культивирования, так и при увеличении кон
ный стимулирующий эффект Prx6 на инсулин
центрации добавленных цитокинов. Так, при
продуцирующую активность бета клеток под
культивировании клеток в течение 24 ч с макси
желудочной железы. Интересно, что стимулиру
мальной концентрацией цитокинов (40 нг для
ющая активность Prx6 была обнаружена как при
TNF α и 15 нг для IL 1β) гибель клеток RIN
культивировании бета клеток в нормальных ус
m5F составляла 50%, а при увеличении времени
ловиях, так и в неблагоприятных условиях, вы
Рис. 2. Защитное действие Prx6 на жизнеспособность кле
Рис. 3. Продукция инсулина клетками RIN m5F при их
ток RIN m5F, культивируемых 24 ч в среде с высоким со
культивировании 24 ч при добавлении в среду культивиро
держанием глюкозы. * Достоверное отличие от контроля,
вания глюкозы (33 мМ), цитокинов (40 нг/мл TNF α и
р < 0,05; ** достоверное отличие от контроля, р < 0,01; # дос
15 нг/мл IL 1β), Prx6 и их комбинаций. * Достоверное от
товерное отличие от клеток, культивируемых без Prx6 в
личие от контроля, р < 0,01; # достоверное отличие от груп
присутствии 35 мМ глюкозы, р < 0,01
пы «цитокины», р < 0,01; + достоверное отличие от группы
«глюкоза», р < 0,01
БИОХИМИЯ том 84 вып. 6 2019
ВЛИЯНИЕ Prx6 НА БЕТА КЛЕТКИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
823
зывающих гибель клеток. Действительно, и в
стресс, NF κB активируется путем фосфорили
присутствии цитокинов, и в условиях гипергли
рования IκB и высвобождения димера p65, что
кемии, добавление Prx6 в среду культивирова
вызывает транслокацию NF κB в ядро и запуск
ния резко увеличивало инсулин продуцирую
экспрессии генов, регулирующих продукцию
щую активность клеток.
цитокинов [16]. Известно, что именно посттранс
Влияние пероксиредоксина 6 на апоптоз и ак
ляционные модификации сигнального белка
тивность каскада NF κB в бета клетках RIN m5F.
р65/NF κB определяют его транскрипционную
Уровень апоптоза бета клеток RIN m5F оцени
специфичность. Наиболее важными сайтами фос
вали по измерению соотношения активирован
форилирования p65 являются Ser276 и Ser536.
ной/неактивированной каспазы 3 (рис. 4, а).
Ser536 фосфорилируется киназами IKK, TANK
Показали, что при повышенном содержании
(TBK1) и RSK1. Фосфорилирование Ser276 обыч
глюкозы в среде культивирования клеток (33 мМ)
но происходит при участии протеинкиназы А
наблюдается достоверное повышение уровня
(PKA) в цитоплазме и киназы MSK1 в ядре [17].
апоптоза. При этом присутствие Prx6 в среде
Посттрансляционная модификация p65 при
полностью устраняло эффект гипергликемии,
фосфорилировании Ser536 описана практичес
нормализуя соотношение активированной и не
ки при всех известных видах неспецифических
активированной каспазы 3.
ответов клетки, ее биологическая роль сходна с
Фактор транскрипции NF κB является клю
функцией фосфо p65 (Ser276). В то время как
чевым участником ответа клетки на стресс, по
активация по Ser276 способствует увеличению
вреждение и воспаление [15]. В цитоплазме NF κB
периода полураспада p65 [18], фосфорилирова
присутствует в качестве p65/p50 гетеродимера,
ние Ser536 с участием IKK связано с усилением
который поддерживается в неактивном состоя
протеосомной деградации этого транскрипцион
нии IκB белками. В ответ на воздействие раз
ного фактора в активированных макрофагах [19].
личных факторов, включая окислительный
Таким образом, фосфорилирование p65 по
Рис. 4. Влияние Prx6 на апоптоз бета клеток RIN m5F (a) и на активность сигнального каскада NF κB (б) при культиви
ровании клеток в присутствии 33 мМ глюкозы в течение 24 ч. Показаны фотографии полос от одного эксперимента, ги
стограммы показывают средние значения от трех независимых экспериментов. а - Гистограммы под полосками - соотно
шение двух форм каспаз; * достоверное отличие от контроля, р < 0,05; # достоверное отличие между группами «глюкоза»
и «Prx6 + глюкоза», р < 0,01. б - гистограммы под полосками - результаты денситометрии полос, в относительных еди
ницах. * Достоверное отличие от контроля, р < 0,05; # достоверное отличие между группами «глюкоза» и «Prx6 + глюкоза».
GAPDH (Глицеральдегид 3 фосфатдегидрогеназа) - контроль загруженности полосок
БИОХИМИЯ том 84 вып. 6 2019
824
НОВОСЕЛОВА и др.
Ser276, скорее всего, связано с выживаемостью
ловиях гипергликемии, с использованием Prx6.
клеток, тогда как фосфорилирование по Ser536
Это новые данные, неизвестные в мировой ли
может приводить к гибели клеток путем апопто
тературе, указывающие на перспективность
за. Активность сигнального каскада NF κB оце
применения этого препарата для снижения па
нивали по фосфорилированию RelA/p65 по двум
тологических последствий сахарного диабета.
сериновым остаткам (Ser276 и Ser536) (рис. 4, б).
Известно, что провоспалительные цитокины
Показали, что культивирование клеток в присут
(TNF α и IL 1β) являются важными участника
ствии 33 мМ глюкозы 2× увеличивает фосфори
ми патогенеза диабета 1 типа [20], при этом ми
лирование RelA/p65 по Ser276, но не изменяет
шенью этих цитокинов являются бета клетки.
фосфорилирование по Ser536. Интересно, что
Механизм разрушительного воздействия IL 1β
добавление к клеткам Prx6 приводит к еще более
реализуется через ингибирование фактора транс
значительному фосфорилированию RelA/p65 по
крипции MafA и транскрипции гена инсулина [21].
Ser536, при этом не изменяется фосфорилиро
Продукция и секреция этого цитокина, индуци
вание NF κB по Ser276. Важно отметить, что в
руемая высоким содержанием глюкозы, способ
отсутствие повышенного содержания глюкозы,
ствует гибели бета клеток [22]. В настоящей ра
добавление Prx6 также значительно повышает
боте мы показали, что присутствие TNF α и IL 1β
активность каскада NF κB, не влияя при этом
приводит к снижению выживаемости RIN m5F
на уровень апоптоза RIN m5F клеток.
клеток, при этом добавление Prx6 в среду куль
Таким образом, Prx6 в условиях in vitro оказы
тивирования защищает клетки от токсического
вает очевидный защитный эффект на бета клет
действия цитокинов, способствуя повышению
ки, повышая их выживаемость и инсулин проду
их способности продуцировать инсулин. Таким
цирующую активность в условиях повышенного
образом, удалось установить, что в присутствии
содержания глюкозы. Доказано, что влияние
Prx6 бета клетки поджелудочной железы, культи
Prx6 на бета клетки осуществляется через акти
вируемые в неблагоприятных условиях (напри
вацию сигнального каскада NF κB путем увели
мер, при высоком содержании глюкозы или в
чения фосфорилирования RelA/p65 по Ser536.
присутствии провоспалительных цитокинов),
сохраняют способность к повышенной секре
ции инсулина. Считаем, что это является самым
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
важным результатом настоящей работы.
Возникает вопрос о механизме воздействия
Известно, что дисфункция бета клеток под
Prx6 на секрецию инсулина бета клетками, ко
желудочной железы является ключевым процес
торые культивируются в обычных условиях.
сом в развитии и прогрессировании сахарного
Действительно, Prx6 приводит к стимуляции
диабета, а нарушение функций бета клеток спо
выработки инсулина независимо от присут
собствуют снижению секреции инсулина и по
ствия добавок глюкозы или цитокинов. Другие
следующему ускоренному развитию патологии.
авторы, изучая влияние фермента антиокси
В нашей работе для защиты RIN m5F бета кле
данта (пероральный миметик GPx) на измене
ток впервые использовали фермент антиокси
ние уровня инсулина в крови молодых крыс по
дант пероксиредоксин 6, при этом были получе
мере их взросления, показали, что к 14 й неделе
ны впечатляющие результаты, доказывающие
количество инсулина у животных, получающих
эффективность применения Prx6 как для сни
антиоксидант, достоверно возрастало [23]. Авто
жения уровня апоптоза бета клеток в условиях
ры считают, что это объясняется повышением
гипергликемии, так и для восстановления их
содержания двух транскрипционных факторов
способности секретировать инсулин.
(Pdx1 и белка MafA), важных для синтеза инсу
В этой связи было важно исследовать влия
лина. Вполне возможно, что Prx6 также может
ние Prx6 на инсулин секреторную функцию бе
участвовать в регуляции продукции инсулина,
та клеток, а также на выживаемость этих клеток
причем это предположение в дальнейшем необ
в неблагоприятных условиях, вызванных присут
ходимо проверить.
ствием цитокинов или повышенного содержа
Анализируя разные патологии, сопряжен
ния глюкозы. В настоящем исследовании клет
ные с окислительным стрессом у животных, ус
ки RIN m5F, выращенные в среде с высоким со
тановили, что механизм защитного действия
держанием глюкозы, были менее жизнеспособ
Prx6 обусловлен, по крайней мере, двумя обстоя
ны по сравнению с клетками, выращенными в
тельствами: во первых, пероксидазной актив
условиях с низкой концентрацией глюкозы, что
ностью фермента и, во вторых, сигнально регу
не противоречит известным данным. Однако
ляторной функцией Prx6, которая не связана с
нам удалось достичь значительного увеличения
его пероксидазной активностью, как указано в
выживаемости клеток, культивированных в ус
нашем обзоре [24].
БИОХИМИЯ том 84 вып. 6 2019
ВЛИЯНИЕ Prx6 НА БЕТА КЛЕТКИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
825
Судя по результатам предыдущих исследова
и развитие диабета 1 типа у трансгенных NOD
ний, активация NF κB может запускать про
мышей, и свидетельствует о том, что NF κB мо
или анти апоптотические каскады [25]. Извест
жет играть анти апоптотическую роль в бета
но, что бета клетки поджелудочной железы яв
клетках мышей NOD и потенциально может
ляются мишенями аутоиммунной атаки, кото
предотвратить развитие диабета. В настоящей
рая провоцируется провоспалительными цито
работе показано, что добавление Prx6 к бета клет
кинами, которые активируют NF κB и способ
кам RIN m5F значительно увеличивает актив
ствуют транслокации NF κB в ядро клетки [26].
ность каскада NF κB. На фоне того, что перок
Эти цитокины модифицируют экспрессию со
сиредоксин 6 увеличивает жизнеспособность и
тен генов, приводя к дисфункции бета клеток и
инсулин секреторную активность этих клеток, в
их гибели от апоптоза [27]. Некоторые из этих
данном случае можно утверждать, что NF κB
генов, индуцированных цитокинами, регулиру
проявляет анти апоптотическую активность.
ются активацией NF κB и являются предпола
гаемыми мишенями для NF κB [28].
Финансирование. Работа выполнена при фи
Другие данные свидетельствуют о том, что
нансовой поддержке Российского фонда фунда
активированный сигнальный каскад NF κB в
ментальных исследований (гранты № 18 04
бета клетках может играть защитную роль. Так,
00091 и 19 04 00080 а) и Программы Президиу
была получена модель трансгенных диабетных
ма РАН 1.18 «Молекулярная и клеточная биоло
мышей, у которых наблюдали ингибирование
гия и постгеномные технологии».
NF κB в бета клетках поджелудочной железы [29].
Благодарности. В работе использовали обо
В этой работе было показано, что длительная
рудование (планшет ридер Infinite 200, («Tecan»,
блокада NF κB у новорожденных животных в те
Австрия)) центра коллективного пользования
чение развития поджелудочной железы умень
Пущинского научного центра.
шала экспрессию ключевых генов в пути секре
Конфликт интересов. Авторы заявляют об от
ции инсулина и уменьшала общее количество
сутствии конфликта интересов.
эндокринных клеток в поджелудочной железе
Соблюдение этических норм. Настоящая
мышей. Это не противоречит результатам, полу
статья не содержит описания каких либо иссле
ченным в работе Kim et al. [30], которые показа
дований с участием людей или животных в каче
ли, что NF κB предотвращает клеточную гибель
стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Hober, D., and Sane, F. (2010) Enteroviral pathogenesis of
8. Karaduleva, E.V., Mubarakshina, E.K., Sharapov, M.G.,
type 1 diabetes, Discov. Med., 10, 151-160.
Volkova, A.E., Pimenov, O.Y., Ravin, V.K., Kokoz, Y.M.,
2.
Kaneto, H., Katakami, N., Kawamori, D., Miyatsuka, T.,
and Novoselov, V.I. (2016) Cardioprotective effect of mod
Sakamoto, K., Matsuoka, T.A., Matsuhisa, M., and
ified peroxiredoxins in retrograde perfusion of isolated rat
Yamasaki, Y. (2007) Involvement of oxidative stress in the
heart under conditions of oxidative stress, Bull. Exp. Biol.
pathogenesis of diabetes, Antioxid. Redox Signal., 9, 355-366.
Med., 160, 639-642, doi: 10.1007/s10517 016 3237 1.
3.
Rains, J.L., and Jain, S.K. (2011) Oxidative stress, insulin
9. Kaneto, H., Kajimoto, Y., Miyagawa, J., Matsuoka, T.,
signaling, and diabetes, Free Radic. Biol. Med., 50,
Fujitani, Y., Umayahara, Y., Hanafusa, T., Matsuzawa, Y.,
567-575, doi: 10.1016/j.freeradbiomed.2010.12.006.
Yamasaki, Y., and Hori, M. (1999) Beneficial effects of
4.
Wojnar, W., Zych, M., and Kaczmarczyk Sedlak, I. (2018)
antioxidants in diabetes - possible protection of pancreatic
Antioxidative effect of flavonoid naringenin in the lenses of
beta cells against glucose toxicity, Diabetes, 48, 2398-2406.
type 1 diabetic rats, Biomed. Pharmacother., 108, 974-984,
10. Новоселова Е.Г., Хренов М.О., Парфенюк С.Б., Ново
doi: 10.1016/j.biopha.2018.09.092.
селова Т.В., Лунин С.М., Фесенко Е.Е. (2014) Роль
5.
Czerwinska, M.E., Gasinska, E., Lesniak, A., Krawczyk, P.,
сигнальных каскадов NF кB, IRF3 и SAPK/JNK в им
Kiss, A.K., Naruszewicz, M., and Bujalska Zadrozny, M.
мунных клетках животных при развитии сахарного
(2018) Inhibitory effect of Ligustrum vulgare leaf extract
диабета 1 типа, Доклады Академии наук, 457, 360-362,
on the development of neuropathic pain in a streptozo
doi: 10.7868/S0869565214210300.
tocin induced rat model of diabetes, Phytomedicine, 49,
11. Novoselova, E.G., Glushkova, O.V., Lunin, S.M., Khre
75-82, doi: 10.1016/j.phymed.2018.06.006.
nov, M.O., Novoselova, T.V., Parfenyuk, S.B., and Fesen
6.
Gordeeva, A.E., Sharapov, M.G., Tikhonova, I.V., Che
ko, E.E. (2016) Signaling, stress response and apoptosis in
meris, N.K., Fesenko, E.E., Novoselov, V.I., and Temnov, A.A.
pre diabetes and diabetes: restoring immune balance in mice
(2017) Vascular pathology of ischemia/reperfusion injury
with alloxan induced type 1 diabetes mellitus, Intern. Immuno)
of rat small intestine, Cells Tissues Organs, 203, 353-364,
pharm., 31, 24-31, doi: 10.1016/j.intimp.2015.11.007.
doi: 10.1159/000455830.
12. Wu, D., and Yotnda, P. (2011) Production and detection of
7.
Sharapov, M.G., Goncharov, R.G., Gordeeva, A.E.,
reactive oxygen species (ROS) in cancers, J. Vis. Exp., 57,
Novoselov, V.I., Antonova, O.A., Tikhaze, A.K., and
e3357, doi: 10.3791/3357.
Lankin, V.Z. (2016) Enzymatic antioxidant system of
13. Bradford, M.M. (1976) A rapid and sensitive method for the
endotheliocytes, Dokl. Biochem. Biophys., 471, 410-412,
quantitation of microgram quantities of protein utilizing the
doi: 10.1134/S1607672916060090.
principle of protein dye binding, Anal. Biochem., 72, 248-254.
6 БИОХИМИЯ том 84 вып. 6 2019
826
НОВОСЕЛОВА и др.
14. Weir, G.C., and Bonner Weir, S. (2004) Five stages of
pancreatic islets, J. Clin. Invest., 110, 851-860, doi: 10.1172/
evolving beta cell dysfunction during progression to dia
JCI15318.
betes, Diabetes, 53 (Suppl. 3), S16-S21.
23. Mahadevan, J., Parazzoli, S., Oseid, E., Hertzel, A.V.,
15. Hayden, M.S., and Ghosh, S. (2008) Shared principles in
Bernlohr, D.A., Vallerie, S.N., Liu, C.Q., Lopez, M.,
NF kappaB signaling, Cell, 132, 344-362, doi: 10.1016/
Harmon, J.S., and Robertson, R.P. (2013) Ebselen treat
j.cell.2008.01.020.
ment prevents islet apoptosis, maintains intranuclear Pdx 1
16. Bubici, C., Papa, S., Dean, K., and Franzoso, G. (2006)
and MafA levels, and preserves β cell mass and function in
Mutual cross talk between reactive oxygen species and nuc
ZDF rats, Diabetes, 62, 3582-3588, doi: 10.2337/db13 0357.
lear factor kappa B: molecular basis and biological signifi
24. Sharapov, M.G., Novoselov, V.I., and Gudkov, S.V. (2019)
cance, Oncogen, 25, 6731-6748, doi: 10.1038/sj.onc.1209936.
Radioprotective role of peroxiredoxin 6, Antioxidants
17. Vermeulen, L., De Wilde, G., Van Damme, P., Vanden
(Basel), 8, 15, doi: 10.3390/antiox8010015.
Berghe, W., and Haegeman, G. (2003) Transcriptional
25. Barkett, M., and Gilmore, T.D. (1999) Control of apoptosis by
activation of the NF кB p65 subunit by mitogen and
Rel/NF kappa B transcription factors, Oncogene, 18, 6910-6924.
stress activated protein kinase 1 (MSK1), EMBO J., 22,
26. Cardozo, A.K., Heimberg, H., Heremans, Y., Leeman, R.,
1313-1324, doi: 10.1093/emboj/cdg139.
Kutlu, B., Kruhoffer, M., Orntoft, T., and Eizirik, D.L.
18. Nihira, K., Ando, Y., Yamaguchi, T., Kagami, Y., Miki, Y.,
(2001) A comprehensive analysis of cytokine induced and
and Yoshida, K. (2010) Pim 1 controls NF kappaB sig
nuclear factor κB dependent genes in primary rat pancre
nalling by stabilizing RelA/p65, Cell Death Differ., 17,
atic β cells, J. Biol. Chem., 276, 48879-48886, doi: 10.
689-698, doi: 10.1038/cdd.2009.174.
1074/jbc.M108658200.
19. Lawrence, T., Bebien, M., Liu, G.Y., Nizet, V., and Karin, M.
27. Eizirik, D.L., and Mandrup Poulsen, T. (2001) A choice of
(2005) IKKalpha limits macrophage NF kappaB activa
death - the signal transduction of immune mediated beta
tion and contributes to the resolution of inflammation,
cell apoptosis, Diabetologia, 44, 2115-2133, doi: 10.
Nature, 434, 1138-1143, doi: 10.1038/nature03491.
1007/s001250100021.
20. Imai, Y., Dobrian, A.D., Morris, M.A., and Nadler, J.L.
28. Larsen, P.M., Fey, S.J., Larsen, M.R., Nawrocki, A.,
(2013) Islet inflammation: a unifying target for diabetes
Andersen, H.U., Kahler, H., Heilmann, C., Voss, M.C.,
treatment? Trends Endocrinol. Metab., 24, 351-360, doi: 10.
Roepstorff, P., Pociot, F., Karlsen, A.E., and Nerup, J.
1016/j.tem.2013.01.007.
(2001) Proteome analysis of interleukin 1beta induced
21. Oetjen, E., Blume, R., Cierny, I., Schlag, C., Kutschenko, A.,
changes in protein expression in rat islets of Langerhans,
Kratzner, R., Stein, R., and Knepel, W. (2007) Inhibition
Diabetes, 50, 1056-1063.
of MafA transcriptional activity and human insulin gene
29. Norlin, S., Ahlgren, U., and Edlund, H. (2005) Nuclear
transcription by interleukin 1beta and mitogen activated
factor kappa B activity in beta cells is required for glucose
protein kinase kinase kinase in pancreatic islet beta cells,
stimulated insulin secretion, Diabetes, 54, 125-132.
Diabetologia, 50, 1678-1687, doi: 10.1007/s00125 007 0712 2.
30. Kim, S., Millet, I., Kim, H.S., Kim, J.Y., Han, M.S.,
22. Maedler, K., Sergeev, P., Ris, F., Oberholzer, J., Joller
Lee, M.K., Kim, K.W., Sherwin, R.S., Karin, M., and
Jemelka, H.I., Spinas, G.A., Kaiser, N., Halban, P.A., and
Lee, M.S. (2007) NF κB prevents β cell beta cell death and
Donath, M.Y. (2002) Glucose induced beta cell produc
autoimmune diabetes in NOD mice, Proc. Natl. Acad. Sci.
tion of IL 1beta contributes to glucotoxicity in human
USA, 104, 1913-1918, doi: 10.1073/pnas.0610690104.
PROTECTIVE EFFECT OF PEROXIREDOXIN 6 ON PANCREATIC
RIN m5F β CELLS AGAINST TOXIC EFFECTS OF GLUCOSE
AND CYTOKINES
E. G. Novoselova*, O. V. Glushkova, S. B. Parfenyuk, M. O. Khrenov, S. M. Lunin,
T. V. Novoselova, M. G. Sharapov, I. A. Shaev, and V. I. Novoselov
Institute of Cell Biophysics, Federal Research Center, Russian Academy of Sciences,
142290 Pushchino, Moscow Region, Russia; E)mail: elenanov_06@mail.ru
Received January 14, 2019
Revised March 18, 2019
Accepted March 18, 2019
Taking into account the special role of pancreatic β cells in development of diabetes mellitus, the effects of peroxire
doxin 6 (Prx6) on the viability and functional activity of rat insulinoma RIN m5F β cells were studied under condi
tions simulating diabetes. To this end, cells were cultured with elevated concentrations of glucose in the medium or in
the presence of pro inflammatory cytokines (TNF α and IL 1) that are known for their special role in cytotoxic
autoimmune reactions in diabetes. It was found that increased glucose concentration in the range 23-43 mM caused
the death of 20-60% of β cells. Added Prx6 significantly reduced level of reactive oxygen species and protected β cells
from hyperglycemia, reducing RIN m5F cell death by several times. Prx6 showed a significant stimulatory effect on
the insulin producing activity of pancreatic β cells. Interestingly, the stimulating activity of Prx6 was detected during
cultivation of β cells both in normal and adverse conditions that cause cell death. One of the mechanisms of Prx6
action on β cells could be a regulation of NF κB signaling cascade, in particular, through activation of RelA/p65
phosphorylation at Ser536.
Keywords: peroxiredoxin 6, hyperglycemia, cytokines, RIN m5F beta cells, insulin production, signal cascade NF κB
БИОХИМИЯ том 84 вып. 6 2019